中上层鱼类作为海洋生态系统的重要组成部分[1-2],它在海洋食物网中发挥着关键作用[3],是连接浮游生物和底栖生物的关键种类[4],并且在人类的饮食中占有重要地位[5-7]。海洋中上层鱼类主要通过体表渗透、鳃膜吸附和饵料消化3种途径,吸收海洋环境中的化学元素[8]。其中,微量元素是构成海洋鱼类有机体的重要组成部分,对于海洋鱼类骨骼的形成、维持内环境的稳定、保持物质代谢正常进行和促进生长发育等具有关键作用[9]。铁(Fe)、钼(Mo)、锰(Mn)、硒(Se)、钴(Co)、铜(Cu)和锌(Zn)等微量元素属于必需元素,主要以金属酶的形式参与生理过程[10-11],如精氨酸酶、谷胱甘肽过氧化酶、丙酮酸脱羧酶,但在低水平时会引起一系列的缺乏症,高水平时可能会产生毒性作用;砷(As)、镉(Cd)、铅(Pb)和汞(Hg)等是非必需微量元素,即使在很低的浓度下,也对生物体有较强的毒性[12]。
国内外有关海洋中上层鱼类微量元素的相关研究主要涉及元素分布和赋存机制,其为海洋渔业资源的开发利用提供了重要参考[13]。近年来,随着世界海洋环境的污染和破坏,海洋生态系统中的微量元素污染受到了广泛关注。人体摄入海产品中的过量微量元素,会导致生理、代谢过程障碍,遗传突变等疾病[14-17]。微量元素对海产品的污染和人类健康的危害已成为国内外研究者普遍关注的安全问题。目前,海洋中上层鱼类微量元素赋存特征是海洋生态的研究热点,但微量元素之间作用关系、赋存影响因素和相关应用却少有报道。本文综述了近30年海洋中上层鱼类微量元素赋存特征,概括了元素相关性以及影响赋存水平的因素,总结了微量元素在鱼类生态学中的应用和微量元素风险评价方法,以期为渔业资源开发利用和健康风险评估提供参考。
1 发表文献概况(Overview of published literature)
1.1 文献计量分析载文量分析
本研究基于Web of Science(WOS)中的核心合集数据,以“TS=‘Marine pelagic fish’ AND TS=‘Trace element’ AND TS=‘Occurrence’ ”主题词为检索项,时间跨度为1995—2022年,经过结果的扩展和精炼,共获得943篇文献。1995—2002年海洋中上层鱼类微量元素赋存的研究,发文量整体呈上升趋势(图1)。其中1995—2010年间发文量波动不大,发文量呈现缓慢增长趋势;2010年后发文量迅速增长,从2010年的16篇到2021年的峰值140篇。
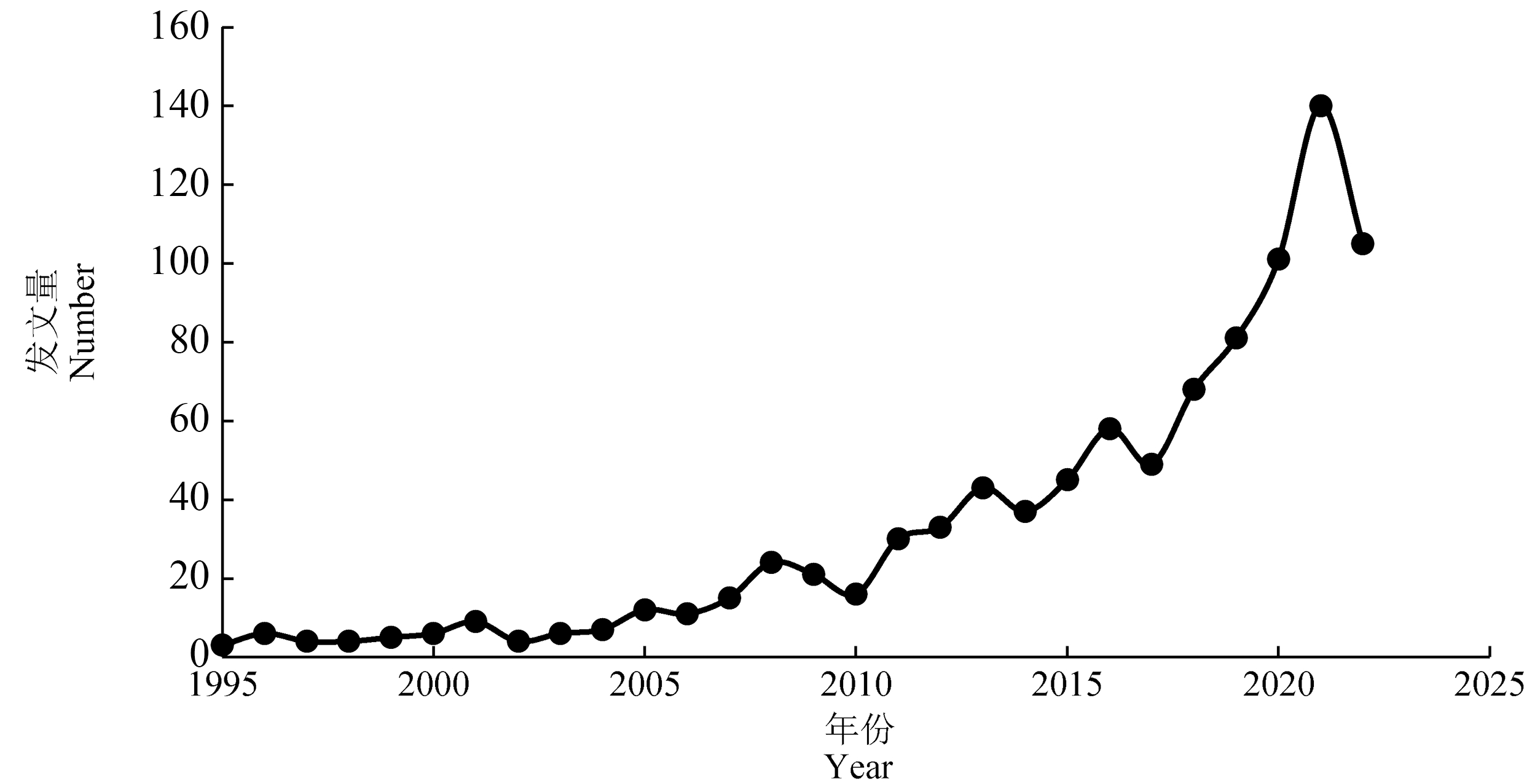
图1 1995—2022年海洋中上层鱼类微量元素赋存论文年度变化趋势
Fig. 1 Annual trends of papers on trace element occurrence of marine pelagic fish from 1995 to 2022
整体数据表明,海洋中上层鱼类微量元素研究发文量呈上升趋势,近几年来相关研究越来越得到国际学术界重视和关注。
1.2 关键词突现分析
运用Citespace软件分析海洋中上层鱼类微量元素赋存相关词频的变动趋势,可以直观地看出关键词的研究强度和时间变化趋势。分析WOS文献关键词(表1),首先,1995—2014年期间,“cadmium”“copper”“zinc”“food chain”和“lead”这些突现词大量出现且有很高的研究强度,表明在海洋中上层鱼类微量元素赋存研究初期,镉、铜、锌和铅是主要研究元素,食物链是主要的研究方向,这些研究内容具有极其重要的研究价值。其次,“methyl mercury”“South China”和“total mercury”等关键词在2005—2018年突现强度较高,表明该时期主要研究对象是甲基汞和总汞,中国南部海洋地区成为海洋中上层鱼类微量元素赋存研究的热点地区。最后,在2019—2022年期间,“health risk assessment”呈现出较高的突现度,说明海洋中超标的微量元素引起了人类对生态以及自身健康的关注。今后,关于海洋中上层鱼类微量元素赋存情况对人类健康的影响仍会是重要的研究方向。
表1 1995—2022年外文文献关键词突现分析
Table 1 Analysis of keyword emergence in foreign language literature from 1995—2022

突现词Emergent word突现强度Strength突现开始时间Beginning突现结束时间Ending铜 Copper7.1419952010锌 Zinc6.319952014镉 Cadmium8.3919982013食物链 Food chain3.7720002008铅 Lead5.7520022013甲基汞 Methyl mercury3.7820052012海洋 Marine4.1820102015有机氯农药 Organochlorine pesticide5.5620112016中国南部 South China4.220112018锌 Zn4.1320112018土耳其 Turkey3.6220112018总汞 Total mercury3.4620122015大小 Size3.9920142015海 Sea3.8920142017淡水 Fresh water3.6920142016健康风险评估 Health risk assessment5.4620192022
1.3 关键词聚类分析
为探究近期海洋中上层鱼类微量元素的研究热点,对WOS核心合集文献库中近10年海洋中上层鱼类微量元素赋存研究的文献数据进行关键词共现分析,通过CiteSpace软件在此基础上使用聚类功能得到相应图谱(图2)。根据2012—2022年关键词进行聚类排序,主要为“heavy metal” “ecological risk assessment” “element level” “toxic element”和“element concentration”。基于微量元素的赋存特征对海洋中上层鱼类的影响研究,研究人员尤其关注重金属相关研究。近年来各种风险评估应用普遍,生态风险评估成为该领域主要研究方向,表明生态环境导致海洋中上层鱼类微量元素含量超标,微量元素污染评价具有与人体健康相结合的趋势。“element level”是一个重要的聚类,与此相关的关键词为“toxic element”和“element concentration”反映出海洋中上层鱼类微量元素的赋存水平及特征成为重要的研究方向。

图2 2012—2022年外文文献关键词聚类分析
Fig. 2 Keyword clustering analysis of foreign literature from 2012—2022
1.4 海洋中上层鱼微量元素的前沿方向
文献统计分析显示,目前海洋中上层鱼类微量元素赋存的前沿研究方向包括以下3类:(1)赋存特征相关研究,包括元素分布、富集能力以及生物利用和影响因素等;(2)微量元素在鱼类生态学研究中的应用,包括种群判定、栖息环境和洄游分布等;(3)风险评估,如在食物链中传递的生态风险以及对人类的健康风险评估。
2 海洋中上层鱼类微量元素赋存特征(Trace element occurrence characteristics of pelagic fish in the ocean)
2.1 微量元素赋存情况
海洋中上层鱼类微量元素富集能力普遍与组织、体型、物种和营养级有关。Shalini等[18]对印度东南沿岸部分海洋中上层鱼类不同器官中微量元素浓度进行了研究,发现在肌肉中微量元素的存在顺序为Fe>Zn>Cu>As>Ni>Cr>Cd>Hg>Co>Pb,在鳃中顺序为Fe>Zn>Cu>As>Cd>Ni>Cr>Co>Pb>Hg,在肝脏中顺序为Fe>Zn>Cu>As>Cd>Co>Pb>Ni>Cr>Hg,在骨骼中顺序为Fe>Zn>Cu>As>Cr>Cd>Ni>Co>Pb>Hg。Rubio等[19]通过研究竹荚鱼(Trachurus japonicus)20种微量元素,发现肝脏中Fe、Mn和Cu的平均浓度高于肌肉,且肌肉中Cd和Pb的平均浓度均未超过欧盟委员会规定的最大限值。Afandi等[20]对来自非洲西北部海岸日本鲐(Scomber japonicus)、竹荚鱼、鳀鱼(Engraulis japonicus)和沙丁鱼(Sardina pilchardus)4种中上层鱼体肌肉10种微量元素进行测定,发现不同物种的微量元素水平存在显著差异(P<0.05),将4种鱼类不同组织微量元素浓度作对比,发现日本鲐肝脏中Fe、Zn、Cd、Co、Cu和Pb的含量显著较高(P<0.05),鳀鱼肌肉中具有较高的Mn、Cu、Cr、Ni和Pb含量。Agusa等[21]发现Cu、Se、Ag、Sn、Cd和Hg的浓度与大眼金枪鱼(Thunnus obesus)体长呈显著正相关关系,Pb的浓度随大眼金枪鱼体长的增加而降低。Honda等[22]研究发现海洋中上层鱼类肌肉中Mn、Cu、Cd和Pb的浓度随着体长的增加而降低。Bodin等[23]在西印度洋海洋中上层生物群落微量元素的研究中,发现Hg浓度与营养位置之间存在正相关关系,反映了Hg通过海洋中上层食物网产生生物放大作用。
不同海域、季节和食性的海洋中上层鱼类对微量元素的富集水平有所差异,微量元素在鱼体含量有所差别。比较不同海域鱼类肌肉中微量元素含量发现(表2),Ni、Pb、Cr和Co之间的差异并不大,Cu、Zn和Fe在不同海域之间差异较明显。对比不同海域沙丁鱼属微量元素水平,发现印度洋金带沙丁鱼(Sardinella gibbosa)各元素水平均低于澳大利亚周边海域沙丁鱼,可能是由于后者的近海污染程度大于前者的远洋污染程度所造成的。杨美兰[24]研究发现海洋鱼类微量元素含量在不同食性鱼类体内存在差异,摄食小型鱼虾贝的鱼类、肉食性鱼类、主食小型浮游生物的鱼类一般高于广食性鱼类。Ghosn等[25]研究发现地中海脂眼鲱(Etrumeus teres)微量元素含量存在季节性差异,Ti、Cr、Mn、Fe、Ni、As和Hg在雨水较多的冬季表现出更高的含量。Abdallah[26]通过研究墨西哥湾和伊朗沿岸海域中上层鱼类微量元素水平,发现前者海域鱼内Cr、Cd、Pb、Cu和Zn的浓度高于后者,2个海域之间微量元素水平出现明显差异,可能是大量排入墨西哥湾的工业废水导致了墨西哥湾海域污染。有研究发现,加那利群岛(西班牙管辖)和葡萄牙2个渔场的小型中上层鱼类微量元素含量有所差别,加那利群岛物种的Cd和Pb浓度较高,可能与非洲上升流输入有关,这极大地影响了该海域物种的Cd和Pb浓度[27]。
表2 海洋中上层鱼类不同组织中微量元素平均含量
Table 2 Mean trace element content in different tissues of marine pelagic fish (mg·kg-1)
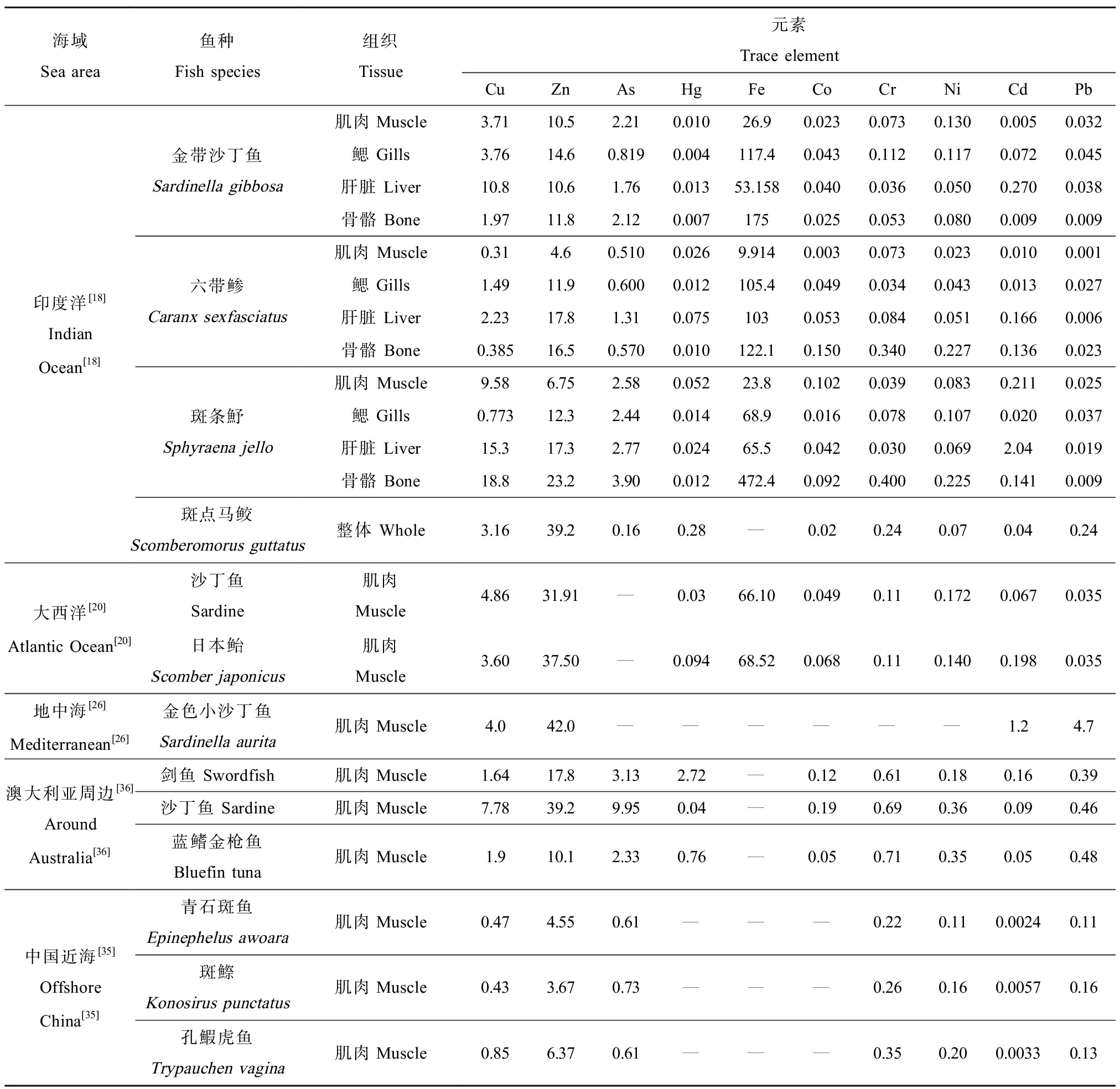
海域Sea area鱼种Fish species组织Tissue元素Trace elementCuZnAsHgFeCoCrNiCdPb印度洋[18]IndianOcean[18]金带沙丁鱼Sardinella gibbosa六带鲹Caranx sexfasciatus斑条魣Sphyraena jello斑点马鲛Scomberomorus guttatus肌肉Muscle3.7110.52.210.01026.90.0230.0730.1300.0050.032鳃 Gills3.7614.60.8190.004117.40.0430.1120.1170.0720.045肝脏 Liver10.810.61.760.01353.1580.0400.0360.0500.2700.038骨骼 Bone1.9711.82.120.0071750.0250.0530.0800.0090.009肌肉 Muscle0.314.60.5100.0269.9140.0030.0730.0230.0100.001鳃 Gills1.4911.90.6000.012105.40.0490.0340.0430.0130.027肝脏 Liver2.2317.81.310.0751030.0530.0840.0510.1660.006骨骼 Bone0.38516.50.5700.010122.10.1500.3400.2270.1360.023肌肉 Muscle9.586.752.580.05223.80.1020.0390.0830.2110.025鳃 Gills0.77312.32.440.01468.90.0160.0780.1070.0200.037肝脏 Liver15.317.32.770.02465.50.0420.0300.0692.040.019骨骼 Bone18.823.23.900.012472.40.0920.4000.2250.1410.009整体 Whole3.1639.20.160.28—0.020.240.070.040.24大西洋[20]Atlantic Ocean[20]沙丁鱼Sardine肌肉Muscle4.8631.91—0.0366.100.0490.110.1720.0670.035日本鲐Scomber japonicus肌肉Muscle3.6037.50—0.09468.520.0680.110.1400.1980.035地中海[26]Mediterranean[26]金色小沙丁鱼Sardinella aurita肌肉Muscle4.042.0——————1.24.7澳大利亚周边[36]Around Australia[36]剑鱼 Swordfish肌肉Muscle1.6417.83.132.72—0.120.610.180.160.39沙丁鱼 Sardine肌肉Muscle7.7839.29.950.04—0.190.690.360.090.46蓝鳍金枪鱼Bluefin tuna肌肉Muscle1.910.12.330.76—0.050.710.350.050.48中国近海[35]OffshoreChina[35]青石斑鱼Epinephelus awoara肌肉Muscle0.474.550.61———0.220.110.00240.11斑鰶Konosirus punctatus肌肉Muscle0.433.670.73———0.260.160.00570.16孔鰕虎鱼Trypauchen vagina肌肉Muscle0.856.370.61———0.350.200.00330.13
海洋中上层鱼内赋存的微量元素,会经过不断富集形成重金属,并通过食物链传递放大,这可能导致人类食用这类鱼产品而危害健康[28-31]。微量元素在海洋中上层鱼类组织或器官中赋存的浓度与人类可食用范围比较,有助于研究海产品中的微量元素富集对人体健康的影响[32]。近年来,少有研究表明食用海产品会对人类造成明显的健康危害,但大量研究表明人类摄食海产品可能存在潜在健康风险。Gobert等[33]研究了地中海剑鱼(Xiphias gladius)的18种微量元素浓度,并进行人类暴露风险评估,发现剑鱼肌肉中的平均元素水平明显低于国际食品安全法规规定的最大允许浓度,食用地中海剑鱼对人类健康风险较小。程家丽等[34]研究报道,中国1 198条海洋鱼产品微量元素整体上污染程度较轻,但多种元素的联合危害应引起重视。吴昊等[35]对我国厦门湾海域中上层鱼类进行Cr、Ni、Cu、Zn、As、Cd和Pb元素含量测量,并采用不同评价模型对人类的健康风险评价,结果发现样品中As的残留量超过了国家食品安全限量标准,且会对人类健康造成潜在的风险。
2.2 微量元素之间的关系
2.2.1 拮抗作用
微量元素之间的作用关系主要表现为拮抗作用和协同作用。拮抗作用是指在机体内微量元素之间相互抑制其吸收作用,或对各自在动物体内的生理生化功能互相产生相反的影响[24,37](表3)。大量研究表明[38],Hg与Se的结合具有解毒作用(图3),可通过检测机体内Hg和Se的含量来判断海洋鱼类是否达到汞中毒的阈值。Hg和Se的主要存在形式是有机Hg和有机Se,有机Hg是海洋生态系统中毒性较强的污染物[39],海洋鱼类体内Hg的毒性与Se的含量呈正相关关系。目前,不溶化合物硒化汞(HgSe)被发现在海豹、海狮和鲸等多种动物体内的大脑和肝脏中[40-41]。Hg和Se会在机体解毒器官内形成HgSe晶体[42],从而减少甲基汞在机体内的含量,形成Se对Hg毒性的拮抗作用,降低Hg对海洋鱼类的伤害。Se作为海洋鱼类有益的必需元素,除了和Hg具有很强的亲和力,还和多种有毒元素Pb、Cd和As等形成分子晶体,以降低重金属富集对海洋鱼类的危害。
表3 海洋中上层鱼类微量元素之间的作用关系[53-66]
Table 3 Relationships between trace elements in marine pelagic fish[53-66]

元素Trace element协同元素Synergistic elements拮抗元素Antagonistic elementsZnMoMn,Co,Cu,Fe,P,CdCuSe,As,PbMn, ZnFeCuMn,Zn,PMn-Zn,Co,PSeCuHg,SIPMo
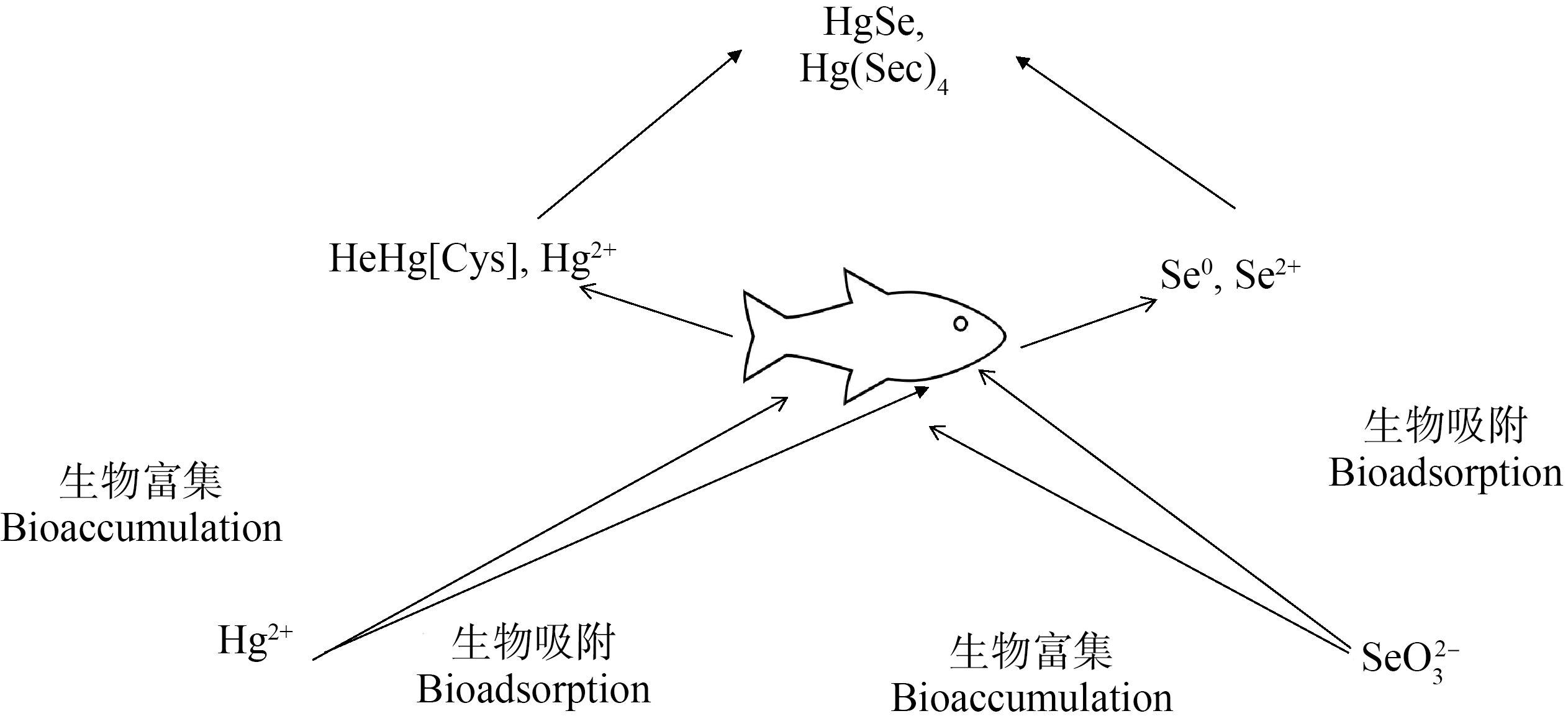
图3 海洋鱼类汞和硒之间作用关系图
Fig. 3 Relationship between mercury and selenium in marine fish
拮抗作用的机制还体现在蛋白质活性基团对不同元素配位能力的差异导致置换反应的发生[43]。肾脏等器官内重金属积累较多,金属硫蛋白(MT)表达量及含量较高。金属硫蛋白可以稳定螯合Cd2+、Hg2+、Pb2+、Zn2+等金属离子,形成无毒的金属离子-MT复合物,从而降低金属离子在机体内的富集,减少对生物体的伤害[44-45]。Zn和Cr在生物体内的浓度关联性较大,Zn在诱导金属硫蛋白的表达中,对Cr中毒具有拮抗作用[46]。当海洋中上层鱼类生存环境中Zn浓度增加,会导致体内组织中的Zn浓度增加,且Cr和Cu等金属元素会随之减弱生物富集效应,这与淡水鱼类研究相似。Satoh等[47]研究尼罗罗非鱼(Oreochromis niloticus)发现,Fe和Zn在全鱼体内呈显著负相关,吸收饲料中的Zn与全鱼的Fe含量也呈显著负相关。
2.2.2 协同作用
协同作用是依赖于某些微量元素而加强另一元素的生物学功能,或使该元素的有效水平增加。Fe、Cu、Co、Mn等微量元素分布于动物造血器官的不同位置,参与造血的不同环节,共同发挥造血功能,相互配合,完成造血过程[48]。彩虹方头鱼(Paracheirodon innesi)[49]不仅在Cu和Pb的混合体系中表现出机体对Cu和Pb吸收的协同作用,还在经Cu预暴露后再投放到含Pb体系中表现出相同作用。朱毅和张瑞涛[50]在As、Cu、苯酚对鲤鱼(Cyprinus carpio)的联合毒性研究中发现,Cu和As的联合毒性表现为协同作用。某些微量元素在消化道内表现出直接协同作用,各元素的吸收水平决定于食糜和饲料中各元素的比例。Hilton和Hodson[51]发现虹鳟(Oncorhynchus mykiss)肝脏Se含量与饲料Cu水平显著相互促进[52]。微量元素不仅在消化道内表现出协同作用,还表现在组织细胞水平代谢上。动物骨骼组织的重要成分羟基磷灰石(用于骨组织修复)的形成过程中,Fe和Cu协同参与血红蛋白的合成。
2.3 影响微量元素赋存的因素
2.3.1 地理差异
鱼类的生存环境对鱼体内微量元素的浓度起主要决定作用。鱼类在不同地区间物种的食物组成和营养位置可能会发生变化,因此在不同生存环境中的海洋中上层鱼类微量元素含量有明显的差异。Anan等[67]为减少体型大小对生物体内微量元素赋存的影响,以体质量为协变量,采用协方差分析(ANCOVA)对不同海域数据进行分析,发现里海拟鲤(Rutilus rutilus)体内Co、Zn、Se和Mo含量以及幼体体内Pb含量在采样点之间存在显著差异(P<0.001),进一步研究发现不同站点的里海拟鲤中Ag和Cr含量从东侧站点到西侧站点呈增加趋势,说明这些元素的污染源可能存在于里海的特定海域。Agusa等[21]研究发现,马来西亚东海岸脂眼凹肩鲹(Selar crumenophthalmus)中Cu、Zn、Se、Ag、Cd、Cs和Hg的浓度高于马来西亚西海岸的同类。
2.3.2 种间差异
海洋中上层鱼类中微量元素含量存在种间差异,这些差异可能是由于物种间的食性、生存环境和体型大小的差异造成的。Kojadinovic等[68]研究发现Se、Cu、Fe和Zn在黄鳍金枪鱼(Thunnus albacares)的肝脏中含量最高,在普通金枪鱼中含量最低。Shalini等[18]在研究印度东南沿海鱼类组织中微量元素含量差异时,除斑条魣和巴鲣(Euthynnus affinis)外,Cr、Fe、Co、Ni、Cu、Zn、As、Cd、Hg和Pb在所有鱼种中的浓度差异显著(P<0.05)。Rahman等[36]通过测量澳大利亚和印度周边海域中上层鱼类中汞的含量,并与其他地区作对比,发现不同鱼种之间汞含量存在显著差异。Vieira等[69]采集了东北大西洋和中大西洋东部海域中的沙丁鱼、竹荚鱼等海洋中上层鱼类,通过统计评估金属在生物体内累积种内和种间变异性,发现Hg和As含量变化主要受物种和体型影响。
2.3.3 体型
微量元素水平与海洋中上层鱼类体型之间的相关性受到广泛研究。鱼类的体质量与体长之间一般存在显著的正相关关系。鱼体内的微量元素含量与鱼体长体质量之间存在生长依赖性变化[70]。Hg浓度与海洋中上层鱼类体型大小呈正相关关系已得到广泛证实[71],部分微量元素与体型呈负相关[72],如Zn和Cu浓度随体型增大而降低[73-75]。Kojadinovic等[70]在研究西印度洋中上层鱼类微量元素的生物累积中发现,肝、肾和肌肉组织中的Hg含量与剑鱼、黄鳍金枪鱼、鲣(Katsuwonus pelamis)和鲯鳅(Coryphaena hippurus)4种鱼类体长确实存在相关性。Cr在剑鱼和鲣体内的浓度与鱼体长度呈正相关,Se含量同样会受到鱼体大小的影响,而Pb与鱼体长度没有表现出相关性。微量元素水平的生长依赖性变化受多种因素的影响[76-77],如代谢率,以及元素的生长稀释,这些因素可能导致了生长与元素含量相关性的不同(表4)。
表4 海洋中上层鱼类生长与微量元素含量的关系
Table 4 Relationship between growth of pelagic fish and trace element content in the ocean
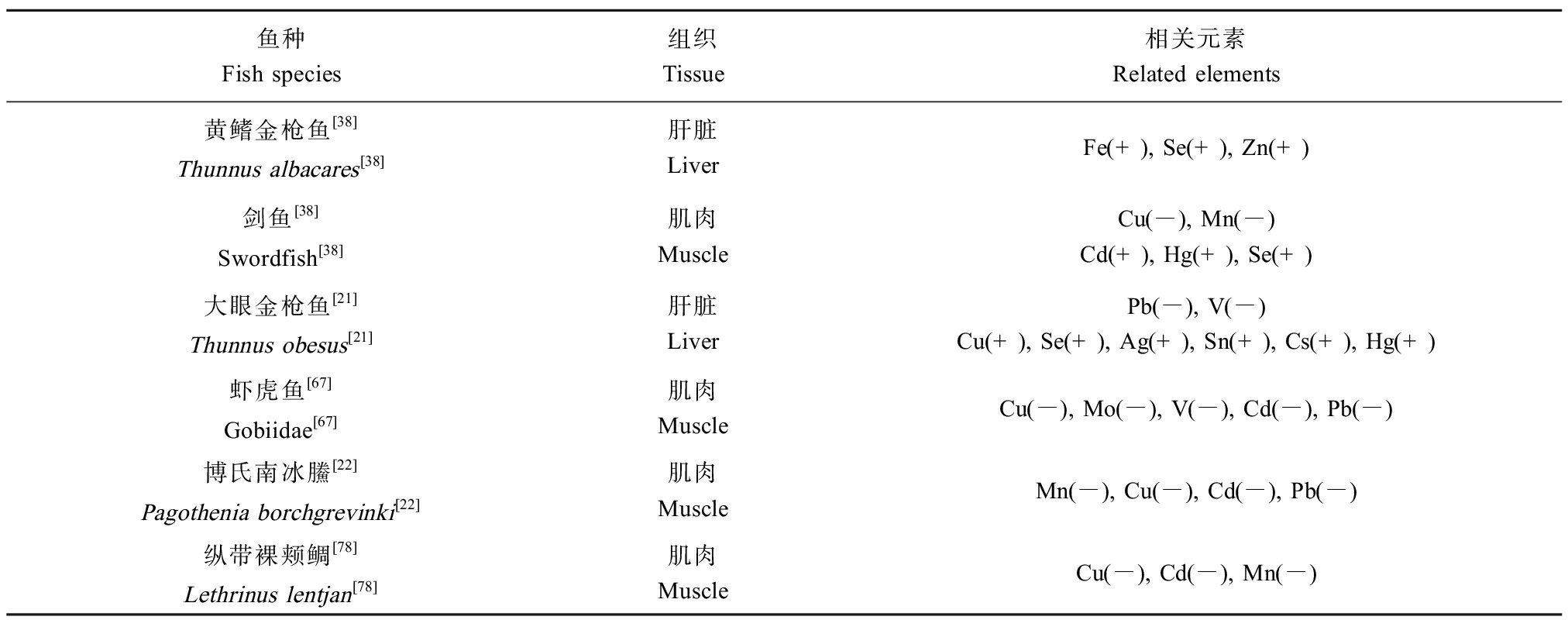
鱼种Fish species组织Tissue相关元素Related elements黄鳍金枪鱼[38]Thunnus albacares[38]肝脏LiverFe(+), Se(+), Zn(+)剑鱼[38]Swordfish[38]肌肉MuscleCu(-), Mn(-)Cd(+), Hg(+), Se(+)大眼金枪鱼[21]Thunnus obesus[21]肝脏LiverPb(-), V(-)Cu(+), Se(+), Ag(+), Sn(+), Cs(+), Hg(+)虾虎鱼[67]Gobiidae[67]肌肉MuscleCu(-), Mo(-), V(-), Cd(-), Pb(-)博氏南冰鰧[22]Pagothenia borchgrevinki[22]肌肉MuscleMn(-), Cu(-), Cd(-), Pb(-)纵带裸颊鲷[78]Lethrinus lentjan[78]肌肉MuscleCu(-), Cd(-), Mn(-)
注:“+”代表海洋中上层鱼类生长与微量元素含量呈正相关关系;“-”代表呈海洋中上层鱼类生长与微量元素含量负相关关系。
Note: “+” represents a positive correlation between the growth of pelagic fish and trace element content in the ocean; “-” represents a negative correlation between the growth of pelagic fish and trace element content in the ocean.
2.3.4 年龄及发育状况
海洋中上层鱼类微量元素富集能力的高低,取决于金属对鱼类组织的亲和力、摄取、沉积和排泄速率。海洋鱼类对微量元素的吸收速率与代谢速率呈正相关,幼鱼的代谢活性通常高于成年鱼,通常幼鱼体内的微量元素累积量较高[68]。Lozano-Bilbao等[79]研究发现沙丁鱼、鲐鱼和蓝鯵鱼(Pomatomus saltatrix)所有未成熟样本微量元素含量高于成熟样本。在生殖发育过程中,微量元素水平会随着代谢活动减少而减少,与生殖相关的生理变化对海洋鱼类微量元素水平影响相对较小,性腺成熟系数(GSI)与微量元素水平的相关性在物种间存在差异。有研究发现[68],鲣肌肉中Mn含量随GSI的降低而降低,表明该元素可能在性腺发育时期从肌肉中转移到其他组织器官使用。
2.3.5 组织
海洋中上层鱼类不同组织与器官对微量元素具有高度选择性[38]。大量研究表明,微量元素在不同器官的富集规律与鱼类代谢过程有关,其中含量最高的是内脏,其次是鳃、骨骼和肌肉[80]。鱼类内脏具有较高的富集能力,可能是由于肝脏和肾脏等器官内能合成大量金属硫蛋白,金属硫蛋白对金属元素有较强的亲和力,导致肝脏和肾脏内积累大量的金属元素,金属硫蛋白对金属元素的毒性作用具有拮抗关系[81-82]。Uluturhan和Kucuksezgin[83]研究了鱼体不同组织中金属元素的分布和积累,发现Hg、Cu、Cd、Pb和Zn在肌肉中的浓度普遍小于肝脏中的浓度。
3 海洋中上层鱼类微量元素含量测定的应用(Application of trace element content determination for pelagic fish in the ocean)
海洋中上层鱼类硬组织的微量元素可应用于判别鱼类洄游环境史、鱼类产卵场的海洋环境、鱼类种群结构及资源评估等研究[84-86],对研究鱼类生活史起重要作用。近年来,海洋鱼类眼睛晶体和耳石等钙化组织中微量元素含量的分析被广泛应用于区分鱼类种群,海洋生物的摄食偏好等。有研究表明,鱼类眼睛晶体微量元素的组成与物种和生活环境有关,因其代谢惰性可以将其沉积生活环境中的微量元素信息永久保存。Dove和Kingsford[87]发现眼睛晶体可用于区分鱼类种群,Cu、Mn和Fe主要分布在晶体外围,发挥辅酶的作用,晶体核心区与晶体外围层会随晶体蛋白的合成和降解存在显著的差异。Rooker等[88]研究发现地中海海域不同产卵场幼鱼的耳石微量元素时空变化存在显著差异,分析表明微量元素的积累具有一定程度上的时间持续性。耳石微量元素指纹技术应用在种群结构及资源评估分析具有较大的应用潜力。
在鱼类的生长发育过程中,海洋环境中的微量元素通过鱼类的生命活动钙化沉积在耳石中[89]。耳石可以永久性保存生活环境中的微量元素,从而反映出鱼类的栖息地特征[90]。研究表明[91],海洋环境的变化会影响耳石中微量元素分布,如:温度、盐度、环境污染等环境因子的改变会通过影响海洋鱼类的生长发育过程和生理生化反应等机能形成微量元素分布不同的耳石[92]。Mayer等[84]发现研究耳石微量元素的组成,可以对鱼类洄游环境史和个体发育的变化有进一步的了解。Arai等[85]通过比较Sr和Ca在西太平洋鲣耳石的浓度,发现两者的浓度存在显著的差异,可能是由于孵化场海洋环境中微量元素含量不同造成的。Walther和Thorrold[93]研究发现海洋鱼类耳石中的一些微量元素含量与鱼类栖息环境相关,其中海洋鱼类耳石中83%的Sr和98%的Ba主要来源于栖息环境的海水。
目前,通过硬组织微化学信息来探究海洋鱼类栖息地变迁过程的研究,主要集中在微量元素等方面,以分析微量元素值的变化规律和其沉积机制及与环境因子的关系技术手段,追溯海洋鱼类生活史过程。李云凯和沈永富[94]研究发现,通过观察和测量海洋软骨鱼类脊椎骨微量元素含量后可以校正大青鲨(Prionace glauca)年龄,并了解其洄游行为。Lin[86]通过比较印度尼西亚海域和印度洋的南方蓝鳍金枪鱼(Thunnus maccoyii)耳石中的微量元素组成,发现两者之间存在显著差异,但核心部位的元素组成成分相似,表明这2个海域的南方蓝鳍金枪鱼产卵场可能相同,洄游路径不同。微量元素测量结果显示随着年龄的增长,微量元素组成呈现不同的变化,可能是由于南方蓝鳍金枪鱼不同的发育阶段洄游环境不同。
4 微量元素风险评价方法(Trace elements risk evaluation method)
目前,关于海洋中上层鱼类必需微量元素的营养评价方法尚未明确。但当海洋中上层鱼制品某些微量元素超标时,会对消费者健康构成重大威胁。根据常见金属不同程度的毒性,我们列出了联合国粮食及农业组织(Food and Agriculture Organization of the United Nation, FAO)/世界卫生组织(World Health Organization, WHO)与中国关于海洋中上层鱼类食品中金属的最大允许限量(表5)。Bodin等[23]在西印度洋海洋中上层生物群落微量元素的研究中,发现所有渔获物中均含Pb和Cr 2种有害元素,但其浓度均低于食品污染最大限值。海洋环境中的有害微量元素可以在鱼类体内富集积累,鱼类微量元素的含量可以在一定程度上反映海洋环境的污染状况。目前,对鱼类微量元素的监测已成为海洋环境污染监测的重要手段之一[95]。陶玲等[96]根据FAO提供的研究海域日平均摄入量,计算鱿鱼肌肉中5种有毒元素每日摄入量(EDI),表明该海域3种鱿鱼样品对人类不存在潜在的微量元素污染健康风险。陈永正[97]测定了福建海区鱼类样品中12种微量元素,运用主成分分析法筛选出主要的污染元素,并建立预测海区污染模型,预报了此海区的污染状况,从而在一定程度上实现对海洋环境的监测。
表5 国际与中国鱼类微量元素标准限量值
Table 5 International and Chinese fish trace elements standard limit values

分类Sort元素Trace elements化学符号Chemical symbols限量/(mg·kg-1)Limit/(mg·kg-1)标准Standard必需元素Essential elements铜CopperCu锰ManganeseMn锌ZincZn铬ChromiumCr4.5FAO/WHO[98]50NY 5073—2006[99]1.0WHO[100]40FAO/WHO[98]1.0FAO/WHO[98]2.0GB 2762—2022[101]非必需有害元素Non-essential harmful elements砷ArsenicAs1.00.1FAO/WHO[98]GB 2762—2022[101]汞MercuryHg0.50.5FAO/WHO[102]GB 2762—2022[101]镉CadmiumCd0.10.1FAO/WHO[98]GB 2762—2022[101]铅LeadPb0.50.5FAO/WHO[98]GB 2762—2022[101]镍NickelNi0.8FAO/WHO[98]
人类健康风险评估方法主要包括单因子污染指数法、内梅罗综合污染指数法、重金属污染指数法、每周可耐受摄入法以及目标危险系数法(表6)。这几种评价方法的特点、使用范围和作用对象各不相同,将几种评价方法联合使用,可以较好地对海洋中上层鱼类微量元素污染状况及其食用安全性进行评估,为人体健康风险评估及生态风险评估提供参考。Storelli等[103]通过运用每周耐受法发现,不同年龄组重金属的每周摄入量均为Hg>Pb>Cd,儿童的摄入浓度最高,其次为青少年、成人和老年人。Bouiba等[104]在地中海西南部海胆微量元素动态的研究中运用环境和目标危险系数法双重风险评估方法,发现地中海西南部海域存在Pb污染,对人类健康问题造成了一定的威胁。
表6 海洋中上层鱼类微量元素污染程度及健康风险评价方法[105]
Table 6 The degree of trace element contamination and health risk evaluation methods for pelagic fish in the ocean[105]

评价方法Evaluationmethodology计算公式Calculation formula参数含义Parameter meaning用途Uses单因子污染指数法Single factor pollution index methodPi=CiSiPi代表鱼体中微量元素i的单因子污染指数;Ci代表鱼体中微元素i含量实测值的平均值(mg·kg-1);Si为鱼体中微量元素i的限量标准(mg·kg-1)Pi represents the single factor pollution index of trace element i in fish; Ci represents the average of measured values of trace element in fish (mg·kg-1); Si is the limit standard of trace element i in fish (mg·kg-1)评价微量元素污染程度Evaluation of trace element contamination levels内梅罗综合污染指数法Nemiro composite pollution index methodP综= P2ave+P2max2P综表征不同种类的鱼体受到多种不同种类的微量元素污染而产生的污染叠加效果,Pave代表污染指数的平均值,Pmax代表污染指数的最大值Psynthesis is to characterize the superimposed effect of contamination of different species of fish by many dif-ferent kinds of trace elements, Pave represents the mean value of the contamination index and Pmax represents the maximum value of the contamination index表示鱼类受不同种类微量元素污染的叠加效果Indicates the superimposed effect of fish contamination by different types of trace elements微量元素污染指数法Trace element pollution index methodMPI=iC1·C2…CiCi代表鱼体中微量元素i含量实测值的平均值(mg·kg-1)Ci represents the average of the measured values of trace elements i in fish (mg·kg-1)比较各类鱼体微量元素含量差异而产生的整体差异Comparison of overall differences due to differences in trace element content in various fish species每周可耐受摄入法Tolerable weekly intake methodAWI=Ci×WCAWI是成人每周的微量元素实际摄入量(mg);Ci是鱼体微量元素i含量实测值的平均值(mg·kg-1);WC是居民每周鱼类消费量(kg)AWI is the actual weekly intake of trace elements for a-dults (mg);Ci is the mean of the measured values of trace element in fish (mg·kg-1); WC is the weekly fish con-sumption of the population (kg)一种针对有害物质通过食物的摄入而损害人体健康的污染评价标准A contamination evaluation standard for harmful substances that can damage human health through food intake目标危险系数法Target hazard factor methodQt,h=EF·ED·FIR·CRFD·wAB·TA×10-3Qt,t,h=∑Qt,hEF代表暴露频率(d·a-1),ED代表暴露时间(a),FIR代表食物摄入率(g·d-1),WAB代表平均体质量(kg),C代表鱼体中微量元素的质量分数(mg·kg-1),TA代表非致癌性平均暴露时间(d),RFD代表参考剂量(mg·kg-1·d-1)EF represents exposure frequency (d·a-1), ED represents exposure time (a), FIR represents food intake rate (g·d-1), WAB represents mean body weight (kg), C repre-sents mass fraction of trace elements in fish (mg·kg-1), TA represents non-carcinogenic mean exposure time (d), and RFD represents reference dose (mg·kg-1·d-1)评价单一微量元素污染风险和多种微量元素复合污染风险Evaluation of single trace element contamination risk and multiple trace element compound contamination risk
5 结论与展望(Conclusion and outlook)
本文综述了海洋中上层鱼体微量元素赋存特征、微量元素之间的作用关系、影响微量元素赋存的因素3个方面内容,归纳和总结了微量元素在鱼类硬组织和人体健康风险评估中的应用。海洋中上层鱼类体内微量元素水平与组织器官、体型、性别、时空要素等因素相关,Fe、Zn是鱼体内浓度较高的微量元素。一般来说,微量元素在鱼类肝脏中的赋存水平大于肌肉,而元素之间的相互作用主要表现为拮抗作用和协同作用。赋存在鱼类硬组织中的微量元素可以用于判别洄游环境史、产卵场的海洋环境、种群结构及进行资源评估等研究。不同的微量元素评价方法,可以对海洋中上层鱼类产品进行健康风险评估,保障人类食品安全。
但仍存在以下问题需要进一步研究。(1)海洋中上层鱼类微量元素之间相互作用研究仍不够系统、完善。研究内容较为局限,主要集中在淡水养殖鱼类,对海洋中上层鱼类研究较少。(2)海洋生态系统中有害元素会与其他环境介质存在复杂的作用关系,但有害元素在不同环境介质条件下对海洋中上层鱼类的联合毒性作用研究还不够深入。(3)影响海洋中上层鱼类微量元素赋存的因素研究还不够全面,目前对于地理差异、种间差异、年龄与生长状况、体型和组织研究较为深入,但对于性别、鱼类不同发育时期、气候现象及自然条件的改变等方面研究较少。(4)海洋中上层小型鱼体内的污染物主要来源之一是海洋环境,其体内的污染物经过食物链的传递,会不断富集在海洋中上层高营养级生物,当海洋环境污染严重时,将会对高营养级生物及人类健康会造成威胁。目前对微量元素在海洋食物网中的营养传递动力学研究还不够深入,关于微量元素迁移转化差异等方面研究还有所欠缺。
[1] 沈国英, 施并章. 海洋生态学[M]. 3版. 北京: 科学出版社, 2002: 37-38
[2] 中国农业百科全书总编辑委员会水产业卷编辑委员会, 中国农业百科全书编辑部. 中国农业百科全书. 水产业卷[M]. 北京: 中国农业出版社, 1994: 328-329
[3] 纪炜炜, 李圣法, 陈雪忠. 鱼类营养级在海洋生态系统研究中的应用[J]. 中国水产科学, 2010, 17(4): 878-887
Ji W W, Li S F, Chen X Z. Application of fish trophic level in marine ecosystem [J]. Journal of Fishery Sciences of China, 2010, 17(4): 878-887 (in Chinese)
[4] Rice J. Food web theory, marine food webs, and what climate change may do to northern marine fish populations [J]. Climate Change &Northern Fish Populations, 1995, 1: 561-568
[5] 卞晓东, 万瑞景, 单秀娟, 等. 莱州湾中上层小型鱼类早期资源量动态及其外在驱动因素[J]. 中国水产科学, 2022, 29(3): 446-468
Bian X D, Wan R J, Shan X J, et al. Preliminary analysis on recruitment variation and the exogenous driving factors to early life stages of small pelagic fishes in the Laizhou Bay [J]. Journal of Fishery Sciences of China, 2022, 29(3): 446-468 (in Chinese)
[6] Food and Agriculture Organization of the United Nations (FAO). The state of world fisheries and aquaculture 2022. Towards blue transformation [R]. Rome: FAO, 2022
[7] 郑元甲, 李建生, 张其永, 等. 中国重要海洋中上层经济鱼类生物学研究进展[J]. 水产学报, 2014, 38(1): 149-160
Zheng Y J, Li J S, Zhang Q Y, et al. Research progresses of resource biology of important marine pelagic food fishes in China [J]. Journal of Fisheries of China, 2014, 38(1): 149-160 (in Chinese)
[8] 王勤. 从’94全国水产加工展示交易会看我国中上层鱼类的加工利用现状[J]. 现代渔业信息, 1995, 10(10): 10-12
Wang Q. Status of utilization of pelagic fish in China-From view of 94’ national aquatic products fair [J]. Modern Fisheries Information, 1995, 10(10): 10-12 (in Chinese)
[9] 顾佳丽. 辽西地区食用鱼中重金属含量的测定及食用安全性评价[J]. 食品科学, 2012, 33(10): 237-240
Gu J L. Determination of heavy metals and safety evaluation of fish from the west of Liaoning Province [J]. Food Science, 2012, 33(10): 237-240 (in Chinese)
[10] Sivaperumal P, Sankar T V, Viswanathan Nair P G. Heavy metal concentrations in fish, shellfish and fish products from internal markets of India vis-a-vis international standards [J]. Food Chemistry, 2007, 102(3): 612-620
[11] National Research Council (NRC). Nutrient requirements of fish and shrimp [S]. Washington D C: National Academy Press, 2011: 206-207
[12] Bosch A C, O’Neill B, Sigge G O, et al. Heavy metals in marine fish meat and consumer health: A review [J]. Journal of the Science of Food and Agriculture, 2016, 96(1): 32-48
[13] Sivaperumal P, Sankar T V, Viswanathan Nair P G. Heavy metal concentrations in fish, shellfish and fish products from internal markets of India vis-a-vis international standards [J]. Food Chemistry, 2007, 102(3): 612-620
[14] Yin Z B, Milatovic D, Aschner J L, et al. Methylmercury induces oxidative injury, alterations in permeability and glutamine transport in cultured astrocytes [J]. Brain Research, 2007, 1131(1): 1-10
[15] Mourón S A, Grillo C A, Dulout F N, et al. A comparative investigation of DNA strand breaks, sister chromatid exchanges and K-ras gene mutations induced by cadmium salts in cultured human cells [J]. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 2004, 568(2): 221-231
[16] Potts R J, Bespalov I A, Wallace S S, et al. Inhibition of oxidative DNA repair in cadmium-adapted alveolar epithelial cells and the potential involvement of metallothionein [J]. Toxicology, 2001, 161(1-2): 25-38
![]() M, Hei T K. Mutagenicity of cadmium in mammalian cells: Implication of oxidative DNA damage [J]. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 2004, 546(1-2): 81-91
M, Hei T K. Mutagenicity of cadmium in mammalian cells: Implication of oxidative DNA damage [J]. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 2004, 546(1-2): 81-91
[18] Shalini R, Jeyasekaran G, Shakila R J, et al. Trace element concentrations in the organs of fish along the southeast coast of India [J]. Marine Pollution Bulletin, 2021, 162: 111817
[19] Rubio C, Acosta L, Luis-González G, et al. A limited survey of metal content in blue jack mackerel (Trachurus picturatus) obtained from markets in the canary islands [J]. Journal of Food Protection, 2018, 81(2): 202-208
[20] Afandi I, Talba S, Benhra A, et al. Trace metal distribution in pelagic fish species from the north-west African coast (Morocco) [J]. International Aquatic Research, 2018, 10(2): 191-205
[21] Agusa T, Kunito T, Yasunaga G, et al. Concentrations of trace elements in marine fish and its risk assessment in Malaysia [J]. Marine Pollution Bulletin, 2005, 51(8-12): 896-911
[22] Honda K, Sahrul M, Hidaka H, et al. Organ and tissue distribution of heavy metals, and their growth-related changes in Antarctic fish, Pagothenia borchgrevinki [J]. Agricultural and Biological Chemistry, 1983, 47(11): 2521-2532
[23] Bodin N, Lesperance D, Albert R, et al. Trace elements in oceanic pelagic communities in the western Indian Ocean [J]. Chemosphere, 2017, 174: 354-362
[24] 杨美兰. 海产鱼类中重金属的分布[J]. 微量元素, 1990, 7(3): 54-56
[25] Ghosn M, Mahfouz C, Chekri R, et al. Seasonal and spatial variability of trace elements in livers and muscles of three fish species from the eastern Mediterranean [J]. Environmental Science and Pollution Research International, 2020, 27(11): 12428-12438
[26] Abdallah M A M. Trace element levels in some commercially valuable fish species from coastal waters of Mediterranean Sea, Egypt [J]. Journal of Marine Systems, 2008, 73(1-2): 114-122
[27] Lozano-Bilbao E, Raimundo J, Jurado-Ruzafa A, et al. Comparing element content in small pelagic fish species from different fishing grounds in the central-east Atlantic Ocean. Risk assessment [J].Thalassas: An International Journal of Marine Sciences, 2021, 37(2): 861-869
[28] Amiard-Triquet C, Jeantet A Y, Berthet B. Metal transfer in marine food chains: Bioaccumulation and toxicity [J]. Acta Biologica Hungarica, 1993, 44(4): 387-409
[29] 王文雄, 潘进芬. 重金属在海洋食物链中的传递[J]. 生态学报, 2004, 24(3): 599-604
Wang W X, Pan J F. The transfer of metals in marine food chains: A review [J]. Acta Ecologica Sinica, 2004, 24(3): 599-604 (in Chinese)
[30] 余杨, 王雨春, 周怀东, 等. 三峡库区蓄水初期大宁河重金属食物链放大特征研究[J]. 环境科学, 2013, 34(10): 3847-3853
Yu Y, Wang Y C, Zhou H D, et al. Biomagnification of heavy metals in the aquatic food chain in Daning River of the Three Gorges Reservoir during initial impoundment [J]. Environmental Science, 2013, 34(10): 3847-3853 (in Chinese)
[31] Rainbow P S. The significance of trace metal concentrations in marine invertebrates [J]. Ecotoxicology of Metals in Invertebrates, 1993, 1: 3-23
[32] 孙鹏飞, 刘越, 代乾良, 等. 水产品重金属富集及人群健康风险评价[J]. 中国渔业质量与标准, 2021, 11(3): 56-63
Sun P F, Liu Y, Dai Q L, et al. Heavy metal accumulation in aquatic products and risk assessment for human health [J]. Chinese Fishery Quality and Standards, 2021, 11(3): 56-63 (in Chinese)
[33] Gobert S, Pasqualini V, Dijoux J, et al. Trace element concentrations in the apex predator swordfish (Xiphias gladius) from a Mediterranean fishery and risk assessment for consumers [J]. Marine Pollution Bulletin, 2017, 120(1-2): 364-369
[34] 程家丽, 马彦宁, 刘婷婷, 等. 中国部分海产品重金属污染特征及健康风险评价[J]. 卫生研究, 2017, 46(1): 148-154
Cheng J L, Ma Y N, Liu TT, et al. Accumulation and health risks of heavy metals in the seafood from China [J]. Journal of Hygiene Research, 2017, 46(1): 148-154 (in Chinese)
[35] 吴昊, 张乐蒙, 黄智伟, 等. 厦门湾常见海洋经济生物重金属污染特征及风险评价[J]. 应用海洋学学报, 2022, 41(3): 395-406
Wu H, Zhang L M, Huang Z W, et al. Characteristics and risk assessment of heavy metal pollution of common marine commercial organisms in Xiamen Bay [J]. Journal of Applied Oceanography, 2022, 41(3): 395-406 (in Chinese)
[36] Rahman M M, Shehzad M T, Nayak A K, et al. Health risks from trace elements in muscles of some commonly available fish in Australia and India [J]. Environmental Science and Pollution Research International, 2020, 27(17): 21000-21012
[37] 澹台炳琰, 张兆兰. 微量元素间的互作关系及在日粮中的平衡[J]. 河北农业大学学报, 1998, 21(3): 75-79
Tantai B Y, Zhang Z L. The interactive relations among some trace elements and its balance in daily feeds [J]. Journal of Agricultural University of Hebei, 1998, 21(3): 75-79 (in Chinese)
[38] Hansen A M, Bryan C E, West K, et al. Trace element concentrations in liver of 16 species of cetaceans stranded on Pacific Islands from 1997 through 2013 [J]. Archives of Environmental Contamination and Toxicology, 2016, 70(1): 75-95
[39] 张启华. 海湾扇贝软体组织中汞与硒的形态分析及硒对汞的拮抗作用研究[D]. 青岛: 中国海洋大学, 2014: 92- 101
Zhang Q H. Studies on the speciation of mercury and selenium in the soft tissues of bay scallops and the antagonism of selenium species to mercury species [D]. Qingdao: Ocean University of China, 2014: 92-101 (in Chinese)
[40] Ralston C R, Lloyd Blackwell J Ⅲ, Ralston N V C. Effects of dietary selenium and mercury on house crickets (Acheta domesticus L.): Implications of environmental co-exposures [J]. Environmental Bioindicators, 2006, 1(1): 98-109
[41] Nigro M, Leonzio C. Intracellular storage of mercury and selenium in different marine vertebrates [J]. Marine Ecology Progress Series, 1996, 135: 137-143
[42] Lailson-Brito J, Cruz R, Dorneles P R, et al. Mercury-selenium relationships in liver of Guiana dolphin: The possible role of Kupffer cells in the detoxification process by tiemannite formation [J]. PLoS One, 2012, 7(7): e42162
[43] 梅光泉. 微量元素硒的生物拮抗作用[J]. 微量元素, 1991, 8(3): 4, 12
[44] Wang W X, Rainbow P S. Significance of metallothioneins in metal accumulation kinetics in marine animals [J]. Comparative Biochemistry and Physiology Part C: Toxicology &Pharmacology, 2010, 152(1): 1-8
[45] Yu H T, Zhen J, Leng J Y, et al. Zinc as a countermeasure for cadmium toxicity [J]. Acta Pharmacologica Sinica, 2021, 42(3): 340-346
[46] 陈细香, 吴文杰, 林玲玲. 重金属Cd、Zn对文蛤的急性毒性和联合毒性[J]. 江苏农业科学, 2014, 42(7): 241-244
Chen X X, Wu W J, Lin L L. Acute toxicity and combined toxicity of heavy metals Cd and Zn to Meretrix meretrix [J]. Jiangsu Agricultural Sciences, 2014, 42(7): 241-244 (in Chinese)
[47] Satoh S, Tabata K, Izume K, et al. Mineral nutrition in fish. ⅩⅪ. Effect of dietary tricalcium phosphate on availability of zinc to rainbow trout [J]. Nippon Suisan Gakkaishi, 1987, 53(7): 1199-1205
[48] 李光辉. 微量元素间及其与营养素之间的协同与拮抗作用[J]. 乳业科学与技术, 2005, 28(2): 80-82
Li G H. The cooperation and antagonism between trace elements and nutrients [J]. Journal of Dairy Science and Technology, 2005, 28(2): 80-82 (in Chinese)
[49] 梁涛, 陶澍, 曹军. 铜铅被鱼吸收过程中的相互作用[J]. 应用生态学报, 2000, 11(4): 621-624
Liang T, Tao S, Cao J. Interaction of Cu and Pb in accumulation process by fish [J]. Chinese Journal of Applied Ecology, 2000, 11(4): 621-624 (in Chinese)
[50] 朱毅, 张瑞涛. 砷、铜、苯酚对鲤鱼(Cyprinus carpio Linn.)的联合毒性研究[J]. 应用与环境生物学报, 2001, 7(3): 262-266
Zhu Y, Zhang R T. Joint toxicity of arsenic, copper and phenol to carps (Cyprinus carpio Linn.) [J]. Chinese Journal of Applied and Environmental Biology, 2001, 7(3): 262-266 (in Chinese)
[51] Hilton J W, Hodson P V. Effects of diet composition on selenium metabolism in rainbow trout [J]. Journal of Nutrition, 1983, 113: 1242-1248
[52] Poppe T T, Hastein T, Froslie A, et al. Nutritional aspects of Haemorrhagic Syndrome (‘Hitra Disease’) in farmed Atlantic salmon Salmo salar [J]. Diseases of Aquatic Organisms, 1985, 1: 155-162
[53] 张子仪. 中国饲料学[M]. 北京: 中国农业出版社, 2000: 90-95
[54] Vangen B, Hemre G I. Dietary carbohydrate, iron and zinc interactions in Atlantic salmon (Salmo salar) [J]. Aquaculture, 2003, 219(1-4): 597-611
[55] 叶超霞, 刘永坚, 田丽霞, 等. 斜带石斑鱼(Epinephelus coioides)饲料中铜的适宜添加量研究[J]. 海洋与湖沼, 2013, 44(2): 461-466
Ye C X, Liu Y J, Tian L X, et al. Dietary copper requirement of juvenile grouper Epinephelus coioides [J]. Oceanologia et Limnologia Sinica, 2013, 44(2): 461-466 (in Chinese)
[56] Maage A, Lygren B, Ali El-Mowafic A F. Manganese requirement of Atlantic salmon (Salmo salar) fry [J]. Fisheries Science, 2000, 66(1): 1-8
[57] Luo Z, Tan X Y, Zheng J L, et al. Quantitative dietary zinc requirement of juvenile yellow catfish Pelteobagrus fulvidraco, and effects on hepatic intermediary metabolism and antioxidant responses [J]. Aquaculture, 2011, 319(1-2): 150-155
[58] Jobling M. National Research Council (NRC): Nutrient requirements of fish and shrimp [J]. Aquaculture International, 2012, 20: 601-602
[59] Eid A E, Ghonim S I. Dietary zinc requirement of fingerling Oreochromis niloticus [J]. Aquaculture, 1994, 119(2-3): 259-264
[60] 叶超霞, 刘永坚, 田丽霞, 等. 饲料中锌含量对斜带石斑鱼(Epinephelus coioides)生长、饲料效率、矿物质含量和体组成的影响[J]. 海洋与湖沼, 2013, 44(1): 83-89
Ye C X, Liu Y J, Tian L X, et al. Effect of dietary zinc on growth, feed efficiency, mineral content and body composition of juvenile grouper Epinephelus coioides [J]. Oceanologia et Limnologia Sinica, 2013, 44(1): 83-89 (in Chinese)
[61] Lanno R P, Slinger S J, Hilton J W. Maximum tolerable and toxicity levels of dietary copper in rainbow trout (Salmo gairdneri Richardson) [J]. Aquaculture, 1985, 49(3-4): 257-268
[62] Conrad M E, Umbreit J N, Moore E G, et al. Separate pathways for cellular uptake of ferric and ferrous iron [J]. American Journal of Physiology Gastrointestinal and Liver Physiology, 2000, 279(4): G767-G774
[63] Gunshin H, MacKenzie B, Berger U V, et al. Cloning and characterization of a mammalian proton-coupled metal-ion transporter [J]. Nature, 1997, 388(6641): 482-488
[64] Carriquiriborde P, Handy R D, Davies S J. Physiological modulation of iron metabolism in rainbow trout (Oncorhynchus mykiss) fed low and high iron diets [J]. The Journal of Experimental Biology, 2004, 207(Pt 1): 75-86
[65] Anderson R A. Trace Elements in Human and Animal Nutrition [M]. Orlando Academic Press, 1987: 225-244
[66] Satoh S, Takeuchi T, Watanabe T. Availability of manganese and magnesium contained in white fish meal to rainbow trout Oncorhynchus mykiss [J]. Nippon Suisan Gakkaishi, 1991, 57(1): 99-104
[67] Anan Y, Kunito T, Tanabe S, et al. Trace element accumulation in fishes collected from coastal waters of the Caspian Sea [J]. Marine Pollution Bulletin, 2005, 51(8-12): 882-888
[68] Kojadinovic J, Potier M, Le Corre M, et al. Bioaccumulation of trace elements in pelagic fish from the Western Indian Ocean [J]. Environmental Pollution, 2007, 146(2): 548-566
[69] Vieira C, Morais S, Ramos S, et al. Mercury, cadmium, lead and arsenic levels in three pelagic fish species from the Atlantic Ocean: Intra- and inter-specific variability and human health risks for consumption [J]. Food and Chemical Toxicology: An International Journal Published for the British Industrial Biological Research Association, 2011, 49(4): 923-932
[70] Agah H, Leermakers M, Elskens M, et al. Accumulation of trace metals in the muscle and liver tissues of five fish species from the Persian Gulf [J]. Environmental Monitoring and Assessment, 2009, 157(1-4): 499-514
[71] Barone G, Storelli A,Mallamaci R, et al. Comparative study on trace metal accumulation in liver of Mediterranean deep-sea fish and their selenium/mercury molar ratios [J]. Water, Air, &Soil Pollution, 2017, 228(6): 211
[72] Khezri P H, Takhsha M, Jamshid K A, et al. Assessment level of heavy metals (Pb, Cd, Hg) in four fish species of Persian Gulf (Bushehr-Iran) [J]. International Journal of Advanced Technology &Engineering Research, 2014, 4: 34-38
[73] Ikemoto T, Kunito T, Watanabe I, et al. Comparison of trace element accumulation in Baikal seals (Pusa sibirica), Caspian seals (Pusa caspica) and northern fur seals (Callorhinus ursinus) [J]. Environmental Pollution, 2004, 127(1): 83-97
[74] Seixas T G, do A Kehrig H, Fillmann G, et al. Ecological and biological determinants of trace elements accumulation in liver and kidney of Pontoporia blainvillei [J]. Science of the Total Environment, 2007, 385(1-3): 208-220
[75] Kojadinovic J, Potier M, Le Corre M, et al. Bioaccumulation of trace elements in pelagic fish from the Western Indian Ocean [J]. Environmental Pollution, 2007, 146(2): 548-566
[76] Phillips D. Quantitative Aquatic Biological Indicators: Their Use to Monitor Trace Metal and Organochlorine Pollution [M]. Barking: Applied Science Publishers, 1980: 56-72
[77] Langston W J, Spence S K. Biological factors involved in metal concentrations observed in aquatic organisms [J]. Metal Speciation and Bioavailability in Aquatic Systems, 1995, 3: 407-478
[78] Al-Yousuf M H, El-Shahawi M S, Al-Ghais S M. Trace metals in liver, skin and muscle of Lethrinus lentjan fish species in relation to body length and sex [J]. Science of the Total Environment, 2000, 256(2-3): 87-94
[79] Lozano-Bilbao E, Jurado-Ruzafa A, Lozano G, et al. Development stage and season influence in the metal content of small pelagic fish in the North-West Africa [J]. Chemosphere, 2020, 261: 127692
[80] 阮晓, 郑春霞, 王强, 等. 重金属在罗非鱼淡水白鲳和鲤鱼体内的蓄积[J]. 农业环境保护, 2001, 20(5): 357-359
Ruan X, Zheng C X, Wang Q, et al. Accumulation of heavy metal in Tilapia nilotica, Colossoma brachypomum and Cyprinus carpio [J]. Agro-Environmental Protection, 2001, 20(5): 357-359 (in Chinese)
[81] Wang W X, Rainbow P S. Significance of metallothioneins in metal accumulation kinetics in marine animals [J]. Comparative Biochemistry and Physiology Part C: Toxicology &Pharmacology, 2010, 152(1): 1-8
[82] Yu H T, Zhen J, Leng J Y, et al. Zinc as a countermeasure for cadmium toxicity [J]. Acta Pharmacologica Sinica, 2021, 42(3): 340-346
[83] Uluturhan E, Kucuksezgin F. Heavy metal contaminants in red pandora (Pagellus erythrinus) tissues from the Eastern Aegean Sea, Turkey [J]. Water Research, 2007, 41(6): 1185-1192
[84] Mayer Jr F L, Marking L L, Bills T D, et al. Physicochemical Factors Affecting Toxicity in Freshwater: Hardness, pH and Temperature [M]// Hamelink J L, Landrum P F, Bergman H L, et al. Bioavailability: Physical, Chemical and Biological Interactions. Boca Raton: Lewis Publishers, 1994: 5-22
[85] Arai T, Kotake A, Kayama S, et al. Movements and stock discrimination of skipjack tuna, Katuwonus pelamis, in the Western Pacific by otolith Sr:Ca ratios [C]. 17th Meeting of the Standing Committee on Tuna and Billfish. Majuro, Marshall Islands: The Scientific Committee of the Commission for the Conservation and Management of Highly Migratory Fish Stocks in the Western and Central Pacific Ocean, 2004: Bio-7
[86] Lin Y T. Age, growth and migratory environmental history of southern bluefin tuna (Thunnus maccoyii) in the Indian Ocean [D]. Taipei, Taiwan, China: Taiwan University, 2006: 15-30
[87] Dove S G, Kingsford M J. Use of otoliths and eye lenses for measuring trace-metal incorporation in fishes: A biogeographic study [J]. Marine Biology, 1998, 130(3): 377-387
[88] Rooker J R, Secor D H, Zdanowicz V S, et al. Otolith elemental fingerprints of Atlantic bluefin tuna from eastern and western nurseries [R]. Madrid: The International Commission for the Conservation of Atlantic Tunas (ICCAT), 2002, 54: 198-506
[89] Payan P, DePontual H, Bœuf G, et al. Endolymph chemistry and otolith growth in fish [J]. Comptes Rendus Palevol, 2004, 3(6-7): 535-547
[90] Elsdon T S, Wells B K, Campana S E, et al. Otolith Chemistry to Describe Movements and Life-history Parameters of Fishes: Hypotheses, Assumptions, Limitations and Inferences [M]//Oceanography and Marine Biology. CRC Press, 2008: 303-336
[91] Wells B K, Rieman B E, Clayton J L, et al. Relationships between water, otolith, and scale chemistries of westslope cutthroat trout from the Coeur d’Alene River, Idaho: The potential application of hard-part chemistry to describe movements in freshwater [J]. Transactions of the American Fisheries Society, 2003, 132(3): 409-424
[92] Luo J. The influential factors of strontium and barium enrichment in otolith and their response to the environment [J]. Earth Science Frontiers, 2008, 15(6): 18
[93] Walther B D, Thorrold S R. Water, not food, contributes the majority of strontium and barium deposited in the otoliths of a marine fish [J]. Marine Ecology Progress Series, 2006, 311: 125-130
[94] 李云凯, 沈永富. 脊椎骨在软骨鱼类年龄、摄食及洄游研究中的应用[J]. 中国水产科学, 2021, 28(1): 112-121
Li Y K, Shen Y F. A review of studies on the age, feeding habits, and migration using vertebrae of cartilaginous fishes [J]. Journal of Fishery Sciences of China, 2021, 28(1): 112-121 (in Chinese)
[95] 许昆灿, 吴丽卿, 汪惠昌. 海洋生物体中痕量金属分析方法的实验室间分析互校[J]. 台湾海峡, 1993, 12(2): 102-109
Xu K C, Wu L Q, Wang H C. Summary report on China Intercomparison Exercise for analytical methods of trace metals in biological tissue [J]. Journal of Oceanography in Taiwan Strait, 1993, 12(2): 102-109 (in Chinese)
[96] 陶玲, 吴强, 李铁军, 等. 大洋鱿鱼体内重金属富集特征及健康风险评估[J]. 生态毒理学报, 2022, 17(3): 293-302
Tao L, Wu Q, Li T J, et al. Bioaccumulation and health risk assessment of heavy metals in pelagic squid [J]. Asian Journal of Ecotoxicology, 2022, 17(3): 293-302 (in Chinese)
[97] 陈永正. 应用鱼类微量元素含量建立预测福建海域污染的数学模型[J]. 台湾海峡, 1997, 16(2): 181-185
Chen Y Z. Model coastal water pollution in Fujian by examination of trace elements in fish [J]. Journal of Oceanography in Taiwan Strait, 1997, 16(2): 181-185 (in Chinese)
[98] Food and Agriculture Organization of the United Nations/World Health Organization (FAO/WHO). Evaluation of certain mycotoxins in food: Fifty-sixth report of the Joint FAO/WHO Expert Committee on Food Additives [R]. Geneva: World Health Organization, 2002: 56
[99] 中华人民共和国农业部. 无公害食品 水产品中有毒有害物质限量: NY 5073—2006[S]. 北京: 农业出版社, 2006
[100] Mokhtar M, Aris A Z, Munusamy V, et al. Assessment level of heavy metals in Penaeus monodon and Oreochromis spp in selected aquaculture ponds of high densities development area [J]. European Journal of Scientific Research, 2009, 30: 348-360
[101] 国家卫生健康委员会, 国家市场监督管理总局. 食品安全国家标准 食品中污染物限量: GB 2762—2022[S]. 北京: 中国标准出版社, 2022
[102] Bosch A C, O’Neill B, Sigge G O, et al. Heavy metals in marine fish meat and consumer health: A review [J]. Journal of the Science of Food and Agriculture, 2016, 96(1): 32-48
[103] Storelli A, Barone G, Dambrosio A, et al. Occurrence of trace metals in fish from South Italy: Assessment risk to consumer’s health [J]. Journal of Food Composition and Analysis, 2020, 90: 103487
[104] Bouiba S, Bendimerad M E A, Rouane-Hacene O, et al. Metallic trace element dynamics in Paracentrotus lividus from Algeria: Environmental and human health risk assessment [J]. Marine Pollution Bulletin, 2023, 187: 114485
[105] 刘庄, 林嘉立, 潘巧敏, 等. 食用鱼类食用安全性评价方法综述[J]. 广东化工, 2019, 46(11): 122-123
Liu Z, Lin J L, Pan Q M, et al. Review on the evaluation methods of food safety of edible fish in Meijiang River [J]. Guangdong Chemical Industry, 2019, 46(11): 122-123 (in Chinese)