重金属含量对水生生物的胚胎发育及幼体生长会产生很大影响,工业废水、生活废水、水产养殖投入品等给水环境带来多种重金属,随着时间的推移排放到水域环境中的重金属会越积越多。生活污水及工业废水中含有镉(Cd),Cd对水体中有毒物质的降解会产生抑制作用[1];铜(Cu)经常作为消灭藻类和一些细菌等微生物的药物使用;一些饵料中也含有一定量Cu2+,水中残饵对养殖水体会造成一定重金属污染[2]。水环境对鱼类胚胎孵化和仔鱼生长至关重要,在生命早期鱼类对生长水体环境中污染物的含量比较敏感,水体中的重金属离子常会对胚胎发育和初孵仔鱼生长产生严重影响[3]。在胚胎发育阶段,重金属可以影响胚胎分化及器官形成,延长或缩短胚胎出膜时长,严重可造成胚胎发育障碍,导致畸形,Cu2+作用下,高浓度组胚胎及初孵仔鱼畸形现象显著,如围心腔畸形、椎体中后部弯曲[4];在初孵仔鱼生长阶段,重金属离子会吸附在鱼体组织器官表面,影响组织器官正常生理代谢活动,对其造成损伤甚至导致死亡[5],如Cu2+中毒情况下褐牙鲆(Paralichthys olivaceus)鳃盖起伏剧烈,出现身体痉挛,死亡个体体表及鳃部覆盖铜绿色沉淀[6]。
由于过度捕捞和环境变化等因素,1994年以来绿鳍马面鲀(Thamnaconus septentrionalis)自然资源急剧下降,这个鱼种逐渐受到人们的重视[7]。目前,重金属对绿鳍马面鲀胚胎发育以及初孵仔鱼的毒性试验尚未见报道。文章通过研究Cu2+、Cd2+对绿鳍马面鲀胚胎及初孵仔鱼的毒性效应,对重金属的耐受性进行比较,以期揭示其对绿鳍马面鲀胚胎及初孵仔鱼的毒性作用,得到水生生物重金属离子急性毒性的基础数据,为了解绿鳍马面鲀资源下降的环境原因和开展人工苗种培育的水质调控提供理论支持。
1 材料与方法(Materials and methods)
1.1 受精卵及初孵仔鱼
试验于2022年6月在中国水产科学研究院东海水产研究所赣榆研究中心开展,绿鳍马面鲀受精卵为研究中心培育的亲鱼自然产卵受精。产卵海水温度(22.0±0.5) ℃,盐度29,pH 7.6±0.1,溶氧(7.5±1.0) mg·L-1。收集的受精卵冲洗消毒后置于清洁海水中充气孵化,选用正常环境孵化的初孵仔鱼用于试验。
1.2 试剂
试验药品为CuSO4·5H2O、CdCl2,均为分析纯,购自上海麦克林生化科技有限公司。分别称取一定量的试验药品,配制成不同浓度的试验用液。
试验海区洁净海水中Cu、Cd这2种重金属离子浓度测定值均<0.001 mg·L-1,因此以洁净自然海水为对照组,Cu、Cd离子浓度可视为0 mg·L-1。
1.3 试验方法
参照国家鱼类急性毒性试验标准[8],设计Cu2+、Cd2+对绿鳍马面鲀胚胎及初孵仔鱼的急性毒性试验。
1.3.1 Cu2+、Cd2+对胚胎的毒性试验
经Cu2+(0.01~0.24 mg·L-1)、Cd2+(1~8 mg·L-1)预实验,确定正式试验浓度梯度分别为0、0.02、0.07、0.12和0.17 mg·L-1;0、1、3、5和7 mg·L-1。分别将处于原肠早期、器官发生期的受精卵放入直径为10 cm含有50 mL实验液的培养皿进行毒性试验,每个培养皿放入30粒,每组3个平行。试验过程中温度控制在(22.0±0.5) ℃、pH 7.6±0.2、盐度29。间隔30 min在显微镜下观察各试验组胚胎发育情况并进行拍照,用吸管吸去死卵,统计在原肠期至神经胚、器官发生期至出膜2个阶段胚胎死亡数、仔鱼孵出数和畸形数。
1.3.2 胚胎发育过程观察
间隔30 min,在显微镜下观察受精卵胚胎发育进程,记录不同浓度Cu2+、Cd2+组原肠期至神经胚、器官发生期至出膜发育阶段的形态特征及发育时间,50%胚胎出现新特征即进入下一胚胎发育阶段;在解剖镜下观察仔鱼发育情况,当有半数以上的受精卵孵化出仔鱼,作为该组的孵化时间。孵化结束后,记录各组孵出仔鱼数量、孵化出膜时间。
1.3.3 Cu2+、Cd2+对初孵仔鱼毒性试验
经Cu2+(0.01~0.25 mg·L-1)、Cd2+(1~8 mg·L-1)的预实验,确定各金属离子浓度范围,以24 h全活质量浓度为下限、72 h全致死质量浓度为上限设Cu2+、Cd2+浓度组各4个,洁净海水作为对照组,Cu2+浓度梯度分别为0、0.03、0.08、0.13和0.18 mg·L-1,Cd2+浓度梯度分别为0、2、4、6和8 mg·L-1。试验容器为水体1 L的烧杯,各放入30尾正常条件下孵出的初孵仔鱼,每组设3个平行。观察记录各组仔鱼活动、形态特征变化,及时清除死亡仔鱼,统计仔鱼暴露24、48和72 h的死亡情况。
1.4 数据处理
采用SPSS 20.0统计软件对胚胎发育时长、死亡率、孵化率和存活率,初孵仔鱼畸形率和存活率等实验数据进行单因子方差分析(One-way ANOVA)和Duncan’s多重比较,用字母标记法来表示差异显著,相同字母间表示差异不显著,不同字母间表示差异显著(P≤0.05)。在SPSS 20.0中调用Probit程序,依据概率-浓度回归方程法求出72 h的LC50(受试样品50%死亡率时对应的污染物浓度)。
孵化率=孵出仔鱼数/受精卵粒数×100%
畸形率=孵出畸形仔鱼数/孵出仔鱼数×100%
死亡率=死亡仔鱼数/孵出仔鱼数×100%
安全质量浓度计算公式如下:
SC=0.1×72 h-LC50
式中:SC为安全质量浓度值,72 h-LC50为染毒72 h后的半致死数量浓度值。
2 结果(Results)
2.1 Cu、Cd对胚胎及仔鱼的致畸作用
在重金属对绿鳍马面鲀胚胎及仔鱼的急性毒性实验中,通过对各个试验组与对照组中胚胎及初孵仔鱼形态及生长状况的观察对比分析,发现不同浓度的Cu2+、Cd2+对胚胎发育的不同阶段会造成不同程度影响。且随重金属浓度升高,毒害效果愈发明显。
Cu2+、Cd2+对胚胎及仔鱼的致畸作用的表现如图1所示。由图1-1可见正常发育至原肠期的受精卵通体晶莹透明,卵膜内原肠胚清晰均匀,胚盘从卵黄囊一侧下包1/2左右,形如碗状,十几个油球界限分明、大小相近,聚集于卵黄囊另一侧。胚胎畸形情况主要表现为:胚体萎缩,停止发育,呈乳白色不透明状(图1-2、图1-4);胚盘细胞质浑浊,油球数量少(图1-3);胚胎生长发育后期,胚体增生,头部发育不全(图1-5);胚体畸形,尾芽弯曲,不能正常发育出膜(图1-6)。正常初孵仔鱼如图1-7所示,具有卵黄囊和油球,卵黄囊呈椭圆形,油球位于卵黄囊前方,仔鱼肌节腹侧有一列呈直线排列的黑色素。初孵仔鱼畸形状态主要包括:躯干畸形,弯曲呈U形(图1-8);头部增大,脊柱弯曲呈L形(图1-9、图1-10);躯体缩短,脊柱弯曲,身体呈S形(图1-11);卵黄囊后脊柱弯曲,呈V形(图1-12)。
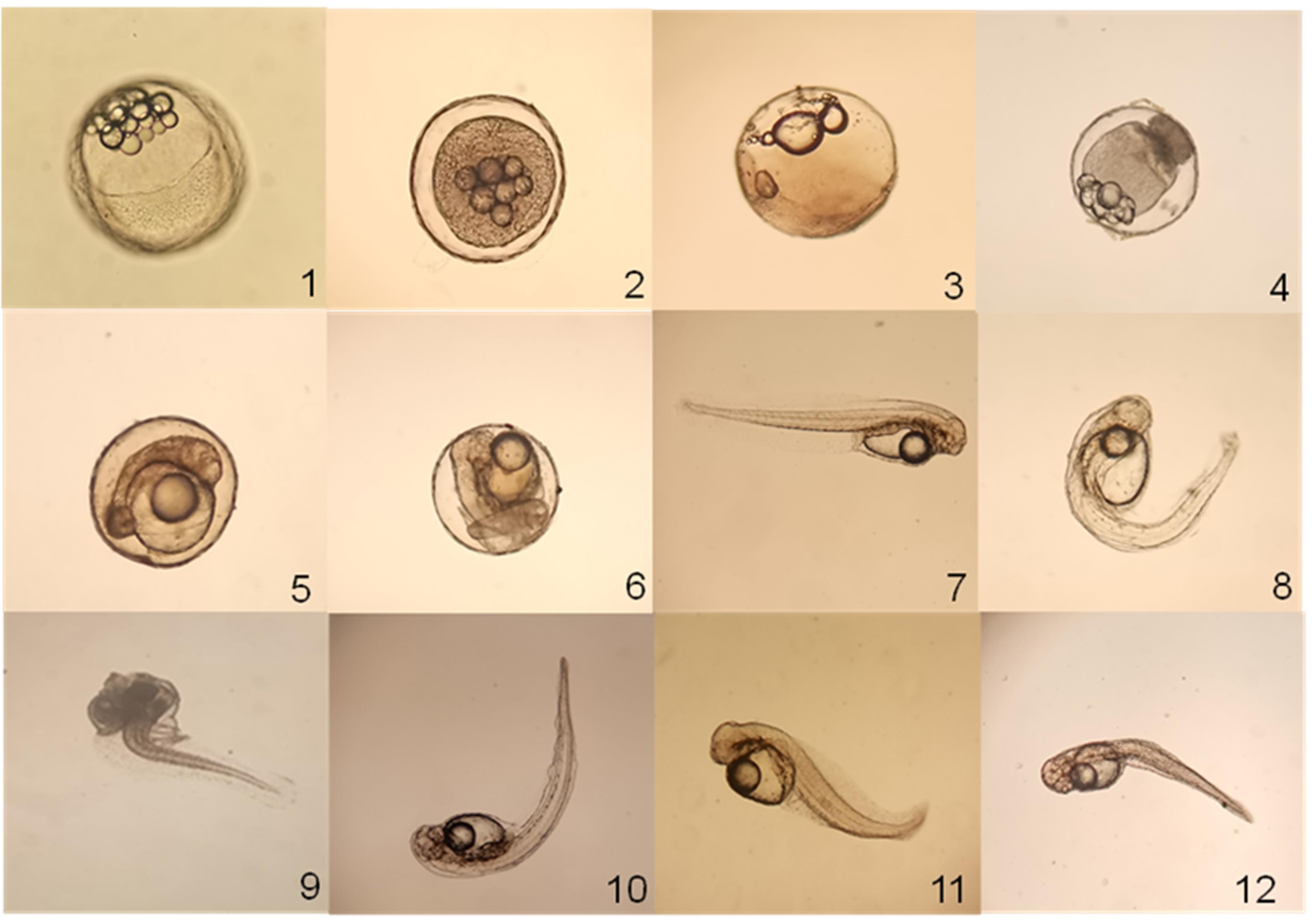
图1 绿鳍马面鲀胚胎和初孵仔鱼的正常和畸形状态
注:1. 正常囊胚;2. 胚体萎缩,呈乳白色不透明状;3. 胚盘细胞质浑浊,油球数量少;4. 胚体萎缩;5. 胚体增生,头部发育不全;6. 胚体畸形,尾芽弯曲;7. 正常初孵仔鱼;8. 躯干畸形,弯曲呈U形;9. 头部增大,脊柱弯曲呈L形;10. 脊柱弯曲呈L形;11. 躯体缩短,脊柱弯曲,身体呈S形;12. 卵黄囊后脊柱弯曲,呈V形。
Fig. 1 Normal and abnormal states of embryo and larvae of Thamnaconus septentrionalis
Note: 1. Normal blastocyst; 2. Embryo body atrophy, milky opaque; 3. The cytoplasm of blastodisk is cloudy and the number of oil globules is small; 4. Embryo body atrophy; 5. Embryo body hyperplasia, incomplete head development; 6. Deformed embryo body, curved tail bud; 7. Normal newly hatched fish; 8. Trunk deformity, bending is U-shaped; 9. The head increases, and the spine bends in an L-shape; 10. The spinal curve is L-shaped; 11. shortening of the body, spine bending, and the body was S-shaped; 12. The spinal curve behind the yolk sac is V-shaped.
将正常孵化条件下的初孵仔鱼放入不同浓度的Cu2+、Cd2+溶液中,6 h内0.03 mg·L-1、0.08 mg·L-1低浓度Cu2+组和2 mg·L-1、4 mg·L-1低浓度Cd2+组仔鱼无异常变化,0.13 mg·L-1、0.18 mg·L-1高浓度Cu2+组和6 mg·L-1、8 mg·L-1高浓度Cd2+组仔鱼开始游动剧烈,之后活动逐渐迟缓;6~24 h,高浓度组部分仔鱼方向感减弱,活动剧烈呈间歇性无规律乱窜;24~48 h,低浓度组仔鱼活力减弱,反应迟缓,高浓度组仔鱼失去游泳能力,原地打转,头部后方或尾部出现弯曲畸形现象;48~72 h,高浓度组大部分仔鱼失去生命活力,沉在烧杯底部死亡且畸形现象严重,低浓度组少数初孵仔鱼出现畸形及死亡现象。
2.2 Cu、Cd对胚胎发育时间和死亡率的影响
在不同重金属浓度梯度下,胚胎发育过程中囊胚期至神经胚、器官分化至出膜2个阶段发育时长及死亡率见表1。Cu2+浓度梯度溶液中,囊胚期至神经胚、器官分化至出膜2个阶段发育时长均随浓度的增加呈先缩短后延长趋势。0.02、0.07和0.12 mg·L-1组发育时长均低于对照组,其中0.07 mg·L-1和0.12 mg·L-1与对照组相比差异显著,0.17 mg·L-1组发育时长显著高于对照组,分别为7.5 h和31.2 h。不同Cd2+浓度梯度溶液中,囊胚期至神经胚、器官分化至出膜2个阶段发育时长均随浓度的增加呈上升趋势。第1阶段各浓度梯度发育时长均大于对照组,其中1 mg·L-1和3 mg·L-1组与对照组相比无显著差异;第2阶段1 mg·L-1组发育时长低于对照组,3、5和7 mg·L-1组发育时长均高于对照组,7 mg·L-1组与对照组相比差异显著。不同Cu2+、Cd2+浓度组在2个发育阶段死亡率均随浓度增加而升高,0.02 mg·L-1 Cu2+组和1 mg·L-1 Cd2+组死亡率与对照组相比无显著差异;囊胚期至神经胚阶段,0.07、0.12和0.17 mg·L-1 Cu2+组胚胎死亡率与对照组相比,分别增加了约5倍、11倍和18倍,3、5和7 mg·L-1 Cd2+组胚胎死亡率与对照组相比,分别增加了约7倍、14倍和19倍;器官分化至出膜阶段,0.07、0.12和0.17 mg·L-1 Cu2+组胚胎死亡率与对照组相比,分别增加了约18倍、35倍和52倍,3、5和7 mg·L-1 Cd2+组胚胎死亡率与对照组相比,分别增加了约22倍、45倍和65倍;同一浓度下,器官分化至出膜阶段胚胎死亡率低于囊胚期至神经胚阶段。
表1 Cu2+、Cd2+对绿鳍马面鲀胚胎发育的影响
Table 1 Effects of Cu2+ and Cd2+ on embryonic development of Thamnaconus septentrionalis
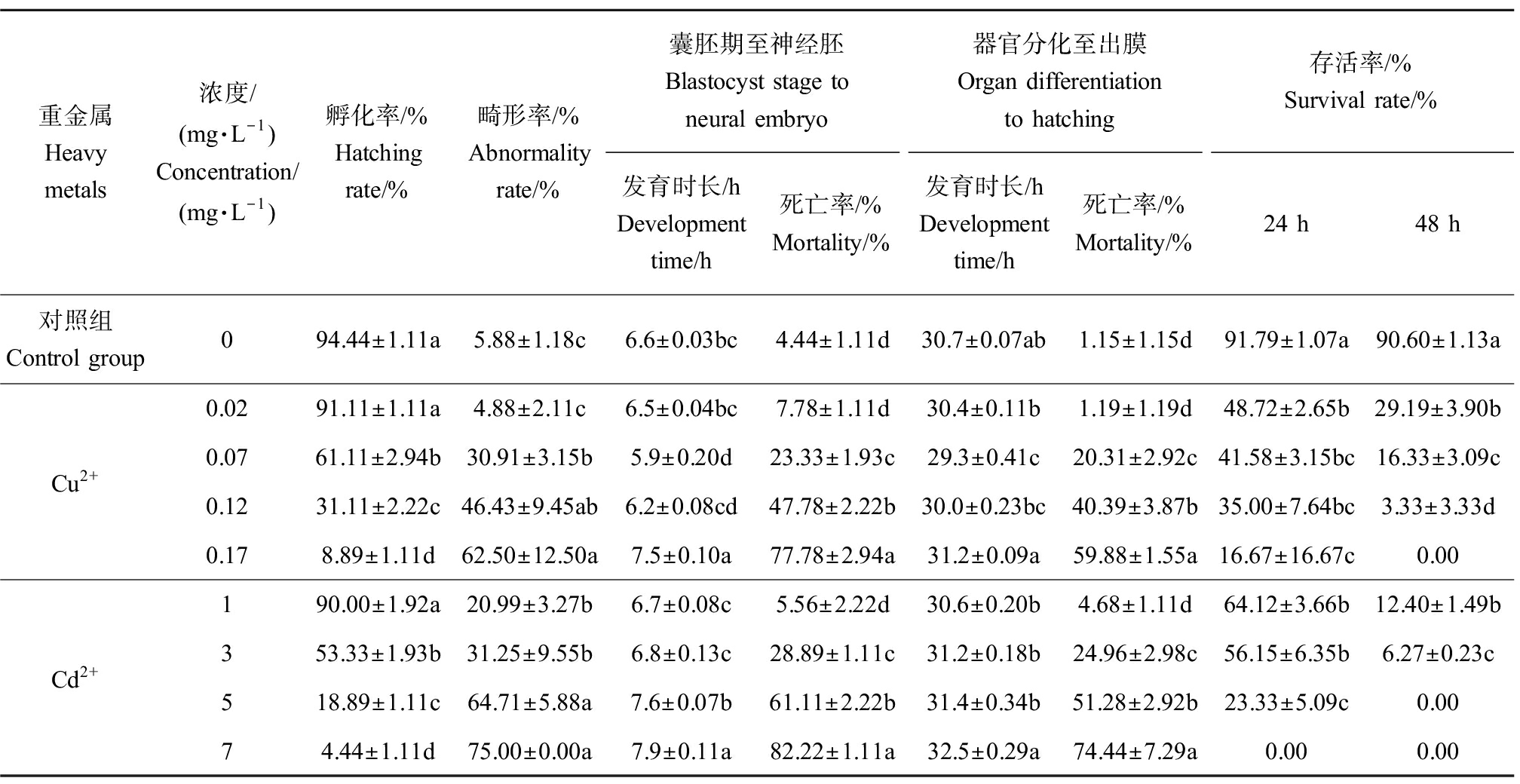
重金属Heavy metals浓度/(mg·L-1)Concentration/(mg·L-1)孵化率/%Hatching rate/%畸形率/%Abnormality rate/%囊胚期至神经胚Blastocyst stage to neural embryo器官分化至出膜Organ differentiation to hatching存活率/%Survival rate/%发育时长/h Development time/h死亡率/%Mortality/%发育时长/h Development time/h死亡率/%Mortality/%24 h48 h对照组Control group094.44±1.11a5.88±1.18c6.6±0.03bc4.44±1.11d30.7±0.07ab1.15±1.15d91.79±1.07a90.60±1.13aCu2+0.0291.11±1.11a4.88±2.11c6.5±0.04bc7.78±1.11d30.4±0.11b1.19±1.19d48.72±2.65b29.19±3.90b0.0761.11±2.94b30.91±3.15b5.9±0.20d23.33±1.93c29.3±0.41c20.31±2.92c41.58±3.15bc16.33±3.09c0.1231.11±2.22c46.43±9.45ab6.2±0.08cd47.78±2.22b30.0±0.23bc40.39±3.87b35.00±7.64bc3.33±3.33d0.178.89±1.11d62.50±12.50a7.5±0.10a77.78±2.94a31.2±0.09a59.88±1.55a16.67±16.67c0.00Cd2+190.00±1.92a20.99±3.27b6.7±0.08c5.56±2.22d30.6±0.20b4.68±1.11d64.12±3.66b12.40±1.49b353.33±1.93b31.25±9.55b6.8±0.13c28.89±1.11c31.2±0.18b24.96±2.98c56.15±6.35b6.27±0.23c518.89±1.11c64.71±5.88a7.6±0.07b61.11±2.22b31.4±0.34b51.28±2.92b23.33±5.09c0.0074.44±1.11d75.00±0.00a7.9±0.11a82.22±1.11a32.5±0.29a74.44±7.29a0.000.00
注:不同浓度的各处理组与对照组多重比较,差异性用字母表示(P≤0.05)。
Note: Multiple comparison between treatment groups and control group with different concentrations; the significant difference is represented by the different letters (P≤0.05).
2.3 Cu、Cd对胚胎孵化率、畸形率和存活率的影响
不同浓度Cu2+、Cd2+溶液中,胚胎孵化率、畸形率及初孵仔鱼24 h、48 h存活率情况见表1。Cu2+溶液中,0.17 mg·L-1组与对照组相比胚胎孵化率差异最显著,为(8.89±1.11)%,0.02 mg·L-1组与对照组相比差距不显著,0.12 mg·L-1组孵化率约为对照组的1/3;0.02 mg·L-1组畸形率低于对照组且差异不显著,为(4.88±2.11)%,其他3组畸形率与对照组相比差异显著,0.07 mg·L-1和0.17 mg·L-1 Cu2+组胚胎畸形率与对照组相比,分别增加了约5倍和10倍,其中0.17 mg·L-1组畸形率最高,为(62.50±12.50)%。不同浓度Cd2+溶液中,除1 mg·L-1组与对照组相比差异不显著外,3、5和7 mg·L-1组与对照组相比差异显著,3 mg·L-1组孵化率约为对照组的1/2,其中7 mg·L-1组孵化率最低,为(4.44±1.11)%;各浓度处理组畸形率均显著高于对照组,3 mg·L-1和7 mg·L-1 Cd2+组胚胎畸形率与对照组相比,分别增加了约5倍和15倍。整体来说,随Cu2+、Cd2+浓度增加,孵化率呈下降趋势,畸形率呈上升趋势。
Cu2+、Cd2+溶液中初孵仔鱼存活率与浓度及处理时间呈负相关,24 h时,各浓度组存活率与对照组相比均有显著性差异,Cu2+组中0.17 mg·L-1组初孵仔鱼存活率最低,为(16.67±16.67)%、7 mg·L-1 Cd2+组初孵仔鱼全部死亡;48 h时,0.17 mg·L-1 Cu2+组、5 mg·L-1和7 mg·L-1 Cd2+组存活率为0,其他浓度组与对照组相比均有显著差异。综合考虑胚胎孵化率、畸形率、初孵仔鱼存活率等指标,Cu2+对胚胎发育的毒性大于Cd2+。
2.4 Cu、Cd对初孵仔鱼的急性毒性试验结果
Cu2+、Cd2+对绿鳍马面鲀初孵仔鱼的毒性影响见表2。由表2可知,金属离子浓度与初孵仔鱼畸形率呈正相关,金属离子浓度和培育时间与初孵仔鱼存活率呈负相关。随着Cu2+、Cd2+浓度增加,初孵仔鱼畸形率升高,与对照组相比均有显著差异(P≤0.05),其中0.18 mg·L-1 Cu2+组和8 mg·L-1 Cd2+组畸形率最高,分别为(47.78±4.01)%、(56.67±1.93)%,约为对照组的14倍、17倍。随着Cu2+、Cd2+浓度和培育时间增加,初孵仔鱼存活率下降,24 h时,0.03 mg·L-1 Cu2+组和2 mg·L-1 Cd2+组的存活率均为100%;48 h时,2种金属离子各浓度组与对照组之间的存活率均差异显著(P≤0.05),其中0.13 mg·L-1 Cu2+组存活率约为对照组的1/2,8 mg·L-1 Cd2+组存活率约为对照组的2/5;72 h时,0.18 mg·L-1 Cu2+组和8 mg·L-1 Cd2+组的存活率为0,其他各组存活率与对照组相比差异显著,0.08 mg·L-1 Cu2+组存活率约为对照组的1/2,4 mg·L-1 Cd2+组存活率约为对照组的1/2。
表2 初孵仔鱼在不同浓度Cu2+、Cd2+溶液中畸形率、存活率
Table 2 Malformation rate and survival rate of larvae in different concentrations of Cu2+ and Cd2+ solution
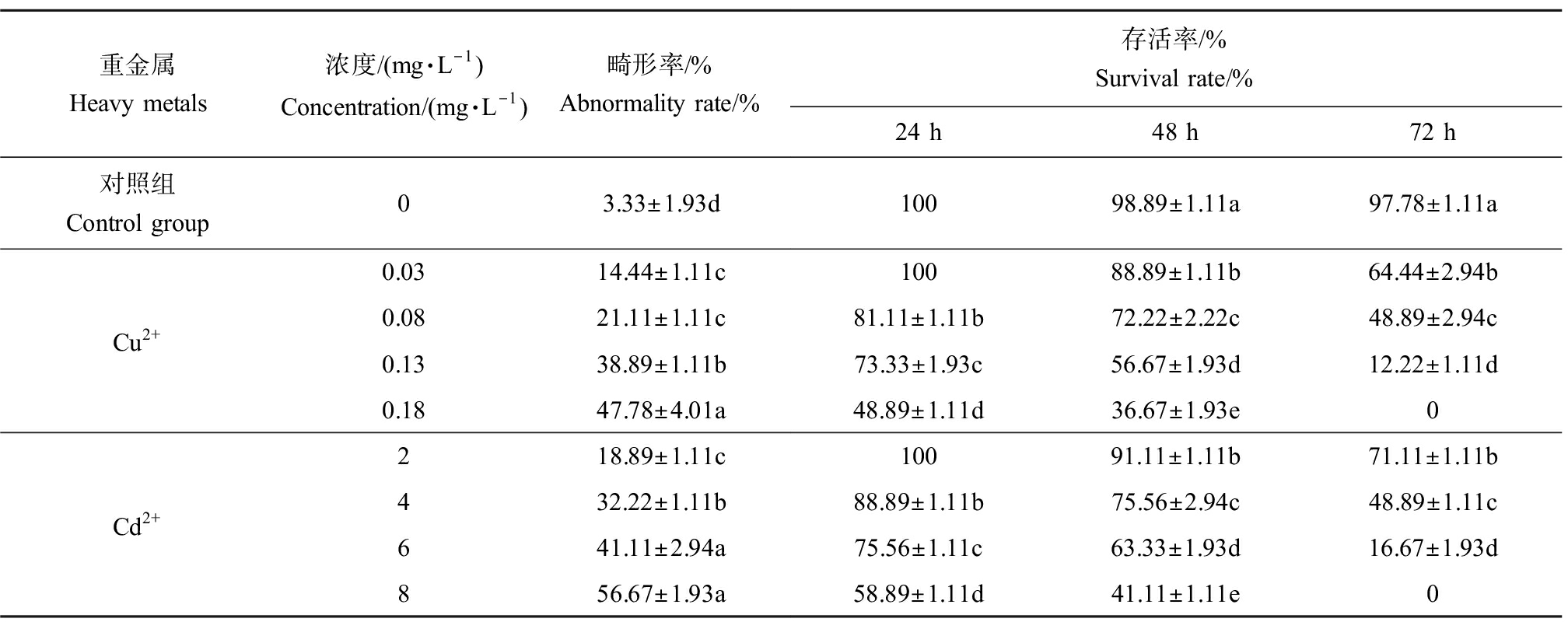
重金属Heavy metals浓度/(mg·L-1)Concentration/(mg·L-1)畸形率/%Abnormality rate/%存活率/%Survival rate/%24 h48 h72 h对照组Control group03.33±1.93d10098.89±1.11a97.78±1.11aCu2+0.0314.44±1.11c10088.89±1.11b64.44±2.94b0.0821.11±1.11c81.11±1.11b72.22±2.22c48.89±2.94c0.1338.89±1.11b73.33±1.93c56.67±1.93d12.22±1.11d0.1847.78±4.01a48.89±1.11d36.67±1.93e0Cd2+218.89±1.11c10091.11±1.11b71.11±1.11b432.22±1.11b88.89±1.11b75.56±2.94c48.89±1.11c641.11±2.94a75.56±1.11c63.33±1.93d16.67±1.93d856.67±1.93a58.89±1.11d41.11±1.11e0
由表3可知,Cu2+、Cd2+的72 h安全浓度分别为0.006 mg·L-1和0.359 mg·L-1,结合存活率和畸形率,Cu2+对绿鳍马面鲀初孵仔鱼的毒性大于Cd2+。
表3 Cu2+、Cd2+对绿鳍马面鲀初孵仔鱼毒性的线性回归方程、LC50及安全浓度
Table 3 Linear regression, LC50 and safe concentration of Cu2+, Cd2+ on larvae Thamnaconus septentrionalis
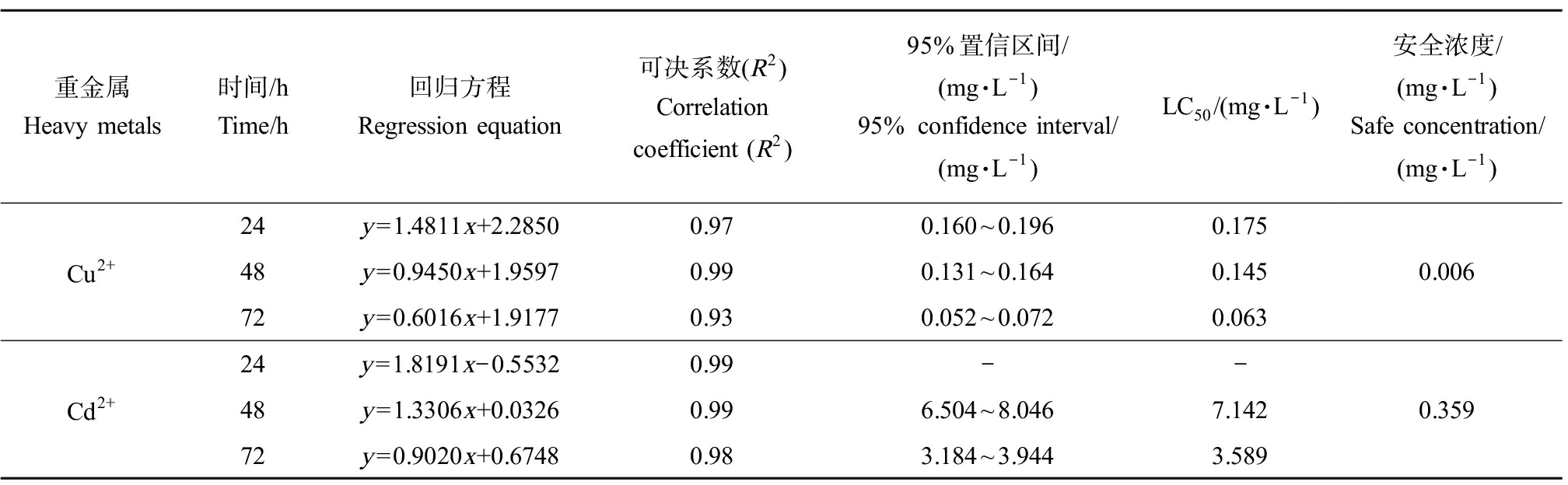
重金属Heavy metals时间/hTime/h回归方程Regression equation可决系数(R2)Correlation coefficient (R2)95%置信区间/(mg·L-1)95% confidence interval/(mg·L-1)LC50/(mg·L-1)安全浓度/(mg·L-1)Safe concentration/(mg·L-1)Cu2+24y=1.4811x+2.28500.970.160~0.1960.17548y=0.9450x+1.95970.990.131~0.1640.14572y=0.6016x+1.91770.930.052~0.0720.0630.006Cd2+24y=1.8191x-0.55320.99--48y=1.3306x+0.03260.996.504~8.0467.14272y=0.9020x+0.67480.983.184~3.9443.5890.359
3 讨论(Discussion)
3.1 Cu、Cd对胚胎发育的毒性影响
重金属在水体中产生活性氧,对鱼体内组织产生氧化损伤,干扰细胞第二信使系统及离子通道等信号途径,从而影响器官分化和胚胎生长发育[9],最终导致胚胎畸形。在绿鳍马面鲀胚胎染毒过程中,0.07 mg·L-1浓度以上Cu2+和1 mg·L-1浓度以上Cd2+处理组胚胎开始出现破碎解体、畸形等现象,且随着浓度的增加胚胎畸形率呈上升趋势,不同浓度重金属对胚胎发育影响有较大差异。陈罗明和凌去非[10]研究发现梭鲈(Stizostedion lucioperca)胚胎发育整体畸形率随Cu2+、Cd2+浓度增加而增加,这与其对绿鳍马面鲀胚胎畸形率毒性作用一致。
胚胎在早期发育阶段抗逆性弱,对水体中重金属离子非常敏感,金属离子可以穿过卵膜进入胚胎,影响其正常生理代谢及组织器官形成[11]。有研究表明重金属可以加快胚胎发育速度,缩短孵化历时,26 ℃时,Cu2+溶液中鲤鱼(common carp)胚胎孵化出膜时间缩短[12];Cd2+也缩短了鲱鱼(Clupea harengus)胚胎的孵化历时[13]。也有研究表明,重金属可以延长孵化时间,使胚胎发育速度减缓,例如Cu2+、Cd2+作用下的裂腹雅罗鱼(Leuciscus idus)胚胎孵化出膜时间延长[14]。0.02、0.07和0.12 mg·L-1的Cu2+作用下绿鳍马面鲀胚胎囊胚期至神经胚、器官分化至出膜2个阶段发育时间短于对照组,囊胚期至出膜总时长缩短了2.03 h,说明低浓度的Cu2+可促进胚胎发育,而Cd2+作用下绿鳍马面鲀胚胎发育速度减缓。
陈玉翠和陈锦云[15]研究Cu2+、Cd2+、汞离子(Hg2+)对斑马鱼(Danio rerio)胚胎毒性大小为Hg2+>Cu2+>Cd2+;柳学周等[16]研究5种重金属毒性对半滑舌鳎(Cynoglossus semilaevis Günther)胚胎毒性大小为Cu2+>Hg2+>Cd2+>Zn2+>Pb2+;柳敏海等[17]等研究5种重金属对早繁鮸鱼(Miichthys miiuy)胚胎的毒性大小依次为Cu2+>Cd2+>Zn2+>Pb2+>Cr6+。Cu2+、Cd2+对绿鳍马面鲀胚胎毒性效果体现为随重金属浓度增加,孵化率不断下降,孵出的仔鱼存活率随浓度增加明显下降。综合分析Cu2+、Cd2+对胚胎毒性的作用浓度,2种重金属的毒性大小为Cu2+>Cd2+,这一结果与上述研究一致。
3.2 Cu、Cd对初孵仔鱼毒性的影响
0.02 mg·L-1 Cu2+和1 mg·L-1 Cd2+作用下孵化出的仔鱼也有部分畸形,例如尾部畸形、弯曲呈L形,躯体萎缩、脊椎弯曲、鱼体呈S形,头部增大、脊椎弯曲呈U形,脑颅后凹陷位置弯曲呈V形等。畸形状态下的仔鱼失去游泳能力或游动无方向感,沉在容器底部,很快死亡,这与非洲鲇(Clarias gariepinus)胚胎在Pb浓度≥300 μg·L-1孵化时,初孵仔鱼出现畸形,具体表现为头部肿大、脊柱侧弯、眼睛畸形[18]的情况相似。正常条件下孵出的仔鱼在高浓度水平Cu2+、Cd2+作用下,24 h内反应剧烈,会出现撞击杯壁、上浮水面现象,而低浓度水平作用下仔鱼反应与对照组相比无明显差别。48~72 h内,高浓度组仔鱼游动速度明显减缓,大部分出现沉底现象,失去平衡性,不能正常摆尾,体表黏液增多,体色加深;低浓度组仔鱼游动不规律。96 h时,高浓度组大部分仔鱼失去生命体征,体表有半透明胶状物覆盖,眼睛、嘴巴及尾部有出血现象。对比陈万光等[19]对高体鳑鲏(Rhodeus ocellatus)幼鱼的急性毒性研究,高体鳑鲏幼鱼受Cu2+、Pb2+的毒性影响反应与绿鳍马面鲀仔鱼中毒反应有相似之处。
24 h时,0.03 mg·L-1 Cu2+组和2 mg·L-1 Cd2+组仔鱼存活率为100%,0.18 mg·L-1 Cu2+组和8 mg·L-1 Cd2+组仔鱼活率分别降低至50%、60%左右;72 h时,0.18 mg·L-1 Cu2+组和8 mg·L-1 Cd2+组仔鱼存活率均为0。说明随时间的延长及浓度的增加,Cu2+、Cd2+毒性作用不断增强,这与叶素兰和余治平[20]研究发现鳙(Aristichthys nobilis)仔鱼存活率受Cu2+、Pb2+、Cd2+和Cr6+ 4种重金属影响均呈下降趋势一致。
3.3 Cu、Cd对初孵仔鱼的安全浓度
Cu2+、Cd2+对初孵仔鱼72 h-LC50分别为0.063 mg·L-1和3.589 mg·L-1,安全浓度分别为0.006 mg·L-1和0.359 mg·L-1,可知Cd2+的毒性浓度约为Cu2+的60倍。重金属毒性大小因物种及发育阶段不同而不同,如Cu2+对七带石斑鱼(Epinephelus septemfasciatus)初孵仔鱼的安全浓度为0.0055 mg·L-1 [21],低于绿鳍马面鲀初孵仔鱼的安全浓度0.006 mg·L-1;Cu2+、Cd2+对澳洲龙纹斑(Maccullochella peelii)幼鱼的安全浓度分别为0.1223 mg·L-1和0.0200 mg·L-1,急性毒性大小为Cd2+>Cu2+ [22]。而陈国柱和方展强[23]等研究的Cu2+、Zn2+和Cd2+对唐鱼(Tanichthy albonubes)初孵仔鱼的安全浓度分别为0.0986、0.9116和1.9654 mg·L-1,急性毒性大小依次为Cu2+>Zn2+>Cd2+,均高于Cu2+、Cd2+对绿鳍马面鲀初孵仔鱼安全浓度;Cu2+、Cd2+对牙鲆(Paralichthys olivaceus)初孵仔鱼安全浓度分别为0.007 mg·L-1和0.038 mg·L-1,急性毒性大小为Cu2+>Cd2+[24];Cu2+、Cd2+对史氏鲟(Acipenser schrenckii)稚鱼安全浓度分别为0.0038 mg·L-1和0.0282 mg·L-1,毒性大小顺序为Cu2+>Cd2+[25],均明显小于绿鳍马面鲀初孵仔鱼安全浓度,但上述研究中Cu2+、Cd2+毒性大小顺序均与文章一致。Cu2+对绿鳍马面鲀初孵仔鱼安全浓度0.006 mg·L-1,比中国渔业水质标准[26]中海水中的Cu2+的最高允许浓度(0.01 mg·L-1)低,说明其对Cu2+的敏感度相对较高,对水质要求偏高。
[1] 龙萌, 王振华, 陈浩, 等. 水环境中镉对鱼类的毒理效应研究进展[J]. 水生态学杂志, 2022, 43(2): 142-150
Long M, Wang Z H, Chen H, et al. Research progress on the toxicity of cadmium to fish [J]. Journal of Hydroecology, 2022, 43(2): 142-150 (in Chinese)
[2] 涂杰峰, 罗钦, 伍云卿, 等. 福建水产饲料重金属污染研究[J]. 中国农学通报, 2011, 27(29): 76-79
Tu J F, Luo Q, Wu Y Q, et al. The study on the heavy metal pollution of aquatic feed in Fujian [J]. Chinese Agricultural Science Bulletin, 2011, 27(29): 76-79 (in Chinese)
[3] 杨志艳, 薛雅芳, 徐永健. 4种重金属离子对海水青鳉胚胎发育及仔鱼的急性毒性研究[J]. 宁波大学学报(理工版), 2021, 34(5): 9-15
Yang Z Y, Xue Y F, Xu Y J. Effects of four heavy metal ions on embryonic development and larval growth of Oryzias melastigma [J]. Journal of Ningbo University (Natural Science &Engineering Edition), 2021, 34(5): 9-15 (in Chinese)
[4] 宋维彦, 解相林. 重金属离子对麦穗鱼的急性毒性作用研究[J]. 江苏农业科学, 2010, 38(1): 239-241
[5] 龙昱, 罗永巨, 肖俊, 等. 重金属胁迫对鱼类影响的研究进展[J]. 南方农业学报, 2016, 47(9): 1608-1614
Long Y, Luo Y J, Xiao J, et al. Research advances in effects of heavy metals stress on fish [J]. Journal of Southern Agriculture, 2016, 47(9): 1608-1614 (in Chinese)
[6] 秦华伟, 刘爱英, 谷伟丽, 等. 6种重金属对3种海水养殖生物的急性毒性效应[J]. 生态毒理学报, 2015, 10(6): 287-296
Qin H W, Liu A Y, Gu W L, et al. Acute toxicity of six heavy metals on three aquaculture organisms [J]. Asian Journal of Ecotoxicology, 2015, 10(6): 287-296 (in Chinese)
[7] 陈丕茂, 詹秉义. 绿鳍马面鲀年龄生长与合理利用[J]. 中国水产科学, 2000, 7(1): 35-40
Chen P M, Zhan B Y. Age and growth of Thamnaconus septentrionalis and rational exploitation [J]. Journal of Fishery Sciences of China, 2000, 7(1): 35-40 (in Chinese)
[8] 国家质量监督检验检疫总局, 中国国家标准化管理委员会. 化学品 鱼类急性毒性试验: GB/T 27861—2011[S]. 北京: 中国标准出版社, 2012
[9] 蔡文超, 区又君. 重金属离子铜对鱼类早期发育阶段的毒性[J]. 南方水产, 2009, 5(5): 75-79
Cai W C, Ou Y J. Toxicity of Cu2+ to fish during early developmental stages: A review [J]. South China Fisheries Science, 2009, 5(5): 75-79 (in Chinese)
[10] 陈罗明, 凌去非. 3种重金属离子和2种杀虫剂对梭鲈胚胎发育的影响[J]. 水生态学杂志, 2008, 29(5): 109-111
Chen L M, Ling Q F. Effects of three heavy metals and two disinfectors on embryonic development of pikeperch (Lucioperca lucioperca L.) [J]. Journal of Hydroecology, 2008, 29(5): 109-111 (in Chinese)
[11] 罗其勇, 谢小军. 水体铅对胚胎-仔鱼期南方鲇的氧化应答及神经毒性作用[J]. 淡水渔业, 2018, 48(1): 97-105
Luo Q Y, Xie X J. The effect of waterborne lead on antioxidative responses stress in tissue and neurotoxic in brain on embryonic and larval development of Silurus meridionalis Chen [J]. Freshwater Fisheries, 2018, 48(1): 97-105 (in Chinese)
[12] Lugowska K, Jezierska B. Effect of copper and lead on common carp embryos and larvae at two temperatures [J]. Folia Universitatis Agriculturae Stetinensis Piscaria, 2000, 26: 29-38
[13] Von Westernhagen H. Incubation of garpike eggs (Belone belone Linne) under controlled temperature and salinity conditions [J]. Journal of the Marine Biological Association of the United Kingdom, 1974, 54(3): 625-634
[14] Witeska M, Sarnowski P,  ugowska K, et al. The effects of cadmium and copper on embryonic and larval development of IDE Leuciscus idus L. [J]. Fish Physiology and Biochemistry, 2014, 40(1): 151-163
ugowska K, et al. The effects of cadmium and copper on embryonic and larval development of IDE Leuciscus idus L. [J]. Fish Physiology and Biochemistry, 2014, 40(1): 151-163
[15] 陈玉翠, 陈锦云. 重金属Cu2+、Cd2+、Hg2+对斑马鱼胚胎发育的毒性效应[J]. 南方水产科学, 2016, 12(3): 35-42
Chen Y C, Chen J Y. Toxic effect of heavy metal ions of Cu2+, Cd2+ and Hg2+ on embryo development of zebrafish(Danio rerio) [J]. South China Fisheries Science, 2016, 12(3): 35-42 (in Chinese)
[16] 柳学周, 徐永江, 兰功刚. 几种重金属离子对半滑舌鳎胚胎发育和仔稚鱼的毒性效应[J]. 海洋水产研究, 2006, 27(2): 33-42
Liu X Z, Xu Y J, Lan G G. Toxic effects of several heavy metals on the embryos, larvae of Cynoglossus semilaevis Günther [J]. Marine Fisheries Research, 2006, 27(2): 33-42 (in Chinese)
[17] 柳敏海, 陈波, 罗海忠, 等. 五种重金属对早繁鮸鱼胚胎和仔鱼的毒性效应[J]. 海洋渔业, 2007, 29(1): 57-62
Liu M H, Chen B, Luo H Z, et al. Toxic effects of five heavy metals on the embryos and larvae of Miichthys miiuy Basilewsky during early developing stages [J]. Marine Fisheries, 2007, 29(1): 57-62 (in Chinese)
[18] Osman A G M, Wuertz S, Mekkawy I A, et al. Lead induced malformations in embryos of the African catfish Clarias gariepinus (Burchell, 1822) [J]. Environmental Toxicology, 2007, 22(4): 375-389
[19] 陈万光, 屈菊平, 邓平平, 等. Cu2+、Pb2+对高体鳑鮍幼鱼的急性毒性研究[J]. 江苏农业科学, 2010, 38(4): 243-244
[20] 叶素兰, 余治平. Cu2+、Pb2+、Cd2+、Cr6+对鳙胚胎和仔鱼的急性致毒效应[J]. 水产科学, 2009, 28(5): 263-267
Ye S L, Yu Z P. Acute toxicity of Cu2+, Pb2+, Cd2+ and Cr6+ to embryos and larvae of bighead carp Aristichthys nobilis [J]. Fisheries Science, 2009, 28(5): 263-267 (in Chinese)
[21] 孔祥迪, 陈超, 李炎璐, 等. Cu2+、Zn2+、Pb2+对七带石斑鱼(Epinephelus septemfasciatus)胚胎和初孵仔鱼的毒性效应[J]. 渔业科学进展, 2014, 35(5): 115-121
Kong X D, Chen C, Li Y L, et al. The toxic effects of Cu2+, Zn2+, and Pb2+ on the embryos and larvae of Epinephelus septemfasciatus [J]. Progress in Fishery Sciences, 2014, 35(5): 115-121 (in Chinese)
[22] 罗土炎, 罗钦, 饶秋华, 等. 重金属离子与消毒药物对澳洲龙纹斑幼鱼的急性毒性[J]. 福建农业学报, 2017, 32(7): 691-696
Luo T Y, Luo Q, Rao Q H, et al. Acute toxicities of disinfectants and metal ions on juvenile Murray cod, Maccullochella peelii peelii [J]. Fujian Journal of Agricultural Sciences, 2017, 32(7): 691-696 (in Chinese)
[23] 陈国柱, 方展强. 铜、锌、镉对唐鱼胚胎及初孵仔鱼的急性毒性及安全浓度评价[J]. 生物学杂志, 2011, 28(2): 28-31
Chen G Z, Fang Z Q. Safety assessment and acute toxicity of copper, zinc and cadmium to the embryo and larval fish of Tanichthys albonubes [J]. Journal of Biology, 2011, 28(2): 28-31 (in Chinese)
[24] 吴玉霖, 赵鸿儒, 侯兰英. 重金属对牙鲆胚胎和仔鱼的影响[J]. 海洋与湖沼, 1990, 21(4): 386-392, 400
Wu Y L, Zhao H R, Hou L Y. Effects of heavy metals on embryos and larvae of flat fish Paralichthys olivaceus [J]. Oceanologia et Limnologia Sinica, 1990, 21(4): 386-392, 400 (in Chinese)
[25] 罗钦, 李正鸿, 饶秋华, 等. 四种重金属离子对史氏鲟稚鱼的急性毒性[J]. 山地农业生物学报, 2014, 33(6): 28-32, 41
Luo Q, Li Z H, Rao Q H, et al. Study on acute toxicity test of four heavy metal ions to the juvenile Acipenser schrenckii fish [J]. Journal of Mountain Agriculture and Biology, 2014, 33(6): 28-32, 41 (in Chinese)
[26] 邱郁春. 水污染鱼类毒性实验方法[M]. 北京: 中国环境科学出版社, 1992: 171-172