桃力庙-阿拉善湾海子(桃-阿海子)位于鄂尔多斯高原西部,曾经是一个面积为10 km2的荒漠咸水湖泊。在20世纪90年代,该区域承载了最大的遗鸥(Larus relictus)繁殖群与迁徙水鸟,于是被认定为第1148号国际重要湿地。但随后由于严重的人为干扰以及干旱少雨,桃-阿海子日渐干涸,随后遗鸥繁殖群放弃该繁殖地,迁徙水鸟也彻底消失[1]。为恢复该重要湿地的生态环境,以待遗鸥再次回归,当地政府于2018年5月正式启动引黄工程,向桃-阿海子注水[2]。到2019年4月,遗鸥繁殖群再次回归此地,使得桃-阿海子恢复了生机蓬勃之象[2]。
引黄工程所引的水源为中天合创和银宏煤矿矿井水,短期内,我们看到引黄工程对于该湿地修复及其物种多样性提高具有积极的作用,尤其对于生存其中的鸟类来说,桃-阿海子补充的水源是其赖以生存的生命之源。但是研究表明矿井水中含有大量重金属污染物[3],长期累积的重金属污染,由于其固有的毒性和生物累积性,会对生物体造成严重危害。同时,水环境中的微生物对于生存其中的动物同样具有重要影响。水源安全是保障饮水安全的重要环节,当水源水中存在病原微生物时可能通过饮水进入动物体[4],导致介水传染病暴发[5],可造成灾难性的后果,因此对水源微生物的控制应引起高度重视[6]。且研究表明重金属污染,会严重危害微生物群落的组成结构和代谢功能[7-8],而微生物作为湖泊湿地生态系统的重要组成部分,驱动着湖泊湿地的营养元素循环及重金属等污染物的迁移转化[9-10],所以研究矿井水注入后桃-阿海子微生物群落组成,对于该区域生存的珍稀野生动物保护具有重要意义,同时也为未来湖泊湿地保护和研究提供理论依据。
基于以上研究背景,为了评估引黄工程所引矿井水对桃-阿海子生存的珍稀野生动物的安全性,以及其对湖泊湿地生态系统的影响,本研究采集了引黄工程注水口1(中天合创矿井水)、注水口2(银宏煤矿矿井水)、湖边和湖心岛4个区域的水源样本,通过16S rRNA高通量测序对这4个区域水样浮游细菌多样性进行检测,并对其与水体中重金属元素含量的关联性进行分析,从而为珍稀物种保护提供参考依据,同时为湿地湖泊保护提供基础。
1 材料与方法(Materials and methods)
1.1 研究区域和样本采集
桃-阿海子(东经109°14′~109°23′;北纬39°45′~39°52′)位于鄂尔多斯市东胜区。本研究分别在注水口1(中天合创注水口)、注水口2(银宏煤矿注水口)、湖边和湖心岛4个样点采样(图1)。注水口1(ZSK1)和注水口2(ZSK2)采样时,其中1份样本为矿井水排出的水样,另外2份样本为与排出点间隔50 m所采集的水样,各样点采集3份样本;湖边(HB)样本沿湖周围间隔2 km以上随机选取,共3份样本;湖心岛(HXD)样本在不同湖心岛之间采集水样3份。每个站点使用无菌PET瓶收集10 L水,采样时间为2022年7月。

图1 研究区域及采样点
Fig. 1 Study area and sampling point
所有采集的样品分为2份,一份用于微生物的分子生物学鉴定,另一份用于重金属元素的测定。用于微生物分子生物学鉴定的样本低温保存运回实验室,使用50 mL无菌离心管8 000 g、4 ℃离心10 min收集下层水体及沉淀,并送至百迈客生物公司进行测序。样品中铬(Cr)、铜(Cu)、锰(Mn)、镍(Ni)、铅(Pb)和锌(Zn)等重金属元素的测定参考相关标准进行[11]。
1.2 DNA提取和16S rRNA高通量测序
使用试剂盒Fast DNA SPINKit for soil(Bio101 Inc., USA)提取总DNA,采用微量分光光度计检测DNA浓度。利用引物341F(5’-CCTACGGGNGGCWGCAG-3’)和805R(5’-GACTACHVGGGTATCTAATCC-3’)扩增细菌16S rRNA基因的V3~V4高变区,PCR产物通过2%琼脂糖凝胶电泳检测,并纯化、定量、制备扩增子测序池,通过Illumina Novaseq 6000平台进行测序,详细操作步骤见文献[12],论文所包含的测序原始数据已上传至SRA数据库,数据链接为http://www.ncbi.nlm.nih.gov/bioproject/PRJNA879866。
1.3 数据处理与分析
首先将Illumina Novaseq 6000平台测序得到的原始测序序列进行质控,得到高质量序列,对其以97%的序列同一性聚类为可操作的分类单位(operational taxonomic unit, OUT)。基于OTU分析结果,对样品在各个分类水平上进行分类学分析,获得各样品在门、纲、目、科、属分类学水平上的群落结构图;通过Alpha多样性分析研究单个样品内部的物种多样性,统计各样品的Shannon、Simpson、Chao1及ACE指数,绘制样品稀释曲线和Shannon曲线;通过加权和未加权UniFrac距离的非度量多维尺度分析(non-metric multidimensional scaling, NMDS)制作散点图,分析不同样品微生物群落的Beta多样性,来比较不同样品在微生物多样性方面存在的差异大小;通过组间差异显著性分析在不同组间寻找具有统计学差异的Biomarker;通过冗余分析(redundancy analysis, RDA)进一步判断环境变量对微生物群落的影响;应用Spearman相关性分析水体重金属元素含量与微生物群落组成之间的关联性;具体分析方法见参考文献[12]。
2 结果(Results)
2.1 不同区域重金属含量
不同采样点样本中的重金属指标数值如表1所示。进一步使用Kruskal-Wallis进行检验分析,结果显示,在所有采样点样本中锰(Mn)和铅(Pb)含量不具有显著性差异。铬(Cr)和镍(Ni)在HB和HXD样本中无显著性差异(P>0.05),ZSK1和ZSK2中无显著性差异,但是ZSK(包括ZSK1和ZSK2)和其他样本中具有显著性差异(P<0.05),ZSK样本中含量显著低于其他样本。铜(Cu)含量在HXD样本中显著高于其他采样点样本(P<0.05),而锌(Zn)含量在HXD样本中显著低于其他样本(P<0.05)。
表1 不同采样点样本中的重金属含量
Table 1 Metal concentration in different sampling area (mg·L-1)
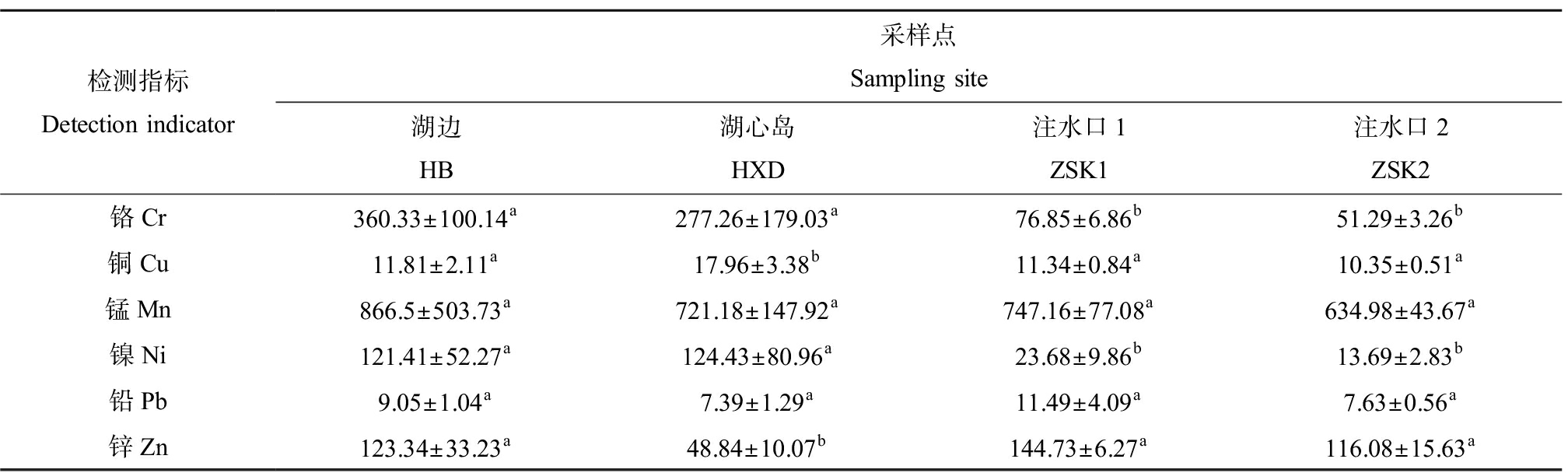
检测指标Detection indicator采样点Sampling site湖边HB湖心岛HXD注水口1ZSK1注水口2ZSK2铬Cr360.33±100.14a277.26±179.03a76.85±6.86b51.29±3.26b铜Cu11.81±2.11a17.96±3.38b11.34±0.84a10.35±0.51a锰Mn866.5±503.73a721.18±147.92a747.16±77.08a634.98±43.67a镍Ni121.41±52.27a124.43±80.96a23.68±9.86b13.69±2.83b铅Pb9.05±1.04a7.39±1.29a11.49±4.09a7.63±0.56a锌Zn123.34±33.23a48.84±10.07b144.73±6.27a116.08±15.63a
注:数据表示为平均值±标准偏差;同一参数内的不同字母表示P≤0.05水平的显著差异。
Note: Data are expressed as mean±standard deviations; different letters within the same parameter indicate significant differences at the P≤0.05 level.
2.2 α多样性分析
对注水口1(ZSK1)、注水口2(ZSK2)、湖边(HB)和湖心岛(HXD)4个区域共12份水样提取基因组DNA,对其16S rRNA V3~V4高变区进行扩增和高通量测序,结果共获得了809 190(63 553~72 242)条有效序列。在97%的序列相似度水平下,总共获得了23 910个OTU,属于55个门,135个纲,397个目,1 009个科和2 296个属。稀疏曲线和Shannon多样性曲线均趋于平缓(图2(a)和2(b)),表明随着测序深度的增加,各样本中微生物多样性不再增加,本次测序数据量合理,可以反映样品中绝大多数的微生物实际情况。通过韦恩图比较不同取样点水样中细菌菌群多样性,如图2(c)所示,在OTU水平上,4个采样点共有的OTU有127个,ZSK1和ZSK2共有的OTU有527个,ZSK1特有OTU有7 233个,ZSK2特有OTU有7 111个,HB特有OTU有3 464个,HXD特有OTU有4 770个。

图2 细菌群落的α多样性分析
注:(a) 细菌群落的稀释曲线;(b) Shannon-Wiener多样性曲线;(c) 细菌群落在OTU水平的韦恩图;(d) Shannon指数;(e) Simpson指数;(f) ACE指数;(g) Chao1指数。
Fig. 2 α diversity analysis of the bacteria community
Note: (a) Rarefaction curves of bacterial community; (b) Shannon-Wiener diversity curves of bacterial community; (c) Venn diagram in OTUs level; (d) Shannon index; (e) Simpson index; (f) ACE index; (g) Chao1 index.
在相同测序深度下,计算Shannon、Simpson、ACE和Chao1指数等α多样性指数分析不同采样点水样中细菌的丰度和多样性。结果如图2(d)~2(g)所示,HXD和HB相比,除了Simpson指数具有显著性差异(P=0.006)外,其他指数均不具有显著性差异(P>0.05);HXD和ZSK2相比,Shannon(P=0.003)和Simpson(P=0.000)指数具有显著性差异,而ACE和Chao1指数不具有显著性差异(P>0.05);HXD和ZSK1相比,Shannon(P=0.000)、Simpson(P=0.000)、ACE(P=0.0038)和Chao1(P=0.0038)指数均具有显著性差异;HB和ZSK2相比,Shannon(P=0.011)、Simpson(P=0.02)、ACE(P=0.023)和Chao1(P=0.023)指数均具有显著性差异;HB和ZSK1相比,Shannon(P=0.002)、Simpson(P=0.007)、ACE(P=0.015)和Chao1(P=0.015)指数均具有显著性差异;ZSK1和ZSK2相比,4个指数均不具有显著性差异(P>0.05)。这表明ZSK1和ZSK2水样的细菌多样性不具有显著性差异,而注水口和其他采样点水样微生物多样性具有显著性差异。
2.3 β多样性分析
通过非加权UniFrac-NMDS和加权UniFrac-NMDS进行各采样点水样微生物的β多样性分析,结果如图3所示,非加权UniFrac-NMDS分析结果显示不同组样本存在聚类趋势,表明其微生物群落组成存在显著性差异(P<0.05)(图3(a)和3(b));加权UniFrac-NMDS分析结果显示ZSK1和ZSK2样本存在聚类趋势,其他组样本单独聚类,表明ZSK1和ZSK2细菌的群落组成相似,而与其他组存在显著性差异(P<0.05)(图3(c)和3(d))。
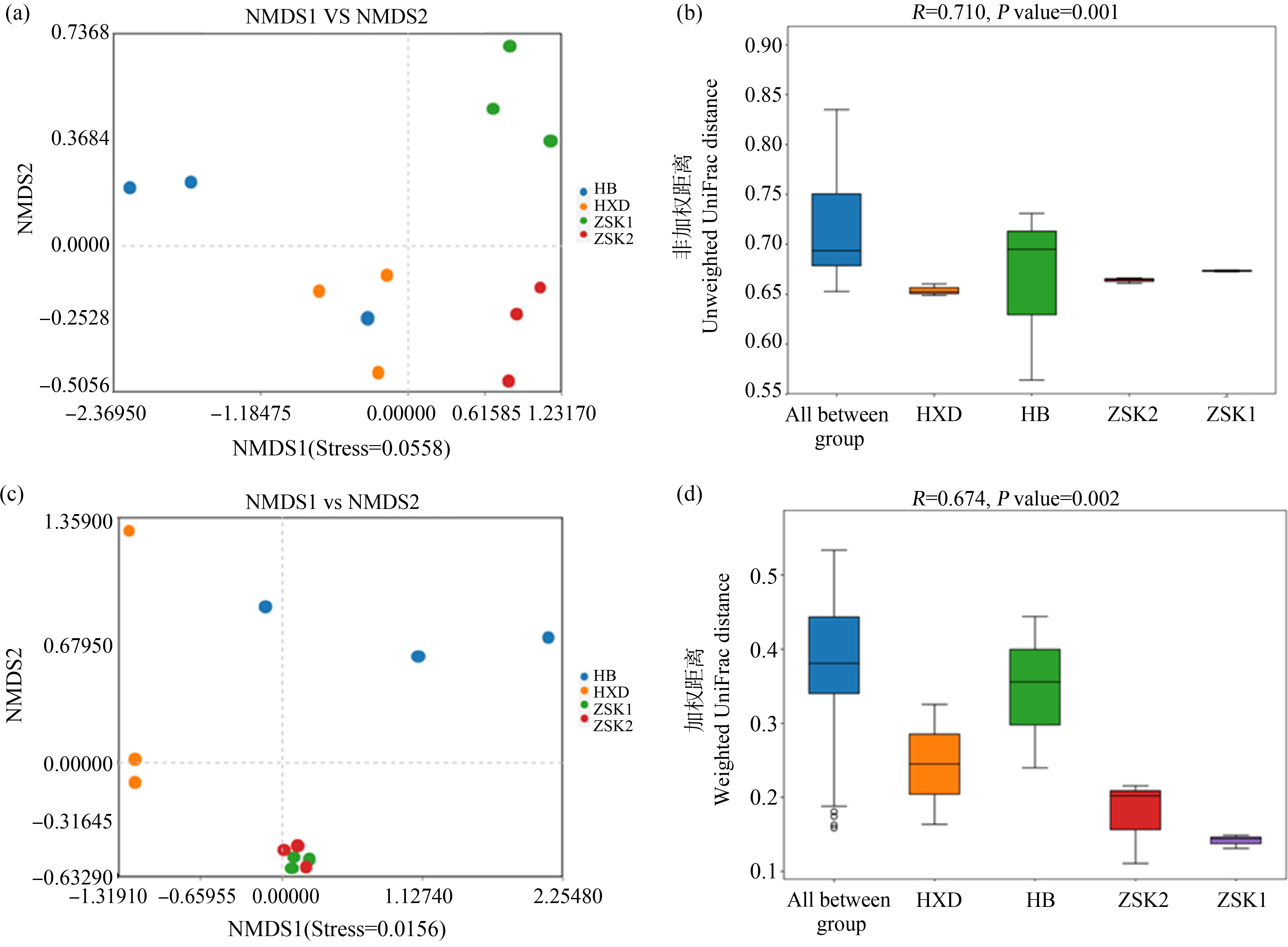
图3 细菌群落的NMDS分析图
注:(a) 非加权NMDS分析;(b) 非加权NMDS相似性检验分析;(c) 加权NMDS分析;(d) 加权NMDS相似性检验分析。
Fig. 3 NMDS analysis of bacterial community
Note: (a) Unweighted UniFrac distance NMDS; (b) Similarity statistics analysis of the unweighted UniFrac distance NMDS; (c) Weighted UniFrac distance NMDS; (d) Similarity statistics analysis of the weighted UniFrac distance NMDS.
2.4 不同采样点水样微生物组成分析
进一步分析了不同区域水样中微生物组成,对丰度>1%的细菌进行聚集信息统计,结果如图4所示,在门水平,各样本共鉴定出55个细菌门,平均相对丰度>1%的细菌门有变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、疣微菌门(Verrucomicrobiota)、放线菌门(Actinobacteria)、unclassified_Bacteria、酸杆菌门(Acidobacteriota)、脱硫菌门(Desulfobacterota)、Cyanobacteria、蓝细菌(Cyanobacteria)、绿弯菌门(Chloroflexi)和一些其他的未知菌门细菌。在这些样本中,有5.46%的细菌未能确定门分类,在HXD样本中丰度最高的细菌门是变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和疣微菌门(Verrucomicrobiota),在其他3个样本中丰度最高的是变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)。
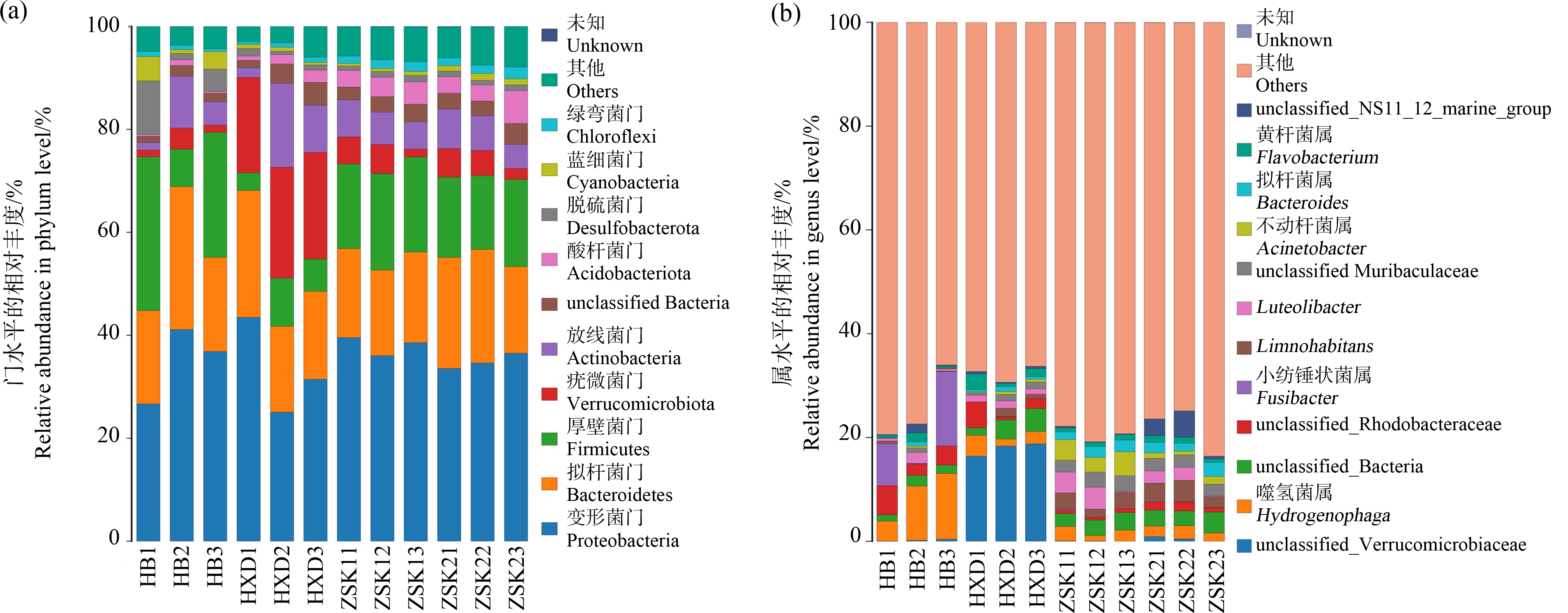
图4 细菌群落在门(a)和属(b)水平物种丰度柱状图
Fig. 4 Bar chart of relative bacterial abundance in phylum (a) and genus (b) level
在属水平,各样本共鉴定出2 296个细菌属,其中平均相对丰度>1%的细菌属有unclassified_Verrucomicrobiaceae、噬氢菌属(Hydrogenophaga)、unclassified_Bacteria、unclassified_Rhodobacteraceae、小纺锤状菌属(Fusibacter)、Limnohabitans、Luteolibacter、unclassified_Muribaculaceae、不动杆菌属(Acinetobacter)、拟杆菌属(Bacteroides)、黄杆菌属(Flavobacterium)、unclassified_NS11_12_marine_group和一些其他未知菌属的细菌。在这些样本中,有74.84%的细菌未能确定属分类,HXD样本中丰度最高的细菌属是unclassified_Verrucomicrobiaceae,HB样本中丰度最高的细菌属是噬氢菌属(Hydrogenophaga),ZSK1样本中丰度最高的细菌属是不动杆菌属(Acinetobacter),ZSK2样本中丰度最高的细菌属是unclassified_Bacteria。
2.5 不同采样点水样微生物LEfSe多级物种差异判别分析
使用LEfSe分析不同采样区域水样之间细菌组成的差异性,结果如图5所示,在门水平,HXD样本中疣微菌门(Verrucomicrobiota)丰度显著高于其他3组,ZSK2样本中酸杆菌门(Acidobacteriota)丰度显著高于其他组(LDA>4.0,P<0.05)。在属水平上,HB样本中的标志细菌属是脱硫微杆菌属(Desulfomicrobium)和丹毒丝菌属(Erysipelothrix);HXD样本中的标志细菌属是uncultured_Flavobacteriales_bacterium和Aquimonas;ZSK1样本中的标志细菌属是不动杆菌属(Acinetobacter)和unclassified_Muribaculaceae;ZSK2样本中的标志细菌属是Limnohabitans(LDA>4.0,P<0.05)。
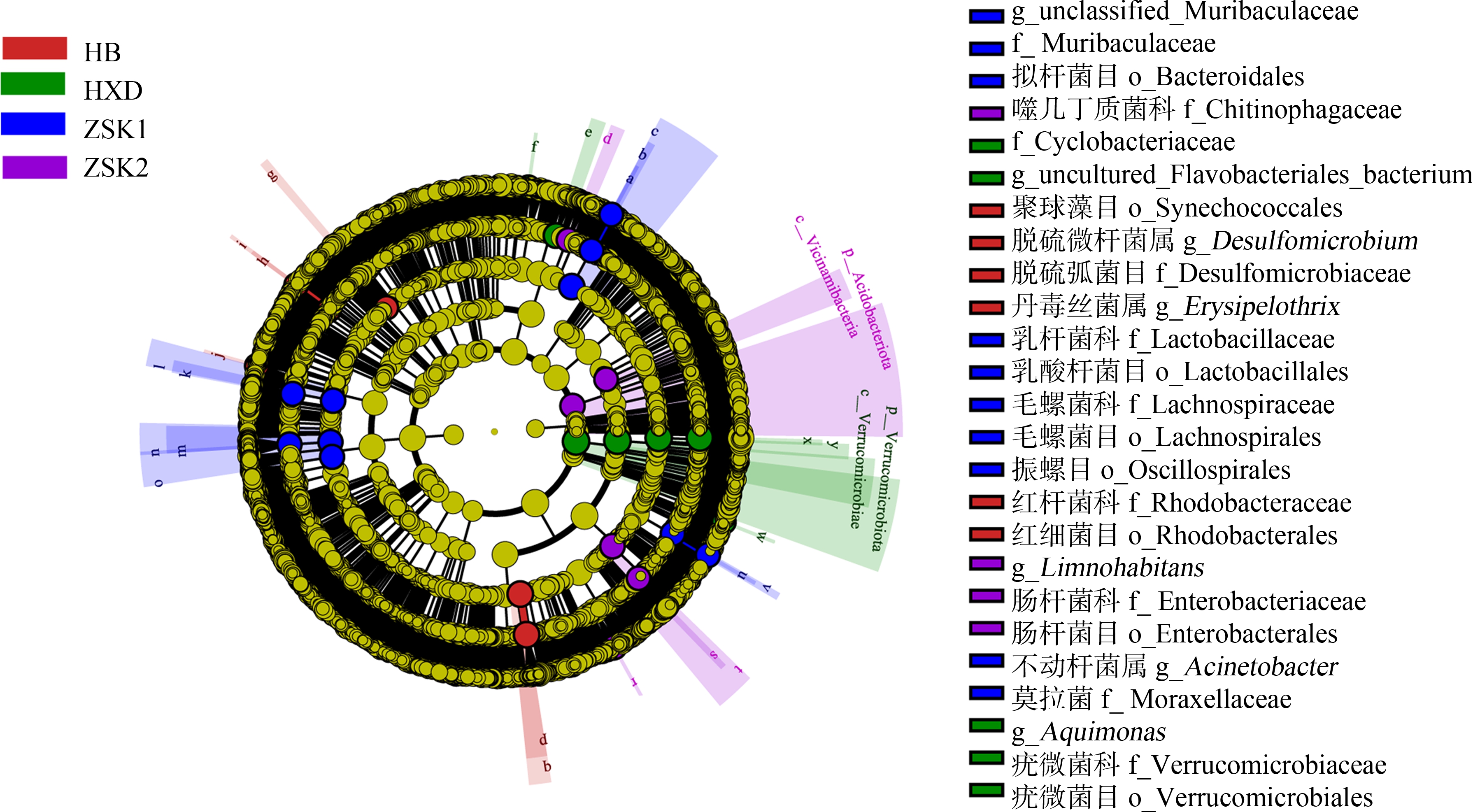
图5 细菌群落组间LEfSe差异分析统计
Fig. 5 Linear discriminant analysis effect size (LEfSe) difference analysis between bacterial community in different sampling site
2.6 重金属富集对微生物群落的影响
如图6(a)所示,RDA分析揭示了重金属指标对不同采样点样本中OTU水平微生物群落结构的影响。环境变量对微生物群落的总解释量为29.27%,显著影响4个采样点微生物群落结构的环境变量依次为Pb(R2=0.64, P=0.026)、Cr(R2=0.60, P=0.022)和Ni(R2=0.48, P=0.048)。基于Spearman分析的热图显示,不同采样点样本中的微生物对重金属含量的响应截然不同(图6(b))。ZSK1样本中的标志细菌属不动杆菌属(Acinetobacter)和unclassified_Muribaculaceae,ZSK2样本中的标志细菌属Limnohabitans和Bacteroides与Cr和Ni呈显著负相关,Bacteroides与Cu也呈显著负相关;unclassified_Verrucomicrobiaceae与Cu呈显著正相关,与Zn呈显著负相关;Flavobacterium与Mn呈显著负相关。进一步通过线性回归分析这些显著相关的重金属与菌群丰度之间的关系,结果如图7所示,Cr和Ni对Bacteroides丰度的解释度分别为56.07%和47.01%(P<0.05),Cr和Ni对Limnohabitans丰度的解释度分别为60.92%和51.80%(P<0.05),Cr和Ni对unclassified_Muribaculaceae丰度的解释度分别为49.99%和38.53%(P<0.05),Zn和Cu对unclassified_Verrucomicrobiaceae丰度的解释度分别为76.76%和76.84%(P<0.05)(图7(a)~7(h))。其他重金属对细菌丰度的解释度模型不成立(P>0.05)。
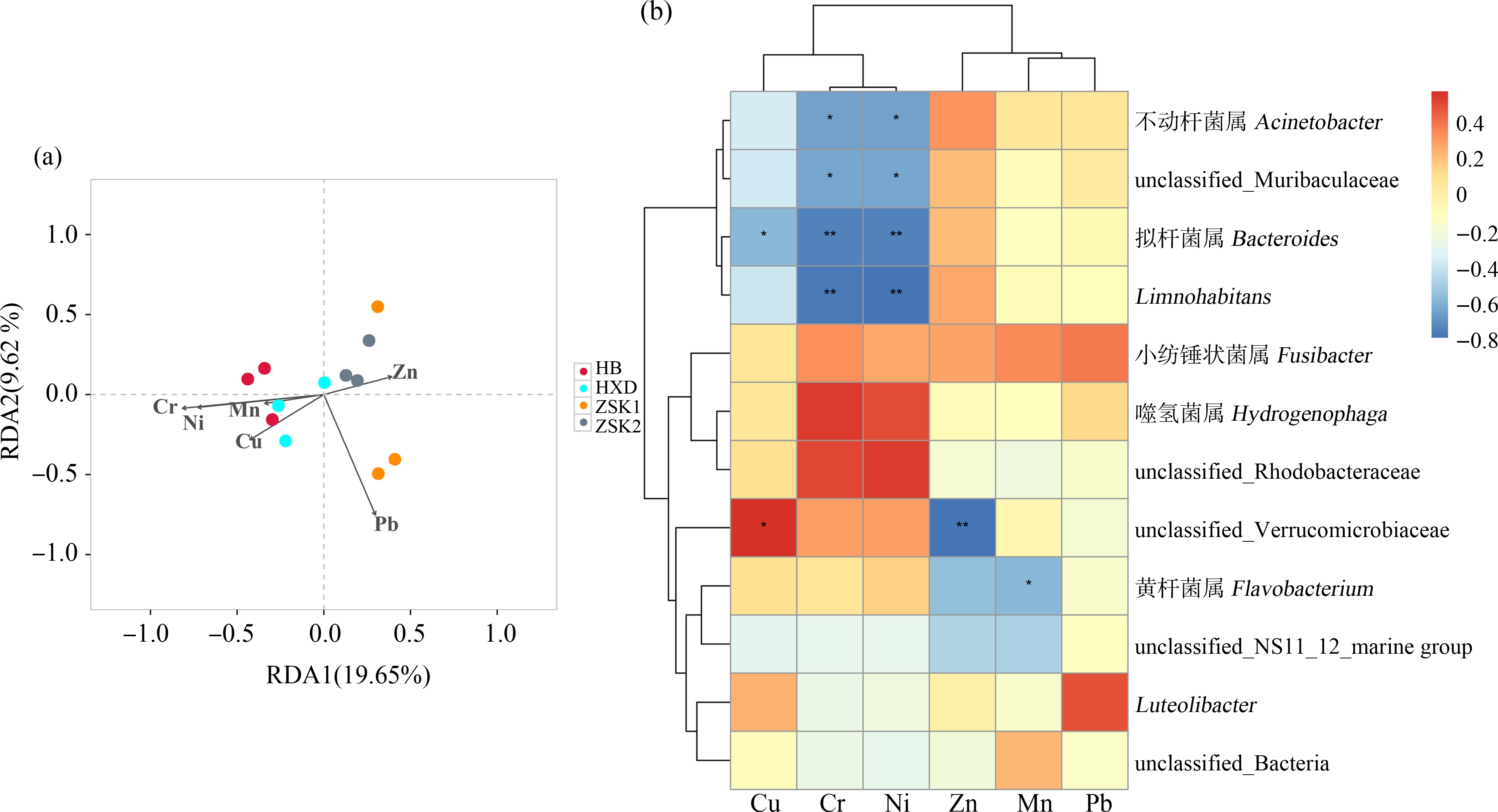
图6 重金属元素对微生物群落的影响
注:(a) RDA分析揭示重金属元素对OTU水平微生物群落结构的影响;(b) 不同采样点样本中丰度>1%的微生物与重金属元素的相关性热图;*P<0.05、**P<0.01。
Fig. 6 Effects of heavy metal elements on microbial communities
Note: (a) RDA analysis revealing the effects of heavy metal elements on microbial communities at the OTU level; (b) Heatmap displaying the correlations between microbial genera with higher abundance (>1%) and heavy metal elements in the water; *P<0.05, **P<0.01.

图7 重金属元素对微生物丰度影响的回归分析
注:(a) Cr对Bacteroides丰度影响的线性回归分析;(b) Ni对Bacteroides丰度影响的线性回归分析;(c) Cr对Limnohabitans丰度影响的线性回归分析;(d) Ni对Limnohabitans丰度影响的线性回归分析;(e) Cr对unclassified_Muribaculaceae丰度影响的线性回归分析;(f) Ni对unclassified_Muribaculaceae丰度影响的线性回归分析;(g) Zn对unclassified_Verrucomicrobiaceae丰度影响的线性回归分析;(h) Cu对unclassified_Verrucomicrobiaceae丰度影响的线性回归分析。
Fig. 7 Regression analysis of the effects of heavy metals on microbial abundance
Note: (a) Regression analysis of the effects of Cr to Bacteroides; (b) Regression analysis of the effects of Ni to Bacteroides; (c) Regression analysis of the effects of Cr to Limnohabitans; (d) Regression analysis of the effects of Ni to Limnohabitans; (e) Regression analysis of the effects of Cr to unclassified_Muribaculaceae; (f) Regression analysis of the effects of Ni to unclassified_Muribaculaceae; (g) Regression analysis of the effects of Zn to unclassified_Verrucomicrobiaceae; (h) Regression analysis of the effects of Cu to unclassified_Verrucomicrobiaceae.
3 讨论(Discussion)
桃-阿海子是一个位于鄂尔多斯高原的咸水湖,气候和环境变化日益加剧的背景下,其微生物群落结构与功能稳定性所受影响对预测湖泊生态系统响应气候和环境变化具有十分重要的意义。且桃-阿海子承载着达6 000~7 000只野生珍稀鸟类,更是国家一级保护动物遗鸥的重要繁殖地,而水源安全对于生存其中的珍稀鸟类具有重要意义,所以对桃-阿海子浮游微生物多样性进行分析对于珍稀野生动物保护及湖泊湿地保护具有重要意义。
本研究通过16S rRNA高通量测序的方法分析了引黄工程注水口1(中天合创矿井水)、注水口2(银宏煤矿矿井水)、湖边和湖心岛4个区域的水样样本中浮游微生物的多样性,结果显示注水口1和注水口2水样样本中微生物多样性不存在显著差异,湖边和湖心岛水样样本中微生物多样性不存在显著差异,而注水口、湖边和湖心岛样本中微生物多样性存在显著差异,表明不同注水口水样虽然来源于不同的矿井水,但其微生物群落多样性差异不大。湖边和湖心岛是鸟类主要的活动区域,这2个区域水样中浮游微生物多样性差异不大。注水口微生物多样性显著大于湖边和湖心岛,这可能是由于鸟类活动干扰导致湖边和湖心岛微生物群落多样性下降[13]。同时,桃-阿海子现有水源,均为引黄工程所注入的矿井水,矿井水多数存在重金属含量超标的情况[14],而重金属元素富集也会降低微生物群落多样性[15-16]。通过对不同样本中重金属元素含量的检测,结果表明铬(Cr)和镍(Ni)在注水口样本中显著低于湖边和湖心岛样本,表明矿井水流入海子时其重金属富集会逐渐增加,导致湖边和湖心岛微生物多样性显著下降。
对微生物群落组成分析发现,各样本共鉴定出55个细菌门,相对丰度最高的细菌门有变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、疣微菌门(Verrucomicrobiota)和放线菌门(Actinobacteria)。桃-阿海子水样中鉴定出的浮游细菌群落组成与之前研究的千岛湖[17]、洞庭湖[18]、鄱阳湖[19]、太湖[20]和滇池[21]等淡水湖泊及长江[22]等河流以及海洋[23]等水体的细菌组成类群相似,研究表明这些细菌在水生生态系统生物地球化学循环过程中起到重要作用[24-25]。在所有采样点样本中变形菌门(Proteobacteria)丰度高于拟杆菌门(Bacteroidetes),表明该区域水样污染不严重[26]。在HXD样本中丰度最高的细菌门是变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和疣微菌门(Verrucomicrobiota),在其他3个样本中丰度最高的是变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes),疣微菌门细菌是一类适应性很强的细菌,可以参与多种物质循环,全面参与甲烷循环,影响着元素循环的动态平衡,具有重要的生态价值[27]。而其他样本中厚壁菌门相对丰度较高,可能是由于其含氧量低,还原条件更显著,因此厌氧的厚壁菌门相对丰度升高[28]。在属水平,各样本共鉴定出2 296个细菌属,有74.84%的细菌未能确定属分类,表明该湖泊中存在着大量的未知微生物,有必要进一步通过宏基因组技术进行分析。其中HB样本中丰度最高的细菌属是噬氢菌属(Hydrogenophaga),其对重金属具有一定适应性,是潜在的重金属耐受菌[29],也间接表明该区域重金属污染较其他区域更为严重,和重金属检测结果相一致。ZSK1样本中丰度最高的细菌属是不动杆菌属(Acinetobacter),是一类潜在致病菌[30],ZSK2样本中丰度最高的细菌属是一类unclassified_Bacteria。
生态系统中微生物会和重金属之间发生协同作用或拮抗作用,不同物种可能以不同的方式来应对重金属污染,表明微生物群落对重金属污染的多样化响应策略[31-32]。本研究结果显示在桃-阿海子水样中,显著影响4个采样点微生物群落结构的环境变量依次为Pb、Cr和Ni。ZSK1和ZSK2中标志细菌多与Cr和Ni呈显著负相关;HXD样本中unclassified_Verrucomicrobiaceae与Cu呈显著正相关,与Zn呈显著负相关,Flavobacterium与Mn呈显著负相关。在HB和HXD样本中耐受重金属的细菌丰度高一些,而在ZSK样本中其丰度较低,这与重金属元素含量检测结果相一致,表明重金属富集会驱动水体中微生物群落构建。
综上所述,本研究通过16S rRNA高通量测序的方法分析了鄂尔多斯遗鸥国家级自然保护区桃-阿海子引黄工程注水口1(中天合创矿井水)、注水口2(银宏煤矿矿井水)、湖边和湖心岛4个区域的水样样本中浮游微生物的多样性,结果显示注水口1和注水口2水样样本中微生物多样性不存在显著差异,湖边和湖心岛水样样本中微生物多样性不存在显著差异,而注水口和湖边以及湖心岛样本中微生物多样性存在显著差异;微生物的β多样性分析显示各组内样本微生物组成相似,ZSK1和ZSK2细菌的群落组成相似,而与其他组存在显著性差异。微生物群落组成分析发现这几个区域的主要细菌门是变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、疣微菌门(Verrucomicrobiota)和放线菌门(Actinobacteria),在属水平存在着大量的未知微生物。该区域不同采样点水样中重金属元素含量存在差异,并驱动了微生物群落的构建过程,显著影响4个采样点微生物群落结构的环境变量依次为Pb、Cr和Ni。在HB和HXD样本中耐受重金属的细菌丰度高一些,而在ZSK样本中其丰度较低。该结果对于评估和预测重金属污染等人为活动对微生物群落的影响具有重要意义,并将为鄂尔多斯遗鸥国家级自然保护区桃-阿海子生态环境管理和污染防治提供重要参考,同时为珍稀野生动物保护提供依据。
[1] 何芬奇, 郭玉民, 陈克林, 等. 初论内蒙古泊江海子矿持续补水对桃—阿海子生境恢复之效益[J]. 湿地科学与管理, 2018, 14(1): 29-32
He F Q, Guo Y M, Chen K L, et al. A preliminary assessment of the effect of continual water supply in Bojianghaizi coal mine on habitat restoration in T-A Nur wetland [J]. Wetland Science &Management, 2018, 14(1): 29-32 (in Chinese)
[2] 何芬奇, 邢小军, 肖红, 等. 初论引黄工程对桃-阿海子湿地生境恢复的作用与影响——兼谈泊江海子采矿区地表沉降成塘的例示[J]. 湿地科学与管理, 2019, 15(2): 36-38
He F Q, Xing X J, Xiao H, et al. Primary assessing on the effect of water introducing effort from the Yellow River to the T-A Nur for its wetland habitat recovering—With the case the ecological effect of the nearby mining subsidence surface-ponding [J]. Wetland Science &Management, 2019, 15(2): 36-38 (in Chinese)
[3] McDevitt B, Cavazza M, Beam R, et al. Maximum removal efficiency of barium, strontium, radium, and sulfate with optimum AMD-marcellus flowback mixing ratios for beneficial use in the northern Appalachian Basin [J]. Environmental Science &Technology, 2020, 54(8): 4829-4839
[4] Leclerc H, Schwartzbrod L, Dei-Cas E. Microbial agents associated with waterborne diseases [J]. Critical Reviews in Microbiology, 2002, 28(4): 371-409
[5] 曲良娇. 某省饮用水微生物安全状况与风险评估[D]. 武汉: 华中科技大学, 2016: 8
Qu L J. The safety status and risk assessment of microorganisms in the drinking water in a province [D]. Wuhan: Huazhong University of Science and Technology, 2016: 8 (in Chinese)
[6] Pruss A, Havelaar A H. The global burden of disease study and applications in water, sanitation and hygiene [R]. London: International Water Association, 2001: 43-59
[7] Pal A, Bhattacharjee S, Saha J, et al. Bacterial survival strategies and responses under heavy metal stress: A comprehensive overview [J]. Critical Reviews in Microbiology, 2022, 48(3): 327-355
[8] Zhang H, Wan Z W, Ding M J, et al. Inherent bacterial community response to multiple heavy metals in sediment from river-lake systems in the Poyang Lake, China [J]. Ecotoxicology and Environmental Safety, 2018, 165: 314-324
[9] Ou Y, Rousseau A N, Wang L X, et al. Identification of the alteration of riparian wetland on soil properties, enzyme activities and microbial communities following extreme flooding [J]. Geoderma, 2019, 337: 825-833
[10] Moghimian N, Hosseini S M, Kooch Y, et al. Impacts of changes in land use/cover on soil microbial and enzyme activities [J]. Catena, 2017, 157: 407-414
[11] Wang J W, Liu T, Sun W L, et al. Bioavailable metal(loid)s and physicochemical features co-mediating microbial communities at combined metal(loid) pollution sites [J]. Chemosphere, 2020, 260: 127619
[12] Gao L, Liu L, Du C, et al. Comparative analysis of fecal bacterial microbiota of six bird species [J]. Frontiers in Veterinary Science, 2021, 8: 791287
[13] 郭娜, 孙丽娜, 孟越, 等. 辽河保护区河岸带土壤微生物群落结构特征[J]. 沈阳大学学报(自然科学版), 2016, 28(6): 457-463
Guo N, Sun L N, Meng Y, et al. Soil microbial community structure characteristics of riparian zone in Liaohe River conservation area [J]. Journal of Shenyang University (Natural Science), 2016, 28(6): 457-463 (in Chinese)
[14] 王甜甜, 靳德武, 杨建. 内蒙古某矿矿井水重金属污染特征及来源分析[J]. 煤田地质与勘探, 2021, 49(5): 45-51
Wang T T, Jin D W, Yang J. Heavy metal pollution characteristics and source analysis of water drainage from a mine in Inner Mongolia [J]. Coal Geology &Exploration, 2021, 49(5): 45-51 (in Chinese)
[15] 何一凡, 肖新宗, 王佳文. 重金属污染对不同生境中微生物群落结构的影响[J]. 环境科学, 2023, 44(4): 2103-2112
He Y F, Xiao X Z, Wang J W. Effects of heavy metal pollution on the structure of microbial communities in different habitats [J]. Environmental Science, 2023, 44(4): 2103-2112 (in Chinese)
[16] Li P, Wang Y H, Dai X Y, et al. Microbial community in high arsenic shallow groundwater aquifers in Hetao Basin of Inner Mongolia, China [J]. PLoS One, 2015, 10(5): e0125844
[17] 胡月, 胡东, 于鑫, 等. 千岛湖水源水微生物安全性评价[J]. 环境科学学报, 2021, 41(2): 634-640
Hu Y, Hu D, Yu X, et al. Evaluation for source water biosafety in Qiandao Lake, China [J]. Acta Scientiae Circumstantiae, 2021, 41(2): 634-640 (in Chinese)
[18] Dai J, Wu H P, Zhang C, et al. Responses of soil microbial biomass and bacterial community structure to closed-off management (an ecological natural restoration measures): A case study of Dongting Lake wetland, middle China [J]. Journal of Bioscience and Bioengineering, 2016, 122(3): 345-350
[19] 刘亚军, 刘欣, 牟晓真, 等. 大型浅水湖泊鄱阳湖湿地微生物的研究现状[J]. 微生物学通报, 2019, 46(12): 3453-3460
Liu Y J, Liu X, Mou X Z, et al. Research status of microorganisms in a large, shallow Lake Poyang Lake wetland [J]. Microbiology China, 2019, 46(12): 3453-3460 (in Chinese)
[20] Wu H N, Li Y, Zhang J, et al. Sediment bacterial communities in a eutrophic lake influenced by multiple inflow-rivers [J]. Environmental Science and Pollution Research International, 2017, 24(24): 19795-19806
[21] Dai Y, Yang Y Y, Wu Z, et al. Spatiotemporal variation of planktonic and sediment bacterial assemblages in two plateau freshwater lakes at different trophic status [J]. Applied Microbiology and Biotechnology, 2016, 100(9): 4161-4175
[22] Huang W, Jiang X. Profiling of sediment microbial community in Dongting Lake before and after impoundment of the Three Gorges Dam [J]. International Journal of Environmental Research and Public Health, 2016, 13(6): 617
[23] 刘明华, 王健鑫, 俞凯成, 等. 东海陆架表层沉积物细菌群落结构及地理分布研究[J]. 海洋与湖沼, 2015, 46(5): 1119-1131
Liu M H, Wang J X, Yu K C, et al. Community structure and geographical distribution of bacterial on surface layer sediments in the East China Sea [J]. Oceanologia et Limnologia Sinica, 2015, 46(5): 1119-1131 (in Chinese)
[24] 牛凤霞, 吉芳英, 赵艮, 等. 龙景湖沉积物的细菌群落垂向分布特征[J]. 中国环境科学, 2017, 37(6): 2322-2331
Niu F X, Ji F Y, Zhao G, et al. Vertical distribution of bacterial communities in sediments of Longjing Lake [J]. China Environmental Science, 2017, 37(6): 2322-2331 (in Chinese)
[25] Inagaki F, Nunoura T, Nakagawa S, et al. Biogeographical distribution and diversity of microbes in methane hydrate-bearing deep marine sediments on the Pacific Ocean Margin [J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(8): 2815-2820
[26] Zou H Y, He L Y, Gao F Z, et al. Antibiotic resistance genes in surface water and groundwater from mining affected environments [J]. The Science of the Total Environment, 2021, 772: 145516
[27] 冯希. 海洋疣微菌的分离、鉴定及疣微菌门分类体系整理[D]. 济南: 山东大学, 2021: 3
Feng X. Isolation, polyphasic taxonomy of marine strains of Verrucomicrobia and updation the classification system of Verrucomicrobia [D]. Jinan: Shandong University, 2021: 3 (in Chinese)
[28] Mayer F, Müller V. Adaptations of anaerobic archaea to life under extreme energy limitation [J]. FEMS Microbiology Reviews, 2014, 38(3): 449-472
[29] 刘幸春, 王洪杰, 王亚利, 等. 府河水体及沉积物细菌群落结构分布特征及其影响因素[J]. 生态毒理学报, 2021, 16(5): 120-135
Liu X C, Wang H J, Wang Y L, et al. Distribution characteristics and influencing factors of bacteria community structure in water and sediments of Fuhe River [J]. Asian Journal of Ecotoxicology, 2021, 16(5): 120-135 (in Chinese)
[30] 翟盼盼, 吴宇骞, 陆坚. 不动杆菌属分类的研究进展[J]. 新发传染病电子杂志, 2020, 5(1): 51-55, 59
Zhai P P, Wu Y Q, Lu J. Progress of study on acinetobacter classification [J]. Electronic Journal of Emerging Infectious Diseases, 2020, 5(1): 51-55, 59 (in Chinese)
[31] Jose J, Giridhar R, Anas A, et al. Heavy metal pollution exerts reduction/adaptation in the diversity and enzyme expression profile of heterotrophic bacteria in Cochin Estuary, India [J]. Environmental Pollution, 2011, 159(10): 2775-2780
[32] Wei Y Q, Zhao Y, Zhao X Y, et al. Roles of different humin and heavy-metal resistant bacteria from composting on heavy metal removal [J]. Bioresource Technology, 2020, 296: 122375