塑料制品由于便捷和经济得到了广泛的使用,然而塑料的大量使用、不当处置和难降解造成了大量的塑料垃圾[1]。研究表明,全球每年大约有4.80×106~1.27×107 t塑料垃圾排入到水环境中[2]。这些进入到水体中的塑料在水解、光降解和生物分解等作用下会形成粒径更小的塑料微粒,其中,粒径≤100 nm的塑料微粒被称为纳米塑料(nanoplastics, NPs) [3]。NPs在水体中分布广泛,种类繁多[4]且易被贻贝、蚤状溞、轮虫等水生生物误食或吸附于生物体表面[5-7],并通过食物链进行传递,进而影响水生生物的生理代谢、生长发育和繁殖等过程[8-10]。此外,NPs具有粒径小、比表面积大、疏水性强等特点,容易吸附和转移水环境中的其他物质形成复合污染物[11-12],造成不可预知的生态风险。聚苯乙烯(PS)是需求量最大的聚合物之一,在水环境中被广泛检出[13-14]。目前,已有的研究表明,PSNPs的长期暴露显著降低海水青鳉(Oryzias melastigma)的子代孵化率,造成胚胎发育畸形[15],PSNPs可以作为水杨酸乙基己酯(EHS)的载体,促进EHS在斑马鱼(Danio rerio)体内的生物积累及其向后代的转移[16]。
溴酸盐![]() 经常在自然水体和处理水中被检出。美国地下水和地表水中溴酸盐浓度分别为2.6 μg·L-1和204.6 μg·L-1[17],英国受化学品生产厂长期泄露影响的地下水中溴酸盐浓度则达到了2 mg·L-1[18],我国沈阳、上海两地地表水中溴酸盐浓度分别为6.96 μg·L-1和33.2 μg·L-1[19]。我国新修订的《生活饮用水卫生标准》(GB 5749—2022)[20]中规定了溴酸盐限值为10 μg·L-1。溴酸盐在水中的溶解度和热稳定性高,会在水环境中长期存在并富集,对水中生物造成影响。研究发现,溴酸盐对大型溞(Daphnia magna)48 h、96 h的LC50为55.3 mg·L-1和46.8 mg·L-1,对萼花臂尾轮虫(Brachionus calyciflorus)24 h的LC50为365.29 mg·L-1,还抑制萼花臂尾轮虫的游泳速度,降低其净繁殖率、种群增长率,缩短寿命[21-22]。
经常在自然水体和处理水中被检出。美国地下水和地表水中溴酸盐浓度分别为2.6 μg·L-1和204.6 μg·L-1[17],英国受化学品生产厂长期泄露影响的地下水中溴酸盐浓度则达到了2 mg·L-1[18],我国沈阳、上海两地地表水中溴酸盐浓度分别为6.96 μg·L-1和33.2 μg·L-1[19]。我国新修订的《生活饮用水卫生标准》(GB 5749—2022)[20]中规定了溴酸盐限值为10 μg·L-1。溴酸盐在水中的溶解度和热稳定性高,会在水环境中长期存在并富集,对水中生物造成影响。研究发现,溴酸盐对大型溞(Daphnia magna)48 h、96 h的LC50为55.3 mg·L-1和46.8 mg·L-1,对萼花臂尾轮虫(Brachionus calyciflorus)24 h的LC50为365.29 mg·L-1,还抑制萼花臂尾轮虫的游泳速度,降低其净繁殖率、种群增长率,缩短寿命[21-22]。
轮虫是淡水浮游动物群落的重要类群,在维持水生态系统正常的物质循环和能量流动中发挥着重要作用,其中,萼花臂尾轮虫具有分布广泛、世代周期短、易培养和对毒物敏感等特点,是开展水生态毒理学研究的模式生物[23]。鉴于环境中PSNPs与溴酸盐的污染现象日益严重,两者共存时的相互作用很可能对轮虫等重要浮游生物产生复杂的毒性效应,影响水生态系统生物群落结构的稳定。本研究以萼花臂尾轮虫为受试生物,从存活、繁殖、种群增长及形态变化等多个方面研究了低浓度PSNPs和NaBrO3对其的联合毒性效应,结果可为探明PSNPs与NaBrO3共存条件下对轮虫类浮游生物的影响提供参考,同时为水环境中复合污染物的生态风险评价和控制提供理论支持。
实验所用的萼花臂尾轮虫采自芜湖市汀棠湖。采样后,随机挑选非混交雌体置于实验室(25±1) ℃的恒温光照培养箱中进行单克隆培养,光照强度为100 lx,光暗比为14 h∶10 h,在实验室的培养时间超过6个月。使用美国环境保护局(US EPA)配方[24]配制轮虫培养液,斜生四链藻(Tetradesmus obliquus)为轮虫唯一食物来源。斜生四链藻采用HB-4培养液培养,待其处于指数增长期时进行离心浓缩收集,储存于4 ℃下保存备用,投喂密度为2.0×106 cells·mL-1。
实验开始前,将一定数量的轮虫置于(25±1) ℃的恒温培养箱内进行预培养,此过程中,每12 h悬浮一次沉淀于试管底部的藻类食物,每24 h更换一次轮虫培养液并投喂新的食物,同时通过去除一部分轮虫个体使种群始终处于指数增长期,预培养时间为1周。
实验所用的聚苯乙烯微球(粒径为0.05~0.1 μm, 2.5% m/V, CAS: 9003-53-6)购自上海阿拉丁生化科技股份有限公司,原液在4 ℃下避光保存。表征结果显示,该聚苯乙烯纳米塑料平均粒径为(83.34±0.60) nm,Zeta电位为(26.20±0.46) mV,且呈较为规则的球形,分散效果良好(图1)。

图1 聚苯乙烯纳米塑料(PSNPs)的形貌
Fig. 1 Morphology of polystyrene nanoplastics (PSNPs)
NaBrO3(分析纯,99.8%)购自国药集团化学试剂有限公司。实验开始前,用蒸馏水配制100 mg·L-1的PSNPs母液和1 000 mg·L-1的NaBrO3母液,并置于4 ℃下保存。为了减小PSNPs的聚集作用,每次使用前进行30 min的超声处理,并每24 h配制一次测试液。结合溴酸盐的实际环境检测浓度及水质标准中规定的限值等因素,设置测试液的浓度为PSNPs:0.001 mg·L-1(低浓度,L)、0.1 mg·L-1(高浓度,H),NaBrO3:0.001 mg·L-1(低浓度,L)、0.1 mg·L-1(高浓度,H),参考杨越等[25]不同毒性比联合毒性实验的设计思路,设置了PSNPs-NaBrO3相同浓度比和不同浓度比的联合处理组,探究联合毒性作用中2种污染物的浓度配比对毒性效应的影响,测试液(PSNPs-NaBrO3)的组成及浓度见表1。
表1 实验测试液PSNPs-NaBrO3的浓度组成
Table 1 The concentration composition of the experimental test solution PSNPs-NaBrO3
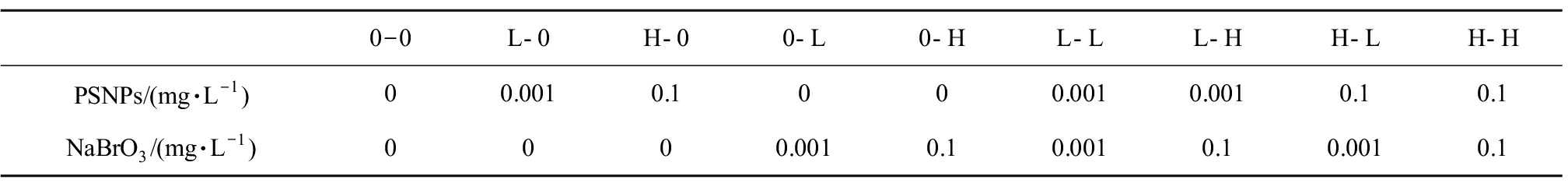
0-0L-0H-00-L0-HL-LL-HH-LH-HPSNPs/(mg·L-1)00.0010.1000.0010.0010.10.1NaBrO3/(mg·L-1)0000.0010.10.0010.10.0010.1
实验开始时,从完成预培养的轮虫中随机吸取若干个带卵的非混交雌体,置于和预培养条件相同的小玻璃杯中进行培养,并每隔2 h把孵化出的轮虫幼体取出用于生命表实验。实验在24孔培养板中进行,每个孔中放入一只幼体(龄长<2 h),并加入0.5 mL测试液(含有2.0×106 cells·mL-1斜生四链藻),每个浓度设置3组重复,将培养板置于(25±1) ℃、无光照的恒温培养箱中进行实验。实验开始12 h后的48 h内,每4 h观察一次、48 h之后每8 h观察一次轮虫的存活及产卵情况,记录轮虫母体的存活情况及产生的幼体数量,并移出所产幼体。实验期间每24 h更换一次测试液并投喂新的斜生四链藻,实验至母体全部死亡为止。
基于实验记录,参照Xue等[26]的方法计算轮虫主要发育阶段的历时,包括幼年期(JP,指从幼体孵出到其产出第一枚卵所经历的时间);胚胎发育时间(ED,指从卵的产出到幼体孵出所经历的时间);生殖期(RP,从第一枚卵产出到最后一枚卵产出所经历的时间);生殖后期(PP,从轮虫产出最后一枚卵到其死亡所经历的时间)。
生命表参数的定义和计算方法参照Ge等[27]的方法,特定年龄存活率(lx)为X年龄组开始时存活个体百分数;特定年龄繁殖率(mx)为X年龄组平均每个个体所产的后代数;生命期望(e0)为各轮虫个体出生时能存活多久的估计值;净生殖率(R0)为种群经过一个世代后的净增长率,R0=∑lx·mx;世代时间(T)为轮虫完成一个世代所经历的时间,![]() 平均寿命(LS)为所有个体平均存活时间的观察值;内禀增长率(rm)为种群在特定实验条件下的最大增长率,先根据方程
平均寿命(LS)为所有个体平均存活时间的观察值;内禀增长率(rm)为种群在特定实验条件下的最大增长率,先根据方程![]() 粗略计算,再根据方程
粗略计算,再根据方程![]() 在Excel中试算求得种群内禀增长率的精确值。
在Excel中试算求得种群内禀增长率的精确值。
从预培养好的试管中随机取10只龄长<2 h的轮虫幼体,将其置于5 mL刻度试管中,加入5 mL测试液(含有2.0×106 cells·mL-1斜生四链藻),每个浓度设置3组重复,置于(25±1) ℃、无光照的恒温培养箱中进行群体累积培养。实验期间,每12 h悬浮一次沉积于试管底部的藻类食物,每24 h更换一次测试液;72 h后,分别计数存活轮虫的携卵雌体数、不携卵雌体数、混交雌体数和休眠卵数。
轮虫种群增长率(r)的计算公式为:![]() 式中:N0、Nt分别为实验开始时和实验进行到第t天时的种群密度,t为时间,本研究中t=3。
式中:N0、Nt分别为实验开始时和实验进行到第t天时的种群密度,t为时间,本研究中t=3。
计算种群中携卵雌体数与不携卵雌体数的比值(OF/NOF),混交雌体数与总雌体数的比值(MR)。
从预培养好的烧杯中随机取30只龄长<2 h的轮虫幼体,将其置于10 mL刻度试管中,加入10 mL测试液(含有2.0×106 cells·mL-1斜生四链藻),每个浓度设置3组重复,置于(25±1) ℃、无光照的恒温培养箱中进行培养。实验开始8 h后每2 h观察一次轮虫,待轮虫携带第一枚卵后取出,用5%甲醛固定。采用蔡康光学(XSP-8CC)显微装置和图像采集系统对固定的轮虫进行拍照并进行测量。根据萼花臂尾轮虫的形态学特征,本实验采用Fu等[28]和Ciros-Pérez等[29]的方法,测量轮虫的背甲宽度、背甲长度、卵长径和卵短径4个形态参数,根据Sarma和Rao[30]的公式计算轮虫的个体大小(body size, BS)和卵体积(egg size, ES):![]() 式中:a和b分别为背甲长度和背甲宽度,m和n分别为卵长径和卵短径。
式中:a和b分别为背甲长度和背甲宽度,m和n分别为卵长径和卵短径。
采用Excel和SPSS 21.0对数据进行处理与分析,Origin2019作图,数据以平均值±标准差(Mean±SD)表示。对所得数据进行正态分布检验和方差齐性检验,符合以上条件的数据,采用单因素方差分析和多重比较(LSD)检验各实验组与空白组之间的差异显著性。P<0.05表示差异显著。
生存分析结果表明,H-H处理组的存活率显著高于对照组(P<0.05)。繁殖率在对照组和各实验组中没有呈现出显著变化(P>0.05),但L-L、L-H、H-L、H-H处理组均使繁殖率的最高点降低且延长了较高繁殖率的时间(图2)。

图2 PSNPs-NaBrO3暴露下萼花臂尾轮虫的存活率和繁殖率
Fig. 2 Age-specific survivorship and age-specific fecundity of B. calyciflorus exposed to PSNPs-NaBrO3
发育阶段的结果表明,与对照组相比,0-H、L-L、H-L、H-H处理组的JP显著延长(P<0.05),H-L处理组的ED显著缩短;0-H、L-L、H-H处理组的RP显著延长(P<0.05);0-H处理组的PP显著缩短(P<0.05)(图3)。

图3 PSNPs-NaBrO3暴露对萼花臂尾轮虫发育阶段的影响
注:(a)、(b)、(c)、(d)分别为胚胎发育期、幼年期、生殖期和生殖后期;a、b、c、d表示不同处理组间存在显著差异(P<0.05); ![]() 表示平均值,
表示平均值, ![]() 表示中位数,误差棒表示±标准差。
表示中位数,误差棒表示±标准差。
Fig. 3 Effects of PSNPs-NaBrO3 exposure on the developmental stages of B. calyciflorus
Note: (a), (b), (c) and (d) represent embryonic development, juvenile period, reproductive period and post-reproductive period respectively; a, b, c and d represent significant difference between each group (P<0.05); ![]() show mean value,
show mean value, ![]() show median, error bars indicate ±SD (n=3).
show median, error bars indicate ±SD (n=3).
单因素方差分析结果表明,与对照组相比,H-L、H-H处理组使e0、LS值显著延长(P<0.05),H-0处理组使R0值显著降低,L-H处理组使R0值显著升高(P<0.05),0-H、L-L、L-H、H-L和H-H处理组显著延长了T(P<0.05),H-0、0-L、0-H、L-L、H-L、H-H处理组显著降低了rm (P<0.05)(表2)。
表2 PSNPs-NaBrO3暴露对萼花臂尾轮虫生命表参数的影响
Table 2 Effects of PSNPs-NaBrO3 exposure on life-table parameters of B. calyciflorus
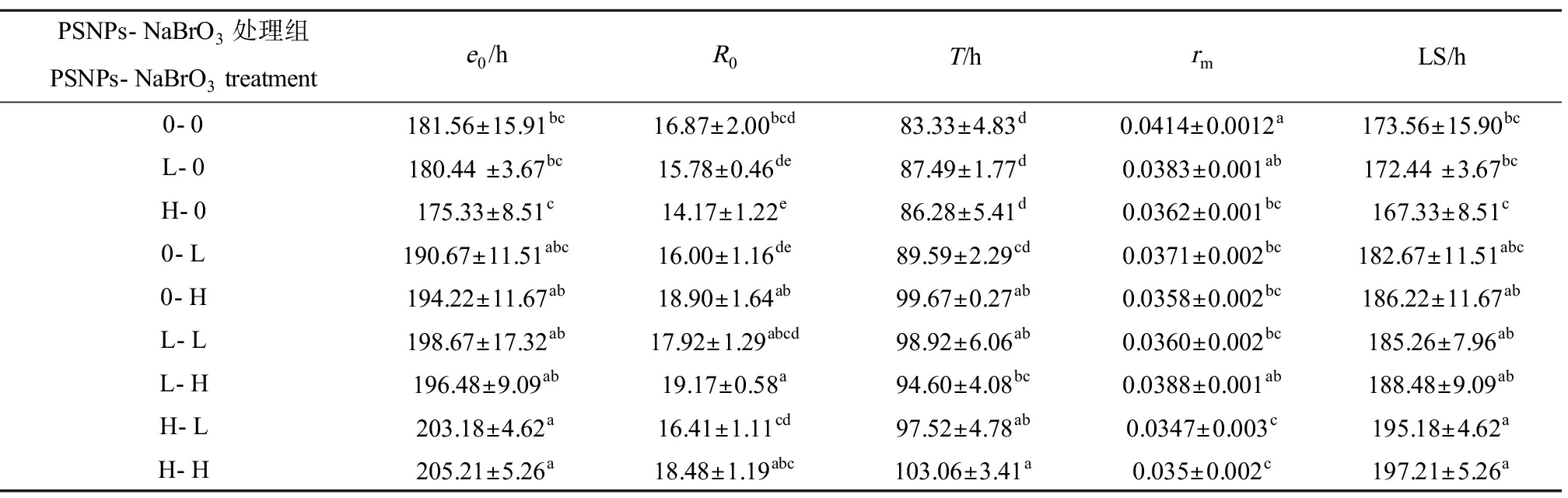
PSNPs-NaBrO3处理组PSNPs-NaBrO3 treatmente0/hR0T/hrmLS/h0-0181.56±15.91bc16.87±2.00bcd83.33±4.83d0.0414±0.0012a173.56±15.90bcL-0180.44 ±3.67bc15.78±0.46de87.49±1.77d0.0383±0.001ab172.44 ±3.67bcH-0175.33±8.51c14.17±1.22e86.28±5.41d0.0362±0.001bc167.33±8.51c0-L190.67±11.51abc16.00±1.16de89.59±2.29cd0.0371±0.002bc182.67±11.51abc0-H194.22±11.67ab18.90±1.64ab99.67±0.27ab0.0358±0.002bc186.22±11.67abL-L198.67±17.32ab17.92±1.29abcd98.92±6.06ab0.0360±0.002bc185.26±7.96abL-H196.48±9.09ab19.17±0.58a94.60±4.08bc0.0388±0.001ab188.48±9.09abH-L203.18±4.62a16.41±1.11cd97.52±4.78ab0.0347±0.003c195.18±4.62aH-H205.21±5.26a18.48±1.19abc103.06±3.41a0.035±0.002c197.21±5.26a
注:e0、R0、T、rm和LS为生命期望、净生殖率、世代时间、内禀增长率和平均寿命;表中同一列数据右上角含相同字母表示差异不显著(P>0.05),不同表示差异显著(P<0.05)。
Note: e0, R0, T, rm and LS represent life expectancy at hatching, net reproductive rate, generation time, intrinsic rate of population increase and average lifespan; the same superscript letters in the same rank represent no significant difference (P>0.05), while the different letters represent significant difference (P<0.05).
与对照组相比,0-L、0-H、L-L、L-H、H-L和H-H处理组的r显著降低,所有处理组对轮虫的OF/NOF均不产生显著影响(图4),所有处理组下均无混交雌体和休眠卵产生。

图4 PSNPs-NaBrO3暴露对萼花臂尾轮虫种群增长的影响
注:(a) PSNPs-NaBrO3暴露3 d后萼花臂尾轮虫的种群增长率;(b) PSNPs-NaBrO3暴露3 d后种群中携卵雌体数
与不携卵雌体数的比值(OF/NOF);a、b、c、d表示不同处理组间存在显著差异(P<0.05)。
Fig. 4 Effects of PSNPs-NaBrO3 exposure on population growth rate of B. calyciflorus
Note: (a) Population growth rate of B. calyciflorus after 3 d exposure to PSNPs-NaBrO3; (b) Ratio of the number of carrying females
to the number of non-carrying females in the population after 3 d exposure of PSNPs-NaBrO3(OF/NOF); a, b, c and d represent
significant difference between each group (P<0.05).
与对照组相比,L-0、H-0、0-L、0-H单独处理组及H-H联合处理组均使轮虫个体显著减小,L-L联合处理组使轮虫的卵体积显著增大(图5)。

图5 PSNPs-NaBrO3暴露对萼花臂尾轮虫个体及卵大小的影响
注:(a) PSNPs-NaBrO3暴露后萼花臂尾轮虫的个体大小;(b) PSNPs-NaBrO3暴露后萼花臂尾轮虫的卵大小;
a、b、c、d表示不同处理组间存在显著差异(P<0.05)。
Fig. 5 Effects of PSNPs-NaBrO3 exposure on body and egg size of B. calyciflorus
Note: (a) Body size of B. calyciflorus after exposure to PSNPs-NaBrO3; (b) Egg size of B. calyciflorus after exposure to PSNPs-NaBrO3;
a, b, c and d represent significant difference between each group (P<0.05).
生命表参数能够综合反映轮虫的存活和繁殖情况,且对特定毒物具有不同的敏感性[31]。通常情况下,繁殖参数对环境压力和化学药物的敏感性大于存活参数[32]。如Rao和Sarma[33]的研究表明,低浓度滴滴涕(DDT)的暴露会使轮虫的R0、rm显著降低,却不会影响轮虫的存活率。R0、rm对不同的毒物也表现出不同的敏感性,研究表明,R0对龙须菜抽提液的敏感性大于rm,而对石油水溶性成分来说,rm的敏感性大于R0[34-35]。本研究中,相对于其他指标而言,rm在多数处理组(6组)中受到毒物单一和联合作用的显著影响,特别是在低浓度组中也与对照组显示出显著差异,而R0则只在少数处理组(2组)中显示出差异性,表明PSNPs和NaBrO3的单一和联合暴露对rm的影响更大,rm比R0和其他参数更加适合监测PSNPs和NaBrO3的单一和联合暴露对轮虫种群的毒性影响。
生物种群的所有个体都承担着种群繁衍的任务,生物种群的增长或衰亡是所有个体存活和繁殖的累积表现。研究表明,面对外界环境和毒物的压力时,轮虫个体会在繁殖和生存之间进行能量的分配权衡[36]。如低温下轮虫寿命的延长要以牺牲繁殖为代价,且温度越低,轮虫所摄取的能量就会越倾向于用来维持自身生命活动[37]。而Xu等[38]研究发现,较高浓度DDT暴露下,轮虫选择降低繁殖率来实现对毒物的适应。本研究中,轮虫的JP和T值在多个处理组中被显著延长,而R0值却没有受到显著影响(除了H-0、L-H组外),表明轮虫受到胁迫后,在不降低后代个数的情况下,推迟了繁殖开始的时间,延长了后代产出的周期,降低了繁殖频次,这直接导致了rm值的显著降低,轮虫个体对种群增长的贡献在减少,其结果必然增加轮虫种群衰亡的风险。然而,值得注意的是,在H-L和H-H组中,轮虫的LS值被显著延长了,而这2组的rm值是所有处理组中最低的2组,表明在耐受压力下,轮虫试图通过延长寿命增加可能的“繁殖机会”以弥补rm的降低给种群带来的风险。
在受污染环境中,生物体会把部分能量用于抵抗污染物的胁迫[39]。研究表明,轮虫对微囊藻毒素的抵抗是一个耗能过程,它可以通过减小形态学参数,节约生长能量以抵抗微囊藻毒素的胁迫[40]。本研究中,L-0、H-0、0-L、0-H和H-H处理组的BS均显著减小,表明轮虫减少了用于自身发育的能量来增加对PSNPs和NaBrO3单一及联合暴露的抵抗。同样,当能量有限时,轮虫的繁殖会在卵大小和产卵量之间进行权衡[41]。如食物短缺时,桡足类会产出体积较大但数量较少的卵,以保证后代有较高的存活率,能更好地维持种群的延续[42]。本实验中,L-L处理组的rm显著降低,ES显著增大,表明轮虫采取降低产卵效率,提高卵质量的对策来增强对低浓度PSNPs和NaBrO3联合胁迫的抵抗。
PSNPs由于粒径小,比表面积大,容易吸附环境中与之共存的污染物,从而影响共存污染物对生物体的毒性效应,同时PSNPs与污染物之间可能存在复杂的相互合作,造成难以预料的生物效应。通常混合物的生物效应大于单一组分的生物效应。有研究发现,高浓度微塑料和氟苯尼考联合作用对河蚬摄食率的抑制远大于两者单独作用的抑制之和[43];微塑料和文拉法辛共存时泥鳅体内超氧化物歧化酶(SOD)活性显著高于单独接触文拉法辛时的活性[44],表明微塑料和共存的污染物之间存在协同作用。本研究中,PSNPs与NaBrO3共存时,所有联合处理组(L-L、L-H、H-L、H-H)的r均受到显著抑制,且抑制效果显著高于各自对应的单独处理组,表明PSNPs与NaBrO3对轮虫r的抑制存在协同作用。造成协同毒性效应的原因可能是:轮虫是一种滤食性动物,可以通过摄食使PSNPs进入体内,而PSNPs作为NaBrO3的载体,导致NaBrO3进入到轮虫体内的量增多,污染物的有效浓度增高,对轮虫r的抑制效果增强。或者是PSNPs独特的化学性质改变了细胞膜的通透性,使得NaBrO3更容易进入膜内产生作用。
然而,不是所有联合作用都会使毒性效应增强。研究表明,PS-MPs和罗红霉素(ROX)共同暴露对大型溞的氧化胁迫并没有比单一暴露强[45],阿伏苯宗(AVO)的存在能够减轻PSNPs对斑马鱼的毒性作用[46]。本实验中,H-L、H-H暴露对rm的抑制作用与H-0、0-L、0-H单独暴露时无显著差异,呈现出独立作用。而L-L、H-L暴露对BS的抑制作用与各自对应的单独暴露相比反而减弱了,呈现出拮抗作用。此外,NaBrO3的存在降低了0.1 mg·L-1 PSNPs对轮虫R0的抑制作用。上述情况结合协同效应充分表明,不同浓度PSNPs和NaBrO3以及二者不同的组合方式,对轮虫产生的毒性效应不尽相同,体现出联合毒性效应的复杂性。
[1] Xu S, Ma J, Ji R, et al. Microplastics in aquatic environments: Occurrence, accumulation, and biological effects [J]. The Science of the Total Environment, 2020, 703: 134699
[2] Haward M. Science-based solutions to plastic pollution [J]. One Earth, 2020, 2(1): 5-7
[3] Mattsson K, Hansson L A, Cedervall T. Nano-plastics in the aquatic environment [J]. Environmental Science Processes &Impacts, 2015, 17(10): 1712-1721
[4] Lv M J, Jiang B, Xing Y, et al. Recent advances in the breakdown of microplastics: Strategies and future prospectives [J]. Environmental Science and Pollution Research International, 2022, 29(44): 65887-65903
[5] Kolandhasamy P, Su L, Li J N, et al. Adherence of microplastics to soft tissue of mussels: A novel way to uptake microplastics beyond ingestion [J]. Science of the Total Environment, 2018, 610-611: 635-640
[6] Liu Z Q, Cai M Q, Wu D L, et al. Effects of nanoplastics at predicted environmental concentration on Daphnia pulex after exposure through multiple generations [J]. Environmental Pollution, 2020, 256: 113506
[7] Xue Y H, Sun Z X, Feng L S, et al. Algal density affects the influences of polyethylene microplastics on the freshwater rotifer Brachionus calyciflorus [J]. Chemosphere, 2021, 270: 128613
[8] 陈涛, 徐晓平, 李彬彬, 等. 聚苯乙烯微塑料和纳米塑料对萼花臂尾轮虫有性生殖的毒性影响[J]. 环境科学研究, 2022, 35(5): 1306-1314
Chen T, Xu X P, Li B B, et al. Effects of polystyrene microplastics and nanoplastics on sexual reproduction of rotifer Brachionus calyciflorus [J]. Research of Environmental Sciences, 2022, 35(5): 1306-1314 (in Chinese)
[9] Mao Y F, Ai H N, Chen Y, et al. Phytoplankton response to polystyrene microplastics: Perspective from an entire growth period [J]. Chemosphere, 2018, 208: 59-68
[10] Jiang W W, Fang J H, Du M R, et al. Microplastics influence physiological processes, growth and reproduction in the Manila clam, Ruditapes philippinarum [J]. Environmental Pollution, 2022, 293: 118502
[11] Sui Y M, Wang S Y, Mohsen M, et al. The combined effect of plastic particles size and concentration on rotifers’ (Brachionus plicatilis) performance [J]. Journal of Ocean University of China, 2022, 21(2): 509-519
[12] Drago C, Pawlak J, Weithoff G. Biogenic aggregation of small microplastics alters their ingestion by a common freshwater micro-invertebrate [J]. Frontiers in Environmental Science, 2020, 8: 574274
[13] Xiong X, Wu C X, Elser J J, et al. Occurrence and fate of microplastic debris in middle and lower reaches of the Yangtze River - From inland to the sea [J]. Science of the Total Environment, 2019, 659: 66-73
[14] Li C R, Busquets R, Campos L C. Assessment of microplastics in freshwater systems: A review [J]. The Science of the Total Environment, 2020, 707: 135578
[15] 靳非, 田淼, 穆景利, 等. 聚苯乙烯微塑料长期暴露对海水青鳉(Oryzias melastigma)亲代生长、繁殖及子代发育的影响[J]. 生态毒理学报, 2021, 16(4): 216-223
Jin F, Tian M, Mu J L, et al. Effects of polystyrene microplastics on growth and reproduction of parental generation and development of filial generation of marine medaka (Oryzias melastigma) after a long-term exposure [J]. Asian Journal of Ecotoxicology, 2021, 16(4): 216-223 (in Chinese)
[16] Zhou R R, Lu G H, Yan Z H, et al. Interactive transgenerational effects of polystyrene nanoplastics and ethylhexyl salicylate on zebrafish [J]. Environmental Science: Nano, 2021, 8(1): 146-159
[17] Kemsley J. Bromate in Los Angeles water [J]. Chemical &Engineering News Archive, 2007, 85(52): 9
[18] Cornelissen J P, Kafouros M, Lock A R. Metaphorical images of organization: How organizational researchers develop and select organizational metaphors [J]. Human Relations, 2005, 58(12): 1545-1578
[19] Wu Q, Zhang T, Sun H W, et al. Perchlorate in tap water, groundwater, surface waters, and bottled water from China and its association with other inorganic anions and with disinfection byproducts [J]. Archives of Environmental Contamination and Toxicology, 2010, 58(3): 543-550
[20] 国家市场监督管理总局, 国家标准化管理委员会. 生活饮用水卫生标准: GB 5749—2022 [S]. 北京: 中国标准出版社, 2022
[21] Fisher D, Yonkos L, Ziegler G, et al. Acute and chronic toxicity of selected disinfection byproducts to Daphnia magna, Cyprinodon variegatus, and Isochrysis galbana [J]. Water Research, 2014, 55: 233-244
[22] Xu X P, Chen T, Wei X Y, et al. Effects of bromate on life history parameters, swimming speed and antioxidant biomarkers in Brachionus calyciflorus [J]. Ecotoxicology and Environmental Safety, 2021, 208: 111705
[23] Dahms H U, Hagiwara A, Lee J S. Ecotoxicology, ecophysiology, and mechanistic studies with rotifers [J]. Aquatic Toxicology, 2011, 101(1): 1-12
[24] Peltier W, Weber C. Methods for measuring the acute toxicity of effluents to freshwater and marine organisms [R]. Washigton DC: Environmental Monitoring and Support Laboratory, Office of Research and Development, United States Environmental Protection Agency, 1985
[25] 杨越, 孙昊宇, 龙茜, 等. 氨基糖苷类抗生素与抗菌剂不同毒性比混合对大肠杆菌的联合效应研究[J]. 生态毒理学报, 2022, 17(2): 118-128
Yang Y, Sun H Y, Long X, et al. Combined toxicity of aminoglycosides and antimicrobials with different ratios on Escherichia coli [J]. Asian Journal of Ecotoxicology, 2022, 17(2): 118-128 (in Chinese)
[26] Xue Y H, Sun Z X, Feng L S, et al. Algal density affects the influences of polyethylene microplastics on the freshwater rotifer Brachionus calyciflorus [J]. Chemosphere, 2021, 270: 128613
[27] Ge Y L, Luo T, Ge C C, et al. Comparison of the life-history parameters and competition outcome with Moina macrocopa between two morphs of Brachionus forficula [J]. Scientific Reports, 2018, 8(1): 6022
[28] Fu Y, Hirayama K, Natsukari Y. Morphological differences between two types of the rotifer Brachionus plicatilis O.F. Müller [J]. Journal of Experimental Marine Biology and Ecology, 1991, 151(1): 29-41
[29] Ciros-Pérez J, Gómez A, Serra M. On the taxonomy of three sympatric sibling species of the Brachionus plicatilis (Rotifera) complex from Spain, with the description of B. ibericus n. sp [J]. Journal of Plankton Research, 2001, 23(12): 1311-1328
[30] Sarma S S S, Rao T R. Effect of food level on body size and egg size in a growing population of the rotifer Brachionus patulus Müller [J]. Archiv Für Hydrobiologie, 1987, 111(2): 245-253
[31] 孙帆, 葛乐乐, 白琰, 等. 亚致死浓度的盐酸四环素对萼花臂尾轮虫存活、生殖和种群增长的影响[J]. 动物学杂志, 2021, 56(3): 377-383
Sun F, Ge L L, Bai Y, et al. Effects of sublethal concentration of tetracycline hydrochloride on survival, reproduction and population growth of Brachionus calyciflorus [J]. Chinese Journal of Zoology, 2021, 56(3): 377-383 (in Chinese)
[32] Dong L L, Wang H X, Ding T, et al. Effects of TiO2 nanoparticles on the life-table parameters, antioxidant indices, and swimming speed of the freshwater rotifer Brachionus calyciflorus [J]. Journal of Experimental Zoology Part A, Ecological and Integrative Physiology, 2020, 333(4): 230-239
[33] Rao T R, Sarma S S S. Demographic parameters of Brachionus patulus Müller (Rotifera) exposed to sublethal DDT concentrations at low and high food levels [J]. Hydrobiologia, 1986, 139(3): 193-200
[34] 龙艾虹, 梁迪文, 罗洪添, 等. 大型海藻龙须菜抽提液对褶皱臂尾轮虫生命表参数的影响[J]. 生态学报, 2019, 39(7): 2583-2590
Long A H, Liang D W, Luo H T, et al. Effects of seaweed extract (Gracilaria lemaneiformis) on life history parameters of the rotifer Brachionus plicatilis [J]. Acta Ecologica Sinica, 2019, 39(7): 2583-2590 (in Chinese)
[35] 王嘉仪, 沙婧婧, 张晖, 等. 石油水溶性成分对褶皱臂尾轮虫(Brachionus plicatilis)生殖、发育及种群动态的影响[J]. 生态毒理学报, 2019, 14(5): 159-167
Wang J Y, Sha J J, Zhang H, et al. Water-accommodated fraction (WAF) of oil exert negative impacts on reproduction, development and population dymanics of marine rotifer Brachionus plicatilis [J]. Asian Journal of Ecotoxicology, 2019, 14(5): 159-167 (in Chinese)
[36] Bernardes J P, John U, Woltermann N, et al. The evolution of convex trade-offs enables the transition towards multicellularity [J]. Nature Communications, 2021, 12(1): 4222
[37] 金对娇. 二甲双胍对萼花臂尾轮虫延寿效果的研究[D]. 南京: 南京师范大学, 2021: 33-55
Jin D J. The life-prolonging effect of metformin on Brachionus calyciflorus [D].Nanjing: Nanjing Normal University, 2021: 33-55 (in Chinese)
[38] Xu X P, Xi Y L, Wang X M. Effects of DDT and dicofol on life table demography of the freshwater rotifer Brachionus calyciflorus Pallas [J]. Polish Journal of Environmental Studies, 2020, 29(2): 1945-1951
[39] Oda Y, Sato K, Hanazato T, et al. Enhanced sensitivity to an insecticide carbaryl in Daphnia magna mediated by fish kairomone [J]. Limnology, 2019, 20(2): 137-141
[40] 项贤领, 朱凌云, 陈莹莹, 等. 微囊藻毒素和温度对萼花臂尾轮虫(Brachionus calyciflorus)形态学特征的影响[J]. 湖泊科学, 2018, 30(4): 1027-1040
Xiang X L, Zhu L Y, Chen Y Y, et al. Combined effects of the microcystin MC-LR and temperature on the morphological features of Brachionus calyciflorus [J]. Journal of Lake Sciences, 2018, 30(4): 1027-1040 (in Chinese)
[41] Liang T, Zhou L, He W F, et al. Variations in the reproductive strategies of three populations of Phrynocephalus helioscopus in China [J]. PeerJ, 2018, 6: e5705
[42] Liu X, Ban S. Size-mediated temperature effect on embryonic development in Eodiaptomus japonicus (Copepoda, Calanoida) in Lake Biwa, Japan [J]. Journal of Plankton Research, 2020, 42(6): 779-782
[43] Guilhermino L, Vieira L R, Ribeiro D, et al. Uptake and effects of the antimicrobial florfenicol, microplastics and their mixtures on freshwater exotic invasive bivalve Corbicula fluminea [J]. Science of the Total Environment, 2018, 622-623: 1131-1142
[44] Qu H, Ma R X, Wang B, et al. Enantiospecific toxicity, distribution and bioaccumulation of chiral antidepressant venlafaxine and its metabolite in loach (Misgurnus anguillicaudatus) co-exposed to microplastic and the drugs [J]. Journal of Hazardous Materials, 2019, 370: 203-211
[45] 姜航, 丁剑楠, 黄叶菁, 等. 聚苯乙烯微塑料和罗红霉素对斜生栅藻(Scenedesmus obliquus)和大型溞(Daphnia magna)的联合效应研究[J]. 生态环境学报, 2019, 28(7): 1457-1465
Jiang H, Ding J N, Huang Y J, et al. Combined effects of polystyrene microplastics and roxithromycin on the green algae (Scenedesmus obliquus) and waterflea (Daphnia magna) [J]. Ecology and Environmental Sciences, 2019, 28(7): 1457-1465 (in Chinese)
[46] Liu Y X, Wang Y H, Li N, et al. Avobenzone and nanoplastics affect the development of zebrafish nervous system and retinal system and inhibit their locomotor behavior [J]. The Science of the Total Environment, 2022, 806(Pt 2): 150681
# 共同通信作者(Co-corresponding author), E-mail: xiaofan108@ahpu.edu.cn
徐晓平(1979—),男,博士,教授,主要研究方向为水污染监测与控制、生态毒理学。
共同通信作者简介:杨晓凡(1978—),男,博士,副教授,主要研究方向为工业污染控制与治理。