基于哺乳动物的传统毒性测试方法存在周期长、成本高、受动物伦理限制等问题。所以学术界和工业界多年来一直致力于传统毒性测试替代方法的开发。特别是进入21世纪以来,全球经济和社会的快速发展导致新的化学物质不断产生,需要大量的人力物力开展毒性测试工作;同时已有的一些化学物质面临着重新评估的问题,由此迫切需要开发快速、高通量的毒性测试方法以满足大量化学物质毒性测试的需求。基于体外细胞的毒性测试方法是动物替代方法研发的主要思路,在美国ToxCast/Tox21项目的支持下,基于细胞的快速、高通量毒性测试方法的研发取得长足进步[1-2]。但是,体外培养的细胞存在缺乏代谢能力、没有组织器官间复杂生物学网络调控等问题,所得毒性测试结果不一定能够很好反映体内的毒性效应[3]。
斑马鱼作为一种典型的生物学研究模式生物,近年来在毒理学研究中也得到广泛应用[4-5]。因为斑马鱼基因组与人类基因组有70%的同源性[6],所以在斑马鱼试验中观察到的毒性一定程度上可指示对人类的损伤。重要的是,斑马鱼胚胎具有发育迅速、体积小易于培养、通体透明易于观察等特点,在发育毒性筛查方向上具有明显的优势。尤其是可在多孔板中培养和观察的特点,使斑马鱼成为活体高、中通量(一般96孔及以上为高通量,低于96孔为中通量)毒性筛查的首选生物种。另外,丰富的转基因品系为斑马鱼高通量毒性筛查提供充分的发展空间[7-9]。目前,已有多种基于特定靶点或效应的斑马鱼高通量测试方法相继被开发利用[10],与基于哺乳动物的毒性测试方法相比,大大提高了毒性测试的效率。
本文就胚胎/仔鱼急性毒性、发育毒性、转基因品系特定靶信号/器官毒性、仔鱼微行为等几个斑马鱼中高通量毒性测试方法的发展现状进行综述,分析各个方法的优势和局限性,并就斑马鱼中高通量毒性测试方法未来的发展方向和应用前景进行探讨。
1 基于孔板的斑马鱼胚胎或仔鱼急性毒性测试方法(Test method for acute toxicity of zebrafish embryo or larva based on orifice plate)
鱼类急性毒性数据是水溶性化学物质危害评估必需的数据,主要通过测试物暴露一定时间后,导致半数死亡的浓度(LC50)表示[11]。但是目前使用成鱼进行的急性毒性试验需要较大的饲养空间,单次试验能够测试的化学物质有限,而且涉及动物伦理问题。2013年,经济合作与发展组织(OECD)发布斑马鱼胚胎急性毒性测试指南(OECD TG 236)。该方法选择4~32细胞期的斑马鱼胚胎为材料,置于24孔板中进行受试物暴露,在受精后48 h(48 hpf)和96 hpf观察胚胎死亡情况,计算LC50,表征测试物的急性毒性。该方法与基于成鱼的鱼类急性毒性试验比较,有效地缩小了试验体系,增加了试验通量,被建议作为传统的鱼类急性毒性试验的替代方法[12]。一些研究数据显示斑马鱼胚胎急性毒性的数据与传统的鱼类急性毒性的数据有很好的吻合性[13-15],支持使用斑马鱼胚胎急性毒性试验替代传统的鱼类急性毒性试验的观点。但是,另外一些研究显示2个试验方法的结果并不能很好吻合,尤其对神经毒物的测试结果存在很大的差异[16]。目前通常认为,斑马鱼胚胎与成鱼急性毒性的差异可能与测试物在试验材料中的毒物动力学过程不同有关,胚胎吸收和代谢测试物的能力可能弱于成鱼,导致对毒性损伤不敏感[14]。最近也有观点认为斑马鱼胚胎对神经毒物的抗性强与呼吸功能不完善相关,成鱼的呼吸系统对神经毒物敏感而容易导致缺氧死亡[17]。总之,目前来看使用基于孔板的斑马鱼胚胎急性毒性试验可能不是理想的成鱼急性毒性试验替代方法。
考虑到斑马鱼胚胎急性毒性试验不能很好地替代成鱼急性毒性试验,一些研究人员将兴趣转向仍可在孔板中培养的仔鱼(受精后5~15 d,5~15 dpf)。一般认为仔鱼具有基本的药物吸收、代谢[18],且避免了卵膜对有毒物质与生命体接触的阻碍作用,因此仔鱼可能是比胚胎更理想的成鱼急性毒性试验替代方案。有研究使用3~8 dpf斑马鱼仔鱼在孔板中测试农药的48 h和96 h急性毒性,并与胚胎及成鱼数据进行比较,发现仔鱼的急性毒性敏感性与胚胎相比更接近成鱼[19]。Xiong等[20]建立了6孔板中4 pdf斑马鱼仔鱼48 h急性毒性试验方法,以检测化学物质的48 h-LC50,结果显示大部分物质的数据与标准的成鱼急性毒性试验数据相当,只有少数的几种神经毒物的数据与成鱼数据相差较大。最近Kämmer等[17]的研究显示,开始具有鳃呼吸功能的仔鱼(12 dpf)不再对毒死蜱、涕灭威等神经毒物具有抗性,而是表现出比胚胎和成鱼更高的敏感性。从现有数据来看,可在孔板中进行的仔鱼毒性试验有望进一步发展成为成鱼急性毒性试验的替代方法,后续需要对仔鱼年龄、孔板类型、每个孔中仔鱼的数量等条件进行进一步的论证,以实现最优化的条件。
2 斑马鱼发育毒性高通量测试方法(High-throughput test method for developmental toxicity of zebrafish)
由于发育快速、可在孔板培养、易于观察等特点,斑马鱼胚胎已被用于化学物质发育毒性的高通量毒性测试。在ToxCast/Tox21项目的支持下,美国国家健康与环境影响研究实验室(NEEFL)和俄勒冈州立大学Tanguay团队各自独立开发了斑马鱼发育毒性高通量测试方法,分别命名为CCTE_Padilla_ZF_144 hpf和Tanguay_ZF_120 hpf(https://www.epa.gov/chemical- research/generating-toxcast-data-toxcast-assays)。这2种方法均在96孔板中对斑马鱼胚胎进行化学物质暴露,在144 hpf或者120 hpf时观察胚胎发育状况,主要以形态学参数为评价指标,以判断测试物的发育毒性。早期研究中,不同实验室间斑马鱼胚胎发育毒性的终点测试指标不尽相同,不利于作为标准方法使用。2017年,Zhang等[21]通过贝叶斯分析对多个指标在发育毒性中的权重进行了评估,最终选出了18个能够代表斑马鱼发育异常的指标,包括卵黄囊水肿、心包水肿、体轴、躯干长度、尾鳍、胸鳍、色素沉着、体节畸形、眼睛、吻部、下颌、耳石畸形、大脑发育、脊索、循环系统、鱼鳔存在和充气、触摸响应以及活跃程度。目前,已有上千种化学物质经过了斑马鱼发育毒性测试,结果显示实验室间有良好的重复性[22]。然而,有研究发现一些测试物在斑马鱼发育毒性测试中其表现与疏水性密切相关,部分亲水的有毒化学品不能被受精卵吸收,呈现出阴性的结果[22]。因此,Tanguay_ZF_120 hpf中增加了使用蛋白酶去除胚胎绒毛膜的步骤[22]。这使得测试方法敏感性增加,亲水物质也能够被测试,但该处理忽视了生物屏障对于化学物质毒性的影响,也使得测试中易出现胚胎死亡的现象。目前,斑马鱼胚胎发育毒性高通量测试方法除用于化学物质的毒性测试外,也被用于探索混合体系或实际水样的毒性检测。如Malev等[23]利用斑马鱼胚胎发育毒性试验方法,鉴别出含有抗生素、精神类药物、工业化学品等复杂污染物的地表水可导致色素沉着异常、心脏畸形等不良效应。
仅凭人工观察形态学特征难以实现斑马鱼发育毒性的高通量测试,借助图像获取和定量分析软件可实现斑马鱼胚胎毒性测试中部分指标的自动化分析[24]。美国Union Biometrica公司开发的基于微流控的VAST BioImager系统,可实现对斑马鱼胚胎和仔鱼的图像自动采集分析,是目前针对斑马鱼胚胎及幼鱼最成熟的自动化成像系统。最近,美国杜克大学研究人员开发了一套基于声流控的无接触斑马鱼图像采集分析系统,可更快速更真实地获取斑马鱼的图像[25]。而且有研究整合机器学习的方法对斑马鱼形态学进行分析,以识别常用斑马鱼胚胎畸形指标[26]。整体来看,目前的斑马鱼图像分析技术获得了很大进展,但是商业化的产品都比较昂贵,一定程度上限制了在发育毒性测试中的应用。
3 转基因斑马鱼特定靶信号或靶器官毒性的高通量测试(High-throughput tests of specific target signals or target organ toxicity in transgenic zebrafish)
针对某一分子或某类细胞,如关键的受体或关键信号通路,可构建包含报告基因的转基因斑马鱼品系,以进行特定靶信号或靶器官的毒性测试。目前,已有不少转基因斑马鱼品系相继被开发用于毒理学研究和毒性检测[27]。
内分泌干扰物尤其是环境雌激素类物质是近年来环境毒理学/生态毒理学高度关注的新污染物[28]。斑马鱼因为对环境雌激素类物质高度敏感而成为研究筛查环境雌激素的良好模式动物[29]。为实现对环境雌激素类物质的快速筛查,有研究人员开发了ere-vtg-egfp转基因斑马鱼品系,其原理是雌激素类物质与雌激素受体结合作用于雌激素响应基因vtg的雌激素响应元件(ERE),从而激活与ERE关联的绿色荧光蛋白基因egfp的表达。根据测试物是否诱导绿色荧光的发生判定测试物是否具有雌激素活性[30]。一些研究显示这样的转基因斑马鱼可检出0.1 ng·L-1的17α-乙炔基雌二醇的雌激素活性[31]。考虑到斑马鱼本身的色素可能干扰荧光的观察,有研究人员将ere-gfp转基因斑马鱼与无色素(Casper)转基因斑马鱼进行杂交,得到(ere-gfp)-Casper转基因斑马鱼品系,这一结合降低了背景值,增强了绿色荧光信号的检测强度,理论上可以实现更灵敏的环境雌激素检测[32]。除基于vtg的转基因斑马鱼,与性激素合成相关的cyp19基因修饰斑马鱼也可用于内分泌干扰物的筛查[33]。
利用荧光蛋白标记的特定组织器官的转基因斑马鱼可检测化学物质对特定靶器官的毒性[34]。心脏和血管是药物和化学品毒性测试中高度关注的靶器官,目前有几个转基因斑马鱼品系可用于心脏和血管的毒性检测。如Tg(myl7::dsred2-nuc)品系斑马鱼的心肌细胞被红色荧光标记,Tg(flia::gfp)品系斑马鱼的心内膜细胞被绿色荧光标记,用这2个转基因斑马鱼品系可观察心肌细胞数量和心内膜细胞数量,根据细胞数量的变化可表征化学物质的心脏毒性。Gu等[35]用Tg(myl7::dsred2-nuc)和Tg(flia::gfp)2个斑马鱼品系,发现双酚AF暴露可导致斑马鱼心肌细胞和内膜细胞减少,表现出明显的心脏毒性。类似地,荧光蛋白标记血管的转基因斑马鱼可用于检测化学物质甚至纳米材料对血管形成的影响[36],神经细胞或神经胶质细胞标记的转基因斑马鱼可用于检测神经发育毒性[37],针对胰岛细胞的报告基因斑马鱼可用于检测胰腺发育干扰作用[38]。利用荧光蛋白标记的特定组织器官的转基因斑马鱼实质上更多用于发育毒性的检测,比单纯利用形态学参数为指标的发育毒性测试更灵敏、更精确。比如,斑马鱼颅神经嵴细胞(cNCCs)损伤和畸形是常见的脑部畸形,但是仅凭外部形态难以做到精准识别;但是利用荧光标记cNCCs转基因斑马鱼品系(fli1:EGFP)可在受精24 h检出颅神经嵴的发育异常,而且与受精后120 h观察到的颅脑畸形一致[39]。目前,我国国家斑马鱼资源中心能够提供大量转基因斑马鱼品系(http://zfish.ihb.ac.cn/),可快速、直观地表征测试物对特定靶点的损伤。除了可利用的转基因斑马鱼外,图像分析系统是决定高通量测试的关键。如前所述,目前市场上已有一些集图像获取和软件分析于一体的商品化系统。目前,我国国家斑马鱼资源中心能够提供大量转基因斑马鱼品系(http://zfish.ihb.ac.cn/),其中部分适用于毒性的筛查(表1),可快速、直观地表征测试物对特定靶点的损伤。
表1 适用于毒性测试的部分转基因斑马鱼品系
Table 1 Transgenic zebrafish strains suitable for toxicity testing
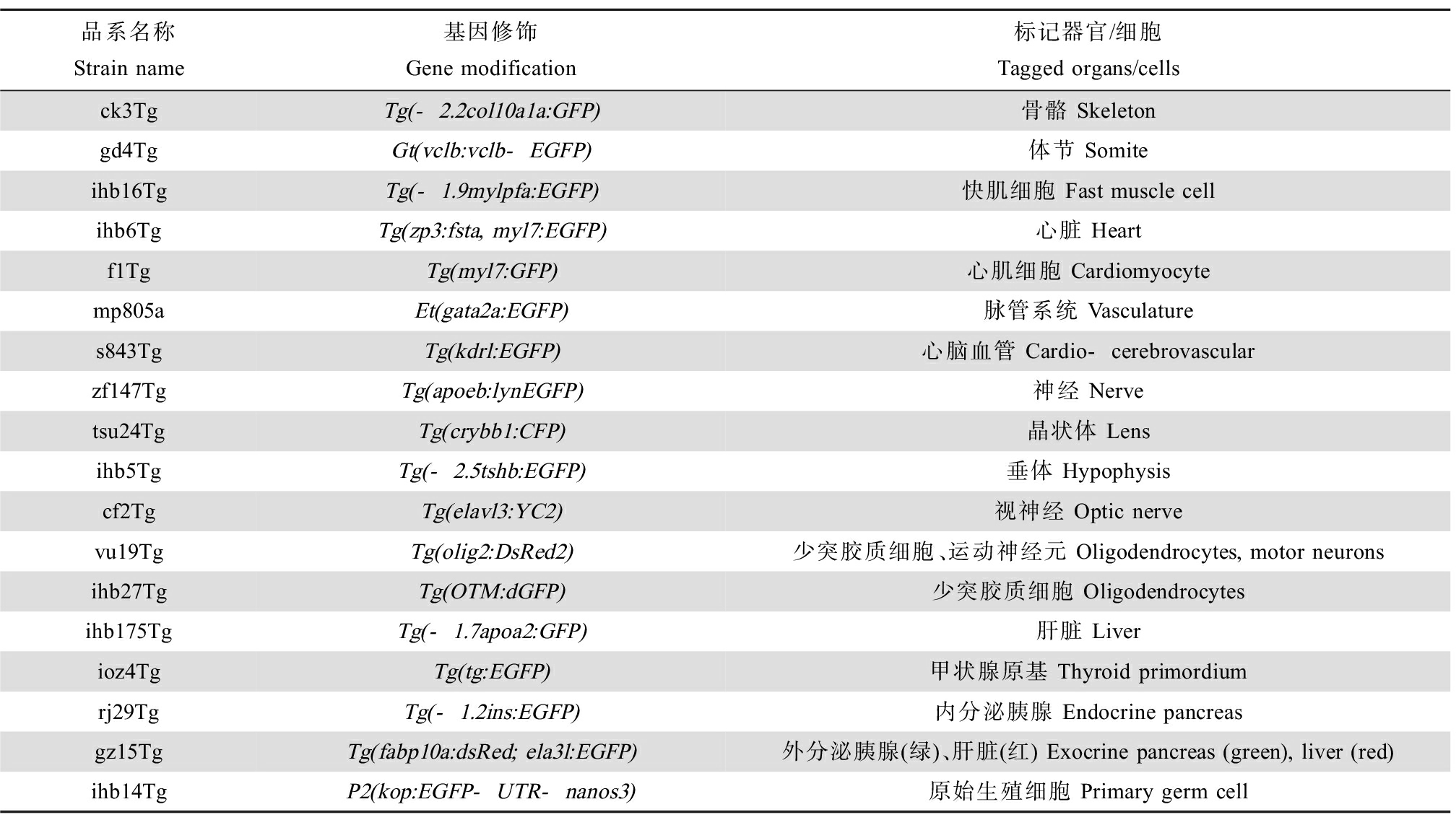
品系名称Strain name基因修饰Gene modification标记器官/细胞Tagged organs/cellsck3TgTg(-2.2col10a1a:GFP)骨骼 Skeletongd4TgGt(vclb:vclb-EGFP)体节 Somiteihb16TgTg(-1.9mylpfa:EGFP)快肌细胞 Fast muscle cellihb6TgTg(zp3:fsta, myl7:EGFP)心脏 Heartf1TgTg(myl7:GFP)心肌细胞 Cardiomyocytemp805aEt(gata2a:EGFP)脉管系统 Vasculatures843TgTg(kdrl:EGFP)心脑血管 Cardio-cerebrovascularzf147TgTg(apoeb:lynEGFP)神经 Nervetsu24TgTg(crybb1:CFP)晶状体 Lensihb5TgTg(-2.5tshb:EGFP)垂体 Hypophysiscf2TgTg(elavl3:YC2)视神经 Optic nervevu19TgTg(olig2:DsRed2)少突胶质细胞、运动神经元 Oligodendrocytes, motor neuronsihb27TgTg(OTM:dGFP)少突胶质细胞 Oligodendrocytesihb175TgTg(-1.7apoa2:GFP) 肝脏 Liverioz4TgTg(tg:EGFP)甲状腺原基 Thyroid primordiumrj29TgTg(-1.2ins:EGFP)内分泌胰腺 Endocrine pancreasgz15TgTg(fabp10a:dsRed; ela3l:EGFP)外分泌胰腺(绿)、肝脏(红) Exocrine pancreas (green), liver (red)ihb14TgP2(kop:EGFP-UTR-nanos3)原始生殖细胞 Primary germ cell
4 斑马鱼仔鱼行为和微行为高通量分析(High-throughput analysis of behaviors and microbehaviors of zebrafish larvae)
动物行为的改变可以综合反映包括神经在内的多系统的损伤。随着斑马鱼在毒理学研究中的应用,很多行为学的指标被开发利用。目前使用的斑马鱼行为学指标主要分为运动指标和空间指标2类。运动指标包括运动距离、速度、角速度等,用以描述斑马鱼的运动特征和运动能力。空间指标主要包括斑马鱼出现在不同区域的时间、进出次数等,表征在空间上的分布和偏好,反映惊恐、焦虑等情绪或者学习记忆能力[40-41]。当施加震动、光照、声音等刺激,通过研究这些行为指标的变化,可以反映斑马鱼对特定刺激的响应能力。目前有一些轨迹追踪软件如idTracker、ToxTracker等,可用于斑马鱼的追踪和行为学指标分析[42]。因为5~7 dpf的斑马鱼仔鱼可在96孔板中游动,为高通量的行为测试提供了可能。Noldus开发了集硬件和软件于一体的斑马鱼行为轨迹跟踪系统DanioVision,在96孔板中实现对斑马鱼仔鱼行为学的自动分析。目前斑马鱼行为轨迹跟踪系统已被广泛用于药物筛选和毒性筛查。例如,Hussain等[43]通过高通量测试系统单次测试12种农药对斑马鱼行进距离、旋转角度等行为学指标的影响,指出这些农药均会影响斑马鱼行为能力,其中乙酰脒、二甲吗啉、氯虫苯甲酰胺、托芬吡拉德、苯醚甲环唑、吡虫啉和氯氰菊酯以类似的方式产生效应。Tombari等[44]利用96孔板测试了4~5 dpf斑马鱼仔鱼在暴露于迷幻药和滥用的药物后爆发游泳速度、爆发运动持续时间、明暗环境中的运动里程等参数,发现测试药物中麦角酸二乙酰胺的神经毒性最强,而致幻剂色胺和氯胺酮的神经毒性比精神兴奋剂更弱。这些研究显示斑马鱼高通量行为测试在污染物毒性测试中具有很好的应用前景。
另一方面,斑马鱼的微行为如胎动、心率、血流等指标,常被用于反映化学品对斑马鱼心脏系统、中枢神经系统、视听觉系统的影响。借助图像获取和定量分析软件可实现斑马鱼微行自动化分析。Noldus开发的斑马鱼微视行为分析系统DanioScope,能够对斑马鱼的胎动、绒毛膜、心脏、血流等指标进行自动分析。Che等[45]利用DanioScope软件分析了斑马鱼幼鱼的体长和心率,以分析甲基硫菌灵对斑马鱼的毒性。此外,考虑到斑马鱼早期鳃呼吸对污染物的敏感性,DanioScope还发展了对幼鱼呼吸频率的测量功能,也已用于一些化学品的毒性检测[46]。综合以上,目前斑马鱼中高通量测试方法可用于多种毒性和指标的检测。图1中概括了目前主要的斑马鱼中高通量毒性测试方法。
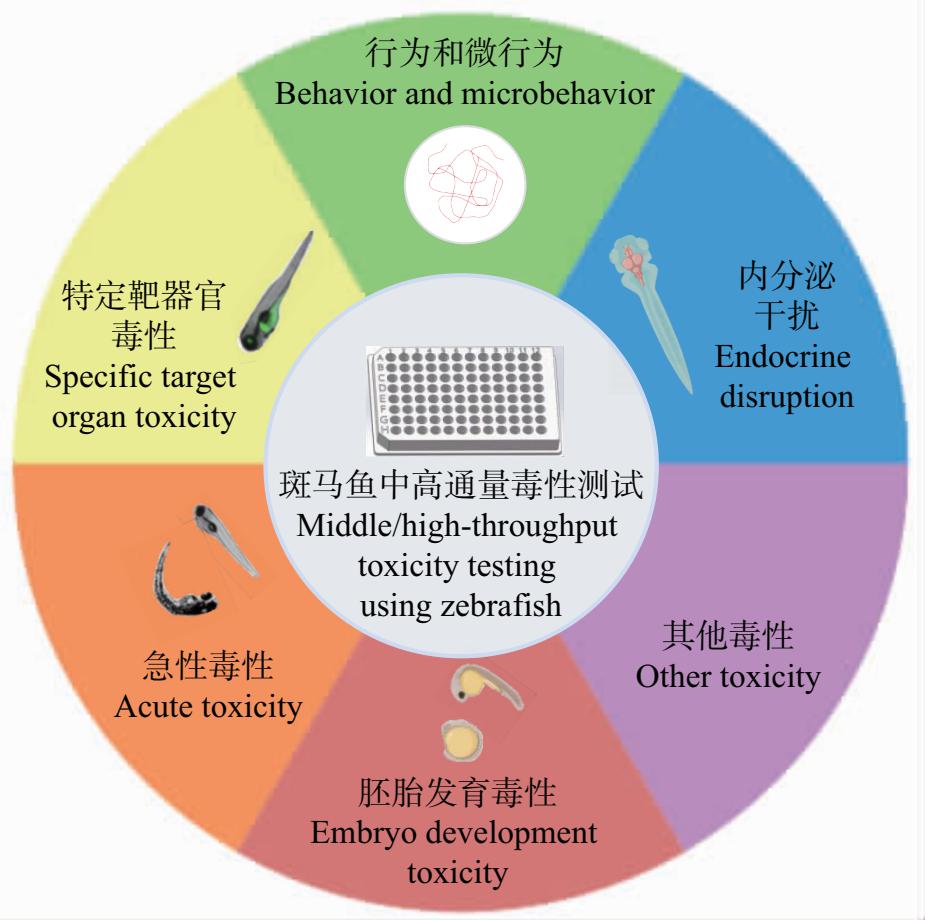
图1 斑马鱼中高通量毒性测试
Fig. 1 Middle/high-throughput toxicity testing using zebrafish
5 斑马鱼高通量测试的自动化设备研究进展(Research progress in automated operation for high-throughput testing using zebrafish)
随着斑马鱼高通量毒性测试方法的发展,鱼卵的收集、向孔板的转移、药物暴露等环节的自动化操作也成为必须解决的问题。Adatto等[47]设计开发了大规模的斑马鱼繁殖容器,实现了180条成鱼一次获取高达7 000枚胚胎的产量,不但是传统杂交设备产量的2倍以上,并且所需空间和时间都得到很大改善。在胚胎分配方面,瑞士一家技术中心基于原有微型模式动物分选仪器COPAS高通量分选系统,针对斑马鱼胚胎开发出名为Zebrafactor的斑马鱼胚胎分选系统,能将胚胎快速分选入96孔板中,还能用于筛选转基因斑马鱼胚胎,最多能在16 h将50 000枚胚胎分配到96孔板中,极大地提高了斑马鱼毒性试验效率[48]。目前,美国霍普金斯大学Isaac Adatto团队整合这些技术,结合他们研发的自动报告定量(ARQiv)高通量筛选平台,能通过酶标仪来检测活斑马鱼胚胎和幼鱼中转基因荧光报告基因强度随时间的变化,构建了一个多功能全生物筛选平台(ARQiv-HTS)。该团队利用转基因斑马鱼Tg(ins:PhiYFP-Eco.NfsB,sst2:TagRFP)对糖尿病治疗药物进行了筛查,其基本流程包括大规模的胚胎繁殖和收集、加药孔板的制备、胚胎的转移和分装、荧光数据扫描读取和数据实时分析等,完成了超过50万只转基因斑马鱼胚胎的药物筛选,确定不同药物对胚胎胰岛素生成细胞的刺激生长[49]。可以预想到,该高通量平台的建成将对斑马鱼高通量毒性测试方法的发展产生深刻的影响,更好地服务于化学品或药物的毒性测试。
6 斑马鱼中高通量毒性测试方法未来的发展趋势和应用前景(Future development trend and application prospect of high-throughput toxicity testing method using zebrafish)
目前的斑马鱼中高通量毒性测试方法大多在96孔板中进行,尽管很难实现如体外细胞毒性测试那样的高通量(384孔或1 536孔),但是斑马鱼活体检测可更真实地揭示化学物质对生物体的毒性效应,这是细胞高通量毒性测试不可比拟的优势。目前,包括ToxCast在内的多项研究中都利用了斑马鱼中高通量方法对大量化学物质的毒性进行筛查,发现所得数据的变异系数和置信区间都较小,显示这一模式生物的高通量毒性测试方法具有很好的稳健性和重复性[3,7,10]。但是,目前已有的斑马鱼高通量毒性测试方法还有一些问题需要解决。
(1)基于孔板的斑马鱼仔鱼急性毒性测试方法是否可以替代标准的成鱼急性毒性测试方法还需要更多的数据论证。从现有的文献数据来看,使用12 dpf的仔鱼有望更敏感地检出化学物质包括神经毒物对斑马鱼的急性毒性[17],但是尚需用更多已知的神经毒性物质进行验证。另外,还需要对具体的测试条件开展标准化的研究。
(2)目前斑马鱼试验的自动化设备尚不普及,市场上已有的图像自动分析系统比较昂贵,很大程度上限制了斑马鱼高通量测试方法在毒性测试中的应用。未来需要大力开发更实用的自动化设备和图像分析系统,以提高斑马鱼高通量毒性测试的效率。
(3)形态学指标虽然可以直观地表征化学物质对斑马鱼发育的损伤,但是要更敏感地检出化学物质的发育毒性还需要发展更精细的基于分子或者信号通路的测试指标。南京大学张效伟团队曾开发一套斑马鱼简化转录组方法,其核心是选择1 637个基因为目标基因,对暴露后的斑马鱼胚胎进行转录组测序,根据结果拟合计算各个效应基因和生物学富集通路的毒性起始浓度点,并对可能的关键事件进行分析[50-51]。这一基于转录组信息的方法比基于形态学改变的方法具有更高的敏感性,未来如果能够形成低成本、自动化的商业芯片将会大大拓展其应用前景。
尽管目前的斑马鱼中高通量毒性测试方法还有一些问题需要解决,但可以预见,这些方法在对大量化学品毒性筛查工作中具有广阔的应用前景。尤其在我国正在推进的“新污染物治理行动”中,从众多的新污染物尤其是污染场地污染物中筛查具有高毒性的物质,斑马鱼的中高通量毒性测试方法有望发挥重要作用。目前至少可以利用斑马鱼中高通量测试方法对大量化学物质或者新污染物进行毒性筛查,然后根据毒性大小进行后续深入危害评估的优先级排序,以提升新污染物筛查评估的效率。随着斑马鱼高通量毒性测试方法不断的发展和优化,其在化学物质毒性筛查和风险评估中将发挥越来越重要作用。
[1] Attene-Ramos M S, Miller N, Huang R L, et al. The Tox21 robotic platform for the assessment of environmental chemicals: From vision to reality [J]. Drug Discovery Today, 2013, 18(15-16): 716-723
[2] Richard A M, Huang R L, Waidyanatha S, et al. The Tox21 10K compound library: Collaborative chemistry advancing toxicology [J]. Chemical Research in Toxicology, 2021, 34(2): 189-216
[3] Jeong J, Kim D, Choi J. Application of ToxCast/Tox21 data for toxicity mechanism-based evaluation and prioritization of environmental chemicals: Perspective and limitations [J]. Toxicology in Vitro, 2022, 84: 105451
[4] Bambino K, Chu J. Zebrafish in toxicology and environmental health [J]. Current Topics in Developmental Biology, 2017, 124: 331-367
[5] Horzmann K A, Freeman J L. Making waves: New developments in toxicology with the zebrafish [J]. Toxicological Science, 2018, 163(1): 5-12
[6] Howe K, Clark M D, Torroja C F, et al. The zebrafish reference genome sequence and its relationship to the human genome [J]. Nature, 2013, 496(7446): 498-503
[7] Mao Y S, Hong K, Liao W, et al. Generation of a novel transgenic zebrafish for studying adipocyte development and metabolic control [J]. International Journal of Molecular Sciences, 2021, 22(8): 3994
[8] Yang Z, Chen S H, Xue S L, et al. Generation of Cas9 transgenic zebrafish and their application in establishing an ERV-deficient animal model [J]. Biotechnology Letters, 2018, 40(11): 1507-1508
[9] Udvadia A J, Linney E. Windows into development: Historic, current, and future perspectives on transgenic zebrafish [J]. Developmental Biology, 2003, 256(1): 1-17
[10] Lai K P, Gong Z Y, Tse W K F. Zebrafish as the toxicant screening model: Transgenic and omics approaches [J]. Aquatic Toxicology, 2021, 234: 105813
[11] Organization for Economic Cooperation and Development (OECD). OECD guidelines for the testing of chemicals, section 2: Effects on biotic systems test No. 203: Acute toxicity for fish [R]. Paris: OECD, 2019
[12] Strähle U, Scholz S, Geisler R, et al. Zebrafish embryos as an alternative to animal experiments: A commentary on the definition of the onset of protected life stages in animal welfare regulations [J]. Reproductive Toxicology, 2012, 33(2): 128-132
[13] Belanger S E, Rawlings J M, Carr G J. Use of fish embryo toxicity tests for the prediction of acute fish toxicity to chemicals [J]. Environmental Toxicology and Chemistry, 2013, 32(8): 1768-1783
[14] Braunbeck T, Kais B, Lammer E, et al. The fish embryo test (FET): Origin, applications, and future [J]. Environmental Science and Pollution Research, 2015, 22(21): 16247-16261
[15] Lammer E, Carr G J, Wendler K, et al. Is the fish embryo toxicity test (FET) with the zebrafish (Danio rerio) a potential alternative for the fish acute toxicity test? [J]. Comparative Biochemistry and Physiology Toxicology &Pharmacology, 2009, 149(2): 196-209
[16] Sobanska M, Scholz S, Nyman A M, et al. Applicability of the fish embryo acute toxicity (FET) test (OECD 236) in the regulatory context of Registration, Evaluation, Authorisation, and Restriction of Chemicals (REACH) [J]. Environmental Toxicology and Chemistry, 2018, 37(3): 657-670
[17] Kämmer N, Erdinger L, Braunbeck T. The onset of active gill respiration in post-embryonic zebrafish (Danio rerio) larvae triggers an increased sensitivity to neurotoxic compounds [J]. Aquatic Toxicology, 2022, 249: 106240
[18] Hu G, Siu S O, Li S, et al. Metabolism of calycosin, an isoflavone from Astragali radix, in zebrafish larvae [J]. Xenobiotica, 2012, 42(3): 294-303
[19] Wang Y H, Lv L, Yu Y J, et al. Single and joint toxic effects of five selected pesticides on the early life stages of zebrafish (Danio rerio) [J]. Chemosphere, 2017, 170: 61-67
[20] Xiong Y M, Chen X Y, Li F, et al. Zebrafish larvae acute toxicity test: A promising alternative to the fish acute toxicity test [J]. Aquatic Toxicology, 2022, 246: 106143
[21] Zhang G Z, Roell K R, Truong L, et al. A data-driven weighting scheme for multivariate phenotypic endpoints recapitulates zebrafish developmental cascades [J]. Toxicology and Applied Pharmacology, 2017, 314: 109-117
[22] Hamm J T, Ceger P, Allen D, et al. Characterizing sources of variability in zebrafish embryo screening protocols [J]. ALTEX, 2019, 36(1): 103-120
[23] Malev O, ![]() S, Sima Cota A, et al. Combining short-term bioassays using fish and crustacean model organisms with ToxCast in vitro data and broad-spectrum chemical analysis for environmental risk assessment of the river water (Sava, Croatia) [J]. Environmental Pollution, 2022, 292(Pt B): 118440
S, Sima Cota A, et al. Combining short-term bioassays using fish and crustacean model organisms with ToxCast in vitro data and broad-spectrum chemical analysis for environmental risk assessment of the river water (Sava, Croatia) [J]. Environmental Pollution, 2022, 292(Pt B): 118440
[24] Mikut R, Dickmeis T, Driever W, et al. Automated processing of zebrafish imaging data: A survey [J]. Zebrafish, 2013, 10(3): 401-421
[25] Chen C Y, Gu Y Y, Philippe J, et al. Acoustofluidic rotational tweezing enables high-speed contactless morphological phenotyping of zebrafish larvae [J]. Nature Communications, 2021, 12(1): 1118
[26] Dong G Q, Wang N, Xu T, et al. Deep learning-enabled morphometric analysis for toxicity screening using zebrafish larvae [J]. Environmental Science &Technology, 2023, 57(46): 18127-18138
[27] Silva Brito R, Canedo A, Farias D, et al. Transgenic zebrafish (Danio rerio) as an emerging model system in ecotoxicology and toxicology: Historical review, recent advances, and trends [J]. The Science of the Total Environment, 2022, 848: 157665
[28] Colborn T D. Our Stolen Future [M]. New York: Penguin Books, 1996: 20-30
[29] Wang H, Tan J T, Emelyanov A, et al. Hepatic and extrahepatic expression of vitellogenin genes in the zebrafish, Danio rerio [J]. Gene, 2005, 356: 91-100
[30] Chen H, Hu J Y, Yang J, et al. Generation of a fluorescent transgenic zebrafish for detection of environmental estrogens [J]. Aquatic Toxicology, 2010, 96(1): 53-61
[31] Mattingly C J, McLachlan J A, Jr Toscano W A. Green fluorescent protein (GFP) as a marker of aryl hydrocarbon receptor (AhR) function in developing zebrafish (Danio rerio) [J]. Environmental Health Perspectives, 2001, 109(8): 845-849
[32] Cooper R, David A, Lange A K, et al. Health effects and life stage sensitivities in zebrafish exposed to an estrogenic wastewater treatment works effluent [J]. Frontiers in Endocrinology, 2021, 12: 666656
[33] Tong S K, Mouriec K, Kuo M W, et al. A cyp19a1b-gfp (aromatase B) transgenic zebrafish line that expresses GFP in radial glial cells [J]. Genesis, 2009, 47(2): 67-73
[34] Poon K L, Wang X G, Lee S G P, et al. Editor’s highlight: Transgenic zebrafish reporter lines as alternative in vivo organ toxicity models [J]. Toxicological Sciences, 2017, 156(1): 133-148
[35] Gu J, Wang H Y, Zhou L J, et al. Oxidative stress in bisphenol AF-induced cardiotoxicity in zebrafish and the protective role of N-acetyl N-cysteine [J]. The Science of the Total Environment, 2020, 731: 139190
[36] Sun M Q, Ding R Y, Ma Y M, et al. Cardiovascular toxicity assessment of polyethylene nanoplastics on developing zebrafish embryos [J]. Chemosphere, 2021, 282: 131124
[37] 顾杰, 郭敏, 吉贵祥, 等. 利用转基因斑马鱼探究四溴联苯醚(BDE-47)的神经毒性作用[J]. 环境监控与预警, 2020, 12(5): 99-104
Gu J, Guo M, Ji G X, et al. Detecting the neurotoxicity effects of 2,2’,4,4’-tetrabromodiphenyl ether using transgenic zebrafish [J]. Environmental Monitoring and Forewarning, 2020, 12(5): 99-104 (in Chinese)
[38] Wang G L, Rajpurohit S K, Delaspre F, et al. First quantitative high-throughput screen in zebrafish identifies novel pathways for increasing pancreatic β-cell mass [J]. eLife, 2015, 4: e08261
[39] Everson J L, Tseng Y C, Eberhart J K. High-throughput detection of craniofacial defects in fluorescent zebrafish [J]. Birth Defects Research, 2023, 115(3): 371-389
[40] Orger M B, de Polavieja G G. Zebrafish behavior: Opportunities and challenges [J]. Annual Review of Neuroscience, 2017, 40: 125-147
[41] Norton W H J. Zebrafish Protocols for Neurobehavioral Research [M]. New York: Springer New York, 2012: 191-203
[42] Franco-Restrepo J E, Forero D A, Vargas R A. A review of freely available, open-source software for the automated analysis of the behavior of adult zebrafish [J]. Zebrafish, 2019, 16(3): 223-232
[43] Hussain A, Audira G, Malhotra N, et al. Multiple screening of pesticides toxicity in zebrafish and Daphnia based on locomotor activity alterations [J]. Biomolecules, 2020, 10(9): 1224
[44] Tombari R J, Mundy P C, Morales K M, et al. Developmental neurotoxicity screen of psychedelics and other drugs of abuse in larval zebrafish (Danio rerio) [J]. ACS Chemical Neuroscience, 2023, 14(5): 875-884
[45] Che X F, Huang Y, Zhong K Y, et al. Thiophanate-methyl induces notochord toxicity by activating the PI3K-mTOR pathway in zebrafish (Danio rerio) embryos [J]. Environmental Pollution, 2023, 318: 120861
[46] Kämmer N, Reimann T, Ovcharova V, et al. A novel automated method for the simultaneous detection of breathing frequency and amplitude in zebrafish (Danio rerio) embryos and larvae [J]. Aquatic Toxicology, 2023, 258: 106493
[47] Adatto I, Lawrence C, Thompson M, et al. A new system for the rapid collection of large numbers of developmentally staged zebrafish embryos [J]. PLoS One, 2011, 6(6): e21715
[48] Zhang X P, Lu Z, Gelinas D, et al. Batch transfer of zebrafish embryos into multiwell plates [J]. IEEE Transactions on Automation Science and Engineering, 2011, 8(3): 625-632
[49] White D, Eroglu A, Wang G, et al. ARQiv-HTS, a versatile whole-organism screening platform enabling in vivo drug discovery at high-throughput rates [J]. Nature Protocol, 2016, 142: 2432-2453
[50] 马聪. 基于剂量-效应简化转录组预测化学品对斑马鱼的胚胎发育毒性[D]. 南京: 南京大学, 2019: 37-47
Ma C. Prediction of chemical-induced embryo toxicity using dose-dependent reduced transcriptomics approach [D]. Nanjing: Nanjing University, 2019: 37-47 (in Chinese)
[51] Gou X, Ma C, Ji H M, et al. Prediction of zebrafish embryonic developmental toxicity by integrating omics with adverse outcome pathway [J]. Journal of Hazardous Materials, 2023, 448: 130958