-
我国红壤面积约为2.1×106 km2,约占全国耕地总面积的22%[1],水稻是红壤区的主要粮食作物。由于工业化快速发展、农药和化肥不合理利用,使土壤中有毒重金属不断积累,对农田土壤造成了污染[2]。目前,我国约有2×105 km2的耕地受到不同程度重金属污染,其中Cd污染的耕地面积约有1.3×105 km2[3],从而对食品安全构成威胁[4]。每年被重金属污染的粮食多达1.2×107 t[5]。红壤由于pH较低,重金属更容易被农作物吸收[1]。因此,降低水稻对镉、铅和铜等重金属的吸收,实现污染红壤的安全利用刻不容缓。
稳定化法(钝化)是一种十分有效的重金属污染农田安全利用方法,具有费用低、操作方便、见效快、可处理复合重金属污染等特点[4]。目前,实际生产中常用的钝化剂包括碱性物质[6]、硅酸盐[7]、黏土矿物[8]、生物炭[9]等。碱性物质主要通过提高土壤pH,使重金属离子形成碳酸盐或氢氧化物沉淀,以降低重金属在土壤中的生物可利用性[6]。韦小了等[10]通过向盆栽土中添加0.82 g·kg−1生石灰,使土壤中可交换态Cd的质量分数显著降低13.08%(p<0.05),稻米中Cd的质量分数显著降低32.33%(p<0.05)。硅酸盐类钝化剂通过与Cd形成硅酸盐络合物降低植物对镉的吸收[7]。沸石、海泡石等黏土矿物稳定性高、比表面积与离子交换量大,具有较强的极性和吸附性。郑荧辉等[11]和PEI等[12]指出沸石和海泡石施用量分别为11 250和15 000 kg·hm−2,使土壤中有效态Cd的质量分数分别降低17.46%和15.2%。有机钝化剂如腐殖酸含有大量的活性官能团,可与土壤中水溶态和可交换态的重金属离子发生络合反应。陆中桂等[13]指出,腐殖酸对Pb和Cd具有很好的吸附效果。DHIMAN等[14]指出,1%聚丙烯酰胺(PAM)可显著提高土壤对Cu、Cd、Zn和Fe的吸附率。然而,目前将PAM用于酸性稻田重金属安全利用的研究尚未见报道。此外,长期大量使用无机钝化药剂对土壤理化性质及微生物多样性和结构会产生不良影响[15]。例如,长期施用石灰会破坏土壤团粒结构,造成土壤板结,进而影响土壤中微生物的活性[8]。而索琳娜等[16]指出,腐殖酸钠和聚丙烯酰胺等高分子有机物料可改善土壤结构、养分和水分状况,起到修复土壤的作用。据此可提出假设:无机钝化剂复配有机物料可以提高重金属钝化效果[14, 17],同时降低无机钝化剂对土壤产生的负面影响。
化学提取可利用性重金属可作为作物对重金属实际吸收情况的重要参考[18]。本研究通过室内筛选实验,对比有机(腐殖酸钠、泥炭和PAM)与无机(海泡石、沸石、针铁矿、生石灰、氢氧化钙、硅酸钙、硅酸钠和硫化亚铁)钝化剂对红壤中Cd、Pb和Cu的钝化效果;并将筛选出的钝化剂复配用于大田实验,评估其在稻谷吸收重金属中发挥的作用及对稻田微生物的影响,以揭示复配药剂对红壤水稻土中Cd、Pb和Cu的主要钝化机理,为酸性红壤水稻田的安全生产提供参考。
-
本研究的试剂包括海泡石、沸石、针铁矿、生石灰、氢氧化钙、硅酸钙、硅酸钠、硫化亚铁、腐殖酸钠、泥炭和PAM,均为分析纯。生石灰(CaO>98%)、腐殖酸钠、沸石、硅酸钙、硅酸钠、硫化亚铁(60.0%< Fe<72.0%)和PAM(非离子型)购自上海阿拉丁生化科技有限公司。氢氧化钙(Ca(OH)2>95%)和海泡石(SiO2>50%,MgO>20%)购自上海麦克林生化有限公司。针铁矿(α-FeO(OH)>98%)和泥炭购自上海源叶生物科技有限公司。
-
本研究的稻田土壤位于江西省吉安市泰和县(114°57′-115°20′E, 26°27′-26°59′N),土壤类型为第四纪红色粘土母质上发育的红壤,当地气候为亚热带湿润季风气候。本研究分为室内筛选和大田试验2部分。室内筛选设置了11种有机和无机钝化剂的钝化实验。无机钝化剂包括海泡石(S)、沸石(Z)、针铁矿(T)、生石灰(Q)、氢氧化钙(C)、硅酸钙(G)、硅酸钠(N)和硫化亚铁(F),有机钝化剂腐殖酸钠(H)、泥炭(P)和PAM(A)。钝化剂均研磨过2 mm筛备用,选用各钝化剂进行处理,每个处理3个平行。具体操作:首先,在200 mL聚乙烯圆盒中加入5 g钝化剂和100 g土壤,混合均匀,加蒸馏水呈淹没状态,采取称重法保持水分培养7 d;之后,将样品置于60 ℃的烘箱内烘干,研磨过2 mm尼龙筛,用于测定pH和有效态重金属的质量分数。
将室内试验中钝化效果较好的钝化剂作为复配钝化剂成分用于大田实验。在不同处理组的稻田中先后施加一定量复配钝化剂的药剂成分,旋耕混合均匀。然后将同一地点育种的杂交籼稻“天优华占”栽种到实验田中。基于当地气候条件,3 ~ 4 d灌溉1次,使之处于持续淹水状态。水稻成熟后采集土壤及相应位点稻米样品。
-
大田实验水稻成熟后,在每个样地采集5个表层土壤(0 ~ 20 cm),混合为1个样品。每个样地采集3个重复土样。取出10 g新鲜土壤样品用于微生物高通量测序。其余土壤样品自然风干,剔除大颗粒和生物碎屑,过2 mm尼龙网筛,待测。土壤基本性质测定参考《土壤农化分析》第三版[19]。在每个土样对应位置收集3个重复的稻米样品。
土壤有效态重金属采用二乙烯三胺五乙酸-氯化钙-三乙醇胺(DTPA-CaCl2-TEA)溶液(pH = 7.30±0.20)浸提,土壤中全量重金属采用HNO3-HClO4-HF法消解,稻米中重金属采用HNO3-HClO4消解,用ICP-MS测定。土壤和稻米分别以红黄壤土壤成分分析标准物质GBW07405(GSS-5)和柑橘叶生物成分分析标准物质GBW10020(GSB-11)进行质量控制[20],土壤样品和植物样品全量消解Cd、Pb和Cu的回收率为95.0% ~ 105.0%。原子吸收光谱法测定Cd、Pb和Cu的检出限分别为0.001、0.010和0.001 μg·mL−1。ICP-MS测定Cd、Pb和Cu的检出限分别为0.03、0.03和0.08 μg·L−1。
-
用CTAB法提取土壤微生物DNA。采用TransGen AP221-02(TransStart Fastpfu DNA Polymerase)和PCR仪(ABI GeneAmP 9700型)进行PCR扩增,并使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物。将PCR产物用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)进行检查定量。通过Miseq测序得到PE reads,根据overlap关系进行拼接,进行OUT聚类分析和物种分类学分析[21]。
-
pH变化率计算如式(1)所示;稻米重金属的降低率计算如式(2)所示。
式中:
$ {\text{pH}}_i $ 为各处理土壤pH值;$ {\text{pH}}_{\text{0}} $ 为对照(CK)的土壤pH值。pH变化率中正值表示土壤pH的增加率,负值表示减少率。式中:
${{R}}_{{i}}$ 为各处理稻米中重金属的降低率;$ {{C}}_{{i}} $ 为各处理稻米中重金属的质量分数,mg·kg−1;$ {{C}}_{{0}} $ 为对照稻谷中重金属的质量分数,mg·kg−1。 -
土壤的基本理化性质:总钾(TK)23.34 g·kg−1、总磷(TP)462.67 mg·kg−1、总氮(TN)2.47 g·kg−1、有机质(SOM)24.37 g·kg−1、阳离子交换容量(CEC)10.40 cmol·kg−1、pH为4.58;土壤中Cd、Pb和Cu的质量分数分别为0.28、36.33和29.92 mg·kg−1,二乙烯三胺五乙酸-氯化钙-三乙醇胺提取态(即有效态)Cd、Pb和Cu的质量分数分别为0.21、6.68和4.89 mg·kg−1。
所有试剂均未检出Cd和Pb。硅酸钠和PAM未检出Cu;海泡石、沸石、针铁矿、生石灰、氢氧化钙、硅酸钙、硫化亚铁、腐殖酸钠和泥炭中Cu的质量分数分别为7.56、6.10、30.23、7.73、6.73、10.72、58.18、13.33和23.17 mg·kg−1。
-
1)无机钝化剂对酸性红壤中有效态重金属质量分数的影响。如表1所示,与对照(CK)相比,海泡石由于比表面积大且天然阳离子交换能力强[22],显著降低了土壤中有效态Cd和Pb的质量分数(p<0.05)。而且,海泡石可以分解成CaCO3,提高土壤pH,增强其对重金属的吸附能力。在Cd污染的酸性稻田中,施用0.75~2.25 kg·m−2海泡石使0.025 mol·L−1 HCl提取Cd的质量分数降低了27.1% ~ 46.6%[15]。针铁矿在铁氧化物的形成过程中或之后,重金属离子被吸附在表面或困在聚集的纳米颗粒之间,从而嵌入矿物结构中[23]。本研究中,针铁矿显著降低了土壤中有效态Cd和Pb的质量分数(p<0.05),但在Fe2+活化再结晶过程初期,针铁矿结构中结合的Cu2+可以还原为Cu+并迅速释放到溶液中,而Cu+不利于再结合[23],导致有效态Cu的质量分数显著增加(p<0.05)。沸石对土壤中有效态Cd的质量分数影响不大(p>0.05)。此外,3种矿物均增加了土壤pH(表1)。考虑到对Cd、Pb和Cu的钝化效果,将矿物钝化剂中的海泡石作为大田实验的一种钝化剂。氢氧化钙和生石灰相似,主要通过提高土壤pH降低土壤重金属的生物有效性[24]。硫化亚铁可将吸附的阳离子重金属转化为硫化物,作用机制类似于置换反应[25]。硫化亚铁显著降低了土壤有效态Pb和Cu的质量分数(p<0.05),但对有效态Cd的质量分数影响不大(p>0.05)。这可能是因为,Pb2+和Cu2+更容易取代FeS中的铁原子生成稳定的硫化物沉淀。硅酸盐作为土壤重金属钝化剂的研究已有较多报道[7, 26],然而本研究中硅酸钠和硅酸钙对土壤重金属的钝化效果并不理想。除硫化亚铁外,其它钝化剂均增加了土壤pH(表1),其中生石灰对土壤pH增加效果最强。考虑到当环境氧气浓度变化时,金属硫化物有再释放的风险,以及结合考虑成本,所以将生石灰作为大田试验的复配钝化剂成分之一。
2)有机钝化剂对酸性红壤中有效态重金属质量分数的影响。3种有机钝化剂对土壤中有效态重金属质量分数的影响见表1。与CK相比,PAM使土壤中有效态Cd、Pb和Cu的质量分数分别显著降低了89.2%、99.1%和92.4%(P<0.05)。PAM所含—CONH2的N原子带有孤对电子,能通过络合作用吸附重金属离子[27]。泥炭和腐殖酸钠处理对土壤有效态Cd的质量分数的影响均不显著(P>0.05)。陈月芳等[28]指出,泥炭中含有大量有机质和腐殖酸。腐殖酸类物质是带负电荷的大分子胶体,其阳离子交换能力强。然而,酸性土壤中含有大量的H+,与可交换性重金属阳离子之间存在激烈竞争,这可能导致重金属离子在腐殖酸上的离子交换容量和亲和力降低[29]。YU等[30]也指出,腐殖酸类改良剂对土壤中交换性Cd质量分数的降低效果不持久。根据钝化效果,将PAM作为大田实验的复配钝化剂的成分之一。
综上所述,海泡石、生石灰和聚丙烯酰胺分别使土壤中有效态Cd、Pb和Cu的质量分数降低32.4%~89.2%、19.5%~99.1%和49.4%~92.4%,故将他们确定为复配钝化剂的成分用于大田实验。
-
1)复配钝化剂对酸性红壤化学性质的影响。复配钝化剂种类和用量对大田实验的土壤化学性质的影响见表2。与对照(CK)相比,各复配钝化剂对土壤pH均有所提高。T1显著提高了土壤pH(P< 0.05)。这与大多研究结果一致[31]。与CK相比,钝化剂处理降低了土壤TN、TP和SOM。PAM、石灰和海泡石在一定条件下可以促进土壤硝化作用[32-33],而硝酸盐易随水流失,可能降低土壤TN。石灰可能会降低土壤水溶性磷[34]。另外,PAM表施可促进有机碳保护,并可能增加有机碳储量[35],而生石灰会促进土壤有机质矿化[36]。与T1相比,T3处理土壤中有机质的质量分数较低。这说明PAM对本研究的土壤有机质并没有起到保护作用。与CK相比,钝化剂处理对土壤CEC(除了T3)和TK没有显著影响。其中,T4对土壤化学性质影响最小。
2)复配钝化剂对酸性红壤中有效态重金属质量分数的影响。大田实验的土壤中有效态Cd、Pb和Cu的质量分数变化见图1。与CK相比,T1、T2和T4使土壤中有效态Cd,Pb和Cu的质量分数显著降低(P<0.05)。海泡石和生石灰组合对土壤重金属钝化的主要机制是生石灰和海泡石中的Ca2+与重金属离子发生交换或络合作用[9, 23, 32]。在本研究中,T3对土壤有效态Pb和Cu的质量分数影响不显著(P>0.05),这可能是由于生石灰或海泡石用量较少。与T1相比,T2可显著降低土壤有效态Cd和Cu的质量分数(P<0.05)。这表明生石灰和PAM复配对土壤重金属的钝化作用强于单一生石灰。与T3相比,T2、T4对土壤中Cd、Pb和Cu的钝化效果更好。这表明PAM对土壤中重金属的钝化作用强于海泡石。
土壤中有效态重金属的质量分数与土壤化学性质(TP、TN、pH、SOM、CEC、TK)之间的相关性如表3所示。土壤中有效态Pb的质量分数与pH呈显著负相关(p<0.01),有效态Cd和Cu的质量分数与TP呈显著正相关(p<0.05)。有研究者指出,pH是水稻土重金属有效性的关键调控因子之一[37]。值得注意的是,T2土壤中有效态Cd的质量分数显著低于T1,而T1土壤pH却高于T2,且土壤有效态Cd的质量分数与pH无显著相关性。这说明PAM对重金属的络合作用是影响水稻土中重金属有效性的关键因素。另外,JIN等[35]指出,磷酸盐改性剂对土壤中重金属的固定和稳定具有积极作用,水溶性磷酸盐可与土壤中重金属离子反应生成不溶性磷酸盐化合物。这一结果表明,施用复合钝化剂的土壤中磷与重金属之间存在相互作用。
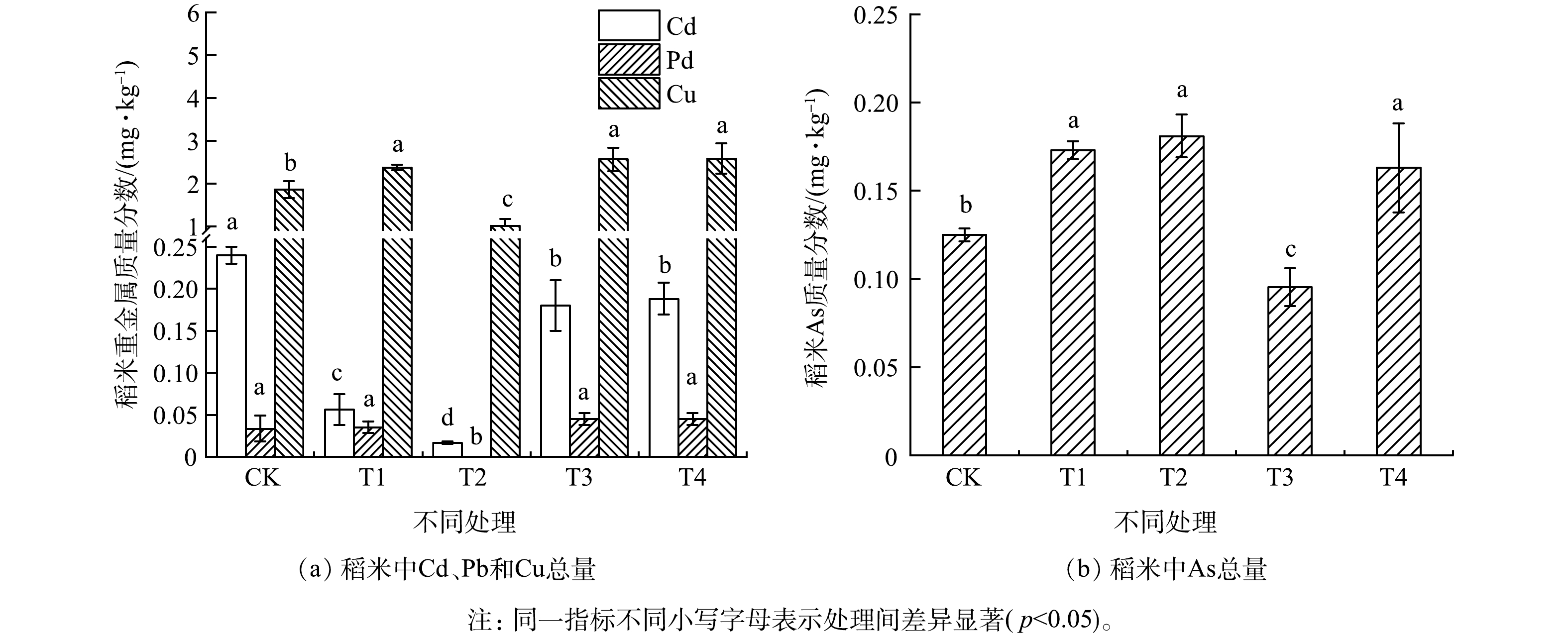
3)复配钝化剂对稻米吸收重金属的影响。复配钝化剂对稻米中重金属质量分数的影响如图2所示。复配钝化剂可有效降低水稻对Cd的吸收,与CK相比,T1、T2、T3和T4分别使稻米中Cd的质量分数显著降低了76.7%、93.1%、25.0%和21.7%(p<0.05),其中,T2效果最佳。国家食品安全标准(GB2762-2017)规定,稻米中Cd的质量分数限值为0.20 mg·kg−1[38]。CK处理组稻米中Cd的质量分数高于该标准规定的限值。而钝化剂处理均使稻米中Cd的质量分数低于国家食品安全标准规定的限值。WU等[39]指出,使用石灰和海泡石复配钝化剂可降低糙米中Cd的质量分数。但在本研究中,与T1相比,T3处理组稻米中Cd的质量分数显著提高(p<0.05),这说明生石灰复配海泡石在本研究没有起到很好的作用。史磊等[31]也指出,在轻度和中度Cd污染稻田土壤中,石灰和海泡石复配钝化与单一石灰钝化对糙米中Cd质量分数的影响没有显著差异。另外,T2处理使稻米中Pb和Cu的质量分数分别显著降低了100.0%和45.3%(P<0.05)。综上所述,生石灰和PAM复配钝化剂最有效地降低了稻米对Cd、Pb和Cu的吸收。T1、T3和T4处理组稻米中Cu的质量分数增加,可能是由于投加的生石灰和海泡石中含有Cu(见2.1部分)。经过复配钝化剂处理后,水稻中Cd的质量分数达标,其余重金属(Cu和Pb)的质量分数也未出现超标现象。考虑到pH升高可能增加稻谷对类金属As的吸收,为此测定了稻米中As的质量分数,结果如图2(b)所示。各处理组稻米中As的质量分数均低于国家食品安全限值(0.20 mg·kg−1)。
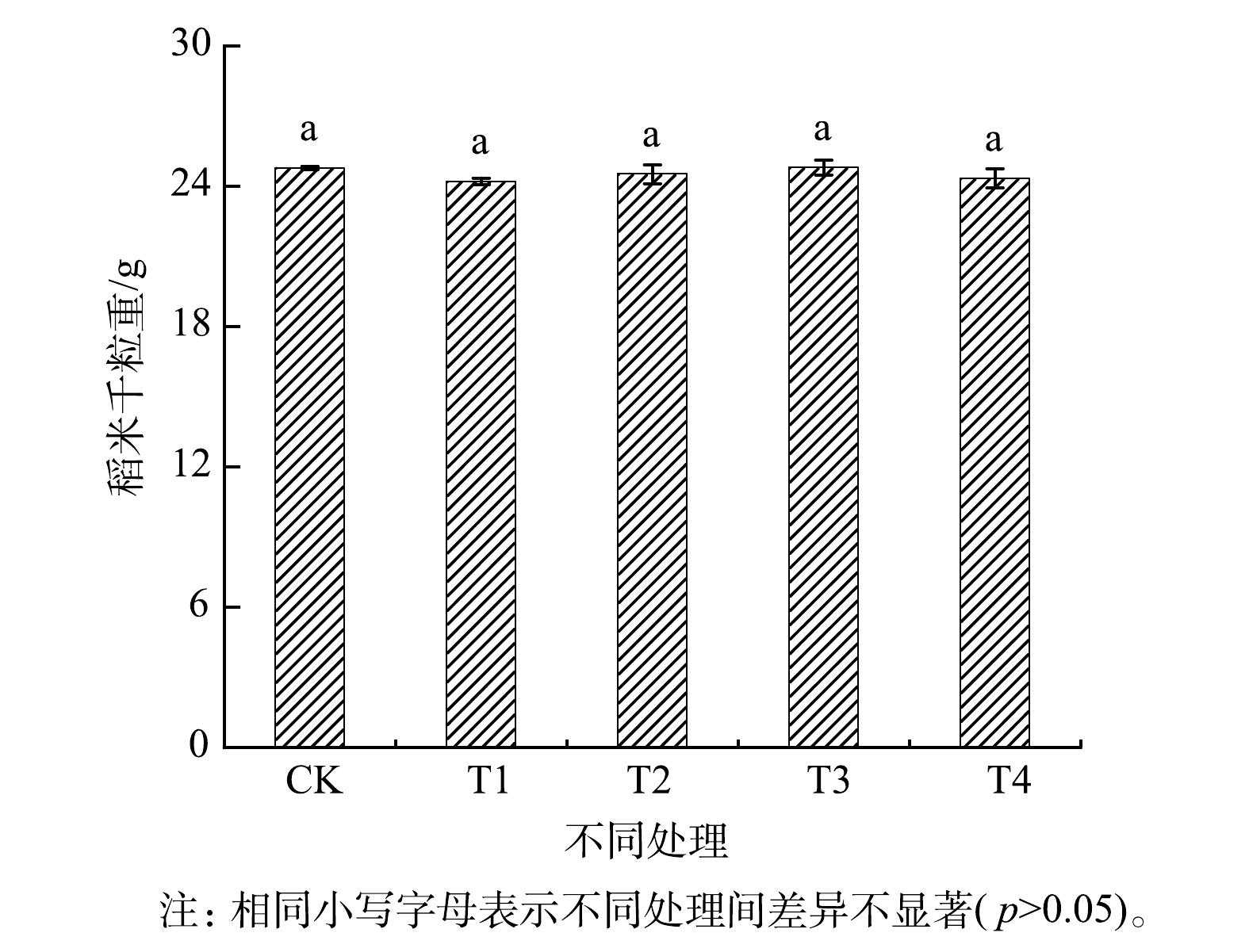
土壤中有效态重金属与水稻中重金属的质量分数的相关性分析结果如表3所示。稻米中重金属的质量分数与土壤中有效态重金属的质量分数之间相关性不显著(P>0.05)。这表明化学提取所表示的土壤中重金属的可利用性并不能准确预测红壤所种植水稻对重金属的实际吸收[1, 36]。由图3可知,与CK相比,施加钝化剂对稻米产量未呈现出显著的影响。有研究者报道,用生石灰对土壤进行为期4 a的处理也有类似的结果[40]。
-
细菌的丰富度主要由Chao和ACE描述,而多样性(均匀度)主要由Shannon 和Simpson 指数描述(表4)。与对照相比,T1、T2、T3和T4处理组中Chao、ACE、Shannon 和Simpson指数均没有显著变化(P> 0.05)。这说明各复配钝化剂对土壤微生物丰富度和多样性没有显著影响。
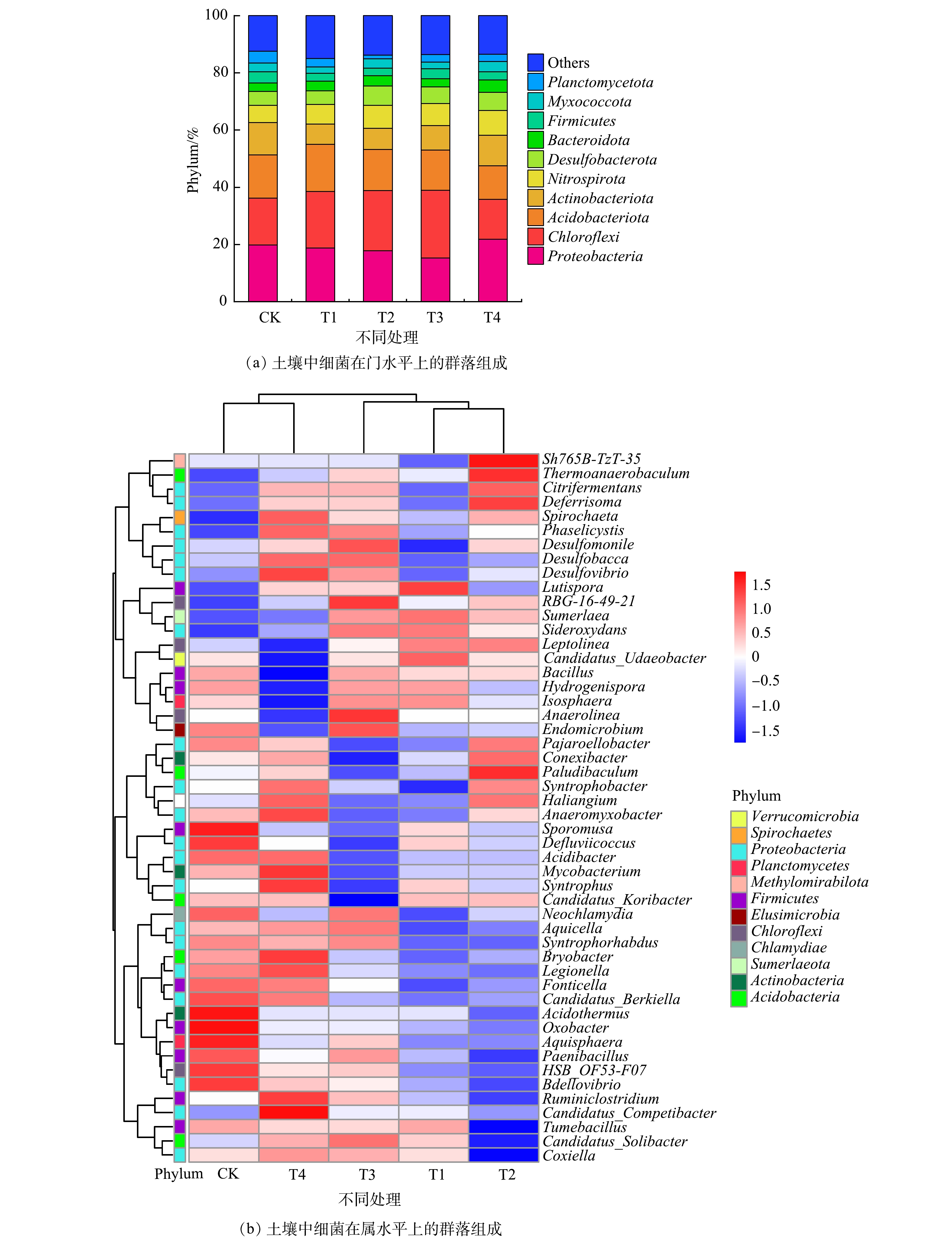
图4(a)为复合钝化剂对水稻土中细菌群落在门水平上的影响。对照和复合钝化剂处理土壤中主要门类细菌包括Proteobacteria、Chloroflexi和Acidobacteriota,共占47.6%~55.1%。WEN等[41]也发现Proteobacteria和Acidobacteria是中国南方酸性红壤土的优势菌门。与CK相比,T1、T2和T3使Chloroflexi的相对丰度增加了14.6%~45.2%。AZARBAD等[42]指出,Chloroflexi可能在受重金属污染的土壤中发挥重要作用。T1、T2、T3和T4使Actinobacteria降低了6.6%~37.8%,该结果与ZHENG等[43]报道的结果一致。T2、T3和T4使Acidobacteriota相对丰度略微降低,这是因为土壤pH增加对Acidobacteriota生存不利[15]。复配钝化剂处理的土壤中Chloroflexi有所增加,同时,Acidobacteriota和Actinobacteria受到抑制。在属水平上(图4(b)),CK与T4处理组土壤中细菌属群落结构相似,T1、T2和T3处理组土壤中细菌属群落结构相似。各处理的优势属均为Haliangium、Desulfobacca、Anaeromyxobacter和Spirochaeta。这些结果表明:与CK相比,T4对土壤中细菌属群落结构没有明显的影响,T1、T2和T3使土壤中细菌属群落结构有所改变。
-
1)各复配钝化剂均降低了土壤中有效态重金属的质量分数,其主要机制是离子交换和络合作用。“生石灰+聚丙烯酰胺+海泡石”复配钝化剂对土壤中Cd、Pb和Cu的钝化效果最好,且对土壤化学性质的影响最小。
2)各处理使稻米中Cd的质量分数均显著降低(P<0.05),重金属的质量分数均符合国家食品安全标准。“生石灰+聚丙烯酰胺”复配钝化剂能最有效地降低稻米Cd、Pb和Cu的吸收。
3)T4对土壤中细菌属群落结构没有明显影响,这表明其对土壤微生物群落的的负面影响较小。
复配钝化剂对稻田重金属有效性及其水稻吸收的影响
Effects of combined passivators on the availability of heavy metals in red paddy soil and their uptake by rice
-
摘要: 针对红壤稻米中重金属Cd超标的问题,通过筛选钝化剂并将其复配用于大田实验,以研究复配钝化剂对土壤有效态重金属(Cd、Pb和Cu)及水稻吸收重金属的影响及其作用机理。室内筛选实验表明,在11种无机和有机钝化剂中,海泡石、生石灰和聚丙烯酰胺对土壤重金属钝化效果较好,使有效态Cd、Pb和Cu分别降低了32.4% ~ 89.2%、19.5% ~ 99.1%和49.4% ~ 92.4%,并将它们确定为复配钝化剂的成分。大田实验结果表明,生石灰、聚丙烯酰胺和海泡石复配对土壤中重金属钝化效果最佳,使有效态Cd、Pb和Cu分别降低了28.6%、20.2%和23.5%(p<0.05),其钝化机制为离子交换和络合作用。而且,该复配钝化剂对土壤化学性质影响最小。复配钝化剂使稻米中Cd的质量分数降低了21.7% ~ 93.1%(p<0.05)。另外,复配钝化剂对土壤微生物丰度和多样性没有显著影响。考虑到土壤的安全性和稳定性,推荐将生石灰、聚丙烯酰胺和海泡石复配钝化剂用于降低红壤稻米对Cd的吸收以确保粮食安全生产。本研究结果可为重金属污染红壤稻田的安全利用提供参考。Abstract: To solve the problem of Cd in rice over the food-safe standard, the combined passivators were selected and used in field experiments to explore the effects of the combined passivators on the available heavy metals (Cd, Pb and Cu) in soil and their uptake by rice in red paddy soil. Sepiolite, quicklime and polyacrylamide were used as the components of the combined passivators in field experiment, because laboratory screening results showed that they decreased available Cd, Pb and Cu by 32.4%~89.2%, 19.5%~99.1% and 49.4%~92.4%, respectively. Field experiment results showed that the combination of quicklime, polyacrylamide and sepiolite had the best passivation effect on heavy metals in soil, decreasing the concentrations of available Cd, Pb and Cu by 28.6%, 20.2% and 23.5%, respectively (p<0.05). The passivation mechanism of this combined passivator was ion exchange and complexation. This combine passivator had less impact on soil chemical properties than other combined passivators. The combined passivators decreased the concentration of Cd in rice by 21.7%~93.1% as compared with the control (p<0.05). In addition, the combined passivators had no significant effect on the abundance and diversity of soil microorganisms. Considering the safety and stability of soil, the combination of quicklime, polyacrylamide and sepiolite was the primary recommendation to decrease Cd content of rice in red paddy soil. The research results can provide a basis for the safe utilization of heavy metals-contaminated red paddy soil.
-
Key words:
- red soil /
- rice /
- heavy metal /
- combined passivators
-

-
表 1 不同钝化剂对土壤中有效态重金属质量分数和土壤pH的影响
Table 1. Effects of different passivators on the concentrations of available heavy metals in soil and soil pH
钝化剂种类 处理组 钝化剂 CdSA /(mg·kg−1) PbSA /(mg·kg−1) CuSA /(mg·kg−1) pH pH变化率/% CK — 0.17 ± 0.02 ab 6.20 ± 0.07 b 5.73 ± 0.12 cd 5.58 — 无机钝化剂 5S 海泡石 0.12 ± 0.01 d 3.52 ± 0.33 d 5.88 ± 0.64 cd 7.25 29.98 5Z 沸石 0.16 ± 0.01 bc 3.98 ± 0.30 cd 6.33 ± 0.73 bc 7.55 35.40 5T 针铁矿 0.10 ± 0.01 de 3.32 ± 0.21 d 6.86 ± 0.16 b 7.03 25.90 5Q 生石灰 0.10 ± 0.01 de 4.99 ± 1.76 c 2.90 ± 0.19 f 11.00 97.21 5C 氢氧化钙 0.09 ± 0.01 e 5.97 ± 0.40 b 4.07 ± 0.77 e 10.56 89.32 5G 硅酸钙 0.15 ± 0.01 c 3.21 ± 0.27 d 6.05 ± 0.38 cd 7.12 27.66 5N 硅酸钠 0.17 ± 0.01 abc 6.97 ± 0.27 b 7.07 ± 0.47 b 9.72 74.25 5F 硫化亚铁 0.16 ± 0.02 bc 2.20 ± 0.14 e 3.36 ± 0.10 ef 4.81 −13.78 有机钝化剂 5H 腐殖酸钠 0.20 ± 0.01 a 8.23 ± 0.32 a 8.21 ± 0.29 a 7.30 30.80 5P 泥炭 0.16 ± 0.02 bc 4.05 ± 0.31 cd 5.50 ± 0.37 d 6.03 8.10 5A PAM 0.02 ± 0.01 f 0.05 ± 0.09 f 0.44 ± 0.17 g 5.28 −5.31 注: SA表示土壤有效态重金属的质量分数;同列不同小写字母表示处理间差异显著(P<0.05)。 表 2 复配钝化剂种类和用量对大田土壤化学性质的影响
Table 2. Effects of combined passivators and dosage on chemical properties of field soil
处理组 钝化剂 用量/
(kg·ha−1)pH TN /
(g·kg−1)TP /
(mg·kg−1)TK /
(g·kg−1)SOM /
(g·kg−1)CEC /
(cmol·kg−1)CK 无 0 4.58±0.08b 2.47±0.13a 462.67±18.5a 23.34±0.07a 27.25±1.34a 10.40±0.46a T1 生石灰 1 875 5.68±0.80a 2.17±0.07bc 441.67±48.95ab 23.33±0.20a 22.47±0.95bc 9.96±0.21ab T2 生石灰+PAM 1 500+375 5.29±0.22ab 1.96±0.18c 344.67±39.11c 23.88±0.69a 19.35±0.78c 10.07±0.57a T3 生石灰+海泡石 1 500+975 5.05±0.16ab 2.07±0.04bc 429.67±33.65ab 25.45±1.26a 21.07±0.59bc 8.72±0.68b T4 生石灰+PAM+海泡石 1 500+150+750 5.39±0.60ab 2.27±0.18ab 317.50±12.02c 24.28±1.51a 22.95±0.49ab 10.90±0.10a 注:同列不同小写字母表示处理间差异显著(p<0.05)。 表 3 土壤理化性质、有效态重金属与水稻重金属质量分数之间的相关性分析
Table 3. Correlation analysis among soil chemical properties, availability of heavy metals in soil, and heavy metals in rice
组别 TP TN SOM CEC TK pH CdSA PbSA CuSA CdRT PbRT CuRT TP 1.000 TN 0.394 1.000 SOM 0.519 0.986** 1.000 CEC −0.447 0.501 0.411 1.000 TK −0.191 −0.426 −0.458 −0.654 1.000 pH −0.421 −0.537 −0.607 0.079 −0.058 1.000 CdSA 0.914* 0.638 0.722 −0.093 −0.443 −0.294 1.000 PbSA 0.536 0.567 0.645 −0.156 0.070 −0.989** 0.407 1.000 CuSA 0.890* 0.596 0.693 −0.363 0.006 −0.735 0.798 0.826 1.000 CdRT 0.280 0.787 0.758 0.107 0.211 −0.706 0.350 0.734 0.658 1.000 PbRT 0.272 0.497 0.433 −0.112 0.361 −0.056 0.394 0.149 0.431 0.697 1.000 CuRT 0.161 0.288 0.211 −0.165 0.409 0.205 0.282 −0.109 0.234 0.483 0.962** 1.000 注:SA代表土壤有效态重金属的质量分数;RT代表稻米中重金属的质量分数;*表示p<0.05、**表示p<0.01。 表 4 土壤中细菌的α-多样性
Table 4. α-diversity of bacteria in soil
处理组 ACE Chao Shannon Simpson CK 5 345.80 ± 42.11 a 5 309.01 ± 128.82 a 6.73 ± 0.06 a 0.004 ± 0.000 a T1 5 196.84 ± 879.96 a 4 926.52 ± 425.03 a 6.70 ± 0.13 a 0.004 ± 0.000 a T2 4 968.82 ± 225.61 a 5 029.53 ± 218.62 a 6.80 ± 0.04 a 0.004 ± 0.000 a T3 5 349.96 ± 266.12 a 5 278.47 ± 215.06 a 6.82 ± 0.08 a 0.004 ± 0.000 a T4 5 693.74 ± 885.39 a 5 317.95 ± 315.03 a 6.77 ± 0.14 a 0.004 ± 0.001 a 注:同列相同小写字母表示不同处理间无显著差异(P> 0.05)。 -
[1] CHEN G, SHAH K J, SHI L, et al. Red soil amelioration and heavy metal immobilization by a multi-element mineral amendment: Performance and mechanisms[J]. Environmental Pollution, 2019, 254: 112964. doi: 10.1016/j.envpol.2019.112964 [2] GUO Y K, MAO K, CAO H R, et al. Exogenous selenium (cadmium) inhibits the absorption and transportation of cadmium (selenium) in rice[J]. Environmental Pollution, 2021, 268: 115829. doi: 10.1016/j.envpol.2020.115829 [3] XU Y, LIANG X F, XU Y M, et al. Remediation of heavy metal-polluted agricultural soils using clay minerals: A review[J]. Pedosphere, 2017, 27(2): 193-204. doi: 10.1016/S1002-0160(17)60310-2 [4] ZHAO H, HUANG X, LIU F, et al. A two-year field study of using a new material for remediation of cadmium contaminated paddy soil[J]. Environmental Pollution, 2020, 263: 114614. doi: 10.1016/j.envpol.2020.114614 [5] 何舞, 王富华, 杜应琼, 等. 东莞市土壤重金属污染现状、污染来源及防治措施[J]. 广东农业科学, 2010, 37(4): 211-–213 [6] 曾晓舵, 王向琴, 凃新红, 等. 农田土壤重金属污染阻控技术研究进展[J]. 生态环境学报, 2019, 28(9): 1900-1906. [7] ZHAO Y, LIU M, GUO L, et al. Influence of silicon on cadmium availability and cadmium uptake by rice in acid and alkaline paddy soils[J]. Journal of Soils and Sediments, 2020, 20(5): 2343-2353. doi: 10.1007/s11368-020-02597-0 [8] 鄢德梅, 郭朝晖, 黄凤莲, 等. 钙镁磷肥对石灰、海泡石组配修复镉污染稻田土壤的影响[J]. 环境科学, 2020, 41(3): 1491-1497. [9] 刘振刚, 夏宇, 孟芋含, 等. 生物质炭材料修复重金属污染土壤的研究进展: 修复机理及研究热点分析[J]. 环境工程学报, 2021, 15(4): 1140-1148. doi: 10.12030/j.cjee.202012051 [10] 韦小了, 牟力, 付天岭, 等. 不同钝化剂组合对水稻各部位吸收积累Cd及产量的影响[J]. 土壤学报, 2019, 56(4): 883-894. doi: 10.11766/trxb201810120516 [11] 郑荧辉, 熊仕娟, 徐卫红, 等. 纳米沸石对大白菜镉吸收及土壤有效镉含量的影响[J]. 农业环境科学学报, 2016, 35(12): 2353-2360. doi: 10.11654/jaes.2016-0717 [12] PEI P, SUN Y, WANG L, et al. In-situ stabilization of Cd by sepiolite co-applied with organic amendments in contaminated soils[J]. Ecotoxicology and Environmental Safety, 2021, 208: 111600. doi: 10.1016/j.ecoenv.2020.111600 [13] 陆中桂, 黄占斌, 李昂, 等. 腐植酸对重金属铅镉的吸附特征[J]. 环境科学学报, 2018, 38(9): 3721-3729. [14] DHIMAN J, PRASHER S O, ELSAYED E, et al. Heavy metal uptake by wastewater irrigated potato plants grown on contaminated soil treated with hydrogel based amendments[J]. Environmental Technology & Innovation, 2020, 19: 100952. [15] WANG F, ZHANG W W, MIAO L J, et al. The effects of vermicompost and shell powder addition on Cd bioavailability, enzyme activity and bacterial community in Cd-contaminated soil: a field study [J]. Ecotoxicology and Environmental Safety, 2021, 215: 112163 [16] 索琳娜, 马杰, 刘宝存, 等. 土壤调理剂应用现状及施用风险研究[J]. 农业环境科学学报, 2021, 40(6): 1141-1149. doi: 10.11654/jaes.2021-0364 [17] LIANG X, HAN J, XU Y, et al. In situ field-scale remediation of Cd polluted paddy soil using sepiolite and palygorskite[J]. Geoderma, 2014, 235: 9-18. [18] ZHANG G X, GUO X F, ZHAO Z H, et al. Effects of biochars on the availability of heavy metals to ryegrass in an alkaline contaminated soil[J]. Environmental Pollution, 2016, 218: 513-522. doi: 10.1016/j.envpol.2016.07.031 [19] 鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000 [20] 周嗣江, 刘针延, 熊双莲, 等. 同步钝化土壤Cd和As材料的筛选[J]. 环境科学, 2021, 42(7): 3527-3534. [21] ZHANG G X, HE L X, GUO X F, et al. Mechanism of biochar as a biostimulation strategy to remove polycyclic aromatic hydrocarbons from heavily contaminated soil in a coking plant[J]. Geoderma, 2020, 375: 114497. doi: 10.1016/j.geoderma.2020.114497 [22] HAMID Y, TANG L, HUSSAIN B, et al. Adsorption of Cd and Pb in contaminated gleysol by composite treatment of sepiolite, organic manure and lime in field and batch experiments[J]. Ecotoxicology and Environmental Safety, 2020, 196: 110539. doi: 10.1016/j.ecoenv.2020.110539 [23] SHI M Q, MIN X B, KE Y, et al. Recent progress in understanding the mechanism of heavy metals retention by iron (oxyhydr) oxides[J]. Science of The Total Environment, 2021, 752: 141930. doi: 10.1016/j.scitotenv.2020.141930 [24] 张迪, 吴晓霞, 丁爱芳, 等. 生物炭和熟石灰对土壤镉铅生物有效性和微生物活性的影响[J]. 环境化学, 2019, 38(11): 2526-2534. [25] 王俊伟, 杜俊逸, 桂梦瑶, 等. 氧化环境中FeS修复重金属的稳定性变化与机制[J]. 环境科学学报, 2020, 40(2): 562-573. [26] GONG H B, TAN Z X, HUANG K, et al. Mechanism of cadmium removal from soil by silicate composite biochar and its recycling[J]. Journal of Hazardous Materials, 2021, 409: 125022. doi: 10.1016/j.jhazmat.2020.125022 [27] MIAO J, GUO Z, WANG Y, et al. Application progress on adsorption of heavy metal ions using polyacrylamide composite materials[J]. Petrochemical Technology, 2017, 46(12): 1558-1565. [28] 陈月芳, 彭焕玲, 侯荣荣, 等. 改性泥炭对Pb(II)和Cd(II)的单一及竞争吸附研究[J]. 应用化工, 2019, 48(2): 243-247. doi: 10.3969/j.issn.1671-3206.2019.02.001 [29] YANG K, MIAO G F, WU W H, et al. Sorption of Cu2+ on humic acids sequentially extracted from a sediment[J]. Chemosphere, 2015, 138: 657-663. doi: 10.1016/j.chemosphere.2015.07.061 [30] YU Y, YUAN S, WAN Y, et al. Effect of humic acid-based amendments on exchangeable cadmium and its accumulation by rice seedlings[J]. Environmental Progress & Sustainable Energy, 2017, 36(5): 1308-1313. [31] 史磊, 郭朝晖, 彭驰, 等. 石灰组配土壤改良剂抑制污染农田水稻镉吸收[J]. 农业工程学报, 2018, 34(11): 209-216. doi: 10.11975/j.issn.1002-6819.2018.11.027 [32] WATSON C, SINGH Y, IQBAL T, et al. Short-term effects of polyacrylamide and dicyandiamide on C and N mineralization in a sandy loam soil[J]. Soil Use and Management, 2016, 32: 127-136. [33] CAO X Y, HU P J, TAN C Y, et al. Effects of a natural sepiolite bearing material and lime on the immobilization and persistence of cadmium in a contaminated acid agricultural soil[J]. Environmental Science and Pollution Research, 2018, 25(22): 22075-22084. doi: 10.1007/s11356-018-1988-0 [34] HAO X, CHO C M, RACZ G J, et al. Chemical retardation of phosphate diffusion in an acid soil as affected by liming[J]. Nutrient Cycling in Agroecosystems, 2002, 64(3): 213-224. doi: 10.1023/A:1021470824083 [35] MAMEDOV A I, TSUNEKAWA A, HAREGEWEYN N, et al. Soil Structure Stability under Different Land Uses in Association with Polyacrylamide Effects[J]. Sustainability, 2021, 13(3): 1407. doi: 10.3390/su13031407 [36] PARADELO R, VIRTO I, CHENU C. Net effect of liming on soil organic carbon stocks: A review[J]. Agriculture Ecosystems & Environment, 2015, 202: 98-107. [37] JIN S L, HU Z J, HUANG Y Z, et al. Evaluation of several phosphate amendments on rare earth element concentrations in rice plant and soil solution by X-ray diffraction[J]. Chemosphere, 2019, 236: 124322. doi: 10.1016/j.chemosphere.2019.07.053 [38] 中华人民共和国国家食品药品监督管理总局. 食品安全国家标准 食品中污染物限量: GB 2762–2017[S]. 北京: 中国标准出版社, 2017 [39] WU Y J, ZHOU H, ZOU Z J, et al. A three-year in-situ study on the persistence of a combined amendment (limestone plus sepiolite) for remedying paddy soil polluted with heavy metals[J]. Ecotoxicology and Environmental Safety, 2016, 130: 163-170. doi: 10.1016/j.ecoenv.2016.04.018 [40] HUANG Y, SHENG H, ZHOU P, et al. Remediation of Cd-contaminated acidic paddy fields with four-year consecutive liming[J]. Ecotoxicology and Environmental Safety, 2019, 188: 109903. [41] WEN T T, YANG L Y, DANG C Y, et al. Effect of basic oxygen furnace slag on succession of the bacterial community and immobilization of various metal ions in acidic contaminated mine soil[J]. Journal of Hazardous Materials, 2020, 388: 121784. doi: 10.1016/j.jhazmat.2019.121784 [42] AZARBAD H, NIKLINSKA M, LASKOWSKI R, et al. Microbial community composition and functions are resilient to metal pollution along two forest soil gradients[J]. Fems Microbiology Ecology, 2015, 91(1): 1-11. [43] ZHENG J F, CHEN J H, PAN G X, et al. Biochar decreased microbial metabolic quotient and shifted community composition four years after a single incorporation in a slightly acid rice paddy from southwest China[J]. Science of The Total Environment, 2016, 571: 206-217. doi: 10.1016/j.scitotenv.2016.07.135 -




 下载:
下载: