-
近年来,水体突发性重金属污染事故频发,严重威胁受污染流域附近的生态平衡和居民健康[1]。微生物燃料电池(MFC)传感器为水体突发性重金属污染的预警提供了一个新的思路[2-4]。水样中重金属物质的生物毒性会抑制MFC传感器阳极上电活性微生物的新陈代谢过程,宏观表现为MFC传感器输出电信号减弱,并可通过计算电信号抑制率(inhibition ratio,IR)进行量化分析[5-7]。MFC传感器在一定程度上具有能量自持、信号直观和自我修复等功能[8-10],故在水体重金属物质的监测预警方面具有较好的实用性。
MFC传感器在应用于监测预警时,仍然存在2个问题。1)水样中存在的可生化降解有机物(biodegradable organic matter, BOM)会使MFC传感器监测预警信号出现假阴性问题。为了提高MFC传感器对水样中BOM波动的抗干扰能力,JIANG等[11]采用氧还原混合菌生物阴极作为MFC传感器的敏感元件来监测水样中的甲醛,相较于传统的生物阳极敏感元件可有效解决乙酸造成的假阴性问题,但仅可用于好氧水体的监测;SPURR等[12]构建了一种新型的三级MFC传感器,可定性地区分BOM含量下降和毒性物质抑制作用所导致的MFC传感器输出电信号减弱的情况。2)重金属毒性会给电活性微生物造成不可逆损伤[13-15],使MFC传感器信号重现性变差。有研究[16-18]利用无机化合物(二氧化硅、碳酸钙、多层聚合电解质等)对电活性微生物活细胞个体进行包裹,以此维持反应器的长期稳定运行,但这些物质也会对微生物电化学传感器的输出电信号造成干扰。
针对上述MFC传感器监测假阴性问题和信号重现性差问题,本研究采取预先使阳极上的电活性微生物在监测时间内恰好处于营养饱和状态的方案,并采用监测时间内的库仑量(coulombic yield,CY)的抑制率作为预警信号指标,利用单室MFC搭建了单程连续流模式实时原位监测装置,以Cr(Ⅵ)为目标污染物,评估传感器的预警性能,分析外加不同浓度乙酸钠与不同种类外源BOM对Cr(Ⅵ)冲击预警稳定性的影响,探索MFC传感器对3次相同浓度Cr(Ⅵ)冲击的信号重现性,为MFC传感器实时原位监测水体重金属污染提供参考。
-
本研究所用培养液为KCl 0.30 g·L−1、NH4Cl 0.31 g·L−1、NaH2PO4 4.68 g·L−1、Na2HPO4 8.66 g·L−1,微量元素12.50 mL·L−1和维生素5 mL·L−1。维生素所含试剂纯度为美国药典级USP(生工生物工程(上海)有限公司),其余试剂为分析纯(国药)。铬源:重铬酸钾(K2CR2O7) 1 g·L−1,优级纯(国药)。碳源:乙酸钠(CH3COONa) 384.62 mg·L−1,纯度≥ 99%(西格玛奥德里奇(上海)贸易有限公司)。外源BOM:谷氨酸、乳酸、蔗糖和葡萄糖,质量浓度均为50 mg·L−1,分析纯(国药)。
-
MFC装置采用有机玻璃板组装成单室构型,有效体积为7.07 cm3,阴阳极均为碳布(W0s1009, Phychemi Co. Ltd., China)材料。阴极碳布材料涂刷Pt/C(20% Pt, Alfa Aesar Co. Ltd., UK)制成催化层。阴阳极面积均为7.07 cm2,由钛丝相连,外接电阻为1 000 Ω。使用实验室长期稳定运行的MFC阳极出水作为菌种来源,按1∶1(出水∶培养液)制成接种液进行启动培养,每24 h更换1次接种液。在连续3个周期收集的库仑量误差为5%以内时,说明启动成功。实验期间,MFC传感器放置在30 ℃的恒温箱中,培养液和模拟重金属废水在进入MFC传感器之前均保持氮气曝气,蠕动泵(BT100-2J, Longer Precision Pump Co. Ltd., China)的流速为0.34 mL·min−1。在实际应用时,需根据水样中BOM的含量来混合配水和调整流速,以保持MFC传感器恰好为营养饱和状态。MFC传感器的输出电信号由信号采集器每隔5 min记录1次。
-
为讨论单室MFC传感器在单程连续流进样条件下监测Cr(Ⅵ)冲击的检出限、灵敏度、最佳监测时间等性能参数,根据已有的研究方法[19],本研究设置了5个Cr(Ⅵ)的质量浓度梯度,分别为0.2、0.4、0.6、0.8和1 mg·L−1,每个质量浓度梯度均设置3个平行样进行实验。监测完成后,进水立即更换为不含Cr(Ⅵ)的培养液,对受冲击后MFC传感器进行性能恢复。实验中,将MFC传感器输出电压降至小于基线电压40 mV时作为响应时刻。从响应时刻开始,分别计算1至6 h 6个时段的库仑量抑制率并分析拟合直线的斜率和拟合度R2。
为探究MFC传感器对BOM波动的抗干扰能力以及抵抗不可逆损伤的能力,首先设定进水Cr(Ⅵ)质量浓度为1 mg·L−1,设置4个乙酸钠质量浓度梯度,分别为384.62、480.77、576.92和961.54 mg·L−1,当阳极电活性微生物已经达到营养饱和状态后,探讨额外增加BOM对预警稳定性的影响;然后再设定模拟废水中乙酸钠质量浓度为384.62 mg·L−1及Cr(Ⅵ)为1 mg·L−1,配制分别含有谷氨酸、乳酸、蔗糖和葡萄糖这4种外源BOM的模拟废水,质量浓度均为50 mg·L−1,研究不同种类BOM对传感器预警稳定性的影响;最后使用MFC传感器对连续3次含有1 mg·L−1 Cr(Ⅵ)的模拟废水进行冲击预警。以上每次监测均设置3个平行样重复实验。
-
库仑量(CY)计算方法见式(1);抑制率(IR)计算方法见式(2)。
式中:QCY为收集的库仑量,C;I为输出电流,mA;U为输出电压,mV;Rext为外电阻,Ω;t为检测时间,s。
式中:R为抑制率;QCY0为重金属污染冲击前的基线库仑量;QCY1为重金属污染冲击后监测时段内的库仑量。
-
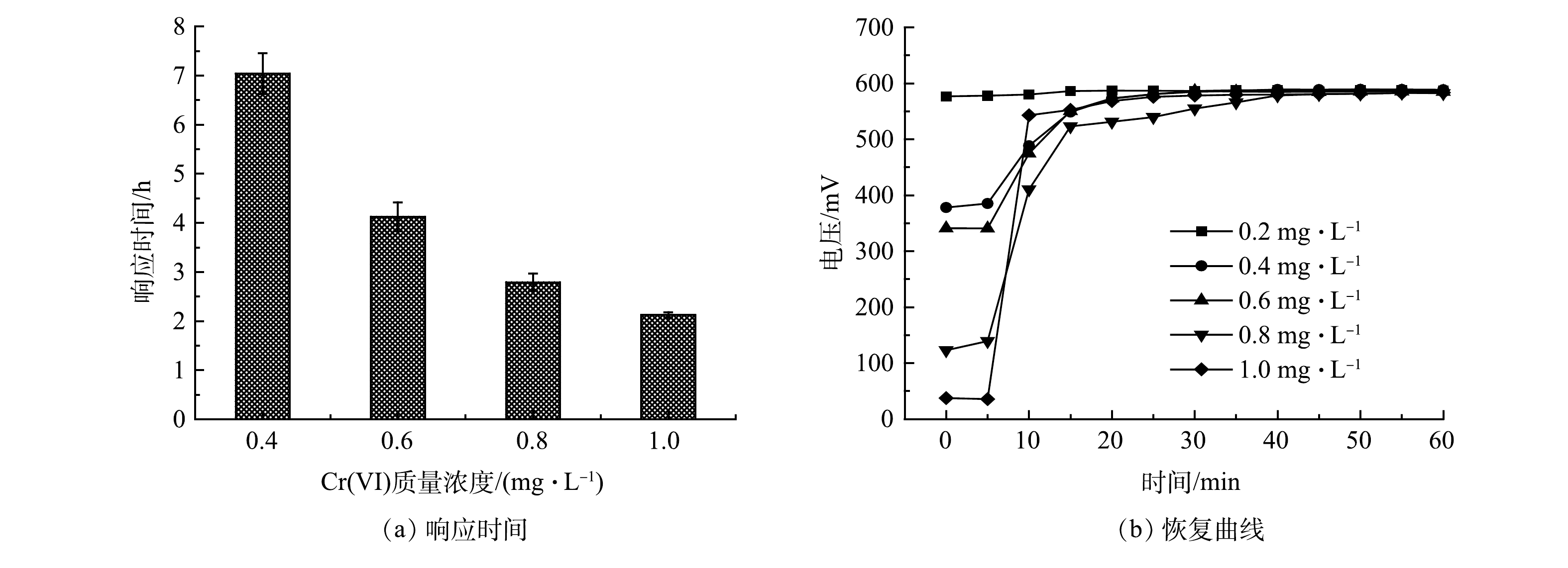
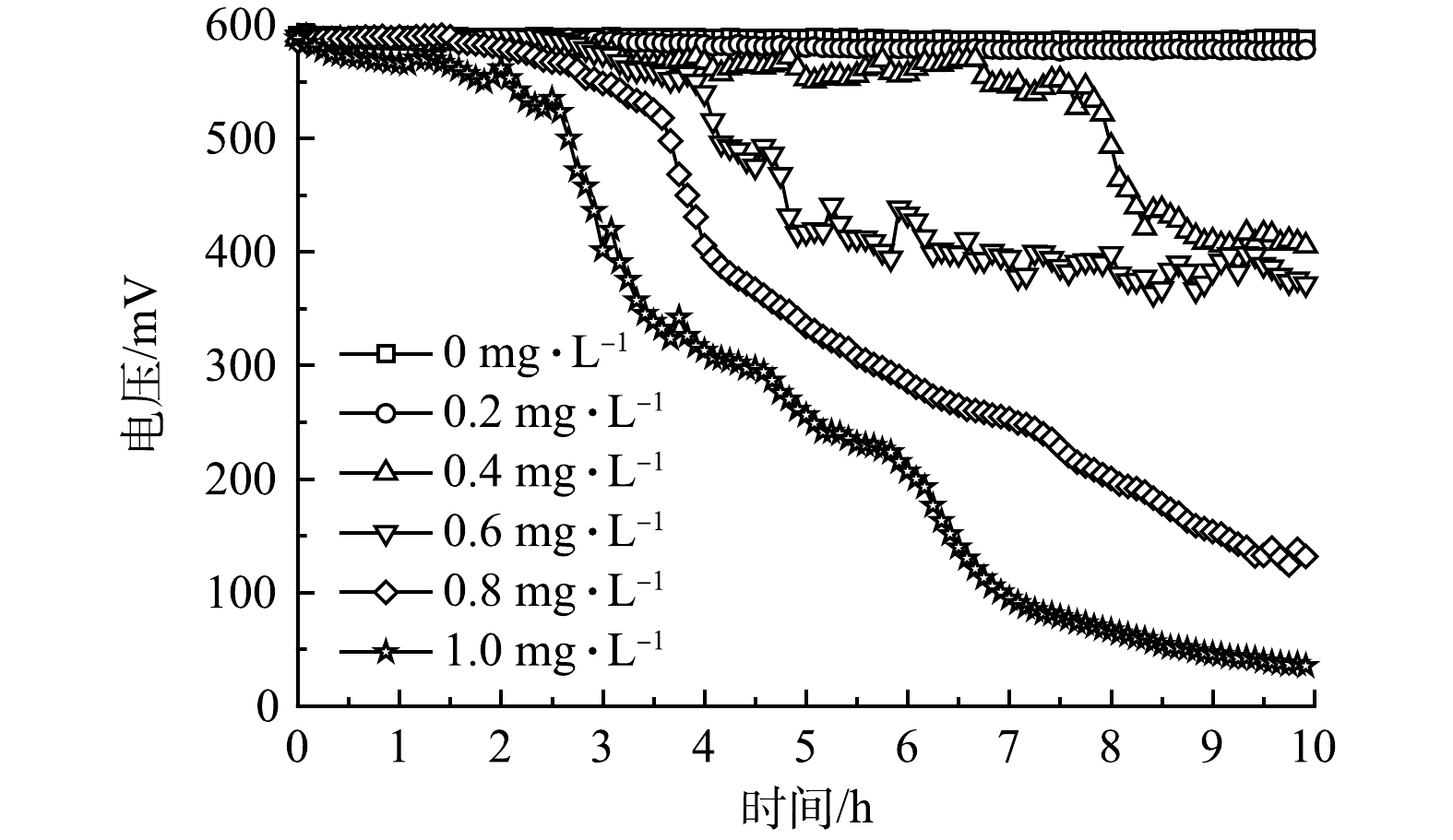
图1为MFC传感器对含有不同质量浓度Cr(Ⅵ)进水的监测电压曲线,设定水样中乙酸钠的质量浓度为384.62 mg·L−1。随着Cr(Ⅵ)质量浓度由0.2 mg·L−1逐渐上升到1 mg·L−1,MFC传感器响应时间逐渐缩短,电压降逐渐增大。当进水中未投加Cr(Ⅵ)时,MFC传感器输出基线电压为(586.55±1.36) mV;当进水中Cr(Ⅵ)质量浓度增至0.2 mg·L−1时,在长达10 h的运行中,MFC传感器稳定输出电压为(582.28± 4.27) mV,与基线电压相比,信号下降微弱;当进水中Cr(Ⅵ)质量浓度进一步增至0.4 mg·L−1时,MFC传感器的输出电压开始出现明显的下降趋势,故判定本研究中MFC传感器对于Cr(Ⅵ)的检出限为0.4 mg·L−1。
MFC传感器运行稳定后,将开始投加Cr(Ⅵ)到输出电压下降了40 mV的时间定义为响应时间。图2(a)反映了Cr(Ⅵ)质量浓度为0.4、0.6、0.8和1 mg·L−1冲击的响应时间,分别为7.04、4.13、2.79和2.13 h。可以看出,随着Cr(Ⅵ)质量浓度越高,MFC传感器预警响应越快。图2(b)为MFC传感器在5个质量浓度的Cr(Ⅵ)冲击后的电压恢复曲线。可以看出,当Cr(Ⅵ)质量浓度的监测区间在0.2 ~ 1 mg·L−1时, MFC传感器的输出电压均可在1 h内快速恢复活性。这表明阳极微生物活性未受到不可逆损害。
-
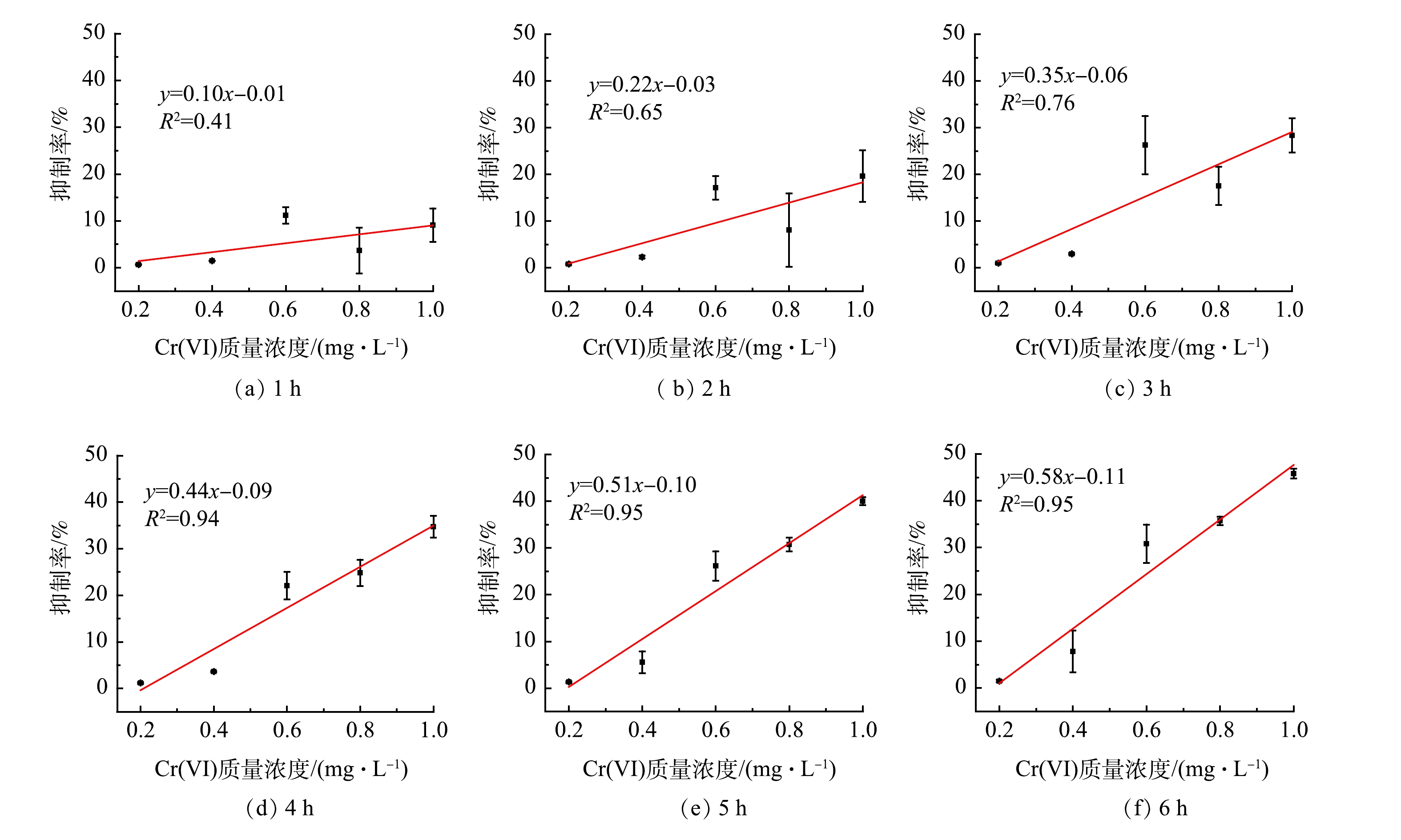
剂量效应曲线可以用来评价MFC传感器的监测灵敏度以及毒性物质质量浓度与电信号抑制率之间的相关性,进而用于毒性物质的定量分析[20]。本研究中的剂量效应曲线是由各Cr(Ⅵ)质量浓度梯度与其库仑量抑制率进行线性拟合得出的不同时间段(1、2、3、4、5和6 h)下的拟合直线。拟合直线的斜率和拟合度(R2)分别代表MFC传感器的灵敏度以及Cr(Ⅵ)质量浓度与库仑量抑制率之间的共变趋势。对比不同时段拟合直线的斜率和R2,筛选出最佳监测时间。在实际使用中,可根据最佳监测时间对应的剂量效应曲线对Cr(Ⅵ)进行定量分析。
从MFC传感器监测各Cr(Ⅵ)质量浓度梯度冲击的响应时刻开始,分别计算6个时段(1、2、3、4、5和6 h)各自的库仑量抑制率,并做拟合直线得到斜率和R2,结果见图3。
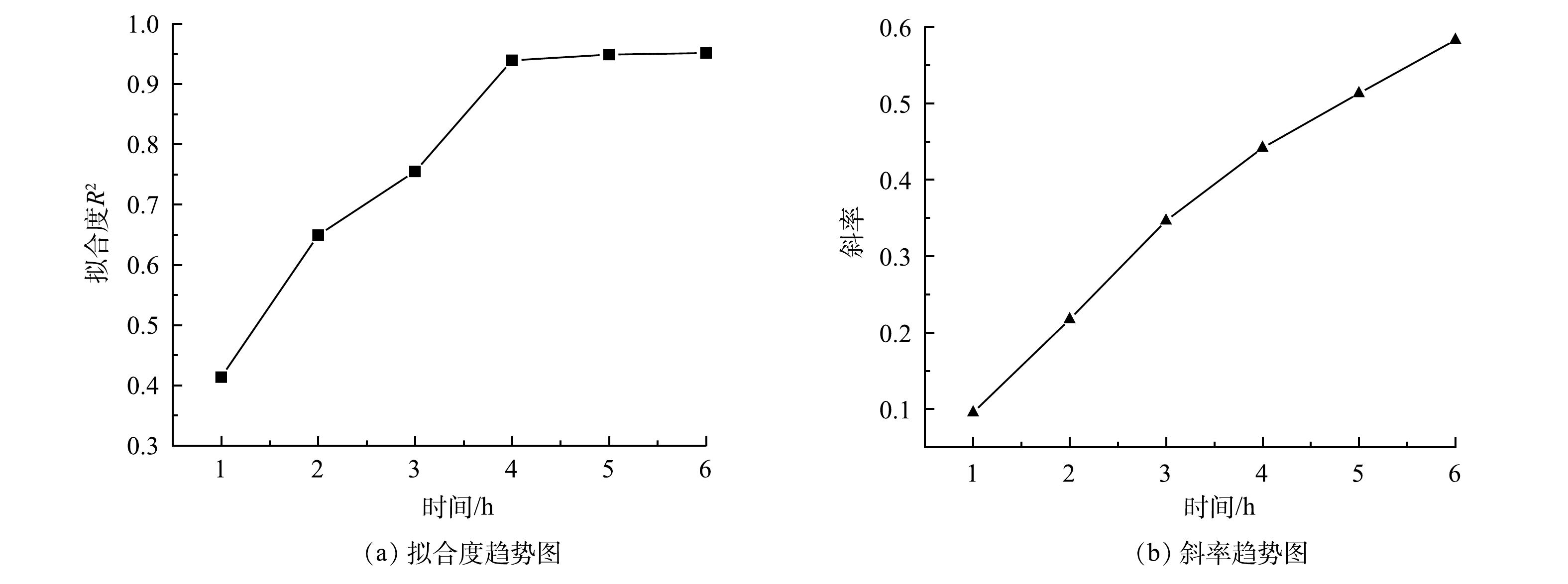
如图4(a)所示,当监测时间从1 h延长至4 h时,MFC传感器剂量效应曲线的R2不断增大,时间为1、2、3和4 h对应的 R2分别为0.41、0.65、0.76和0.94。这说明在3 h以内,MFC传感器的库仑量抑制率与模拟废水中Cr(Ⅵ)质量浓度之间的共变趋势较差。当监测时间为5 h和6 h时,对应的剂量效应曲线R2均为0.95。这说明4 h过后,MFC传感器的库仑量抑制率与模拟废水中Cr(Ⅵ)质量浓度之间的共变趋势趋于稳定,并且已经具有较好的共变趋势。如图4(b)所示,MFC传感器剂量效应曲线的斜率随监测时间的延长不断增大。这说明灵敏度会随监测时间的增加而不断升高,但考虑到MFC传感器预警监测的时效性,确定4 h为最佳的监测时间。在监测时间为4 h时, Cr(Ⅵ)质量浓度梯度0.2、0.4、0.6、0.8和1 mg·L−1对应的库仑量抑制率分别为1.17%、3.60%、22.06%、24.84%和34.71%。值得注意的是,在监测时间为4 h时,剂量效应曲线斜率较低,仅为0.44。这说明MFC传感器的灵敏度较低,可以从传感器构型方面进行改进,如改变腔室体积[21]、外加电流或电压[22-23]、修饰电极[24]和优化流态分布[25]等。
-
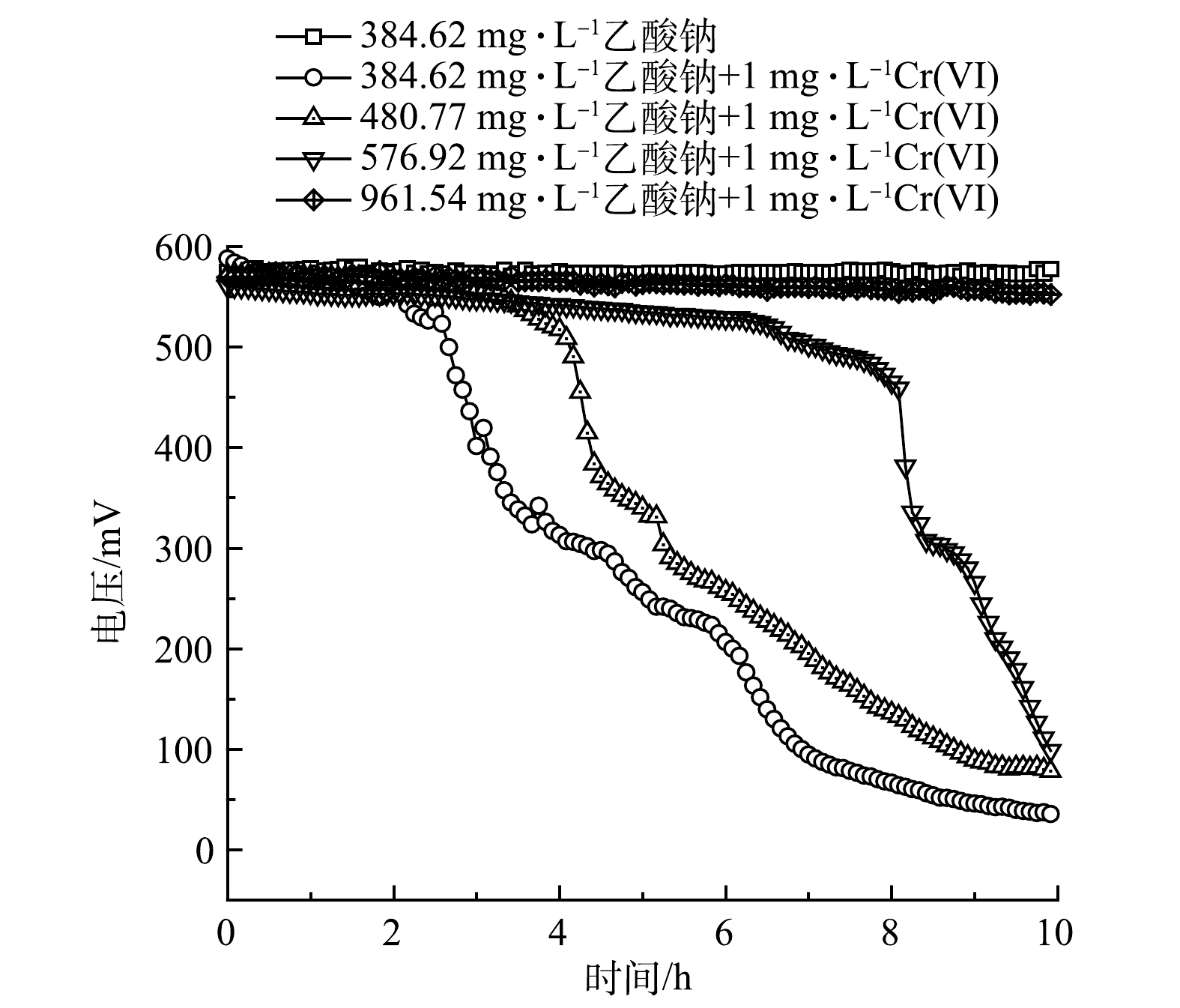
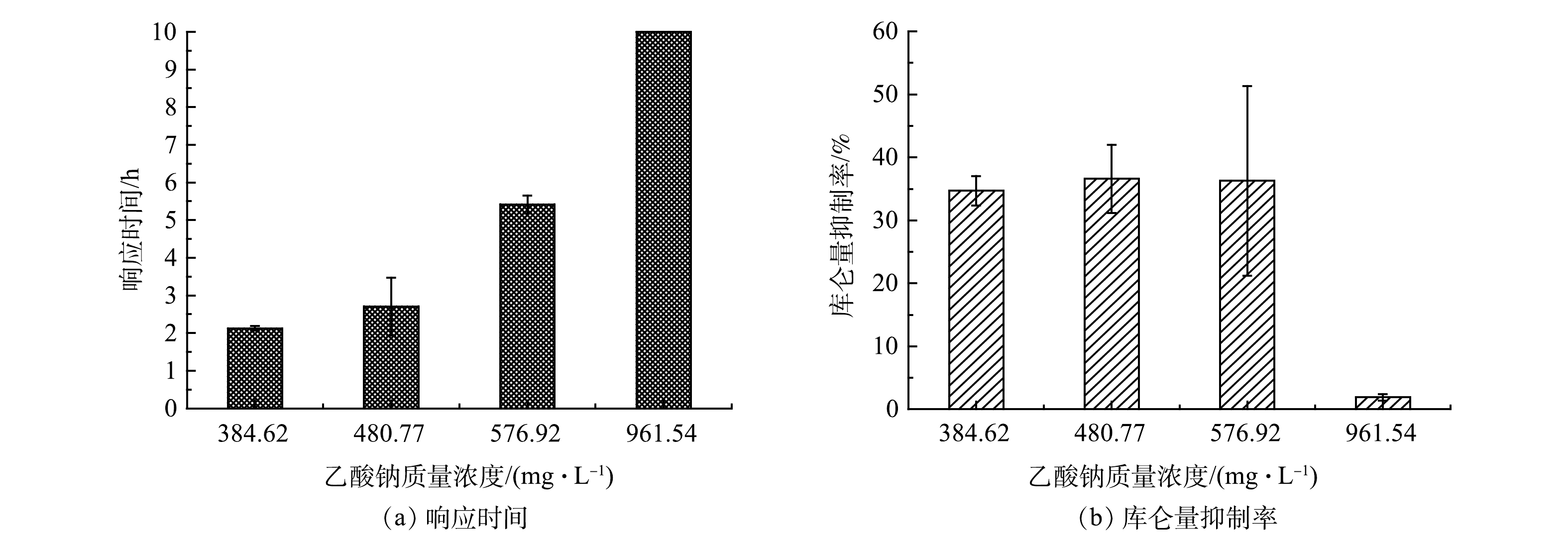
以乙酸钠为研究对象,设定Cr(Ⅵ)的质量浓度为1 mg·L−1,设置模拟废水中乙酸钠的质量浓度为384.62、480.77、576.92和961.54 mg·L−1,相对应的标准品五日生化需氧量值为200、250、300和500 mg·L−1。由图5可以看出,随着模拟废水中乙酸钠质量浓度的上升,MFC传感器的响应时间相应越长。
如图6(a)所示,当乙酸钠质量浓度为384.62、480.77和576.92 mg·L−1时,MFC传感器响应时间分别为2.13、2.71和5.42 h。当乙酸钠质量浓度为961.54 mg·L−1时,在10 h内,MFC传感器稳定输出电压为(562.86±10.79) mV,与基线电压(574.27±2.05) mV相比,降幅微弱,无法产生有效的预警信号。
图6(b)反映了在4 h的监测时间内,不同乙酸钠质量浓度下MFC传感器对含1 mg·L−1 Cr(Ⅵ)模拟废水预警的库仑量抑制率。可以看出,在乙酸钠质量浓度为384.62、480.77和576.92 mg·L−1时,库仑量抑制率分别为34.71%±1.65%、36.60%±3.82%和36.28%±10.64%。当模拟废水中乙酸钠的质量浓度为384.62~ 576.92 mg·L−1时,含有1 mg·L−1的Cr(Ⅵ)水样毒性预警受乙酸钠质量浓度变化影响较小。乙酸钠质量浓度越高,库仑量抑制率误差越大,这种误差可以通过增加平行监测传感器的数量来解决。当乙酸钠质量浓度达到961.54 mg·L−1时,含有1 mg·L−1的Cr(Ⅵ)水样的库仑量抑制率明显下降,仅为1.92%±0.36%。这说明当水样中BOM质量浓度过高时, MFC传感器监测灵敏度会下降。其原因可能是水样中添加过量的乙酸钠可以帮助电活性微生物抵抗重金属毒性带来的损伤,从而增加阳极微生物的产电稳定性[26]。另外,还有研究[27]发现,过量的营养基质会提高阳极生物膜的胞外聚合物,进而提高阳极微生物的抗毒性,造成检测库仑量抑制率降低。不过,这个现象也为重度损伤的MFC传感器的性能恢复和高质量浓度重金属污染监测预警提供了新思路。
-
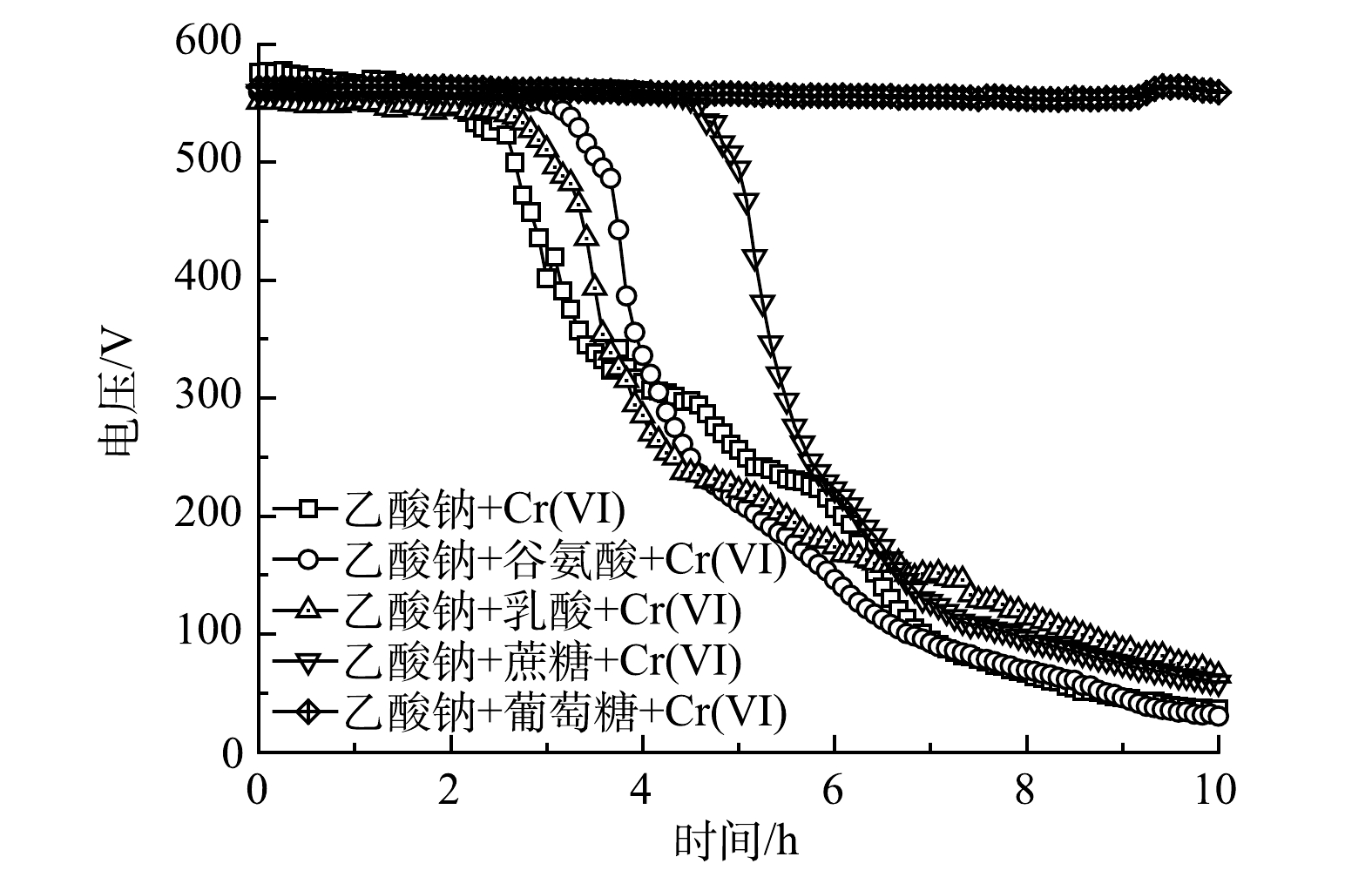
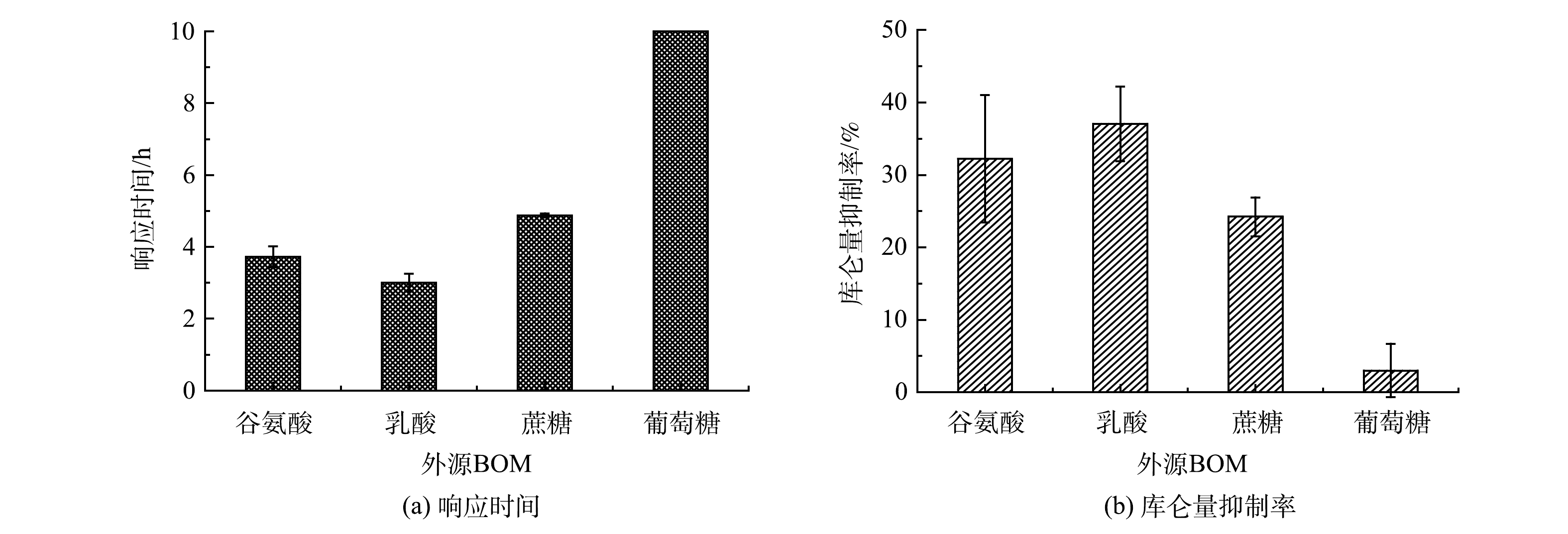
以不同的外源BOM为研究对象(谷氨酸、乳酸、蔗糖和葡萄糖,质量浓度均为50 mg·L−1),设定模拟废水中Cr(Ⅵ)质量浓度为1 mg·L−1、乙酸钠质量浓度为384.62 mg·L−1,研究不同的外源BOM对MFC传感器预警Cr(Ⅵ)冲击稳定性的影响。
如图7所示,对含有谷氨酸、乳酸和蔗糖的模拟废水进行Cr(Ⅵ)冲击预警时,MFC传感器均有明显的电压降反应,可以产生有效的预警信号,但对含有葡萄糖的模拟废水无明显的电压降。
如图8(a)所示:MFC传感器对于含有谷氨酸、乳酸和蔗糖的模拟废水的响应时间相差较小,分别为3.72、3.00和4.86 h;MFC传感器对含葡萄糖的模拟废水在10 h监测过程内都没有响应。图8(b)反映了MFC传感器对含谷氨酸、乳酸、蔗糖和葡萄糖模拟废水的4 h监测库仑量抑制率。由图8(b)可以看出,抑制率分别为35.22%±6.51%、37.05%±3.74%、24.23%±1.90%和2.99%±2.63%。对于含有葡萄糖的模拟废水来说,本研究中的MFC传感器没能成功预警Cr(Ⅵ)冲击。其原因可能是葡萄糖可以将Cr(Ⅵ)还原为Cr(Ⅲ)[28],但这并不影响MFC传感器预警水样中真实Cr(Ⅵ)冲击的功能。
-
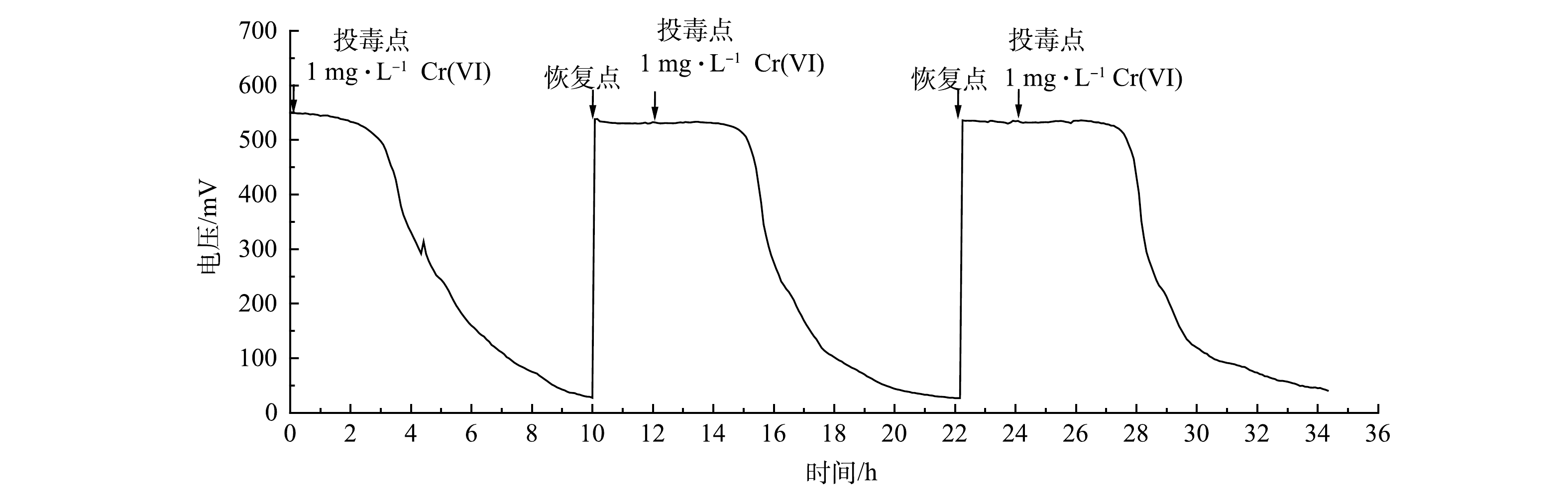
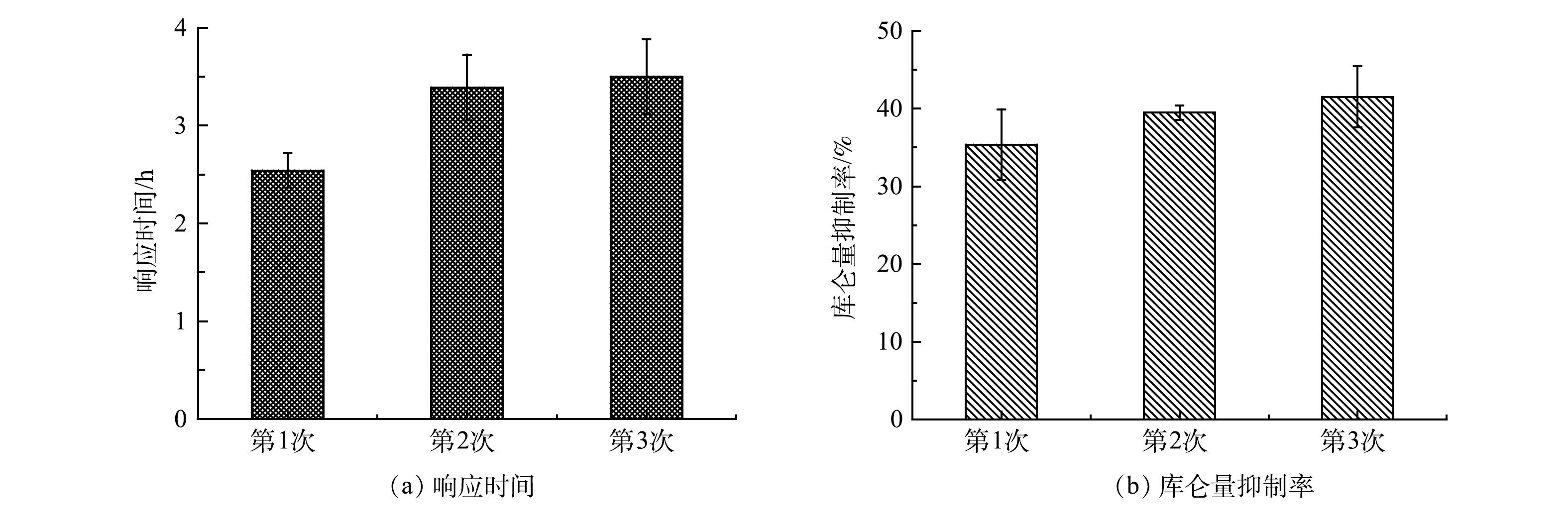
用Cr(Ⅵ)质量浓度为1 mg·L−1的模拟废水对MFC传感器进行连续3次冲击,前2次冲击结束后,均用培养液进行2 h的清洗和恢复。如图9所示,前2次冲击过后,MFC传感器的输出电压均可以迅速恢复,但并不能恢复到第1次冲击前(548.60± 1.17) mV的水平,输出电压为(532.51± 3.21) mV。在实际监测中,重新确定基线即可解决这个问题。由图10(a)可以看出,第2次和第3次冲击MFC传感器的响应时间分别为3.39 h和3.50 h,相比于第一次冲击的2.54 h稍微增加。其原因可能是,第1次冲击后阳极电活性微生物受到了一定程度的损伤,2 h的恢复时间还不足以使其完全恢复[29]。JIANG等[30]采用了阴极共享型的MFC传感器阵列,4个阳极通道可以在保证连续工作的同时,受损的阳极也能得到足够的恢复,共用一个阴极也确保了监测结果的平行性。由图10(b)可以看出,3次冲击MFC传感器的库仑量抑制率波动不大,分别为35.37%±3.21%、39.48%±0.95%和41.50%±4.24%,均可有效预警。这说明本研究中MFC传感器在达到营养饱和状态后再接受重金属毒性冲击的预警方法,可以有效减少阳极电活性微生物受到的不可逆损伤,MFC传感器能在冲击后快速恢复且预警信号具有较好的重现性。
-
1)在单程连续流进样模式下,单室MFC对Cr(Ⅵ)冲击预警的检出限为0.4 mg·L−1,最佳监测时间为4 h;在质量浓度为0.2 ~ 1 mg·L−1时,库仑量抑制率和Cr(Ⅵ)质量浓度具有较好的共变趋势,剂量效应曲线R2为0.94,且MFC传感器在监测结束后均可在1 h内恢复,说明本研究装置可有效预警重金属冲击。
2) 模拟废水中乙酸钠的质量浓度为384.62、480.77和576.92 mg·L−1时,MFC传感器预警1 mg·L−1 Cr(Ⅵ)的库仑量抑制率分别为34.71%±1.65%、36.60%±3.82%和36.28%±10.64%;设定乙酸钠浓度为384.62 mg·L−1,模拟废水中分别含有50 mg·L−1的谷氨酸、乳酸和蔗糖时,传感器对1 mg·L−1 Cr(Ⅵ)的库仑量抑制率分别为35.22%±6.51%、37.05% ±3.74%和24.23%±1.90%。2组实验结果表明MFC传感器能够在一定程度上抵抗水样中BOM的干扰。
3) MFC传感器对连续3次1 mg·L−1Cr(Ⅵ)冲击的库仑量抑制率分别为35.37%±3.21%、39.48%±0.95%和41.50%±4.24%,表明MFC传感器的信号重现性较好。
基于微生物库仑量抑制率的水体重金属污染监测方法
Monitoring method of heavy metal pollution in water based on inhibition ratio of microbial coulomb
-
摘要: 为实现对水环境重金属污染的实时原位监测,利用单室微生物燃料电池(microbial fuel cell,MFC)传感器搭建了单程连续流装置,并对其预警稳定性进行了探讨。结果表明:以Cr(VI)作为目标污染物,MFC传感器的检出限为0.4 mg·L−1,在0.2~1 mg·L−1的质量浓度区间内,库仑量抑制率与Cr(VI)质量浓度具有较高的共变趋势;设定模拟废水中Cr(VI)的质量浓度为1 mg·L−1,MFC传感器对乙酸钠质量浓度分别为384.62、480.77和576.92 mg·L−1的模拟废水预警的库仑量抑制率为34.71%±1.65%、36.60%±3.82%和36.28%±10.64%;对分别含有谷氨酸、乳酸和蔗糖(质量浓度均为50 mg·L−1)的模拟废水预警的库仑量抑制率为35.22%±6.51%、37.05%±3.74%和24.23%±1.90%,这说明MFC传感器对水样中的可生化降解有机物具有一定的抗干扰能力; MFC传感器连续3次对含有1 mg·L−1 Cr(VI)模拟废水预警的库仑量抑制率为35.37%±3.21%、39.48%±0.95%和41.50%±4.24%,证明MFC传感器的预警信号重现性较好。以上研究结果可为MFC传感器实时原位监测水体重金属污染提供技术参考。
-
关键词:
- 微生物燃料电池传感器 /
- 重金属污染 /
- 库仑量抑制率 /
- 实时原位监测
Abstract: In order to realize the real-time in-situ monitoring of heavy metal pollution in the water environment, a single-chamber microbial fuel cell (MFC) sensor was used to build a single-pass continuous flow device, and its early warning stability was discussed. The results showed that with Cr(VI) as the target pollutant, the detection limit of the MFC sensor was 0.4 mg·L−1, the coulomb inhibition ratio had a high linear correlation with the mass concentration of Cr(VI) in the range of 0.2~1 mg·L−1. In addition, the mass concentration of Cr(VI) in the simulated wastewater was set as 1 mg·L−1, and the coulombic inhibition rates of MFC sensors for the simulated wastewater with the sodium acetate mass concentrations of 384.62, 480.77 and 576.92 mg·L−1 were 34.71%±1.65%, 36.60%±3.82% and 36.28%±10.64%, respectively. The coulombic inhibition rates for the simulated wastewater samples containing glutamic acid, lactic acid and sucrose (all concentrations were 50 mg·L−1) were 35.22%±6.51%, 37.05%±3.74% and 24.23%±1.90%, respectively, this results showed that the MFC sensor had a certain anti-interference ability to biodegradable organic matter (BOM) in water samples. Finally, for the early warning of simulated wastewater containing 1 mg·L−1 Cr(VI), the coulombic inhibition rates of MFC sensors were 35.37%±3.21%, 39.48%±0.95% and 41.50%±4.24% for three consecutive times, respectively, this results showed that the early warning signal of the MFC sensor had good reproducibility. The above research provides a technical reference for the real-time in-situ monitoring of heavy metal pollution in water by MFC sensors. -

-
-
[1] EMENIKE P C, NERIS J B, TENEBE I T, et al. Estimation of some trace metal pollutants in River Atuwara southwestern Nigeria and spatio-temporal human health risks assessment[J]. Chemosphere, 2020, 239: 124770. doi: 10.1016/j.chemosphere.2019.124770 [2] 吴锋, 刘志, 周奔, 等. 单室MFC型生物毒性传感器对重金属离子的检测研究[J]. 环境科学, 2010, 31(7): 1596-1600. [3] 乔军晶. 基于微生物燃料电池的重金属质量浓度检测技术的电化学参数选择与优化[D]. 上海: 华东理工大学, 2016. [4] LIU Y, TUO A X, JIN X J, et al. Quantifying biodegradable organic matter in polluted water on the basis of coulombic yield[J]. Talanta, 2018, 176: 485-491. doi: 10.1016/j.talanta.2017.08.029 [5] LOGAN B E, REGAN J M. Microbial fuel cells: Challenges and applications[J]. Environmental Science & Technology, 2006, 40(17): 5172-5180. [6] SU L, JIA W Z, HOU C J, et al. Microbial biosensors: A review[J]. Biosensors & Bioelectronics, 2011, 26(5): 1788-1799. [7] MOORE J. Microbial biosensors: A review[J]. Journal of Microbial & Biochemical Technology, 2021, 13(6): 475. [8] STEIN N E, KEESMAN K J, HAMELERS H V M, et al. Kinetic models for detection of toxicity in a microbial fuel cell based biosensor[J]. Biosensors & Bioelectronics, 2011, 26(7): 3115-3120. [9] ABREVAYA X C, SACCO N J, BONETTO M C, et al. Analytical applications of microbial fuel cells. Part I: Biochemical oxygen demand[J]. Biosensors & Bioelectronics, 2015, 63(1): 580-590. [10] HILL A, TAIT S, BAILLIE C, et al. Microbial electrochemical sensors for volatile fatty acid measurement in high strength wastewaters: A review[J]. Biosensors & Bioelectronics, 2020, 165: 112409. [11] JIANG Y, LIANG P, LIU P, et al. A novel microbial fuel cell sensor with biocathode sensing element[J]. Biosensors & Bioelectronics, 2017, 94: 344-350. [12] SPURR M W A, YU E H, SCOTT K, et al. A microbial fuel cell sensor for unambiguous measurement of organic loading and definitive identification of toxic influents[J]. Environmental Science:Water Research & Technology, 2020, 6(3): 612-621. [13] ZHAO T, XIE B, YI Y, et al. Sequential flowing membrane-less microbial fuel cell using bioanode and biocathode as sensing elements for toxicity monitoring[J]. Bioresourse Technology, 2019, 276: 276-280. doi: 10.1016/j.biortech.2019.01.009 [14] GONZALEZ M J, CORTON E, FIGUEREDO F. Sorting the main bottlenecks to use paper-based microbial fuel cells as convenient and practical analytical devices for environmental toxicity testing[J]. Chemosphere, 2021, 265: 129101. doi: 10.1016/j.chemosphere.2020.129101 [15] GAO Y Y, WANG S, YIN F J, et al. Enhancing sensitivity of microbial fuel cell sensors for low concentration biodegradable organic matter detection: Regulation of substrate concentration, anode area and external resistance[J]. Journal of Environmental Sciences, 2021, 101(3): 227-235. [16] YANG S H, LEE K B, KONG B, et al. Biomimetic encapsulation of individual cells with silica[J]. Angewandte Chemie, 2009, 48(48): 9160-9163. doi: 10.1002/anie.200903010 [17] FAKHRULLIN R F, MINULLINA R T. Hybrid cellular-inorganic core-shell microparticles: Encapsulation of individual living cells in calcium carbonate microshells[J]. Langmuir, 2009, 25(12): 6617-6621. doi: 10.1021/la901395z [18] ZAMALEEVA A I, SHARIPOVA I R, PORFIREVA A V, et al. Polyelectrolyte-mediated assembly of multiwalled carbon nanotubes on living yeast cells[J]. Langmuir, 2010, 26(4): 2671-2679. doi: 10.1021/la902937s [19] JIANG Y, LIANG P, LIU P P, et al. A cathode-shared microbial fuel cell sensor array for water alert system[J]. International Journal of Hydrogen Energy, 2016, 42(7): 4342-4348. [20] WU W G, LESNIK K L, XU S T, et al. Impact of tobramycin on the performance of microbial fuel cell[J]. Microbial Cell Factories, 2014, 13: 91. doi: 10.1186/s12934-014-0091-6 [21] DAVILA D, ESQUIVEL J P, SABATE N, et al. Silicon-based microfabricated microbial fuel cell toxicity sensor[J]. Biosensors & Bioelectronics, 2011, 26(5): 2426-2430. [22] MODIN O, WILÉN B M. A novel bioelectrochemical BOD sensor operating with voltage input[J]. Water Research, 2012, 46(18): 6113-6120. doi: 10.1016/j.watres.2012.08.042 [23] JIN X, LI X, ZHAO N, et al. Bio-electrolytic sensor for rapid monitoring of volatile fatty acids in anaerobic digestion process[J]. Water Research, 2017, 111: 74-80. doi: 10.1016/j.watres.2016.12.045 [24] XU Z H, LIU B C, DONG Q C, et al. Flat microliter membrane-based microbial fuel cell as “on-line sticker sensor” for self-supported in situ monitoring of wastewater shocks[J]. Bioresource Technology, 2015, 197: 244-251. doi: 10.1016/j.biortech.2015.08.081 [25] MOON H, CHANG I S, KANG K H, et al. Improving the dynamic response of a mediator-less microbial fuel cell as a biochemical oxygen demand (BOD) sensor[J]. Biotechnology Letters, 2004, 26(22): 1717-1721. doi: 10.1007/s10529-004-3743-5 [26] STAGER J L, ZHANG X, LOGAN B E. Addition of acetate improves stability of power generation using microbial fuel cells treating domestic wastewater[J]. Bioelectrochemistry, 2017, 118: 154-160. doi: 10.1016/j.bioelechem.2017.08.002 [27] XING F, XI H, YU Y, et al. A sensitive, wide-ranging comprehensive toxicity indicator based on microbial fuel cell[J]. Science of the Total Environment, 2020, 703: 134667. doi: 10.1016/j.scitotenv.2019.134667 [28] 史开宇, 王兴润, 范琴, 等. 不同还原药剂修复Cr(Ⅵ)污染土壤的稳定性评估[J]. 环境工程学报, 2020, 14(2): 473-479. doi: 10.12030/j.cjee.201904129 [29] HENG X Z, CHENG L Y, ISAIAH W, et al. Disposable self-support paper-based multi-anode microbial fuel cell (PMMFC) integrated with power management system (PMS) as the real time “shock” biosensor for wastewater[J]. Biosensors & Bioelectronics, 2016, 85: 232-239. [30] JIANG Y, LIANG P, LIU P, et al. A cathode-shared microbial fuel cell sensor array for water alert system[J]. International Journal of Hydrogen Energy, 2017, 42(7): 4342-4348. doi: 10.1016/j.ijhydene.2016.12.050 -



 下载:
下载: