-
鱼类是人类摄取动物蛋白质、微量营养素和必需脂肪酸的重要来源之一,在当前人口快速增长的同时,对鱼类的需求也在不断增加[1]。鉴于捕捞渔业的过度开发及其引起的相关水生态环境问题,选择并使用新型环保的养殖系统维持全球鱼类需求的上升是当务之急[2]。陆基循环水产养殖系统(land-based recirculating aquaculture systems,RAS)通过多步骤的水处理过程回收自然输入水,减少对新添加水的需求,同时降低废水中污染物的浓度;具备控制养殖水质及节水节能的优势,优于传统的养殖系统,是未来重要的养殖模式之一[3-4]。然而,RAS作为人工圈养系统,具有相对封闭性,在养殖过程中需投喂大量外源性饲料,其产生的鱼粪和残饵会在水中沉积,经微生物分解后,将增加水体有机和无机物质(C、N、P)含量,引起水体氨氮、COD等有害物质的累积,导致水质恶化并引起鱼虾类疾病频繁发生[5-6]。
RAS中鱼粪是养殖区沉积物的主要组成部分,其对上层水的直接影响在于引起有机物的积累及底质向缺氧状态的改变[7]。现有研究表明,氧环境改变是影响营养物质释放的关键因子[8]。其中,厌氧环境会加速底泥N、P释放;好氧条件会抑制反硝化作用,使NO3−-N消耗减少,同时能够抑制NO3−-N异化还原为NH4+-N,促进硝化作用[9]。BEUTEL等[10]指出,湖泊沉积物中氨释放通常发生在厌氧条件下,而高溶解氧含量会抑制沉积物中氨释放。KANG等[11]发现海河口缺氧环境中TP和TN的浓度约为好氧环境中的两倍。目前,关于氧环境改变下水产养殖系统沉积物-水界面C、N、P迁移转化特征的研究主要集中于湖泊、池塘、水库等相对开放的养殖系统[12-14],而对于以鱼粪和残饵为主要沉积物的相对封闭、高密度养殖和高强度饵料投放的RAS的研究鲜有报道。因此,本研究采用室内模拟的方法,探讨了氧环境(好氧、厌氧)对RAS中鲈鱼粪N、P、DOM(dissolved organic matter,DOM)释放特征及鱼粪细菌群落结构的影响,揭示了鱼粪及其上覆水理化性质与细菌群落特征间的相关关系,旨在为陆基循环水产养殖水体富营养化预防和水产养殖业健康发展提供参考。
-
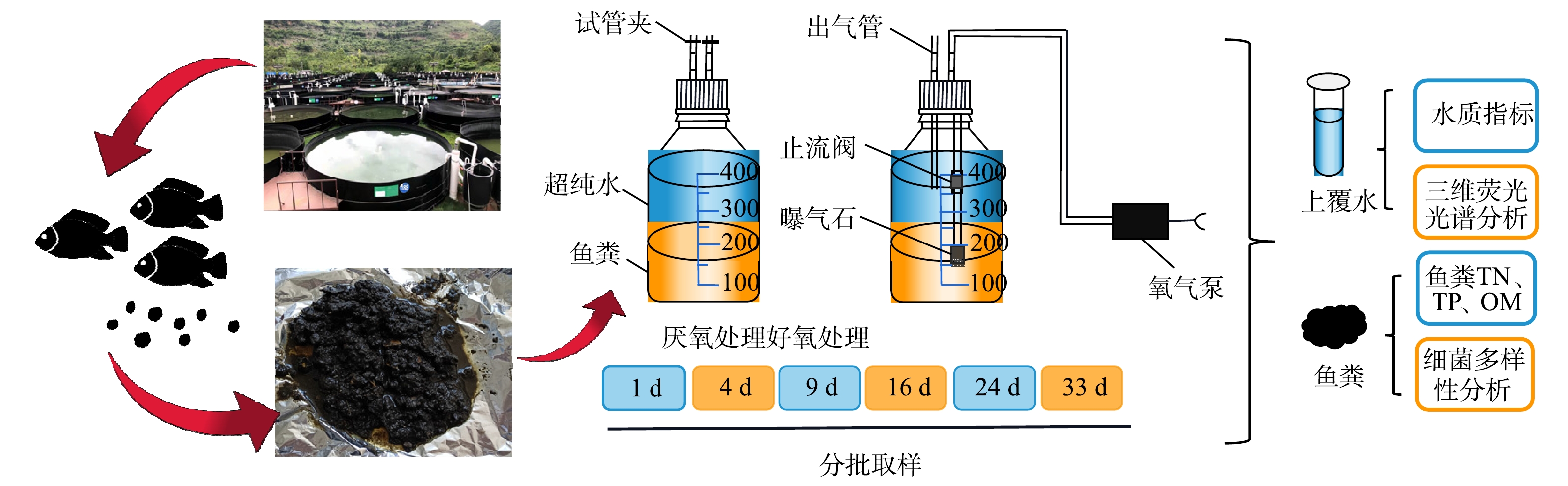
本研究所需的鲈鱼粪采集于万峰湖水产发展有限公司的养殖基地,该公司是贵州省内规模较大的高密度陆基循环水养殖企业,目前已投入生产的陆基循环水养殖箱体达300余个,养殖品种主要有加州鲈鱼、鲤鱼、罗非鱼等,养殖密度可达40~80 kg·m−3。
采用玻璃血清瓶作为实验装置(图1)。具体的实验方法为:分别将80 g冷冻干燥的鲈鱼粪分装于500 mL玻璃血清瓶中,并按相应的比例(固液比1:4)添加320 mL超纯水,充氮气2 min,迅速夹住出气管。共设计好氧和厌氧2个处理组:其中厌氧处理组始终用试管夹夹住出气管;好氧处理组为配有1个氧气泵(曝气量为3 L·min−1)进行持续曝气,溶解氧(dissolved oxygen,DO)为7.93~10.75 mg·L−1,DO平均值为9.98 mg·L−1。根据采样时间间隔,每个处理分别设计6个批次实验(3个重复),置于室温下培养33 d,分别于第1、4、9、16、24、33 天进行取样,其中,厌氧、好氧处理组不同阶段鱼粪样品分别用D1Y、D4Y、D9Y、D16Y、D33Y及D1H、D4H、D9H、D16H、D33H表示。反应结束后,将每个血清瓶中的鱼粪和水混合物进行固液分离,上覆水置于离心管中,在低速离心机中以4 000 r·min−1的转速离心10 min,将上清液过滤后,保存于−4 ℃冰箱待测。鱼粪样品一部分存于−80 ℃冰箱用于细菌群落多样性分析;另一部分自然风干、研磨、过100目筛后用于鱼粪理化性质分析。
-
1)上覆水理化性质分析。上覆水pH、EC值分别采用pH计、电导率仪测定;NH4+-N、NO3−-N、TP含量分别采用纳氏试剂比色法(HJ 535-2009)、紫外分光光度法(HJ/T 346-2007)、钼酸铵紫外分光光度法(GB 11893-89)测定;COD、TOC含量分别采用哈希快速测定仪、TOC测定仪测定。
2)上覆水三维荧光光谱分析。上覆水样的荧光特征使用三维荧光分光光度计(F-380荧光分光光度计,天津港东)分析,方法为:激发光源150 W氙弧灯、PMT电压700 V、信噪比>110、响应时间0.05 s,将水样放于10 mm比色皿中,在激发波长为200~500 nm、发射波长为200~600 nm、扫描间隔为5 nm、扫描速度为30 000 nm·min−1的条件下进行扫描。
3)鱼粪理化性质分析。鱼粪TN、鱼粪TP、有机质( organic matter,OM)分别采用H2SO4-H2O2消煮-奈氏试剂法、H2SO4-H2O2消煮-钼锑抗比色法、水合热重铬酸钾氧化-比色法测定[15-16]。
4)鱼粪细菌DNA提取、PCR扩增及高通量测序。根据E.Z.N.A.® soil DNA kit (Omega Bio-tek,Norcross,GA,美国)说明书进行细菌群落总DNA抽提,使用1%的琼脂糖凝胶电泳检测DNA的提取质量,使用NanoDrop2000测定DNA浓度和纯度,纯度A260/A280值要求在1.8~2.0。将DNA样品置于-20 ℃保存。使用细菌通用引物338F (5’-ACTCCTACGGGAGGCAGCAG-3’) 和806R (5’-GGACTACHVGGGTWTCTAAT-3’) 对16S rRNA基因V3-V4可变区进行PCR扩增[17],扩增程序如下:95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),然后72 ℃稳定延伸10 min,最后在4 ℃进行保存(PCR仪:ABI GeneAmp® 9700型)。PCR反应体系为:5×TransStart FastPfu缓冲液4 μL,2.5 mmol·L−1 dNTPs 2 μL,上游引物(5 umol·L−1)0.8 μL,下游引物(5 umol·L−1)0.8 μL,TransStart FastPfu DNA聚合酶0.4 μL,模板DNA 10 ng,ddH2O补足至20 μL。将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit (Axygen Biosciences,Union City,CA,美国) 进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用Quantus™ Fluorometer (Promega,美国)对回收产物进行检测定量。使用NEXTflexTM Rapid DNA-Seq Kit(Bioo Scientific,美国)进行建库,利用Illumina公司的Miseq PE300平台进行2×300 bp双端测序分析(上海美吉生物医药科技有限公司)。原始数据上传至NCBI SRA数据库(登录号:PRJNA800339)。
-
采用Microsoft Office Excel 2010和Origin 2021软件对数据进行分析处理和作图,并用IBM SPSS 19.0 软件进行单因素方差分析以检验数据间的差异性,以P<0.05为具有显著性差异。使用带有DOMFlour工具包的Matlab R2017a软件对样品三维荧光光谱进行平行因子分析。使用Fastp(version 0.20.0)软件[18]对细菌原始测序序列进行质控,使用FLASH(version 1.2.7)软件[19]进行拼接,使用Usearch软件中UPARSE算法[20](version 7.1),根据97%的相似度对序列进行操作分类单元(operational taxonomic units,OTUs)聚类并剔除嵌合体,利用RDP classifier(version 2.2)[21]对每条序列进行物种分类注释,比对Silva 16S rRNA数据库(version 138),设置比对阈值为70%。使用Origin 2021绘制Bar图,利用R语言包绘制主坐标分析图(principal co-ordinates analysis,PCoA)、冗余分析图(redundancy analysis,RDA)和Heatmap图。
-
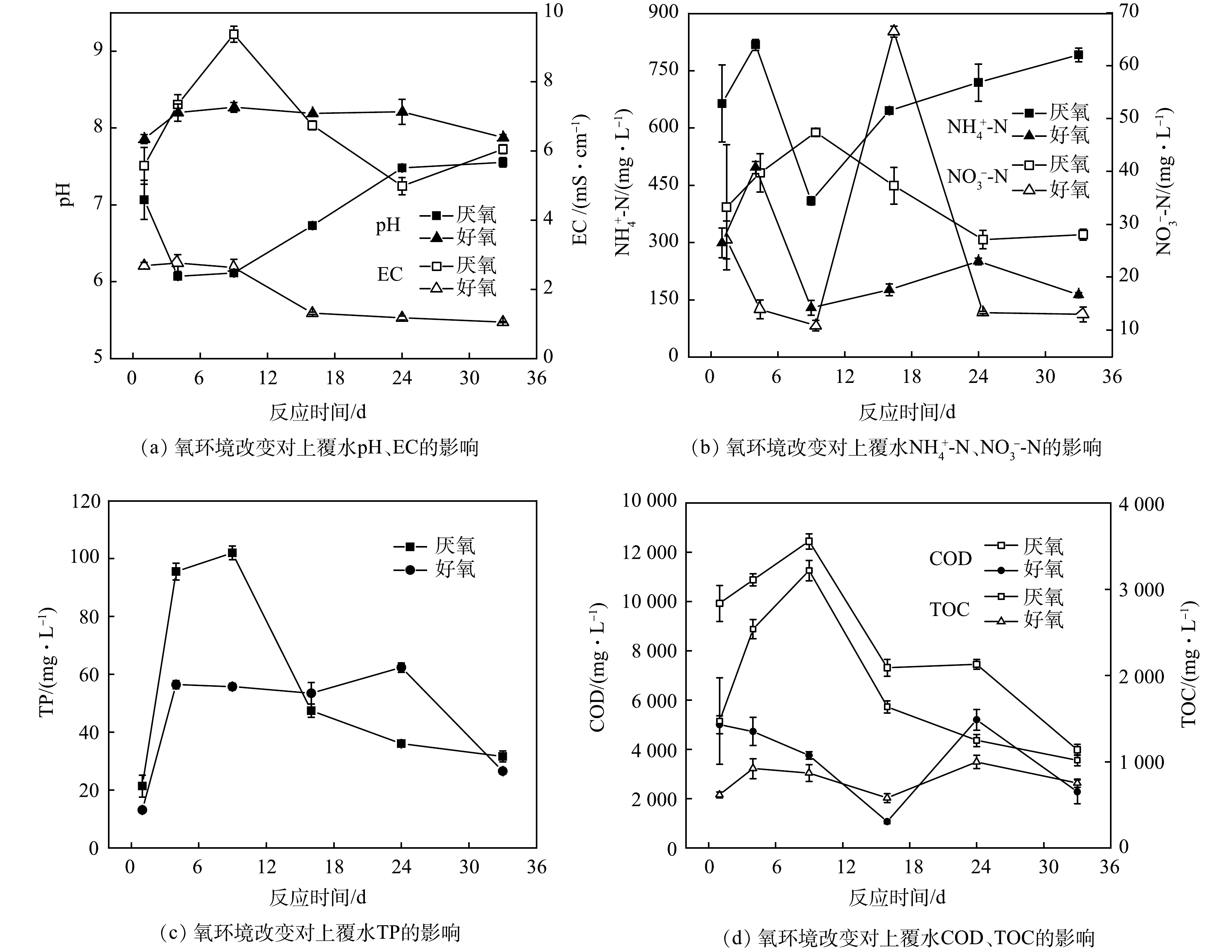
氧环境改变对鱼粪上覆水理化性质的影响如图2所示。随着反应时间的增加,厌氧处理组的上覆水pH均显著低于好氧处理组(P<0.05)。好氧处理组pH由7.85增至8.20,随后在第33天降低至7.87;厌氧处理组pH则先下降后上升至中性,在第4天达到最低值6.07。此外,氧环境改变下上覆水EC变化差异显著(P<0.05),好氧处理组EC随反应时间呈先降低后保持恒定的趋势,反应前期(1~9 d)明显高于反应后期(16~24 d);厌氧处理组上覆水EC随反应时间呈先上升后降低的趋势,在第9天达到最大值(9.38 mS·cm−1),随后逐渐降低。
在第1~24天,厌氧、好氧处理组上覆水NH4+-N质量浓度变化趋势相似,初期持续上升,在第4天均达到最大值,分别为817.82 mg·L−1和496.66 mg·L−1,随后呈下降趋势且在第9天降至最低,分别为409.23 mg·L−1和129.20 mg·L−1;在第9~33天,厌氧处理组NH4+-N质量浓度呈持续上升趋势,好氧处理组则无明显波动。厌氧处理组NO3−-N质量浓度呈先上升(1~9 d)后下降(9~24 d)再恒定(24~33 d)的变化趋势;好氧处理组NO3−-N质量浓度则呈先下降(1~9 d)后上升(9~16 d)再下降(16~24 d)的变化趋势,在第16天达到最大值(66.46 mg·L−1),并于第24天趋于恒定。
反应前期(1~16 d),厌氧、好氧处理TP质量浓度变化趋势相似,但厌氧处理组上覆水TP质量浓度明显高于好氧处理组,在第9天达到峰值(102.00 mg·L−1),随后逐渐下降并趋于稳定;反应中后期(16~33 d)则是好氧处理组略高于厌氧处理组,且波动不大。厌氧处理组COD值在1~9 d迅速升高,在第9天达到峰值(12 450 mg·L−1),随后呈逐渐下降之势;而好氧处理组COD值则呈先下降(1~16 d)后上升(16~24 d)再下降(24~33 d)的趋势,在第16天达到最低值(1 066.67 mg·L−1),且厌氧处理组COD显著高于好氧处理组(P<0.05)。氧环境改变下上覆水TOC与COD变化规律相似,厌氧处理组TOC值在第1~9天迅速升高至3 218.33 mg·L−1后逐渐降低;好氧处理组TOC质量浓度显著低于厌氧处理组(P<0.05),且反应期间TOC质量浓度波动不大。
-
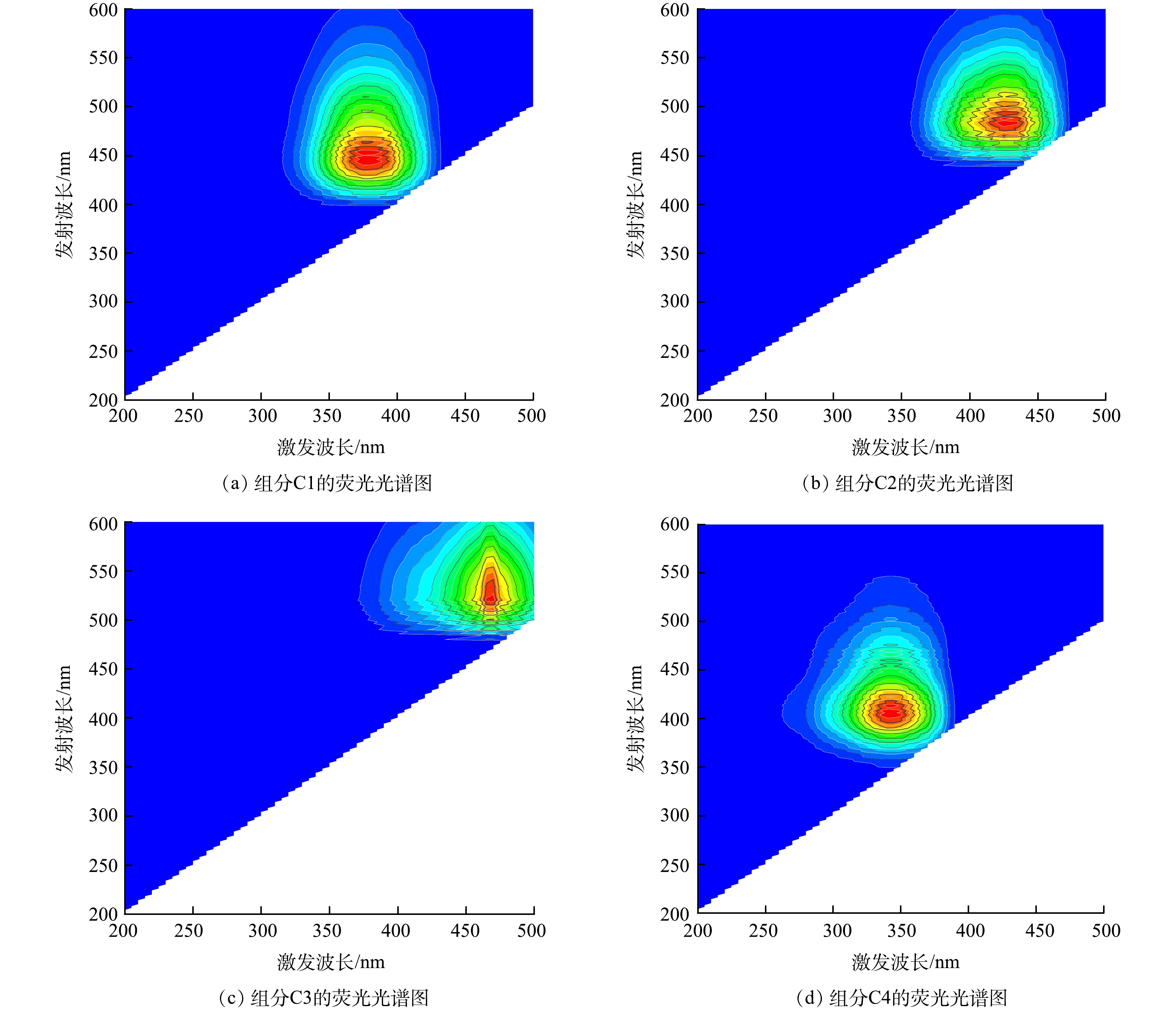
采用平行因子分析法对厌氧、好氧处理鱼粪不同反应时间上覆水样品三维荧光光谱进行解析,分离出4种荧光组分。如图3所示,C1、C2、C3、C4对应Ex/Em分别为375 nm/444 nm、425 nm/484 nm、470 nm/520 nm、340 nm/404 nm,其中C1为类富里酸,C2为富里酸向胡敏酸转化的中间产物,C3为胡敏酸类物质,C4代表一类具有荧光特性的蛋白质类物质[22]。
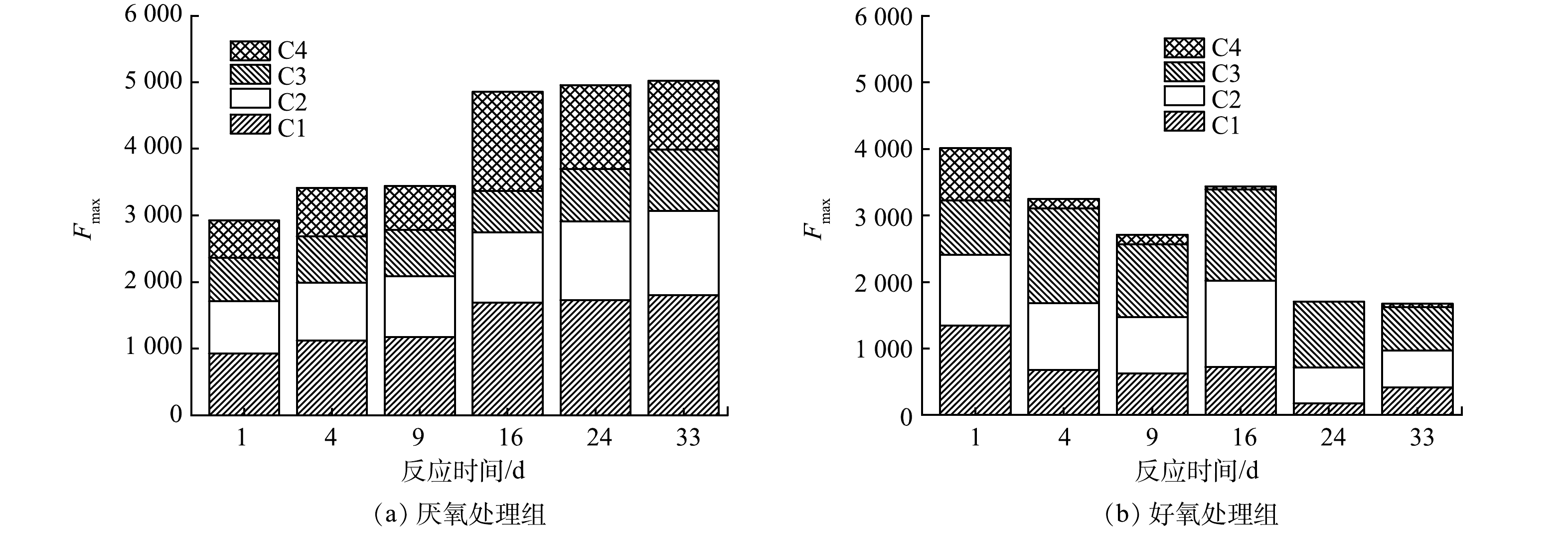
利用平行因子分析法对所得组分最大荧光强度Fmax(maximum fluorescence, Fmax)进行制图,结果如图4所示。Fmax表示各类荧光峰的荧光强度或各样品中各组分的含量。可见,厌氧处理的Fmax值呈现先逐渐升高后下降的趋势;好氧处理组的Fmax值整体呈先逐渐下降后升高再逐渐下降的趋势。在整个反应过程中,厌氧组中C1含量逐渐升高至趋于稳定且含量最高,C2、C3含量逐渐增加,波动不大,C4在反应前期波动不大,中期迅速升高后又缓慢降低,为562.43~1 485.80。好氧条件下,C3占据主导地位,C2呈先降低后升高再降低的趋势,C1、C4变化趋势一致均随反应时间增加逐渐降低,说明好氧条件下蛋白质类、类富里酸物质被逐渐降解为分子质量更小的物质。
-
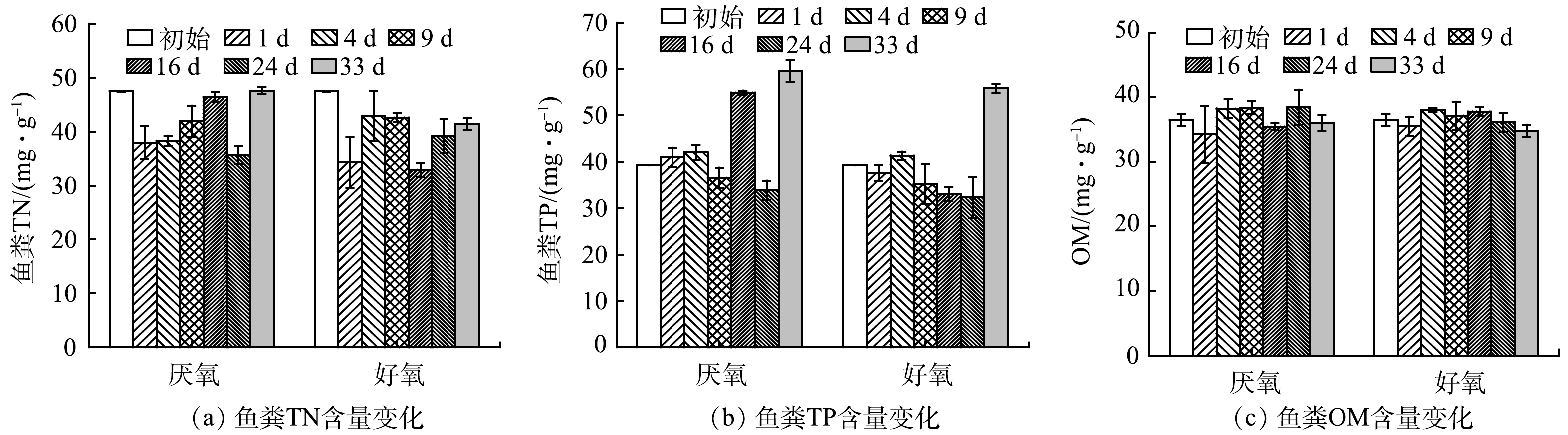
氧环境改变下鱼粪TN、鱼粪TP、OM含量变化特征如图5所示。其中,厌氧处理组鱼粪TN含量在初始阶段迅速降低后逐渐增至47.61 mg·kg−1,好氧处理组鱼粪TN含量在反应初期迅速降低,在第4天增加并趋于稳定,随后逐渐降低至第16天达到最低值(32.93 mg·kg−1)后缓慢增加至41.38 mg·kg−1(图5(a))。厌氧、好氧处理末期鱼粪TP含量分别是初始值的1.52倍、1.42倍,但在反应过程中好氧处理组在初始值附近变化,厌氧处理组除第16天外,整体波动不大(图5 (b))。氧环境改变对鱼粪OM影响不大,OM含量均在初始值附近波动(图5(c))。
-
1)细菌群落α多样性变化。通过Miseq PE300高通量测序平台对12个样品测序,共获得503 966条序列,平均每个样品有41 997条高质量序列,序列平均长度为415.20 bp;共获得9 813个OTUs,平均每个样品有817个OTUs。按照最小样本序列数进行抽平后,共得到17 989条有效序列,样品稀释曲线达到平缓,表明本次测序数据量足够。
对原始数据质控优化后,样品OTUs、细菌群落多样性指数(Shannon和Simpson指数)和丰富度指数(Ace和Chao1指数)如表1所示,样品间OTUs存在差异,D16Y样品中OTUs最高(1 051个),D4H样品中OTUs最低(529个)。在1~4 d,厌氧处理组细菌群落多样性指数高于好氧处理组,在9~33 d则相反;好氧、厌氧处理组细菌群落丰富度指数在1~16 d具有相似的变化趋势,但厌氧处理略高于好氧处理。这说明在反应前期厌氧处理组细菌群落多样性高于好氧处理组,在反应后期则相反;在整个反应过程中,厌氧处理组的细菌群落丰富度优于好氧处理组。
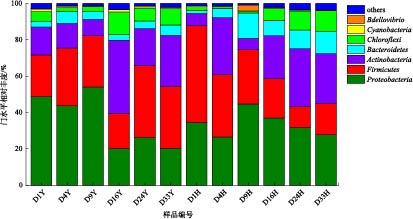
2)氧环境改变下鱼粪中细菌群落组成特征。在门水平上对样品物种丰度进行统计分析,将相对丰度占比少于1%的物种归为others。如图6所示,在门水平上,鱼粪细菌门主要包括变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)。其中,Proteobacteria占主要地位,其相对丰度在厌氧处理前期(1~9 d,43.80%~54.44%)明显高于后期(16~33 d,20.02%~26.61%),其相对丰度在好氧处理组呈逐渐降低的趋势(9~33d,27.61%~44.64%);Firmicutes在厌氧和好氧处理组的相对丰度变化分别为19.49%~39.67%、11.41%~53.30%,特别是厌氧处理后期其相对丰度高于Proteobacteria;Bacteroidetes在好氧处理组的相对丰度高于厌氧处理组,平均相对丰度为9%;Chloroflexi主要出现在第16天以后,且其在好氧处理组中的相对丰度高于厌氧处理组。Actinobacteria在厌氧和好氧处理组中的平均相对丰度分别为21.06%和21.22%,主要出现在反应后期。
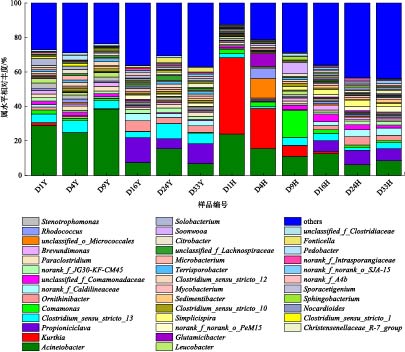
在属水平(图7)上,对Top 40的优势菌属进行分析。结果表明,不同处理下优势菌属的相对丰度存在较大差异,其中厌氧处理组优势菌属为不动杆菌属(Acinetobacter,6.97%~38.54%)、Clostridium_sensu_stricto_13(3.47%~8.69%)、丙酸棒状体菌属(Propioniciclava,0.06%~11.37%)、鸟氨酸球菌属(Ornithinibacter,0.44%~6.00%);好氧处理组优势菌属为Acinetobacter(6.13%~23.95%)、库特氏菌属(Kurthia,0.01%~44.28%)、丛毛单孢菌属(Comamonas,1.18%~15.51%)、Propioniciclava(0.03%~7.15%)、Clostridium_sensu_stricto_13(1.21~4.60%)。其中,Acinetobacter在鱼粪中占有较高的丰度,其在厌氧处理组的相对丰度明显高于好氧处理组,随着反应时间的增加,其相对丰度总体呈逐渐降低的趋势。Kurthia主要存在好氧处理前期(1~9 d),其相对丰度为6.21%~44.18%,明显高于其他菌属。Clostridium_sensu_stricto_13的相对丰度则是厌氧处理组高于好氧处理组。Propioniciclava、Ornithinibacter在厌氧、好氧处理中均主要出现在反应后期,与Actinobacteria的变化趋势一致。Proteobacteria中优势菌属Comamonas主要出现在好氧处理组。此外,Paraclostridium、Stenotrophomonas、Leucobacter等平均相对丰度大于1%的菌属主要存在于厌氧处理组;Rhodococcus、Glutamicibacter等则主要存在好氧处理组中。
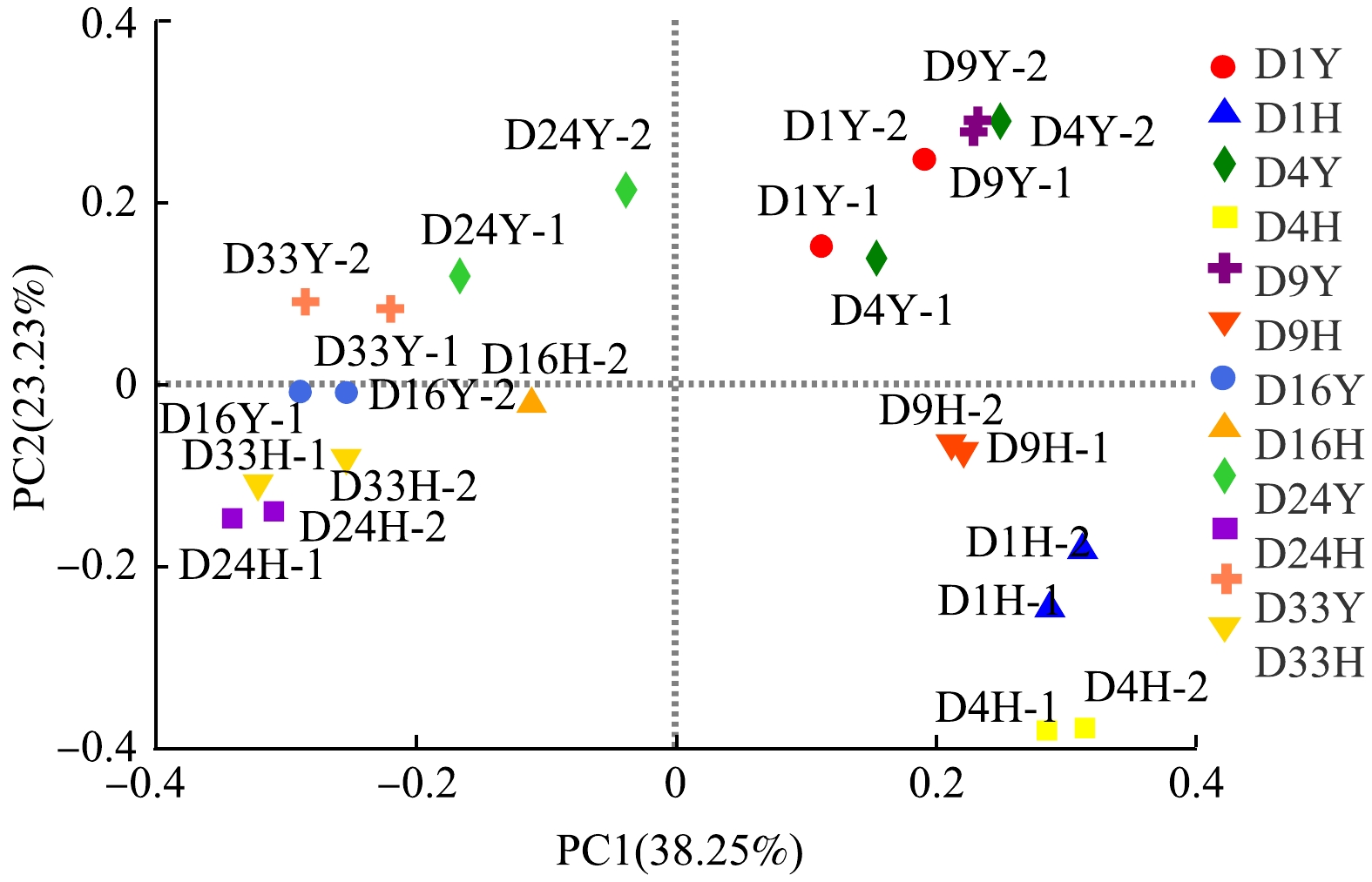
3)细菌群落聚类特征与环境因子相关性分析。基于Bray_Curtis距离的PCoA分析氧环境改变下不同反应阶段鱼粪中细菌在OTUs水平上的相似性和差异性。由图8可见,第1、2主成分的贡献率分别为38.25%和23.23%。厌氧、好氧处理组鱼粪细菌群落组成在反应前期(1~9 d)与反应后期(16~33 d)存在差异;但厌氧、好氧处理组样本点在反应后期接近。这说明氧环境改变初期对鱼粪细菌群落组成有较大的影响,后期细菌群落组成则趋于相似。
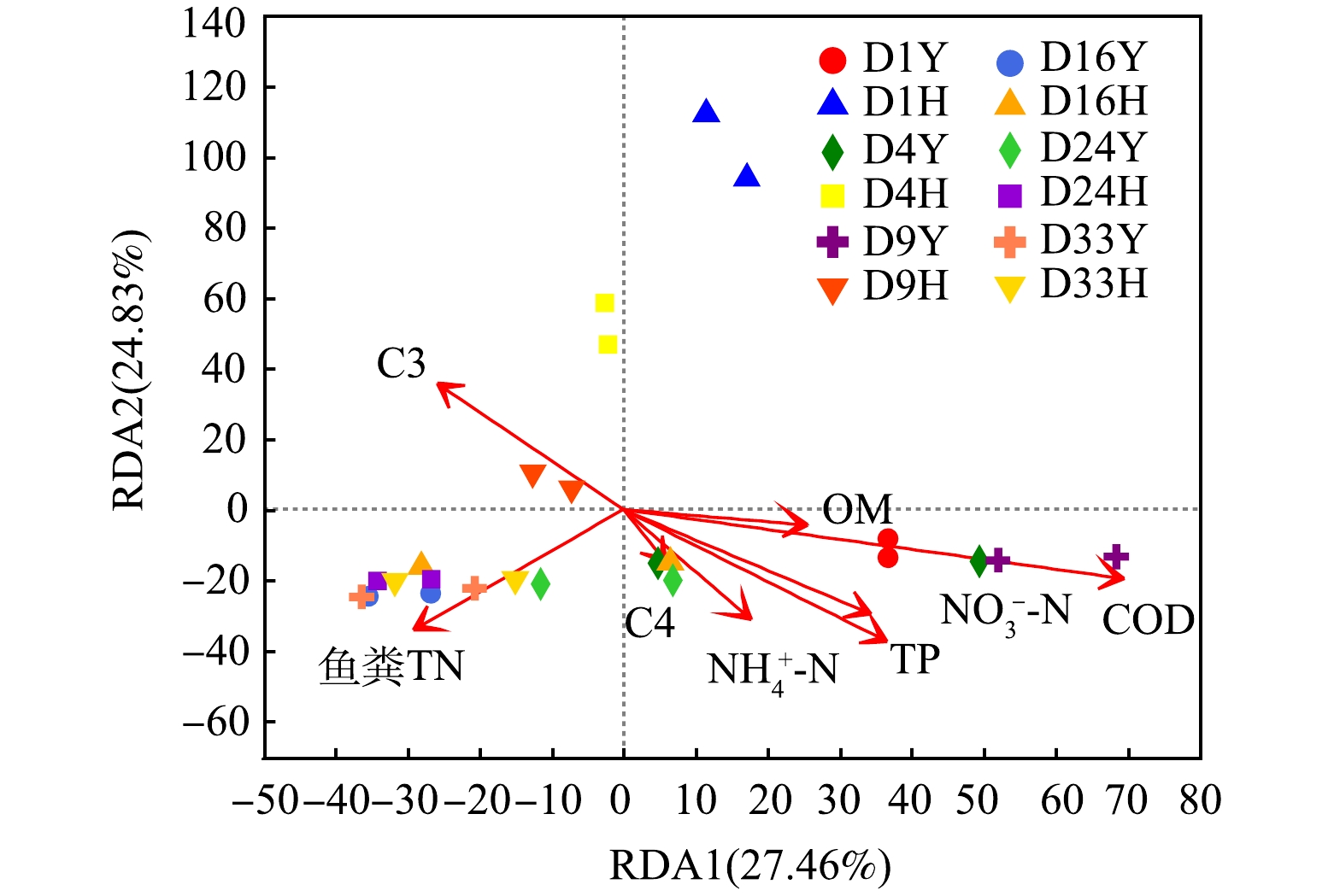
细菌群落结构与环境因子的变化紧密相关,利用方差膨胀因子(variance inflation factor,VIF)分析对环境因子进行筛选,过滤掉VIF大于10且存在共线性的环境因子(pH、EC、TOC、鱼粪TP、C1、C2)。对NH4+-N、NO3−-N、TP、COD、鱼粪TN、OM、C3、C4 等环境因子与鱼粪细菌群落(属水平)进行RDA分析(图9)。结果表明,环境因子对鱼粪细菌群落的贡献率为52.29%,RDA1和RDA2的解释度分别为27.46%和24.83%。鱼粪TN和C3与RDA1呈负相关,C3与RDA2呈正相关。在各理化因子中,COD (r2=0.598 6,P=0.001)、TP(r2=0.278 9,P=0.028)显著影响细菌群落结构。
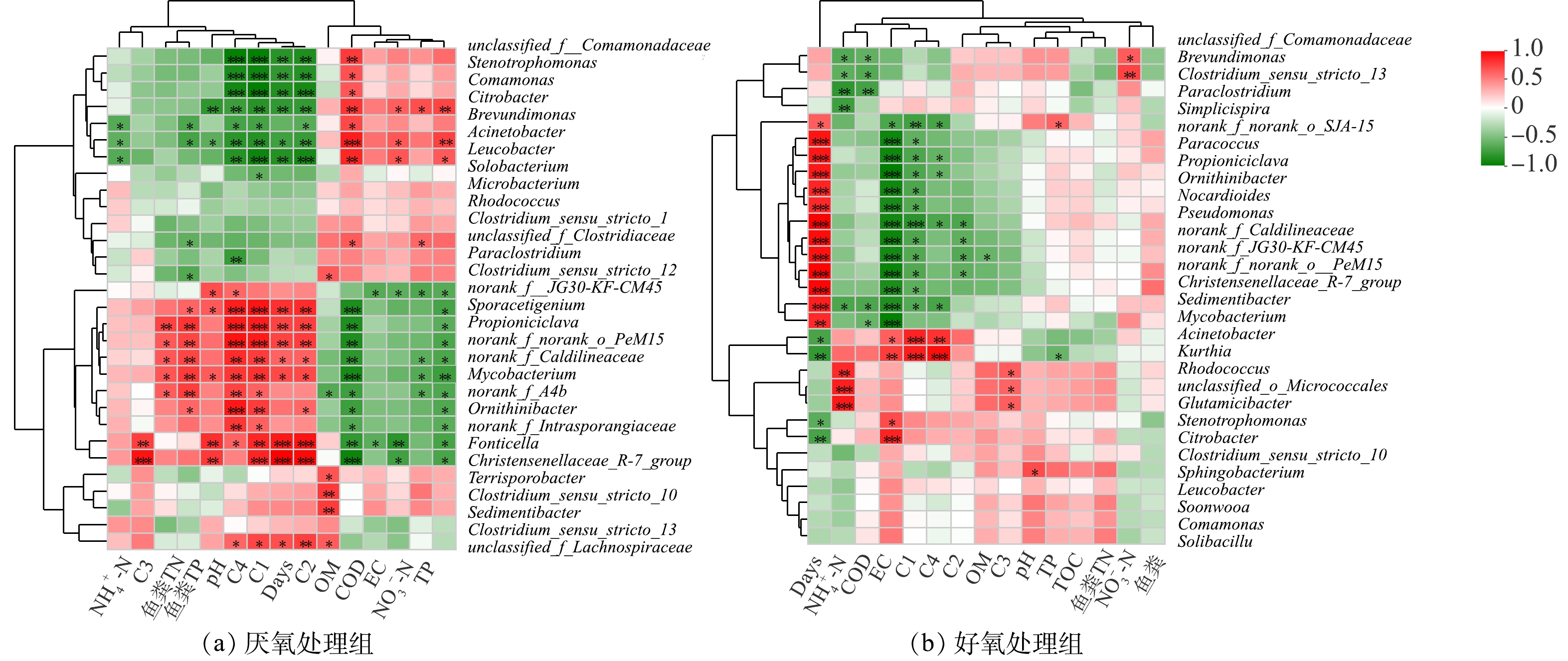
厌氧、好氧条件下相对丰度前30的菌属与环境因子间的Heatmap图如图10所示。可见,厌氧处理组中大多数细菌与环境因子显著相关(P<0.05)。其中,Acinetobacter、Leucobacter、Citrobacter与COD、TOC、NO3−-N呈显著正相关,与反应时间、C1、C2、C4、pH、鱼粪TP、NH4+-N呈负相关或显著负相关;Propioniciclava、norank_f_Caldilineaceae、norank_f_norank_o_PeM15、Mycobacterium、Ornithinibacter等与COD、TOC、TP、NO3−-N、EC呈显著负相关或负相关,与C1、C2、C4、反应时间、鱼粪TP、鱼粪TN、pH呈正相关或显著正相关;而优势菌属Clostridium_sensu_stricto_13、Paraclostridium与环境因子的相关性不显著(P>0.05)。
好氧处理中与环境因子显著相关的细菌属较少,主要有Acinetobacter、Kurthia,其与EC、C1、C4呈显著正相关,与反应时间呈显著负相关;Propioniciclava、Ornithinibacter、Pseudomonas、norank_f_Caldilineaceae、norank_f_norank_o_PeM15等菌属与反应时间呈显著正相关,与EC、C1、C2、C4呈显著负相关;Glutamicibacter、Rhodococcus、unclassified_o_Micrococcales与NH4+-N、C3呈显著正相关。
-
氧环境改变对上覆水理化性质具有不同影响,在厌氧条件下鱼粪中的有机物先分解产生大量无机盐和有机酸,使上覆水EC升高,pH降低;但随着厌氧反应的进行,小分子有机酸及阴阳离子被微生物转化利用生成CH4、CO2及腐殖质类物质,进而促使上覆水EC下降、pH升高[14]。对于好氧处理组,鱼粪中有机质可通过有氧途径进行分解降低发酵反应产生的酸性物质,同时氧气泵曝气的吹脱作用会促进反应过程中NH3、CO2的排放,使上覆水呈弱碱性,EC有所下降[14,23]。氧环境改变下反应前期上覆水营养盐浓度(NH4+-N、TP、COD、TOC)迅速升高,且厌氧处理组显著高于好氧处理组(P<0.05)。这归结于反应初期鱼粪-水界面的浓度差使鱼粪向上覆水释放营养盐(C、N、P),其中,厌氧、好氧环境分别为促进和抑制此过程的发生[24]。但好氧处理初期曝气的扰动作用会使部分鱼粪颗粒处于悬浮状态,从而促进污染物的释放;同时曝气复氧改变了底部鱼粪的氧化还原环境,鱼粪中存在的兼性或好氧性细菌加速有机质分解,导致鱼粪N、P、COD等向上覆水中释放[24-25]。随着反应时间的增加,厌氧条件下有机质矿化过程中产生的NH4+-N由于缺氧不能通过硝化作用转化为NO3−-N,因此反应中后期,NH4+-N质量浓度逐渐增加。好氧处理组NH4+-N质量浓度低于厌氧处理组,可能是好氧处理充分曝气,上覆水中的一部分NH4+-N可能会扩散到鱼粪中,并进一步转化为有机氮,另一部分NH4+-N可能通过硝化作用转化为硝酸盐;同时在好氧处理下,pH为中偏碱性,NH4+-N会与上覆水中的OH-发生反应转化为NH3从水体中逸出[26]。对于NO3−-N而言,反硝化作用是NO3−-N衰减的主要过程,主要在厌氧条件下发生,因此厌氧处理组上覆水中NO3−-N质量浓度初期波动后逐渐降低。高DO含量会抑制沉积物-水界面的反硝化作用,导致NO3−-N积累,并在适当的条件下进一步释放到上覆水中[26]。但本研究中厌氧处理组上覆水NO3−-N平均质量浓度高于好氧处理组,仅在反应中期好氧处理组高于厌氧处理组。这可能是存在的好氧反硝化菌(如Comamonas)在有氧条件下进行了反硝化作用[27]。反应中后期,厌氧、好氧处理组TP质量浓度逐渐下降,这主要是由于反应后期各处理组pH均为中偏碱性,Fe(OH)3会吸附上覆水中的P;此外,鱼粪中有机物分解产生的腐殖质等能与铁、铝等形成络合物,生成有机-无机配体,增加对鱼粪中磷的吸附,从而减少鱼粪向上覆水释磷[28]。在反应后期,厌氧、好氧处理组上覆水COD、TOC质量浓度持续下降,这可能与鱼粪中微生物将有机物分解为CO2和H2O及有机物可通过吸附沉淀等方式向底部转移有关[23]。
三维荧光光谱分析结果表明,氧环境改变下鱼粪上覆水中荧光物质主要为蛋白质、腐殖质类物质(类富里酸、胡敏酸)。厌氧处理组DOM各组分(C1、C2、C4)含量均高于好氧处理组。林绍霞等[29]发现荧光组分含量与水环境中NH4+-N、CODMn、TOC、TP呈正相关。这可能也是厌氧处理组上覆水水质指标(NH4+-N、COD、TOC)高于好氧处理组的原因之一。对于好氧处理组,水体中的荧光组分含量逐渐降低,主要是因为在高溶解氧条件下,有利于腐殖质通过酶水解形成更具生物利用度的物质,同时蛋白质被水解形成氨基酸经氧化脱氨作用进一步矿化成CO2[30]。
-
氧环境改变下鱼粪细菌群落在门和属水平的优势菌群组成分布特征表明,在门水平上,Proteobacteria、Firmicutes、Actinobacteria、Bacteroidetes、Chloroflexi为主要优势菌门,随反应时间增加,优势菌门相对丰度呈现差异。其中,Proteobacteria是脱氮除磷降低水中COD的主要功能菌门,能够去除和转化多种污染物[31]。鱼粪中的氮磷可为Proteobacteria提供丰富的营养物质,促进该类菌群的生长繁殖[6],因此,Proteobacteria占据了一定的生态位优势。Firmicutes是第二优势菌门,其可以通过直接利用水中硝酸盐和亚硝酸盐从而净化水质[6]。Actinobacteria能分泌多种酶,促进水中蛋白质分解[32],从而降低上覆水中DOM。Bacteroidetes在好氧处理后期占有一定的相对丰度,养殖水体中残饵及粪便的沉积,可能导致水体中Bacteroidetes数量增加,且该菌门与有机质的降解和氮矿化密切相关[33],这可能与好氧处理组反应后期NH4+-N、COD、TOC小幅减少有关。在属水平上,Comamonas菌属在好氧处理中的相对丰度高于厌氧处理组,该菌属是兼养的反硝化细菌,在异养和自养的反硝化过程中都有观察到[34],这可能与好氧处理组上覆水营养物质(NH4+-N、NO3−-N)质量浓度低于厌氧处理组有关。厌氧处理组中Acinetobacter菌属占据绝对的优势,且其相对丰度明显高于好氧处理组,该类菌属具有反硝化作用和解磷功能[34],这可能是鱼粪上覆水NO3−-N、TP质量浓度逐渐降低的原因之一。Clostridium-sensu-stricto_13是一类能形成芽胞、厌氧生长的革兰阳性杆菌,具有反硝化除磷功能[35];本研究中该菌属主要出现在厌氧处理组,可促进厌氧反硝化作用,使鱼粪上覆水NO3−-N质量浓度逐渐降低。
微生物动态变化是对环境变化的有效响应。PCoA分析表明随反应时间增加,细菌群落结构趋于相似,可能是反应后期上覆水中营养物质(如TP、COD、TOC)质量浓度接近导致了更多相似的细菌群落[36]。RDA分析也表明COD、TP与鱼粪细菌群落的相关性显著(P<0.05),是影响鱼粪细菌群落多样性和组成的重要驱动因素。由图10可见,厌氧处理组中COD、TOC、反应时间、C1、C2、C4、鱼粪TP和TN、NO3−-N等与大部分细菌属的相关性显著 (P<0.05);好氧处理组中只有部分细菌菌属与EC、反应时间、C1、C2、C4、NH4+-N的相关性显著(P<0.05),而与其他环境因子的相关性不强。其中,不同氧环境下大多数细菌属均与C1、C2、C4的相关性显著(P<0.05)。有研究表明[37],Proteobacteria、Bacteroidetes等细菌门在营养物质充足时可快速生长;同时,富含蛋白质、氨基酸等高生物活性物质可为微生物生长代谢提供丰富碳源,提高微生物分解活性,说明DOM可提高细菌群落的生产力及适应性。有研究表明[38],N和P等环境因子被认为是影响细菌生长的重要因子。由图10可见,大部分营养盐对厌氧处理组细菌群落结构的影响明显强于好氧处理组,结合好氧处理组中后期细菌群落多样性与丰富度指数分别高于和低于厌氧处理组的结果,说明好氧环境更适合鱼粪细菌群落生长代谢且具有更强的稳定性,不易受外界环境的影响。
综上所述,氧环境改变下鱼粪中C、N、P释放特征影响鱼粪细菌群落的组成及多样性;反之,氧环境改变下细菌群落结构与组成的改变能够综合反映鱼粪C、N、P的释放特征。因此,基于RAS的高密度养殖并投入大量饵料和抗病药物等,使得养殖水体和沉积物中营养盐和有机质含量升高影响沉积物细菌的群落结构及其生态功能,进而影响养殖环境和养殖对象的健康发展。可以考虑通过曝气、加装增氧机等方式充氧减缓沉积物中鱼粪营养盐的释放及厌氧微生物的增长,提高系统净化工效及生物安全性。
-
1)厌氧处理组上覆水中C、N、P浓度整体高于好氧处理组。其中,厌氧处理组上覆水NO3−-N、TP、COD、TOC质量浓度及好氧处理组上覆水NH4+-N、TP、COD、TOC质量浓度均呈先升高后降低的趋势。氧环境改变下鱼粪上覆水中DOM组分(C1、C2、C3、C4)主要成分是蛋白质、腐殖质类物质;厌氧和好氧处理分别促进和抑制鱼粪DOM组分释放。
2)氧环境改变下不同反应时间鱼粪优势细菌门主要为Proteobacteria、Firmicutes、Actinobacteria、Bacteroidetes、Chloroflexi。优势菌属的相对丰度因氧环境改变和反应时间增加存在差异,厌氧处理组细菌属主要有Acinetobacter、Clostridium_sensu_stricto_13、Propioniciclava、Ornithinibacter;好氧处理组细菌属主要有Acinetobacter、Kurthia、Comamonas、Propioniciclava。
3)细菌群落聚类特征与环境因子相关性分析表明,氧环境改变下鱼粪中细菌群落结构逐渐趋于相似。厌氧处理组COD、TOC、反应时间、C1、C2、C4、鱼粪TP和TN等与大部分细菌属显著相关(P<0.05);好氧处理组细菌群落多样性稳定性强,仅有部分细菌属与反应时间、EC、C1、C2、C4显著相关(P<0.05)。
氧环境改变对陆基循环水养殖鱼粪碳、氮、磷释放特征及细菌群落的影响
Oxygen environment changes on carbon, nitrogen, and phosphorus release and bacterial community of land-based recirculating aquaculture fish manure
-
摘要: 为探究氧环境改变对陆基循环水养殖系统(RAS)中鲈鱼粪氮(N)、磷(P)、溶解性有机质(DOM)释放特征及鱼粪细菌群落多样性的影响,采用室内模拟的方法,分析氧环境(好氧、厌氧)改变对鱼粪及其上覆水理化性质及鱼粪细菌群落特征的影响,并揭示其间的相关关系。结果表明,第1~16天,厌氧处理上覆水中NH4+-N、TP、COD和TOC质量浓度明显高于好氧处理,在第16~33 天,NH4+-N质量浓度持续增加、TP质量浓度低于好氧处理组、COD和TOC质量浓度降低但仍高于好氧处理。三维荧光光谱表明,氧环境改变下上覆水DOM主要成分是蛋白质、腐殖质类物质,但厌氧条件下各组分含量均较高。细菌群落分析表明,不同处理鱼粪细菌群落相对丰度存在差异,优势菌门为Proteobacteria、Firmicutes、Actinobacteria、Bacteroidetes、Chloroflexi,相对丰度均大于5%;厌氧处理组优势菌属为Acinetobacter、Clostridium_sensu_stricto_13、Propioniciclava、Ornithinibacter,好氧处理组优势菌属为Acinetobacte、Kurthia、Comamonas、Propioniciclava。细菌群落聚类特征与环境因子相关性表明,随反应时间增加,氧环境改变下细菌群落结构趋于相似;厌氧处理下DOM(C1、C2、C4)、反应时间、COD、TOC、鱼粪TN、鱼粪TP、NO3−-N是影响细菌属的关键环境因子,好氧处理下仅有部分细菌属与反应时间、EC、DOM(C1、C2、C4)、NH4+-N具有显著相关性(P<0.05)。厌氧处理能够显著影响鱼粪及上覆水的理化性质,促进氮、磷及有机质释放,并在一定程度上影响细菌群落结构和多样性,其次是好氧处理。Abstract: In order to explore the effects of oxygen environment changes on the release characteristics of nitrogen (N), phosphorus (P), dissolved organic matter (DOM) and bacterial community diversity from fish manure in the land-based circulating water culture system (RAS). The indoor simulation experiments were conducted to analyze the effects of oxygen environment (aerobic and anaerobic) changes on the physicochemical properties of the fish manure and its overlying water, and the bacterial community characteristics of the fish manure, finally reveal their correlations. The results showed that the mass concentrations of NH4+-N, TP, COD, and TOC in the overlying water by anaerobic treatments were significantly higher than that by aerobic treatments at 1-16 d. At 16-33 d, the NH4+-N continuously increased and the TP was lower than that by aerobic treatments. The mass concentrations of COD and TOC by the anaerobic treatment were still higher than that by aerobic treatments. Three-dimensional fluorescence spectroscopy showed that DOM components in the overlying water mainly included protein and humic substances under the changes of oxygen environment, but anaerobic conditions caused higher contents of each component. Microbiological analysis showed that there were differences in the relative abundance of bacterial communities by different treatments. The dominant bacterial phyla were Proteobacteria, Firmicutes, Actinobacteria, Bacteroidetes, and Chloroflexi, and their relative abundances were all greater than 5%. The dominant bacterial genera by anaerobic treatments mainly included Acinetobacter, Clostridium_sensu_stricto_13, Propioniciclava, and Ornithinibacte. The dominant bacterial genera by aerobic treatments were Acinetobacte, Kurthia, Comamonas, and Propioniciclava. The correlation analysis between the clustering characteristics of bacterial community and environmental factors showed that the bacterial community structure by aerobic and anaerobic treatments tended to be similar with the increase of reaction times. The DOM components (C1, C2, and C4), reaction times, COD, TOC, fish manure TN, fish manure TP, and NO3−-N were the key environmental factors that affecting the bacterial genera by anaerobic treatments. There were significant correlations between some bacterial genera and reaction times, EC, DOM (C1, C2, C4), NH4+-N, and COD by aerobic treatments (P<0.05). Additionally, the change in oxygen environment significantly impacted the physicochemical properties of fish manure and its overlying water, promoted the release of N, P and DOM, and influenced on the structure and diversity of bacterial community. These effects by anaerobic treatments were stronger than that by aerobic treatments.
-

-
表 1 氧环境改变下鱼粪中细菌多样性指数变化特征
Table 1. The diversity index of bacteria in fish manure under the changes in oxygen environment
样品 平均序列数/条 OTUs/个 Ace指数 Chao1指数 Shannon指数 Simpson指数 D1Y 37 159 840 1 658 1 429 4.57 0.06 D4Y 45 069 690 1 429 1 218 4.54 0.06 D9Y 34 295 710 1 452 1 230 4.09 0.11 D16Y 41 461 1 051 1 617 1 560 5.20 0.03 D24Y 45 779 844 1 485 1 474 4.94 0.03 D33Y 45 174 983 1 974 1 715 5.20 0.02 D1H 39 302 636 1 523 1 242 3.15 0.21 D4H 39 004 529 1 124 972 3.73 0.08 D9H 42 965 555 1 065 935 4.41 0.03 D16H 36 722 948 1 735 1 614 5.26 0.02 D24H 49 584 1 028 1 670 1 704 5.44 0.01 D33H 47 452 999 1 604 1 630 5.40 0.02 -
[1] AGUILAR-ALARCÓN P, GONZALEZ S V, SIMONSEN M A, et al. Characterizing changes of dissolved organic matter composition with the use of distinct feeds in recirculating aquaculture systems via high-resolution mass spectrometry[J]. Science of the Total Environment, 2020, 749: 142326. doi: 10.1016/j.scitotenv.2020.142326 [2] BESSON M, AUBIN J, KOMEN H, et al. Environmental impacts of genetic improvement of growth rate and feed conversion ratio in fish farming under rearing density and nitrogen output limitations[J]. Journal of Cleaner Production, 2016, 116: 100-109. doi: 10.1016/j.jclepro.2015.12.084 [3] BADIOLA M, MENDIOLA D, BOSTOCK J, et al. Aquacultural engineering recirculating aquaculture systems (RAS) analysis: Main issues on management and future challenges[J]. Aquacultural Engineering, 2012, 51: 26-35. doi: 10.1016/j.aquaeng.2012.07.004 [4] MARTINS C I M, EDING E H, VERDEGEM M C J, et al. New developments in recirculating aquaculture systems in Europe: a perspective on environmental sustainability[J]. Aquacultural Engineering, 2010, 43(3): 83-93. doi: 10.1016/j.aquaeng.2010.09.002 [5] VAN R J. Waste treatment in recirculating aquaculture systems[J]. Aquacultural Engineering, 2013, 53: 49-56. [6] 冯国禄, 罗金飞, 廖永岩, 等. 不同盐度循环养殖水体微生物群落特征[J]. 环境科学研究, 2020, 33(8): 1838-1847. doi: 10.13198/j.issn.1001-6929.2020.02.11 [7] YOKOYAMA H, ABO K, ISHIHI Y. Quantifying aquaculture-derived organic matter in the sediment in and around a coastal fish farm using stable carbon and nitrogen isotope ratios[J]. Aquaculture, 2006, 254: 411-425. doi: 10.1016/j.aquaculture.2005.10.024 [8] WANG J F, CHEN J G, YU P P, et al. Oxygenation and synchronous control of nitrogen and phosphorus release at the sediment-water interface using oxygen nano-bubble modified material[J]. Science of The Total Environment, 2020: 725. doi: 10.1016/j.scitotenv.2020.138258 [9] 代政, 祁艳丽, 唐永杰, 等. 上覆水环境因子对滨海水库沉积物氮磷释放的影响[J]. 环境科学研究, 2016, 29(12): 1766-1772. doi: 10.13198/j.issn.1001-6929.2016.12.05 [10] BEUTEL M W, LEONARD T M, DENT S R, et al. Effects of aerobic and anaerobic conditions on P, N, Fe, Mn, and Hg accumulation in waters overlaying profundal sediments of an oligo-mesotrophic lake[J]. Water Research, 2008, 42: 1953-1962. doi: 10.1016/j.watres.2007.11.027 [11] KANG M X, PENG S, TIAN Y M, et al. Effects of dissolved oxygen and nutrient loading on phosphorus fluxes at the sediment-water interface in the Hai River Estuary, China[J]. Marine Pollution Bulletin, 2018, 130: 132-139. doi: 10.1016/j.marpolbul.2018.03.029 [12] YANG P, ZHAO G H, TONG C, et al. Assessing nutrient budgets and environmental impacts of coastal land-based aquaculture system in southeastern China[J]. Agriculture, Ecosystems& Environment, 2021: 322. doi: 10.1016/j.agee.2021.107662 [13] BORGES P A F, TRAIN S, DIAS J D, et al. Effects of fish farming on plankton structure in a Braziliantropical reservoir[J]. Hydrobiologia, 2010, 649(1): 279-291. doi: 10.1007/s10750-010-0271-2 [14] ZHU D T, CHENG X J, SAMPLE D J, et al. Effect of intermittent aeration mode on nitrogen concentration in the water column and sediment pore water of aquaculture ponds[J]. Journal of Environmental Sciences, 2020, 90: 331-342. doi: 10.1016/j.jes.2019.11.022 [15] 熊仕娟, 徐卫红, 杨芸, 等. 不同温度下微生物和纤维素酶对发酵猪粪理化特性的影响[J]. 环境科学学报, 2014, 34(12): 3158-3165. doi: 10.13671/j.hjkxxb.2014.0668 [16] 鲁如坤. 土壤农业化学分析方法[J]. 北京. 中国农业科技出版社, 2000: 108. [17] XU N, TAN C, WANG H Y, et al. Effect of biochar additions to soil on nitrogen leaching, microbial biomass and bacterial community structure[J]. European Journal of Soil Biology, 2016, 74: 1-8. doi: 10.1016/j.ejsobi.2016.02.004 [18] CHEN S F, ZHOU Y Q, CHEN Y R, et al. fastp: an ultra-fast all-in-one FASTQ preprocessor[J]. Bioinformatics, 2018, 34(17): 884-890. doi: 10.1093/bioinformatics/bty560 [19] MAGOČ T, SALZBERG S L. FLASH: fast length adjustment of short reads to improve genome assemblies[J]. Bioinformatics, 2011, 27(21): 2957-2963. doi: 10.1093/bioinformatics/btr507 [20] EDGAR R C. UPARSE: highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods, 2013, 10(10): 996-998. doi: 10.1038/nmeth.2604 [21] WANG Q, GARRITY G M, TIEGJE J M, et al. Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J]. Applied Environment Microbiology, 2007, 73(16): 5261‐5267. [22] 梅晓洁, 唐建国, 张悦. 城镇污水处理厂污泥稳定化处理产物转化机理及可利用价值揭示[J]. 给水排水, 2018, 54(11): 11-19. doi: 10.3969/j.issn.1002-8471.2018.11.002 [23] 尚丽霞, 柯凡, 李文朝, 等. 高密度蓝藻厌氧分解过程与污染物释放实验研究[J]. 湖泊科学, 2013, 25(1): 47-54. doi: 10.3969/j.issn.1003-5427.2013.01.007 [24] 谌建宇, 许振成, 骆其金, 等. 曝气复氧对滇池重污染支流底泥污染物迁移转化的影响[J]. 生态环境, 2008, 17(6): 2154-2158. [25] 王美丽, 刘 春, 何连生, 等. 曝气深度对河道底泥特性及水质的影响[J]. 环境工程学报, 2016, 10(6): 2909-2914. doi: 10.12030/j.cjee.201501034 [26] ZHANG L, WANG S R, WU Z H. Coupling effect of pH and dissolved oxygen in water column on nitrogen release at watere-sediment interface of Erhai Lake, China[J]. Estuarine, Coastal and Shelf Science, 2014, 149: 178-186. doi: 10.1016/j.ecss.2014.08.009 [27] TIAN X P, ZHAO J T, HUANG J, et al. The metabolic process of aerobic granular sludge treating piggery wastewater: Microbial community, denitrification genes and mathematical model calculation[J]. Journal of Environmental Chemical Engineering, 2021: 9. doi: 10.1016/j.jece.2021.105392 [28] BAO Y, HUANG T, NING C W, et al. Changes of DOM and its correlation with internal nutrient release during cyanobacterial growth and decline in Lake Chaohu, China[J]. Journal of Environmental Sciences, 2023, 124: 769-781. doi: 10.1016/j.jes.2022.02.019 [29] 林绍霞, 肖致强, 张转铃, 等. 贵州草海水体溶解性有机物的荧光光谱特征及来源解析[J]. 中国环境科学, 2021, 41(3): 1325-1335. doi: 10.3969/j.issn.1000-6923.2021.03.036 [30] ZHAO L Y, LI N, HUANG T L, et al. Effects of artificially induced complete mixing on dissolved organic matter in a stratified source water reservoir[J]. Journal of Environmental Sciences, 2022, 111: 130-140. doi: 10.1016/j.jes.2021.03.024 [31] HOU L F, ZHOU Q, WU Q P, et al. Spatiotemporal changes in bacterial community and microbial activity in a full-scale drinking water treatment plant[J]. Science of the Total Environment, 2018, 625: 449-459. doi: 10.1016/j.scitotenv.2017.12.301 [32] SINGH B, MINICK K J, STRICKLAND M S, et al. Temporal and spatial impact of human cadaver decomposition on soil bacterial and arthropod community structure and function[J]. Frontiers in Microbiology, 2018: 8. doi: 10.3389/fmicb.2017.02616 [33] CHEN J F, LIU Y Y, LIU K, et al. Bacterial community composition of internal circulation reactor at different heights for large-scale brewery wastewater treatment[J]. Bioresource Technology, 2021: 331. doi: 10.1016/j.biortech.2021.125027 [34] ZHOU R, WANG Y J, HILAL M G, et al. Temporal succession of water microbiomes and resistomes during carcass decomposition in a fish model[J]. Journal of Hazardous Materials, 2021: 403. doi: 10.1016/j.jhazmat.2020.123795 [35] MELVILLE C M, SCOTT K P, MERCER D K, et al. Novel tetracycline resistance gene, tet(32), in the Clostridium-related human colonic anaerobe K10 and its transmission in vitro to the rumen anaerobe Butyrivibrio fibrisolvens[J]. Antimicrobial Agents and Chemotherapy, 2001, 45(11): 3246-3249. doi: 10.1128/AAC.45.11.3246-3249.2001 [36] WEISS S, CARTER D O, METCALF J L, et al. Carcass mass has little influence on the structure of grave soil microbial communities[J]. International Journal of Legal Medicine, 2016, 130(1): 253-263. doi: 10.1007/s00414-015-1206-2 [37] TRAVING S J, ROWE O, JAKOBSEN N M, et al. The effect of increased loads of dissolved organic matter on estuarine microbial community composition and function[J]. Frontiers in Microbiology, 2017: 8. doi: 10.3389/fmicb.2017.00351 [38] WANG H J, LIU X C, WANG Y L, et al. Spatial and temporal dynamics of microbial community composition and factors influencing the surface water and sediments of urban rivers[J]. Journal of Environmental Sciences, 2022, 124: 187-197. -



 下载:
下载: