-
台特玛湖是我国最大的内陆河塔里木河与车尔臣河的尾闾湖。20世纪70年代后,由于塔里木河中上游截流用水,1 321 km的干流河道有近400 km出现断流,尾闾台特玛湖干涸,大片胡杨林死亡[1]。为遏制塔里木河流域生态环境持续恶化,2000年国家启动了塔里木河流域近期综合治理工程,投资107×109元,向河流下游生态输水[2-3]。近20 a,台特玛湖水面逐渐恢复,现已成南疆第2大湖泊,湖泊生态环境不断得到改善,是阻断塔克拉玛干和罗布泊合拢的生态屏障[4-5]。台特玛湖周边50 km区域无人类居住、无工业和农业污染,其入湖河流水体水质是Ⅱ类,但台特玛湖水体呈劣Ⅴ类水质,主要超标因子为COD、氟化物、TN,因此,需要结合流域和气候特征,进一步探究台特玛湖流域水质超标的原因。
DOM是湖泊生态系统中一种重要的化学组分,作为表征有机污染的重要指标,主要由C、H、O、N、S和P等元素组成[6],在污染物的迁移转化、生物降解和营养物质循环等方面也扮演着重要角色[7-9]。而荧光光谱法具有快速、高灵敏度、低检测限、所需样品量少和对样品结构无破坏等特点[10-11],被广泛用于研究各类水体中的DOM。目前针对台特玛湖的研究主要集中在台特玛湖生态输水后湖泊面积变化[5]、植物群落及多样性[12-13]和土地利用变化[14-15]等,但相关水环境质量的研究却较少。为此,采用荧光光谱法研究台特玛湖流域水体DOM光谱特征,有利于从定性和定量的角度揭示DOM性质、浓度及分布特征等。
为探究台特玛湖水质超标原因以及DOM的来源,对台特玛湖流域水质指标进行了检测,通过DOM的三维荧光区域积分法和平行因子分析法,分析了DOM在台特玛湖流域水生生态系统中的组成,研究了其各组分的光谱特征,探讨了水质参数与荧光组分的关系,可为台特玛湖流域水环境保护提供参考。
-
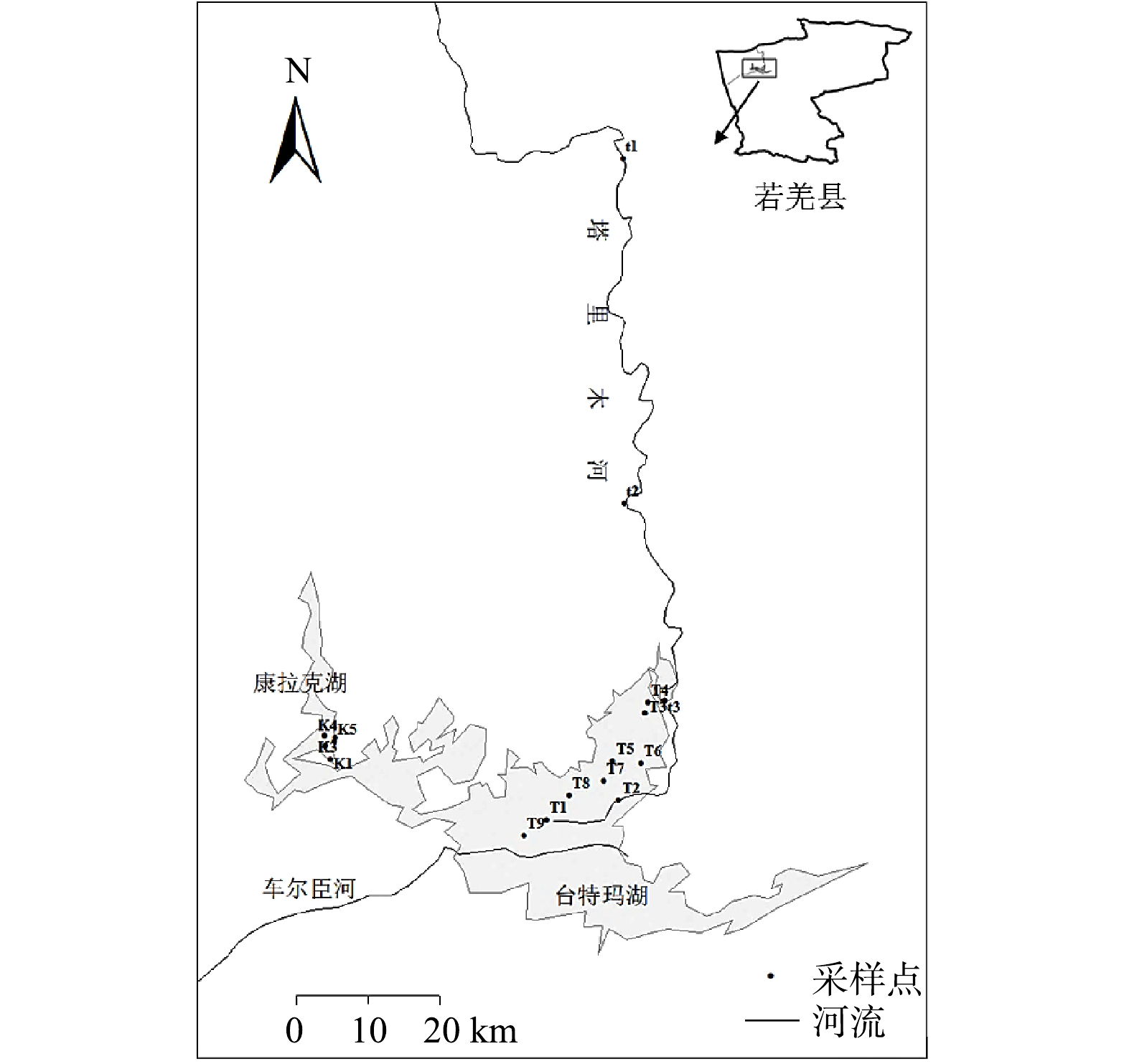
台特玛湖位于巴音郭楞蒙古自治州若羌县北部、塔里木盆地东南部,平均海拔805 m,是塔里木河和车尔臣河的尾闾湖。20世纪80年代末,车尔臣河河道自库完墩向北迁移,河水流经沙漠,在沙丘间蓄积形成康拉克湖群。台特玛湖是由阿尔金山冲积平原和塔里木河交汇处的洼地积水形成的,为冲积平原-湖积地貌,湖区平坦开阔,土壤类型主要有3种,分别为风沙土、胡杨林土和沼泽土。该区属典型的暖温带大陆性干旱气候,气候干燥,降水稀少,蒸发强烈,年均降水量28.5 mm,而年蒸发量高达2 920.2 mm。台特玛湖西侧为塔克拉玛干沙漠,东侧为库鲁克沙漠,可有效阻断两大沙漠的合拢。自然植被主要由胡杨、红柳、梭梭、芦苇及骆驼刺等植物组成。
-
分别于2021年11月、2022年1月、3月和6月在塔里木河(t1、t2、t3)、台特玛湖(T1、T2、T3、T4、T5、T6、T7、T8、T9)和康拉克湖(K1、K2、K3、K4、K5)进行了采样(图1)。现场采用便携式溶解氧仪(REX 型号,JPBJ-608,中国)测定溶解氧,采用pH计(PHBJ-260F,上海精密科学仪器有限公司,中国)测定pH。同时采集表层(0~30 cm)水样500 mL,低温保存,运回实验室储存在4 ℃的冷藏室中供分析备用。矿化度采用重量法测定,总氮采用碱式过硫酸钾消解紫外分光光度法测定,化学需氧量采用快速消解分光光度法(DR-1900,哈希,美国)测定,氟化物采用离子色谱法(ICS-1500,美国戴安公司,美国)测定。水样用0.45 μm醋酸纤维膜过滤后,进行光谱测定分析。
-
1)荧光光谱分析。采用日立(Hitachi)F-7000荧光分光光度计对过滤水样进行测定。测定条件为:150 W氙灯为激发光源,PMT电压设为700 V,扫描光谱进行仪器自动校正,激发波长(Ex)为200~450 nm,发射波长(Em)为250~600 nm,间隔和狭缝宽度为5 nm,扫描速度为2 400 nm·min−1,将Milli-Q超纯水作空白去除拉曼散射,在位于发射波长等于激发波长或2倍激发波长的光谱区域,将瑞利散射及上方的光谱数据均视为0,以消除瑞利散射的影响。
2)平行因子分析法。在MATLAB 2021a软件上应用DOMfluor工具箱,对所有样品的三维荧光光谱数据进行平行因子分析。平行因子分析三维荧光光谱为常用的数学统计的方法,将DOM复杂的荧光数据矩阵分离出不同的组分,把三维荧光数据组分解成3个线性项和一个残留数组,从而识别其特征[16]。
3)三维荧光区域积分法。按照CHEN[17]等提出的荧光区域积分(FRI)分析法,将荧光区域按照激发波长和发射波长的不同范围划分为5个区域,分别为:区域Ⅰ(Ex/Em=200~250 nm/280~330 nm)为酪氨酸类蛋白质;区域Ⅱ(Ex/Em=200~250 nm/330~380 nm)为色氨酸类蛋白质;区域Ⅲ(Ex/Em=200~250 nm/380~550 nm)为富里酸类物质;区域Ⅳ(Ex/Em=250~450 nm/280~380 nm)为可溶性微生物代谢物;区域Ⅴ(Ex/Em=250~450 nm/380~550 nm)为类腐殖质酸物质。
根据FRI方法,通过Origin9.1计算荧光区域的积分体积Фi;对荧光区域的积分体积进行标准化,得到区域i的标准化积分体积Фi,n;再计算总荧光区域标准化积分体积ФT,n;最后计算区域i标准化积分体积占总标准化积分体积之比Pi,n[18]。
4)荧光指数法。采用荧光指数(FI)、腐殖化指数(HIX)、自生源指标(BIX)、新鲜度指数(β:α)、Fn(355)和Fn(280)来探讨DOM的来源特征。FI反映了芳香氨基酸与非芳香物对DOM荧光强度的相对贡献率[19],HIX用来表示有机质腐殖化程度[20],BIX反映了新产生的DOM在整体DOM中所占的比例[21],β:α表征新产生的DOM占整体DOM的比例[20],Fn(355)表征类腐殖质物质相对浓度水平,Fn(280)表征类蛋白物质相对浓度水平[22]。
-
在MATLAB 2021a软件中进行三维荧光光谱图绘制和区域积分分析,运用Origin 9.1软件分析处理数据,运用SPSS 25软件进行相关性分析。
-
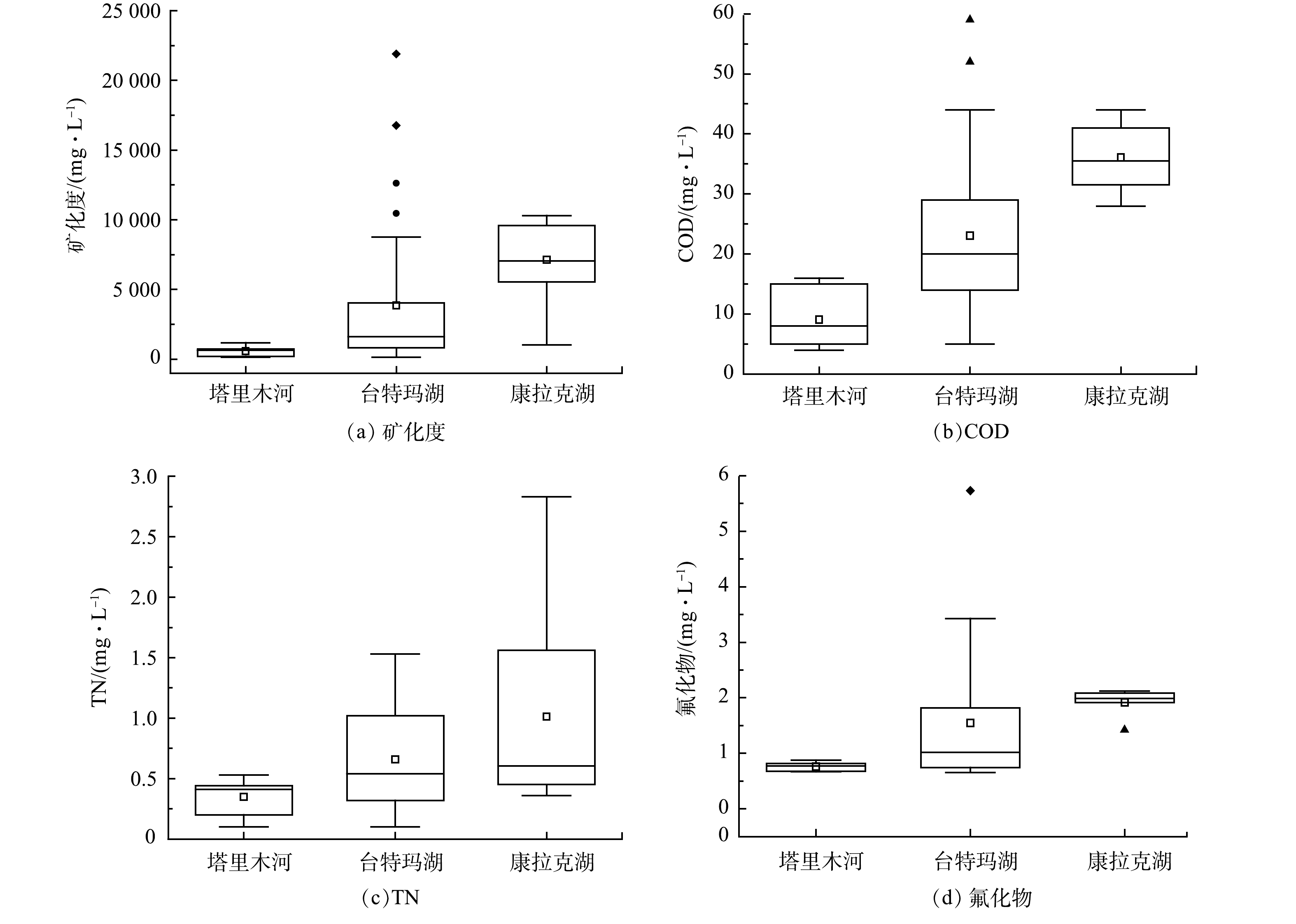
台特玛湖流域的矿化度、COD、TN、氟化物检测结果如图2所示。可见,塔里木河各指标均符合地表水环境质量Ⅱ类标准,台特玛湖和康拉克湖呈劣Ⅴ类水质,COD、TN和氟化物均存在不同程度的超标。塔里木河矿化度、COD、TN、氟化物的平均质量浓度分别为585.09、9.09、0.35、0.76 mg·L−1。台特玛湖矿化度、COD、TN、氟化物的平均质量浓度分别为3 854.97、23.06、0.66、1.55 mg·L−1。康拉克湖矿化度、COD、TN、氟化物的平均质量浓度分别为7 142.92、36.08、1.01、1.92 mg·L−1。由于台特玛湖水量主要由塔里木河补给,且除了蒸发外,基本没有任何出口,成为最终的物质归宿区,导致湖泊的矿化度一直居高不下。通过调研发现,台特玛湖周边50 km区域无人类居住、无工业和农业污染。同时台特玛湖气候干旱,且属于封闭性湖泊,年蒸发量超过补给量,面积大,水深浅。这可能是导致湖泊中有机物、氟化物和氮浓度不断增加、水质变差的原因。
-
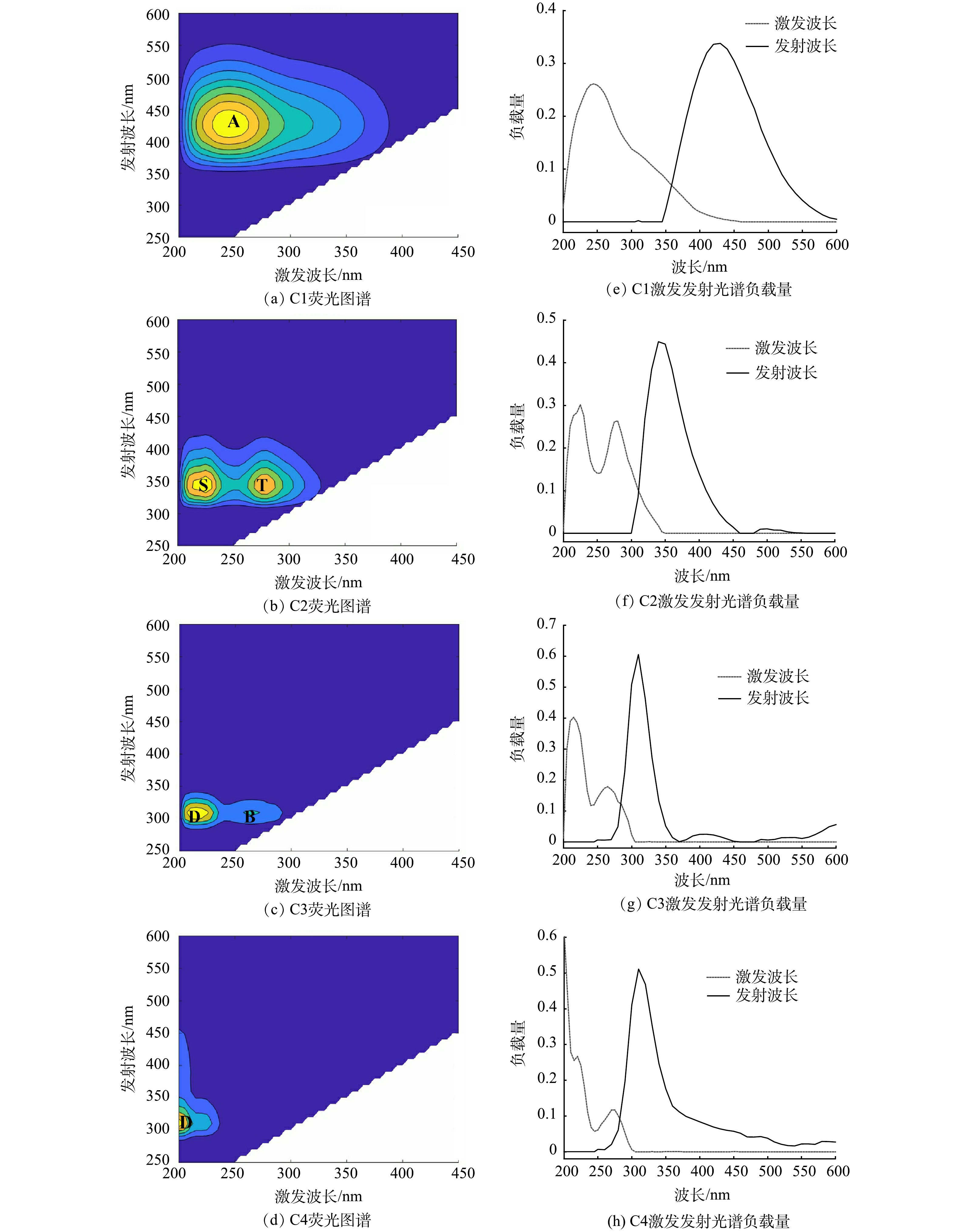
利用PARAFAC对台特玛湖流域所有样品的三维荧光光谱图进行解谱,确定了样品中DOM的4种主要荧光组分,相应的激发和发射光谱图如图3所示,类型及与文献的对比见表2。组分主要为1个类腐殖质组分(C1)和3个类蛋白组分(C2、C3、C4)。
C1组分(Ex/Em=245 nm/430 nm)属于紫外光类腐殖质,以富里酸为代表,荧光峰相应于传统陆源类腐殖峰A(Ex/Em=230~260 nm/380~460 nm)[23-25]。C2组分(Ex/Em=225 nm(275 nm)/340 nm)具有2个激发峰和1个发射峰,其中225/340 nm峰相应于传统的低激发色氨酸S峰(Ex/Em=220~230 nm/320~350 nm)区域,275/340 nm峰相应于传统的高激发色氨酸T峰(Ex/Em=270~280 nm/320~350 nm)区域,代表类蛋白质荧光峰[23-24,26-27]。C3组分(Ex/Em=220 nm(265 nm)/310 nm)属于生物降解来源的酪氨酸,与DOM中的芳环氨基酸结构有关,荧光峰相应于传统的D峰(Ex/Em=220~230 nm/300~310 nm)和B峰(Ex/Em=270~280 nm/300~310 nm)区域[28-29]。C4组分(Ex/Em=200 nm/310 nm)为类蛋白荧光基团,以类酪氨酸为代表,荧光峰与传统的D峰相似[24,27]。
根据平行因子分析,S、T、B、D峰均属于类蛋白荧光峰,反映的是生物降解后的色氨酸和酪氨酸,其与DOM中的芳香环结构有关[30]。A峰反映的是腐殖酸形成的荧光峰,代表较难降解的DOM,被认为与类富里酸荧光和腐殖质结构中的羰基和羧基等有关,由分子结构复杂的腐殖质类产生[19,31]。一般认为,类腐殖酸主要是外源输入,来源于陆源植物残体的腐烂、降解产物等[28],类蛋白物质主要来源于藻类暴发后的生物残体释放或生活污水的陆源输入[32-33]。以上结果说明台特玛湖流域水体DOM的来源表现出内源和外源的双重特性。
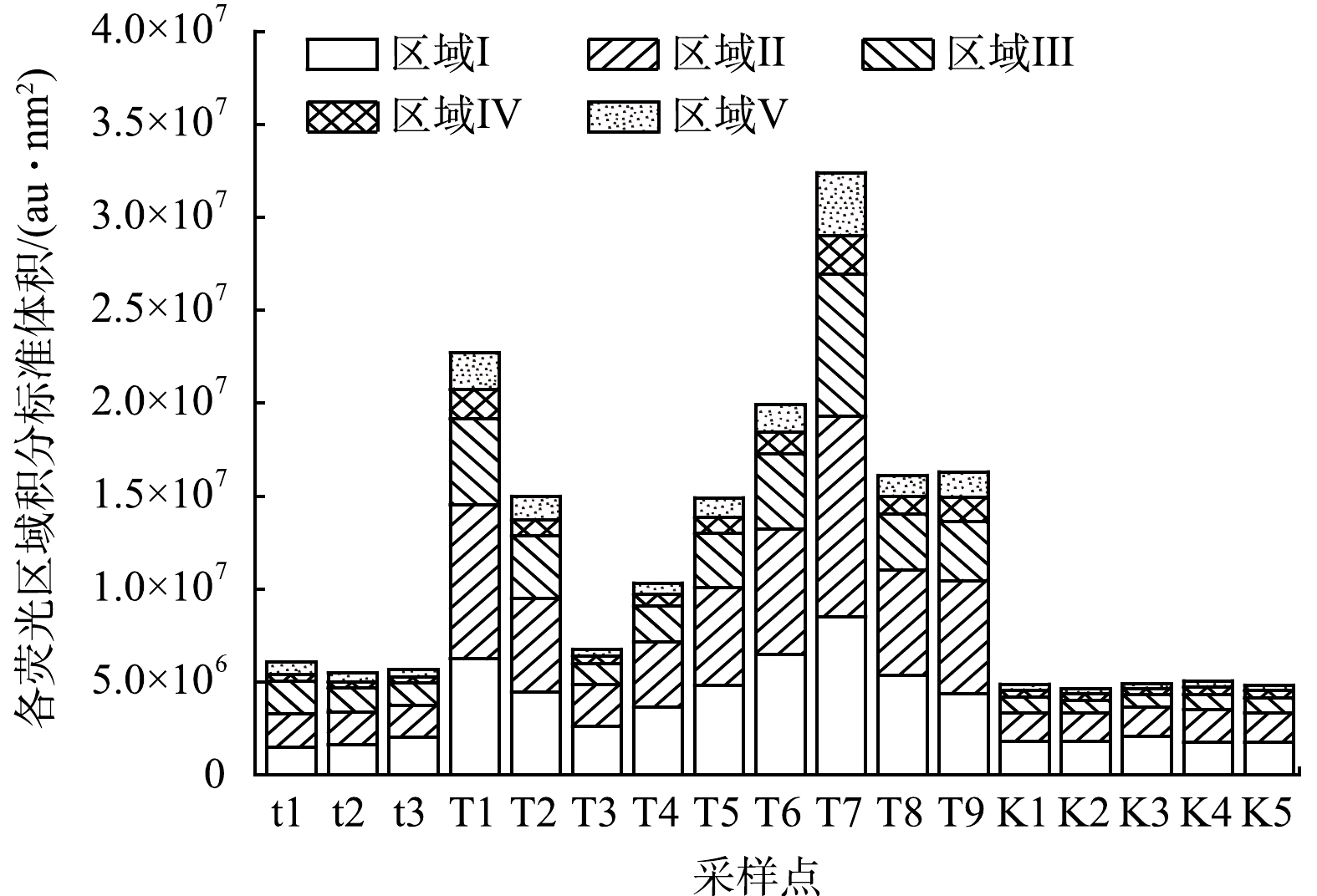
为了更深层次探究DOM的荧光特性,运用荧光光谱FRI对DOM的三维荧光光谱进行定量分析,对三维荧光光谱进行区域积分是对三维荧光光谱定量分析的一种有效手段,能详细解释DOM物质组成和荧光团的变化[34]。各采样点的总积分标准体积见图4。由图4可以看出,T1和T7的DOM荧光强度较强。说明该点位水体中浮游植物、浮游动物被微生物降解的残体较多,导致其类蛋白物质浓度高。台特玛湖DOM荧光强度相较塔里木河与康拉克湖有所升高,DOM的荧光强度高低在很大程度上指示了水体中溶解性有机物的含量[35],台特玛湖地处干旱地区,降雨稀少,湖泊面积大,水深浅,水体更新缓慢和内源的累积可能是台特玛湖DOM荧光强度高的原因。
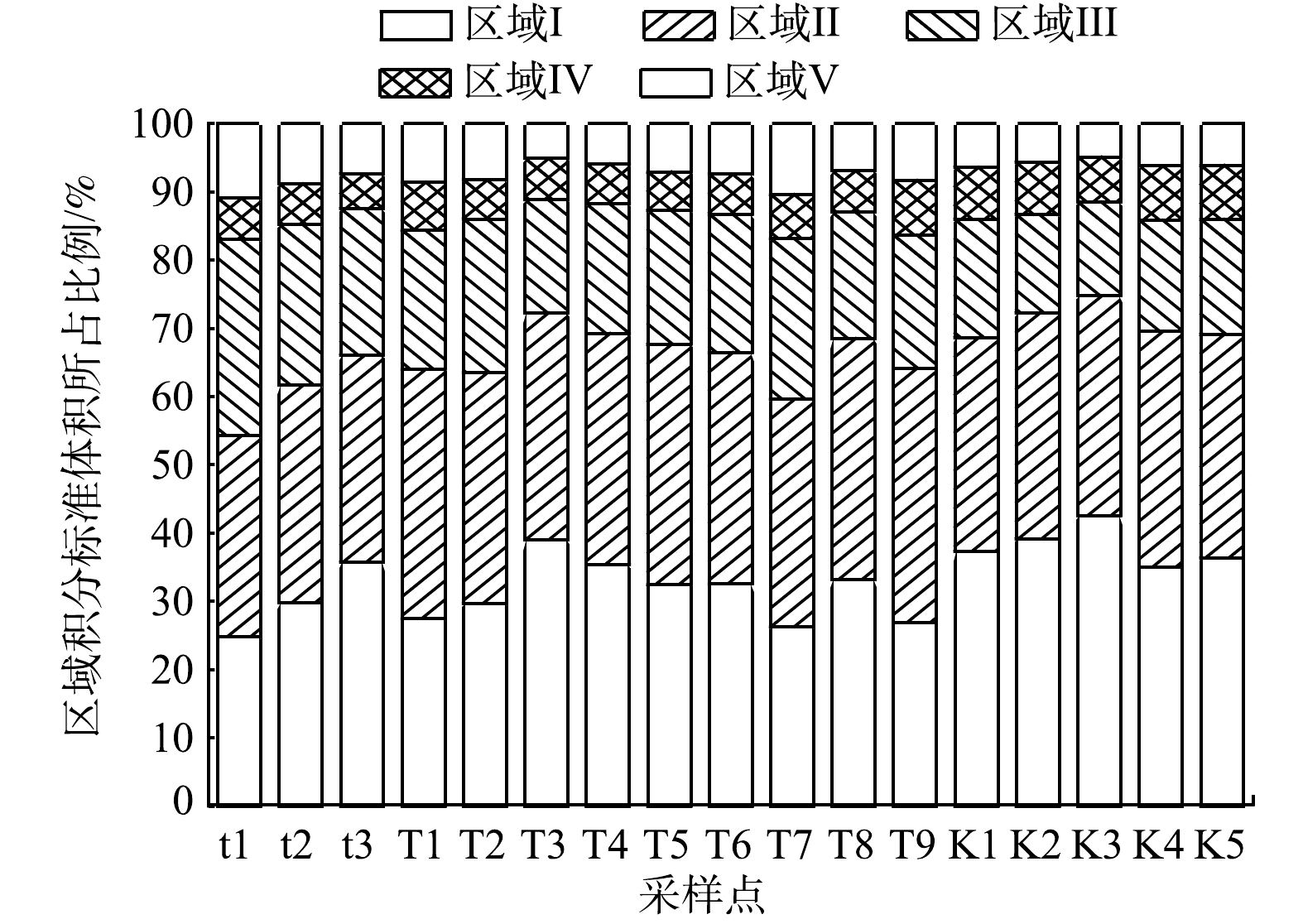
各荧光组分占比见图5,可以看出,台特玛湖流域水体中DOM主要为酪氨酸类蛋白质和色氨酸类蛋白质,占总体比例为66.57%。所有采样点5个荧光组分积分标准体积在总积分标准体积中的占比均值从大到小依次排序为:Ⅱ色氨酸类蛋白质(33.40%)﹥Ⅰ酪氨酸类蛋白质(33.17%)﹥Ⅲ富里酸类物质(19.53%)﹥Ⅴ腐殖酸类物质(7.34%)﹥Ⅳ溶解性微生物代谢产物(6.56%)。根据荧光峰位置及前人研究可知,I区、II区及IV区的荧光物质与类蛋白物质有关,III区和V区的荧光物质与类腐殖质有关,其中V区所代表物质的分子量更大,芳构化和共轭程度更高[36]。
综上所述,台特玛湖流域DOM主要以类蛋白物质为主,类腐殖质物质较少。台特玛湖初级生产力以浮游植物为主,绿藻和蓝藻是台特玛湖的优势种,藻类堆积死亡后能释放大量的类蛋白质物质,水体的自生源特征增强。同时,藻类能够为更多不同种类的微生物提供碳源,这些微生物优先分解水体中易降解有机物,导致水体腐殖化程度较低[37]。台特玛湖流域水体中低分子DOM组分相对更丰富,由于尾闾湖泊水体无法流动,水的停留时间延长,所有植物死亡分解后,全部留在水中,太阳长期的照射可能会增加水中光化学氧化过程的程度,并伴随天然水体中盐度的增加,复杂的腐殖酸分子被分解成低分子量的富里酸物质[38]。
-
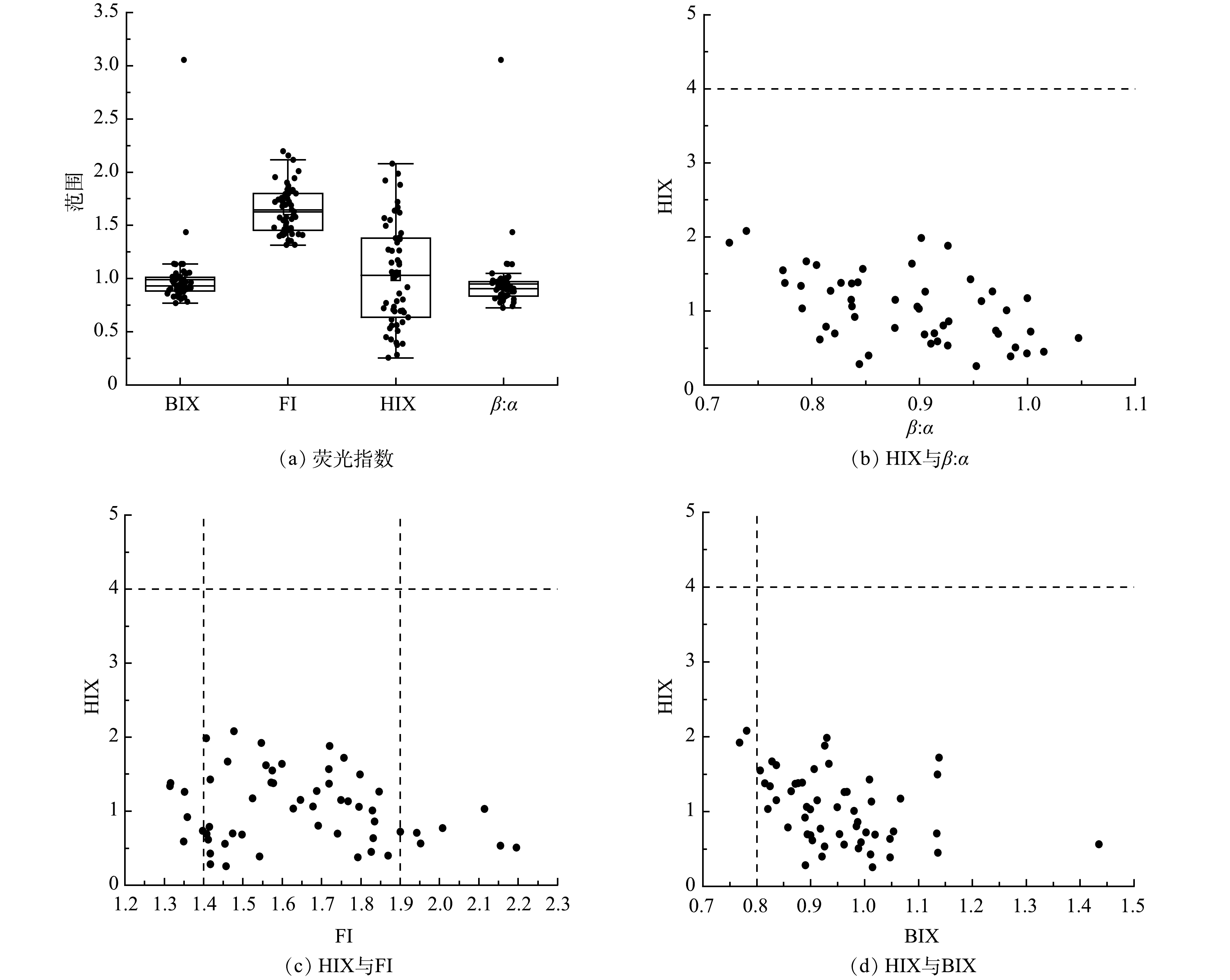
DOM的荧光特征参数见图6。由图6(a)和图6(c)可以看出,荧光指数FI在1.314 9~2.195 8,均值为1.645 6±0.220 8。当FI<1.4时DOM是陆地或土壤源输入,水体自身生产力贡献相对较低,FI在1.4~1.9之间表明水体DOM是陆源和自生源贡献相结合,FI>1.9表明微生物活动强烈自生源特征明显,表明台特玛湖流域水体DOM为陆源和自生源贡献结合。由图6(a)和图6(d)可以看出,自生源指标BIX在0.768 3~3.053 3,均值为0.988 6±0.302 2,BIX>0.8自生源特征明显,BIX<0.8自生源特征不明显。表明台特玛湖流域新生的自生源DOM较多,自生源指标体现新生DOM在总体DOM中所占比例,比例越高,说明水体DOM降解生成内源性有机物的能力越强,可见水体DOM具有较强的自生源特征。腐殖化指数HIX在0.255 2~2.078 7,均值为1.102 9±0.475 2,HIX>4表明腐殖化程度高,HIX<4表明腐殖化程度低,由此可见台特玛湖流域腐殖化程度较低。由图6(a)~(b)可以看出,新鲜度指数β:α在0.723 6~3.053 3,均值为0.950 9±0.309 1,说明台特玛湖流域水体新生DOM占比较高,且水体生物活性较高,与自生源指标分析结果一致。Fn(355)代表DOM中类腐殖质组分的相对浓度,Fn(280)代表类蛋白质的相对浓度,也是DOM陆源和自身源相对贡献率的表征指标。Fn(355)在3.421~54.845,均值为18.077 1±12.400 4,Fn(280)在20.069~604.7,均值为94.236 4±90.019 5,进一步验证荧光组分识别结果,台特玛湖流域DOM主要以类蛋白物质为主,类腐殖质物质较少。
结合上述6种荧光特征参数以及区域积分的计算结果可以得出,台特玛湖流域DOM来源是陆源与自生源共同作用的结果,且主要以内源输入为主,新产生的有机物相对浓度高,腐殖化程度低,类蛋白物质大于类腐殖质物质。台特玛湖地处干旱地区,无工业和农业污染,推测其更多的是来源于内源生有机质或水生植物的残留物,除了藻类和水生植物腐解后对水体内源污染有贡献以外,沉积物释放也会影响水体DOM组成结构和分布规律,随着沉积物降解时间的增长,大量类蛋白物质向上覆水体中释放,另外,由于尾闾湖的封闭性、面积大、水深浅及高蒸发量,水体无交换,有利于有机物的积累,说明藻类和水生植物的沉积和分解是水体COD的重要贡献。
-
DOM在水体生态系统中可以促进营养物质尤其是氮磷元素的循环,而且还是碳循环的重要载体[39],因此,开展DOM与水质参数的相关性分析是非常有必要的。一方面,不仅可以探讨台特玛湖流域水环境中DOM与水质的关系;另一方面,还可以借助其相关性来指示环境中水质参数的变化,方便监测和生态环境的保护。表1反映了对台特玛湖流域的水质参数与荧光组分进行相关性分析结果。
台特玛湖流域类腐殖质组分C1、类蛋白质组分C2、类蛋白质组分C3间互为极显著正相关,说明不同组分间可能存在相同的来源或变化趋势。组分C1、C2、C3与COD、TN、HIX呈显著正相关,氮是构成某些DOM的必须元素,也是微生物生长的营养物质,表明台特玛湖流域水中DOM部分荧光组分的演变与氮循环关系密切。DOM组分在一定程度上也可以反应COD值大小及水体有机污染情况。COD还与矿化度、TN和氟化物之间呈显著正相关,说明其来源相关性较强。矿化度与TN、BIX和β:α呈显著正相关,说明矿化度在一定程度上影响水体生物活性和自生源特征。氟化物与矿化度之间具有极强正相关,台特玛湖作为典型的封闭型湖泊,长期的蒸发浓缩作用是水体矿化度高的主要影响因素,推测氟化物浓度较高也是湖体长期积累的结果,氟化物通常在火山岩中浓度较高[40],未来的工作可以重点关注台特玛湖流域岩层中是否含有较多的氟化物。
-
综上分析,由于台特玛湖湖面过大、水深过浅,蒸发量大[41],湖体中藻类和水生植物的自身腐败,难降解有机污染物质累积导致COD偏高。自然界中氟化物分布广泛,岩石风化作用、矿产开发、工业生产、生活日常使用等均会向水体释放氟化物,水体氟化物偏高将为湖泊生态系统及人类健康带来较大风险。通过相关性分析发现,台特玛湖氟化物和矿化度之间的相关性显著,说明矿化度和氟化物的累积过程具有较强的同步性,氟化物浓度偏高与台特玛湖水体更新不畅有较大关系,氟化物常年累积导致其浓度偏高。为改善台特玛湖区域水环境质量,考虑到当地实际情况和可能达到的预期效果,现提出以下措施与建议。
1)完善台特玛湖流域水资源分配。自然作用是对环境较长期的调节过程,流域生态环境具有调整适应的能力,但人类活动具有放大作用[42],虽然生态输水工程在一定程度上缓解了台特玛湖的咸化过程,但并未从根本上改变尾闾湖的属性。由于台特玛湖特殊的地理环境和气候特征,导致台特玛湖水位及水盐关系紊乱,同时由于污染物的累积导致COD及氟化物浓度超标,给区域生态系统带来不利影响。因此,完善台特玛湖流域水资源分配方案,开展台特玛湖水系更新方案研究,在保障流域生态安全前提下,开展台特玛湖生态输水工程,加快台特玛湖水系更新速率。针对性研究水陆统筹的盐度及矿化度控制技术,如流域节水工程、生态移民、生态输水、人工修筑阶梯状塘堰等[43]。
2)加强台特玛湖流域水质监测。目前针对台特玛湖的研究主要集中在台特玛湖生态输水后湖泊面积变化、植物群落及多样性和土地利用变化等,但相关水环境质量的研究却较少。应加强台特玛湖流域水质监测,定时定点对台特玛湖区域对地表水、地下水、植被响应、生物多样性等方面进行监测,取得长时间的监测资料,更能说明生态输水的作用和效果。建立遥感技术结合GIS、GPS,以及更加完备的水文、水质监测系统,实现对湖区生态环境变化的快速准确预报,为流域生态环境治理保护和社会经济持续发展提供强有力的技术支撑。
3)改善湖泊水生态系统结构。湖泊生态的自然恢复过程缓慢,应加强人工措施干预,改善湖泊水生态系统结构。首先,选择适合尾闾荒漠环境的耐旱、耐盐碱的植物并栽植,提高尾闾湖泊湿地的植被覆盖度;其次,采取围堰工程,在小范围内形成有深度的水域,减少湖水蒸发损耗;再次,人工放养适当的鱼类,改善水域的鱼类群落组成,保障生态平衡;最后,调集部分水进行防护林建设,改善生态环境,防止湖面太大导致蒸发损失水量。定期开展台特玛湖水生态系统调查与安全评估工作,跟踪评估水生态系统健康水平,采取必要限制开发措施,针对台特玛湖开展本地物种增殖放流活动,保护水生生物多样性。
4)完善监督管理体系建设。按照生态系统的整体性、系统性以及内在规律,坚持保护优先、自然恢复为主,推进台特玛湖区域生态系统保护与修复。建立部门协调机制、明确各职能部门职责,统筹塔里木河丰、平、枯水期水资源分配策略和输水时间、频率及方式,保持台特玛湖一定的湖面面积。根据樊自立等[44]的研究成果,为保证台特玛湖30~50 km2的湖面面积,需保证3~4.5×109 m3生态水,水量应由塔里木河和车尔臣各承担50%,以维系台特玛湖一定水面,保障河湖的联通性及生态系统的完整性和稳定性。
-
1)入湖河流的水体水质较好,为Ⅱ类水质,而台特玛湖和康拉克湖流域水体水质为劣Ⅴ类水质,COD、TN和氟化物存在不同程度的超标。水体水质超标主要是因为尾闾湖的封闭性、面积大、水深浅及高蒸发量,导致个别水质指标不断富集。
2)通过平行因子分析识别出样品中DOM的4种主要荧光组分,即代表紫外光类腐殖质(富里酸) C1组分、类蛋白质(色氨酸)荧光峰C2组分、类蛋白质(酪氨酸) C3和C4组分。经三维荧光区域积分分析得出,台特玛湖流域水体DOM主要组分为色氨酸类蛋白质和酪氨酸类蛋白质,占总体比例为66.57%,类腐殖质物质较少。
3)台特玛湖流域荧光特征参数表明,台特玛湖流域DOM来源主要以内源输入为主,新产生的有机物相对浓度高,腐殖化程度低。类蛋白质物质的来源主要为微生物降解藻类或水生植物的残留物,以及沉积物的释放,DOM在湖泊中的积累会造成COD值的升高。
4)台特玛湖流域类腐殖质组分C1、类蛋白质组分C2、类蛋白质组分C3间互为极显著正相关关系,说明不同组分间可能存在相同的来源或变化趋势;组分C1、C2、C3与COD、TN呈显著正相关,其来源与氮循环关系密切,DOM组分在一定程度上也可以反应COD值大小及水体有机污染的情况;氟化物与矿化度之间呈显著正相关,推测氟化物浓度较高也是湖体长期积累的结果。
5)应加强台特玛湖水质监测和人工措施干预,完善监督管理体系建设,改善台特玛湖区域水生态系统结构和水质状况。
台特玛湖流域水体溶解性有机质的光谱特征与来源解析
The fluorescent characteristics and sources of dissolved organic matter in water of Tetma Lake, China
-
摘要: 为探究台特玛湖水体水质超标原因,结合流域自然条件,以水中溶解性有机质(DOM)为研究对象,分析DOM的光谱特征和来源,通过平行因子分析(PARAFAC)和荧光区域积分分析(FRI)对台特玛湖流域水体DOM进行定性与定量分析。结果表明:PARAFAC识别出台特玛湖流域DOM中 4种主要荧光组分,分别为腐殖酸、类色氨酸、类酪氨酸(B峰和D峰),水体DOM主要组分为色氨酸类蛋白质和酪氨酸类蛋白质,占总体比例为66.57%,说明DOM来源主要以内源输入为主,腐殖化程度低;台特玛湖流域水体水质超标主要是因为尾闾湖的封闭性、面积大、高蒸发量且为浅水湖泊,导致个别水质指标不断富集;水体DOM各组分与TN和COD呈显著正相关,氟化物与矿化度之间呈显著正相关。本研究为台特玛湖水质超标提出的原因分析及建议措施可为台特玛湖流域水环境保护提供依据。Abstract: In order to explore the reasons for over standard on water quality of Tetma Lake, the dissolved organic matters (DOMs) in it was taken as the research object with the combination of the natural conditions of the basin. The fluorescence characteristics and sources of DOMs in Tetma lake were determined through qualitative and quantitative analysis of DOM with parallel factor analysis (PARAFAC) and three-dimensional fluorescence regional integral (FRI) methods. The resulted showed that four fluorescence components were identified in lake DOMs by PARAFAC, they were humic acid, tryptophan-likeand tyrosine-like(peak B and peak D), respectively. The main components of DOMs in water body were divided into tryptophan protein and tyrosine protein, their overall proportion was 66.57%, these DOMs were mainly produced from self-generating endogenous sources in the water body of Tetma Lake, and their humification degree was low. The over standard on water quality of Tetma Lake was mainly due to the closedness, large area, shallow water depth and high evaporation of Tetma Lake, which leads to the continuous enrichment of individual water quality indicators. Each component of DOMs in water body was significantly positively correlated with TN and COD, and there was a strong positive correlation between fluoride and mineralization. The reason analysis and suggestions for the over standard on water quality can provide the basis for the environmental protection in Tetma Lake Basin.
-

-
[1] 邓铭江, 周海鹰, 徐海量, 等. 塔里木河下游生态输水与生态调度研究[J]. 中国科学:技术科学, 2016, 46(8): 864-876. [2] 胡正超, 刘洋, 李生宇, 等. 台特玛湖干涸湖盆风沙对公路潜在危害评价[J]. 国土与自然资源研究, 2018(2): 54-59. doi: 10.3969/j.issn.1003-7853.2018.02.014 [3] 霍天赐, 颜伟, 马晓飞. 内陆河尾闾湖泊水域面积变化及驱动因素研究——以台特玛湖地区为例[J]. 国土资源遥感, 2020, 32(3): 149-156. [4] 李丽君, 张小清, 陈长清, 等. 近20 a塔里木河下游输水对生态环境的影响[J]. 干旱区地理, 2018, 41(2): 238-247. [5] 王慧玲, 吐尔逊·哈斯木. 生态输水前后台特玛湖生态环境变化探究分析[J]. 生态科学, 2020, 39(1): 93-100. doi: 10.14108/j.cnki.1008-8873.2020.01.013 [6] ALCP, AJLL, CSKB, et al. Seasonal changes in dissolved organic matter composition in Delaware Bay, USA in March and August 2014: ScienceDirect[J]. Organic Geochemistry, 2018, 122: 87-97. doi: 10.1016/j.orggeochem.2018.05.005 [7] 卢松, 江韬, 张进忠, 等. 两个水库型湖泊中溶解性有机质三维荧光特征差异[J]. 中国环境科学, 2015, 35(2): 516-523. [8] 詹亚, 尹浩, 冯景伟, 等. 派河及其支流溶解性有机质分子组成特征[J/OL][J]. 环境科学, 2022, 43(3): 1365-1374. [9] 张广彩, 王雅南, 常昕, 等. 应用多元统计研究蘑菇湖水体DOM紫外光谱特征[J]. 环境科学研究, 2019, 32(2): 301-308. doi: 10.13198/j.issn.1001-6929.2018.11.03 [10] WU J, PONS M N, POTIER O. Wastewater fingerprinting by UV-visible and synchronous fluorescence spectroscopy[J]. Water Science & Technology A Journal of the International Association on Water Pollution Research, 2006, 53(4/5): 449. [11] 梁月清, 刘会来, 崔康平, 等. 基于三维荧光光谱-平行因子分析法的工业园区污水溶解性有机物溯源与归趋[J]. 环境工程学报, 2022, 16(4): 1238-1247. [12] 徐俏, 叶茂, 徐海量, 等. 塔里木河下游生态输水对植物群落组成、多样性和稳定性的影响[J]. 生态学杂志, 2018, 37(9): 2603-2610. [13] 王雅梅, 张青青, 徐海量, 等. 生态输水前后台特玛湖植物多样性变化特征[J]. 干旱区研究, 2019, 36(5): 1186-1193. [14] 贾丹阳, 熊祯祯, 高岩, 等. 近30a台特玛湖地区土地利用/土地覆被变化及其影响因素[J]. 干旱区地理, 2021, 44(4): 1022-1031. [15] 张帅, 汪洋, 夏婷婷, 等. 塔里木河生态输水条件下土地利用/覆被变化对生态系统服务价值的影响[J]. 干旱区地理, 2021, 44(3): 739-749. [16] 吕纯剑, 高红杰, 李晓洁, 等. 沈阳市黑臭水体溶解性有机物组分及其光学特征[J]. 环境工程学报, 2019, 13(3): 559-568. [17] CHEN W, PAUL W, JERRY L, et al. Fluorescence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter[J]. Environmental Science & Technology, 2003, 37(24): 5701-5710. [18] 姚璐璐, 涂响, 于会彬, 等. 三维荧光区域积分评估城市污水中溶解性有机物去除[J]. 环境工程学报, 2013, 7(2): 411-416. [19] LAVONEN E E, KOTHAWALA D N, TRANVIK L J, et al. Tracking changes in the optical properties and molecular composition of dissolved organic matter during drinking water production[J]. Water Research, 2015, 85: 286-294. doi: 10.1016/j.watres.2015.08.024 [20] HUGUET A, VACHER L, RELEXANS S, et al. Properties of fluorescent dissolved organic matter in the Gironde Estuary[J]. Organic Geochemistry, 2009, 40(6): 706-719. doi: 10.1016/j.orggeochem.2009.03.002 [21] OHNO T, FERNANDEZ I J, HIRADATE S, et al. Effect of soil acidification and forest type on water soluble soil organic matter properties[J]. Geoderma, 2007, 140(1-2): 176-187. doi: 10.1016/j.geoderma.2007.04.004 [22] ZHANG Y, LIU M, QIN B, et al. Photochemical degradation of chromophoric-dissolved organic matter exposed to simulated UV-B and natural solar radiation[J]. Hydrobiologia, 2009, 627(1): 159-168. doi: 10.1007/s10750-009-9722-z [23] 刘晶晶, 张彦, 翟洪艳, 等. 丰水期渤海湾水体中DOM的分布特征及来源[J]. 中国环境科学, 2021, 41(10): 4802-4810. doi: 10.19674/j.cnki.issn1000-6923.20210526.005 [24] 翟天恩, 霍守亮, 张靖天. 沉积物中溶解性有机质的垂直分布光谱特性[J]. 环境工程学报, 2017, 11(11): 6196-6204. [25] ZHANG Y, ZHANG E, YAN Y, et al. Characteristics and sources of chromophoric dissolved organic matter in lakes of the Yungui Plateau, China, differing in trophic state and altitude[J]. Limnology & Oceanography, 2010, 55(6). [26] 林绍霞, 肖致强, 张转铃, 等. 贵州草海水体溶解性有机物的荧光光谱特征及来源解析[J]. 中国环境科学, 2021, 41(3): 1325-1335. doi: 10.3969/j.issn.1000-6923.2021.03.036 [27] XIN Y, YZ A, GZ A, et al. Resolving the variability of CDOM fluorescence to differentiate the sources and fate of DOM in Lake Taihu and its tributaries - ScienceDirect[J]. Chemosphere, 2011, 82(2): 145-155. doi: 10.1016/j.chemosphere.2010.10.049 [28] YU X, ZHANG J, KONG F, et al. Identification of source apportionment and its spatial variability of dissolved organic matter in Dagu River-Jiaozhou Bay estuary based on the isotope and fluorescence spectroscopy analysis[J]. Ecological Indicators, 2019, 102(7): 528-537. [29] 宋柯峥, 蔡启佳, 洪培, 等. 武汉南湖可溶解性有机物的来源与组成分析[J]. 环境科学与技术, 2021, 44(3): 120-129. [30] 傅平青, 刘丛强, 吴丰昌. 溶解有机质的三维荧光光谱特征研究[J]. 光谱学与光谱分析, 2005(12): 2024-2028. doi: 10.3321/j.issn:1000-0593.2005.12.031 [31] 颜秉斐, 彭剑峰, 邓齐玉, 等. 白塔堡河水体DOM分布特征及来源[J]. 环境工程技术学报, 2019, 9(3): 225-232. doi: 10.12153/j.issn.1674-991X.2019.02.190 [32] 卜鸡明, 何佳, 焦立新, 等. 滇池流域入湖河流溶解性有机质的分布及来源[J]. 环境科学学报, 2020, 40(8): 2795-2804. doi: 10.13671/j.hjkxxb.2020.0128 [33] 蒋凤华, 杨黄浩, 黎先春, 等. 胶州湾海水溶解有机物三维荧光特征研究[J]. 光谱学与光谱分析, 2007(9): 1765-1769. [34] 虞敏达, 张慧, 何小松, 等. 河北洨河溶解性有机物光谱学特性[J]. 环境科学, 2015, 36(9): 3194-3202. doi: 10.13227/j.hjkx.2015.09.010 [35] 杨颖, 刘吉宝, 魏源送, 等. 北运河沉积物中氮磷营养盐及荧光溶解性有机物的污染特征研究[J/OL][J]. 环境科学学报, 2022, 42(3): 40-50. [36] 吕晶晶, 张列宇, 席北斗, 等. 人工湿地中水溶性有机物三维荧光光谱特性的分析[J]. 光谱学与光谱分析, 2015, 35(8): 2212-2216. doi: 10.3964/j.issn.1000-0593(2015)08-2212-05 [37] 孙伟, 胡泓, 赵茜, 等. 达里诺尔湖水体DOM荧光特征及其来源解析[J]. 环境科学研究, 2020, 33(9): 2084-2093. doi: 10.13198/j.issn.1001-6929.2020.03.26 [38] SONG K, SHANG Y, WEN Z, et al. Characterization of CDOM in saline and freshwater lakes across China using spectroscopic analysis[J]. Water Research, 2019, 150(MAR.1): 403-417. [39] 周石磊, 陈召莹, 张甜娜, 等. 白洋淀典型淀区沉积物间隙水溶解性有机物的光谱时空演变特征[J]. 环境科学, 2021, 42(8): 3730-3742. doi: 10.13227/j.hjkx.202011063 [40] 仝利红, 刘英俊, 张硕, 等. 乌伦古湖水体矿化度和氟化物浓度的年际变化及模拟[J]. 湖泊科学, 2022, 34(1): 134-141. doi: 10.18307/2022.0112 [41] 王光焰, 徐生武. 台特玛湖生态环境现状与保护对策研究[J]. 水利发展研究, 2021, 21(8): 109-114. doi: 10.13928/j.cnki.wrdr.2021.08.024 [42] 海拉提·阿力地阿尔汗, 彭小武, 刘晓伟, 等. 新疆乌伦古湖水生态环境保护对策研究[J]. 新疆环境保护, 2021, 43(2): 15-21. [43] 张同泽. 石羊河流域水资源合理配置与危机应对策略[D]. 咸阳: 西北农林科技大学, 2007. [44] 樊自立, 徐海量, 傅荩仪, 等. 台特玛湖湿地保护研究[J]. 第四纪研究, 2013, 33(3): 594-602. doi: 10.3969/j.issn.1001-7410.2013.03.20 -



 下载:
下载: