-
近年来,通过微生物燃料电池 (microbial fuel cell, MFC) 将蕴藏在有机污染物中的化学能直接转化为电能,成为废水能源化利用的新兴方向[1]。葡萄糖、乙酸钠、醋酸钠等低分子有机物和纤维素、淀粉、蛋白质等高分子有机物均被证实可成为MFC的底物[2],且有机底物的组成越简单,有机物分子量越低,MFC的输出功率越大[3]。尿液中有机物质量浓度高 (8~17 g·L−1,以COD计) [1],含有肌酐、肌酸、尿酸等小分子有机物,易于微生物直接利用。同时,尿液具有良好的溶液电导率 (0~20 mS·cm−1) [4],能降低MFC系统的扩散内阻和传质内阻改善产电性能。尿液中高浓度的尿素 (20 g·L−1) 使其具有极强的碱性缓冲能力 (660 mmol·L−1) ,可以平衡氧化约5 g·L−1有机物产酸导致的pH下降[5]。这些特质使尿液相比于其他有机底物,具备了更优良的潜力。此外,尿液日产量庞大 (全球1.16~1.54×1010 L·d−1) [6],相比人工合成有机底物更具有经济性。
2012年,英国西英格兰大学IEROPOULOS教授团队使用碳幕作阴、阳电极,阳离子交换膜作分隔材料,总体积为50 mL的双室型MFC (图1) ,从尿液中获得8 mA·m−2的电流密度[7],以尿液作为驱动MFC“燃料”的研究开始被关注。同年,KUNTKE[8]等构建总体积250 mL的双室型MFC,以石墨毡作阳极,载铂碳毡作阴极,阳离子交换膜作分隔材料,处理尿液产生500 mA·m−2的电流密度,并基于NH4+在阳离子交换膜中迁移得到3.29 g·d−1·m−2的氨氮回收率,实现MFC对尿液中资源回收同时增强产电性能。经过近10年的发展,通过从电极材料、分隔材料、产电微生物、反应器构型等方面的优化研究,基于尿液为阳极基质的单个MFC从研究初期功率密度仅为0.1 mW·m−2[9],到现在可超过1 000 mW·m−2[10],并且通过堆栈式扩大在穿戴设备、微型电器及小功率照明设备的供能上均有实践和现场应用[11-17],而要实现在现实生活中的普及还需进一步提高其功率密度。
基于对近十年以尿液为阳极基质的MFC研究进行梳理,阐述尿液在MFC中的工作原理,从产电微生物、电极及膜材料、反应器组件方面对产电性能的影响因素进行分析,通过总结现阶段尚需改进的工作及对未来提升产电性能的有效方法,并对其产生能源和尿液中资源的合理利用途径给出建议,以期在为MFC的研究与工程化应用提供参考。
-
尿液在生活污水中占比约2%。除高浓度的有机物外,包含了生活污水中80%~88%氮、60%~67%磷、70%~73%钾[18-19],能为微生物提供丰富的营养来源。尿液用作MFC的阳极基质,不仅对尿液中的各类污染物能进行一定程度的去除,同时相关生物或化学反应过程中发生的电子转移,能进一步提升产电性能。以单室型MFC为例,尿液MFC的工作原理如图2所示,相关的生物化学反应如式(1)~(8)。尿液中的有机物通过阳极上的产电微生物氧化有机底物释放电子、H+和CO2 (式(3)) ,电子由阳极经外电路传递至阴极,同时H+由阳极向阴极扩散。在阴极,电子和H+与O2发生还原反应生成水,从而产生电流 (式(6)) 。尿素经过微生物脲酶水解产生NH4+ (式(1)~(2)) ,NH4+在电势和离子浓度作用下迁移至阴极区,在好氧 (或缺氧) 环境中与氧气发生硝化反应生成NO3−和NO2− (式(4)~(5)) ;阴极区的细菌则通过生物反硝化过程将NO3−、NO2−还原为N2 (式(7)~(8)) [20]。此外,随着反应进行pH升高,部分NH4+与OH−离子发生化学反应生成NH3溢出[8]。尿液里的磷元素以无机磷酸盐的形式存在,在阳极厌氧环境中,生物膜上的聚磷菌吸收氧化阶段产生的能量,并以溶解性磷酸盐形式释磷;在阴极区好氧 (或缺氧) 环境中,摄取细胞外的无机磷酸盐并转化为多聚磷酸盐储存于体内[21]。以上反应过程中发生的电子转移均会影响MFC的产电性能。
-
产电微生物是MFC系统的核心组成部分。不同种类的产电微生物在代谢底物产生电子的能力上有所差异。具有产生电子能力的细菌、藻类或真菌统称为产电微生物,大多为兼性或厌氧异养型,种类主要包含变形菌 (Probacteria) 和厚壁菌 (Firmicutes) 两大门类。变形菌是最大的一门,为革兰氏阴性菌;厚壁菌多数为革兰氏阳性菌[22]。革兰氏阴性菌细胞膜含10%的肽聚糖和90%的蛋白质,具有多层结构且通透性良好的细胞壁和丰富的电子传递蛋白,具备更高效的电子传递速率。相比之下,革兰氏阳性菌细胞膜中含10%的磷和90%的肽聚糖,其与磷壁酸之间的键合紧密导致细菌表面电位较大[23],故产电能力较弱。混合菌群的发电效率高于单一菌种,是由于混合菌中不同菌群对营养底物的争夺强化了各种群微生物活性,具备更强的抗环境冲击能力[24]。
新鲜尿液中高浓度的有机物、丰富的元素种类、适宜的 pH 和碳氮比,为不同种类的细菌提供了良好的营养来源和生长环境。因此,在尿液中产生的微生物种群与非尿液基质中的微生物种群表现出一定的差异性[1]。非尿液基质的 MFC 中产电微生物种群一般以γ变形菌中的地杆菌属 (Geobacter) 、除硫单胞菌属 (Desulfuromonas) 、希瓦氏菌属 (Shewanella) 、气单胞菌属(Aeromonas);σ变形菌中的脱硫杆菌属(Desulfobacterales)、厚壁菌中的梭菌属(Clostridium)、链球菌属(Streptococcus)等为主[24-26]。而在OBATA等[27]构建堆栈式尿液MFC电池中厚壁菌门里的蒂西耶氏菌属 (Tissierella) 和β-变形菌纲 (Betaproteobacteria) 里的伯克氏菌科 (Burkholderiaceae) 逐渐取代原尿液中γ-变形菌的假单胞菌属 (Pseudomonas) 及拟杆菌 (Bacteroidetes) 而成为优势菌群。引起尿液MFC中菌群种类差异的主要原因之一是基底为微生物提供的营养源不同,如尿液中的肌酐可作为蒂西耶氏菌的唯一碳源,将其代谢转化醋酸盐、氨和 CO2,醋酸盐又进一步成为伯克氏菌、丹毒丝菌、消化球菌等菌种的碳源。这些产电微生物通过种间竞争增强微生物的代谢活性,加速尿液内物质所涉及的反应速率,有利于 MFC 快速启动并提高产电性能。在上述研究中,尿液 MFC 启动 2 d后便可产生 1.28 mW 功率,而接种了厌氧污泥的尿液MFC启动耗时5 d,功率仅 0.7 mW,这是由于产电微生物的不同所导致的。在未接种厌氧污泥的尿液MFC中,解脲寡源杆菌 (Oligellaureolytica) 、尿道气球菌 (Aerococcus urinae) 、产氢产乙酸菌 (Acetogenicbecteria) 、丹毒丝菌 (Erysipelothrix) 、消化球菌 (Peptococcus) 、产碱杆菌 (Alcaligenes) 等较为罕见的菌属增加。这些菌属可促进物质转化和提升产电性能。如消化球菌是重要的醋酸盐代谢细菌,能加速有机物的降解;产碱杆菌具备代谢氨的能力,并拥有纳米导线,能处理氮元素的同时加速电子的传递。尿液 MFC 中常见的阳极微生物种群如表1所示。
-
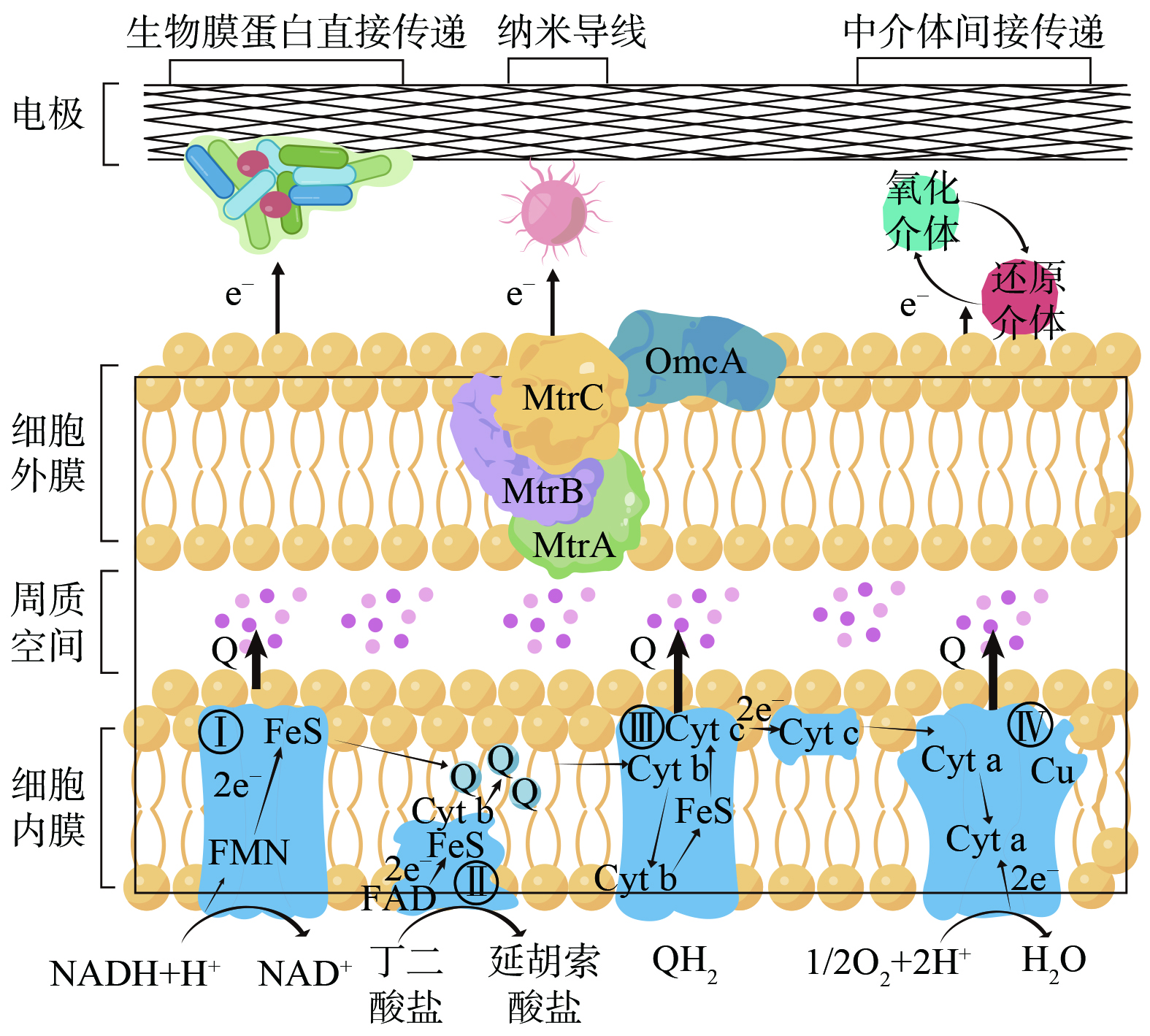
如图3所示,MFC中电子的传递机制分为细胞内电子转移和细胞外电子传递两部分 (以Shewanella. oneidensis MR-1为例) 。微生物代谢产生电子经过细胞内电子传递链迁移至细胞外膜表面完成胞内电子转移。细胞外电子传递则是利用细胞外膜表面电极和微生物之间存在的氧化还原电势差自发地进行[40],包括直接电子传递 (direct electron transfer, DET) 和间接电子传递 (mediated electron transfer, MET) 。前者主要由含细胞色素c的生物膜蛋白和纳米级导电菌毛2种方式体现,后者则利用具有氧化还原可逆性的小分子水溶性物质作为中介体帮助电子穿梭[29]。目前,对MFC内产电微生物电子传递机制的研究主要集中于较常见的希瓦氏菌和杆菌,对尿液中较为罕见的微生物中电子传递机制的研究相对匮乏,而产电微生物种类的不同意味着胞内、胞外电子传递的机制不同,对温度、pH、碳氮比等环境因素的适应能力也不同。
-
1) 温度。产电微生物耐受温度为−20~122 ℃,包括嗜热菌 (45~122 ℃) 、恒温菌 (20~45 ℃) 及嗜冷菌 (20~−12 ℃) 。25~35 ℃是大部分微生物最适生长温度,该温度区间能保证MFC中较适电解液溶解度、电子传递速率、微生物种群丰富度和代谢活性,对生成电活性稳定、代谢能力优良的生物膜是有利的。在35 ℃左右时,MFC普遍处于最佳产电状态[41-43]。沈文瑞[44]研究发现当温度超过45 ℃时,电解液溶解度、电子传递速率、微生物活性和种群多样性降低,MFC产电性能明显受抑制,相比于35 ℃时损失约30%产电能力。此外,50 ℃以上会导致系统中的尿素加速水解,氮素以氨气形式流失。
2) pH。pH会影响微生物活性和氧化还原反应速率,大部分微生物在pH为6~8的中性和弱碱性环境具有良好的细胞活性[45]。在MFC的阳极室中,随着反应进行,有机物分解导致质子累积,pH降低,致使酶活性降低,细菌生长受到抑制,MFC产电性能下降,故阳极室的碱度很重要。新鲜尿液pH一般约为6.5,由于尿素浓度较高,水解后pH逐渐升高,拥有极好的碱性缓冲力,能中和有机物分解产酸,从而减少生成的H+对反应的影响,促进阴极氧还原反应,有利于MFC以更好的产电性能运行[46]。
3) 碳氮比。碳氮比 (C/N) 是微生物生长的重要因素,同时影响MFC产电效率和有机物降解率。碳氮比过低导致微生物生长所需碳源不足,细菌无多余活性进行代谢,导致产生的电子数量下降,影响MFC产电性能。碳氮比过高时反硝化细菌繁殖,种间竞争使硝化细菌减少,氧化反应降低导致电子产生减少。适合的碳氮比能够控制微生物数量及菌间竞争程度从而保证产电性能和污染物降解能力。臧华生等[47]使用湖底厌氧污泥,启动总体积96 mL,以碳刷作阳极、活性炭聚四氟乙烯不锈钢网混合压制作阴极的MFC,以葡萄糖作碳源,氯化铵作氮源,对比不同C/N营养液的产电性能,在C/N=4时获得最大功率密度(2 200 mW·m−3)。王佳琪等[48]使用总体积100 mL,碳刷作阴阳电极的双室型MFC,以醋酸钠作碳源,氯化铵作氮源配置不同C/N的污水运行MFC,在C/N=4.2时获得550 mV最大电压,以及96.1%COD降解率和97.1%氨氮去除率。以上结果表明,MFC系统尿液的C/N≈4,非常适合用作微生物营养底物来源。
4) 药物。尿液中含有未被人体完全代谢的药物污染物,会对某些微生物群落活性产生抑制作用,进而影响MFC产电性能。OLUWATOSIN等[32]发现尿液中4.8 g·L−1氯二甲酚对MFC中戈特沙尔克菌属 (Gottschalkia) 、产乙酸嗜蛋白质菌 (Proteiniphilum) 、伯克霍尔德菌 (Burkholderiaceae) 、蒂西耶氏菌 (Tissierella) 等15个产电微生物菌群产生明显抑制作用,1.2 mW产电性能在4 d内完全损失。CATAL等[49]发现尿液中1 000 ng·mL−1的可卡因代谢物苯甲酰胍,使功率密度从156 mW·m−2降至96 mW·m−2,产电性能损失38.4%。
5) 电导率。尿液所含物质丰富,离子浓度较高,因此具有良好电导率 (约20 mS·cm−1) 。电导率越高,MFC的扩散内阻越小,电子传递过程中能量损失越小,对产电性能的提升越有利。但是尿液水解、结晶及稀释等会导致离子浓度下降,电导率也随之下降,最终影响MFC产电性能,因此对尿液必要的预处理尤为重要。
-
电极材料的选择直接决定MFC的产电效率,其中阳极是MFC中是产电菌群的附着载体,也是经氧化代谢产生的电子从微生物向电极传递的关键位点,需要具备多孔、比表面积大、内阻小、耐腐蚀、成本低等性能。根据催化剂种类,阴极可分为生物型阴极和非生物型阴极,对于非生物型阴极,在催化剂的作用下接收电子并与电子受体结合完成氧还原反应。而对于生物型阴极,除了氧还原反应外,还可发生其他还原反应,如硝酸盐还原反应。
-
电极材料分为碳基与金属基材料。碳基材料化学性能稳定、成本低廉、耐腐蚀,但是过电位较高,内阻较大,会增加电子转移内阻,而且比表面积较小,导电性能较差。金属基材料虽然导电性较高、内阻较小,但存在比表面积低、价格较高、生物毒性较大等劣势。表2显示碳基材料是尿液MFC研究领域最常见的电极材料,相比之下金属基材料较少被采用。使用镁、钙基金属能够触发尿液沉淀反应形成鸟粪石、羟基磷灰石和方解石,回收尿液中氮、磷等营养物。HAO等[50]使用菱镁矿作阳极、碳毡作阴极、总体积80 mL单室型MFC处理尿液,获得最大电流密度 (1.7 mA·cm−2) ,同时以鸟粪石形式有效回收95%氮和85.8%磷。这种以牺牲金属电极实现营养物质回收的方式,虽然为尿液的资源循环利用提供了发展方向,但电极表面产生的结晶,会增加生物膜与电极之间的传质电阻、降低电子传递速率,最终降低MFC的产电性能和运行的稳定性。
-
通过对电极进行修饰与改性,可显著提高电极材料的性能,常用高温氨气处理、热处理、酸处理和电化学氧化等方法。周宇等[58]使用酸性K2CR2O7改性碳布作阳极,在总体积80 mL双室型MFC中产出最大功率密度438 mW·m−2,相比未改性碳布产电性能提升81%。此外,新型高性能材料,纳米材料如多孔碳[37, 59-61, 76],石墨烯[77]以及碳纳米管[78]等,能通过增加比表面积和提高生物相容性以提升MFC产电性能。IWONA等[62]利用多孔活性炭颗粒结合碳纤维导电网络制备新型3D碳纤维支架阳极,并与活性炭PTFE不锈钢网混合压制阴极构建陶瓷膜MFC堆栈,使用尿液与厌氧污泥混合运行获得最大功率密度21 100 mW·m−3,对比未修饰碳幕阳极 (11 900 mW·m−3) 产电性能提升77%。吡津酰胺、磺胺、磺胺嘧啶等有机物和金属材料也被用作催化剂提升电极性能。SALAR等[57]用含Fe3+盐和链霉素 (STR) 作为催化剂,以二氧化硅为模板使用牺牲载体法制备Fe-STR阴极,碳毡作阳极,以尿液与厌氧污泥混合启动25 mL陶瓷膜MFC,获得1 040 mW·m−2的功率密度,相比活性炭阴极 (600 mW·m−2) 性能提升74%。GAJDA等[63]同样采用牺牲载体法制得含有Fe3+和尼卡巴嗪 (Fe-NCB) 的改性阴极和碳毡阳极构建陶瓷膜MFC堆栈,以尿液和厌氧污泥混合接种获得44 800 mW·m−3最大功率密度,与碳毡相比产电性能提高了53%。金属材料耦合纳米碳材料能提供更大的比表面积和良好生物相容性,并增加电极的耐久性,DECTOR等[64]使用60%锐钛矿和40%板铝石作金属基底,以电聚合方式制备Ni(OH)2(TiO2Ni)阳极,与载铂碳毡阴极构建微流控平板式MFC处理含0.33 mol·L−1尿素的模拟尿液得到最大功率密度 (900 mW·m−2) 。导电聚合物,如聚苯胺 (Polyaniline, PANI) 、聚吡咯 (Polypyrrole, PPy) 、聚3,4-乙烯二氧噻吩/聚苯乙烯磺酸盐 (PEDOT/PSS) 因兼具良好的电化学性能以及机械性,且具有可规模化使用的经济优势,近
年来受到广泛关注。周宇等[79]通过电聚合将PANI覆盖于具有3D结构的钛合金骨架金属阳极,以合成尿液与厌氧污泥混合启动40 mL双室MFC得到最大功率密度934 mW·m−3。SALAR等[80]以1.8 V恒电位电聚合制备PEDOT/PSS修饰碳布阳极,使用尿液运行MFC得到了0.5 mW最大输出功率,产电性能比碳布提升了24.3%。
-
MFC的反应器通常有单室型和双室型,也有通过串并联单电池形成的堆栈式MFC。单室型MFC无质子交换膜,调节阴阳极间距离可减小欧姆电阻从而提高产电性能。SANTORO等[81]将无膜单室MFC用于尿液的处理,以碳刷作阳极,载铂碳布作阴极,在130 mL体积内获得55 μW最大功率。YANG等[20]使用碳毡作阴、阳极,在总体积600 mL单室型MFC中实现了同步硝化反硝化过程,获得最大产电功率为63 mW·m−3。但也存在由于阴、阳极同室容易出现离子扩散,电极表面易产生鸟粪石结晶,以及单室型MFC输出功率略低且系统在长期运行下不太稳定等问题。由表2可知,双室构型是尿液MFC中最常用的反应器构型,其中阴、阳极室由离子交换膜隔开。阴极室通常以磷酸缓冲溶液 (Phosphate buffer saline,PBS) 作为电子受体的溶剂,通过增加溶解氧或者添加铁氰化钾 (K3[Fe(CN)6]) 、Fe3+等电子受体可以显著提升MFC产电性能,可用于评估电极材料、膜、电解质和特殊阳极底物等对MFC性能的影响。这种系统操作灵活便捷,但因膜材料产生的内阻对产电性能有一定影响。通过级联多个MFC装置构成的堆栈式MFC能有效提升产电性能。CLEMENT等[65]用2堆32个单室的MFC堆栈组合处理尿液得到有效电流密度为65 mA·m−2,平均功率密度为23 mW·m−2。堆栈式MFC系统中复杂的生物反应容易使微生物失活,导致电极反转而影响系统稳定性[82],需进一步研究在实际应用的解决方案。
-
分隔材料通常置于阴、阳极室之间,起到防止阴极室的溶解氧进入阳极室、发生短路等作用,需要具备成本低廉、渗透阻力较小、不易弯曲、离子传导性良好等特性。传统分隔材料如盐桥、玻璃珠和玻璃纤维等因其会大幅提高MFC内阻而逐渐不被采用。目前,离子交换膜既能保证系统内阻较小又能保持阳极室的缺氧状态,可作为MFC研究的优选材料,已被广泛使用。根据允许通过离子不同,分隔材料又分为阳离子交换膜、阴离子交换膜与质子交换膜。在处理尿液时普遍选择只允许H+通过的质子交换膜,以保证阳极硝化反应和阴极氧化还原反应的发生。阴、阳离子交换膜的出现使尿液中氮、磷营养物同步回收成为可能。HAN等[66]以选择性透过NH4+的阳离子交换膜作分隔材料,制作碳刷阳极、载铂碳幕阴极的28 mL双室MFC,并在阴极结合疏水性气体渗透管,以尿液启动运行获得9 210 mW·m−3最大功率密度,同时回收91.6%氮。GAO等[59]以活性炭作阳极,炭黑、活性炭与PTFE混合制成空气阴极,阴、阳双离子交换膜作分隔材料,构建总容积685 mL带有营养物回收室的MFC,以合成尿液运行获得21 300 mW·m−3最大功率密度,同时实现1 234 mg·L−1氮和101 mg·L−1磷的回收效果。LI等[67]使用类似双离子交换膜构型,以石墨刷作阳极,活性炭作阴极,在28 mL的MFC处理合成尿液获得1 300 mW·m−2最大功率密度,同时以42%、37%和59%回收总氮、磷酸盐和硫酸盐。STEFANO等[68]构建以石磨棒作阳极,活性炭与PTFE混合的载铂阴极,双离子交换膜作分隔材料,总容积600 mL的MFC处理水解尿液,通过自产3 A·m−2电流密度驱动循环泵,实现了第一个尿液营养自动回收系统,得到含1.2%氮、0.4%钾、0.02%磷和0.1%硫的肥料浓缩液。
近年来,研究者们倾向用管状陶瓷膜代替传统离子交换膜,陶瓷膜的多孔结构允许离子交换,具有良好的热稳定性、化学稳定性和高机械强度。陶瓷膜管状结构通过提高膜的空间利用率从而提升离子和质子交换率,使其与传统膜具备几乎相同的功率和降解能力[83]。此外,陶瓷膜廉价易制、可清洗,并能减缓膜污染,可在缩减经济成本的同时保证MFC长期稳定运行[69]。MERINO-JIMENEZ等[84]将经过3次循环固化煅烧制备细火黏土陶瓷膜作分隔材料,以碳幕阳极和活性炭混合PTFE阴极,由18个20 mL的MFC构建堆栈电池组,在尿液基质中获得1.06 mW的最大输出功率。SALAR等[71]制备含有5.75%氧化铁的粘土陶瓷膜作分隔层,以尿液运行MFC,获得1.04 mW的最大功率。此外,尿液驱动的陶瓷膜MFC可在阴极原位合成具有杀菌效果的浓缩液[73],且杀菌能力、pH和电导率随陶瓷膜厚度和运行时间增加而增加[72]。
-
进料流量会影响微生物获得营养物质的速率及生物膜富集状态,是影响MFC产电性能的重要因素。对于间歇式运行的MFC,产电微生物将尿液中的代谢物质消耗殆尽后电压下降,视为一个产电周期,重新添加尿液基质后恢复产电。对于连续流MFC,较低的流量会形成厚实的生物膜,增加欧姆内阻, 影响电子传递效率进而影响产电性能。随着流量的继续增加,水力停留时间 (hydraulic retention time, HRT) 减小,MFC系统的有机负荷率 (organic loading rate,OLR) 减小,微生物因有效氧化时间降低,对产电和降解性能产生负面影响,同时高流速产生较高的剪切应力可能导致微生物难以有效附着于电极表面。合适的进料流量能使MFC获得最佳产电性能。不同的MFC系统因反应器不同对流量有不同要求,比增长率,即进液流量的增加和输出功率增加到最大比值时的临界流量[85],是描述一个MFC系统以最佳产电性能运行的重要指标。针对每一个MFC系统实验,得到相对应的比增长率是其实际应用的关键。DE RAMON-FERNANDEZ等[74]以碳纤维布阳极、活性炭与聚四氟乙烯混合载铂阴极和陶瓷膜组成28 mL的双室MFC,并将6个串联形成堆栈,利用人工神经网络模拟16种不同的进料流速下的功率性能,以Levenberg-Marquarelt算法预测在尿液基底下,HRT≈1.83 h时可获得超过500 mW·m−2功率密度,提供了一种高效的最适HRT获得方式。
-
XAVIER等[4]在构建特殊单室构型MFC—自分层微生物燃料电池 (self-stratified microbial fuel cell, SC-MFC) 后指出可通过调整阴极材料在尿液中的浸没深度,改变阴极氧还原反应速率能够影响MFC的产电性能。XAVIER等[75]还将SC-MFC的阳极完全浸没于尿液中,置于反应器底部,间隔小段距离将阴极置于阳极上方,并将部分阴极暴露于空气中。该研究发现随着阴极浸没于尿液的体积变多,微生物在缺氧条件下代谢的活性和速率增加,未浸入部分与氧气接触而增加氧还原反应速率,两者之间的平衡在浸没体积为阴极长度的3/4时达到最大值,此时MFC获得最大产电性能。之后,随着阴极持续浸没后产电性能开始下降,并且在完全浸没后阴极彻底失去与氧气的直接接触,导致产电性能急剧下降。该结论在后续研究中也多次被证实[54, 86-88]。而双室型MFC可通过在阴极室中添加电子受体或曝气等方式促进阴极还原反应速率,故改变电极浸没深度对产电性能的影响不大。
-
1) MFC产电性能的进一步提升。尿液MFC的产电性能,如功率密度和固体氧化物燃料、氢燃料等大功率燃料电池相比,依然有待进一步提升。这需要进一步提高尿液MFC中特征微生物的活性,以革兰氏阳性菌为代表的厚壁菌门细菌是尿液MFC的优势菌种,但其细胞壁较厚,所含有的非导电肽聚糖层会影响胞内电子传递,在不损伤薄壁菌的同时通过技术手段改变后壁菌的细胞膜通透性是发展方向之一,如投加一定浓度的溶菌酶。对于尿液中所存在的罕见产电微生物,如Tissierella、Burkholderiaceae等,可通过分析细胞中产生电子的蛋白酶和传递电子的自源性介质,识别影响细菌代谢的关键因素,并借助基因工程技术增加它们在细胞内的表达,构建高活性的产电菌落结构,这亦是提升尿液MFC产电性能的重要发展方向。限制尿液MFC产电性能的另一个重要原因是,MFC的内阻导致极化现象造成能量损失,则需要对电极材料进行优化。纳米材料能显著提高微生物-胞外受体间电子转移速率,降低活化内阻,提升产电性能。纳米金属材料中的过渡金属氧化物、金属有机骨架 (MOFs) 和导电聚合物中如聚多巴胺、聚噻吩等材料还具备高导电性,欧姆内阻更小,亦为重要研究方向。
2) MFC技术的应用拓展。MFC在产电的过程中,如前文中对尿液MFC的工作原理及相关生物化学反应过程所述,伴随着微生物生长和氧化还原过程,也会发生硝化、反硝化、聚磷和释磷的“脱氮除磷”过程。这些过程对尿液中有机污染物和营养物有一定的去除作用,但仅靠MFC的作用去除效率较低,加之尿液中污染物浓度高,MFC的出水难以满足相关的排放要求。因此,需要增加后续处理单元,或者通过改变物质的形态,以实现营养物回收。将MFC单元所产生的电能用以电强化微生物实现降解功能是极具潜力的发展方向。研究表明,外加0.2 V~0.8 V电压形成的双室微生物电解池 (microbial electrolytic cell , MEC) ,能强化阳极生物膜活性,增加尿液处理效率,在阳极产生磷肥的同时阴极还原产生氢气与氨气,实现尿液中的资源回收与污染物去除[56]。此外,使用MFC为光电催化技术 (photoelectro-catalytic technology, PEC)提供所需低电压,形成耦合系统加速反应过程,能强化难降解污染物的去除。
3) MFC技术的工程化应用。已有尿液MFC示范是由西英格兰大学IEROPOULOS教授团队在2次音乐节场地厕所的应用。若将尿液MFC推向工程化应用,还需克服经济性和操作条件等困难。一方面,实现MFC的规模应用需要较强的产电能力,这需要通过堆栈实现,而堆栈规模、构型等对产电效能的影响还有待考察;同时,对于在连续运行中MFC反应条件实现自动控制、精准调控也还需要相应技术手段的支撑。另一方面,离子交换膜的费用在MFC中占了重要组成,其价格从几十元 (陶瓷膜,Earthenware的价格为每平米35.19元) 到上万元不等 (Nafion N117 PEM的价格为每平米14 732.85元) 。开发更低成本离子交换膜或者实现无质子膜的MFC反应器,从而大幅度降低MFC的制造成本,还需克服无膜或者陶瓷类膜的性能缺陷,这将成为一项重要工作。另外,电极材料成本占比也较大,应关注廉价、耐用、性价比高材料的淘选,如导电聚合物对碳基材料的修饰是较合理的研究选择。此外,在尿液MFC的实际应用中,应通过合适的收集手段避免尿液水解、结晶导致离子和营养物质的流失,还要确保在室温环境下微生物活性和尿液电导率、反应器最适HRT、有机负荷等参数,以获得最佳产电性能。
以尿液为阳极基质的微生物燃料电池研究进展
Research progress of microbial fuel cell based on urine as anode substrate
-
摘要: 微生物燃料电池 (MFC) 是一种利用微生物将有机物中的化学能直接转化成电能的环境友好型技术,已成为污水资源化领域的研究重点。尿液以高有机浓度、高电导率、营养物质丰富且产量庞大等特点成为MFC的优选基质。梳理了近十年以尿液为阳极基质的MFC研究工作,详细阐述了尿液作为MFC阳极基质的优势和工作机理,以及该研究领域的发展历程;总结了以尿液为阳极基质的MFC中产电微生物、电极及膜材料、反应器构型等因素对产电性能的影响;在现有研究的基础上就产电性能、能源与资源回收效益的提升以及工程化应用方面现存挑战与发展方向给出建议,以期为更好地解决基于尿液为阳极基质的MFC在实际应用中的难题提供参考。
-
关键词:
- 微生物燃料电池(MFC) /
- 尿液 /
- 产电微生物 /
- 电极材料 /
- 能源回收
Abstract: Microbial fuel cell is an environmentally friendly technology in the bio-electrochemical system. It can directly convert the chemical energy in organic wastewater into electrical energy by virtue of the metabolic capacity of electrogenic microorganisms and has gradually become the focus of research. Urine has become a good choice for microbial fuel cell substrate due to its high organic concentration, high conductivity, rich nutrients and large output. This paper reviewed the research work of microbial fuel cell base on urine as anode substrate in the past decade. First, the advantages and mechanism of urine as the substrate were demonstrated in detail, as well as the development history of this research field. Then the influence of factors such as electro-generating microorganisms, electrode and membrane materials, reactor configuration, etc. on the electricity generation performance of MFC base on urine was summarized. Finally, on the basis of the existing research, suggestions were given on the current challenges and development directions in three aspects: power generation efficiency, improvement of energy and resource recovery efficiency, and engineering application, in order to solve the problems in the practical application of MFC treatment of urine better. -

-
表 1 尿液MFC中常见的阳极微生物及特性
Table 1. Common anodic microorganisms and characteristics in urine MFC
纲 科 属 种 产电性能 文献 α-变形菌纲a 慢生根瘤菌科 红假单胞杆菌属 — — [28] 红杆菌科 玫瑰杆菌属 — — [28] 红杆菌属 红杆菌属 — [28] 斯塔普氏菌属 — — [20] 嘉利翁氏菌科 亚硝化单胞菌属 [29] β-变形菌纲a 丛毛单胞菌科 氢噬胞菌属 — — [20] 普罗卡杆菌科 普罗卡杆菌属 — — [29] 伯克氏菌科 贪铜菌属 Cupriavidus sp. — [27] 红育菌属 — — 伯克氏菌属 红藻菌 — [25] 红环菌科 红环菌属 — — [27] 陶厄氏菌属 — — [30] 甲基洛维氏菌 — — [27] 固氮弓菌属 — — [20] 产碱菌科 产碱菌属 — — [27] 德克斯氏菌属 — — [31] 寡源杆菌属 解脲寡源杆菌 — [32] 嗜氢菌科 硫杆状菌属 — — [20] γ-变形菌纲a 假单胞菌科 假单胞菌属 铜绿假单胞杆菌 455 mV [31] 门多萨假单胞菌 — [33] 硫假单胞菌 — [34] 肠杆菌科 埃希菌属 大肠杆菌 — [35] 变形杆菌属 普通变形杆菌 482 mV [36] 沙门氏菌属 鼠伤寒沙门氏菌 634 μW [37] 盐单胞菌科 盐单胞菌属 — — [20] 交替单胞菌科 别样希瓦氏菌属 — — [37] 气单胞菌科 甲苯单胞菌属 甲苯单胞菌 424 mW·m-2 硫发菌科 硫发菌属 — — 鱼立克次体科 噬甲基菌属 嗜甲基菌 — [32] ε-变形菌纲a 希万氏菌科 希瓦氏菌属 希瓦氏菌 — [28] 弯曲菌科 弓形杆菌属 — — [31] δ-变形菌纲a 地杆菌科 地杆菌属 硫还原地杆菌 0.17 mA·cm-2 [35] 脱硫弧菌科 脱硫弧菌属 — — [28] 除硫单胞菌科 除硫单胞菌属 — — [36] 芽孢杆菌纲b 乳酸杆菌科 乳杆菌属 — — [31] 气球菌科 气球菌属 尿道气球菌 — [27] 肉杆菌科 Atopostipes Atopostipes sp. — [35] 芽孢杆菌纲b 肉杆菌科 束毛球菌 — — [35] 德库菌属 — — [27] 头孢菌属 — — [38] 芽孢杆菌科 芽孢杆菌属 枯草芽孢杆菌 147 mV [39] 葡萄球菌科 葡萄球菌属 金黄色葡萄球菌 718 μW [28] 科未定 厌氧醋菌科 — — [39] 肠球菌科 肠球菌属 — — [30] 梭菌纲b 梭菌科 胺基酸杆菌属 [20] 梭菌属- — — [35] 消化链球菌科 微单胞菌属 — — [28] 噬胨菌属 — — [38] 消化链球菌属 — — [28] 蒂西耶氏菌属 噬酸葡萄球菌 — [40] 硫杆菌属 — — [30] 小纺锤状菌属 — — [36] 消化球菌属 — — [27] 优杆菌科 Anaerovorax — — [30] 梅利索球菌属 — — [31] 硝化螺旋菌纲c 硝化螺旋菌 硝酸螺旋菌属 — — [37] 柔膜菌纲d 丹毒丝菌科 丹毒丝菌属 — — [38] 拟杆菌纲e 拟杆菌科 — — — [27] 理研菌科 产氢产乙酸菌属 Petrimonas sp. [30] 黄杆菌纲l 黄杆菌科 黄杆菌属 — — [38] 绿弯菌纲f — — — — [27] 放线菌亚纲g 假诺卡氏菌科 — — — [37] 微球菌科 四联球菌属 — — [27] 酸杆菌纲h — — — — [36] 广古菌纲j — — — — [29] 异常球菌纲k 特吕珀菌科 特吕珀菌属 — — [27] 注:a代表变形菌门;b代表厚壁菌门;c代表硝化螺旋菌门;d代表柔膜菌门;e代表拟杆菌门;f代表绿弯菌门;g代表放线菌门;h代表酸杆菌门;i代表浮霉菌门;j代表广古菌门;k代表异常球菌门;l代表黄杆菌门。 表 2 尿液MFC构建组件及性能
Table 2. Construction components and performance of urine MFC
构型 阳极液/容积 阴极液/容积 阳极 阴极 膜材料 外阻/Ω 温度/℃ HRT 产电性能 文献 双室 真实尿液/25 mL 自来水/25 mL 碳布 碳布 CEM 1 300 室温 6.25 min 8 mA·m−2 [7] 单室 真实尿液/130 mL — 碳刷 碳布/Pt — 1 000 30 间歇式 0.06 mW [51] 单室 真实尿液/130 mL — 碳刷 碳布/Pt — 30 间歇式 0.23 mA [9] 双室 真实尿液/- — 碳幕 碳纤维 陶瓷膜 1 000 室温 20 h 7 700 mW·m−3 [52] 双室×48 真实尿液/0.7 mL -/0.7 mL 碳纤维 碳纤维 陶瓷膜 1 000 22 — 1 850 mW·m−3 [53] 双室×12 真实尿液/49 mL — 碳纤维 石墨 陶瓷膜 — 室温 3.8 h 2.1 mW [12] 双室×24 真实尿液/6.25 mL — 碳纤维 碳布 CEM 24 h 2.5 mW 单室×4 真实尿液/6.9 L — 碳纤维 活性炭 — — 室温 11.5 h 130 mW [13] 单室 真实尿液/0.4 mL — 碳布 活性炭 — — 室温 10 min 1.2 mW [54] 双室×288 真实尿液/25 L — 活性炭 活性炭 陶瓷膜 — 室温 间歇式 400 mW [55] 单室×432 真实尿液/42 L — 碳布 碳布 — — 室温 间歇式 700 mW [17] 双室 真实尿液/20 mL PBS/20 mL 石墨毡 碳毡、Pt CEM 1 000 20 20 min 500 mA·m−2 [8] 双室×9 真实尿液/30 mL PBS/30 mL 碳布 活性炭 陶瓷膜 100 室温 1.5 h 1.28 mW [27] 双室 真实尿液/90 mL PBS /90 mL 碳刷 碳刷 CEM 100 35 间歇式 421.9 mW·m−3 [56] 双室 真实尿液/30 mL — 碳布 活性炭 陶瓷膜 100 室温 42.8 min 1.2 mW [32] 单室 真实尿液/12 mL — 碳布 碳布 — 980 32 — 156 mW·m−2 [49] 单室 真实尿液/18 mL — 镍片 碳布、Pt、活性炭 — — 室温 2.25 h 8 140 W·m−3 [57] 真实尿液/0.08 mL — — — 16 min 44.16 W·m−3 单室 真实尿液/30 mL — 碳膜 碳膜 — 室温 间歇式 124.2 mW·m−2 [35] 单室 真实尿液/80 mL — 菱镁矿 碳毡 — — — 20 min 1.7 mA·cm−2 [50] 双室 模拟尿液/40 mL PBS/40 mL 碳布 碳布 PEM 1 000 35 间歇式 0.44 mW·m−2 [58] 石墨烯 碳布 44.9 W·m−2 PANI、不锈钢、钛 碳布 930 mW·m−3 三室 真实尿液/315 mL 尿液/105 mL 活性炭 炭黑、活性炭 CEM、AEM 500 25 52.5 min 21.3 W·m−3 [59] 双室 模拟尿液/40 mL PBS/40 mL 碳布 碳毡 PEM 1 000 35 间歇式 555.1 mW·m−3 [60] 单室×15 真实尿液/6.25 mL — 多孔碳、碳纤维 炭黑 — — 22 32.4 min 60.7 mW·m−2 [61] 双室×22 真实尿液/1.8 L — 活性炭、碳幕 碳幕 陶瓷膜 — 室温 间歇式 21.1 W·m−3 [62] 双室 真实尿液/12.5 mL — 碳膜 铁盐、链霉素、活性炭 陶瓷膜 1 000 室温 3.5 h 1 040 mW·m−2 [10] 双室×3 真实尿液/60 mL — 碳纤维 铁盐、尼卡巴嗪、活性炭 陶瓷膜 500 室温 间歇式 4 480 mW·m−3 [63] 单室 真实尿液/- — 纳米二氧化钛 活性炭、Pt — — 室温 20 min 900 mW·m−2 [64] 双室×32 真实尿液/3.5 L — 碳膜 碳幕 陶瓷膜 4 室温 — 65 mW·m−2 [65] 双室 合成尿液/28 mL NaCl/20 mL 碳刷 碳布、Pt CEM 1 000 30 — 9 210 mW·m−3 [66] 三室 合成尿液/28 mL 合成尿液/28 mL 石墨刷 活性炭 CEM、AEM 10 30 间歇式 1 300 mW·m−2 [67] 三室 真实尿液/200 mL 真实尿液/200 mL 石墨 碳布、炭黑、Pt CEM、AEM — 室温 9.62 h 3 A·m−2 [68] 双室×8 真实尿液/435 mL — 碳纱、活性炭 活性炭、碳幕 陶瓷膜 — 室温 12 h 15 mW [69] 单室×28 真实尿液/525 mL — 活性炭 — 12 h 25 mW 双室×18 真实尿液/360 mL — 碳幕 活性炭 陶瓷膜 1 000 室温 43.37 h 1.06 mW [70] 双室 真实尿液/10 mL — 碳板 活性炭、碳幕 陶瓷膜 — 室温 2.86 h 1.05 mW [71] 双室×12 真实尿液/200 mL — 碳膜 碳纤维、活性炭 陶瓷膜 80 22 22.22 h 2.2 mW [72] 双室×6 真实尿液/96 mL — 碳纱 碳膜、活性炭 陶瓷膜 — 室温 10.67 h 3.1 mW [73] 双室×6 真实尿液/168 mL — 碳纤维 活性炭、Pt 陶瓷膜 500 室温 1.83 h 500 mW·m−2 [74] 单室 真实尿液/ 碳纤维 活性炭 — 120 室温 — 3.0 mW [75] -
[1] SHARMA R, KUMARI R, PANT D, et al. Bioelectricity generation from human urine and simultaneous nutrient recovery: Role of Microbial Fuel Cells[J]. Chemosphere, 2021, 292: 133437. [2] 郭璇. 微生物燃料电池技术底物的研究进展[J]. 广东化工, 2014, 41(18): 112-113. doi: 10.3969/j.issn.1007-1865.2014.18.059 [3] 孔晓英, 孙永明, 李连华, 等. 不同底物对微生物燃料电池产电性能的影响[J]. 农业工程学报, 2011, 27(S1): 185-188. [4] WALTER X A, GAJDA I, FORBES S, et al. Scaling-up of a novel, simplified MFC stack based on a self-stratifying urine column[J]. Biotechnology for biofuels, 2016, 9(1): 93. doi: 10.1186/s13068-016-0504-3 [5] LEDEZMA P, KUNTKE P, BUISMAN C J N, et al. Source-separated urine opens golden opportunities for microbial electrochemical technologies[J]. Trends in Biotechnology, 2015, 33(4): 214-220. doi: 10.1016/j.tibtech.2015.01.007 [6] 高振超. 尿液的氮磷资源化与处理技术研究[D]. 北京: 北京交通大学. 2018. [7] IEROPOULOS I, GREENMAN J, MELHUISH C. Urine utilization by microbial fuel cells; energy fuel for the future[J]. Physical Chemistry Chemical Physics, 2011, 14(1): 94-98. [8] KUNTKE P, SMIECH K M, BRUNING H, et al. Ammonium recovery and energy production from urine by a microbial fuel cell[J]. Water Research, 2012, 46(8): 2627-2636. doi: 10.1016/j.watres.2012.02.025 [9] SANTORO C, IEROPOULOS I, GREENMAN J, et al. Current generation in membraneless single chamber microbial fuel cells (MFCs) treating urine[J]. Journal of Power Sources, 2013, 238: 190-196. doi: 10.1016/j.jpowsour.2013.03.095 [10] SALAR G M J, SANTORO C, KODALI M, et al. Iron-streptomycin derived catalyst for efficient oxygen reduction reaction in ceramic microbial fuel cells operating with urine[J]. Journal of power sources, 2019, 425: 50-59. doi: 10.1016/j.jpowsour.2019.03.052 [11] TAGHAVI M, STINCHCOMBE A, GREENMAN J, et al. Self-sufficient wireless transmitter powered by foot-pumped urine operating wearable MFC[J]. Bioinspiration & Biomimetics, 2016, 11(1): 016001. [12] IEROPOULOS I A, LEDEZMA P, STINCHCOMBE A, et al. Waste to real energy: the first MFC powered mobile phone[J]. Physical Chemistry Chemical Physics, 2013, 15(37): 15312-15316. doi: 10.1039/c3cp52889h [13] WALTER X A, GREENMAN J, IEROPOULOS I A. Microbial fuel cells directly powering a microcomputer[J]. Journal of Power Sources, 2020, 446: 227328. doi: 10.1016/j.jpowsour.2019.227328 [14] LIU Y, HE L F, DENG Y Y. Recent progress on the recovery of valuable resources fromsource-separated urine on-site using electrochemical technologies: A review[J]. Chemical engineering journal, 2022, 442(1): 136200. [15] IEROPOULOS I, STINCHCOMBE A, GAJDA I, et al. Pee Power Urinal – Microbial Fuel Cell Technology Field Trials In The Context Of Sanitation[J]. Environmental Science:Water Research & Technology, 2016, 2(2): 336-343. [16] WALTER X A, YOU J, WINFIELD J, et al. From the lab to the field: Self-stratifying microbial fuel cells stacks directly powering lights[J]. Applied Energy, 2020, 277: 115514. doi: 10.1016/j.apenergy.2020.115514 [17] WALTER X A, MERINO-JIMÉNEZ I, GREENMAN J, et al. PEE POWER® urinal II – Urinal scale-up with microbial fuel cell scale-down for improved lighting[J]. Journal of Power Sources, 2018, 392: 150-158. doi: 10.1016/j.jpowsour.2018.02.047 [18] NARAYANANA N, MANGOTTIRI V, NARAYANAN K. Waste to Energy Conversion and Sustainable Recovery of Nutrients from Pee Power - Recent Advancements in Urine-Fed MFCs[J]. Mini-Reviews in Organic Chemistry, 2019, 16(7): 768-779. [19] MASRURA S U, DISSANAYAKE P, YUQING S, et al. Sustainable use of biochar for resource recovery and pharmaceutical removal from human urine: A critical review[J]. Critical Reviews in Environmental Science and Technology, 2020, 51(24): 3016-3048. [20] YANG N, LIU H, JIN X, et al. One-pot degradation of urine wastewater by combining simultaneous halophilic nitrification and aerobic denitrification in air-exposed biocathode microbial fuel cells (AEB-MFCs)[J]. Science of The Total Environment, 2020, 748: 141379. doi: 10.1016/j.scitotenv.2020.141379 [21] 刘有华, 王思婷, 杨乔乔, 等. 国内外水体富营养化现状及聚磷菌研究进展[J]. 江苏农业科学, 2021, 49(9): 26-35. [22] 刘远峰, 张秀玲, 张其春, 等. 微生物燃料电池中阳极产电菌的研究进展[J]. 精细化工, 2020, 37(9): 1729-1737. doi: 10.13550/j.jxhg.20200001 [23] PRATHIBA S, KUMAR P S, VO D N. Recent advancements in microbial fuel cells: A review on its electron transfer mechanisms, microbial community, types of substrates and design for bio-electrochemical treatment[J]. Chemosphere, 2021, 286(Pt 3): 131856. [24] 黄霞, 梁鹏, 曹效鑫, 等. 无介体微生物燃料电池的研究进展[J]. 中国给水排水, 2007, 23(4): 1-6. doi: 10.3321/j.issn:1000-4602.2007.04.001 [25] 洪义国, 郭俊, 孙国萍. 产电微生物及微生物燃料电池最新研究进展[J]. 微生物学报, 2007, 47(1): 173-177. doi: 10.3321/j.issn:0001-6209.2007.01.036 [26] 杨政伟, 顾莹莹, 赵朝成, 等. 土壤微生物燃料电池的研究进展及展望[J]. 化工学报, 2017, 68(11): 3995-4004. doi: 10.11949/j.issn.0438-1157.20170793 [27] OBATA O, SALAR-GARCIA M J, GREENMAN J, et al. Development of efficient electroactive biofilm in urine-fed microbial fuel cell cascades for bioelectricity generation[J]. J Environ Manage, 2020, 258: 109992. doi: 10.1016/j.jenvman.2019.109992 [28] SALARGARCIA M J, OBATA O, KURT H, et al. Impact of inoculum type on the microbial community and power performance of urine-fed Microbial Fuel Cells[J]. Microorganisms, 2020, 8(12): 1921. doi: 10.3390/microorganisms8121921 [29] Barbosa S G, Peixoto L, Soares O, et al. Influence of carbon anode properties on performance and microbiome of Microbial Electrolysis Cells operated on urine[J]. Electrochimica Acta, 2018: 122-132. [30] THAPA B S, KIM T, PANDIT S, et al. Overview of electroactive microorganisms and electron transfer mechanisms in microbial electrochemistry[J]. Bioresource Technology, 2022, 347: 126579. doi: 10.1016/j.biortech.2021.126579 [31] PRIYA S, SRIKANTH M. Nutrient recovery and microbial diversity in human urine fed microbial fuel cell[J]. Water Science & Technology, 2019, 79(4): 718-730. [32] OLUWATOSIN O, JOHN G, HALIL K, et al. Resilience and limitations of MFC anodic community when exposed to antibacterial agents[J]. Bioelectrochemistry, 2020, 134: 107500. doi: 10.1016/j.bioelechem.2020.107500 [33] 贾婧, 彭俊霖, 王一靖, 等. 反硝化微生物燃料电池脱除低C/N废水中氮的研究[J]. 环境污染与防治, 2021, 43(8): 937-941. doi: 10.15985/j.cnki.1001-3865.2021.08.002 [34] 陈诗雨, 许志成, 杨婧, 等. 微生物燃料电池在废水处理中的研究进展[J]. 化工进展, 2022, 41(2): 951-963. doi: 10.16085/j.issn.1000-6613.2021-0420 [35] PRIYA S, DEVENDRA K, SRIKANTH M. Probing the degradation of pharmaceuticals in urine using MFC and studying their removal efficiency by UPLC-MS/MS[J]. Journal of Pharmaceutical Analysis, 2021, 11(3): 320-329. doi: 10.1016/j.jpha.2020.04.006 [36] SÓNIA G B, LUCIANA P, OLÍVIA S G P S, et al. Influence of carbon anode properties on performance and microbiome of Microbial Electrolysis Cells operated on urine[J]. Electrochimica Acta, 2018, 267: 122-132. doi: 10.1016/j.electacta.2018.02.083 [37] IEROPOULOS I, OBATA O, PASTERNAK G, et al. Fate of three bioluminescent pathogenic bacteria fed through a cascade of urine microbial fuel cells[J]. Journal of industrial microbiology & biotechnology, 2019, 46(5): 587-599. [38] GREENMAN J, GAJDA I, IEROPOULOS I. Microbial Fuel Cells (MFC) and microalgae; Photo Microbial Fuel Cell (PMFC) as complete recycling machines[J]. Sustainable Energy & Fuels, 2019, 3(10): 2546-2560. [39] 王美聪, 王紫诺, 张学军. 羧甲基纤维素钠为阳极底物的微生物燃料电池产电性能[J]. 化工管理, 2020(4): 108-109. doi: 10.3969/j.issn.1008-4800.2020.04.068 [40] 张吉强. 微生物燃料电池同步脱氮产电性能及机理研究[D]. 杭州: 浙江大学, 2014. [41] 汪飞. MnO2/聚苯胺复合修饰微生物燃料电池阳极处理垃圾渗滤液[D]. 淮南: 安徽理工大学, 2021. [42] 袁晓东. 基于A/O工艺的双室MFC脱氮除磷及产电性能的研究[D]. 张家口: 河北建筑工程学院, 2020. [43] 梁涛. 光合微生物燃料电池(PMFC)同步处理两种不同废水的研究[D]. 太原: 太原理工大学, 2019. [44] 沈文瑞. 阳极菌群的调控对微生物燃料电池产能的促进[D]. 济南: 齐鲁工业大学, 2020. [45] 李莉, 代勤, 张赛, 等. 不同pH下微生物燃料电池降解含硫偶氮染料废水的效能及其机理[J]. 环境工程学报, 2021, 15(1): 115-125. doi: 10.12030/j.cjee.202004125 [46] SANTORO C, GARCIA M, WALTER X A, et al. Urine in bioelectrochemical systems: An overall review[J]. ChemElectroChem, 2020, 7(6): 1312-1331. doi: 10.1002/celc.201901995 [47] 臧华生, 周新国, 李会贞, 等. pH值和碳氮比对微生物燃料电池脱氮除磷效果的影响[J]. 灌溉排水学报, 2019, 38(2): 49-55. [48] 王佳琪, 付国楷, 黄梓良, 等. 碳氮比对高盐废水单室MFCs产电、污染物去除及微生物群落结构的影响[J]. 环境工程学报, 2021, 15(4): 1354-1366. doi: 10.12030/j.cjee.202009094 [49] CATAL T, KUL A, ATALAY V E, et al. Efficacy of microbial fuel cells for sensing of cocaine metabolites in urine-based wastewater[J]. Journal of Power Sources, 2019, 414: 1-7. doi: 10.1016/j.jpowsour.2018.12.078 [50] HAO J W, ZENG H B, LI X Y, et al. Nitrogen and phosphorous recycling from human urine by household electrochemical fixed bed in sparsely populated regions[J]. Water Research, 2022, 218: 118467. doi: 10.1016/j.watres.2022.118467 [51] SANTORO C, IEROPOULOS I, GREENMAN J, et al. Power generation and contaminant removal in single chamber microbial fuel cells (SCMFCs) treating human urine[J]. International Journal of Hydrogen Energy, 2013, 38(26): 11543-11551. doi: 10.1016/j.ijhydene.2013.02.070 [52] TAGHAVI M, GREENMAN J, BE CC AI L, et al. High-performance, totally flexible, tubular Microbial Fuel Cell[J]. ChemElectroChem, 2015, 1(11): 1994-1999. [53] IEROPOULOS I A, GREENMAN J, MELHUISH C. Miniature microbial fuel cells and stacks for urine utilisation[J]. International Journal of Hydrogen Energy, 2013, 38(1): 492-496. doi: 10.1016/j.ijhydene.2012.09.062 [54] CARLO S, XAVIER A W, FRANCESCA S, et al. Self-stratified and self-powered micro-supercapacitor integrated into a microbial fuel cell operating in human urine[J]. Electrochimica Acta, 2019, 307: 241-252. doi: 10.1016/j.electacta.2019.03.194 [55] GAJDA I, GREENMAN J, MELHUISH C, et al. Electro-osmotic-based catholyte production by Microbial Fuel Cells for carbon capture[J]. Water Research, 2015, 86: 108-115. [56] 于瑞娟. BES处理尿液的影响因素及能源回收资源化研究[D]. 西安: 陕西科技大学, 2019. [57] YOUSEFI R, MARDANPOUR M M, YAGHMAEI S. Fabrication of the macro and micro-scale microbial fuel cells to monitor oxalate biodegradation in human urine[J]. Scientific reports, 2021, 11(1): 14346. doi: 10.1038/s41598-021-93844-y [58] 周宇. 尿液微生物燃料电池阳极性能的研究[D]. 北京: 北京工业大学, 2017. [59] GAO Y F, SUN D Y, WANG H, et al. Urine-powered synergy of nutrient recovery and urine purification in a microbial electrochemical system[J]. Environmental Science:Water Research & Technology, 2018, 4(10): 1427-1438. [60] 陈稳稳, 刘中良, 侯俊先, 等. 新型超级电容器材料修饰尿液微生物燃料电池阳极的研究[J]. 工程热物理学报, 2018, 39(8): 1818-1823. [61] YOU J, SANTORO C, GREENMAN J, et al. Micro-porous layer (MPL)-based anode for microbial fuel cells[J]. International Journal of Hydrogen Energy, 2014, 39(36): 21811-21818. doi: 10.1016/j.ijhydene.2014.07.136 [62] IWONA G, JOHN G, IOANNIS I. Microbial Fuel Cell stack performance enhancement through carbon veil anode modification with activated carbon powder[J]. Applied Energy, 2020, 262: 114475. doi: 10.1016/j.apenergy.2019.114475 [63] GAJDA I, GREENMAN J, SANTORO C, et al. Multi-functional microbial fuel cells for power, treatment and electro-osmotic purification of urine[J]. Journal of chemical technology and biotechnology, 2019, 94(7): 2098-2106. doi: 10.1002/jctb.5792 [64] DECTOR D, ORTEGA-DIAZ D, OLIVARES-RAMIREZ J M, et al. Harvesting energy from real human urine in a photo-microfluidic fuel cell using TiO2–Ni anode electrode[J]. International Journal of Hydrogen Energy, 2021, 46(51): 26163-26173. doi: 10.1016/j.ijhydene.2021.02.148 [65] CLEMENT A C, ANDREW S, IOANNIS I, et al. Urine microbial fuel cells in a semi-controlled environment for onsite urine pre-treatment and electricity production[J]. Journal of Power Sources, 2018, 400: 441-448. doi: 10.1016/j.jpowsour.2018.08.051 [66] HAN C, YUAN X, MA S, et al. Simultaneous recovery of nutrients and power generation from source-separated urine based on bioelectrical coupling with the hydrophobic gas permeable tube system[J]. Science of the Total Environment, 2022, 824: 153788. doi: 10.1016/j.scitotenv.2022.153788 [67] SIDAN L, HONGNA L, GUANGCAI T, et al. Resource recovery microbial fuel cells for urine-containing wastewater treatment without external energy consumption[J]. Chemical Engineering Journal, 2019, 373: 1072-1080. doi: 10.1016/j.cej.2019.05.130 [68] STEFANO F, MADDALENA E L, JULIETTE M, et al. Self-Powered Bioelectrochemical Nutrient Recovery for Fertilizer Generation from Human Urine[J]. Sustainability, 2019, 11(19): 5490. doi: 10.3390/su11195490 [69] WALTER X A, MADRID E, GAJDA I, et al. Microbial fuel cell scale-up options: Performance evaluation of membrane (c-MFC) and membrane-less (s-MFC) systems under different feeding regimes[J]. Journal of Power Sources, 2022, 520: 230875. doi: 10.1016/j.jpowsour.2021.230875 [70] RAMIREZ-NAVA J, MARTINEZ-CASTREJON M, GARCIA-MESINO R L, et al. The implications of membranes used as separators in microbial fuel cells[J]. Membranes(Basel), 2021, 11(10): 738. doi: 10.3390/membranes11100738 [71] SALAR-GARCÍA M J, WALTER X A, GURAUSKIS J, et al. Effect of iron oxide content and microstructural porosity on the performance of ceramic membranes as microbial fuel cell separators[J]. Electrochimica Acta, 2021, 367: 137385. doi: 10.1016/j.electacta.2020.137385 [72] MERINOJIMENEZ I, OBATA O, PASTERNAK G, et al. Effect of microbial fuel cell operation time on the disinfection efficacy of electrochemically synthesised catholyte from urine[J]. Process biochemistry (Barking, London, England), 2021, 101: 294-303. [73] JIMENEZ I M, BRINSON P, GREENMAN J, et al. Electronic faucet powered by low cost ceramic microbial fuel cells treating urine[J]. Journal of Power Sources, 2021, 506(1): 230004. [74] DE RAMON-FERNANDEZ A, SALAR-GARCIA M J, RUIZ F D, et al. Evaluation of artificial neural network algorithms for predicting the effect of the urine flow rate on the power performance of microbial fuel cells[J]. Energy (Oxf), 2020, 213: 118806. doi: 10.1016/j.energy.2020.118806 [75] WALTER X A, SANTORO C, GREENMAN J, et al. Self-stratifying microbial fuel cell: The importance of the cathode electrode immersion height[J]. International Journal of Hydrogen Energy, 2019, 44(9): 4524-4532. doi: 10.1016/j.ijhydene.2018.07.033 [76] GAJDA I, OBATA O, GREENMAN J, et al. Electroosmotically generated disinfectant from urine as a by-product of electricity in microbial fuel cell for the inactivation of pathogenic species[J]. Scientific Reports, 2020, 10(1): 5533. doi: 10.1038/s41598-020-60626-x [77] 周宇, 刘中良, 侯俊先, 等. 石墨烯类材料修饰尿液微生物燃料电池阳极的研究[J]. 化工学报, 2018, 69(6): 2790-2796. [78] ZHOU Y, HOU J X, CHEN W W, et al. Carbon nanotube sponge 3D anodes for urine-powered microbial fuel cell[J]. Energy Sources, Part A:Recovery, Utilization, and Environmental Effects, 2017, 39(14): 1543-1547. doi: 10.1080/15567036.2017.1339220 [79] ZHOU Y, TANG L J, LIU Z L, et al. A novel anode fabricated by three-dimensional printing for use in urine-powered microbial fuel cell[J]. Biochemical Engineering Journal, 2017, 124: 36-43. doi: 10.1016/j.bej.2017.04.012 [80] SALAR-GARCIA M J, MONTILLA F, QUIJADA C, et al. Improving the power performance of urine-fed microbial fuel cells using PEDOT-PSS modified anodes[J]. Applied Energy, 2020, 278: 115528. doi: 10.1016/j.apenergy.2020.115528 [81] THULASINATHAN B,JAYABALAN T,ARUMUGAM N, et al. Wastewater substrates in microbial fuel cell systems for carbon-neutral bioelectricity generation: An overview[J]. Fuel, 2022, 317: 123369. doi: 10.1016/j.fuel.2022.123369 [82] 罗帝洲, 许玫英, 杨永刚. 微生物燃料电池串并联研究及应用[J]. 环境化学, 2020, 39(8): 2227-2236. doi: 10.7524/j.issn.0254-6108.2019052802 [83] WALTER X A, SANTORO C, GREENMAN J, et al. Scaling up self-stratifying supercapacitive microbial fuel cell[J]. Int J Hydrogen Energy, 2020, 45(46): 25240-25248. doi: 10.1016/j.ijhydene.2020.06.070 [84] MERINO-JIMENEZ I, GONZALEZ-JUAREZ F, GREENMAN J, et al. Effect of the ceramic membrane properties on the microbial fuel cell power output and catholyte generation[J]. Journal of Power Sources, 2019, 429: 30-37. doi: 10.1016/j.jpowsour.2019.04.043 [85] VENKATA M S, RAGHUVULU S V, SRIKANTH S, et al. Bioelectricity production by meditorless microbial fuel cell (MFC) under acidophilic condition using wastewater as substrate: influence of substrate loading rate[J]. Current Science, 2007, 92(12): 1720-1726. [86] HIL M F, ABU BAKAR M H. Tubular ceramic performance as separator for microbial fuel cell: A review[J]. International Journal of Hydrogen Energy, 2020, 45(42): 22340-22348. doi: 10.1016/j.ijhydene.2019.08.115 [87] WALTER X A, SANTORO C, GREENMAN J, et al. Scalability and stacking of self-stratifying microbial fuel cells treating urine[J]. Bioelectrochemistry, 2020, 133: 107491. doi: 10.1016/j.bioelechem.2020.107491 [88] YAMANE T,YOSHIDA N,SUGIOKA M, et al. Estimation of total energy requirement for sewage treatment by a microbial fuel cell with a one-meter air-cathode assuming Michaelis-Menten COD degradation[J]. RSC Advances, 2021, 11(33): 20036-20045. doi: 10.1039/d1ra03061b.eCollection2021Jun3 -



 下载:
下载: