-
金属矿产资源采、选、冶炼过程产生的大量废弃尾矿无序堆放是矿区周边环境中重金属的重要来源,对当地居民健康及生态系统构成了潜在威胁[1-2]。贵州兴仁滥木厂汞铊矿是中国西南地区典型的多金属矿山,具有较长的开采历史[2]。虽然采矿活动已经停止了300多年,但遗留下大量的废渣被无序堆放在矿区周边土壤上,这些裸露废渣暴露于自然环境中长期遭受风蚀和水蚀作用,废渣中重金属持续释放、迁移至周边水土环境中,对矿区周边环境造成严重污染[3-5]。植被恢复是减少尾矿堆场遭受水蚀和风蚀的有效策略[4],其中,建立先锋草本植物是恢复尾矿堆场生物地球化学功能的关键环节[5],这是由于先锋草本植物能耐受尾矿中高浓度重金属,有利于尾矿生境条件改善及其它修复植物引进[6]。三叶草(Trifolium repens)是广泛用于改善尾矿堆场环境条件的先锋草本植物[7]。随着尾矿堆场植被演替,先锋草本植物将被其他优势植物所取代,先锋草本凋落物分解可产生大量的溶解性有机质(dissolved organic matter,DOM)[8]。有研究[9-10]表明,DOM是一种活性极强的有机成分,其对植物生长、微生物代谢和重金属迁移转化过程具有重要影响。DOM含有丰富的活性有机官能团(如酚羟基、羧基、羰基等),其通过与土壤重金属发生一系列反应(如离子交换吸附,氧化还原,络合和甲基化),进而影响土壤中重金属的迁移转化过程[11-12]。然而,关于尾矿堆场生态修复过程中先锋草本植物凋落物源DOM对尾矿中重金属迁移转化影响的研究鲜有报道。
贵州兴仁滥木厂汞铊矿历史活动遗留下的废渣成分较复杂,其含有多种对DOM敏感的特征重金属,包括铊(Tl)、汞(Hg)、砷(As)和锑(Sb)等。然而,在废渣堆场生态修复过程中,先锋草本植物凋落物源DOM对废渣特征重金属迁移转化的影响仍尚不明晰。基于此,本研究拟以典型汞铊矿废渣以及三叶草凋落物源DOM为研究对象,通过开展批次培养实验,探究三叶草凋落物源DOM对废渣中特征重金属释放行为的影响,明晰废渣-DOM体系中重金属释放特征的驱动因子,旨在深入理解废渣堆场生态修复过程中先锋草本植物凋落物源DOM对废渣中重金属地球化学行为的影响,以期为开展生态修复的废渣堆场的科学管理提供理论依据。
-
废渣样品采集于贵州省兴仁市滥木厂汞铊矿区的废渣堆场(105º30′32″ E, 25º31′32″ N)。废渣中Tl、Hg、As和Sb的含量分别为209.63、46.22、85.75和9.01 mg·kg−1[3]。通过XPS表征可知,废渣中Hg、As、Sb和Tl的价态主要分别为Hg2+、As5+、Sb3+和Tl3+。采集的废渣样品经自然风干后,过2 mm筛,备用。于贵州大学校园内未受污染的土壤上采集三叶草凋落物,用去离子水冲洗后,70 °C干燥。根据MCLEOD报道的方法[13]提取三叶草凋落物的DOM,并做了适当的修改。修改后的三叶草凋落物源DOM提取步骤为:将50 g三叶草凋落物样品(<4 cm2)置于锥形瓶中,加入1 L去离子水,于25 °C的水平摇床中振荡24 h。提取的DOM溶液先经250 μm筛网预过滤,再用0.45 μm微孔膜过滤后用棕色瓶保存于4 °C冰箱,备用。DOM溶液的pH、氧化还原电位(Eh)、电导率(electrical conductivity,EC)和溶解性有机碳(dissolved organic carbon,DOC)含量分别为5.24、116 mV、1 527 μS·cm−1和1 311.83 mg·L−1。
-
将40 g废渣装入500 mL聚乙烯塑料瓶中,加入不同体积的DOM溶液(0、20、40、60、80 mL)。按固液比1:10加入相应体积的去离子水。根据DOM与去离子水的体积比,得到不同DOM浓度梯度(0%、5%、10%、15%、20%),其中0%的处理组作为CK处理组。共设计5个处理组,每个处理组3个平行。废渣和DOM的混合物在(25±1) °C的黑暗条件下培养40 d,分别在0、10、40 d分批次采集废渣浸出液和废渣样品。用0.45 μm滤膜过滤废渣浸出液,并测定其理化性质和重金属含量。废渣样品冷冻干燥后进行红外光谱表征。
-
废渣浸出液中pH、Eh和EC均采用电极法测定;废渣浸出液中硫酸根(SO42−)含量采用铬酸钡分光光度法(HJ/T 342-2007)测定。废渣浸出液中Tl采用石墨炉原子吸收光谱仪(普析TAS-990,北京)测定;废渣浸出液中Hg、As和Sb采用原子荧光光谱仪(海光AFS-8510,北京)测定。废渣浸出液中Hg(Ⅱ)采用冷原子吸收测汞仪(华光F732-Vj,上海)测定;废渣浸出液中As(Ⅲ)采用原子荧光光谱仪(海光AFS-8510,北京)测定。废渣浸出液中DOC含量和采用总有机碳分析仪(元析TOC-2000,上海)测定。
-
废渣浸出液中DOM组分采用三维荧光分光光度计分析(港东F-380A,天津)。具体步骤如下:配备1 cm石英比色皿,扫描速度为3 000 nm·min−1,激发扫描区域为200~500 nm,发射扫描区域为200~550 nm,激发带宽和发射带宽均设置为5 nm。根据STEDMON和BRO的方法[14],将测得数据集使用MATLAB R2020b(Mathworks, Natick, MA, USA)中的DOMFluor工具箱进行平行因子(PARAFAC)分析。
-
废渣样品经冷冻干燥并研磨过200目筛后,取适量粉末样品利用X射线衍射仪(PANalytical X'Pert PRO,荷兰)分析废渣的主要矿物相。测试条件为:铜靶配镍滤光片,扫描角度为10°~80°,扫描速度为2°·min−1。采用X 射线光电子能谱仪 (XPS) (Thermo Scientific K-Alpha,美国)分析废渣特征重金属(Hg、As、Sb和Tl)的价态特征,以C1s在结合能284.80 eV进行校正。
-
废渣及其浸出液DOM样品的官能团组成均采用傅里叶变换红外光谱仪(Fourier Transform Infrared Spectrometer)(港东FTIR-850,天津)分析。将冷冻干燥后的样品与溴化钾(KBr)均匀混合,充分研磨后,用压片机进行压片,用FTIR分析样品的红外光谱特征。FTIR的扫描范围为400~4 000 cm−1,每个样品经过16次扫描获得光谱。每个样本的光谱均经过背景校正,以减少环境干扰。
-
所有样品的测试数据均进行3次重复分析,并使用标准物质进行质量控制。所有结果均以平均值±标准差(SD)表示。所有数据的相对标准偏差(RSD)均小于10%。采用Excel 2019和SPSS 25.0软件对实验数据进行处理和统计分析。采用单因素方差分析(one-way ANOVA)分析不同处理间的显著性差异(P<0.05)。使用Origin 2021 Pro软件进行绘图。
-
不同处理组的废渣矿物相特征如图1所示。废渣的矿物组成主要为石英(Quartz)、高岭石(Kaolinite)、黄钾铁矾(Jarosite)和锐钛矿(Anatase)。其中,石英为主要矿物,其次为高岭石,还有少量硫酸盐矿物存在。废渣中存在黄钾铁矾矿物,说明不同处理组的废渣发生了不同程度的氧化。在不同培养时间下,不同含量DOM处理废渣与对照组(CK)的矿物组成几乎一致,说明DOM处理下废渣中矿物特征吸收峰无明显变化,即无新的矿物形成。这可能是由于废渣中的原生矿物较为稳定,不同浓度DOM在短时间内对废渣中的矿物组成无明显影响。
-
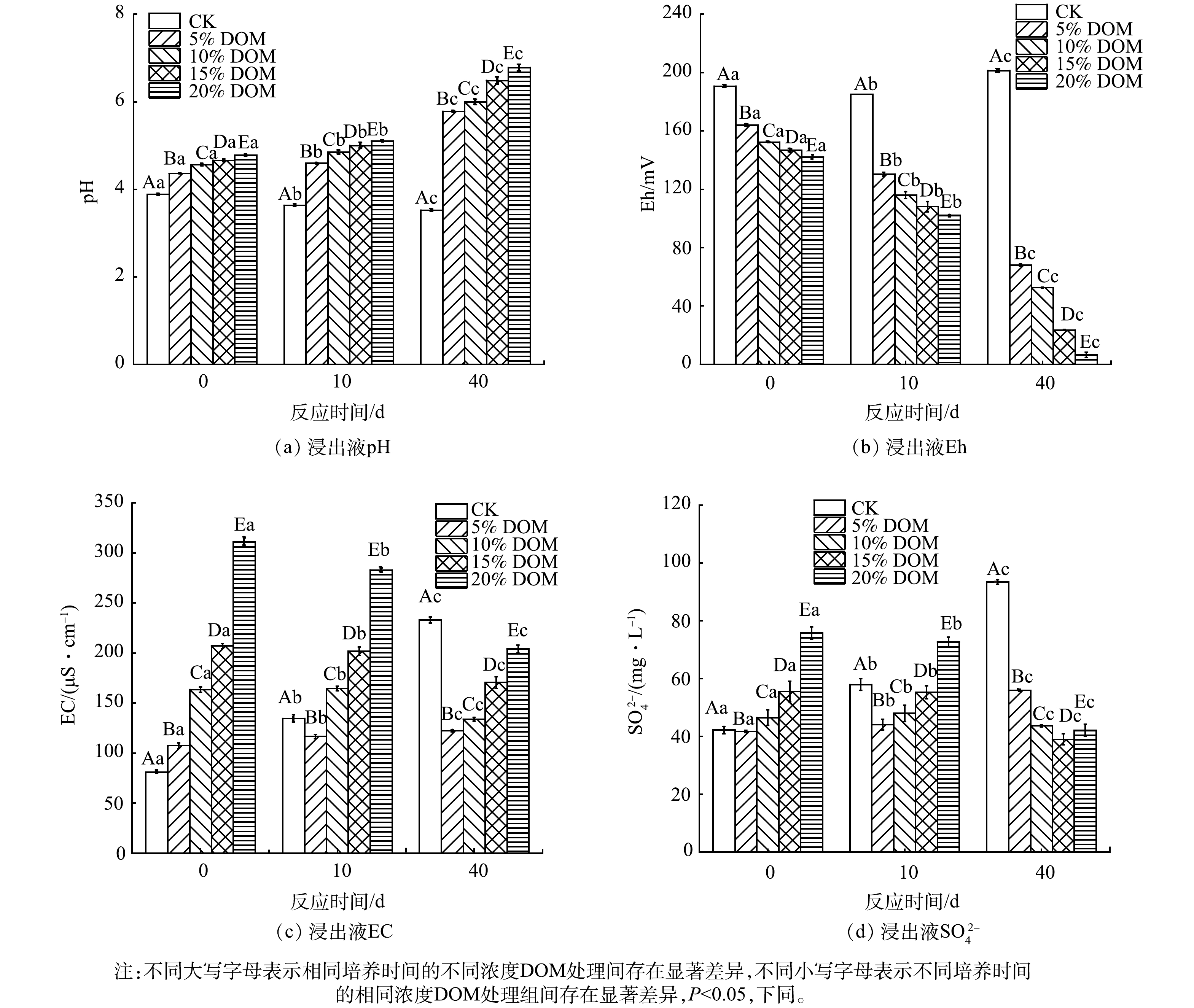
不同处理条件下废渣浸出液的理化性质的变化特征如图2所示。CK组中废渣浸出液EC、Eh和SO42−含量随着培养时间的增加而增加,而pH呈相反的变化趋势。这表明废渣中硫化物矿物与氧和水反应释放大量的SO42−、H+[3-4]。此外,废渣中含有少量的硫酸盐矿物可被水直接溶解,并释放出SO42−。与CK组相比,废渣浸出液中pH和EC随DOM添加量的增加而增加,而Eh则呈相反的变化趋势。此外,随着培养时间的增加,DOM处理组中pH也逐渐增加。导致这种现象可能的原因归为以下3点:1)不同添加量的DOM自身含有较高的pH,在一定程度上可缓冲废渣氧化产生的H+[15];2) DOM添加有助于反应体系中还原环境的建立,可抑制或减缓S和Fe氧化细菌的增殖及其对废渣的氧化作用,从而导致pH增加[16];3)反应体系的Eh极低,硫酸盐还原菌利用DOM作为碳源,将SO42−还原为S2−,同时产生HCO3−增加反应体系的浸出液的pH[17]。DOM添加可有效降低浸出液的Eh。这可能是由于废渣中的微生物代谢活动消耗反应体系中的氧气,从而导致Eh降低[17],使得反应体系由好氧环境逐渐向厌氧环境转变[18]。DOM处理组中废渣浸出液EC增加,其原因可能归因于以下2点: DOM本身含有丰富的离子;DOM具有较强的螯合、络合能力,可促进废渣中的离子解吸[19]。由不同处理条件下废渣浸出液理化性质的变化特征可知,培养时间是显著影响DOM处理废渣浸出液中pH、EC、Eh和SO42−变化特征的重要因素。
-
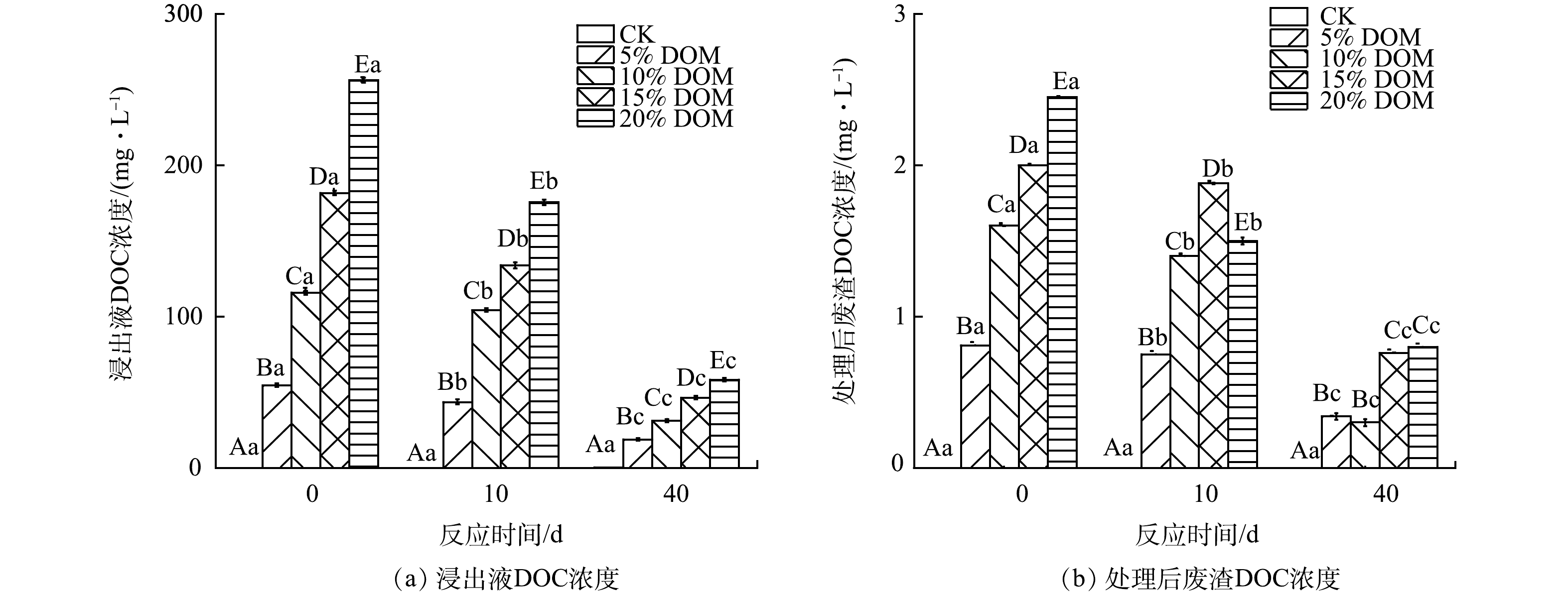
废渣浸出液中DOC含量的变化特征如图3(a)所示。有研究[20]表明,DOC含量可用于量化DOM的含量。在CK处理组中,废渣浸出液的DOC含量始终未检出,表明废渣中有机物含量极低,这与前人的研究结果一致[2]。DOM处理组中废渣浸出液DOC含量明显高于CK处理组,并且随着DOM添加量的增加而增加。然而,DOM处理组中废渣浸出液的DOC含量随着培养时间的增加而降低。这可能是因为DOM含有大量的官能团,其可提供更多的电子受体和电子供体的结合位点[21],其与重金属和矿物相间的络合或吸附反应导致DOC的含量降低[22],不同DOM处理废渣中的DOC明显高于对照废渣(图3(b))可证实废渣对DOM的吸附作用。此外,微生物对DOM的降解作用也是造成浸出液中DOC含量降低的另外一个重要原因[23]。综上所述,DOM与废渣矿物的吸附/共沉淀以及微生物降解的协同作用促使反应体系中DOC含量的降低[24]。
-
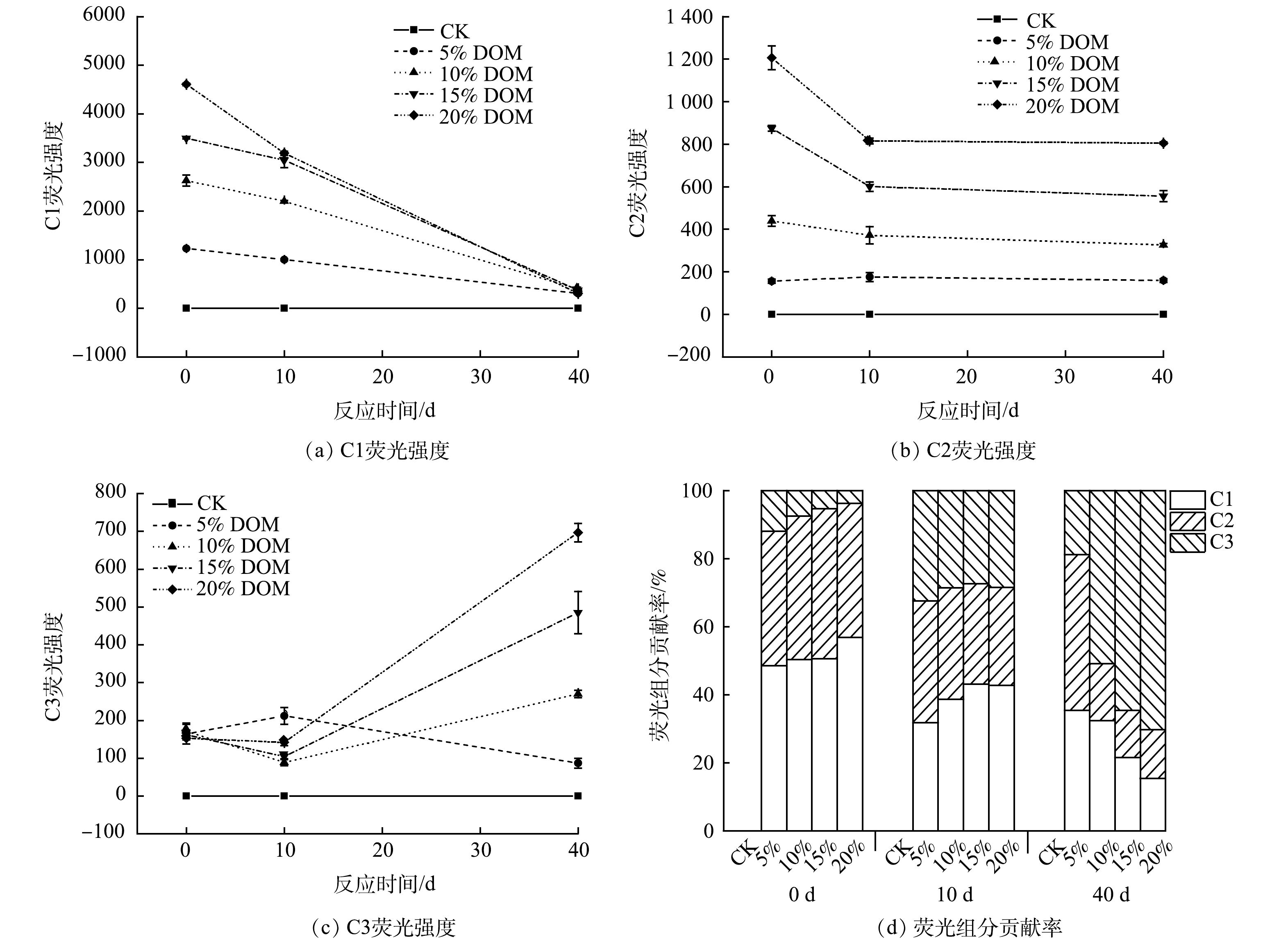
不同处理条件下,废渣浸出液中DOM的组分变化特征如图4所示。DOM主要包含一种蛋白类物质(C1)和2种腐殖质类物质(C2和C3)。组分1(C1)位于Ex/Em=208 nm/305 nm,属于类络氨酸物质[25];组分2(C2)在Ex/Em=325 nm/425 nm处有1个最大的荧光峰,与陆生类腐殖质物质有关[26];组分3(C3)在Ex/Em=395 nm/467 nm处有1个主峰,在Ex/Em=270 nm/467 nm处有1个次级峰,主峰的荧光强度远高于次级峰,其荧光峰属于微生物类腐殖质物质[27]。
通过最大荧光值(Fmax)可分析DOM的结构变化情况(图5)。CK处理组中未出现荧光强度,这与废渣浸出液中较低的DOC含量的结果一致。C1和C2的Fmax随着DOM添加量的增加而增加,并且随着培养时间的增加而降低。然而,C3的Fmax随着培养时间的增加而增加。一方面这可能是由于C1和C2在微生物的作用下降解而造成的;另一方面可能是由于废渣在长时间的浸泡下难溶性有机质逐渐被溶解释放。其中C1的Fmax的降低速率明显大于C2的Fmax。研究表明,类蛋白物质比类腐殖物质具有更高的敏感度和更快的降解速率[28]。由三种不同DOM组分对Fmax的贡献率可知(图5(d))。在培养初期(0 d),各组分间的占比依次表现为C1>C2>C3,这说明DOM主要包含了C1和C2两种组分。随着培养时间的增加,C3的占比逐渐增加。在实验结束时(40 d),C3在反应体系中占据主导地位,这说明在第40天时反应体系中微生物的代谢活动较活跃。
-
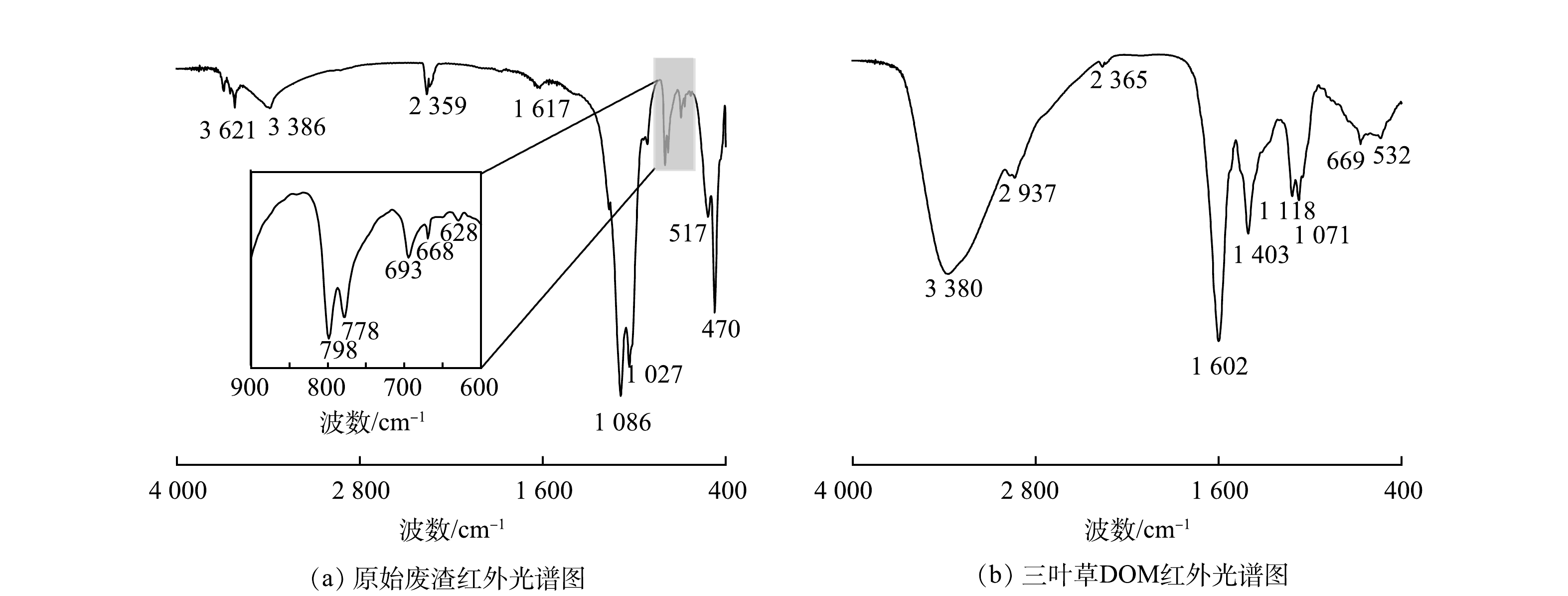
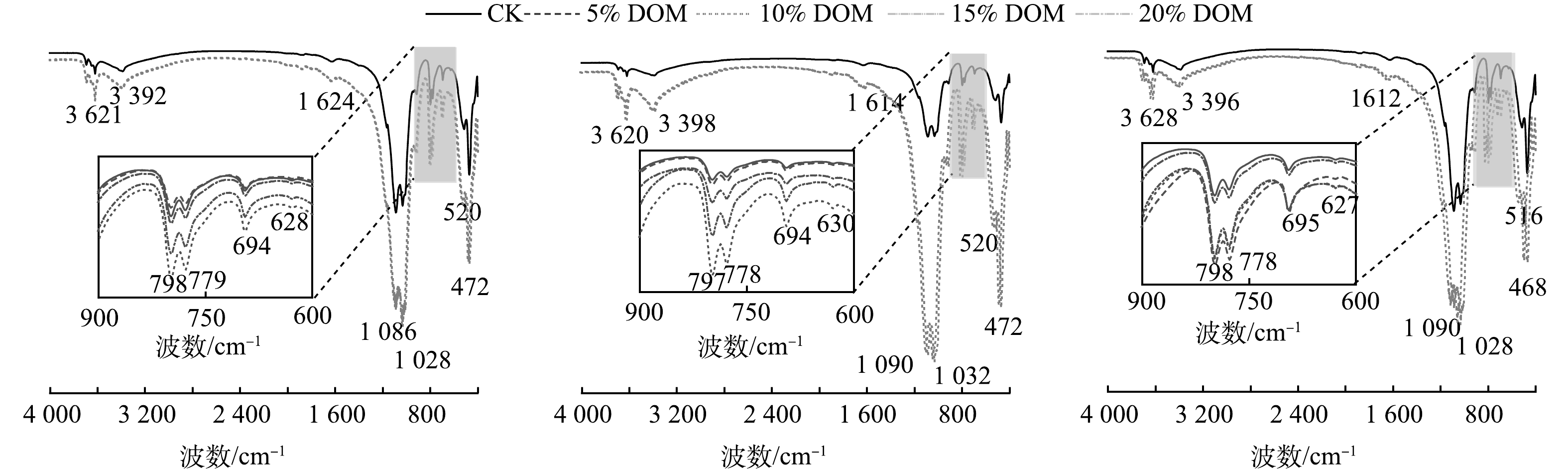
原始废渣和DOM溶液的FTIR光谱特征如图6所示。如图6(a)所示,废渣的吸收带主要集中在470~1 086 cm−1。位于669 cm−1/694 cm−1、778 cm−1/796 cm−1和1 027 cm−1/1 086 cm−1处的吸收峰归属为不对称Si—O弯曲振动,其主要是由于石英(SiO2)为废渣的主要矿物,故上述特征吸收峰为Si—O的特征吸收峰[29-30]。位于1 617、3 386和3 621cm−1附近的吸收峰被分配给了与水分子有关的—OH拉伸振动[31]。在2 359 cm−1附近的吸收峰与N—H拉伸或C=O的拉伸振动有关[32]。由图6(b)可知,DOM溶液与废渣出现了类似的特征吸收峰,主要表现在532、669、1 071、1 118、1 602、2 365、3 380 cm−1附近。相比于废渣官能团,DOM溶液中明显减少了与Si—O有关的吸收峰。此外,DOM溶液中还出现了约在2 949 cm−1和1 407 cm−1的特征吸收峰,其分别归属于CH3的对称振动带和COO−1基团的拉伸振动[33-34]。综上所述,DOM溶液比原始废渣具有更多的有机官能团。
DOM处理后废渣的官能团的变化特征如图7所示。在不同培养时间,不同添加量的DOM处理组中废渣的官能团发生了细微的改变。在0、10、40 d中,观察到废渣中位于2 359 cm−1处的吸收峰消失,表明N—H或C=O与重金属发生络合作用或离子交换效应[3]。DOM处理组中废渣的吸收峰强度高于CK处理组。这可能是由于官能团间发生叠加作用。值得注意的是,DOM处理后废渣中并未发现CH3和COO−官能团,这说明CH3和COO−官能团与重金属主要在液相中发生反应。
-
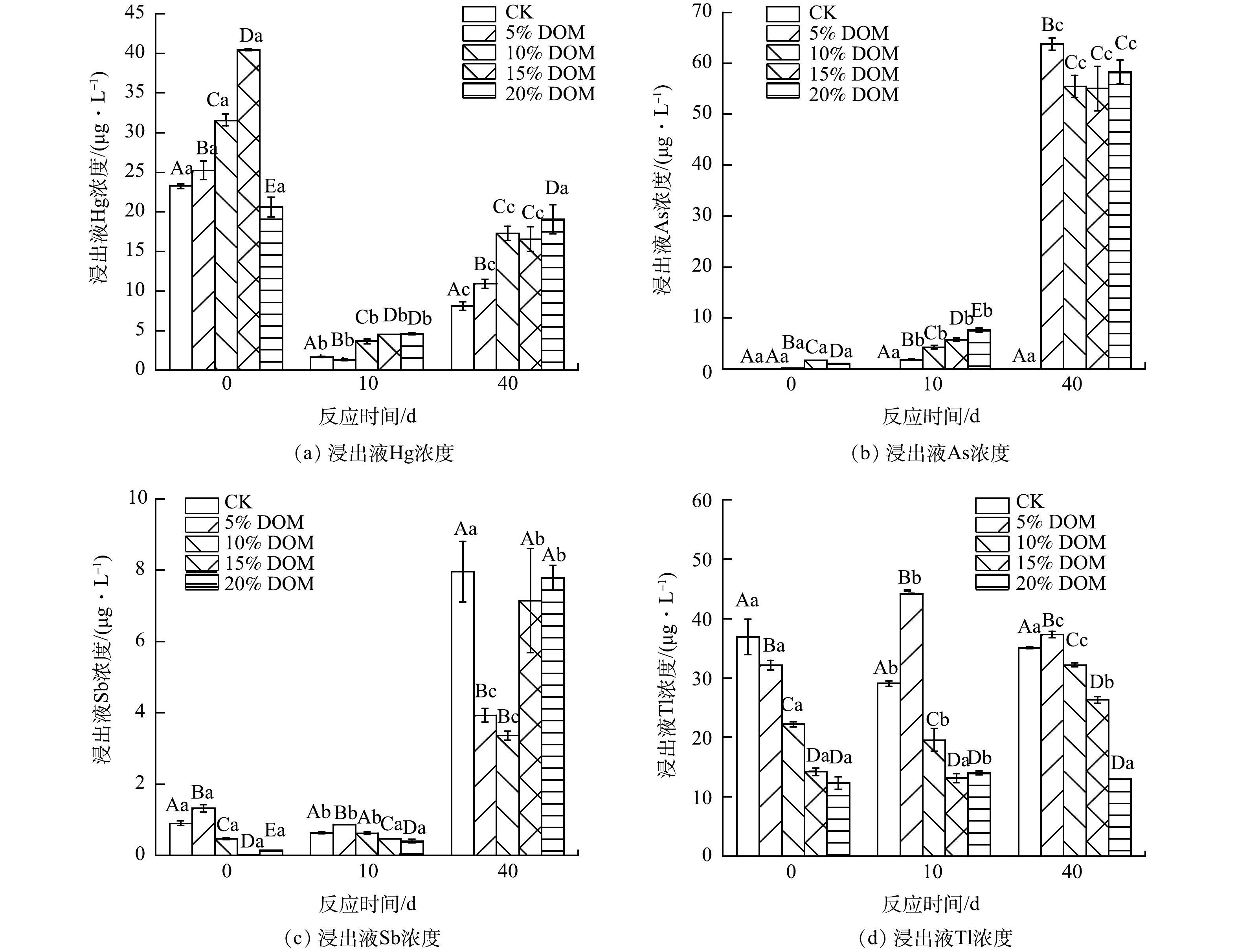
废渣中重金属的释放特征如图8所示。DOM处理组中废渣浸出液Hg含量高于CK处理组,并且随着DOM添加量的增加而增加。在不同处理条件下,废渣浸出液中Hg含量随着培养时间的增加呈现出先降后升的变化趋势(图8(a))。其原因可能是DOM中的官能团(如羟基)可作为废渣矿物的表面活性位点,其可通过络合和沉淀作用进而降低浸出液中Hg的含量[35]。然而,随着培养时间增加,DOM浓度逐渐降低,有机官能团的数量减少,导致废渣矿物吸附的Hg再次被释放。
高浓度DOM(10%、15%和20%)处理组中废渣浸出液Tl含量均低于CK处理组(图8(b))。ANTIC-MLADENOVIC等研究[36]表明,高Eh可增强Tl的移动。然而,本研究表明,添加DOM可降低废渣浸出液的Eh,并抑制Tl的移动。其原因可能是废渣浸出液中的Tl以胶体颗粒的形式存在,可与DOM结合形成配合物,降低游离的Tl离子含量[37]。
CK处理废渣浸出液中As含量低于DOM处理组废渣浸出液,且DOM处理废渣浸出液中As含量随着培养时间的增加而增加(图8(c))。CK处理组废渣中As含量较低的原因是废渣中含有丰富的铁矿物[38],铁矿物的氧化和水化可能会抑制废渣中As的释放[39]。此外,CK处理组废渣浸出液呈酸性(pH较低),酸性条件下矿物表面对As固定能力较强,与部分金属离子形成复杂的难溶性砷化物,从而导致水溶性As含量降低[40]。随着DOM处理组废渣浸出液pH的增加,浸出液中OH−离子逐渐增多,OH−离子就会与砷酸根离子竞争吸附点位,从而使As的吸附能力减弱。因此,DOM的添加促进废渣中As的释放。有研究[41]表明,DOM对As有很强的亲和力,DOM可通过还原溶解和配体交换作用促进铁矿物中吸附的As的迁移[42]。DEONARINE等[43]发现,氧化还原条件和DOM都影响As的迁移,但氧化还原条件对As迁移的影响作用较DOM更大。
不同处理组废渣浸出液中的Sb含量在0、10 d无明显变化,直到40 d时废渣浸出液中Sb含量最高,且DOM处理废渣浸出液中Sb含量低于CK处理(图8(d))。有研究[44]表明,As和Sb具有相似的地球化学行为,其对类腐殖质物质具有较强的亲和力。随着培养时间的增加,类蛋白质物质和类腐殖质物质含量及其提供的吸附点位的减少,是第40天废渣浸出液Sb含量最高的主要原因。
综上所述,不同含量DOM处理组中废渣重金属表现出不同的释放特征。这可能是废渣矿物的晶体结构、化学组成和表面基团的多样性决定了矿物界面重金属反应的复杂性和多样性[11,45]。此外,LIONS等[46]发现,不同重金属的释放特征还取决于他们不同的电子强度。另外,废渣中重金属的释放特征还与培养时间和DOM添加量等因素密切相关。
-
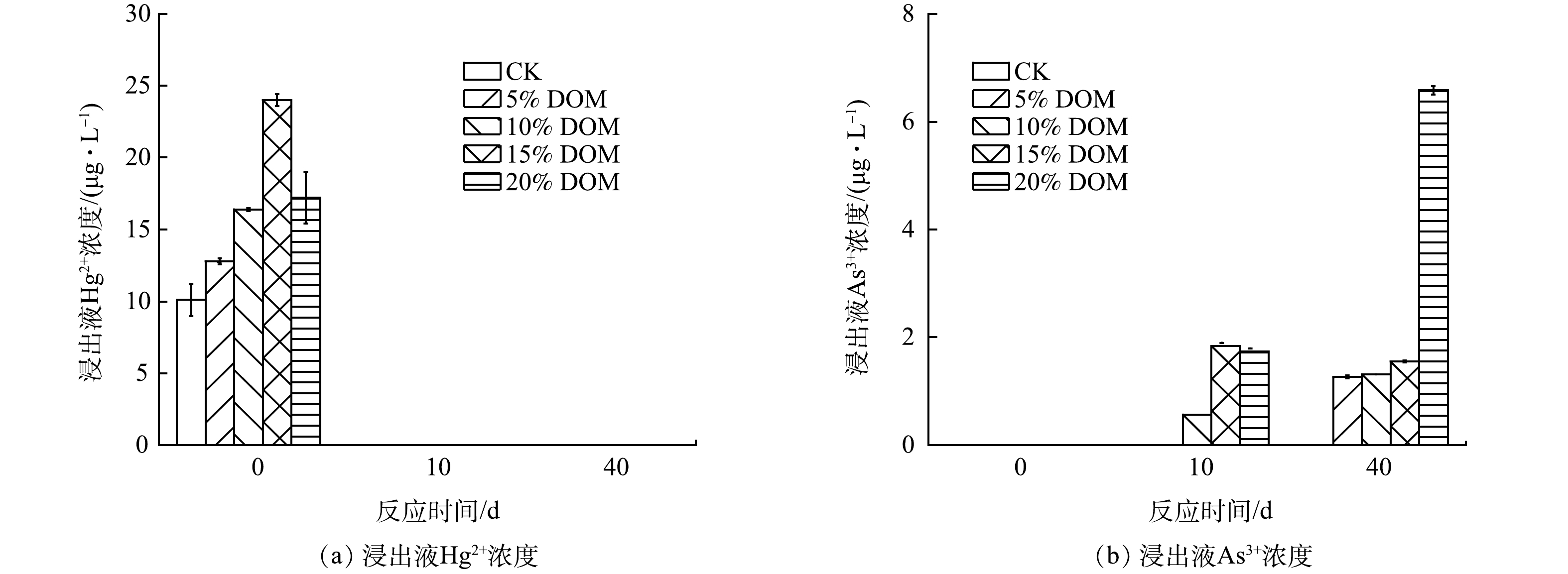
废渣浸出液中仅有Hg和As的价态检出,在此仅分析Hg和As价态的变化特征。废渣浸出液Hg和As的价态变化特征如图9所示。在0 d时,不同处理组废渣浸出液中Hg(Ⅱ)的浓度表现为DOM处理组高于CK组,最大浸出含量为24.00 μg·L−1,并且浸出液中Hg(Ⅱ)浓度占据总Hg浓度的36.63%,其他汞的形态可能为甲基汞和颗粒态汞。因为有研究[47]表明DOM可增加尾矿浸出液中颗粒态汞含量并促进汞的甲基化。然而,在10 d和40 d时,废渣浸出液中Hg(Ⅱ)未检出(图9(a))。在CK处理组中,浸出液中Hg(Ⅱ)未检出的原因可能是随着反应体系的稳定,反应体系中发生的吸附和沉淀反应导致Hg(Ⅱ)被废渣中的硫化物矿物表面固定。有研究表明,Hg(Ⅱ)会被迅速的吸附到硫化矿物表面,形成黑辰砂、朱砂、汞铁硫化物[48]。RANDALL等[49]研究表明,在氧化环境条件下,Hg0会被氧化成Hg(Ⅱ),并且伴随着硫酸盐还原菌的存在,Hg(Ⅱ)又可与S2−迅速结合形成HgS,从而降低其迁移性。DOM处理组中Hg(Ⅱ)未检出的原因可能归为以下2点:一是废渣中硫化物矿物表面的固定(同CK处理组);二是DOM处理组中的Eh极低(图2(b)),呈还原环境,反应体系中的硫酸盐还原菌将浸出液中的部分SO42−还原为S2−(图2(d),SO42−含量降低),其与Hg(Ⅱ) 结合形成HgS,进而降低Hg(Ⅱ)含量。浸出液中总Hg含量在第10和40 d降低(图8(a))也说明反应体系中发生了吸附反应。
废渣浸出液中As(Ⅲ)的浓度与总As的浓度具有相似的变化规律,其浓度变化总体上表现为随着培养时间的增加而增加。值得注意的是,CK处理组中废渣浸出液中As(Ⅲ)未检出,这可能是废渣与水和空气接触发生氧化反应,As(Ⅲ)被迅速转化为As(Ⅴ)。XPS的分析结果也表明废渣中As主要以As(Ⅴ)为主。然而,在40 d时,DOM处理组(20%)废渣浸出液中As(Ⅲ)的浓度最高,达6.58 μg·L−1(图9(b))。DOM浓度越高,废渣浸出液中As(Ⅲ)浓度越高,其主要原因可能是DOM添加促进废渣浸出液的Eh降低,有利于As(Ⅴ)还原为As(Ⅴ)。随着培养时间的增加,DOM处理组中废渣浸出液Eh越低(图2(b)),越有利于As(Ⅴ)还原为As(Ⅲ)。通过与总As含量对比,尽管DOM添加有利于As(Ⅴ)还原为As(Ⅲ),但反应体系中As(Ⅴ)仍占据绝对优势。
-
废渣浸出液的环境因子与重金属含量间的主成分分析结果如图10(a)所示,第1主成分和第2主成分解释的方差分别为38.0%和35.7%,共解释总方差的73.7%。其中DOC、EC、Fmax(C2)和Fmax(C1)在第1主成分上载荷较大,pH、Fmax(C3)、As和Sb在第2主成分上载荷较大。这说明DOM添加量决定其DOC含量、组分大小及EC,pH与废渣As和Sb的释放特征更为密切。此外,As和Sb被划分为同一象限,表明他们具有相似的地球化学性质及其变化规律。利用Spearman相关性分析进一步探究废渣浸出液环境因子对废渣重金属释放特征的影响,结果如图10(b)所示。可见,pH与Eh、Tl呈显著负相关,与Fmax(C2)、Fmax(C3)、As呈显著正相关,表明pH是影响DOM性质和重金属释放特征的重要因素。As与Fmax(C2)、Fmax (C3)呈显著正相关,说明As与腐殖质类物质的络合能力强于蛋白质类物质。SO42−与pH、Tl、As、Sb呈负相关,而与Eh呈正相关,表明重金属的释放与废渣中硫化物矿物的氧化溶解有关。DOC与Fmax(C1)、Fmax(C2)、Fmax(C3)呈显著正相关,说明C1、C2、C3与DOM浓度的关系更为密切。Hg与DOC、Fmax(C1)、Fmax(C2)、Fmax(C3)呈正相关,表明DOM中的腐殖质类物质对Hg具有络合能力[50]。Tl、Sb与DOC、Fmax(C1)、Fmax(C2)呈显著负相关。上述结果表明,DOM添加可促进废渣Hg和As的释放,但抑制废渣Tl和Sb的释放。DOM的自身组分及其对环境条件(pH、Eh)的改变是影响废渣重金属释放特征的主要因素。
-
1)废渣的矿物组成以石英为主,还含有少量的硫化矿物和硫酸盐矿物,DOM处理对废渣矿物相的影响较小。
2) CK处理组中的废渣具有连续氧化特性,浸出液中Eh、EC、SO42−含量随着培养时间的增加而增加,浸出液中pH、Hg、Tl含量随着培养时间的增加而降低。与CK处理相比,DOM添加可促进废渣中Hg和As的释放,抑制废渣中Tl和Sb的释放。浸出液中重金属的浓度为As>Tl>Hg>Sb。DOM添加有利于废渣中Hg(Ⅱ)溶出,促进废渣中As(Ⅴ)还原为As(Ⅲ)。
3) DOM的成分主要为类络氨酸、陆生类腐殖质和微生物类腐殖质物质。主成分和相关分析结果表明,pH、Eh、DOC含量和DOM成分是影响废渣重金属释放特征的主要因素。
先锋草本植物凋落物源溶解性有机质对典型汞铊矿废渣中重金属释放特征的影响
Effects of dissolved organic matter from pioneer herb plant on the release characteristics of heavy metals in a typical mercury-thallium mining waste slag
-
摘要: 先锋草本植物广泛应用于尾矿堆场生态恢复,其凋落物分解是尾矿中溶解性有机质(DOM)的重要来源。然而,先锋草本植物凋落物源DOM对尾矿中重金属释放特征的影响尚不清晰。本研究以典型汞铊矿废渣及三叶草凋落物为研究对象,通过开展批次培养实验探讨了三叶草凋落物源DOM对废渣中重金属(Hg、As、Sb、Tl)释放特征的影响。结果表明,三叶草凋落物源DOM的成分主要为类络氨酸类物质、陆生类腐殖质物质和微生物类腐殖质物质。DOM的添加明显促进废渣中Hg和As的释放,抑制Tl和Sb的释放,浸出液中重金属的浓度依次为As>Tl>Hg>Sb。DOM的添加有利于废渣中Hg(Ⅱ)的溶出,促进废渣中As(Ⅴ)还原为As(Ⅲ)。主成分和相关性分析结果表明,DOM的自身组分及其对环境条件(pH、Eh)的改变是影响废渣重金属释放特征的主要因素。以上研究结果可为深入认识开展生态修复的废渣堆场上重金属的地球化学过程及环境风险提供参考。Abstract: Pioneer herbs are widely used for the ecological restoration of mine tailing sites, and their litter decomposition is an important source of dissolved organic matter (DOM) in the mine tailings. However, the effect of DOM derived from pioneer herb litter on the migration and transformation of heavy metals in the mine tailings remains unclear. In this study, the typical mercury-thallium mining waste slag and litter of Trifolium repens were used as research objects. The batch culture experiments were conducted to investigate the effects of DOM derived from the litter of Trifolium repens on the release characteristics of heavy metals (Hg, As, Sb, and Tl) in the waste slag. The results showed that the main components of DOM were tyrosinoid-like substances, terrestrial humus-like substances, and microbial humus-like substances. DOM addition significantly promoted the release of Hg and As, but inhibited the release of Tl and Sb in the waste slag, and the heavy metal concentrations in the leachate exhibited the following order: As>Tl>Hg>Sb. DOM addition facilitated the release of Hg(Ⅱ) and the reduction of As(Ⅴ) to As(Ⅲ) in the waste slag. Principal component and correlation analysis indicated that DOM components and the corresponding changes in environmental conditions (e.g., pH and Eh) were the main factors affecting the release characteristics of heavy metals in the waste slag. The results can provide a theoretical basis for understanding the geochemical processes and environmental risks of heavy metals in the waste slag sites undergoing the ecological restoration.
-

-
-
[1] SUN R, GAO Y, Yang Y. Leaching of heavy metals from lead-zinc mine tailings and the subsequent migration and transformation characteristics in paddy soil[J]. Chemosphere, 2022, 291: 132792. doi: 10.1016/j.chemosphere.2021.132792 [2] XIAO T, GUHA J, BOYLE D, et al. Environmental concerns related to high thallium levels in soils and thallium uptake by plants in southwest Guizhou, China[J]. Science of the Total Environment, 2004, 318(1-3): 223-244. doi: 10.1016/S0048-9697(03)00448-0 [3] WEN J, WU Y, LI X, et al. Migration characteristics of heavy metals in the weathering process of exposed argillaceous sandstone in a mercury-thallium mining area[J]. Ecotoxicology and Environmental Safety, 2021, 208: 111751. doi: 10.1016/j.ecoenv.2020.111751 [4] WEI Z, HAO Z, LI X, et al. The effects of phytoremediation on soil bacterial communities in an abandoned mine site of rare earth elements[J]. Science of the Total Environment, 2019, 670: 950-960. doi: 10.1016/j.scitotenv.2019.03.118 [5] SUN X, ZHOU Y, TAN Y, et al. Restoration with pioneer plants changes soil properties and remodels the diversity and structure of bacterial communities in rhizosphere and bulk soil of copper mine tailings in Jiangxi Province, China[J]. Environmental Science and Pollution Research, 2018, 25: 22106-22119. doi: 10.1007/s11356-018-2244-3 [6] LUO Y, WU Y, WANG H, et al. Bacterial community structure and diversity responses to the direct revegetation of an artisanal zinc smelting slag after 5 years[J]. Environmental Science and Pollution Research, 2018, 25: 14773-14788. doi: 10.1007/s11356-018-1573-6 [7] LUO Y, WU Y, XING R, et al. Effects of plant litter decomposition on chemical and microbiological characteristics of artisanal zinc smelting slag using indigenous methods[J]. Journal of Geochemical Exploration, 2018, 190: 292-301. doi: 10.1016/j.gexplo.2018.03.019 [8] JIA T, WANG X, GUO T, et al. Litter Decomposition of Imperata cylindrica in a copper tailing areas with different restoration history: fungal community dynamics and driving factors[J]. Frontiers in Microbiology, 2021: 3466. [9] LAN J, ZHANG S, DONG Y, et al. Stabilization and passivation of multiple heavy metals in soil facilitating by pinecone-based biochar: Mechanisms and microbial community evolution[J]. Journal of Hazardous Materials, 2021, 420: 126588. doi: 10.1016/j.jhazmat.2021.126588 [10] SUI M, LI Y, JIANG Y, et al. Sediment-based biochar facilitates highly efficient nitrate removal: physicochemical properties, biological responses and potential mechanism[J]. Chemical Engineering Journal, 2021, 405: 126645. doi: 10.1016/j.cej.2020.126645 [11] LI Y, GONG X, XIONG J, et al. Different dissolved organic matters regulate the bioavailability of heavy metals and rhizosphere microbial activity in a plant-wetland soil system[J]. Journal of Environmental Chemical Engineering, 2021, 9(6): 106823. [12] BOLAN N S, ADRIANO D C, KUNHIKRISHNAN A, et al. Dissolved organic matter: biogeochemistry, dynamics, and environmental significance in soils[J]. Advances in Agronomy, 2011, 110: 1-75. [13] MCLEOD M L, BULLINGTON L, CLEVELAND C C, et al. Invasive plant-derived dissolved organic matter alters microbial communities and carbon cycling in soils[J]. Soil Biology and Biochemistry, 2021, 156: 108191. doi: 10.1016/j.soilbio.2021.108191 [14] STEMDMON C A, BRO R. Characterizing dissolved organic matter fluorescence with parallel factor analysis: a tutorial[J]. Limnology and Oceanography:Methods, 2008, 6(11): 572-579. doi: 10.4319/lom.2008.6.572 [15] LUO Y, WU Y, FU T, et al. Effects of a proline solution cover on the geochemical and mineralogical characteristics of high-sulfur coal gangue[J]. Acta Geochimica, 2018, 37: 701-714. doi: 10.1007/s11631-018-0260-0 [16] TAPIA A, CORNEJO-LA TORRE M, SANTOS E S, et al. Improvement of chemical quality of percolated leachates by in situ application of aqueous organic wastes on sulfide mine tailings[J]. Journal of Environmental Management, 2019, 244: 154-160. [17] RAKOTONIMARO T V, GUITTONY M, NECULITA C M. Compaction of peat cover over desulfurized gold mine tailings changes: Arsenic speciation and mobility[J]. Applied Geochemistry, 2021, 128: 104923. doi: 10.1016/j.apgeochem.2021.104923 [18] XIA X, TENG Y, ZHAI Y. Influence of DOM and microbes on Fe biogeochemistry at a riverbank filtration site[J]. Environmental Research, 2023, 216: 114430. doi: 10.1016/j.envres.2022.114430 [19] 陈春羽. DOM对土壤和底泥汞吸附解吸行为的影响[D]. 重庆: 西南大学, 2008. [20] VENEGAS A, RIGOL A, VIDAL M. Changes in heavy metal extractability from contaminated soils remediated with organic waste or biochar[J]. Geoderma, 2016, 279: 132-140. doi: 10.1016/j.geoderma.2016.06.010 [21] GU L, HUANG B, XU Z, et al. Dissolved organic matter as a terminal electron acceptor in the microbial oxidation of steroid estrogen[J]. Environmental Pollution, 2016, 218: 26-33. doi: 10.1016/j.envpol.2016.08.028 [22] JIA L, WU W, ZHANG J, et al. Insight into heavy metals (Cr and Pb) complexation by dissolved organic matters from biochar: Impact of zero-valent iron[J]. Science of the Total Environment, 2021, 793: 148469. doi: 10.1016/j.scitotenv.2021.148469 [23] SHAN G, XU J, JIANG Z, et al. The transformation of different dissolved organic matter subfractions and distribution of heavy metals during food waste and sugarcane leaves co-composting[J]. Waste Management, 2019, 87: 636-644. doi: 10.1016/j.wasman.2019.03.005 [24] COWARD E K, OHNO T, PLANTE A F. Adsorption and molecular fractionation of dissolved organic matter on iron-bearing mineral matrices of varying crystallinity[J]. Environmental Science & Technology, 2018, 52(3): 1036-1044. [25] 杜尔登, 郭迎庆, 孙悦, 等. 三维荧光结合自组织映射神经网络考察自来水厂有机物去除效果[J]. 光谱学与光谱分析, 2012, 32(7): 1846-1851. doi: 10.3964/j.issn.1000-0593(2012)07-1846-06 [26] GUO X, XIE X, LIU Y, et al. Effects of digestate DOM on chemical behavior of soil heavy metals in an abandoned copper mining areas[J]. Journal of Hazardous Materials, 2020, 393: 122436. doi: 10.1016/j.jhazmat.2020.122436 [27] ISHII STEPHANIE K L, TREAVOR B. H. Behavior of reoccurring PARAFAC components in fluorescent dissolved organic matter in natural and engineered systems: A critical review[J]. Environmental Science & Technology, 2012, 46: 2006-2017. [28] 任浩宇, 姚昕, 马飞扬. 细菌降解影响下湖泊草源DOM与重金属的相互作用[J]. 中国环境科学, 2020, 40(11): 4989-4997. doi: 10.3969/j.issn.1000-6923.2020.11.041 [29] KHANG V C, KOROVKIN M V, ANANYEYA L G. Identification of clay minerals in reservoir rocks by FTIR spectroscopy//IOP Conference Series: Earth and Environmental Science[J]. IOP Publishing, 2016, 43(1): 012004. [30] ZHANG T, YANG H, ZHANG H, et al. Aluminum extraction from activated coal gangue with carbide slag[J]. Journal of Analytical and Applied Pyrolysis, 2022, 163: 105504. doi: 10.1016/j.jaap.2022.105504 [31] YIN Y, YIN J, ZHANG W, et al. FT-IR and micro-Raman spectroscopic characterization of minerals in high-calcium coal ashes[J]. Journal of the Energy Institute, 2018, 91(3): 389-396. doi: 10.1016/j.joei.2017.02.003 [32] KOKILA T, RAMESH P S, GEETHA D. Biosynthesis of silver nanoparticles from Cavendish banana peel extract and its antibacterial and free radical scavenging assay: a novel biological approach[J]. Applied Nanoscience, 2015, 5: 911-920. doi: 10.1007/s13204-015-0401-2 [33] LIANG P, CHEN C, ZHAO S, et al. Application of Fourier transform infrared spectroscopy for the oxidation and peroxide value evaluation in virgin walnut oil[J]. Journal of Spectroscopy, 2013, 2013: 138728. [34] XU D M, FU R B. The mechanistic insights into the leaching behaviors of potentially toxic elements from the indigenous zinc smelting slags under the slag dumping site scenario[J]. Journal of Hazardous Materials, 2022, 437: 129368. doi: 10.1016/j.jhazmat.2022.129368 [35] LU X, HUANG F X, MA J. Removal of trace mercury (II) from aqueous solution by in situ formed Mn–Fe (hydr) oxides[J]. Journal of Hazardous Materials, 2014, 280: 71-78. doi: 10.1016/j.jhazmat.2014.07.056 [36] ANTIC-MLADENOVIC S, FROHNE T, KRESOVIC M, et al. Redox-controlled release dynamics of thallium in periodically flooded arable soil[J]. Chemosphere, 2017, 178: 268-276. doi: 10.1016/j.chemosphere.2017.03.060 [37] BELZILE N, CHEN Y W. Thallium in the environment: a critical review focused on natural waters, soils, sediments and airborne particles[J]. Applied Geochemistry, 2017, 84: 218-243. doi: 10.1016/j.apgeochem.2017.06.013 [38] XIAO T, GU J, BOYLE D. High thallium content in rocks associated with Au–As–Hg–Tl and coal mineralization and its adverse environmental potential in SW Guizhou, China[J]. Geochemistry:Exploration, Environment, Analysis, 2004, 4(3): 243-252. doi: 10.1144/1467-7873/04-204 [39] ELGHALI A, BENZAAZOUA M, BOUZAHZAH H, et al. Role of secondary minerals in the acid generating potential of weathered mine tailings: Crystal-chemistry characterization and closed mine site management involvement[J]. Science of the Total Environment, 2021, 784: 147105. doi: 10.1016/j.scitotenv.2021.147105 [40] 陈怀满. 土壤中化学物质的行为与环境质量[M]. 北京: 科学出版社, 2002. [41] FAN Y, ZHENG C, HUO A, et al. Investigating the binding properties between antimony (V) and dissolved organic matter (DOM) under different pH conditions during the soil sorption process using fluorescence and FTIR spectroscopy[J]. Ecotoxicology and Environmental Safety, 2019, 181: 34-42. doi: 10.1016/j.ecoenv.2019.05.076 [42] MLADENOV N, ZHENG Y, SIMONE B, et al. Dissolved organic matter quality in a shallow aquifer of Bangladesh: implications for arsenic mobility[J]. Environmental Science & Technology, 2015, 49(18): 10815-10824. [43] DEONARINE A, KOLKER A, DOUGHTEN M W, et al. Mobilization of arsenic from coal fly ash in the presence of dissolved organic matter[J]. Applied Geochemistry, 2021, 128: 104950. doi: 10.1016/j.apgeochem.2021.104950 [44] HU X, GUO X, HE M, et al. pH-dependent release characteristics of antimony and arsenic from typical antimony-bearing ores[J]. Journal of Environmental Sciences, 2016, 44: 171-179. doi: 10.1016/j.jes.2016.01.003 [45] UDDIN M K. A review on the adsorption of heavy metals by clay minerals, with special focus on the past decade[J]. Chemical Engineering Journal, 2017, 308: 438-462. doi: 10.1016/j.cej.2016.09.029 [46] LIONS J, VAN D L J, GUERIN V, et al. Zinc and cadmium mobility in a 5-year-old dredged sediment deposit: experiments and modelling[J]. Journal of Soils and Sediments, 2007, 7: 207-215. doi: 10.1065/jss2007.05.226 [47] ECKLEY C S, LUXTON T P, STANFIELD B, et al. Effect of organic matter concentration and characteristics on mercury mobilization and methylmercury production at an abandoned mine site[J]. Environmental Pollution, 2021, 271: 116369. doi: 10.1016/j.envpol.2020.116369 [48] LIU J, VALSARAJ K T, DEVAI I, et al. Immobilization of aqueous Hg (II) by mackinawite (FeS)[J]. Journal of Hazardous Materials, 2008, 157(2-3): 432-440. doi: 10.1016/j.jhazmat.2008.01.006 [49] RANDALL P, CHATTOPADHYAY S. Influence of pH and oxidation-reduction potential (Eh) on the dissolution of mercury-containing mine wastes from the Sulphur Bank Mercury Mine[J]. Mining, Metallurgy & Exploration, 2004, 21: 93-98. [50] 姚爱军, 青长乐, 牟树森. 腐殖酸对汞的络合稳定特性及其环境学意义[J]. 中国生态农业学报, 2006(3): 138-140. -




 下载:
下载: