-
汞是全球性持久有毒污染物,可越洋进行全球传输。废水中的汞可在生物体内积累并通过甲基化反应形成甲基汞,造成婴儿智力损失并增加人类心脏病诱发率[1]。2017年8月,全球128个国家和地区在瑞士日内瓦倡议并签署生效《水俣公约》,再次以国际法形式限制Hg使用和排放,Hg污染对人类健康和生态环境的危害从未间断,并已迫在眉睫,亟待解决[2]。地壳汞含量低、形态稳定,汞污染主要来源于人类活动。我国是汞排放大国,约占全球总排放量的33%[3]。Hg主要来源于手工和小规模采矿、煤燃烧、有色金属冶炼、氯乙烯催化等过程,随着社会生产发展,Hg的来源更加多样,如电子废弃物回收、垃圾焚烧、医疗废物焚烧等,Hg的减量化控制和污染防治至关重要[4]。Hg不易沉积,可在大气与水环境中持续迁移,烟气中Hg0是Hg排放的主要形式,而Hg污染减量化控制和污染防治的关键在于废水中Hg2+的控制,Hg0以Hg2+被吸附剂截留并经吸附剂水洗再生转移至废水中,实现固化稳定。寻求废水中Hg2+高效、稳定及经济可行的治理技术,对解决Hg的迁移转化和生态环境破坏问题至关重要。
混凝和化学沉淀法(Na2S)是当前废水中Hg2+去除主要方法,然而受质量传递效率限制Hg2+出水质量浓度远高于城镇污水Hg的排放限值0.001 mg·L−1 [5],且形成含Hg污泥及产生H2S气体,带来次生环境风险。吸附法因操作简便,汞吸附容量大、速率快、选择性强的特点,在废水中汞污染治理方面具有潜在应用前景[6]。已有利用层状双金属氢氧化物(LDHs)[7]、金属硫化物[8]、聚合硫化物[9]、改性碳材料[10]、金属有机框架(MOFs)[11]、共价有机框架聚合物(COFs)[12]等纳米材料的实验室与现场研究报道。MOFs和COFs有机骨架材料对Hg2+的吸附容量大(Fe-BTC/PDA与TPB-DMPT-COG-SH饱和吸附容量分别为1 634和4 395 mg·g−1),但制备成本高、分离回收困难、适用pH范围窄、稳定性差等问题,制约着该类材料发展与使用[11-12]。LDHs、硫化物、聚合物、碳材料等无机纳米吸附剂稳定性强,制备成本低,但该类纳米材料在废水中易于聚合而降低表面活性位点利用率,Hg2+吸附容量低(N-rich polymer饱和吸附容量为1 172 mg·g−1)[8]。开展无机纳米材料的微观形貌调控以提高其Hg2+吸附位点利用效率,进而提高Hg2+吸附性能是实现废水中Hg2+高效去除有效方法之一。
本研究以在废水中稳定性强、具有Hg2+吸附选择性的CuxS纳米片为Hg2+吸附活性位点,采用聚多巴胺(PDA)包裹的磁性Fe3O4为基底(PDA@Fe3O4),通过简便可行的常温化学沉积方法将CuxS纳米片原位嵌布于PDA@Fe3O4表面,制备了三维团簇状结构的CuxS/PDA@Fe3O4磁性纳米吸附剂,该吸附剂含有吸附位点多、吸附容量大,且不易团聚。通过CuxS纳米片负载量、合成温度与合成pH因素控制,调控纳米吸附剂的微观形貌,通过模拟含Hg2+废水处理评估所制备纳米材料的废水适配性。利用透射电镜-能谱分析(TEM-Mapping)、X射线衍射(XRD)、X射线光电子能谱(XPS)、拉曼光谱(Raman)等方法阐明Hg2+的吸附机理。研究结果可为废水中Hg2+污染防治提供技术支撑。
-
四氧化三铁纳米颗粒(Fe3O4)、二水合氯化铜(CuCl2·2H2O,分析纯)、硫化铵水溶液((NH4)2S,质量百分比为14%,分析纯)、盐酸多巴胺(C8H11NO2·HCl,分析纯)、三羟基甲基氨基甲烷(Tris,C4H11NO3,分析纯)、氢氧化钠(NaOH,分析纯)、硝酸(HNO3,分析纯)购置于国药集团化学试剂有限公司,以上试剂均为分析纯。Hg2+、Ag+、Co2+、Mo2+、Mn2+、Pb2+、Cd2+、Ca2+、Zn2+、Mg2+、Fe3+、Al3+、Ni2+、Cr6+/Cr3+金属离子ICP标准溶液(质量浓度均为1.0 g·L−1),购置于河北北纳生物科技有限公司。溶液均采用去离子水配制。
-
将0.2 g Fe3O4颗粒加入200 mL含有2 g·L−1 C8H11NO2·HCl的水溶液中,用10 mmol·L−1的Tris-HCl缓冲液调节液相pH=8.5,充分搅拌并超声处理15 min,而后在45 ℃恒温搅拌1.0 h,使用磁石进行固液分离得到聚多巴胺包裹的Fe3O4材料(PDA@Fe3O4),将制备好的PAD@Fe3O4用去离子水反复洗涤,真空抽滤在0.22 μm的水系滤膜上并置于50 ℃烘箱中烘至恒质量,研磨备用。分别将0.2 g PDA@Fe3O4颗粒加入50 mL浓度为0.02、0.04、0.06、0.2 mol·L−1的CuCl2·H2O溶液中,超声分散处理15 min,对应CuCl2·2H2O浓度不同将0.5、1.0、1.5、5.0 mL (NH4)2S水溶液分别逐滴滴加到烧杯中,滴加完成后调节液相pH=3.0,在20 ℃条件下反应30 min。待其稳定陈化3 h,使用磁石进行磁分离,多次洗涤去除未反应完全的杂质,抽滤并置于50 ℃烘箱中烘至恒质量,研磨备用,制备不同CuxS负载量的CuxS/PDA@Fe3O4磁性纳米吸附剂。采用浓度0.04 mol·L−1的CuCl2·2H2O溶液、1.0 mL (NH4)2S水溶液,反应pH=3.0,在温度20、40、60及80 ℃时,制备不同合成温度的CuxS/PDA@Fe3O4磁性纳米吸附剂。采用浓度0.04 mol·L−1的CuCl2·2H2O溶液、1.0 mL (NH4)2S水溶液,在反应温度为20 ℃时调节液相pH=3.0和4.0,制备不同合成pH的CuxS/PDA@Fe3O4磁性纳米吸附剂。
-
采用不同制备条件下获得的CuxS/PDA@Fe3O4磁性纳米吸附剂开展含Hg2+模拟废水处理实验,评估其Hg2+吸附去除性能:废水Hg2+初始质量浓度~10.0 mg·L−1,吸附pH=6.0,废水体积50 mL,CuxS/PDA@Fe3O4投加量0.03 g,放入气浴恒温振荡器中吸附24 min,保持吸附温度为25 ℃,振荡频率为180 r·min−1。每隔4 min取样,样品通过0.22 μm水系滤膜过滤后,加入少量2.0 mol·L−1 HCl酸化,用原子荧光分光光度计(AF,AF-
2200 ,北京瑞利分析仪器有限公司)测定样品中Hg2+的含量。采用浓度0.04 mol·L−1的CuCl2·2H2O溶液、1.0 mL (NH4)2S水溶液,反应pH=3.0,反应温度20 ℃时制备的CuxS/PDA@Fe3O4磁性纳米吸附剂开展Hg2+饱和吸附容量测定,初始Hg2+质量浓度为1.0、5.0、10.0、20.0、50.0、100.0、200.0及500.0 mg·L−1,吸附剂投加量0.6 mg·L−1,吸附pH=6.0,吸附温度为25 ℃,振荡频率为180 r·min−1,吸附反应时间120 min。测定吸附后Hg2+浓度,采用式(1)计算CuxS/PDA@Fe3O4对Hg2+吸附量q [13]。采用Langmuir (式(2))和Freundlich模型(式(3))对实验数据进行拟合。式中:C0和C分别为吸附前后Hg2+浓度,mg·L−1;V为废水体积,L;m为吸附剂用量,g。
式中:qe为平衡吸附容量,mg·g−1; qm为单层吸附饱和吸附量,mg·g−1;Ce为平衡时Hg2+浓度,mg·L−1;KL为Langmuir常数,L·mg−1; KF为Freundlich常数,(mg·g−1)·(mg·L−1)n;n为经验常数。
使用浓度0.04 mol·L−1的CuCl2·2H2O溶液、1.0 mL (NH4)2S水溶液,反应pH=3.0,反应温度20 ℃时制备的CuxS/PDA@Fe3O4磁性纳米吸附剂开展Hg2+吸附选择性实验和吸附-解吸实验。在吸附pH=4.0,金属离子初始质量浓度~10.0 mg·L−1开展Ag+、Co2+、Mo2+、Mn2+、Pb2+、Cd2+、Ca2+、Zn2+、Mg2+、Fe2+、Al3+、Ni2+的吸附实验,评估CuxS/PDA@Fe3O4磁性纳米吸附剂Hg2+吸附选择性。采用2.0 mol·L−1 HCl溶液为解吸液,对Hg2+吸附后的CuxS/PDA@Fe3O4吸附剂进行解吸处理。吸附实验:吸附剂投加量0.6 mg·L−1,废水Hg2+质量浓度50.0 mg·L−1,吸附时间24 min。解吸实验:吸附剂投加量3 mg·L−1解吸液,解吸时间24 min。吸附-解吸循环6次,测定每次吸附-解吸的Hg2+吸附率和解吸率。上述实验均开展2次,数据分析采用2次实验所得平均值。
-
采用场发射扫描电子显微镜(FSEM,SUPRA 40,德国ZEISS)、透射电子显微镜(TEM,Tecnai G2 F20, 美国FEI)观察CuxS/PDA@Fe3O4吸附剂的微观形貌,并结合X-射线能量色散光谱仪(EDS-Mapping,英国X-Max)进行表面元素分布分析。采用振动样品磁强计(VSM,SQUID-VSM,美国Quantum Design)研究了CuxS/PDA@Fe3O4吸附剂的磁性。采用X-射线衍射仪(XRD,D8,德国Bruker)对不同制备条件下获得的CuxS/PDA@Fe3O4吸附剂进行物相表征及晶格结构分析,使用拉曼光谱仪(Raman,法国HORIBA Jobin Yvon)测试Hg2+吸附前后CuxS/PDA@Fe3O4吸附剂活性基团变化,并采用X-射线光电子能谱仪(XPS,美国K-Alpha)进行Cu、Hg元素化学形态分析,阐明Hg2+吸附去除机理。
-
采用透射电子显微镜(TEM)对Fe3O4、PDA@Fe3O4、CuxS/PDA@Fe3O4 3种纳米颗粒进行微观形貌的表征,同一放大倍率下的TEM图分别见图1(a)~(c)。从整体上看,这3种纳米颗粒的形貌均呈球状,其中Fe3O4与周围分界清晰,说明颗粒均匀致密,表面较光滑;PDA@Fe3O4颗粒内部与Fe3O4相似,但表面有均匀的浅色薄层;而CuxS/PDA@Fe3O4颗粒内部均匀且密度明显比外层高,外层分布有蓬松的絮状突出。3种纳米颗粒分别对应CuxS/PDA@Fe3O4吸附剂自组装合成的3种状态。其中,Fe3O4颗粒是原始状态,作为支撑基底。PDA@Fe3O4是在Fe3O4表面通过自聚合作用包覆了一层聚多巴胺(PDA)形成的颗粒,因此TEM图显示其表面有浅色薄层。CuxS/PDA@Fe3O4是在PDA@Fe3O4表层负载了具有三维结构CuxS纳米团簇的纳米颗粒,其TEM图显示的外部疏松多孔的絮状结构即CuxS纳米团簇。这3种纳米颗粒的微观形貌特征验证了CuxS/PDA@Fe3O4纳米吸附剂的合成路径切实可行。
通过透射电子显微镜结合能谱面分布扫描(TEM-mapping)对合成后的CuxS/PDA@Fe3O4纳米吸附剂进行表面元素分析,结果如图1(d)所示。通过电镜的暗场图可以清晰看出吸附剂表面有片状物互相堆叠、致密有序的团簇结构,即CuxS纳米团簇。面分布扫描(mapping)结果显示吸附剂表面主要含有C、N、Cu、S等元素,其中,C和N的含量占比分别为2.31%和0.01%,主要来源于聚多巴胺(PDA),表明聚多巴胺(PDA)很好地包裹在Fe3O4表面,形成了PDA@Fe3O4作为CuxS纳米团簇的生长表面。Cu的含量占比为72.23 %,S的含量占比为25.46 %,表明CuxS在PDA@Fe3O4表面含量很高,负载状态很好,同时也说明聚多巴胺(PDA)能够较好地促进CuxS在其表面生长。
采用振动样品磁强计(VSM)对Fe3O4、CuxS/PDA@Fe3O4这2种纳米颗粒进行磁性表征,结果如图1(e)所示。结果表明,Fe3O4纳米颗粒的饱和磁化强度为91.52 emu·g−1,经过PDA包覆和CuxS负载后,由于单位质量纳米颗粒中Fe3O4含量降低,CuxS/PAD@Fe3O4吸附剂的饱和磁化强度降低至48.55 emu·g−1,但其仍然保持较高的磁响应,磁性能优良。
从CuxS/PDA@Fe3O4纳米吸附剂的微观结构特征、表面元素分布及磁性分析可知,聚多巴胺(PDA)包裹的磁性Fe3O4纳米颗粒表面可以负载具有三维结构的CuxS纳米团簇,形成具有丰富表面结构的磁性纳米吸附剂。这种吸附剂具有高吸附效率和易磁分离回收的优势,有助于废水中Hg2+的吸附和去除。
-
CuxS/PDA@Fe3O4的合成过程关键参数对它的Hg2+吸附性能至关重要。因此,需要探究CuxS负载量、合成温度及合成pH对CuxS/PDA@Fe3O4的合成及Hg2+吸附性能的影响机制,获得最优的合成条件。
通过添加不同浓度的CuCl2·2H2O及相应的(NH4)2S用量来调控不同CuxS负载量,探究CuxS负载量对合成的CuxS/PDA@Fe3O4吸附剂的影响。图2(a)~(d)分别是0.02、0.04、0.06、0.20 mol·L−1的CuCl2所合成的CuxS/PDA@Fe3O4吸附剂的SEM图。从这4种样品的微观形貌可以看出,随着CuxS负载量的增大,球状颗粒表面微小的不规则晶片越来越多。但当CuCl2浓度增加到0.20 mol·L−1时,球状颗粒表面微小的不规则晶片减少了,变成了较大块,这可能的原因是高浓度的CuCl2使得CuxS晶片迅速生长,互相遮盖堆叠,最终形成了球团,而不是有序插层的三维纳米花簇。从微观形貌来看,0.04 mol·L−1的CuCl2所合成吸附剂的表面结构是最好的,其表面能清晰看见分布致密有序的纳米片团簇。
通过XRD分析4种浓度的CuCl2所合成的CuxS/PDA@Fe3O4吸附剂的物质组成和结晶状态,结果如图2(e)所示。可见,0.20 mol·L−1 CuCl2所合成的CuxS/PDA@Fe3O4的衍射峰较小,其结晶度相对较低。0.02、0.04、0.06 mol·L−1 CuCl2所合成的CuxS/PDA@Fe3O4衍射峰更强,结晶程度更高。XRD图谱中显示了CuS和Cu2S的特征峰,其中29.78°、31.78°、47.78°、57.21°的衍射峰对应CuS (PDF 06-0464),其中26.36°、30.53°、43.74°、54.26°的衍射峰对应Cu2S (PDF 46-
1195 )。用不同浓度CuCl2合成的CuxS/PDA@Fe3O4吸附模拟废水中的Hg2+,水样中剩余Hg2+的质量浓度随时间的变化如图2(f)所示。在吸附24 min后,水样中剩余Hg2+质量浓度均低于0.006 mg·L−1,吸附率均达到了99.9 %以上,表明CuxS/PDA@Fe3O4对废水中Hg2+吸附性能较好。其中,0.02 mol·L−1和0.20 mol·L−1 CuCl2合成的吸附剂的吸附速率相对较低。较少的CuxS负载以及过量CuxS负载造成结团,均使其表面的吸附位点较少,最终导致吸附速率较差,这也与SEM图观察到的微观形貌特征相吻合。因此,综合SEM、XRD以及模拟废水Hg2+吸附实验结果分析,0.04 mol·L−1的CuCl2所合成的CuxS/PDA@Fe3O4吸附剂更加稳定,且对Hg2+的吸附效果更好。
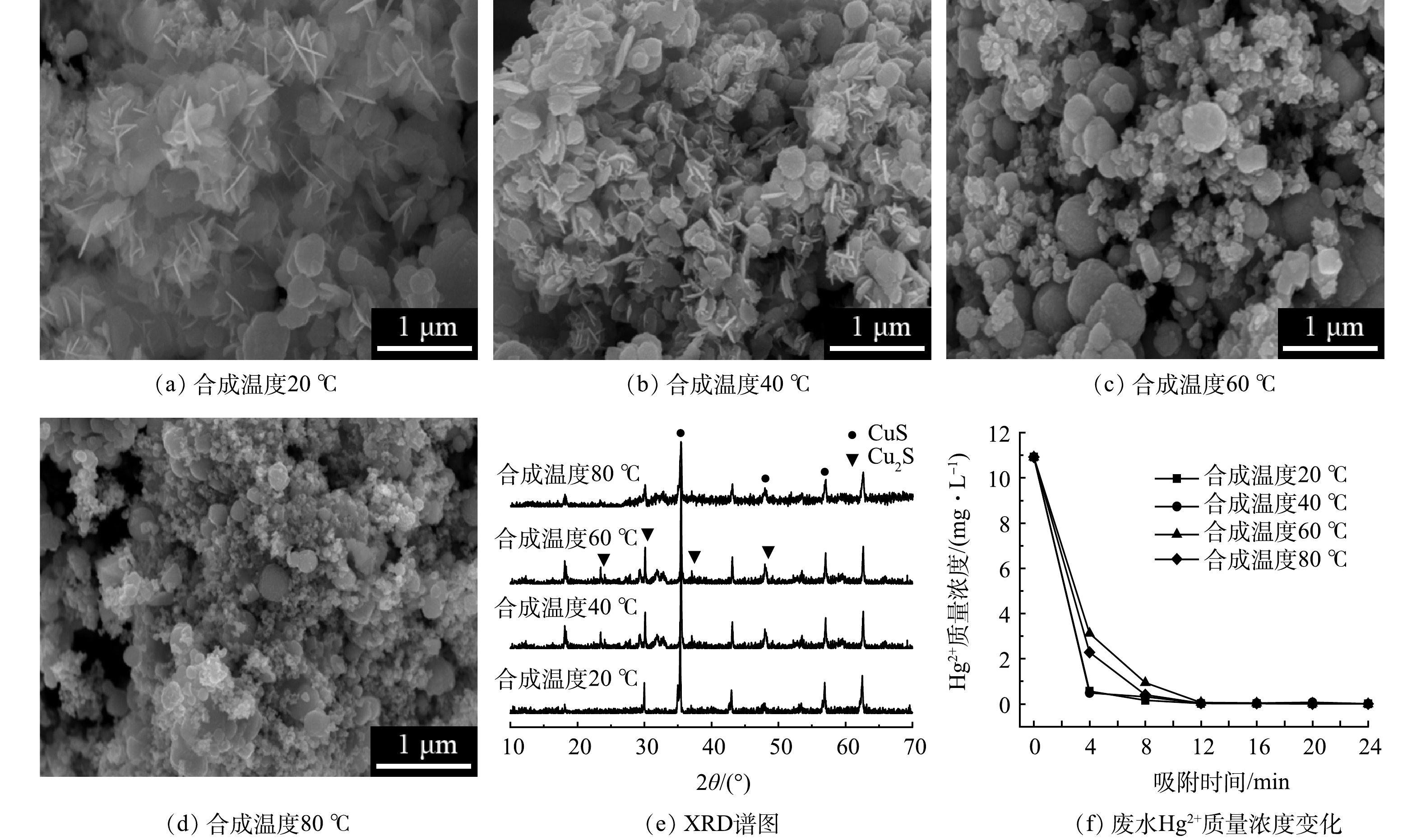
通过控制合成温度,制备不同温度下合成的CuxS/PDA@Fe3O4磁性纳米吸附剂,探究合成温度对CuxS/PDA@Fe3O4吸附剂的影响。图3(a)~(d)分别是20、40、60、80 ℃所合成的CuxS/PDA@Fe3O4吸附剂的SEM图。由4种样品的微观形貌可以看出,20 ℃合成的吸附剂表面的三维结构CuxS花簇形貌清晰,晶片均匀,分布致密有序。随着温度越来越高,表面的CuxS花簇结构越来越少,变得杂乱无序,有的形成了球团。这可能是因为高温导致CuxS合成反应速率加快,使得CuxS晶片迅速生长,但还未长成较大晶片就被下一层覆盖,最终形成了球团,而不是有序交叉的三维纳米花簇。从微观形貌来看,20 ℃条件下更易合成均匀成型的CuxS纳米团簇。
通过XRD分析不同温度下所合成的CuxS/PDA@Fe3O4吸附剂的物质组成和结晶状态。如图3(e)所示,不同温度下所合成吸附剂的衍射峰位置基本相同,随着合成温度越高,吸附剂显示的衍射峰越弱,峰面积也更小,表明其结晶度更低。XRD的分析结果与前文所述一样,含有CuS和Cu2S 2种组分。
将不同温度下所合成的CuxS/PDA@Fe3O4用于吸附模拟废水中的Hg2+,水样中剩余Hg2+的质量浓度随时间的变化如图3(f)所示。可见,在吸附24 min后,水样中剩余Hg2+质量浓度均低于0.005 mg·L−1,吸附率都达到了99.9 %以上。其中,60 ℃和80 ℃合成的吸附剂的吸附速率相对较低,这也与SEM图分析的结果相吻合。因此,综合SEM、XRD以及模拟废水Hg2+吸附实验的分析,20 ℃所合成的CuxS/PDA@Fe3O4吸附剂的Hg2+吸附性能更好。此外,20 ℃接近室温,在实际应用中减少了加热合成的步骤,降低材料成本。
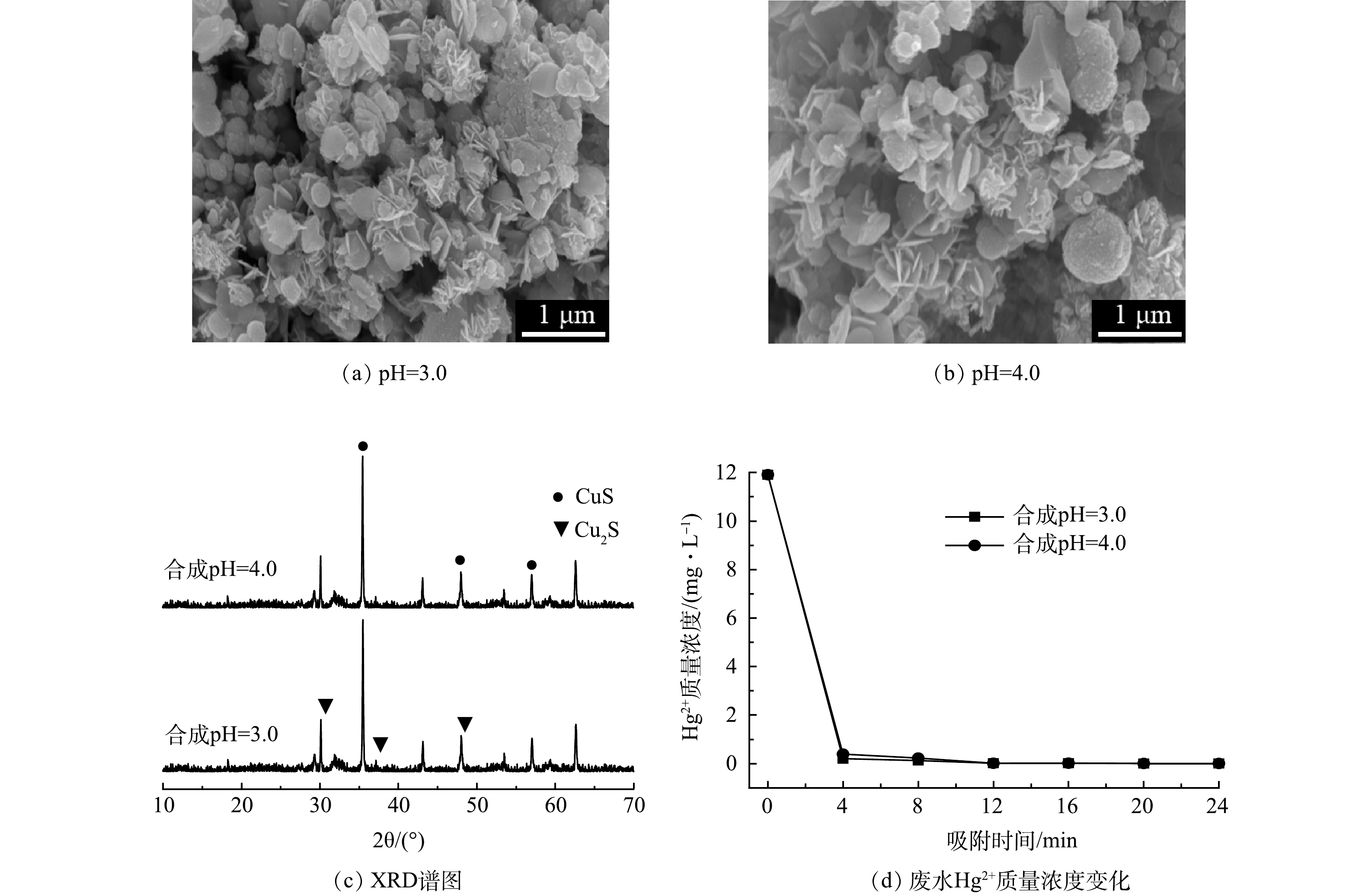
通过控制合成pH,制备不同pH条件下合成的CuxS/PDA@Fe3O4磁性纳米吸附剂,探究合成pH对CuxS/PDA@Fe3O4吸附剂的影响。图4(a)和图4(b)分别是pH=3.0和pH=4.0条件下所合成的CuxS/PDA@Fe3O4吸附剂的SEM图。从这2种样品的微观形貌可以看出,所合成的CuxS均为清晰且致密有序的花簇状,pH=3.0所合成的吸附剂花簇状分布相对更为致密。通过XRD分析2种pH条件下所合成的CuxS/PDA@Fe3O4吸附剂的物质组成和结晶状态,如图4(c)所示。不同pH条件下所合成的吸附剂的衍射峰位置基本相同,衍射峰均尖锐明显,差别不大,说明结晶度较好。XRD的分析结果与前文所述一样,含有CuS和Cu2S这2种组分。用2种pH条件下所合成的CuxS/PDA@Fe3O4吸附剂吸附模拟废水中的Hg2+,水样中剩余Hg2+的质量浓度随时间的变化如图4(d)所示。在吸附24 min后,水样中剩余Hg2+质量浓度均低于0.002 mg·L−1,吸附率都接近于100 %。在4 min时,pH=3.0所制备的吸附剂对Hg2+的去除率就达到了98.3 %,因此,综合SEM、XRD以及模拟废水Hg2+吸附实验的分析,确定pH=3.0的条件下制备的CuxS/PDA@Fe3O4吸附剂为最优吸附剂。
-
为探究CuxS/PDA@Fe3O4对Hg2+吸附性能,通过吸附等温线模型计算了CuxS/PDA@Fe3O4磁性纳米吸附剂对Hg2+吸附容量。如图5(a)所示,CuxS/PDA@Fe3O4对Hg2+的吸附随Hg2+的初始质量浓度的增加而增大,当Hg2+初始质量浓度为500 mg·L−1时,吸附等温线模拟后的饱和吸附容量达到1 394.61 mg·g−1,优于大多数同类吸附剂的吸附容量。使用Langmuir模型和Freundlich模型来研究CuxS/PDA@Fe3O4的吸附平衡等温线。结果表明,Langmuir模型拟合的可决系数(R2)为0.85,而Freundlich模型拟合的可决系数(R2)为0.99,表明Freundlich模型对Hg2+的吸附拟合效果更好,说明吸附剂表面对Hg2+的吸附是化学吸附和孔道截留的协同作用。
为探究CuxS/PDA@Fe3O4对废水中不同金属阳离子的吸附性能,使用CuxS/PDA@Fe3O4吸附剂分别对Hg2+、Ag+、Co2+、Mo2+、Mn2+、Pb2+、Cd2+、Ca2+、Zn2+、Mg2+、Fe3+、Al3+、Ni2+和Cr6+/Cr3+这14种金属阳离子进行了吸附实验,结果如图5(b)所示。结果表明,吸附剂仅对Hg2+、Ag+、Mo2+、Cr6+/Cr3+具有较好的亲和力,去除率分别为99.9%、99.7%、46.19%、38.7%,其中去除Hg2+吸附效果最好。Co2+、Mn2+、Cd2+、Ca2+、Zn2+、Mg2+、Fe3+、Al3+、Ni2+等金属阳离子完全没有任何去除效果。因此,当Hg2+与其他金属离子共存时,可实现Hg2+的选择性去除。
为探究CuxS/PDA@Fe3O4纳米吸附剂的稳定性能,采用2.0 mol·L−1 HCl作为CuxS/PDA@Fe3O4表面Hg2+的洗脱剂进行了6次吸附解吸循环实验,结果如图5(c)所示。第1次的吸附率为97.63%,第2次明显降低,仅为65.40%;第1次和第2次的解吸率均保持在100 %,在第3次吸附率保持在58.33%,解吸率下降至84.94%,经过6次吸附解吸循环,最终次吸附率和解吸率分别为44.76%和74.26 %。结果表明,CuxS/PDA@Fe3O4吸附剂具有较好的可循环利用性,在实际工作中可以进行持续性的循环利用。
-
采用X射线光电子能谱(XPS)分析CuxS/PDA@Fe3O4磁性纳米吸附剂吸附Hg2+前后的表面元素化学状态。图6(a)为CuxS/PDA@Fe3O4纳米粒子在Hg2+吸附前后的XPS全谱图。吸附前后的吸附剂中Cu、S、O、C等元素的特征峰变化不大,而吸附Hg2+后的吸附剂中明显增加了Hg元素的特征峰。大量存在Cu和S证明了CuxS在PDA@Fe3O4材料表面成功负载。对比吸附前后Hg的特征峰,可明显看到Hg在吸附完成后大量存在于吸附剂表面,证明CuxS/PDA@Fe3O4对Hg2+的成功吸附。图6(b)为吸附Hg2+后的CuxS/PDA@Fe3O4的Hg4f谱图,对其分峰拟合后,在101.0 eV和105.1 eV处的特征峰分别对应Hg4f7/2和Hg4f5/2。表明吸附后的Hg以+2价存在。而位于102.5 eV处的特征峰为Si2p,因与Hg4f峰位邻近,易造成干扰,这也与图6(a)的吸附前全谱图中该位置的峰相对应。图6(c)为Cu2p谱图,对其分峰拟合后,在932.0 eV和951.9 eV处的特征峰对应Cu2+的2p3/2和2p1/2轨道,在932.5 eV和952.4 eV处的特征峰对应Cu+的2p3/2和2p1/2轨道,说明,CuxS主要以CuS和Cu2S这2种组分存在。图6(d)为Fe3O4、PDA@Fe3O4、CuxS/PDA@Fe3O4以及吸附Hg2+后的CuxS/PDA@Fe3O4的Raman谱图对比。可见,相比于Fe3O4和PDA@Fe3O4,CuxS/PDA@Fe3O4在472.17 cm−1处有1个明显的Cu-S键吸收峰,吸附Hg2+后的该吸收峰明显增强。表明PDA@Fe3O4表面成功负载了CuxS,且在吸附Hg2+后,Hg2+与CuxS的S结合形成了HgS。
CuxS/PDA@Fe3O4磁性纳米吸附剂合成和Hg2+吸附机理总结如下:磁性Fe3O4纳米颗粒作为支撑基底,其本身具有磁性,有利于吸附剂在吸附Hg2+后的分离回收。在Fe3O4表面通过自聚合作用包覆一层聚多巴胺(PDA),其表面呈现出正电性,有利于负电性的CuxS在其表面生成。Cu2+与S2-结合形成纳米片,逐滴加入的(NH4)2S缓慢释放S2-使得晶核逐渐生长,并沿着能量较低的面生长形成片状纳米花瓣。在这个过程中,纳米片会为了追求更稳定的状态而聚集起来,完成自组装。由于纳米花瓣的两面带有不同的电性:Cu原子富集的一侧表现出正电性,而S原子富集的另外一侧表现出负电性。在自组装过程中,为了降低整个体系的能量,二维的瓣状纳米片最终会定向交叉形成三维纳米花结构而达到稳定状态[14]。因为带负电的S2-倾向于以带正电的铜离子为着位点向外延伸,从而使得CuxS表面带负电,因此易负载于PDA@Fe3O4表面,形成CuxS/PDA@Fe3O4磁性纳米吸附剂。其对Hg2+的吸附作用主要是孔道截留和化学吸附。孔道截留作用主要得益于三维CuxS纳米花簇的丰富孔隙结构,其与Hg2+大的接触面积有助于对Hg2+的吸附。化学吸附主要基于“硬软酸碱”(HSAB)理论,Hg2+优先与Lewis软碱S2-基团形成不溶性和稳定的化合物,CuS的溶度积常数pKsp为36.26,远小于HgS的溶度积常数pKsp值53.43,从热力学角度S与Hg的结合很容易进行,CuxS/PDA@Fe3O4磁性纳米吸附剂表面丰富的S含量可以促进其对Hg2+的吸附。
-
1)本研究采用界面自组装方法合成了一种高效、可重复使用的Hg2+吸附剂CuxS/PDA@Fe3O4。由带负电的层状CuxS纳米团簇、正电性的中间层和磁性Fe3O4基底构成,其中CuxS主要为Cu2S和CuS这2种物质。最优吸附剂的制备条件为:CuCl2投加摩尔比为0.04 mol·L−1、合成温度为20 ℃、反应pH为3.0。
2) CuxS/PDA@Fe3O4吸附剂对Hg2+的吸附容量可达1 394.61 mg·g−1。CuxS/PDA@Fe3O4纳米吸附剂对Hg2+的吸附过程为化学吸附和孔道截留的协同作用。该吸附剂对Hg2+、Ag+、Mo2+、Cr6+/Cr3+均具有吸附效果,其中,对Hg2+的吸附效果最好,去除率接近100%。
3)吸附剂循环稳定性能较好,经过6次吸附-解吸循环后的吸附和解吸率仍能达到44.76%和74.26%,并且吸附Hg2+后的吸附剂可通过磁分离法进行回收,不会造成二次污染。这种绿色、经济、高效的CuxS/PDA@Fe3O4纳米吸附剂具有较大的应用潜力。
CuxS纳米团簇磁性吸附剂的制备及其对Hg2+的吸附性能与机理
Preparation of CuxS nanocluster magnetic adsorbent and its Hg2+ adsorption performance and mechanism
-
摘要: 燃煤、有色冶金等作业排放的含Hg2+废水对人类健康和生态环境构成重大威胁。该研究开发了一种CuxS/PDA@Fe3O4磁性纳米吸附剂,该吸附剂在去除废水中Hg2+方面展现出高效和可持续的优势。通过聚多巴胺(PDA)对Fe3O4纳米颗粒进行改性,并采用液相化学沉积方法将CuxS纳米团簇稳固锚定于带正电的PDA@Fe3O4表面,形成了结构稳定的CuxS/PDA@Fe3O4磁性纳米吸附剂。该吸附剂在120 min内即可达到
1394.61 mg·g−1的Hg2+吸附容量,且在复杂环境中保持对Hg2+的高选择性吸附。优化研究表明,最佳制备条件为CuCl2投加量0.04 mol·L−1、合成温度20 ℃及pH值3.0。采用HCl溶液成功实现了吸附剂的解吸再生,循环使用性能优异。同时,吸附剂的磁性便于吸附后的快速分离回收。该吸附剂制备成本低,工艺简单高效,在汞面源污染治理和重金属废水处理领域具有广阔的应用前景。Abstract: Wastewater containing Hg2+ emitted from coal combustion, non-ferrous metallurgy and other industries poses a serious threat to human health and ecosystems. CuxS/PDA@Fe3O4 magnetic nano-adsorbent was developed for efficient and sustainable removal of Hg2+ from wastewater. By modifying Fe3O4 nanoparticles with polydopamine (PDA) and firmly anchoring CuxS nanoclusters onto the positively charged PDA@Fe3O4 surface through liquid-phase chemical deposition, a type of CuxS/PDA@Fe3O4 magnetic nano-adsorbent with stable structure is synthesized. Within 120 minutes, the adsorbent can achieve a Hg2+ adsorption capacity of1394.61 mg·g−1, and also maintains high selectivity for Hg2+ in complex environments. Optimization studies reveal the optimal preparation conditions are following: CuCl2 dosage of 0.04 mol·L−1, the synthesis temperature of 20°C, and pH 3.0. Desorption and regeneration of the adsorbent are successfully achieved using HCl solution, demonstrating its excellent recyclability. Furthermore, the magnetic property of the adsorbent facilitates the rapid separation and recovery after adsorption. The adsorbent can be prepared with low cost, simple and efficient process, and has a promising application in mercury pollution control and heavy metal wastewater treatment. -

-
-
[1] CHEN L, LIANG S, LIU M, et al. Trans-provincial health impacts of atmospheric mercury emissions in China[J]. Nature Communications, 2019, 10: 1484-1495. doi: 10.1038/s41467-019-09080-6 [2] U. S. Environmental Protection Agency. Mercury emissions: The global context[R]. [2023-10-01]. https://www.epa.gov/international-cooperation/mercury-emissions-global-context#health. [3] 贾里, 李犇, 徐樑, 等. 不同制备条件对生物焦汞吸附特性及吸附动力学的影响[J]. 环境工程学报, 2018, 12(1): 134-144. [4] LI Y, CHEN L, SAI L, et al. Looping mercury cycle in global environmental−economic system modeling[J]. Environmental Science & Technology, 2022, 56: 2861-879. [5] 陆素芬, 张高荣, 伍丽娟, 等. 功能化共价有机框架材料对水体中汞离子的吸附性能研究[J]. 生态与农村环境学报, 2023, 39(8): 1059-1066. [6] 冉颖, 涂书新, 袁媛, 等. 典型铁氧化物对Hg(II)吸附及其机制的比较研究[J]. 环境科学学报, 2023, 43(3): 138-149. [7] WANG L, WANG M, LI Z, et al. Enhanced removal of trace mercury from surface water using a novel Mg2Al layered double hydroxide supported iron sulfide composite[J]. Chemical Engineering Journal, 2020, 393: 124635-124646. doi: 10.1016/j.cej.2020.124635 [8] ZHANG Y, ZHANG X, WANG D, et al. Three-dimensional molybdenum disulfide/graphene hydrogel with tunable heterointerfaces for high selective Hg(II) scavenging[J]. Journal of Colloid and Interface Science, 2018, 514: 715-722. doi: 10.1016/j.jcis.2017.12.082 [9] LI B, ZHANG Y, MA D, et al. Mercury nano-trap for effective and efficient removal of mercury(II) from aqueous solution[J]. Nature Communications, 2014, 5: 5537-5543. doi: 10.1038/ncomms6537 [10] YANG G, HAN H, DU C, et al. Facile synthesis of melamine-based porous polymer networks and their application for removal of aqueous mercury ions[J]. Polymer, 2010, 51: 6193-6202. doi: 10.1016/j.polymer.2010.10.052 [11] DANIEL T, LI P, WASHINGTON S, SEYED M, et al. Selective heavy metal removal from water by a metal−organic framework/polydopamine composite[J]. ACS Central Science. 2018, 4: 349-356. [12] LAURA M, SERGIO R, FELIX Z, et al. Thiol grafted imine-based covalent organic frameworks for water remediation through selective removal of Hg(II)[J]. Journal of Materials Chemistry A, 2017, 5: 17973-17981. doi: 10.1039/C7TA05588A [13] 吴培, 刘子璇, 雷明婧, 等. 葡萄籽提取液还原制备生物炭负载纳米铁对水中As(Ⅲ)的去除性能及机理[J]. 环境工程学报, 2023, 17(8): 2596-2605. doi: 10.12030/j.cjee.202304041 [14] 赵先拓, 徐林林, 田悦, 等. 自组装CuS多孔级次纳米花及其吸附自沉积特性研究[J]. 物理学报, 2021, 70(22): 221-230. -




 下载:
下载: