-
在全球变暖与湖库富营养化加剧的背景下,拉氏尖头藻 (Raphidiopsis raciborskii) 引发的有害藻类水华事件频频发生[1-2]。拉氏尖头藻作为可固氮、耐受低磷、适应高温的丝状蓝藻,是一种适应能力强、扩张速度快的有毒有害入侵种[3],起初发现于印度尼西亚,近年来快速入侵我国南方地区,替代其他蓝藻成为优势种[4-6]。其在水中均匀分布,不会在水面聚积,处置难度高,水华一旦形成,严重威胁当地水体的水生态健康与居民用水安全[7]。
混凝是广泛应用于水体蓝藻水华应急处置技术之一。在天然水体中藻类细胞通常携带负电荷[8-9],投加阳离子混凝剂可以使藻类形成絮体实现沉降[10]。然而,混凝除藻存在药剂消耗大,产出藻泥多等问题。氧化处理被认为是强化蓝藻混凝效果、降低混凝剂消耗量的有效前处理技术之一。氧化剂 (如H2O2、NaClO、O3、KMnO4等) 通过诱使细胞失活、脱稳或释放藻源有机物等方式提高藻类去除效果[11]。任鹏飞等[12]使用KMnO4强化PACl处置拉氏尖头藻富藻水,但是KMnO4颜色较深,用量不当时容易造成水色变化。赵春禄等[13]发现H2O2与混凝剂联用去除颤藻,其浊度和叶绿素a (Chl a) 去除率高达96.4%和98.2%。H2O2所产生的·OH (2.80V) 具有极高的氧化还原电位[14],高于NaClO (1.63V) 和KMnO4 (1.51V) 的氧化还原电位,具有较强氧化性[15-16]。MA等[17]认为次氯酸可破坏胞内结构与酶活,KMnO4可以诱导藻源有机物释放后发挥架桥作用以强化混凝效果。LIN等[18]研究表明次氯酸钠预氧化对藻类的表面电位没有明显改变,其强化机制以细胞失活为主。目前,大部分预氧化混凝除藻研究主要针对微囊藻、伪鱼腥藻等水华蓝藻,对拉氏尖头藻的混凝去除过程的影响尚不清晰,难以满足有关管理部门对拉氏尖头藻水华水体治理工作的需要。
本研究针对华南地区典型富营养化水体的拉氏尖头藻水华,选择环境友好的H2O2与水厂常用的氯氧化物 (NaClO) ,对拉氏尖头藻混凝过程进行预氧化处理,探究拉氏尖头藻去除的有效混凝剂量与氧化剂量,同步研究预氧化混凝过程藻丝体长度、藻细胞光合活性、水中溶解性有机物 (DOM) 以及Zeta电位等相关反应特征的变化情况,分析预氧化混凝技术对拉氏尖头藻的影响特征与去除能力,旨在为拉氏尖头藻水华的应急处置工作提供数据基础与理论支撑。
-
实验所用拉氏尖头藻富藻水采自粤西某水库,藻细胞密度为1.33×108 cells·L−1,Chl a浓度为36.98 μg·L−1,拉氏尖头藻作为优势种,其细胞密度占总细胞密度超过90%。经检测,藻水浊度为12.1 NTU,总氮为1.35 mg·L−1,总磷为0.028 mg·L−1,高锰酸盐指数为5.00 mg·L−1,溶解性有机物 (DOM) 浓度为6.56 mg·L−1。聚合氯化铝 (PACl,AlCl(OH)5,28% Al2O3) 与双醋酸荧光素 (FDA) 购自阿拉丁公司,实验所用其他试剂购自国药集团,均为分析纯级别。在实验开始之前,将H2O2、NaClO与PACl分别使用纯水配制成浓度为1 g·L−1的母液待用。
-
1) 氧化剂投加量对拉氏尖头藻混凝去除效果的影响实验。在粤西某水库收集富藻水放入1 L烧杯中,经过预实验调试合适剂量范围之后,投加不同剂量的H2O2 (0.2~0.8 mg·L−1) 或NaClO (0.8~1.4 mg·L−1) ,搅拌混匀后放置在岸边空地进行2 h的氧化预处理;随后在原水与预氧化水样中添加10 mg·L−1 PACl,以600 r∙min−1 (242 s−1) 快速搅拌2 min,以200 r∙min−1 (23 s−1) 慢速搅拌10 min;静置沉淀1 h。实验结束后收集水面以下5 cm处水样留待检测。
2) PACl剂量对拉氏尖头藻混凝去除效果的影响实验。基于1) 中实验结果选择合适剂量的H2O2和NaClO分别对拉氏尖头藻藻水进行预氧化,并添加不同浓度PACl (0~25 mg·L−1) ,混凝条件与样品采集如前所示。
3) 去除率。将预氧化与混凝处理后的水样依次检测吸光度 (OD680nm) 、Chl a与浊度,OD680nm在分光光度计 (岛津UV-
1800 ,日本) 波长680 nm下测定,Chl a浓度按照《水与废水监测分析方法 (第四版) 》采用丙酮提取-分光光度法检测,浊度由浊度仪测定 (哈希HACH 2100Q,美国) ,并由以下公式(1)计算各自去除率。式中:a0与a分别为原水与预氧化混凝处理后水样的OD680nm、Chl a或浊度。
4) 藻丝体特性表征。藻丝体形态以藻丝体长度变化表征,采用显微摄影系统 (Olympus CX33) 进行图像采集,然后利用MingHui软件对图像中的藻丝体长度进行统计分析。细胞膜的通透性以活性表征,在荧光显微镜下观察藻细胞形态特征,在绿色光下, Chl a释放红色荧光;将FDA丙酮溶液加入藻样进行染色,最终浓度为100 mg·L−1,在蓝色光下,具备正常酯酶活性的藻细胞会释放亮绿色荧光。使用浮游植物荧光光谱仪 (PHYTO-PAM,德国) 测定最大光电子产率 (Fv/Fm) 。藻体表面电性以Zeta电位表征,使用Zeta电位分析仪 (马尔文Zetasizer NanoZ,英国) 测定收集水样的Zeta电位,用于检测预氧化混凝过程藻类颗粒物表面电性变化情况[19]。
5) 余铝检测。使用校准后的移液枪取1 mL各组试验上层水样,加入5%稀硝酸溶液定容至10 mL,测定前使用注射器和孔径为0.22 μm聚醚砜 (PES) 针筒式滤膜过滤器将溶液过滤,去除溶液中的不溶性杂质。处理后的水溶液使用电感耦合等离子体质谱仪 (ICP-MS) 测定水样中溶解性铝[20]。
-
将原水和预氧化混凝处理后的水样经GFF滤膜 (Whatman,美国) 过滤,收集滤液于-20 ℃下保存留待检测。DOM浓度以溶解性总有机碳浓度 (DOC) 表征,使用有机碳分析仪 (岛津TOC-L,日本) 测定[21]。SUVA254表征DOM中可吸收紫外光的组成部分,可揭示该部分有机物的变化情况。设置紫外-可见分光光度计检测254 nm与700 nm处的吸光度,并根据校正参照公式对SUVA254进行计算[22]。原藻水的DOM浓度为6.56 mg·L−1,SUVA254为2.07。
通过荧光分光光度计 (日立FL-
7000 ,日本) 测定样品溶液的三维荧光光谱,仪器的参数设置如下:激发光谱波长 (Ex) 范围为200~450 nm,步长间隔为5 nm;发射光谱波长 (Em) 范围为250~500 nm,步长间隔为2 nm;扫描速度为30 000 nm·min−1,PTV为850 V。以超纯水作为空白样扣除拉曼散射,采用平行因子分析 (PARAFAC) 方法识别荧光组分[23]。 -
预氧化处理提高PACl对拉氏尖头藻的混凝效果,并降低PACl的消耗剂量。在H2O2 (0.2~0.8 mg·L−1) 与NaClO (0.8~1.4 mg·L−1) 预氧化后,拉氏尖头藻的去除率随氧化剂浓度增加而升高,分别在0.6 mg·L−1 H2O2与1.2 mg·L−1 NaClO处达到最优去除率;随着氧化剂浓度进一步增加,去除率趋于稳定 (图1) 。相比未氧化组,0.6 mg·L−1 H2O2使拉氏尖头藻的OD680nm去除率从28.2%升至69.2%,浊度去除率从30.8%升至66.5%,Chl a去除率从33.42%升至68.7%;1.2 mg·L−1 NaClO使拉氏尖头藻的OD680nm去除率升至76.3%,浊度去除率升至71.7%,Chl a去除率升至88.8%。JIA等[24]发现375 μmol·L−1 H2O2可将125 μmol·L−1 FeSO4对铜绿微囊藻去除率提升至90%以上,并归因于H2O2对藻细胞的氧化灭活以及表面电位绝对值的降低。MA等[25]认为NaClO会影响藻细胞的通透性并诱导胞内有机物的释放,其中的大分子有机物有助于AlCl3对铜绿微囊藻的混凝去除,并发现NaClO对藻细胞完整性与表面电位无明显影响。
当拉氏尖头藻经过H2O2或NaClO预氧化后,在0~25 mg·L−1 PACl范围内,随着PACl剂量增加,OD680nm、浊度与Chl a去除率均高于相同PACl剂量的未氧化组 (图2) 。H2O2组的OD680nm、浊度与Chl a去除率在25 mg·L−1 PACl处达到最高,分别为87.5%、84.0%与91.6%;NaClO组的OD680nm、浊度与Chl a去除率在15 mg·L−1 PACl达到最优,分别为87.5%、81.5%与95.5%。刘立明等[26]使用8 mg·L−1 K2FeO4将PACl对铜绿微囊藻Chl a去除率提高57.6%,PACl用量减少32 mg·L−1,与本研究结果相似。当去除率超过80%时,H2O2组与NaClO组需消耗15 mg·L−1 PACl,而未氧化组消耗25 mg·L−1 PACl,混凝剂消耗剂量减少40%,这不仅有助于混凝工艺的降本增效,还可以实现絮体减量。
此外,在0~25 mg·L−1 PACl范围内,H2O2组与NaClO组OD680nm与浊度的去除率无显著差异 (POD680nm=0.082,P浊度=0.739) ,但是NaClO组的Chl a去除率显著高于H2O2组 (P<0.05) ,相差4.61~24.03%。Chl a不仅与藻类生物量有关,也与单个细胞内的Chl a含量有关,说明NaClO可能具有更强的膜穿透性从而影响胞内Chl a。MA等[27]也发现NaClO氧化会引发铜绿微囊藻胞内物质的释放。H2O2与NaClO可能以不同的方式对拉氏尖头藻的混凝过程发挥强化效果。
铝残留含量事关预氧化混凝处理拉氏尖头藻藻水的健康风险。当PACl剂量为15 mg·L−1时,对照组、H2O2组与NaClO组的余铝浓度分别为0.087、0.067与0.066 mg·L−1;当PACl剂量增至25 mg·L−1时,对照组、H2O2组与NaClO组的余铝浓度分别为0.146、0.125与0.127 mg·L−1,均低于我国《生活饮用水卫生标准》 (GB5749-2022) 规定的0.2 mg·L−1的铝残留限值。预氧化处理组的余铝浓度低于未氧化组,H2O2组与NaClO组间的余铝浓度无显著差异 (P=0.992) 。藻细胞表面为带正电荷的铝离子及其水解产物提供结合位点,形成的絮体在沉降过程中可能对游离铝进一步网捕吸附,造成氧化处理组中游离铝含量的减少。
-
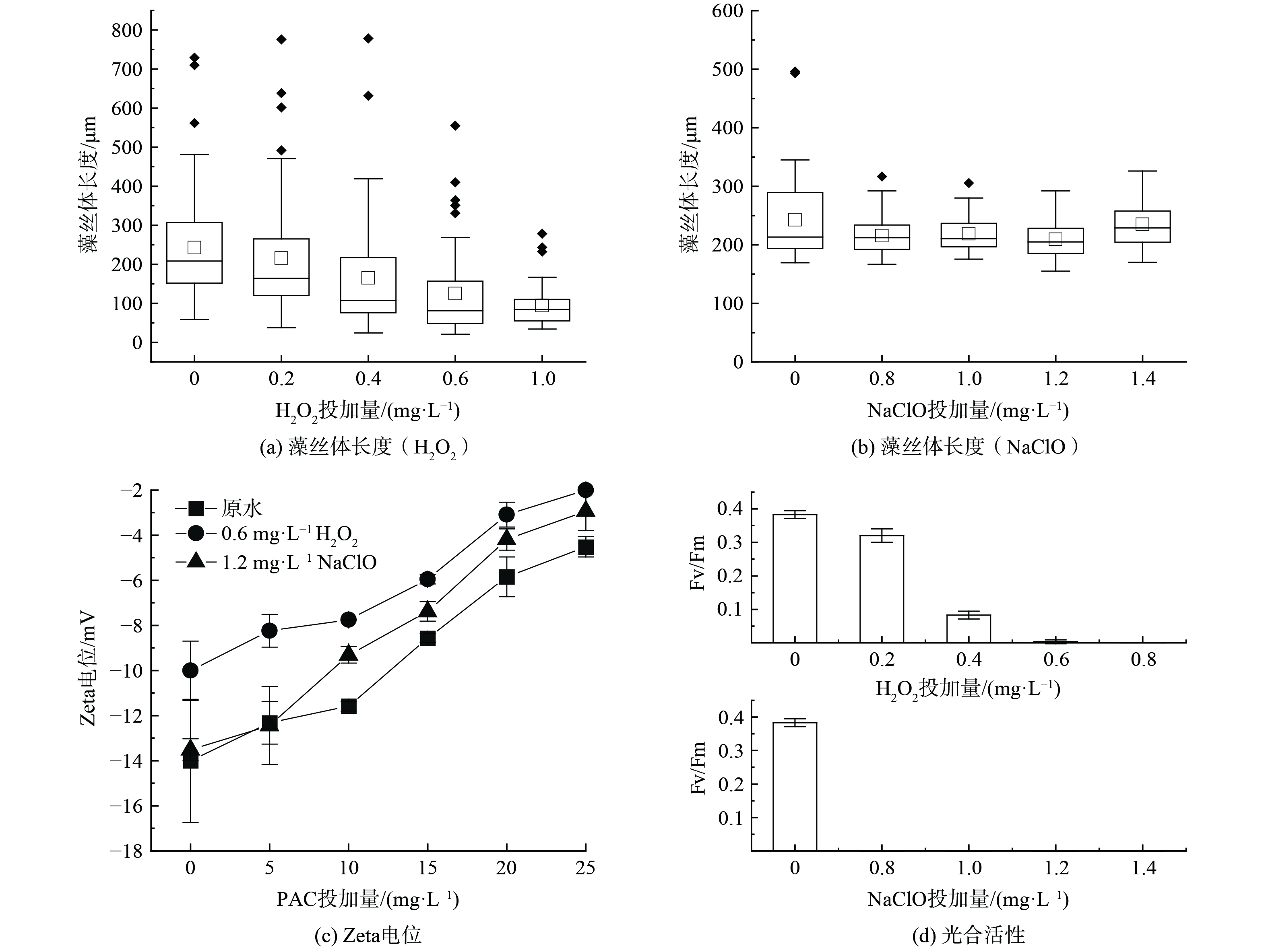
为探究预氧化处理的混凝强化方式,进一步分析拉氏尖头藻藻细胞的形态、表面电位与细胞活性等特征。如图3(a)、(b)所示,相比未氧化组与NaClO组,H2O2组藻丝体明显变短。在未氧化组中,藻丝体平均长度为242.5 μm,H2O2组藻丝体长度随H2O2浓度升高而缩短,在1.0 mg·L−1 H2O2时仅为94.5 μm,藻丝体长度与H2O2浓度呈负相关;NaClO组藻丝体长度在0.8~1.2 mg·L−1浓度范围内为209.6~218.9 μm,相比原水的藻丝体长度略有降低,但与NaClO浓度无明显相关性 (P=0.729) ,这说明H2O2对拉氏尖头藻细胞表面具有较强的侵蚀作用。H2O2在水体中易产生羟基自由基 (·OH) ,氧化还原电位达2.8 mV,高于ClO−或MnO42-,可能对细胞表面物质具有氧化降解作用。多数研究认为氯氧化作用虽然改变藻细胞通透性与部分内源物质释放,但是不会破坏藻细胞的完整性。尽管如此,添加NaClO后的藻丝体相比原水藻丝体仍略有降低,推测藻丝体部分细胞间连接较为脆弱的位置也容易被NaClO氧化降解。
表面电位也反映了藻细胞表面的变化。如图3(c)所示,未经处理的原水中,藻细胞Zeta电位为−14 mV,0.6 mg·L−1 H2O2使其升至−10 mV,1.2 mg·L−1 NaClO对Zeta电位无明显影响,两种氧化剂对藻细胞Zeta电位的影响存在差异。JIA等[24]发现“紫外光+H2O2”法可使铜绿微囊藻Zeta电位从−54.5 mV提升至−33.8 mV。H2O2可以降低体系内的负电性,Zeta电位绝对值越低,藻细胞间静电斥力越弱,从而提高藻细胞混凝效果。相比H2O2,NaClO未明显改变藻细胞Zeta电位。MA等[17]也发现NaClO预氧化对铜绿微囊藻细胞表面电位无明显影响[25]。KMnO4对微囊藻Zeta电位无明显影响,与NaClO结果类似,推测与氧化能力有关。
通过Fv/Fm、叶绿素自发荧光与酯酶活性 (FDA荧光) 分析预氧化对藻细胞活性的影响。如图3(d)所示,两种氧化剂明显削减藻细胞的Fv/Fm。H2O2组中,随着H2O2剂量升至0.4 mg·L−1,Fv/Fm从0.39降低至0.07,在最优剂量0.6 mg·L−1下,Fv/Fm值为0;NaClO组中,在0.8~1.4 mg·L−1NaClO之间均未检测到光合活性,NaClO对拉氏尖头藻光合活性具有显著抑制作用。显微镜镜检结果表明,尽管光合活性未检出,胞内Chl a仍可发出荧光,表明光合色素未被完全氧化降解 (图4) ,推测氧化过程未破坏胞内结构,但是抑制胞内光合系统的正常运行。值得注意的是,在相同的激发光下,NaClO组观察到的Chl a自发荧光弱于H2O2组与正常对照组,说明NaClO造成部分Chl a的荧光淬灭。预氧化对胞内酯酶活性的影响与光合活性类似,经H2O2或NaClO预氧化处理后,FDA未能在藻细胞内发射绿色荧光,这意味着细胞膜的完整性受损或酯酶代谢的减弱。
-
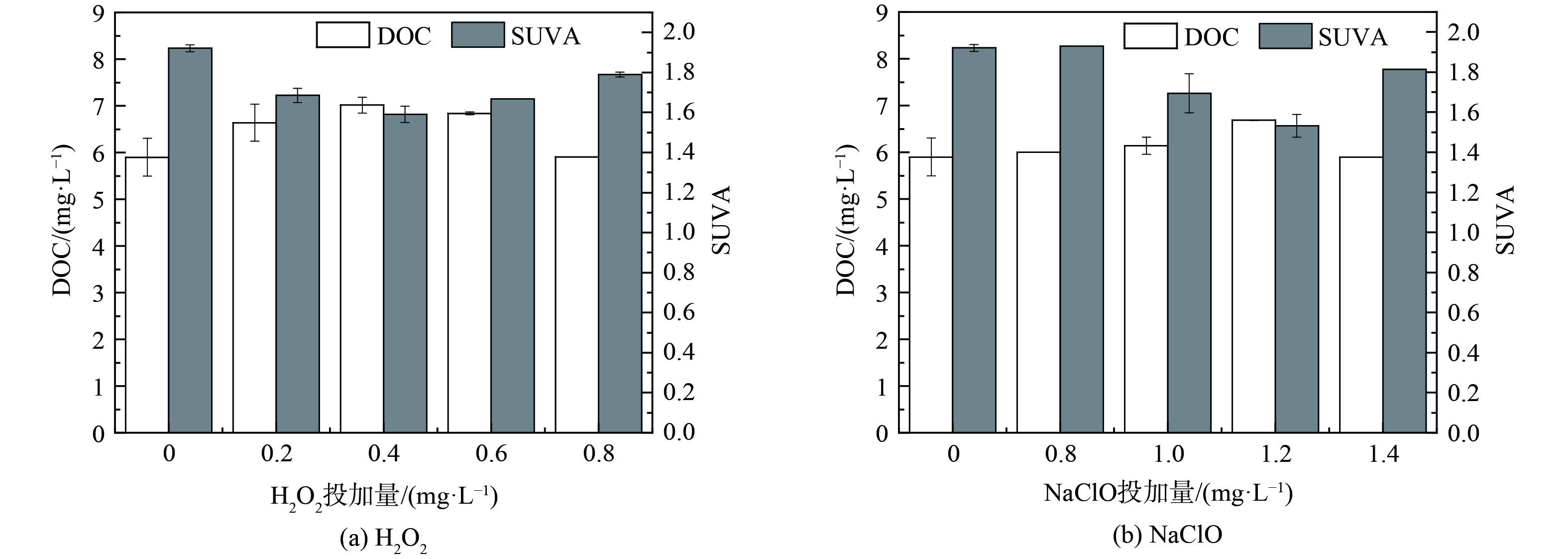
鉴于氧化剂对藻细胞活性的影响,部分藻源性有机物可能释放到胞外,并对混凝效果产生影响,这些有机物包含蛋白质、多糖、腐殖质等大分子物质[28]。如图5所示,随着氧化剂浓度升高,DOM浓度先升高后下降,SUVA254反之。在H2O2组中,当H2O2浓度增至0.6 mg·L−1,DOM浓度升至7.01 mg·L−1;在NaClO组中,当NaClO浓度增至1.2 mg·L−1时,DOM浓度升至6.68 mg·L−1;进一步增加H2O2和NaClO剂量,DOM浓度降为5.90 mg·L−1和5.94 mg·L−1,说明氧化作用诱导藻源性有机物释放[29],且该过程较为温和,当氧化剂浓度较高时,氧化剂对藻源有机物的降解能力超过其释放到胞外的速度,DOM浓度反而下降。LIU等[30]也发现部分DOM在预氧化过程发生降解。与原水相比 (DOM为6.56 mg·L−1) ,预氧化混凝处理未造成藻水DOM浓度明显升高,证明在0.2~0.8 mg·L−1 H2O2与0.8~1.4 mg·L−1 NaClO剂量范围内预氧化处理的安全性。SUVA254用于表征藻水DOM的有色组分丰度,包含蛋白质与腐殖质,它们通常为强负电性的难降解组分[31]。当H2O2与NaClO分别增至0.4 mg·L−1和1.2 mg·L−1时,SUVA254分别降至1.59和1.53,说明氧化剂对蛋白质或腐殖质等有色有机物具有降解能力[32]。
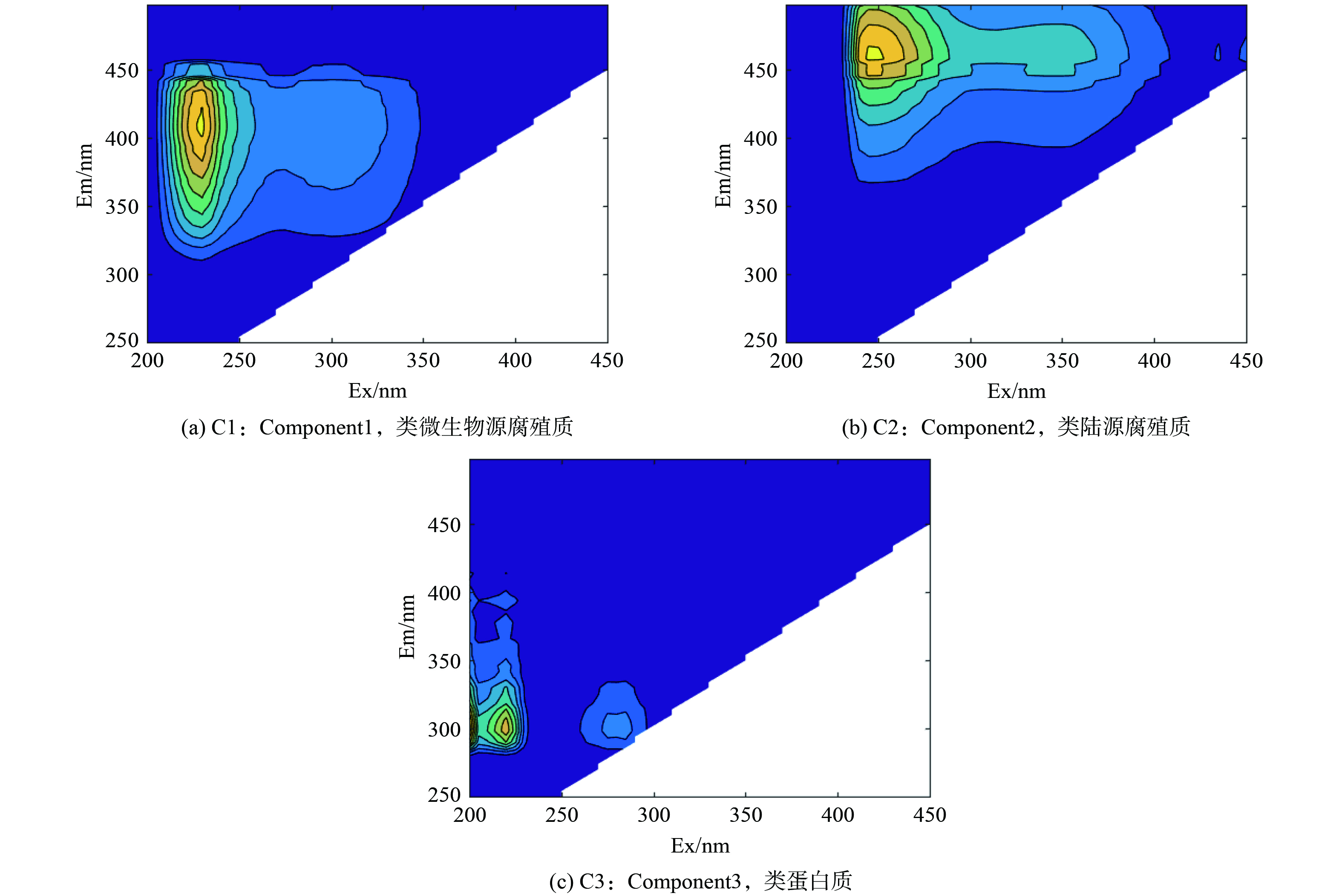
进一步识别有色有机物组分的变化特征,经PARAFAC分析筛选,藻水在预氧化混凝处理过程中出现3种荧光组分 (图6) :C1组分 (Ex:230/305 nm,Em:420 nm) 为微生物源的类腐殖质组分,C2组分 (Ex:245 nm,Em:460 nm) 代表了陆源的类腐殖质组分[33-34],C3组分 (Ex:200/220 nm,Em:306 nm) 代表了类蛋白质组分,该组分与水中藻类等水生生物的代谢活动高度相关[31]。
类腐殖质组分与类蛋白质组分是DOM中携带高密度负电荷的大分子物质,影响藻细胞的混凝效果[35]。不同于DOM浓度,随着H2O2剂量增多,C1组分降至0.162 R.U.,H2O2可以显著降解微生物源腐殖质类有机物;C2组分先升高后降低,在0.4 mg·L−1处最高为0.166 R.U.;C3组分先降低后升高,在0.6 mg·L−1处最低为0.093 R.U.,在0.8 mg·L−1处升至0.138 R.U.,说明低浓度H2O2可以降低DOM中的类蛋白质有机物含量,但是较高浓度H2O2可能反而造成胞外蛋白质组分增多(图7)。当NaClO剂量为1.0 mg·L−1时,C1组分降至0.190 R.U.,随后升至0.201 R.U.,NaClO对微生物源腐殖质降解能力较H2O2弱;C2组分在0.8~1.0 mg·L−1约为0.150 R.U.,在1.0~1.4 mg·L−1升至0.172 R.U.;C3组分不受NaClO影响 (P=0.138) ,NaClO氧化作用没有引发明显的胞内蛋白质释放(图7)。在本研究中,0.2~0.6 mg·L−1 H2O2与0.8~1.2 mg·L−1 NaClO均未造成明显的胞内有机物释放行为,与其他研究结论一致[18,28]。
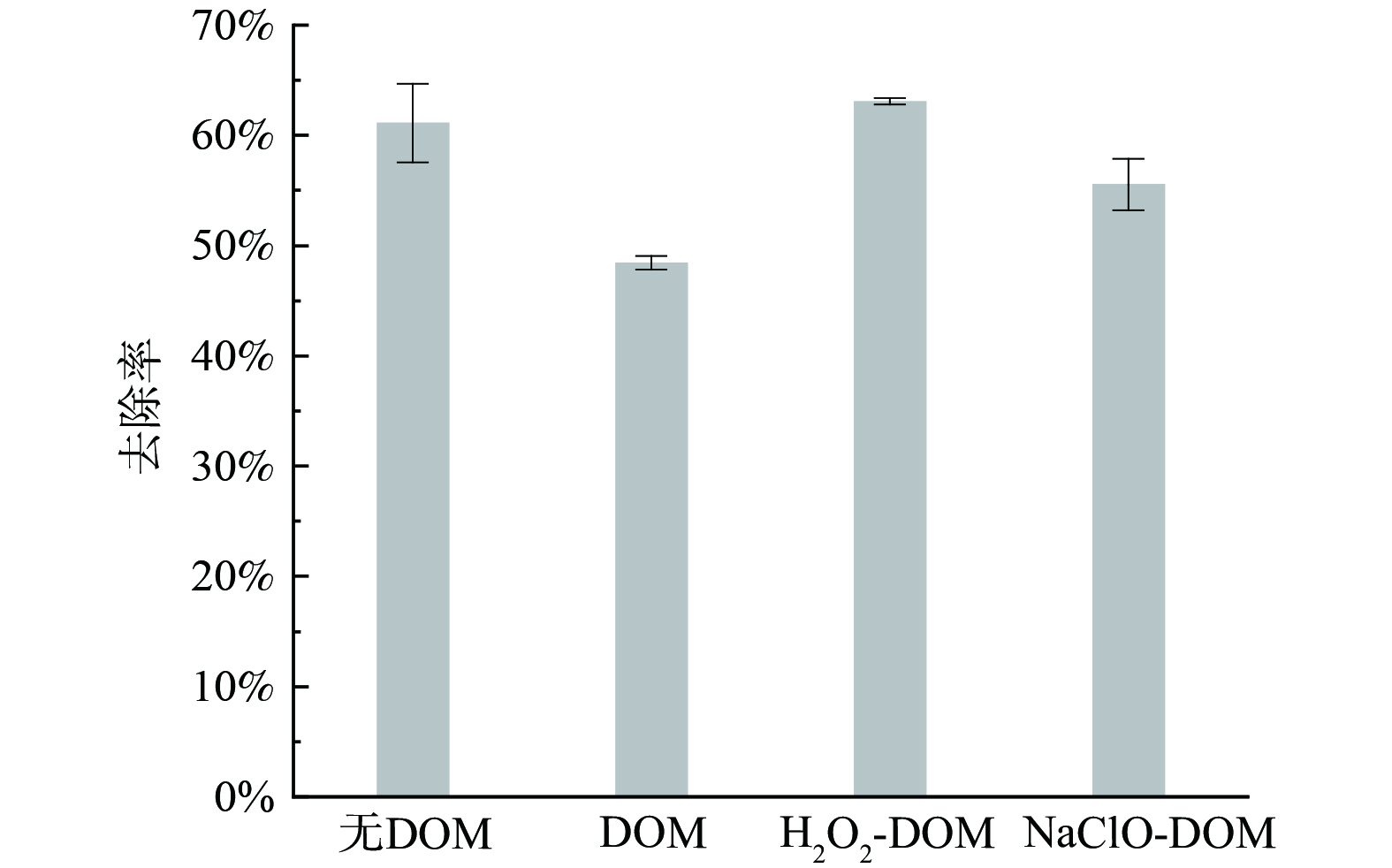
类腐殖质组分与类蛋白组分随着氧化剂剂量增多而下降,说明氧化剂可以降解部分强负电性的有机物,阻止它们与PACl螯合形成溶解性复合物,从而提高藻细胞对PACl的竞争力[36]。SAFARIKOVA等[37]和HANUMANTH等[38]则认为低浓度的藻源性有机物尤其是蛋白质类组分可以在藻细胞混凝过程中发挥架桥作用而提高混凝效果。为探究氧化后DOM对藻细胞混凝效果的独立影响,将氧化处理的藻水滤液与正常的藻细胞重新混合,并以原藻水滤液为对照组 (DOM) ,以藻细胞单独混凝为空白组 (无DOM) ,相比对照组的去除率仅为48.4%,空白组、NaClO组与H2O2组的去除率分别升至61.1%、55.5%与63.1% (图8) 。考虑到水体中的无机物质较为稳定,H2O2组去除率的提升可能主要受DOM特征变化影响。当DOM被分离,PACl对剩余藻细胞的去除率提高,2种氧化剂处理后的DOM与正常藻细胞再次混合,混凝去除率同样提高。这一结果意味着DOM中蛋白质类或腐殖质类组分的减少可能是拉氏尖头藻预氧化处理后混凝效果改善的关键原因之一。考虑到DOM组分的复杂性与易变性,拉氏尖头藻胞外DOM对其预氧化混凝去除过程的影响机制需要进一步的研究进行解析。
-
1) 低浓度预氧化处理 (0.6 mg·L−1 H2O2与1.2 mg·L−1 NaClO) 可将PACl消耗剂量从25 mg·L−1降至15 mg·L−1,并将拉氏尖头藻去除率提升至80%以上。
2) H2O2或NaClO均可引发藻细胞活性降低提高藻细胞沉降能力,H2O2还可降低藻细胞表面负电性;同时H2O2与NaClO导致胞外DOM浓度升高以及强负电性组分 (如蛋白质与腐殖质) 减少,这些可能是预氧化处理提高拉氏尖头藻混凝效果的原因。
3) 以H2O2与NaClO为代表的低剂量预氧化处理均未造成拉氏尖头藻胞内物质大量释放。预氧化处理用于提高拉氏尖头藻混凝效果具备可行性。考虑H2O2的环境友好属性及其更低的剂量消耗,在拉氏尖头藻水华应急处置工作中,可优先选择H2O2进行预氧化处理。
预氧化对聚铝混凝去除拉氏尖头藻水华的影响
Effects of pre-oxidation on the removal of Raphidiopsis raciborskii by coagulation with polyaluminum chloride
-
摘要: 以拉氏尖头藻 (Raphidiopsis raciborskii) 为优势种的有毒有害蓝藻水华在我国南方地区湖库水体频繁暴发,严重影响当地水生态健康与用水安全,拟采用过氧化氢 (H2O2) 与次氯酸钠 (NaClO) 研究预氧化混凝技术对拉氏尖头藻藻水的处置效果。通过测定藻丝体长度、表面电位、活性及溶解性有机物,分析预氧化促进混凝效果的原因。结果表明,随着氧化剂或混凝剂剂量增加,拉氏尖头藻去除率升高,0.6 mg·L−1 H2O2或1.2 mg·L−1 NaClO可将聚合氯化铝 (PACl) 消耗剂量从25 mg·L−1降低至15 mg·L−1,且去除率>80%。预氧化处理后,藻细胞Fv/Fm从0.39降至0.07以下,且荧光显微镜未能观察到酯酶活性,说明藻细胞失活,膜通透性升高。H2O2使藻水Zeta电位从−14 mV升至−10 mV,可促进PACl对藻细胞的静电中和作用,而NaClO对Zeta电位无明显影响。H2O2与NaClO分别使藻水溶解性有机物 (DOM) 浓度从5.95 mg·L−1升至7.01 mg·L−1与6.68 mg·L−1,但是强负电性的蛋白质组分与腐殖质组分含量明显降低,H2O2与NaClO处理的DOM可分别将藻细胞去除率提高13.7%和7.1%,说明预氧化处理可通过影响DOM特征而促进藻细胞的混凝效果。本研究为预氧化混凝处置拉氏尖头藻的有效性与安全性提供数据支撑与理论依据,该技术在拉氏尖头藻原位应急处置工作具有较好的应用潜力。Abstract: Toxic and harmful cyanobacteria blooms with Raphidiopsis raciborskii as the dominant species have erupted frequently in lakes and reservoirs in Southern China, seriously affecting local ecological health and water safety. In this investigation, hydrogen peroxide (H2O2) and sodium hypochlorite (NaClO) were used to study the treatment effect of preoxidation coagulation technology on the disposal of algal water of Raphidiopsis raciborskii. By measuring the length, surface potential, activity and dissolved organic matter of algal filament, the reason why preoxidation promotes coagulation effect is analyzed. The results showed that an escalation in the dosage of oxidants or coagulants correspondingly heightens the removal efficiency of Raphidiopsis raciborskii. Specifically, doses of 0.6 mg·L−1 H2O2 or 1.2 mg·L−1 NaClO reduced the polyaluminum chloride (PACl) dosage from 25 mg·L−1 to 15 mg·L−1, achieving a removal efficiency surpassing 80%. Post oxidation treatment, Fv/Fm of algal cells plummeted from 0.39 to below 0.07, and esterase activity was not observed by fluorescence microscopy, indicating that algal cells were deactivated and membrane permeability increased. H2O2 elevated the Zeta potential of algal water from -14 mV to -10 mV, facilitating the electrostatic neutralization of PACl on algal cells, while NaClO exhibited negligible impact on the Zeta potential. Both H2O2 and NaClO augmented the dissolved organic matter (DOM) concentration in algal water from 5.95 mg·L−1 to 7.01 mg·L−1 and 6.68 mg·L−1, respectively. However, the content of strongly negatively charged protein and humic substance components exhibited a notable decrease with H2O2 or NaClO treatment, resulting in a 13.7% or 7.1% enhancement in algal cell removal efficiency. This implies that preoxidation treatment can enhance coagulation effectiveness by influencing DOM characteristics. The outcomes of this study furnish data support and a theoretical foundation for the effectiveness and safety of oxidation coagulation in the treatment of Raphidiopsis raciborskii, underscoring its potential utility in the in-situ emergency disposal of Raphidiopsis raciborskii blooms.
-
Key words:
- Raphidiopsis raciborskii /
- blooming /
- preoxidation /
- coagulation /
- dissolved organic matters
-

-
-
[1] LU Z, LEI L M, LU Y, et al. Phosphorus deficiency stimulates dominance of Cylindrospermopsis through facilitating cylindrospermopsin-induced alkaline phosphatase secretion: Integrating field and laboratory-based evidences[J]. Environmental Pollution, 2021, 290: 117946. doi: 10.1016/j.envpol.2021.117946 [2] YANG Y M, YU G L, CHEN Y X, et al. Four decades of progress in cylindrospermopsin research: The ins and outs of a potent cyanotoxin[J]. Journal of Hazardous Materials, 2021, 406: 124653. doi: 10.1016/j.jhazmat.2020.124653 [3] 雷腊梅, 雷敏婷, 赵莉, 等. 入侵蓝藻—拟柱胞藻的分布特征及生理生态研究进展[J]. 生态环境学报, 2017, 26(03): 531-537. [4] JIANG Y, XIAO P, YU G L, et al. Sporadic distribution and distinctive variations of cylindrospermopsin genes in cyanobacterial strains and environmental samples from Chinese freshwater bodies[J]. Applied and Environmental Microbiology, 2014, 80(17): 5219-5230. doi: 10.1128/AEM.00551-14 [5] LEI L M, PENG L, HUANG X H, et al. Occurrence and dominance of Cylindrospermopsis raciborskii and dissolved cylindrospermopsin in urban reservoirs used for drinking water supply, South China[J]. Environmental Monitoring and Assessment, 2014, 186(5): 3079-3090. doi: 10.1007/s10661-013-3602-8 [6] LEI L M, LEI M T, CHENG N, et al. Nutrient regulation of relative dominance of cylindrospermopsin-producing and non-cylindrospermopsin-producing Raphidiopsis raciborskii[J]. Frontiers in Microbiology, 2021, 12: 793544. doi: 10.3389/fmicb.2021.793544 [7] 薛现光, 方光宏, 邹楚均, 等. 大沙河水库拟柱孢藻昼夜垂直分布特征[J]. 生态学杂志, 2020, 39(7): 2348-2355. [8] HENDERSON R, PARSONS S A, JEFFERSON B. The impact of algal properties and pre-oxidation on solid-liquid separation of algae[J]. Water Research, 2008, 42: 1827-1845. doi: 10.1016/j.watres.2007.11.039 [9] EDZWALD J K. Algae, bubbles, coagulants, and dissolved air flotation[J]. Water Science and Technology, 1993, 27(10): 67-81. doi: 10.2166/wst.1993.0207 [10] 宋金思. 聚合氯化铝混凝去除铜绿微囊藻的实验研究[D]. 湘潭: 湘潭大学, 2011. [11] CHEN J J, YRH H H, TSENG I C. Effect of ozone and permanganate on algae coagulation removal-pilot and bench scale tests[J]. Chemosphere, 2009, 74(6): 840-846. doi: 10.1016/j.chemosphere.2008.10.009 [12] 任鹏飞, 蒋白懿, 何南浩, 等. 混凝/预氧化去除微污染水源水中拟柱孢藻的效能[J]. 中国给水排水, 2019, 35(11): 21-25. [13] 赵春禄, 侯孝来, 孙鹏程. H2O2预氧化颤藻及其复合高岭土除藻性能研究[J]. 环境工程学报, 2011, 5(2): 357-360. [14] 邱丽佳. H2O2及O3氧化两种典型蓝藻致嗅物质和灭藻效应研究[D]. 北京: 北京建筑大学, 2017. [15] 陈伯俭. 南水北调(邯郸段)水源水预氧化-强化混凝试验研究[D]. 邯郸: 河北工程大学, 2020. [16] 李春梅. 预氧化对南方某水库中藻类控制效果的研究[D]. 长沙: 湖南大学, 2018. [17] MA J Y, JIA B T, LI S, et al. Enhanced coagulation of covalent composite coagulant with potassium permanganate oxidation for algae laden water treatment: Algae and extracellular organic matter removal[J]. Chemical Engineering Journal Advances, 2023, 13: 100427. doi: 10.1016/j.ceja.2022.100427 [18] LIN J L, HUANG C, WANG W M. Effect of cell integrity on algal destabilization by oxidation-assisted coagulation[J]. Separation and Purification Technology, 2015, 151: 262-268. doi: 10.1016/j.seppur.2015.07.064 [19] CAI Q J, GONG S H, SONG K Z, et al. Effective harvesting of Scenedesmus using quaternary ammonium chitosan and xanthan gum: Formation of mega flocs with oppositely charged polyelectrolytes[J]. Journal of Cleaner Production, 2021, 329: 129730. doi: 10.1016/j.jclepro.2021.129730 [20] 凌卫卫. 高温季节深度处理水厂二氧化碳控铝研究[J]. 中国给水排水, 2023, 39(13): 66-70. [21] CAI Q J, SONG K Z, TIAN C C, et al. Harvesting of Microcystis from waterbody by flocculation and filtration: the essential role of extracellular organic matters[J]. Journal of Water Process Engineering, 2021, 41: 102053. doi: 10.1016/j.jwpe.2021.102053 [22] SONG K S, LI L, TEDESCO L, et al. Spectral characterization of colored dissolved organic matter for productive inland waters and its source analysis[J]. Chinese Geographical Science, 2014, 25(3): 295-308. [23] CAI Q J, CAI P, XU L, et al. Role of lake dissolved organic matter in cyanobacteria removal by cationic polyacrylamide flocculation and screen filtration[J]. Separation and Purification Technology, 2023, 311: 123350. doi: 10.1016/j.seppur.2023.123350 [24] JIA P L, ZHOU Y P, ZHANG X F, et al. Cyanobacterium removal and control of algal organic matter (AOM) release by UV/H2O2 pre-oxidation enhanced Fe(II) coagulation[J]. Water Research, 2018, 131: 122-130. doi: 10.1016/j.watres.2017.12.020 [25] MA M, LIU R P, LIU H J, et al. Effects and mechanisms of pre-chlorination on Microcystis aeruginosa removal by alum coagulation: Significance of the released intracellular organic matter[J]. Separation and Purification Technology, 2012, 86: 19-25. doi: 10.1016/j.seppur.2011.10.015 [26] 刘立明, 李丽萍, 黄应平. 高铁酸钾/PAC氧化-混凝去除水体中铜绿微囊藻[J]. 生态科学, 2013, 32(6): 686-691. [27] MA M, LIU R P, LIU H J, et al. Chlorination of Microcystis aeruginosa suspension: Cell lysis, toxin release and degradation[J]. Journal of Hazardous Materials, 2012, 217-218: 279-85. doi: 10.1016/j.jhazmat.2012.03.030 [28] QI J, MA B W, MIAO S Y, et al. Pre-oxidation enhanced cyanobacteria removal in drinking water treatment: A review[J]. Journal of Environment Science (China), 2021, 110: 160-168. doi: 10.1016/j.jes.2021.03.040 [29] PARK J W, KIM H C, MEYER A S, et al. Influences of NOM composition and bacteriological characteristics on biological stability in a full-scale drinking water treatment plant[J]. Chemosphere, 2016, 160: 189-198. doi: 10.1016/j.chemosphere.2016.06.079 [30] LIU X L, WANG J Q, LIU T T, et al. Effects of assimilable organic carbon and free chlorine on bacterial growth in drinking water[J]. Plos One, 2015, 10(6): e0128825. doi: 10.1371/journal.pone.0128825 [31] ZHANG Y L, ZHOU Y Q, SHI K, et al. Optical properties and composition changes in chromophoric dissolved organic matter along trophic gradients: Implications for monitoring and assessing lake eutrophication[J]. Water Research, 2018, 131: 255-263. doi: 10.1016/j.watres.2017.12.051 [32] 邱丽佳. H2O2氧化铜绿微囊藻致嗅物质及灭藻效应研究[J]. 环境科学学报, 2017, 37(3): 954-961. [33] ZHOU Y Q, XIAO Q T, YAO X L, et al. Accumulation of terrestrial dissolved organic matter potentially enhances dissolved methane levels in eutrophic Lake Taihu, China[J]. Environment Science Technology, 2018, 52(18): 10297-10306. doi: 10.1021/acs.est.8b02163 [34] CHEN Y H, YU K F, ZHOU Y Q, et al. Characterizing spatiotemporal variations of chromophoric dissolved organic matter in headwater catchment of a key drinking water source in China[J]. Environmental Science & Pollution Research, 2017, 24(36): 27799-27812. [35] SILLANPAA M, NCIBI M C, MATILAINEN A, et al. Removal of natural organic matter in drinking water treatment by coagulation: A comprehensive review[J]. Chemosphere, 2018, 190: 54-71. doi: 10.1016/j.chemosphere.2017.09.113 [36] SANO D, ISHIFUJI S, SATO Y, et al. Identification and characterization of coagulation inhibitor proteins derived from cyanobacterium Microcystis aeruginosa[J]. Chemosphere, 2011, 82(8): 1096-1102. doi: 10.1016/j.chemosphere.2010.12.005 [37] SAFARIKOVA J, BARESOVA M, PIVOKONSKY M, et al. Influence of peptides and proteins produced by cyanobacterium Microcystis aeruginosa on the coagulation of turbid waters[J]. Separation and Purification Technology, 2013, 118: 49-57. doi: 10.1016/j.seppur.2013.06.049 [38] RAO N R H, GRANVILLE A M, WICH P R, et al. Detailed algal extracellular carbohydrate-protein characterisation lends insight into algal solid-liquid separation process outcomes[J]. Water Research, 2020, 178: 115833. doi: 10.1016/j.watres.2020.115833 -




 下载:
下载: