-
湖泊是地表水资源的重要载体,是自然生态中不可或缺的一部分。当前,富营养化已成为中国内陆湖泊面临的最大环境挑战。据统计,110个被监测的重要湖库中,中度富营养及以上的湖库大约占90%,贫营养湖库仅占10%左右[1],而水体中氮磷含量超标是水体富营养化的直接威胁因子。随着湖泊富营养化程度的日趋严重,氮磷等营养物质会通过一系列物理、化学和生物作用汇入沉积物中,沉积物成为湖泊氮磷营养元素的重要储存载体。当外界条件发生改变时,这些营养物质会从底泥中释放到上覆水,加速水体的营养化[2-3]。因此在湖泊污染治理过程中,必须考虑如何减少沉积物释放氮磷的内源污染,这使得针对沉积物-水界面氮磷迁移转化规律的研究尤为重要[4-5]。
国内外对于沉积物-水交换界面氮磷的迁移转化进行了部分研究,国外学者MORTIMER[6]率先提出沉积物的内源释放概念,此后沉积物与上覆水界面的营养盐交换成为研究热点。BOERS等[7]与BOLALEK等[8]分别根据浓度梯度估算法、实验室连续流系统法,发现氮磷的界面扩散通量与环境因子之间具有良好的相关性[9-10]。文帅龙等[11]、WANG等[12]和杨平等[13]分别对大黑汀水库,丹江口水库,九龙江河口中沉积物进行研究实验,结果表明各点沉积物均表现为水环境氮磷的“源”,沉积物是水体上覆水中营养盐的重要来源。目前国内外已开展部分大型湖泊、河流及水库沉积物内源污染物迁移转化规律的研究,然而针对城市浅水湖泊内源氮磷交换通量的季节性变化等研究相对较少。随着生态保护的重视,许多大型湖泊、流域富营养化得到了改善,但浅水湖泊富营养状况改善缓慢。其根本原因在于浅水湖泊的环境容量较小、湖泊自净能力不足且营养盐稀释能力较弱。当浅水湖泊外源污染得到有效控制后,其更容易受到内源污染的影响[14]。并且,浅水湖泊内源氮磷作用机制和环境影响等基础信息的缺乏,阻碍了此类湖泊富营养化的有效治理。摸清湖泊沉积物-上覆水界面氮磷交换通量的变化规律,估算界面交换对水体氮磷的潜在贡献率并探讨环境因子影响,是开展湖泊水环境精准治理的前置性工作,因此尤为重要。
国内约60%的浅水湖泊集中于长江中下游地区[15],其中大冶湖是长江中下游地区重要的典型中层型浅水城市湖泊,也是湖北省首批重点省控湖泊之一,具有防汛调洪、农业灌溉、渔业养殖等多种功能,被称为湖北黄石市人民的“母亲湖”。大冶湖流域作为承载黄石未来发展的重要地区,其良好的生态环境密切关系着黄石市的转型发展之路。然而,近年来大冶湖营养状态从轻度富营养上升至中度富营养,水体营养状态指数呈逐步上升的态势[16]。探明大冶湖沉积物-水界面氮磷交换的变化规律,解析其氮磷的内源污染状况,对于减缓湖泊水体富营养化进程,改善城市浅水湖泊水质具有重要意义。因此,本研究以大冶湖为研究对象,对比探究冬夏两季沉积物-上覆水界面氮磷的迁移释放行为,估算界面交换对水体氮磷的潜在贡献率,并考察扰动、温度、溶解氧、水体pH等环境因子对氮磷迁移转化规律的影响,为厘清长江中下游城市浅水湖泊富营养化内源污染贡献、设计湖泊内源负荷控制方案提供科学支撑。
-
大冶湖位于湖北省黄石市,其所辖的大冶市位于湖岸的西侧。湖泊水面中心地理坐标为东经115°54′6′′,北纬30°5′25′′。大冶湖流域属于长江河床冲积平原过渡地带。地形表现为由西向东倾斜,西部下袁湖海拔14.6 m,中部磊山湖海拔13.5 m,东部港底海拔11.0 m,属亚热带季风气候区,冬季温和少雨,夏季高温多雨,季风发达,雨热同期。大冶湖水体自西向东流动,本研究设置了3个常规监测断面(点),即大冶湖大桥断面(省控),磊山湖心断面(省控),大冶湖闸断面(国控)。采样点信息见图1和表1。
-
冬季(枯水期)和夏季(丰水期)的采样时间分别为2022年2月和8月。根据水质 采样技术指导(HJ 494-2009)采集沉积物及上覆水,采样过程保证无扰动并保持沉积物-水界面完整无损。利用抓斗式采样器在每个点位采集0~10 cm深度的表层沉积物,将泥样装入自封袋中做标记。同时使用有机玻璃采样器采集底层原位上覆水(底层以上10~15 cm),将采集的上覆水装入采样瓶。采集的泥样和水样被迅速带回实验室于4 ℃冷藏备用。采样时记录每个点位上覆水温度、pH及溶解氧(DO)。
-
采样现场使用便携式多参数测定仪测定温度、pH及溶解氧(DO)。水样中TN、NH4+-N、TP、PO43−-P的测定参考《水和废水监测分析方法》(第四版)[17]。TN采用碱性过硫酸钾氧化紫外分光光度法(检出限0.05 mg·L−1)测定,NH4+-N采用纳氏试剂分光光度法(检出限0.025 mg·L−1)测定,TP及PO43−-P采用钼酸铵分光光度法(检出限0.01 mg·L−1)测定。
-
上覆水氮磷交换通量估算:实验采样时间分为冬夏两季,每次实验周期28 d,第1~7天每24 h取样1次,之后每48 h取样1次。每组实验设置2个平行样品和1个空白样品。考虑到沉积物厚度和水位高度,泥水比设定为1:5,培养柱总高度为35 cm,内径为10 cm。上覆水采用孔径为0.45 μm的滤膜滤掉藻类等浮游生物。为防止对沉积物造成扰动,采用虹吸法注水。待培养柱内泥水稳定后开始连续取样,直至质量浓度达到稳定。每次用注射器从取水口抽取100 mL,用注射器将相同体积的原水从进水口补充进去,并根据体积修正稀释造成的误差。
沉积物氮磷释放的影响规律:实验底泥采自夏季丰水期磊山湖心的2#点位,水样为同期采集的底泥上覆水。将沉积物平铺于有机玻璃柱底部,上覆水缓缓加入后静置,泥水比与培养柱高度同上。结合大冶湖实际情况,设置扰动、温度、溶解氧和pH等4个环境因子进行实验。扰动实验装置在静态释放通量实验装置的基础上,增加扰动装置(所填充底泥上部5 cm处增设搅拌器)构建而成,搅拌器进行搅拌使下层底泥再悬浮。温度、溶解氧和pH实验开始后,每12 h取1次上覆水样品,每次用注射器从取水口抽取100 mL,再将相同体积的原水从进水口补入。每个因素实验周期7 d,整个实验周期28 d。每组实验设置2个平行样品和1个空白样品。
扰动影响实验:上覆水中增加扰动装置(所填充底泥上部5 cm处增设搅拌器)构建而成,搅拌器进行搅拌使下层底泥再悬浮。设置0、100、200和300 r·min−1 4个扰动组,取样间隔为0.5、l、2、3、5、10、15、24、48 h,直至质量浓度趋于稳定状态。温度影响实验:将反应装置分别置于10、20、30 ℃的控温水浴箱中进行避光培养。溶解氧影响实验:实验分为好氧、正常及厌氧状态。好氧状态利用曝气装置使溶解氧达到平衡,DO>7.0 mg·L−1;正常氧状态为2 mg·L−1<DO<7 mg·L−1;厌氧状态将反应装置利用橡胶塞密封保存,持续消耗溶解氧至<2.0 mg·L−1。pH影响实验:设置酸性、中性和碱性3个条件,分别使用0.1 mol·L−1 HCl和0.1 mol·L−1 NaOH将反应装置上覆水pH调节至4、7和10。
-
沉积物-上覆水的交换通量由上覆水营养盐质量浓度的净变化速率平均值(式(1))来表示[18]。
式中:M为交换通量,mg·(m2·d)−1,正值代表营养盐从沉积物向上覆水扩散,负值代表营养盐从上覆水向沉积物扩散;S为培养柱的截面积,m2;Δt为培养时间的变化量,d;At为在t时间内上覆水营养盐的质量变化量,mg,计算方法如式(2)所示。
式中:V为培养柱内上覆水的总体积,L;Ct为t时刻上覆水中营养盐质量浓度,mg·L−1;Dt−1为t−1时刻上覆水中实际营养盐质量浓度,mg·L−1。
在t−1时刻取出体积为V0的上覆水水样,再加入相同体积V0的现场水样后,由t−1~t时刻这段时间上覆水的实际质量浓度会受到影响,需根据式(3)进行修正。
式中:V0为每次所取上覆水体积,L;C0为原始时刻上覆水中营养盐的质量浓度,mg·L−1;Ct-1为t−1时刻上覆水中营养盐的质量浓度,mg·L−1。
-
在水体原有营养盐浓度基础上,根据式(4)估算沉积物-上覆水界面交换对水中氮磷的潜在贡献率[19-20]。
式中:P为氮磷含量的潜在贡献率,%;A为培养柱的内截面面积,m2;h为培养柱中的水的深度,m,本研究中为0.25 m;H为对应点位平均水深,m;C0为实验用水的本底营养盐质量浓度,mg·L−1;C为培养实验稳定后水体的营养盐质量浓度,mg·L−1;C1为对应点位现存营养盐质量浓度,mg·L−1。
-
TN作为沉积物中氮含量的重要指标,其交换通量标志着沉积物向上覆水体提供氮素的能力[21]。由图2(a)~(b)可知,在实验的初始阶段,各点位TN的交换通量都比较大,交换过程比较强烈,随时间的增加,交换通量下降,变化幅度逐渐减小,交换过程逐渐平缓,在第15天后慢慢趋于0,即上覆水和间隙水达到浓度平衡。冬季交换通量大部分为正值,平衡之后呈正负交替;夏季交换通量均为正值,说明TN由沉积物向上覆水迁移扩散。NH4+-N的变化趋势与TN相似,如图2(c)~(d)所示,在实验的初始阶段,1#、2#和3#点位NH4+-N的释放量达到最大,第3天后,交换通量呈下降趋势,第20天后逐渐趋于0,即上覆水达到浓度平衡。冬夏两季3个点位NH4+-N的交换通量均大于零,说明NH4+-N由沉积物向上覆水释放。
TP及PO43−-P交换通量整体呈先上升后下降的趋势。由图3(a)~(b)可知,冬季2#和3#点位TP交换通量在实验初始阶段为负值,表明TP由上覆水向沉积物扩散,之后随时间增加,交换通量增加,在第7天时交换通量达到最大值,之后逐渐下降并在0附近波动,呈吸收和释放交替现象。夏季3个点位TP交换通量开始均为正值,表明TP由沉积物向上覆水释放,前9 d一直处于增长状态,在第9天达到最大值后逐渐下降,第15天后趋于稳定,达到平衡状态。由图3(c)~(d)可知,各个点位PO43−-P交换通量在实验初始阶段均为负值,表示PO43−-P由上覆水向沉积物扩散,呈吸收状态,随后交换通量为正值并逐渐增加,表示PO43−-P由沉积物向上覆水扩散,呈释放状态。冬季1#、2#和3#点位交换通量在第7天时达到最大值,夏季在第9天时达到最大值,之后逐渐下降,在第15天之后又变为吸收状态,之后稳定在0附近,吸收和释放呈交替现象。
-
沉积物对水体中营养盐的潜在贡献率结果如表2所示。其中1#、2#、3#采样点的平均水深分别为2.1、2.2、4.4 m,采集的水样均为沉积物底层原位上覆水。根据贡献率的正负值可知,冬季沉积物对上覆水中TN和NH4+-N整体上起“源”的作用,而对TP和PO43−-P表现为“汇”;夏季沉积物对上覆水中TN、NH4+-N、TP、PO43−-P均起“源”的作用。具体来看, TN的贡献率在冬季和夏季分别为−1.86%~49.53%和8.01%~22.63%,NH4+-N的贡献率在冬季和夏季分别为4.24%~80.02%和2.08%~42.16%,TP在冬季和夏季分别的贡献率为−1.66%~−0.22%和−6.32%~11.36%,PO43−-P的贡献率在冬季和夏季分别为−9.71%~−0.15%和12.96%~71.71%。冬季潜在贡献率最大的是NH4+-N,夏季潜在贡献率最大的是PO43−-P。整体而言,夏季水体温度较高,沉积物吸附能力下降,固体颗粒表面的离子更容易解吸进入间隙水和上覆水体,从而导致夏季入湖及出湖处上覆水氮磷质量浓度升高。与国内其他湖泊如雁鸣湖相比[22],大冶湖界面交换对上覆水氮磷的贡献率较大。这说明对于浅水湖泊大冶湖而言,沉积物是极为重要的内源污染源,也是加速其富营养化的重要因素。需要注意的是,由于各监测点的贡献率计算与水体流动、沉积物悬浮、实际水深等多因素有关,可能导致营养盐潜在贡献率结果与实际情况有轻微出入,后续还应该开展实地监测。
-
由表3可知,各点位TN、NH4+-N的冬夏季平均交换通量均为正值,即TN、NH4+-N由沉积物向上覆水扩散,且各点位平均交换通量的季节差异明显,同点位夏季的平均交换通量均高于冬季。可能的原因是,夏季温度更高,溶解氧被有机物大量消耗,导致沉积物界面处于缺氧状态,有利于氮转化和分解反应,促进沉积物中氮的释放。沉积物间隙水中的NH4+-N一方面来源于有机氮的矿化,另一方面来自微生物厌氧还原有机氮[23]。有机氮在沉积物表层转化为NH4+-N后,在水流作用下向浓度较低的区域迁移,并累积在沉积物中,或者在界面间扩散,成为水生动植物的直接氮源和硝化作用的初始氮源。而在水环境中,界面间扩散的NH4+-N在亚硝酸盐菌和硝酸盐菌的作用下,会发生硝化反应转化为NO3−-N和NO2−-N[24]。夏季的温度较高,NO3−-N或NO2−-N被进一步还原为N2和N2O,这些低价态物质会逸出水体,使水环境中NH4+-N含量减小,界面浓度差变大,促进沉积物的内源释放。此外,夏季是汛期、入湖水量大,会稀释水中的污染物,导致上覆水体中氮素质量浓度降低,即界面间浓度差增大,有利于沉积物中氮的释放[25]。值得注意的是,大冶湖入湖处、湖心处及出湖处交换通量季节差异明显,尤其是入湖处和出湖口处通量较大,意味着水流量对浅水湖泊氮磷内源释放的显著影响。
与氮交换通量类似,各点位TP、PO43−-P的平均交换通量均为正值(表3),且夏季大于冬季,季节更替对磷的释放同样有着差异性影响。首先,夏季水温高、溶解氧低有利于有机磷矿化分解为溶解性磷酸盐;且高温会提升酶活性增强微生物的生命活动,导致界面间氧化还原电位降低,沉积物中难溶解性PO43−-P从而容易被微生物代谢产物溶解,促进沉积物中PO43−-P的释放;其次,沉积物颗粒对磷的吸附通常会释放热量,冬季温度下降,促进了颗粒物对磷的吸附,使得间隙水磷含量下降,浓度差降低[26],导致交换通量减小。此外,沉积物中有机质的矿化过程也会影响磷的释放。夏季高温会加快有机质矿化产生腐殖质,这些腐殖质可以吸附磷形成稳定聚合物,同时产生H+,聚合物和H+的形成共同促进了磷的释放[22]。值得注意的是,夏季湖泊中藻类会大量繁殖,藻类分解会增加水中PO43−-P质量浓度。随着藻类分解,PO43−-P质量浓度会随着藻类密度的增加而升高[27],进一步加剧湖泊的磷污染。
-
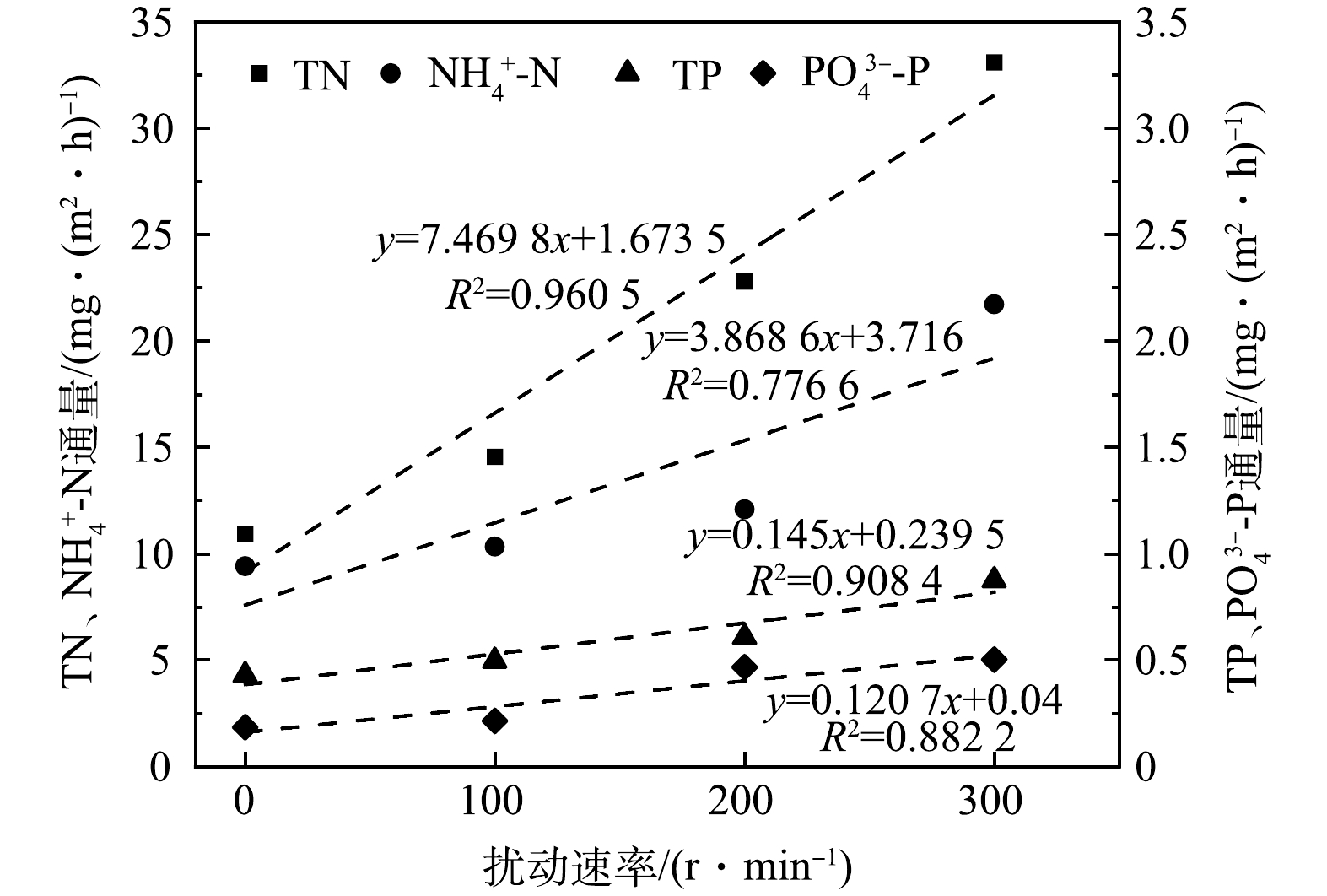
扰动对氮磷释放的影响如图4所示。在0~300 r·min−1扰动速率内,TN、NH4+-N、TP、PO43−-P的再悬浮通量均与扰动速率呈线性相关,即扰动速率越大,TN、NH4+-N、TP、PO43−-P的再悬浮通量越大。一般认为扰动过程会增加水中溶解氧,可能不利于沉积物氮磷的生物作用释放,但扰动增强了泥水混合交换,极大促进了沉积物中营养盐的释放[28],且随着扰动增强,营养盐的释放速率也随之提升[29]。由此可知,浅水湖泊水体若受到风浪,船舶和其他人为活动干扰,沉积物的再悬浮状态会增加氮磷等营养盐释放到上覆水体的风险,其扰动作用能够将沉积物氮磷的扩散速率提高数倍甚至数十倍[30],导致大冶湖水质恶化。因此,应尽可能减小或避免对大冶湖沉积物的扰动,从而一定程度上降低沉积物中氮磷的释放。
-
上覆水温度对沉积物氮磷释放通量的影响如图5所示。整体来看,TN、NH4+-N、TP、PO43−-P变化规律一致,其释放通量呈现随温度增加而上升的趋势。30 °C时的TN及NH4+-N通量分别为10 °C时的2.24倍和8.34倍。一般来说,温度影响着沉积物与水界面的物理化学反应,温度升高会增加沉积物表面活性,导致氮磷的吸附量降低,沉积物表面的离子更容易脱附进入湖泊水体中,加速氮磷的溶解和扩散[31]。其次,水温会影响微生物的活动能力,从而影响着氮磷的界面交换。升温致使微生物代谢增加并消耗更多的氧气,微生物反硝化活性增强,能加速了内源氮的释放和扩散,而微生物代谢有机质过程会产生酒石酸、柠檬酸等有机酸,这些有机酸在络合金属离子过程中会进一步促进沉积物中氮磷的释放[32]。因此,在一定范围内温度越高,沉积物中氮磷的释放能力越强,这是夏季湖泊容易发生富营养化的重要原因之一[33],故大冶湖夏季富营养化的风险更高。
-
进一步分析上覆水溶解氧浓度对氮磷交换通量的影响。由图6可知,在不同溶解氧浓度下,TN、NH4+-N、TP、PO43−-P通量变化规律类似,表现为上覆水溶解氧浓度越小沉积物营养盐向上覆水交换越强烈,即通量随着溶解氧浓度的减小而增大,厌氧条件下会加速氮磷的释放。由图2和图3可知,夏季氮磷平均释放强度高于冬季。其原因可能在于夏季湖泊水体温度高、水位增加、藻类繁殖加剧,导致底泥界面容易长期形成缺氧或无氧环境[22,34],促使氮磷内源释放增加,这与溶解氧影响实验结果相符合。好氧条件下的TN和NH4+-N通量均值分别为0.099 mg·(m2·d)−1和0.158 mg·(m2·d)−1;而在厌氧条件下二者分别增加到1.632 mg·(m2·d)−1和0.622 mg·(m2·d)−1。水体溶解氧浓度影响着沉积物-上覆水界面氧化还原电位和微生物生存状况。一般情况下,当上覆水溶解氧浓度升高时,沉积物与水界面的氧化还原电位会上升,趋于氧化态的界面会促进沉积物中有机氮的矿化[35]。同时减弱微生物反硝化作用,使硝态氮的消耗降低,而好氧的硝化菌会加速硝化反应将沉积物和上覆水中氨氮转化为硝态氮,使得沉积物中硝态氮释放量增大,氨氮释放通量降低[36]。在夏季,湖泊沉积物-水界面处于缺氧状态,此时微生物的反硝化作用会加强,生物扰动更为频繁,有机氮、硝态氮会加速向氨氮转化,导致上覆水中氮质量浓度的增加[37]。TP通量在好氧条件下均值为0.049 mg·(m2·d)−1,在厌氧条件下增加到0.098 mg·(m2·d)−1;PO43−-P通量在厌氧条件下达到最大值0.056 mg·(m2·d)−1,为好氧条件下的2.43倍。上覆水中好氧环境会促使沉积物中低价态金属离子如Fe2+向高价态如Fe3+转化,并形成氢氧化铁胶体沉积在湖底,吸附水中部分磷,同时水体中铁离子与磷酸盐的沉淀反应速率会加快[38],导致沉积物-上覆水界面的磷质量浓度差下降,磷释放通量降低。此外,缺氧环境中微生物碱性磷酸酶的活性会提高,从而加剧磷的释放。而夏季湖泊水体缺氧,导致沉积物-水界面由氧化状态向还原状态转变,促进沉积物中铁结合态磷的释放。此外,缺氧、水温高等环境条件会提高微生物碱性磷酸酶的活性,同样能促使有机磷向无机磷转化、不溶性磷向可溶性磷转化[37],共同加剧磷的释放。
-
浅水湖泊水体pH受多种因素如微生物代谢过程、藻类光合作用以及外源污染等影响,进而严重影响沉积物-上覆水界面的离子交换过程。由图7(a)~(b)可以看出,TN和NH4+-N通量随着环境pH的降低而提高。TN通量均值由pH=10的1.054 mg·(m2·d)−1升高到pH=4的2.072 mg·(m2·d)−1;NH4+-N通量均值由pH=10的0.648 mg·(m2·d)−1升高到pH=4的2.010 mg·(m2·d)−1。在酸性条件下,水中含有较多的H+,可交换态氮中的NH4+容易与H+发生竞争,导致NH4+加速从胶体表面解离迁移到上覆水,使得界面氮通量增加;而当pH升高时,沉积物表面容易带负电荷,负电荷会吸附NH4+,使其固定在沉积物中,减少其释放。部分NH4+离子还会以氨气形式溢出水面,同时与水中金属阳离子形成氮盐沉淀,降低上覆水TN含量[39]。相比之下,水体pH对磷释放的影响规律则不同。由图7(c)~(d)可知,在碱性条件下TP及PO43−-P通量均最大,酸性条件时次之,中性条件时最小;当pH=10时,沉积物中TP及PO43−-P通量均达到最大值,分别为2.234 mg·(m2·d)−1和1.754 mg·(m2·d)−1,为最小值的1.70倍(1.316 mg·(m2·d)−1)和1.75倍(1.002 mg·(m2·d)−1)。在碱性条件下,沉积物表面的弱吸附态磷(即铁铝磷)会与水中OH−发生离子交换,加速磷的释放,且碱性越强交换越强烈;而酸性环境中,H+会促进沉积物表面钙磷的解析,加快界面磷酸盐的溶解与释放[40]。不过,过多的H+会促进沉积物表面基团质子化,增强对磷酸盐的静电吸附强度[41],从而减缓磷酸盐的释放。这可能是酸性环境磷释放稍小于碱性环境的原因之一。在中性环境下,磷酸盐较容易与沉积物表面的金属元素结合,吸附沉积于底泥,导致磷释放通量较小。因此,维持湖泊水质的中性环境对改善内源氮磷释放有帮助。
-
1)冬季和夏季浅水湖泊大冶湖中不同点位的交换通量存在差异。夏季时TN、NH4+-N、TP、PO43−-P的交换通量较大,冬季气温降低不利于营养盐的释放,交换通量降低。空间上,冬季入湖处1#点位氮磷交换通量最大,夏季出湖处3#点位氮磷交换通量最大,冬夏两季大冶湖入湖处及出湖处沉积物氮磷的释放潜力均高于湖心处。
2)沉积物中氮磷对水体营养盐潜在贡献率估算表明,冬季沉积物对上覆水中TN和NH4+-N整体上起“源”的作用,而对TP和PO43−-P表现为“汇”;夏季沉积物对上覆水中TN、NH4+-N、TP、PO43−-P均起“源”的作用。大冶湖夏季营养盐贡献率较高,说明夏季沉积物的内源污染更为严重,值得关注。
3)环境影响因子实验结果表明,扰动状态下水体氮磷的质量浓度明显高于静态时的质量浓度,随着扰动速率的增加,沉积物氮磷的再悬浮通量越大;升温会促进沉积物释放氮磷;好氧条件可抑制氮磷的释放,厌氧条件则会加速沉积物释放氮磷;pH对氮磷释放的影响规律不同,氮营养盐的释放随pH的升高而减少,而磷营养盐在中性条件下释放强度最弱,偏酸或偏碱环境有助于磷的释放。
4)根据研究结果,建议对大冶湖氮磷污染防治采取针对性措施,例如若开展底泥疏浚,应选择在温度较低的冬季进行,以减少大冶湖水体内源氮磷释放,并且尽量减少疏浚过程对大冶湖水体的扰动;此外还可以进行缓慢曝气充氧抑制以减少沉积物内源释放;冬夏季均需严格控制外源营养盐的输入,从而最大限度抑制其水质恶化。
综上所述,大冶湖底泥沉积物通过界面交换对上覆水氮磷的贡献率较大,是水体氮磷营养盐重要的内在污染源。这为大冶湖富营养化精细化防治提供科学依据,为控制长江中下游城市浅水湖泊氮磷污染提供参考与借鉴。
大冶湖沉积物-上覆水界面氮磷交换通量的冬夏对比
Comparison of nitrogen and phosphorus exchange fluxes at the sediment-overlying water interfaces of Daye Lake between winter and summer
-
摘要: 通过泥柱静态培养实验,对比探究大冶湖冬夏两季沉积物-上覆水界面氮磷交换通量的变化规律,估算界面交换对水体氮磷的潜在贡献率并探讨沉积物的“源”与“汇”作用,最后通过单因素控制法开展扰动、温度、溶解氧及水体pH等环境因子对氮磷释放的影响研究。结果表明,冬夏两季不同点位的交换通量和“源”、“汇”角色不同。冬季入湖处1#点位氮磷交换通量最大,TN、NH4+-N、TP、PO43−-P的平均交换通量分别为202.94、41.62、0.55、0.36 mg·(m2·d)−1;夏季出湖处3#点位氮磷交换通量最大,TN、NH4+-N、TP、PO43−-P平均交换通量分别为389.27、89.54、1.79、1.18 mg·(m2·d)−1。冬季沉积物对上覆水中TN和NH4+-N整体上起“源”的作用,而对TP和PO43−-P表现为“汇”;夏季沉积物对上覆水中TN、NH4+-N、TP、PO43−-P均起“源”的作用。环境因子实验结果表明,水体扰动速率越大,沉积物氮磷的再悬浮通量越大;升温及厌氧条件均会促进沉积物氮磷的释放;水体pH对氮磷释放的影响规律不同,氮营养盐释放随着pH的升高而减少,而磷营养盐中性条件下释放强度最弱,偏酸或偏碱环境有助于磷的释放。本研究有助于厘清长江中下游城市浅水湖泊富营养化内源污染贡献,对设计湖泊内源负荷控制方案以及湖泊富营养化防控具有重要指导意义。Abstract: In this work, the static incubation experiments of mud columns were used to compare the exchange fluxes of nitrogen and phosphorus at the sediment-overlying water interfaces of Daye Lake in winter and summer. The potential contribution of interfacial exchange to the nitrogen and phosphorus in the water body was then estimated, and the source or sink role of sediment was also discussed. Finally, the effects of disturbance, temperature, dissolved oxygen, and pH on the release of nitrogen and phosphorus were investigated through single-factor experiments. The results showed that the exchange fluxes and the source or sink role were different among the investigated sites between winter and summer. The exchange fluxes of nitrogen and phosphorus were the largest at point 1# of the lake in winter, and the average exchange fluxes of TN, NH4+-N, TP, and PO43−-P were 202.94, 41.62, 0.55, and 0.36 mg·(m2·d)−1, respectively. The maximum nitrogen and phosphorus exchange fluxes were observed at point 3# of the lake outlet in summer, the average exchange fluxes of TN, NH4+-N, TP, and PO43−-P were 389.27, 89.54,1.79, and 1.18 mg·(m2·d)−1, respectively. In winter, the sediment acted as a source of TN and NH4+-N in the overlying water, and as a sink for TP and PO43−-P in the overlying water. However, in summer the sediment acted as a source of TN, NH4+-N, TP, and PO43−-P in the overlying water. Results of environmental factors analysis indicated that the resuspension fluxes of nitrogen and phosphorus increased with the increase of disturbance rate. High temperature and anaerobic conditions could promote the release of nitrogen and phosphorus from the sediment. The influence of water pH on nitrogen and phosphorus release was different, the release of nitrogen decreased with the increase of pH, while the release of phosphorus was the weakest at neutral pHs, but increased at acidic or alkaline pHs. This study is of great significance for clarifying the contribution of endogenous pollution to eutrophication in urban shallow lakes in the middle and lower reaches of Yangtze River, and for designing lake endogenous load control schemes as well as prevention and control of eutrophication in lakes.
-
Key words:
- Daye Lake /
- sediment-overlying water /
- nitrogen and phosphorus /
- exchange fluxes /
- influence factor
-

-
表 1 大冶湖采样点信息表
Table 1. Information of sampling points in Daye Lake
点位 名称 经度 纬度 级别 属性 1# 大冶湖大桥 115°00'16.5" 30°06'05.7" 省控 湖泊 2# 磊山湖心 115°08'35.9" 30°05'35.2" 省控 湖泊 3# 大冶湖闸 115°12'41.35" 30°07'30.95" 国控 长江一级支流 表 2 大冶湖沉积物-上覆水界面营养盐交换对水体营养盐的潜在贡献率
Table 2. Potential contribution of nutrients exchange at the sediment-overlying water interface of Daye Lake
季节 点位 水体中现存营养盐/(mg·L−1) 界面交换的营养盐/(mg·L−1) 贡献率/% TN NH4+-N TP PO43−-P TN NH4+-N TP PO43−-P TN NH4+-N TP PO43−-P 冬季 1# 2.83 1.25 0.108 0.066 14.901 8.435 0.093 0.087 49.53% 80.02% −0.22% −0.15% 2# 2.45 0.52 0.055 0.017 1.68 0.451 0.034 0.024 −1.86% 8.49% −1.66% −9.71% 3# 1.67 0.42 0.047 0.019 1.363 0.347 0.022 0.01 −1.64% 4.24% −0.99% −3.67% 夏季 1# 1.273 0.437 0.122 0.003 2.533 0.65 0.057 0.011 11.79% 5.80% −6.32% 32.39% 2# 0.634 0.307 0.086 0.027 1.089 0.384 0.067 0.059 8.01% 2.80% −2.37% 12.96% 3# 0.432 0.221 0.062 0.013 2.152 1.861 0.186 0.177 22.63% 42.16% 11.36% 71.71% 表 3 TN、NH4+-N、TP、PO43−-P的冬、夏季平均交换通量
Table 3. Average winter and summer exchange fluxes of TN, NH4+-N, TP, PO43−-P mg·(m2·d)−1
点位 TN NH4+-N TP PO43−-P 冬季 夏季 冬季 夏季 冬季 夏季 冬季 夏季 1# 202.94 240.45 41.62 83.41 0.55 0.93 0.36 0.53 2# 83.22 189.15 11.41 60.68 0.37 0.78 0.28 0.51 3# 185.61 389.27 14.53 89.54 0.19 1.79 0.22 1.18 -
[1] 张运林, 秦伯强, 朱广伟, 等. 论湖泊重要性及我国湖泊面临的主要生态环境问题[J]. 科学通报, 2022, 67(30): 3503-3519. [2] 韩宁, 郝卓, 徐亚娟, 等. 江西香溪流域干湿季交替下底泥氮释放机制及其对流域氮输出的贡献[J]. 环境科学, 2016, 37(2): 534-541. [3] LIU C, ZHONG J, WANG J, et al. Fifteen-year study of environmental dredging effect on variation of nitrogen and phosphorus exchange across the sediment-water interface of an urban lake[J]. Environmental Pollution, 2016, 219: 639-648. doi: 10.1016/j.envpol.2016.06.040 [4] 李运奔, 匡帅, 王臻宇, 等. 东巢湖沉积物水界面氮、磷、氧迁移特征及意义[J]. 湖泊科学, 2020, 32(3): 688-700. doi: 10.18307/2020.0309 [5] 王延军, 徐敏, 孟凡生, 等. 长江中游黄盖湖富营养化趋势分析及原因诊断[J]. 湖泊科学, 2023, 35(4): 1183-1193. doi: 10.18307/2023.0412 [6] MORTIMER C H. The exchange of dissolved substances between mud and water in lakes[J]. Journal of Ecology, 1942, 30(1): 147-201. doi: 10.2307/2256691 [7] BOERS P C M, VAN HESE O. Phosphorus release from the peaty sediments of the loosdrecht lakes (The Netherlands)[J]. Water Research, 1988, 22(3): 355-363. doi: 10.1016/S0043-1354(88)90240-0 [8] BOLALEK J, GRACA B. Ammonia nitrogen at the water-sediment interface in puck bay (Baltic Sea)[J]. Estuarine[J], Coastal and Shelf Science, 1996, 43(6): 767-779. doi: 10.1006/ecss.1996.0102 [9] 向速林, 陶术平, 吴代赦. 鄱阳湖沉积物和水界面磷的交换通量[J]. 湖泊科学, 2017, 29(2): 326-333. doi: 10.18307/2017.0208 [10] CLAVERO V, IZQUIERDO J J, FERNANDEZ J A, et al. Seasonal fluxes of phosphate and ammonium across the sediment-water interface in a shallow small estuary (Palmones River, southern Spain)[J]. Marine Ecology Progress Series, 2000, 198: 51-60. doi: 10.3354/meps198051 [11] 文帅龙, 吴涛, 杨洁, 等. 冬季大黑汀水库沉积物-水界面氮磷赋存特征及交换通量[J]. 中国环境科学, 2019, 39(3): 1217-1225. doi: 10.3969/j.issn.1000-6923.2019.03.039 [12] WANG Z, REN H, MA Z, et al. The Release of endogenous nitrogen and phosphorus in the Danjiangkou reservoir: a double-membrane diffusion model analysis[J]. Journal of Sensors, 2021, 2021: 1-11. [13] 杨平, 金宝石, 谭立山, 等. 九龙江河口区养虾塘沉积物-水界面营养盐交换通量特征[J]. 生态学报, 2017, 37(1): 192-203. [14] ZHOU J, LEAVITT P R, ZHANG Y, et al. Anthropogenic eutrophication of shallow lakes: is it occasional?[J]. Water Research, 2022, 221: 118728. doi: 10.1016/j.watres.2022.118728 [15] QIN B Q, GAO G, ZHU G W, et al. Lake eutrophication and its ecosystem response[J]. Chinese Science Bulletin, 2013, 58: 961-970. [16] 祝维俊. 大冶湖水环境协同治理研究[D]. 武汉: 华中科技大学, 2021. [17] 国家环境保护总局. 水和废水监测分析方法 (第四版)[M]. 北京: 中国环境科学出版社, 2002. [18] 张硕, 方鑫, 黄宏, 等. 基于正交试验的沉积物-水界面营养盐交换通量研究-以海州湾海洋牧场为例[J]. 中国环境科学, 2017, 37(11): 4266-4276. doi: 10.3969/j.issn.1000-6923.2017.11.032 [19] 陈洪涛, 刘素美, 陈淑珠, 等. 渤海莱州湾沉积物-海水界面磷酸盐的交换通量[J]. 环境化学, 2003, 22(2): 110-114. doi: 10.3321/j.issn:0254-6108.2003.02.002 [20] 邢方威. 天津近岸海域营养盐分布及沉积物-水界面营养盐交换特性研究[D]. 天津: 天津大学, 2013. [21] 杜奕衡, 刘成, 陈开宁, 等. 白洋淀沉积物氮磷赋存特征及其内源负荷[J]. 湖泊科学[J], 2018, 30(6): 1537-1551. [22] 裴佳瑶. 雁鸣湖底泥氮磷释放及主要环境影响因子研究[D]. 西安: 西安理工大学, 2020. [23] 王洪伟, 王少明, 张敏, 等. 春季潘家口水库沉积物-水界面氮磷赋存特征及迁移通量[J]. 中国环境科学, 2021, 41(9): 4284-4293. doi: 10.3969/j.issn.1000-6923.2021.09.035 [24] XIA X, LIU T, YANG Z, et al. Dissolved organic nitrogen transformation in river water: Effects of suspended sediment and organic nitrogen concentration[J]. Journal of Hydrology, 2013, 484: 96-104. doi: 10.1016/j.jhydrol.2013.01.012 [25] 宋雅涓, 谢海燕, 张洁等. 东道海子表层沉积物氮营养盐及有机质分布及评价[J]. 新疆农业大学学报, 2016, 39(4): 324-331. doi: 10.3969/j.issn.1007-8614.2016.04.013 [26] 董慧. 河口区沉积物-水界面营养盐交换通量研究[D]. 青岛: 中国海洋大学, 2012. [27] 赵家敏, 田伟, 杨桂军等. 扰动方式对湖泊营养盐及藻类生物量影响的模拟研究[J]. 生态与农村环境学报, 2020, 36(2): 234-241. [28] TRIMMER M, NEDWELL D B, SIVYER D B, et al. Nitrogen fluxes through the lower estuary of the river Great Ouse, England: the role of the bottom sediments[J]. Marine Ecology Progress Series, 1998, 163: 109-124. doi: 10.3354/meps163109 [29] 孙振红. 波浪作用下沉积物中氮、磷释放规律的试验研究[D]. 青岛: 中国海洋大学, 2015. [30] 周启星, 俞洁, 陈剑, 等. 某城市湖泊中磷的循环特征及富营养化发生潜势[J]. 环境科学[J], 2004, 25(5): 138-142. [31] 陈平, 倪龙琦. 河湖底泥中氮磷迁移转化的研究进展[J]. 徐州工程学院学报(自然科学版), 2020, 35(2): 60-66. [32] 裴佳瑶, 冯民权. 环境因子对雁鸣湖沉积物氮磷释放的影响[J]. 环境工程学报, 2020, 14(12): 3447-3459. doi: 10.12030/j.cjee.201912021 [33] 朱健, 李捍东, 王平. 环境因子对底泥释放COD, TN和TP的影响研究[J]. 水处理技术, 2009, 35(8): 44-49. [34] 殷燕, 吴志旭, 刘明亮, 等. 千岛湖溶解氧的动态分布特征及其影响因素分析[J]. 环境科学, 2014, 35(7): 2539-2546. [35] 刘亚贺, 王晓燕, 许康丽. 环境因子对密云水库消落带沉积物-水界面氮交换通量的影响研究[J]. 农业环境科学学报, 2022, 41(4): 849-856. doi: 10.11654/jaes.2021-1053 [36] 王美丽, 刘春, 白璐, 等. 曝气对黑臭河道污染物释放的影响[J]. 环境工程学报, 2015, 9(11): 5249-5254. doi: 10.12030/j.cjee.20151119 [37] 刘静静, 董春颖, 宋英琦, 等. 杭州西湖北里湖沉积物氮磷内源静态释放的季节变化及通量估算[J]. 生态学报, 2012, 32(24): 7932-7939. [38] 郭念, 闫金龙, 魏世强, 等. 三峡库区消落带典型土壤厌氧呼吸对铁还原及磷释放的影响[J]. 水土保持学报, 2014, 28(3): 271-276. [39] 付春平, 钟成华, 邓春光. pH与三峡库区底泥氮磷释放关系的试验[J]. 重庆大学学报(自然科学版), 2004, 27(10): 125-127. [40] 刘笑天, 刘军, 王以斌, 等. 不同溶解氧条件下沉积物-水体系磷循环[J]. 环境科学, 2022, 43(12): 5571-5584. [41] 龚云辉, 刘云根, 杨思林, 等. pH值对高原山地分散养殖型农村沟渠底泥磷释放的影响[J]. 江苏农业学报, 2020, 36(4): 955-964. -




 下载:
下载: