-
岩溶区地下水资源的保护与修复是全球面临的重要环境问题[1]。燃油泄漏是地下环境常见的污染源之一,其组分苯(benzene, B)、甲苯(toluene, T)、乙苯(ethylbenzene, E)和二甲苯(xylene, X)是主要的有害物质。由于具有较高的溶解度与迁移性,BTEX不仅对环境和生态造成威胁,对人类的健康也构成严重危害,能诱发癌症等疾病[2-4]。因此,岩溶区燃油污染及其治理受到研究者的广泛关注,成为环境保护领域的重要议题。
原位化学氧化(in situ chemical oxidation, ISCO)是近年来常用的有机污染修复技术,通过向土壤或地下水中注入氧化剂,将有机污染物转化为无害或低毒性物质,从而达到修复目的[5]。过硫酸盐(persulfate, PS)是ISCO中常用的氧化剂之一,具有强氧化性、易溶于水、良好稳定性和适用范围广等特点[6]。然而,ISCO技术仍然存在一些不足,如氧化剂寿命受含水介质影响持久性变差,在岩溶水系统因为水流速度快而容易流失,因此,为达到持续治理目的通常需要进行多次投注[7]。随着修复技术的发展,缓释体(slow-release materials, SRMs)技术已成为当前的研究热点。SRM技术通过将氧化剂与粘合剂构成缓释体来减缓氧化剂的释放速率,达到延长使用寿命和增加利用率的目的[8]。缓释技术基本以物理法为主,作为载体的粘合剂不与氧化剂发生反应,将氧化剂混合、包裹在SRM内,使其缓慢释放。目前,按粘合剂的不同可分为石蜡类缓释体、混凝土类缓释体以及凝胶类缓释体等,这些缓释体在地下水原位修复中具有巨大的利用潜力[9]。其中,以石蜡为粘合剂的PS-SRMs技术有良好的应用前景,现有研究[10-11]已证明其具有降解有机污染物的性能。
为加强污染治理效果,研究者已经提出将ISCO技术与增强型生物修复(enhanced bioremediation, EBR)技术联合形成处理链,扬长避短,协同促进修复性能[12-14]。在微氧或厌氧的石油烃污染地下水环境中,硝酸盐、三价铁和硫酸盐常被微生物降解作用利用为电子受体[15-17],因此,这些化合物也可能成为ISCO-EBR处理链利用的电子受体。尽管PS-ISCO具有抑制微生物活性的缺点[18],但有研究[19-21]表明PS-ISCO产生的硫酸根离子可以被微生物利用继续降解BTEX。然而,通过添加电子受体促进EBR并与PS-SRM-ISCO协同处理BTEX的研究,至今仍未见相关报道,其研究可能对削减ISCO对微生物活性影响也具有积极意义。
为发展岩溶含水层石油污染修复技术,本研究以岩溶地下河中石灰石和砂粒混合物作为含水介质,以汽油饱和溶液为BTEX来源,以石蜡粘合剂制备PS-SRM,通过添加硝酸盐、三价铁以及利用PS氧化产生的硫酸盐来补充电子受体,开展了微元体研究,探究了不同过硫酸钠/石蜡质量比PS-SRM处理汽油BTEX的效果,更好地认识PS缓释情况下电子受体的可利用情况,为岩溶区EBR-ISCO-SRM技术联合处理地下水石油污染治理提供科学依据。
-
实验所用石灰石及砂粒均采集于广西桂林岩溶地下河,其化学组分检测结果如表1所示。制备SRM所用石蜡为半精炼颗粒状石蜡,实验所用试剂过硫酸钠(Na2S2O8)、氯化铁(FeCl3)和硝酸钠(NaNO3)为分析纯,无水乙醇(CH3CH2OH)为优级纯,汽油为市售92号汽油。所用地下水取自桂林理工大学内未受污染的浅层岩溶地下水。为模拟地下水受污染后的微氧-厌氧环境,将地下水用氮吹浓缩仪(APNE-12,北京吉天仪器有限公司)进行去氧处理,其化学指标如下:溶解氧为1.05~2.20 mg·L−1,电导率为208.4~241 μS·cm−1,pH为7.58~8.32,硝酸盐质量浓度为4.31~5.24 mg·L−1,硫酸盐质量浓度为1.25~2.66 mg·L−1。
-
实验采用体积为1 000 mL的蜀牛透明玻璃瓶制作微元体,按电子受体添加情况分为3类:不添加电子受体、添加硝酸盐和添加氯化铁,其中的过硫酸钠/石蜡质量比分为0.5、1、2和3,分别标记为S1~S5、N1~N5和F1~F5组。微元体设置如表2所示。从当前乙醇汽油推广应用前景和有利于微生物活性和生长的碳源考虑,所有微元体均添加乙醇(EtOH),目标质量浓度为100 mg·L−1。
制作微元体时,先加入200 g石灰石颗粒(粒径1~10 mm)与200 g河砂(粒径约为0.5 mm),然后加入一定量的去氧地下水、硝酸钠溶液、氯化铁溶液以及乙醇溶液,最后加入汽油饱和溶液和PS-SRM,液体总体积为800 mL。为避免实验结果的偶然性,每组微元体设置3个平行体。为模拟污染地下水微氧/无氧环境,实验期间微元体均置于厌氧手套箱内,溶解氧保持在1.8 mg·L−1以下,同时避光存放,手套箱腔内温度为(25±2) °C。
-
定期使用20 mL的一次性医用注射器在微元体固体介质表面上2 cm处取15 mL样品,其中5 mL直接注入含1 g氯化钠的透明顶空瓶内,使用气相色谱仪(Agilent 7890B,美国安捷伦科技有限公司)分析BTX与EtOH浓度[22];其余10 mL样品在用便携式水质分析仪(HQ30d,美国哈希公司)检测DO、pH、EC及ORP等水化学指标后,取5 mL样品分别用默克化工Calcium-test和Alkalinity-test试剂盒测定Ca2+和HCO3−;取2 mL样品使用碘量法和邻菲罗啉法分别检测PS、Fe2+和总铁含量[23-24],所使用的仪器为紫外分光光度计(UV-6000PC,上海元析仪器有限公司);取1 mL样品并用超纯水稀释一定倍数,使用离子色谱仪(ISC-2100IC,美国赛默飞世尔科技有限公司)检测SO42−、NO3−、NO2−和乙酸根等。实验结束后取1 g左右沉积物样品,由上海生工生物工程股份有限公司完成微生物16S测序工作。
-
在实验初期,PS-SRMs的释放导致PS浓度快速上升,然后趋于相对稳定。PS在水中自然分解或与污染物化学氧化时会产生硫酸盐,其产生量与PS分解或参与反应的质量相等(式(1)与式(2))。
以硫酸盐产生质量和PS检出浓度对应的质量之和除以SRM中初始PS质量,即为缓释率。过硫酸钠/石蜡质量比越高,PS缓释率越高。当质量比等于0.5和1时,PS缓释率较低,小于80%,而且微元体平行体之间会出现明显的PS缓释差异,这是因为缓释体内的PS固体颗粒分布不均匀,PS溶解空隙之间连通性较差,因此,造成PS缓释不均匀[25]。当过硫酸钠/石蜡质量比提高到2和3时,SRMs包含的PS颗粒质量较高,分布相对均匀,溶解空隙连通性更好,使得PS缓释较为匀称,缓释率可达到90%以上(表3)。
由表3可见,缓释体质量比越高,PS增长速率越大。当质量比等于2时,S4、N4和F4组增长速率分别为34.3、71.4和34.6 mg·(L·d)−1;当质量比等于3时,PS释放加快,S5、N5和F5增长速率分别为64.9、69.0和61.8 mg·(L·d)−1。
-
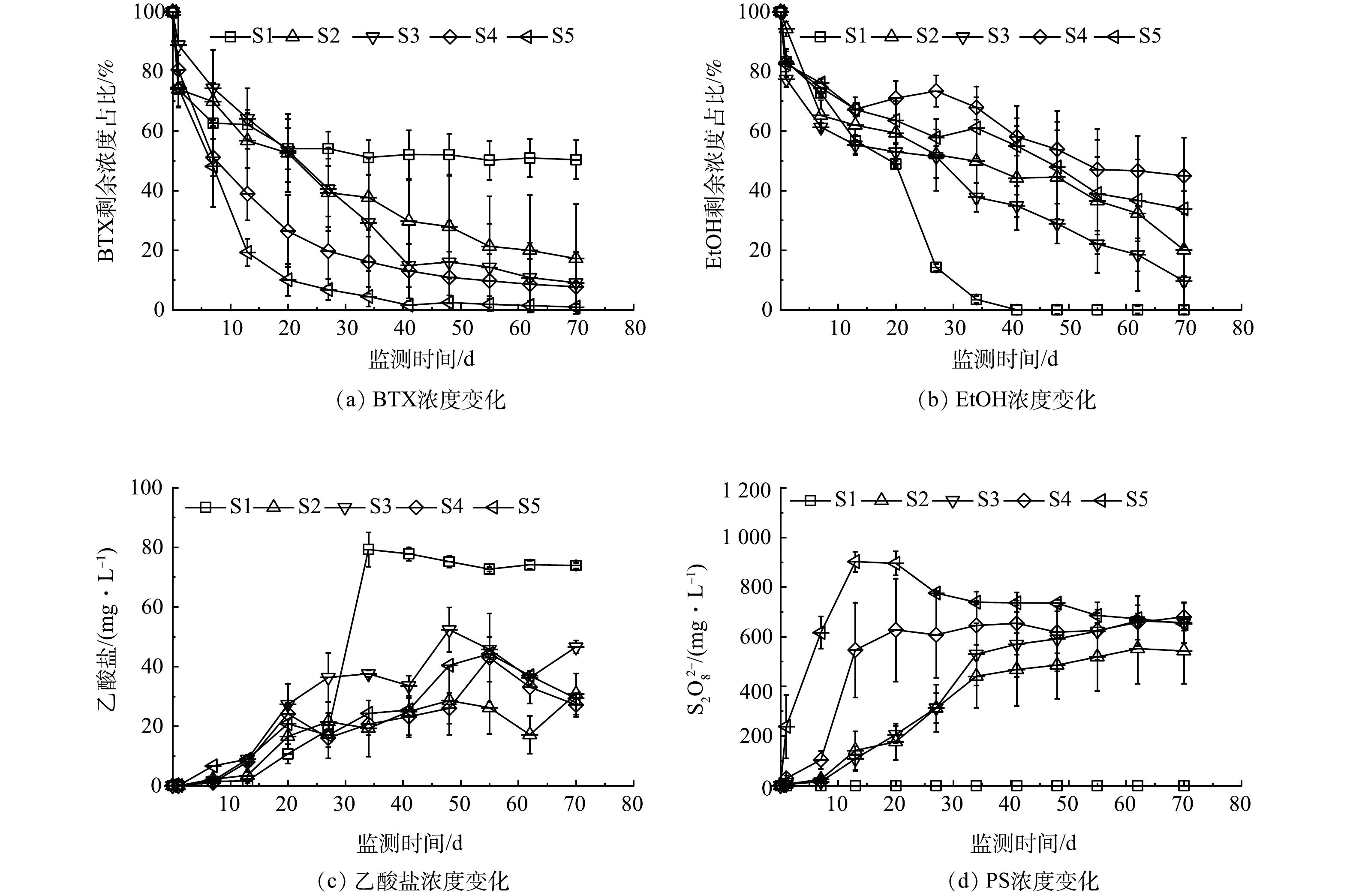
1)未添加电子受体。未添加电子受体情况下,各组中BTX、EtOH、PS及乙酸盐质量浓度变化如图1所示,BTX及EtOH降解准一级动力学拟合结果见表4。其中,S1组未添加电子受体和SRM,可反映污染组分自然衰减特征。BTX下降趋势平缓,如图1(a)所示,在第70天测得质量浓度约为11.4 mg·L−1,准一级动力学常数(kobs)为0.009 d−1;EtOH则有明显的降解,kobs为0.079 d−1,在第36天时质量浓度低于检测下限(图1(b))。相较于BTX,EtOH更容易被微生物降解,其产物乙酸盐积累量最高达到75.5 mg·L−1(图1(c))。由于EtOH降解能够优先利用有限的电子受体,BTX的生物降解受到EtOH降解的抑制,BTX浓度的下降主要是吸附作用所致。
在添加PS-SRMs的S2~S5组中,PS的分解会增加溶液中的硫酸盐浓度,相当于补充了硫酸盐电子受体。各组BTX均有明显降解,随着过硫酸钠/石蜡质量比增大,PS浓度增长速率加快,BTX降解速率也相应增大。在第70天时S2、S3、S4和S5中BTX的去除率分别为82.9%、91.0%、92.3%和99.1%,对应的PS增长速率分别为8.9、14.4、34.3和64.9 mg·(L·d)−1(表3)。这表明高质量比缓释体有利于提高BTX降解速率,化学氧化作用是BTX去除的主要作用。然而,EtOH的降解效果低于BTX,在第70天时S2、S3、S4和S5中EtOH降解准一级动力学常数分别为0.018、0.028、0.010和0.014 d−1,去除率分别为79.9%、90.4%、55.0%和66.2%,缓释体质量比提高不利于EtOH降解速率的提高。以上结果表明,缓释体质量比增大可增强PS的化学氧化作用,BTEX比EtOH更容易被PS氧化[26],乙醇降解受到抑制;缓释体质量比降低有利于乙醇的降解以及微生物活性的增强,但不利于BTX的降解。在不添加电子受体环境下,由PS分解产生的硫酸盐是可利用电子受体,硫酸盐还原可能是乙醇降解的主要作用。
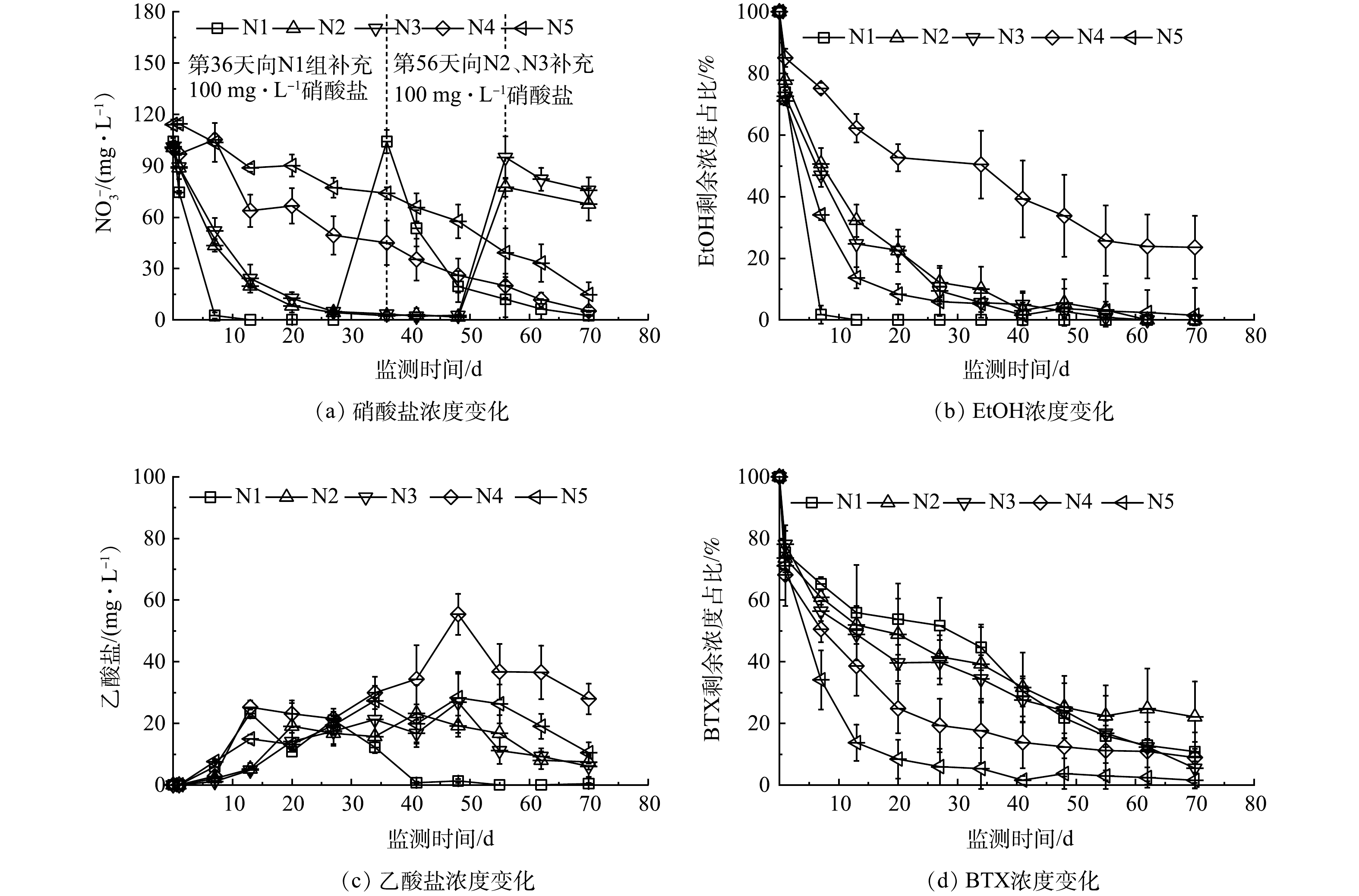
2)添加硝酸盐电子受体。在添加硝酸盐(初始质量浓度约100 mg·L−1)条件下,均可观测到硝酸盐质量浓度明显下降的现象(图2(a))。在没有PS存在的N1组,硝酸盐还原作用十分明显,在第7天测得硝酸盐和亚硝酸盐质量浓度低于检测下限,并于同一天测得EtOH剩余质量浓度为1.5 mg·L−1,去除率高达98.2%,乙酸盐积累量为5.9 mg·L−1(图2(c))。但BTX的降解情况基本与没有添加电子受体的S1接近,在第7天计算出去除率仅为34.8%。该结果表明N1中硝酸盐还原作用会优先降解乙醇及其产物乙酸盐[27],BTX的去除基本以含水介质吸附为主。为了探究乙醇被去除后硝酸盐还原作用降解BTX的效果,第36天再次向微元体补充硝酸盐(约100 mg·L−1),这促进了BTX的降解,第50天时BTX去除率达到78.2%,硝酸盐被大幅度利用,残余质量浓度为19.5 mg·L−1,表明N1中存在既能降解乙醇又能降解BTX的硝酸盐还原作用,只是当乙醇存在时会大量消耗硝酸盐,从而阻止了BTX的降解。
添加PS对硝酸盐还原作用有抑制影响,这是因为PS本身具有强氧化性,会使得微生物活性降低,同时PS化学氧化过程会产生大量氢离子,导致溶液pH降低[28],这对生物微生物活性产生抑制作用[29]。在投注PS-SRMs的N2~N5中,由于微元体中石灰石的缓冲作用,pH在7.4~8.3浮动,溶液的酸碱度变化对微生物的影响较小,但PS的强氧化性仍然会较大程度地影响硝酸盐还原作用,PS浓度越高,硝酸盐利用率越低,硝酸盐还原作用越弱。
在SRMs质量比分别为0.5的N2和1.0的N3中,硝酸盐还原菌对EtOH及乙酸具有优先降解性,BTX降解以PS化学氧化为主。其中,N2中PS质量浓度以6.9 mg·(L·d)−1的速率缓慢上升,第70天达487.2 mg·L−1;第35天时硝酸盐剩余质量浓度为2.5 mg·L−1,亚硝酸盐达34.1 mg·L−1;同时计算出EtOH去除率为90.1%,BTX去除率为60.8%,略低于未添加电子受体的N1组。对于N3组,第35天时硝酸盐剩余质量浓度为3.5 mg·L−1,EtOH及BTX去除率分别为94.4%和65.6%,去除率高于N2。在第56天再次向N2与N3组补充硝酸盐后,硝酸盐还原作用得到增强,EtOH与乙酸质量浓度下降,均低于检测下限。
当SRMs质量比分别提高到2和3时,即N4和N5组,PS质量浓度增长速率分别为71.4 mg·(L·d)−1和69.0 mg·(L·d)−1,且在第13天时PS质量浓度达到峰值,分别为969.2 mg·L−1和971.6 mg·L−1。BTX的降解十分明显,第69天时去除率分别为91.1%和98.5%,EtOH的去除率分别为76.4%和81.3%,乙酸盐质量浓度分别达27.9 mg·L−1和10.4 mg·L−1。EtOH降解的准一级动力学常数分别为0.020 d−1和0.021 d−1,显著低于N2与N3。在N4和N5组中,没有第2次补充硝酸盐,实验结束时硝酸盐残余质量浓度分别为5.2 mg·L−1与14.8 mg·L−1,同时有大量的亚硝酸盐积累,质量浓度均达至66.9 mg·L−1。与未添加电子受体的S4和S5相似,N4和N5的结果也表明,当SRMs质量比提高到2和3时,PS增长速率较大,BTX被化学氧化去除的速率加快,去除率大于90%,而EtOH去除率降低;硝酸盐还原作用仍然存在,但硝酸盐利用量降低,微生物活性受到明显抑制。
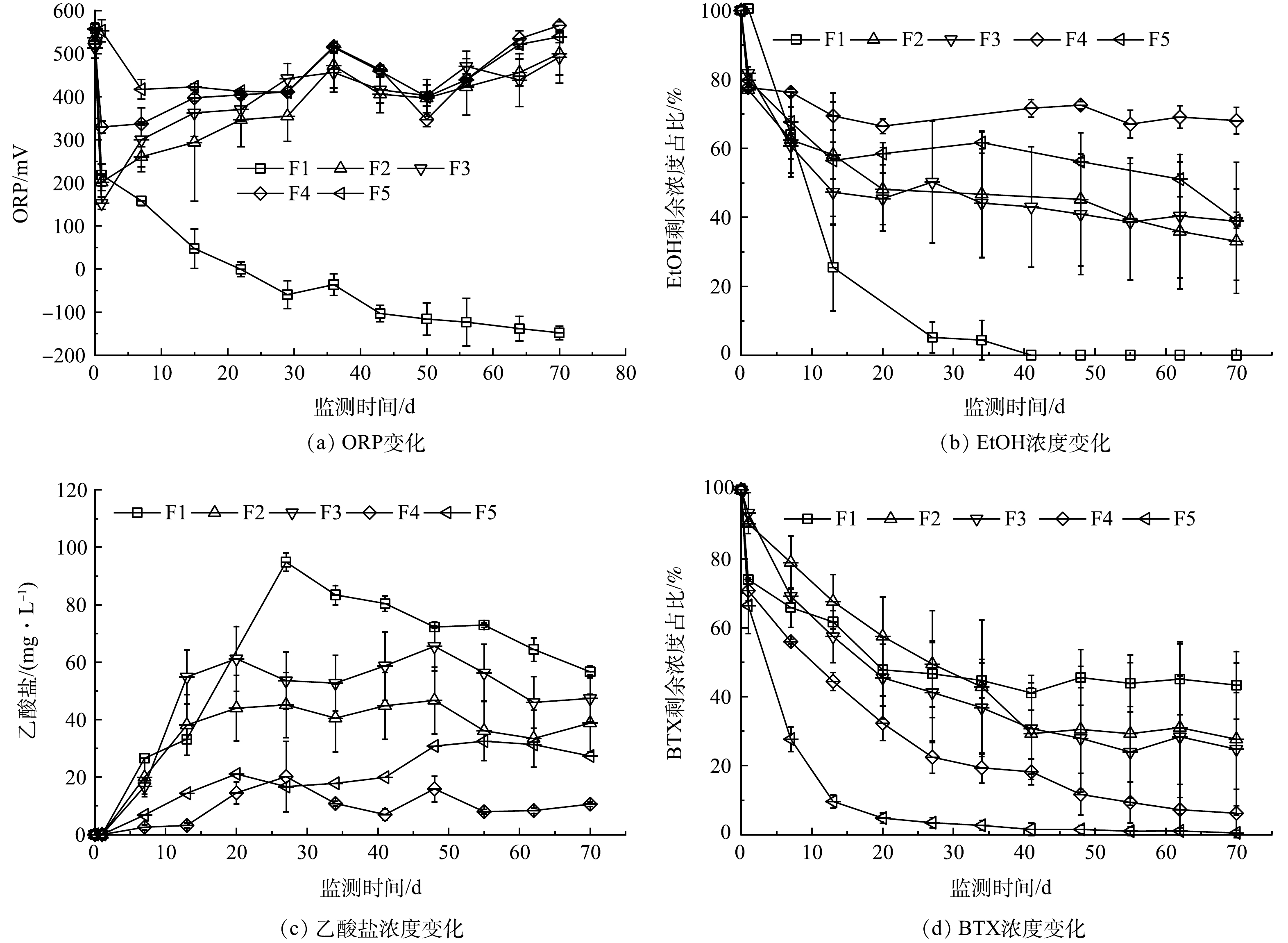
3)添加三价铁电子受体。在F1~F5中,当氯化铁被投注后,溶液pH下降迅速,基本在2.8~3.1,由于石灰石的缓冲作用,在7 d内即可恢复至中性水平,溶液由红褐色变为无色,有红色絮状物沉积。
在没有PS存在的F1组,第22天检测出亚铁(0.50 mg·L−1),发现有少量硫化铁黑色沉淀,表明有三价铁还原作用发生,溶液ORP值由投注三价铁后的558.0 mV快速下降到第22天的−0.7 mV(图3(a))。第22天时,EtOH剩余质量浓度为4.8 mg·L−1,乙酸盐质量浓度达到峰值94.8 mg·L−1(图3(c));BTX质量浓度变化与上述未添加电子受体的S1组类似(图3(d)),在第71天时其剩余质量浓度为8.4 mg·L−1。该结果表明,乙醇的降解可能与三价铁还原有关,而BTX降解仍受到乙醇存在的抑制影响。
在添加PS-SRMs的F2至F5组中,EtOH质量浓度变化如图3(b)所示,降解准一级动力学常数分别为0.012、0.011、0.003和0.011 d−1,明显小于添加硝酸盐的N2~N5组,这与溶液长期处于高氧化性(ORP均值大于400 mV)导致微生物活性较低有关,EtOH被生物降解的效率下降。在质量比较低的F2与F3中,BTX降解准一级动力学常数也明显低于未添加电子受体组和添加硝酸盐组相同质量比的结果(表4)。随着SRMs质量比增大,F4和F5组中的BTX降解准一级动力学常数明显提高,分别为0.038 d−1和0.069 d−1,均大于未添加电子受体组与添加硝酸盐组相同质量比情况下的值(表4),其原因可能是铁活化PS生成氧化性更强的硫酸盐自由基。
-
根据微生物多样性分析结果,各组微生物丰富度(Chao)、均匀度(Shannon)及物种覆盖率(coverage)的分析结果如表5所示。其中,未添加PS-SRM的S1组菌落丰富度与均匀度最高,没有受到化学氧化作用影响;在添加PS-SRM组别中,微生物丰富度与均匀度均有明显下降,添加硝酸盐的微元体多样性好于添加三价铁的微元体。
图4给出了各组微生物菌属的相对丰度。由于PS-SRMs质量比以及添加电子受体情况不同,各组间存在较明显的差异。在未添加电子受体的S1~S5中,S1组是较为特殊的。由于该组既未投注电子受体也未投注PS-SRM,其微生物的种类十分丰富。根据OTU聚类结果可知,S1中优势菌属(相对丰度大于1%),其中包括鞘氨醇单胞菌属(Sphingobium)、罗尔斯通氏菌属(Ralstonia)、嗜酸菌属(Acidovorax)、根瘤菌属(Allorhizobium)、贪铜菌属(Cupriavidus)、氢噬胞菌属(Hydrogenophaga)和甲基营养菌属(Methyloversatilis)等,这表明S1中可能存在固氮作用和产甲烷作用[30]。在S2~S5组中,各组均投入有PS-SRMs,PS在氧化BTX/EtOH及自然分解过程中会产生硫酸根离子,可认为硫酸根离子为该环境下的优势电子受体,优势菌属主要包括鞘氨醇单胞菌属和罗尔斯通氏菌属,相对丰度分别为31.4%~91.1%和1.2%~16.7%。有研究[31-32]表明,鞘氨醇单胞菌属中某些菌种既可以在好氧条件下降解多环芳香烃,又可以在兼性条件下利用硝酸盐或硫酸盐进行烃降解,而FAPROTAX功能预测结果表明,硫循环相关功能(sulfate respiration、dark sulfide oxidation等)总相对丰度小于0.1%,这说明鞘氨醇单胞菌属在该环境下基本不以硫酸盐作为电子受体降解污染物。此外,与硫酸盐还原作用有直接联系的SRB菌属如脱硫弧菌属(Desulfovibrio)等相对丰度均小于0.1%,这也说明硫酸盐的还原作用基本不参与降解过程。
在N1~N5组中,添加硝酸盐使得生物组成发生明显变化,优势菌种更为集中。在N1组中,优势菌属除鞘氨醇单胞菌属和罗尔斯通氏菌属外,还存在有短波单胞菌属(Brevundimonas)、丛毛单胞菌属(Comamonas)、热单胞菌属(Thermomonas)、固氮螺菌属(Azospirillum)和固氮弧菌属(Azoarcus)等,以固氮作用和硝酸盐还原作用为主。在N2~N5组中,主要菌属为鞘氨醇单胞菌属、罗尔斯通氏菌属和根瘤菌属,N2组与N3组中根瘤菌属相对丰度较高,分别为2.0%和3.5%;N4组和N5组相对丰度较低,均小于1.0%。以上结果表明高质量比的缓释体不利于固氮作用,低质量比有利于固氮作用。
在添加三价铁的F1~F5中,F1组中优势菌属为罗尔斯通氏菌属、固氮螺菌属和趋磁螺菌属(Magnetospirillum),相对丰度分别为53.9%、7.8%和3.3%,该组二价铁浓度上升基本与这三类菌属相关[33-34]。其余各组基本以鞘氨醇单胞菌属和罗尔斯通氏菌属为主,罗尔斯通氏菌属的相对丰度随PS-SRMs质量比增大而增大。
-
1) PS-SRMs质量比越大,PS增长速率、缓释率越大,当质量比等于3时,PS缓释率可达到90%以上;BTX降解速率随PS-SRMs质量比增加而变快,相反,EtOH的降解速率随质量比增加而降低。当质量比为0.5和1时,EtOH能够明显地被微生物降解;当质量比提高到2和3时,BTX能够优先被PS氧化,而乙醇降解受到限制,微生物活性明显降低。
2) 在投加PS-SRM情况下,添加的硝酸盐、三价铁以及由PS分解产生的硫酸盐均可以作为电子受体被微生物利用。其中,硝酸盐的利用程度最高,硝酸盐还原作用较为明显,硝酸盐还原菌普遍存在;PS分解产生的硫酸盐被微生物利用的程度较低,硫酸盐还原菌相对丰度小于0.1%;添加的三价铁被微生物利用的可能性不明显。
3) 在不同电子受体环境下生物群落构成有着明显差异,但鞘氨醇单胞菌属和罗尔斯通氏菌属在各种环境下都具有优势,均可以利用不同电子受体降解污染物。
PS缓释处理岩溶水石油污染过程中电子受体的利用
Availability of electron acceptors in the persulfate slow-release treatment of petroleum pollution in karst groundwater
-
摘要: 原位化学氧化与生物修复技术在石油污染地下水中具有联合的潜力,但化学氧化对微生物活性具有抑制影响,通过缓释氧化剂技术可能会缓解这种影响。为了更好地认识基于过硫酸钠的缓释技术在修复岩溶地下水石油污染过程中对生物降解作用的影响,本研究利用微元体实验在微氧/厌氧条件下,开展了过硫酸盐缓释处理石油污染修复中不同电子受体利用的研究。实验设置了未投加缓释体和添加缓释体(过硫酸钠/石蜡质量比分别为0.5、1、2和3)的不同工况,通过未添加电子受体、添加100 mg·L−1硝酸盐和添加100 mg·L−1三价铁作为电子受体,探究石油污染物苯、甲苯、二甲苯(简称BTX)以及乙醇(EtOH)处理及电子受体的可利用性。结果表明:BTX的降解速率与缓释体过硫酸钠/石蜡质量比呈正相关,在过硫酸钠/石蜡质量比为2和3时降解速率较高,比乙醇更容易被化学氧化;BTX降解以化学氧化为主,而乙醇的降解则以微生物作用为主。过硫酸盐缓释条件下,生物作用中硝酸盐还原作用较为明显,硫酸盐还原作用较为微弱,铁还原作用不明显;硝酸盐最容易被利用为电子受体,其次为硫酸盐,三价铁被微生物利用的可能性最小。缓释体质量比不同、电子受体类型不同可导致优势菌属存在明显的差异,鞘氨醇单胞菌属和罗尔斯通氏菌属相对丰度普遍较高,二者均可利用多种电子受体降解污染物,在生物降解上起到主要作用。Abstract: In situ chemical oxidation (ISCO) has the potential to combine with bioremediation techniques in the remediation of petroleum-contaminated groundwater, but it can decrease the activity of microorganisms, which may be buffered by slow-release material (SRM) techniques. To better understand the effect of SRM with persulfate (PS) on the biodegradation in the remediation of petroleum pollution in karst groundwater, a microcosm experiment under microaerobic and anaerobic conditions was conducted to explore the availability of different electron acceptors. In the test, different working conditions without or with slow release PS (persulfate/paraffin mass ratios of 0.5, 1, 2, and 3) were set as follows: no addition of electron acceptor, addition of 100 mg·L−1 nitrate as electron acceptor, addition of 100 mg·L−1 Fe3+ as electron acceptor, the treatment of benzene, toluene, xylene (referred to as BTX) and ethanol (EtOH) was investigated, as well as the availability of electron acceptors. The results showed that the degradation rate of BTX was positively correlated with the mass ratio of SRMs, and the highest degradation rate constants occurred at persulfate/paraffin mass ratios of 2 and 3. BTX was more preferentially oxidized by PS than EtOH. BTX degradation was dominated by chemical oxidation, while EtOH dgradation was dominated by microbial action. With the presence of SRMs, nitrate reduction was more significant in microbial action, while sulfate reduction was relatively weak, iron reduction was unconspicuous. Nitrate was more readily used as an electron acceptor by microorganisms, followed by sulfate. However, the possibility of ferric iron used by microbial was slight. Different mass ratios of SRMs and different types of electron acceptors could lead to significant differences in the dominant genera. Both Sphingomonas spp. and Ralstonia spp. had higher relative abundances than others and played a major role in utilizing various electron acceptors to degrade pollutants.
-
Key words:
- petroleum pollution /
- persulfate /
- slow-release material /
- groundwater /
- biodegradation
-

-
表 1 实验采用含水介质的化学成分
Table 1. Chemical constituents of aqueous media used in experiments %
含水介质 Al2O3 CaCO3 SiO2 Fe2O3 Na2O MgCO3 K2O 其他 石灰石 0.41 88.22 1.38 0.24 0.01 9.63 0.02 0.09 河砂 23.21 0.29 56.15 11.15 0.11 2.02 5.13 1.94 表 2 微元体设置
Table 2. Design of the microcosms
电子受体 过硫酸钠/
石蜡质量比组别 添加物及目标质量浓度/(mg·L−1) S2O82− BTX EtOH SO42− NO3− Fe3+ 未添加电子受体 — S1 — 20 100 — — — 0.5 S2 791 20 100 * — — 1 S3 791 20 100 * — — 2 S4 791 20 100 * — — 3 S5 791 20 100 * — — 添加硝酸盐电子受体 — N1 — 20 100 — 100 — 0.5 N2 791 20 100 * 100 — 1 N3 791 20 100 * 100 — 2 N4 791 20 100 * 100 — 3 N5 791 20 100 * 100 — 添加三价铁电子受体 — F1 — 20 100 — — 100 0.5 F2 791 20 100 * — 100 1 F3 791 20 100 * — 100 2 F4 791 20 100 * — 100 3 F5 791 20 100 * — 100 注:“—”表示未添加相应组分;“*”表示SRMs释放的PS会产生硫酸盐离子;汽油饱和溶液未能检出乙苯(E)。 表 3 各组缓释体PS释放情况
Table 3. Release of sustained-release materials in each group
电子受体 组别 质量比 拟合时间/d 拟合方程 PS增长速率/(mg·(L·d)−1) R2 缓释率/% 未添加电子受体 S2 0.5 0~70 y=8.9x+18.7 8.9 0.931 9 59.7 S3 1 0~63 y=14.4x−18.1 14.4 0.937 5 69.2 S4 2 0~20 y=34.3x−19.4 34.3 0.916 6 77.4 S5 3 0~13 y=64.9x+98.6 64.9 0.956 1 96.1 添加硝酸盐 N2 0.5 0~70 y=6.9x+8.7 6.9 0.989 3 54.6 N3 1 0~70 y=10.4x−39.6 10.4 0.977 3 67.7 N4 2 0~13 y=71.4x−57.1 71.4 0.920 1 98.6 N5 3 0~13 y=69.0x+131.6 69.0 0.931 2 100.0 添加三价铁 F2 0.5 0~49 y=12.4x−45.3 12.4 0.915 4 58.2 F3 1 0~42 y=13.9x−3.7 13.9 0.947 5 60.0 F4 2 0~27 y=34.6x−38.9 34.6 0.934 0 87.1 F5 3 0~13 y=61.8x+50.0 61.8 0.948 7 93.4 表 4 各组分浓度准一级动力学拟合结果
Table 4. Pseudo-first-order kinetic fitting results of each component concentration
组分 Kobs/d−1 未添加电子受体 添加硝酸盐 添加三价铁 S1 S2 S3 S4 S5 N1 N2 N3 N4 N5 F1 F2 F3 F4 F5 BTX 0.007 0.023 0.036 0.036 0.066 0.018 0.023 0.032 0.032 0.055 0.009 0.019 0.020 0.038 0.069 EtOH 0.079 0.018 0.028 0.010 0.014 — 0.062 0.077 0.021 0.020 0.091 0.012 0.011 0.003 0.011 B 0.004 0.014 0.024 0.021 0.045 0.012 0.014 0.023 0.021 0.053 0.005 0.011 0.011 0.022 0.048 T 0.006 0.021 0.041 0.053 0.091 0.018 0.021 0.035 0.042 0.061 0.010 0.021 0.023 0.048 0.241 X 0.030 0.046 0.056 — — 0.111 0.057 — — — 0.051 0.062 — — — 注:“—”表示可供拟合点数少于5个,不具有代表性。 表 5 各组Alpha多样性指数分析
Table 5. Alpha diversity index analysis of each group
未添加电子受体 添加硝酸盐电子受体 添加三价铁电子受体 缓释体质量比 组别 丰富度 均匀度 覆盖度 组别 丰富度 均匀度 覆盖度 组别 丰富度 均匀度 覆盖度 S1 1117.8 4.2 1 N1 758.0 4.2 1 F1 221.5 2.0 1 0 S2 549.1 2.3 1 N2 186.0 2.9 1 F2 164.6 1.6 1 0.5 S3 577.2 2.7 1 N3 262.9 3.0 1 F3 575.9 1.3 1 1 S4 508.9 3.2 1 N4 641.6 2.2 1 F4 490.0 2.0 1 2 S5 512.6 0.8 1 N5 567.2 2.6 1 F5 158.2 1.4 1 3 -
[1] KALHOR K, GHASEMIZADEH R, RAJIC L, et al. Assessment of groundwater quality and remediation in karst aquifers: A review[J]. Groundwater for Sustainable Development, 2019, 8: 104-121. doi: 10.1016/j.gsd.2018.10.004 [2] LEE T H, CAO W Z, TSANG D C, et al. Emulsified polycolloid substrate biobarrier for benzene and petroleum-hydrocarbon plume containment and migration control: A field-scale study[J]. Science of the Total Environment, 2019, 666: 839-848. doi: 10.1016/j.scitotenv.2019.02.160 [3] KHPALWAK W, JADOON W A, ABDEL-DAYEM S M, et al. Polycyclic aromatic hydrocarbons in urban road dust, Afghanistan: Implications for human health[J]. Chemosphere, 2019, 218: 517-526. doi: 10.1016/j.chemosphere.2018.11.087 [4] LV H, WANG Y, WANG H. Determination of major pollutant and biogeochemical processes in an oil-contaminated aquifer using human health risk assessment and multivariate statistical analysis[J]. Human and Ecological Risk Assessment: An International Journal, 2019, 25(3): 505-526. doi: 10.1080/10807039.2018.1449099 [5] SUTTON N B, KALISZ M, KRUPANEK J, et al. Geochemical and microbiological characteristics during in situ chemical oxidation and in situ bioremediation at a diesel contaminated site[J]. Environmental Science & Technology, 2014, 48(4): 2352-2360. [6] WEI K, MA J, XI B, et al. Recent progress on in-situ chemical oxidation for the remediation of petroleum contaminated soil and groundwater[J]. Journal of Hazardous Materials, 2022, 432: 128738. doi: 10.1016/j.jhazmat.2022.128738 [7] 韦俊宏, 蒋亚萍, 陈余道, 等. 过硫酸盐氧化去除地下水中乙醇的研究[J]. 环境污染与防治, 2020, 42(8): 953-958. [8] MA Y, FENG Y, FENG Y, et al. Characteristics and mechanisms of controlled-release KMnO4 for groundwater remediation: Experimental and modeling investigations[J]. Water Research, 2020, 171: 115385. doi: 10.1016/j.watres.2019.115385 [9] WANG W, JIA J, ZHANG B, et al. A review of slow-release materials for remediation of organically contaminated groundwater-material preparation, applications and prospects for practical application[J]. Journal of Hazardous Materials Advances, 2024, 13: 100393. doi: 10.1016/j.hazadv.2023.100393 [10] EVANS P J, DUGAN P, NGUYEN D, et al. Slow-release permanganate versus unactivated persulfate for long-term in situ chemical oxidation of 1, 4-dioxane and chlorinated solvents[J]. Chemosphere, 2019, 221: 802-811. doi: 10.1016/j.chemosphere.2019.01.075 [11] DAI Z, LI D, AO Z, et al. Theoretical exploration of VOCs removal mechanism by carbon nanotubes through persulfate-based advanced oxidation processes: Adsorption and catalytic oxidation[J]. Journal of Hazardous Materials, 2021, 405: 124684. doi: 10.1016/j.jhazmat.2020.124684 [12] HONETSCHLÄGEROVÁ L, MARTINEC M, ŠKAROHLÍD R. Coupling in situ chemical oxidation with bioremediation of chloroethenes: a review[J]. Reviews in Environmental Science and Bio/Technology, 2019, 18: 699-714. doi: 10.1007/s11157-019-09512-1 [13] YU B, YUAN Z, YU Z, et al. BTEX in the environment: An update on sources, fate, distribution, pretreatment, analysis, and removal techniques[J]. Chemical Engineering Journal, 2022, 435: 134825. doi: 10.1016/j.cej.2022.134825 [14] TAN B, HE Z, FANG Y, et al. Removal of organic pollutants in shale gas fracturing flowback and produced water: A review[J]. Science of the Total Environment, 2023, 883: 163478. doi: 10.1016/j.scitotenv.2023.163478 [15] ZHU B, FRIEDRICH S, WANG Z, et al. Availability of nitrite and nitrate as electron acceptors modulates anaerobic toluene-degrading communities in aquifer sediments[J]. Frontiers in Microbiology, 2020, 11: 559985. [16] ZHAO Y, QU D, HOU Z, et al. Enhanced natural attenuation of BTEX in the nitrate-reducing environment by different electron acceptors[J]. Environmental Technology, 2015, 36(5): 615-621. doi: 10.1080/09593330.2014.954006 [17] CORSEUIL H X, GOMEZ D E, SCHAMBECK C M, et al. Nitrate addition to groundwater impacted by ethanol-blended fuel accelerates ethanol removal and mitigates the associated metabolic flux dilution and inhibition of BTEX biodegradation[J]. Journal of Contaminant Hydrology, 2015, 174: 1-9. doi: 10.1016/j.jconhyd.2014.12.004 [18] CHANG Y, PENG Y, CHEN K, et al. The effect of different in situ chemical oxidation (ISCO) technologies on the survival of indigenous microbes and the remediation of petroleum hydrocarbon-contaminated soil[J]. Process Safety and Environmental Protection, 2022, 163: 105-115. doi: 10.1016/j.psep.2022.05.019 [19] KOLHATKAR R, SCHNOBRICH M. Land application of sulfate salts for enhanced natural attenuation of benzene in groundwater: A case study[J]. Groundwater Monitoring & Remediation, 2017, 37(2): 43-57. [20] WARTELL B, BOUFADEL M, RODRIGUEZ-FREIRE L. An effort to understand and improve the anaerobic biodegradation of petroleum hydrocarbons: A literature review[J]. International Biodeterioration & Biodegradation, 2021, 157: 105156. [21] RAJBONGSHI A, GOGOI S B. A review on anaerobic microorganisms isolated from oil reservoirs[J]. World Journal of Microbiology and Biotechnology, 2021, 37(7): 111. doi: 10.1007/s11274-021-03080-9 [22] 梁美娜, 陈余道, 张燕, 等. 气相色谱法测定地下水的乙醇和单环芳香烃[J]. 环境科学与技术, 2009, 32(11): 130-132. doi: 10.3969/j.issn.1003-6504.2009.11.030 [23] LIANG C, HUANG C, CHEN Y. Potential for activated persulfate degradation of BTEX contamination[J]. Water Research, 2008, 42(15): 4091-4100. doi: 10.1016/j.watres.2008.06.022 [24] 吕长青, 母玉凤. 水样中亚铁及总铁含量连续测定方法探讨[J]. 油气田环境保护, 2013, 23(1): 50-52. doi: 10.3969/j.issn.1005-3158.2013.01.016 [25] 朱雪强, 花港, 周来, 等. “蜡烛”型过硫酸盐缓释材料释放行为与机制[J]. 中国环境科学, 2023, 43(2): 601-609. doi: 10.3969/j.issn.1000-6923.2023.02.012 [26] WANG H, CHEN Y, MENG W, et al. Preferential removal of benzene, toluene, ethylbenzene, and xylene (BTEX) by persulfate in ethanol-containing aquifer materials[J]. Environmental Science and Pollution Research, 2022, 29(12): 17617-17625. doi: 10.1007/s11356-021-16926-4 [27] 郑杲, 蒋亚萍, 陈余道, 等. 过硫酸盐去除石灰土介质中汽油BTEX的效果及乙醇的影响[J]. 环境科学学报, 2022, 42(7): 217-224. [28] 孟伟, 蒋亚萍, 陈余道, 等. 几种含水介质中过硫酸钠去除苯系物/乙醇的效果和影响[J]. 环境化学, 2019, 38(10): 2187-2194. doi: 10.7524/j.issn.0254-6108.2018112804 [29] KAKOSOVÁ E, HRABÁK P, ČERNÍK M, et al. Effect of various chemical oxidation agents on soil microbial communities[J]. Chemical Engineering Journal, 2017, 314: 257-265. doi: 10.1016/j.cej.2016.12.065 [30] DIELS L, Van ROY S, TAGHAVI S, et al. From industrial sites to environmental applications with Cupriavidus metallidurans[J]. Antonie van Leeuwenhoek, 2009, 96: 247-258. doi: 10.1007/s10482-009-9361-4 [31] WAIGI M G, KANG F, GOIKAVI C, et al. Phenanthrene biodegradation by sphingomonads and its application in the contaminated soils and sediments: A review[J]. International Biodeterioration & Biodegradation, 2015, 104: 333-349. [32] WANG M, WANG L, SHI H, et al. Soil bacteria, genes, and metabolites stimulated during sulfur cycling and cadmium mobilization under sodium sulfate stress[J]. Environmental Research, 2021, 201: 111599. doi: 10.1016/j.envres.2021.111599 [33] PII Y, MARASTONI L, SPRINGETH C, et al. Modulation of Fe acquisition process by Azospirillum brasilense in cucumber plants[J]. Environmental and Experimental Botany, 2016, 130: 216-225. doi: 10.1016/j.envexpbot.2016.06.011 [34] RAWAT D, SHARMA U, PORIA P, et al. Iron-dependent mutualism between Chlorella sorokiniana and Ralstonia pickettii forms the basis for a sustainable bioremediation system[J]. ISME communications, 2022, 2(1): 83. doi: 10.1038/s43705-022-00161-0 -



 下载:
下载: