-
硅钙基工业固废是我国工业固废的主要组成部分之一,其中钢渣和粉煤灰是2种典型代表。我国现阶段钢渣年产出量达1×109 t以上[1],粉煤灰年产出量达7.48×109 t以上[2],目前钢渣和粉煤灰主流的资源化策略主要是以整体的建材化利用为主,少量用于农业利用及矿坑回填利用等,这几类技术虽可实现大规模消纳而实现固废减量化,但因资源化产品价值低而缺乏市场竞争力,同时,低值化利用技术应用过程中,很容易导致2次污染的产生,其综合利用率仅分别为20%~30%和74.7%,导致大量的钢渣和粉煤灰堆存[3-4],因此,加快推进硅钙基工业固废高值绿色利用,解决整体建材化的运输路径限制等难题,并协同解决目前的系列环境难题实现协同利用,对我国可持续循环发展、环境保护具有重要意义。
同时,近年来随着金属钴的广泛应用,其开采、冶炼等工业制造过程中产生大量含钴废水,尤其是核电站及其他利用核能的相关研究机构产生的含钴废水中具有中低水平的放射性,对环境和人体造成了不可预估的危险[5]。目前,在含钴废水处理方法中,吸附法因为操作简单、水质要求低、性能高效等特点成为主要研究方向之一[6]。然而,当前常用的吸附剂(如活性炭、活性氧化铝等材料)通常存在制备工艺复杂、成本高等缺点,不适于大规模工业含钴废水处理。同时,饱和吸附后吸附剂的回收再利用技术仍亟待研究[7]。
双酚A (bisphenol A, BPA)是一种重要的化工原料,由于其单体具有良好的机械性能,被广泛应用于生产聚碳酸酯塑料、数码产品、食品容器、玩具等产品上,并通过市政污水处理厂、垃圾渗滤液与垃圾降解等过程进入到环境中[8]。BPA可与雌性激素受体结合而进一步干预体内雌激素的合成、分泌、运输、代谢、活动以及消除,会导致人体神经系统紊乱、发育异常、免疫力降低甚至诱发肿瘤[9]。此外BPA还会抑制植物根生长,引起叶片萎缩和植株矮化,影响植物营养元素和矿物质的吸收,干扰内源激素的分泌和光合作用[10]。当前高级氧化法是对环境最友好、高效的BPA去除方法,不仅能够对水中痕量BPA有良好的去除效果,同时也可以有效地矿化降解过程中产生的中间副产物,降低生物毒性。近年来,由于过一硫酸盐(peroxymonosulfate, PMS)的最终产物SO42-是惰性且无污染的,因而作为高级氧化法的氧化剂被广泛使用。但其对SO4·−自由基的活化反应通常伴随着较高的标准氧化还原电位[11],因此,催化剂的选择对BPA的降解过程具有重要影响。非均相金属催化剂,特别是钴基催化剂在活化PMS降解有机物的过程中表现出了良好的催化活性,负载型钴基催化剂是其中使用最广泛的一类[12]。然而,由于钴金属的成本过高,当前负载型钴基催化剂对于载体的研究方向主要集中在纳微米级材料,对性能要求过高导致成本提升,同时,在分离回收高度分散的催化剂过程中低回收率和高运作成本也一定程度的阻碍了其实际应用。
针对我国工业固废面临的高值化综合利用技术瓶颈和含钴废水处理的迫切需求,本研究从不同硅钙基固废结构与元素组成不同出发,以2种典型硅钙基工业固废为例,分别采用碱激发和碱溶解-沉淀法将钢渣和粉煤灰制备为清洁、高效的固废源水合硅酸钙吸附剂,对废水中的钴离子进行处理。同时,将饱和吸附后的材料经简单的热处理转化为环保、稳定的负载型钴基催化剂,催化降解废水中的有机污染物,以实现其绿色循环利用。本研究考察了固废源水合硅酸钙吸附钴离子后的结构、形貌以及晶相特征,重点研究了在添加PMS后,含钴催化剂对BPA的降解性能及其降解机制。本研究可为提升硅钙基工业固废的利用和含钴和有机污染物废水的处理提供技术参考,具有废物-资源-资源全流程绿色循环利用的意义。
-
水玻璃溶液(NaO·nSiO2)、无水乙醇(C2H6O)、硝酸(HNO3)、甲醇(CH4O)、叔丁醇 (C4H10O) 、盐酸(HCl)、氢氧化钠(NaOH)、氢氧化钙(Ca(OH)2)、偏硅酸钠(Na2SiO3·9H2O)、过硫酸氢钾(2KHSO5·KHSO4·K2SO4)、硝酸钴(Co(NO3)2)、乙腈(C2H3N)等购自上海麦克林生化科技有限公司,双酚A((CH3)2C(C6H4OH)2)购自上海阿拉丁生化科技股份有限公司,5, 5-二甲基-1-吡咯啉-N-氧化物(DMPO)购自国药集团化学试剂有限公司。实验中使用的化学药品和溶剂除单独注明外均为分析纯。
-
1)固废源水化硅酸钙制备。将取自河北省某钢厂的粗钢渣原料研磨至200目以下,并分别使用超纯水和无水乙醇清洗2次,于60 ℃的烘箱中烘干24 h备用。称量10 g钢渣缓慢加入混合水玻璃(质量分数为25%)和NaOH溶液(100 mL的1 mol·L−1 NaOH)的碱激发剂中,在60 ℃下长时间搅拌,然后固液分离,收集悬浮液中钢渣源水合硅酸钙(steel slag source-calcium silicate hydrate, SS-CSH),然后采用超纯水洗涤3次,采用无水乙醇洗涤2次,于60 ℃的烘箱中烘干24 h,制备得到复合材料SS-CSH。此外,在水热合成反应釜中加入粉煤灰、NaOH溶液和适量的超纯水,得到粉煤灰与NaOH质量比为2的混合液,充分混合后至于水热合成反应釜,升温至110 ℃反应30 min,待反应结束后收集浸出液,然后与Ca(OH)2溶液混合,采用沉淀法制备出粉煤灰源水合硅酸钙(fly ash-calcium silicate hydrate, FA-CSH )复合材料。
2)钢渣源(Co@SS-CSH-700)和粉煤灰源负载型钴基催化剂(Co@FA-CSH-700)的制备,将500 mg的固废源水合硅酸钙吸附剂(SS-CSH和FA-CSH)分别加入500 mg·L−1的Co2+模拟废水,在pH=7、25 ℃和转速600 r·min−1的反应条件下搅拌2 h,然后将吸附Co2+后的Co@SS-CSH和Co@FA-CSH置于高速离心机中以8 000 r·min−1的转速离心5 min,回收沉淀物后于80 ℃烘箱中烘干12 h,然后将沉淀物置于马夫炉中于700 ℃下焙烧2 h,冷却后即得到Co@SS-CSH-700和Co@FA-CSH-700催化剂。
-
配置30 mg·L−1的BPA溶液作为储备液备用。有机污染物BPA的催化降解实验于100 mL的烧杯中进行,在磁力搅拌器上以600 r·min−1的转速搅拌30 min达到吸附平衡,反应温度控制在25 ℃。加入PMS,分别在1、2、5、10、20和30 min时用移液枪取1 mL BPA溶液反应溶液,并快速与1 mL的甲醇混合,抑制氧化反应的继续进行,经0.22 μm聚醚砜膜过滤后去除杂质,使过高效液相色谱仪(Agilent 126)进行测定,每组实验重复进行2次取平均值。为避免引入的其他离子对BPA降解过程产生影响,在降解实验中,除pH对BPA降解性能影响实验外,其他实验均不调节pH。BPA的降解率根据式(1)进行计算。
式中:R为降解率,%;C0和Ct分别代表BPA在降解过程中初始和t时刻的质量浓度,mg·L−1。
-
采用扫描电子显微镜(SEM,Zeiss Sigma 300)和透射电子显微镜(TEM,FEI Talos F200X)对钢渣、粉煤灰及其所制备吸附剂、催化剂样品表面形貌进行观察。通过X射线光电子能谱仪(XPS,PHI 5000 Versaprobe III)测定固废源水合硅酸钙和负载型钴基催化剂表面元素及吸附Co2+后钴、氧元素的存在状态,以及催化前后表面元素的价态变化。通过X射线衍射仪(XRD,Rigaku Smartlab)对样品的物质结构组成进行表征。通过高效液相色谱仪测定初始及降解过程中BPA的浓度,温度设定为30 ℃,流动相为50%超纯水和50%的色谱级乙腈,流速为1 mL·min−1,检测波长设定为278 nm。通过顺磁共振波谱仪(EPR)可以检测活化PMS降解有机污染物BPA时产生的活性自由基。
-
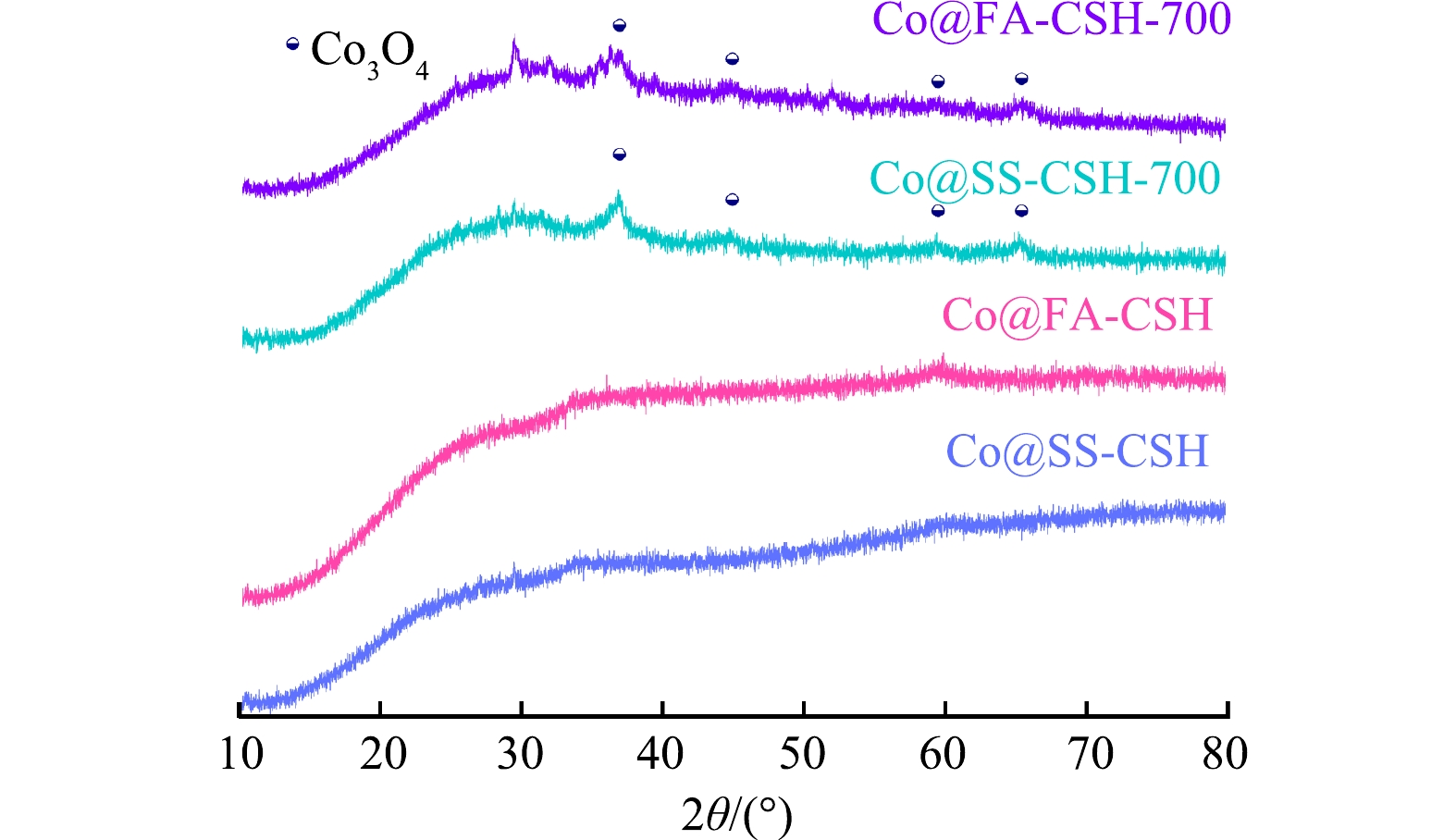
1)固废源负载型钴基催化剂的物相表征。对Co@SS-CSH和Co@FA-CSH样品及700 ℃焙烧后的Co@SS-CSH-700和Co@FA-CSH-700样品的物相进行分析,如图1所示,与煅烧前相比,Co@SS-CSH-700和Co@FA-CSH-700样品中晶体的衍射峰更加明显,在2θ=36.902°、44.879°、59.451°和65.342°处出现新的衍射峰,对应氧化钴物相的标准卡片(Co3O4,PDF#76-1802),说明吸附过程产生的Co(OH)2沉淀经过700 ℃的高温反应,转化为Co3O4。含钴金属氧化物Co3O4已经被证明在催化PMS生成活性自由基方面表现出较高的催化活性[9],因此,热处理后的Co@SS-CSH-700和Co@FA-CSH-700样品可作为后续活化PMS降解BPA实验的催化剂。
2)固废源负载型钴基催化剂的形貌表征。为了观察制备后的水化硅酸钙形貌,对SS-CSH和FA-CSH样品进行TEM表征。SS-CSH样品是由许多交错的超薄纳米片(图2(a)和图2(b))组成,纳米片堆叠到一起。由图2(a)中内嵌图可见,选择区电子衍射图只有同心漫射环,这是典型非晶态材料电子衍射特征图像,证实了SS-CSH样品为非晶结果,此外,图2(c)为SS-CSH纳米片的超高分辨TEM图,在图中没有观察到明显的晶格条纹。因此,可以判断SS-CSH样品是由层状纳米片叠加而成的无定型状非晶态结构。选择具有代表性的FA-CSH样品进行TEM分析。由图2(d)可见,选择区电子衍射图像出现的漫射环也同样证明FA-CSH样品没有结晶。由图2(d)、图2(e)和图2(f)中可以清楚的看出,由粉煤灰为前驱体制备的FA-CSH是由许多超薄交错的纳米片团聚组成,对FA-CSH样品纳米片进行高分辨率TEM表征未观察到明显的晶格条纹。
对吸附后的Co@SS-CSH样品进行SEM分析,结果如图3(a)和图3(b)所示。与吸附前的SS-CSH相比,吸附Co2+后的Co@SS-CSH样品表面出大量氢氧化钴等纳米絮状结构。吸附前表面的大量片状结构被堵塞,但Co@SS-CSH样品内部仍有片状结构,这说明Co2+的吸附过程不完全。图3显示SS-CSH的元素组成主要为O、Si和Ca,Co元素。综上分析,废水中的Co2+已经被SS-CSH吸附剂所吸附且在吸附剂表面发生了沉淀反应。同时,对吸附Co2+后的Co@FA-CSH也进行SEM和元素面扫分析,与图2中吸附前的FA-CSH样品相比,Co@FA-CSH样品在吸附后表面也变得粗糙,结合Co@FA-CSH样品的元素面扫结果可知,Co元素均匀吸附在FA-CSH样品表面。
进一步分析了Co@SS-CSH-700和Co@FA-CSH-700催化剂的微观结构(图4)。可见,相较于中Co@SS-CSH和Co@FA-CSH样品片状结构被大量堵塞(图3),焙烧后的催化剂团状沉淀颗粒均有所变少,重新出现大量的颗粒堆积。这再次证明Co(OH)2沉淀在高温下发生化学反应生成Co3O4。对比2种催化剂的表面形貌可以看出,Co@FA-CSH-700样品的结构更加蓬松且片状结构更小,这可能是由于其前驱体FA-CSH样品更纯净,而Co@SS-CSH-700样品中仍有部分钢渣成分中的重金属离子,在空气中以700 ℃高温焙烧时可能会生成少量其他金属氧化物,导致形貌更加密实紧致。
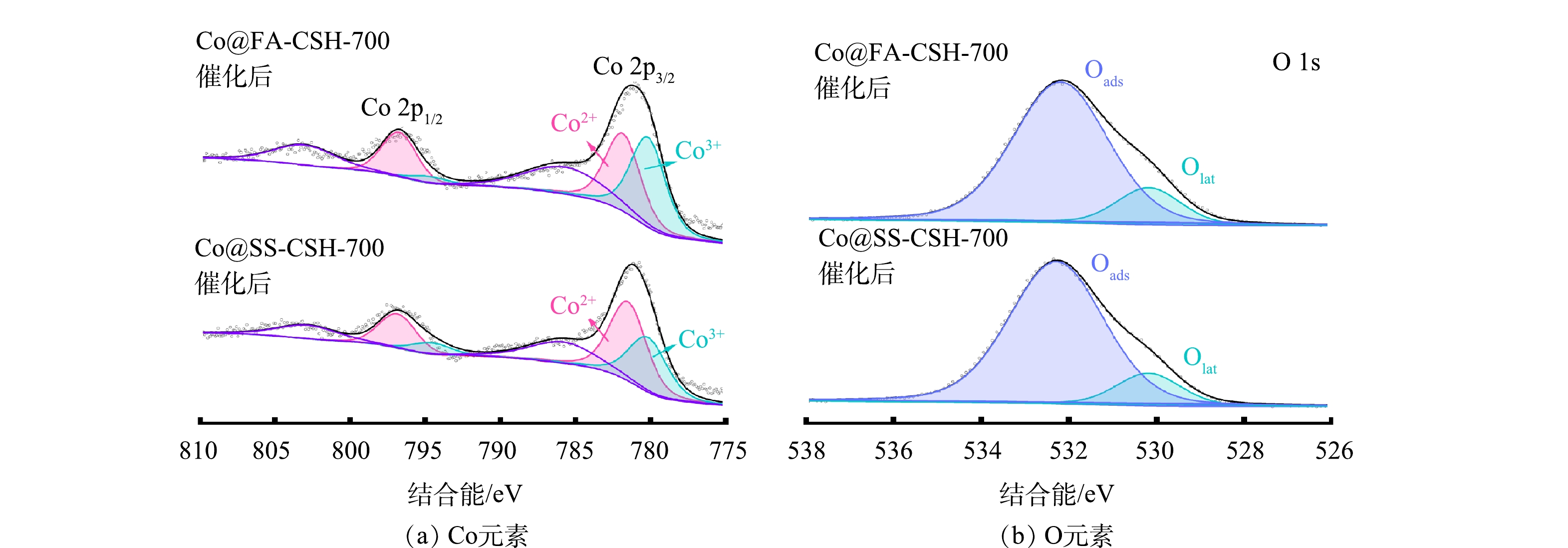
对Co@SS-CSH-700和Co@FA-CSH-700样品进行高分辨率XPS表征,进一步分析2种催化剂表面元素存在形式和含量。如图5(a)所示,热处理后2种催化剂在Co2p3/2和Co2p1/2自旋轨道电子的结合能分别为796.4 eV和780.7 eV,比值约为2:1,其中位于797.51 eV和780.2 eV处的峰为Co2+的特征峰,位于796.4 eV和780.2 eV处的峰为Co3+的特征峰,同时,将803.0 eV和786.2 eV处出现的峰视为Co2+的特征峰。计算得到Co@SS-CSH-700和Co@FA-CSH-700中Co2+/Co3+的比值分别为0.37和0.52,与Co@SS-CSH和Co@FA-CSH相比,Co3+含量有明显的增多。这说明在热处理过程中,大部分Co2+氧化为Co3+。O元素的高分辨率光谱如图5(b)所示。O1s在532.2 eV处的峰可表示吸附氧(Oads),代表催化剂表面的羟基官能团或氢氧结合物,在530.3 eV处出现的峰可表示为晶格氧(Olat)。Co@SS-CSH和Co@FA-CSH样品中仅存在Oads峰,说明吸附后O元素的存在形式主要为Co(OH)2,而热处理后催化剂中均出现Olat峰,且比例分别为19.2%和17.5%,这与Co3O4中O元素的存在形式是一致的。
-
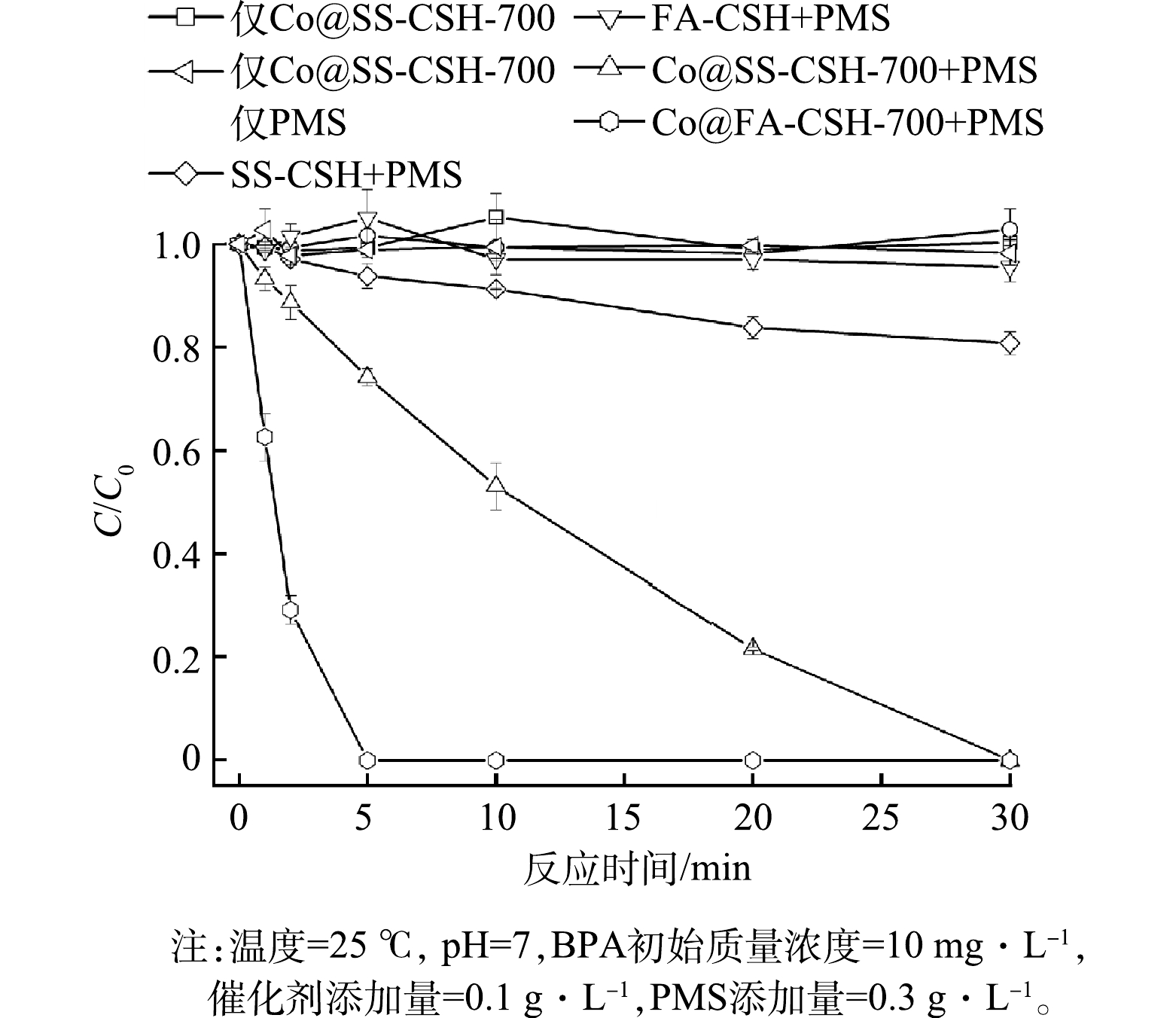
1)催化体系对BPA降解性能的影响。选择相同的反应条件,分别加入10 mg BPA,形成Co@SS-CSH-700、Co@FA-CSH-700、PMS、PMS/SS-CSH、PMS/FA-CSH、PMS/Co@SS-CSH-700和PMS/Co@FA-CSH-700等7种体系,研究7种体系下溶液中BPA (10 mg·L−1,100 mL)的降解结果,以此研究Co@SS-CSH-700和Co@FA-CSH-700催化剂的催化效果。图6给出了不同体系下的降解结果,表明在仅有PMS存在的溶液体系中,30 min内BPA的降解曲线有一定程度的波动,最终降解效率小于3.0%,这说明仅有PMS存在对BPA几乎没有降解,当溶液中分别只添加Co@SS-CSH-700和Co@FA-CSH-700催化剂时,BPA的降解效率同样极低,当PMS分别与SS-CSH和FA-CSH吸附剂同时存在时,BPA的降解效率均有一定程度的提高。其中,PMS/FA-CSH体系中,BPA的降解效率为4.4%,而在PMS/SS-CSH体系中,BPA的降解效率可以达到20.2%,这是因为SS-CSH吸附剂中含有的少量重金属可以为PMS提供催化活性位点,从而降解部分BPA。当分别加入PMS/Co@SS-CSH-700和PMS/Co@FA-CSH-700体系时,30 min内BPA的降解效率均可达到99.9%以上,这证实了Co@SS-CSH-700和Co@FA-CSH-700催化剂均可以高效活化PMS降解有机物。这是因为PMS/SS-CSH这2种催化剂中的钴是以氢氧化钴的形式存在,经过煅烧后形成的氧化钴具有更好的催化活性,同时煅烧留下了大量的规则孔洞,提供了大量的PMS催化活性位点,从而有效提升了催化效率。值得注意的是,在PMS/Co@FA-CSH-700体系中,BPA在5 min内即降解完全,Co@FA-CSH-700展现出比Co@SS-CSH-700更好的催化活性。这是由于FA-CSH吸附剂对Co2+的吸附容量更大,进行热处理后,Co@FA-CSH-700催化剂中Co3O4含量更多;同时,Co@FA-CSH-700催化剂的蓬松结构也可以为PMS提供更多的活性位点,促进BPA的降解。
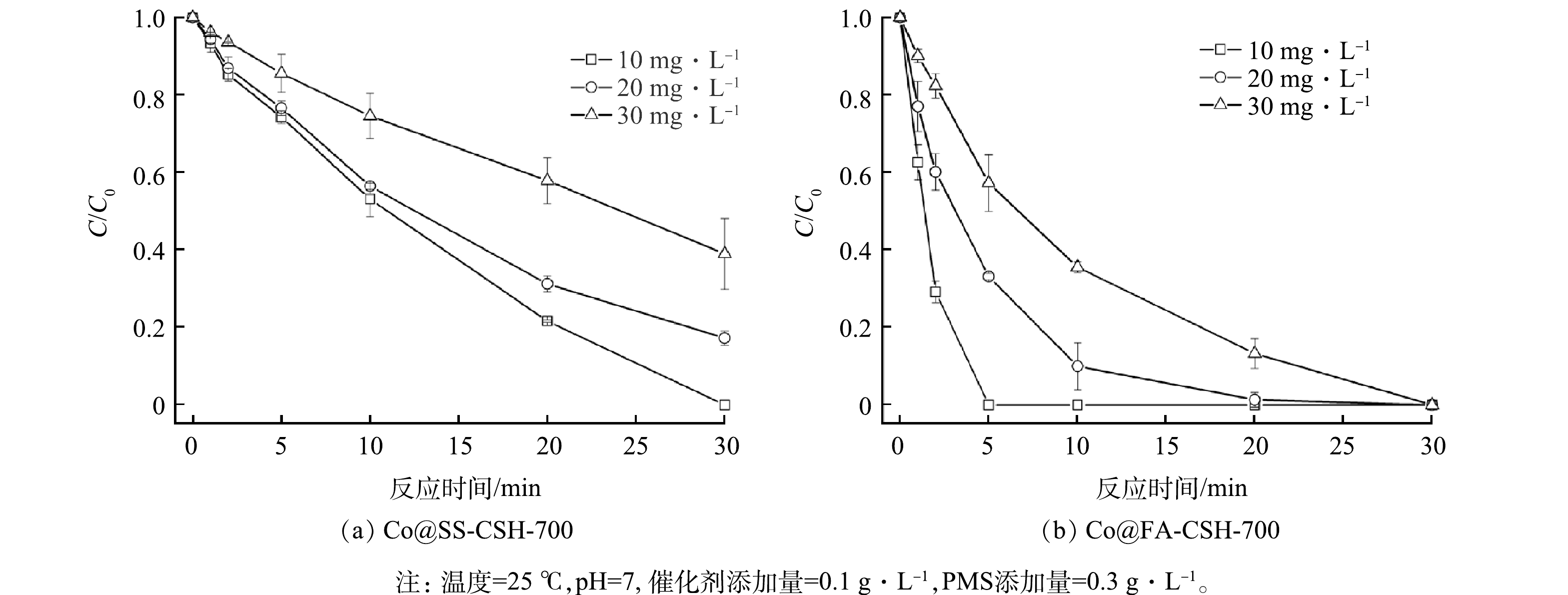
2)初始质量浓度对BPA降解性能的影响。实际废水受到一定干扰时,BPA的排放浓度会有较大波动,为了研究不同BPA初始质量浓度对降解效果的影响。图7给出了分别以Co@SS-CSH-700和Co@FA-CSH-700作催化剂时对不同BPA初始质量浓度梯度的降解曲线。在PMS/Co@SS-CSH-700催化剂体系中,BPA初始质量浓度为10 mg·L−1时,30 min内降解效率可以达到99.9%以上;随着BPA的初始质量浓度从10 mg·L−1增加到30 mg·L−1,其降解效率也从99.9%降低到61.0%。而在PMS/Co@FA-CSH-700催化剂体系中,BPA的初始质量浓度范围在10~30 mg·L−1之间,30 min内均可达到完全降解,其中当BPA的初始质量浓度为10 mg·L−1时,完全降解时间仅为5 min。2种催化剂对BPA初始质量浓度梯度实验均可说明,初始质量浓度的增加对BPA降解过程有着不利影响。这是由于质量浓度的增加,会使更多的目标有机物BPA竞争PMS在催化剂表面的活性位点,导致降解效率的降低,而Co@FA-CSH-700催化剂中活性位点较多,因此在BPA初始质量浓度较高时仍有良好的降解能力。
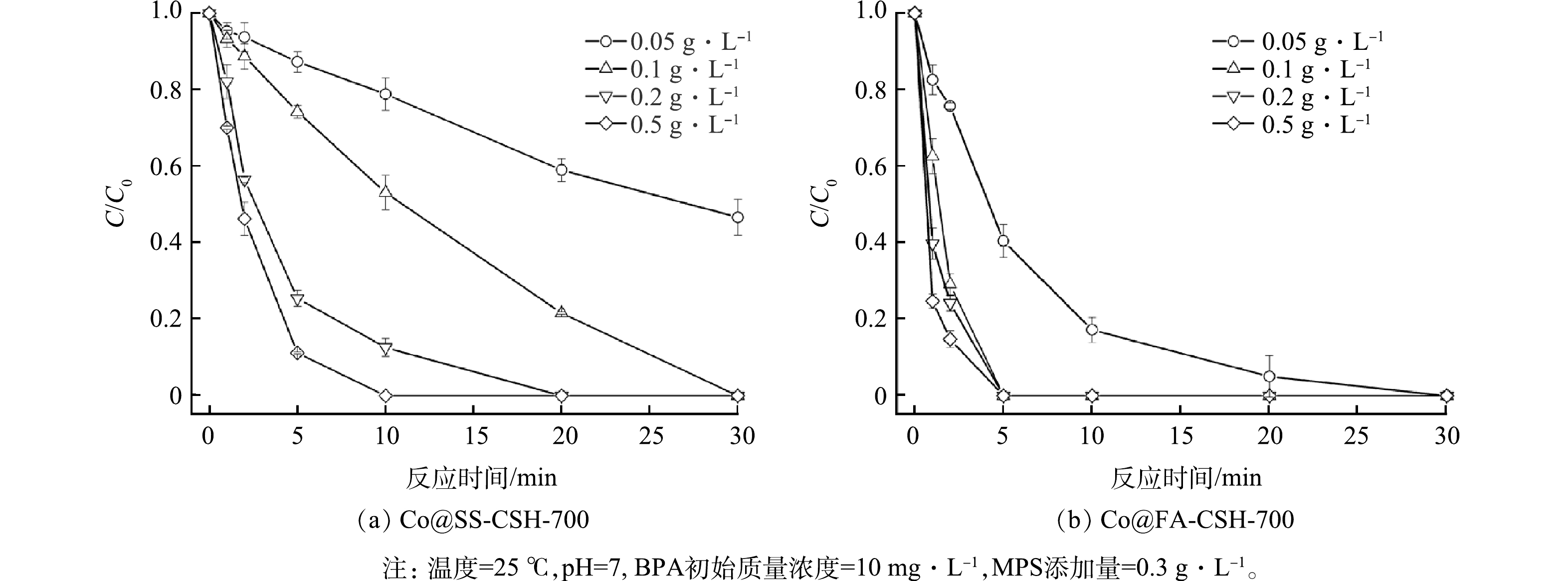
3)催化剂添加量对BPA降解性能的影响。图8(a)给出了不同Co@SS-CSH-700催化剂添加量对BPA降解效率的影响。结果表明,当催化剂用量为0.05 g·L−1时,BPA的降解效率仅为53.4%;而催化剂添加量增加至0.1 g·L−1时,降解效率即可达到99.9%。随着催化剂的添加量继续增加至0.2 g·L−1和0.5 g·L−1时,20 min内BPA即可到达完全降解。Co@FA-CSH-700催化剂添加量对BPA降解效率的影响曲线如图8(b)所示,结果表明,在低催化剂添加量时,BPA降解效率即达到99.9%;随着催化剂添加量增加到0.1 g·L−1时,5 min内BPA即可完全降解,继续增加催化剂的添加量难以进一步缩短降解时间。综合2种催化剂添加量对BPA降解效率的影响可以说明,催化剂添加量的增多可以一定程度上缩短BPA的降解时间;当添加量增加大至一定范围时,BPA的降解时间趋于稳定。这是因为当催化剂添加量的增多可以增加BPA的表面吸附位点及PMS的有效活性位点,从而提高了BPA的降解速率;而Co@FA-CSH-700催化剂的表面位点较多,在催化剂较低时仍有较高的降解速率;当催化剂添加量增大一定程度时,溶液中PMS的含量成为限制因素,导致BPA降解时间不会进一步缩短。
4) PMS添加量对BPA降解性能的影响。PMS添加量对BPA降解效率的影响如图9所示。结果表明,随着PMS的添加量从0.02 g·L−1增加到0.5 g·L−1,在PMS/Co@SS-CSH-700和PMS/Co@FA-CSH-700催化体系中BPA的降解率分别由57.3%升至99.9%和99.5%升至99.9%。分析主要原因为,当PMS的添加量增多时,产生的反应活性自由基变多,降解率明显升高。而PMS的添加量继续增大至100 mg·L−1和200 mg·L−1时,BPA的降解速率有一定程度的降低,说明体系中过多PMS对BPA的降解过程有不利影响。这是由于过多的PMS会与BPA竞争吸附位点从而影响降解过程;PMS需要一定数量的催化剂进行活化,当催化剂添加量一定时,反应体系中活性位点数量一定,BPA降解速率增长缓慢;过多PMS会发生自耦合反应,导致SO4·−自由基减少(式(2));过多的PMS可能会与SO4·−与·OH自由基发生清除反应(式(3))[9, 13]。
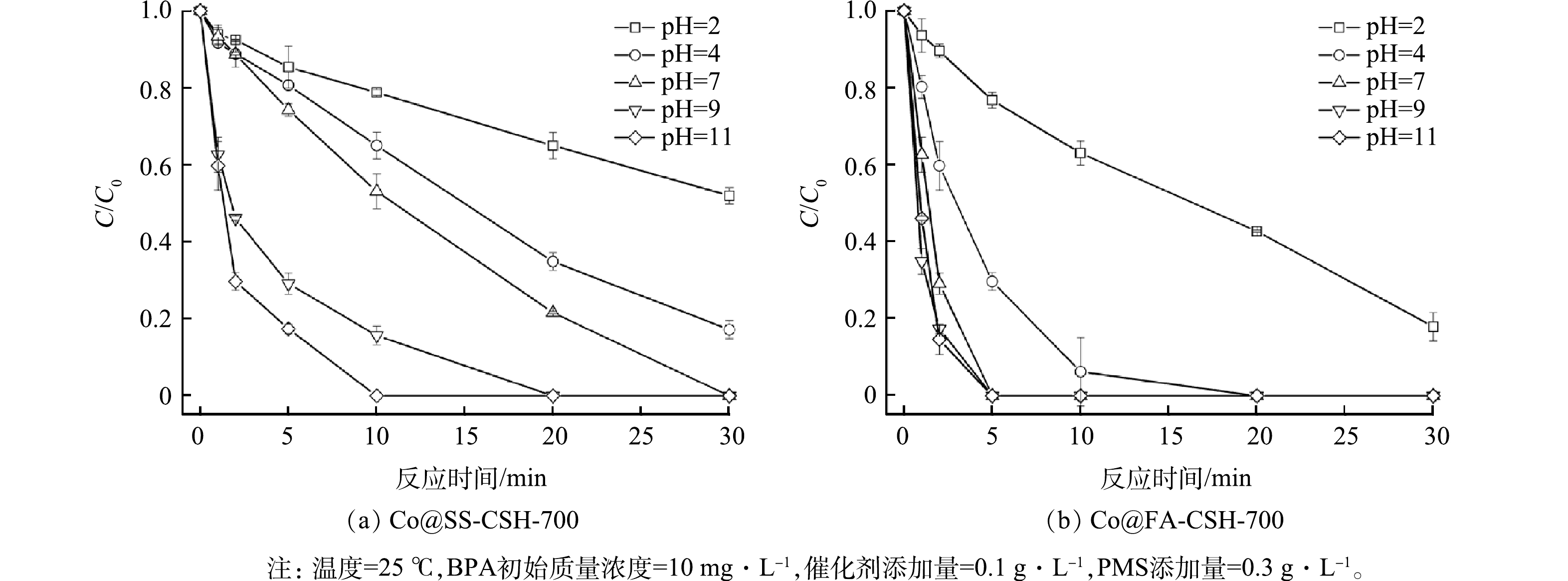
5) pH对BPA降解性能的影响。实际含BPA废水的成分较为复杂,当受到外界的干扰时,废水中pH常会有较大波动,为了探究溶液pH对BPA降解的影响,本研究考察了Co@SS-CSH-700和Co@FA-CSH-700分别在pH为2~11内对BPA的降解效率,结果如图10所示。结果表明,在pH分别为2和4时,PMS/Co@SS-CSH-700催化体系中BPA降解率仅为48.0%和82.8%;随着体系pH升高,BPA的降解效率显著增强,并在pH为7时BPA完全降解;随着体系pH的继续升高,BPA降解速率增加有所变缓。当PMS/Co@FA-CSH-700催化体系的pH为2时,BPA的降解率为82.1%;随着溶液pH的提升,降解过程完全;然而当pH达到一定范围时,BPA的降解速率达到稳定甚至有降低的趋势。
综上可知,在酸性条件下,BPA的降解速率较低,这是由于环境中的H+捕捉SO4·−与·OH自由基,导致活性自由基变少,催化体系的氧化能力下降[14];较高浓度的H+也会一定程度抑制SO4·−自由基的生成[15];PMS在酸性条件下较为稳定,氧化能力减弱[16]。而在碱性环境下,催化体系更容易形成Co-OH络合物,有利于PMS活化过程中SO4·−自由基的生成[17];另一方面,与HSO5−相比,碱性溶液中更容易被活化的SO52-含量较大[18];PMS在碱性环境中通过自降解反应产生的单线态氧(1O2)也可有效促进BPA的降解[19]。然而,随着pH的增长,BPA的降解速率没有明显提升,甚至有降低的趋势。这可能由于碱性环境中,溶液中OH−吸附在催化剂表面上,与PMS之间产生了静电斥力,不利于催化剂与PMS的接触,削弱了体系的氧化能力导致降解反应速率提升不明显[20];同时,在强碱环境中,PMS的存在不稳定,部分会被抑制活化分解,甚至会以非自由基的形式发生自分解反应[9];此外,强碱环境中SO4·−自由基易转化为·OH自由基,进一步转化为氧化能力较弱的O·−自由基,最终导致BPA的降解效率降低。
-
1)催化剂元素价态分析。利用XPS对降解后的催化剂进行表面化学状态探究,催化后的Co@SS-CSH-700和Co@FA-CSH-700催化剂中Co和O元素的含量均没有明显差异,通过高分辨率XPS扫描,进一步探究催化前后催化剂表面Co元素和O元素的价态变化情况。如图11(a)所示,Co2p3/2和Co2p1/2自旋轨道电子的结合能分别为797 eV和781 eV;位于797.51 eV和781.9 eV处的峰为Co2+,位于780.2 eV的处的峰代表Co3+;同时,将803.1 eV和786.3 eV处出现的峰视为Co2+的振荡卫星峰。计算得到催化后Co@SS-CSH-700和Co@FA-CSH-700中Co2+/Co3+的比值分别为1.83和1.54,与催化前的样品相比,Co3+含量有所降低,表明在催化过程中Co元素的存在形式发生了变化,一部分Co3+被还原为Co2+。这可能是由于在降解过程中,在Co2+氧化为Co3+的同时,PMS中的HSO5−还原为SO4·−和·OH自由基;同时,体系中SO5−会氧化为HSO4−,使得Co3+又重新还原为Co2+[21]。因此在降解过程中,Co2+与Co3+的含量是动态平衡的,催化前Co元素主要由Co3+存在,因此在催化后,Co2+的含量有一定的程度的增加。O元素的高分辨率光谱如图11(b)所示,O 1s在532.2 eV处的峰可表示吸附氧(Oads),在530.3 eV处出现的峰代表晶格氧(Olat)[10],且催化后的Co@SS-CSH-700和Co@FA-CSH-700催化剂中Olat/Oads比例分别为17.6%和18.7%,这与催化前O元素的存在形式基本保持一致。说明降解完成后,催化剂的性质均基本保持不变,具有较强的稳定性和持续使用能力。
2) PMS的活化机理。在目前已知的报道中,PMS在催化剂、热、电、光等条件的激发下,可以产生SO4·−、·OH和单线态氧1O2等[22]。这些自由基的产生会影响PMS活化降解BPA的反应速率和降解路径。为了探究PMS/Co@SS-CSH-700和PMS/Co@FA-CSH-700催化体系中存在的活性自由基,本研究采用化学探针法捕捉体系降解过程可能会产生的活性自由基。有研究表明,叔丁醇(tert butyl alcohol, TBA)可以作为·OH的探针[23],这是因为TBA与SO4·−的反应速率常数仅为·OH反应速率常数的1/1 000,对SO4·−的产生干扰极小;乙醇(EtOH)因为对SO4·−与·OH均有较高的反应速率常数,且大小接近,可以同时作为SO4·−与·OH自由基的化学探针[24],通过对比TBA的淬灭结果,可判断SO4·−是否具有活性;1O2在水溶液中只能存在3.5 ms,而在氧化氘(俗称重水,氢原子被氘原子取代而形成的水分子,D2O)中的稳态时间可以延长18倍,故D2O可以作为1O2的化学探针[25]。
由图12(a)可见,在PMS/Co@SS-CSH-700催化体系中,加入TBA后,BPA的降解速率有些许变缓,而在30 min内仍可达到降解完全,这说明·OH在BPA降解过程中贡献较小;加入EtOH后可以发现,BPA的降解效率仅为18.5%,对比TBA淬灭实验的结果,可以说明SO4·−对BPA的去除起主要作用;而加入D2O后BPA的降解速率与空白组基本保持一致,表示体系中可能不存在1O2。由图12(b)可以看出,在PMS/Co@FA-CSH-700催化体系中加入TBA和D2O后,BPA的降解速率均明显变缓,说明·OH和1O2对BPA降解过程有一定促进作用;而加入EtOH后发现BPA的降解产生了明显的抑制效应,可推测SO4·−在BPA降解过程中发挥关键作用。
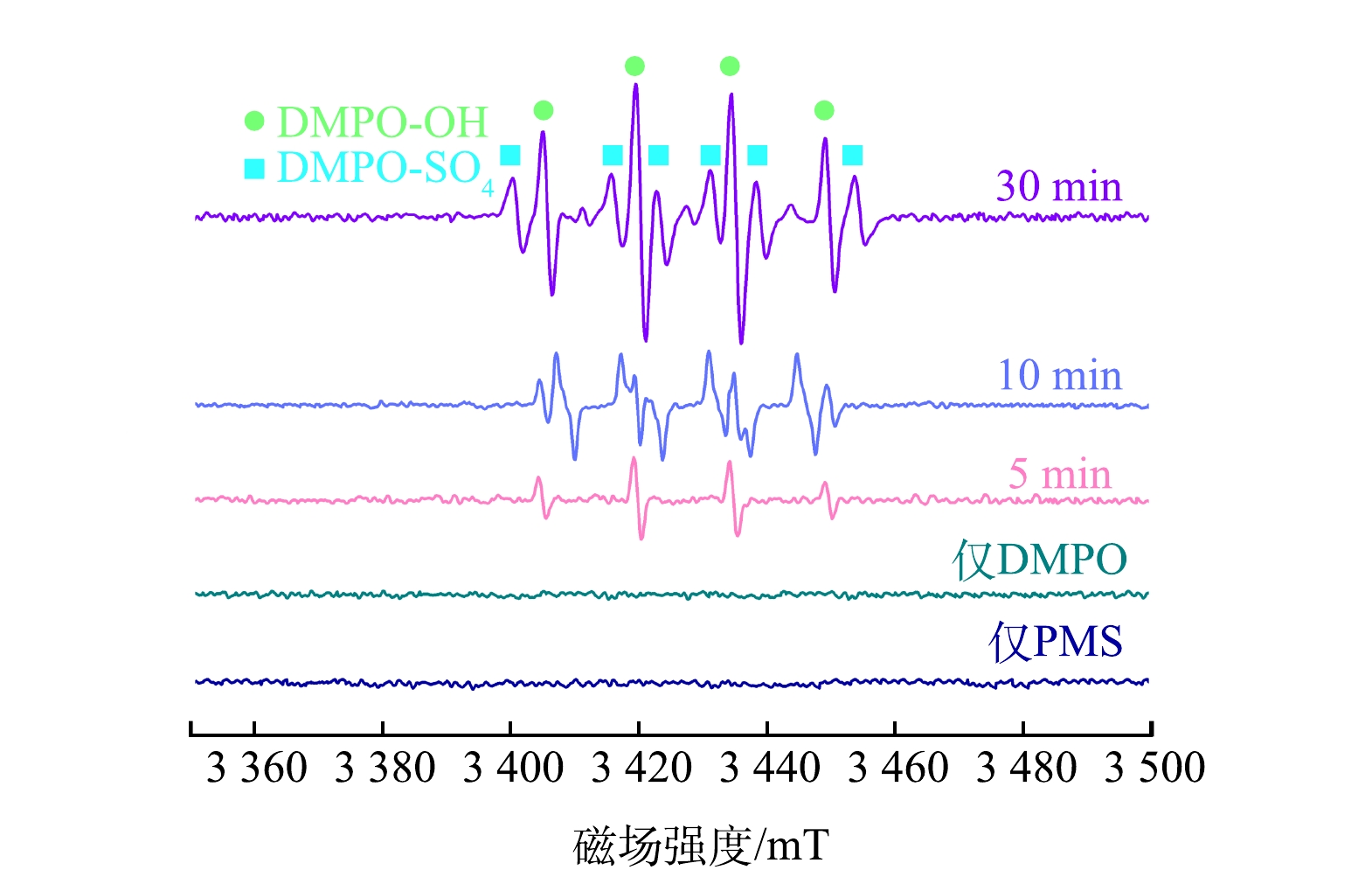
通过电子顺磁共振技术(electron paramagnetic resonance, EPR)可以定性和半定量的检测PMS/催化剂体系在BPA降解过程中产生的自由基。本研究利用DMPO作为自由基捕获剂,选择催化性能较好的Co@FA-CSH-700进行EPR测试,结果如图13所示。结果表明,在单独存在DMPO和PMS的谱图中均未发现特征峰,说明没有催化剂时,体系不能产生活性自由基;当加入Co@FA-CSH-700催化剂后,图谱出现DMPO-OH的四重特征峰,这说明体系中产生了·OH;而从10 min后开始出现DMPO-SO4的六重特征峰,且峰强逐渐变高。
综上所述,固废源负载型钴基催化剂活化PMS产生的活性自由基在BPA的降解过程中发挥着重要作用,且SO4·−由于较高的氧化潜能而比其他自由基更有效。本研究中催化降解BPA的机理和过程为:首先,通过Co2+接受1个电子使PMS中的过氧化物键(-O-O-)断裂而产生·OH[21](式(4));其次,Co2+在催化剂表面转移电子到PMS,从而产生表面结合的SO4·−自由基(式(5)),Co3+与PMS反应生成SO5·−和Co2+[10](式(6));与此同时,SO4·−与水分子或OH-反应生成·OH自由基(式(7)),SO4·−和·OH自由基共同攻击BPA,使其降解(式(8)和式(9))。
-
1) Co@SS-CSH-700和Co@FA-CSH-700催化剂的主要晶相均为Co3O4,且Co@FA-CSH-700催化剂的结构更加蓬松,可为PMS提供更多的活性位点,促进BPA降解。
2) PMS/Co@SS-CSH-700和PMS/Co@FA-CSH-700催化体系均可有效活化PMS降解BPA,且PMS/Co@FA-CSH-700催化体系的降解效率更高,二者的最佳添加量分别为0.2和0.1 g·L−1;PMS的添加量和反应体系pH在一定范围内上升有助于BPA的降解过程,当添加量过多及碱性过高时会导致BPA的降解效率有较为明显的降低。
3)在PMS/Co@SS-CSH-700和PMS/Co@FA-CSH-700催化体系中,对BPA的降解过程起到决定性作用的为SO4·−,其活化机理为:Co2+通过电子传递使PMS产生·OH和SO4·−自由基;Co3+与PMS反应生成SO5·−和Co2+,Co2+和Co3+的含量动态平衡;同时,SO4·−与水分子或OH−反应生成·OH,共同攻击BPA使其降解。
硅钙源固废负载钴基催化剂活化过一硫酸盐降解双酚A的性能及机理
Performance and mechanism of degradation of bisphenol A by cobalt-based catalysts loaded on silicate-calcium solid waste activating peroxymonosulfate
-
摘要: 大宗硅钙基固废的高效清洁利用一直是研究的热点,由于其共存物相种类杂、微观结构差异大等复杂难题,导致目前主要以建材化和筑基修路等低值资源化利用为主,缺乏市场竞争力而消纳有限,实现硅钙基固废的绿色高值化利用至关重要。本研究以钢渣和粉煤灰等典型硅钙基固废为原料制备了钢渣源Co@SS-CSH-700和粉煤灰源Co@FA-CSH-700 2种催化剂,用于降解污水中的双酚A。结果表明,Co@FA-CSH-700的结构更蓬松,可为过一硫酸盐(peroxymonosulfate, PMS)提供更多活性位点,促进了双酚A(bisphenol A, BPA)降解。在PMS/Co@SS-CSH-700体系下,30 min内BPA的降解率均超过99.9%,而在PMS/Co@FA-CSH-700体系中,BPA在5 min内即可完全降解,展现出极高的催化效率。此外,SO4·−自由基是BPA降解的关键活性物种,而·OH和1O2的作用较小。基于上述研究,提出了固废源负载型钴基催化剂活化PMS降解BPA的机理,以上研究结果可为工业固废资源化制备高效催化剂并处理有机污染物废水提供新的技术路径。Abstract: The efficient and clean utilization of bulk silicate-calcium solid wastes is always a hot topic. Due to the complex problems such as their diverse phase types and large microstructure differences, silicate-calcium solid wastes are mainly taken for the low-value resource utilization such as building materials and road construction materials, which lacks market competitiveness and handling capacity, so it is very important to realize green high-value utilization of silicate-calcium solid wastes. In this study, two catalysts, such as Co@SS-CSH-700 derived from steel slag and Co@FA-CSH-700 derived from fly ash, were prepared to degrade bisphenol A (BPA) in wastewater. The results showed that Co@FA-CSH-700 exhibited a fluffier structure than Co@SS-CSH-700, and provided more active sites for peroxymonosulfate (PMS), which promoted the degradation of BPA. The study demonstrated that the degradation efficiency of BPA in PMS/Co@SS-CSH-700 system exceeded 99.9% within 30 minutes, while in PMS/Co@FA-CSH-700 system, BPA could be completely degraded within 5 minutes, showing a very high catalytic efficiency. Furthermore, the study also found that SO4·− free radicals were key active species for BPA degradation, whereas ·OH and 1O2 had slight effects. Based on the above studies, the mechanism of BPA degradation by cobalt-based catalysts loaded on silicate-calcium solid waste activating PMS was proposed. This study provides a new technical path for the preparation of high efficient catalysts from industrial solid wastes to treat organic pollutant wastewater.
-

-
-
[1] LIU Z, ZENG H, WANG F. Development of high performance carbonatable concrete for steel slag valorization[J]. Construction and Building Materials, 2021, 291: 123317. doi: 10.1016/j.conbuildmat.2021.123317 [2] 张书阅, 惠远峰. 粉煤灰改性方法及其在废水处理中的应用[J]. 山东化工, 2022, 51(3): 210-213. doi: 10.3969/j.issn.1008-021X.2022.03.071 [3] 国家发改委. 关于“十四五”大宗固体废弃物综合利用的指导意见[J]. 再生资源与循环经济, 2021, 14(4): 1-3. doi: 10.3969/j.issn.1674-0912.2021.04.001 [4] 徐硕, 杨金林, 马少健. 粉煤灰综合利用研究进展[J]. 矿产保护与利用, 2021, 41(3): 104-111. [5] AHMADPOUR A, TAHMASBI M, BASTAMI T R, et al. Rapid removal of cobalt ion from aqueous solutions by almond green hull[J]. Journal of Hazardous Materials, 2009, 166(2/3): 925-30. [6] 陶欢. 固废基水化硅酸钙的制备及其去除重金属性能研究[D]. 徐州: 中国矿业大学, 2021. [7] JAMIU Z A, SALEH T A, ALI S A. Biogenic glutamic acid-based resin: Its synthesis and application in the removal of cobalt(II)[J]. Journal of Hazardous Materials, 2017, 327: 44-54. doi: 10.1016/j.jhazmat.2016.12.041 [8] MA J, QIN G, ZHANG Y, et al. Heavy metal removal from aqueous solutions by calcium silicate powder from waste coal fly-ash[J]. Journal of Cleaner Production, 2018, 182: 776-82. doi: 10.1016/j.jclepro.2018.02.115 [9] TAKDASTAN A, KAKAVANDI B, AZIZI M, et al. Efficient activation of peroxymonosulfate by using ferroferric oxide supported on carbon/UV/US system: A new approach into catalytic degradation of bisphenol A[J]. Chemical Engineering Journal, 2018, 331: 729-43. doi: 10.1016/j.cej.2017.09.021 [10] LONG X, YANG S, QIU X, et al. Heterogeneous activation of peroxymonosulfate for bisphenol A degradation using CoFe2O4 derived by hybrid cobalt-ion hexacyanoferrate nanoparticles[J]. Chemical Engineering Journal, 2021, 404: 127052. doi: 10.1016/j.cej.2020.127052 [11] HU L, ZHANG G, LIU M, et al. Application of nickel foam-supported Co3O4-Bi2O3 as a heterogeneous catalyst for BPA removal by peroxymonosulfate activation[J]. Science of the Total Environment, 2019, 647: 352-61. doi: 10.1016/j.scitotenv.2018.08.003 [12] JIN J, YANG Z, XIONG W, et al. Cu and Co nanoparticles co-doped MIL-101 as a novel adsorbent for efficient removal of tetracycline from aqueous solutions[J]. Science of the Total Environment, 2019, 650: 408-18. doi: 10.1016/j.scitotenv.2018.08.434 [13] PENG J, LU X, JIANG X, et al. Degradation of atrazine by persulfate activation with copper sulfide (CuS): Kinetics study, degradation pathways and mechanism[J]. Chemical Engineering Journal, 2018, 354: 740-52. doi: 10.1016/j.cej.2018.08.038 [14] GHANBARI F, MORADI M. Application of peroxymonosulfate and its activation methods for degradation of environmental organic pollutants[J]. Chemical Engineering Journal, 2017, 310: 41-62. doi: 10.1016/j.cej.2016.10.064 [15] SONG Q, FENG Y, WANG Z, et al. Degradation of triphenyl phosphate (TPhP) by CoFe2O4-activated peroxymonosulfate oxidation process: Kinetics, pathways, and mechanisms[J]. Science of the Total Environment, 2019, 681: 331-8. doi: 10.1016/j.scitotenv.2019.05.105 [16] WANG Y, TIAN D, CHU W, et al. Nanoscaled magnetic CuFe2O4 as an activator of peroxymonosulfate for the degradation of antibiotics norfloxacin[J]. Separation and Purification Technology, 2019, 212: 536-44. doi: 10.1016/j.seppur.2018.11.051 [17] DU J, BAO J, LIU Y, et al. Efficient activation of peroxymonosulfate by magnetic Mn-MGO for degradation of bisphenol A[J]. Journal of Hazardous Materials, 2016, 320: 150-9. doi: 10.1016/j.jhazmat.2016.08.021 [18] QI C, LIU X, LIN C, et al. Activation of peroxymonosulfate by microwave irradiation for degradation of organic contaminants[J]. Chemical Engineering Journal, 2017, 315: 201-9. doi: 10.1016/j.cej.2017.01.012 [19] XU M, LI J, YAN Y, et al. Catalytic degradation of sulfamethoxazole through peroxymonosulfate activated with expanded graphite loaded CoFe2O4 particles[J]. Chemical Engineering Journal, 2019, 369: 403-13. doi: 10.1016/j.cej.2019.03.075 [20] PAROLO M E, SAVINI M C, VALLES J M, et al. Tetracycline adsorption on montmorillonite: pH and ionic strength effects[J]. Applied Clay Science, 2008, 40(1-4): 179-86. doi: 10.1016/j.clay.2007.08.003 [21] LIU Y, LUO R, LI Y, et al. Sandwich-like Co3O4/MXene composite with enhanced catalytic performance for Bisphenol A degradation[J]. Chemical Engineering Journal, 2018, 347: 731-40. doi: 10.1016/j.cej.2018.04.155 [22] CHEN C, LIU L, LI Y, et al. Insight into heterogeneous catalytic degradation of sulfamethazine by peroxymonosulfate activated with CuCo2O4 derived from bimetallic oxalate[J]. Chemical Engineering Journal, 2020, 384: 123257. doi: 10.1016/j.cej.2019.123257 [23] LU S, WANG G, CHEN S, et al. Heterogeneous activation of peroxymonosulfate by LaCo1-xCuxO3 perovskites for degradation of organic pollutants[J]. Journal of Hazardous Materials, 2018, 353: 401-9. doi: 10.1016/j.jhazmat.2018.04.021 [24] DING M, CHEN W, XU H, et al. Novel α-Fe2O3/MXene nanocomposite as heterogeneous activator of peroxymonosulfate for the degradation of salicylic acid[J]. Journal of Hazardous Materials, 2020, 382: 121064. doi: 10.1016/j.jhazmat.2019.121064 [25] LUO R, LI M, WANG C, et al. Singlet oxygen-dominated non-radical oxidation process for efficient degradation of bisphenol A under high salinity condition[J]. Water Research, 2019, 148: 416-24. doi: 10.1016/j.watres.2018.10.087 -



 下载:
下载: