-
印染废水是纺织、印染等企业经预处理、漂白、染色、洗涤等过程排放的废水,排放量占工业废水排放总量的17%~20%[1]。由于其来源复杂、染料呈现出较高的化学稳定性和有限的生物降解性,是水处理行业最具挑战性的工业废水之一[1]。目前针对印染废水处理方法主要有吸附、膜分离、混凝沉淀、催化氧化等,吸附法因其处理效率高、可再生性好、无有毒副产品产生等优势得到广泛关注。常见的吸附剂有活性炭/生物炭材料、分子筛材料、氧化石墨烯基复合材料、聚合物/磁性材料、共价/金属有机框架等,普遍存在合成成本高、分离回收难等问题[2]。因此开发廉价易得原料、性能优异的吸附剂材料非常必要。
煤矸石和赤泥是我国大宗工业固体废弃物,前者产生于煤炭开采和洗选过程,后者产生于铝土矿生产氧化铝过程,煤矸石的主要成分是Al2O3、SiO2,此外还有Fe2O3、CaO、MgO、Na2O和微量稀有元素,赤泥主要成分为SiO2、Al2O3、CaO、Fe2O3等,碱性强。我国煤矸石总堆存量超过7×109 t,且以6×108~8×108 t·年−1的速度持续增加,利用率约为60%;而赤泥堆存量已超1×109 t,以1×108 t·年−1的速度增加,利用率仅为4%左右[3-4]。目前煤矸石和赤泥主要利用方式为建筑材料的制备,开发多途径利用方式对其资源化利用非常重要。许多学者分别以煤矸石、赤泥为原料,改性后将其应用于印染废水污染物的去除[5-10]。如冯坤等[5]通过ZnCl2改性法合成改性煤矸石吸附剂,用于水体中甲基橙(MO)、孔雀石绿(MG)的吸附,吸附量分别达到21.29、27.34 mg·g−1。乔改瑞等[6]将煤矸石与氯化锌等激发剂混合“煅烧-活化”得到的材料用于吸附水体中亚甲基蓝(100 mg·L−1),去除效率达51.76%。尹娜[7]以煤矸石为原料,通过碱溶-水热法合成X型沸石,用于碱性品红的吸附,吸附量达23 mg·g−1。马宏飞等[8]将十二烷基苯磺酸钠改性后赤泥用于废水中亚甲基蓝的吸附,吸附量达16.37 mg·g−1。AN等[9]以赤泥为原料,加入造孔剂与粘结剂合成多孔粒状材料,并在其表面负载活性锌,用于印染废水中刚果红的吸附,吸附量可达6.5 mg·g−1。钱翌等[10]采用焙烧还原-重构法合成赤泥基层状金属氧化物材料,并用于水体中活性艳蓝染料(RBB,50 mg·L−1)的吸附,去除率高达97%。课题组前期以煤矸石和赤泥为原料,通过混合煤矸石、赤泥调整体系铝硅摩尔比,经碱熔活化、水热晶化转变为沸石相。与此同时,煤矸石和赤泥中分别存在的碳和铁,在还原性碱熔活化过程中可同步转化为磁性相(Fe3O4),进而保留至水热产物。最终所合成的磁性沸石,其包含磁性相和沸石相两部分[11-12]。其中,沸石的基本构成单元是硅氧四面体[SiO4]4-和铝氧四面体[AlO4]5-的三维框架结构,硅、铝都是以高氧化态形式存在,具有较大的比表面积和丰富的表面活性位点,可用于水体中有机污染物的脱除,而磁性相则能有助于分离回收[13-14]。
基于此,本研究以煤矸石-赤泥基磁性沸石作为吸附剂,亚甲基蓝和罗丹明B作为模型印染有机污染物,考察了污染物初始质量浓度、吸附剂添加量、反应温度、pH值等吸附条件对亚甲基蓝和罗丹明B吸附效率的影响,并通过吸附数据拟合,分析了煤矸石-赤泥基磁性沸石吸附亚甲基蓝和罗丹明B的等温吸附模型和动力学模型。结合N2吸脱附曲线、Zeta电位、傅里叶红外光谱(FT-IR)、X射线光电子能谱(XPS)手段,分析了煤矸石-赤泥基磁性沸石吸附亚甲基蓝和罗丹明B的反应机制,以期为煤矸石-赤泥基磁性沸石用于处理印染废水提供理论指导。
-
实验所用煤矸石源自漳村煤矿(山西,长治),赤泥取自国家电投集团山西铝业有限公司(山西,忻州),其化学组成见表1。将原料置于105 °C烘箱中干燥24 h,在行星式球磨机中粉磨至小于180目筛,通过还原焙烧-水热晶化工艺[12]合成磁性沸石。此外,本实验中使用的盐酸(HCl)、氢氧化钠(NaOH)、亚甲基蓝(MB)和罗丹明B(RhB)均为分析纯。
-
1)沸石合成。将烘干研磨后煤矸石、赤泥、NaOH按照Na∶Al∶Si摩尔比3.6∶1∶1均匀混合,于N2气氛中600 ℃焙烧90 min,N2流量为0.5 L∙min−1,冷却至室温备用;将焙烧熟料与去离子水按照Na∶H2O摩尔比2.8∶1混合,室温搅拌陈化12 h;转移至水热反应釜中,于90 ℃水热反应9 h,反应结束后冷却至室温,离心过滤、水洗,于80 ℃干燥24 h制得磁性A型沸石。
2)吸附实验。以亚甲基蓝和罗丹明B(MB和RhB)配制不同质量浓度溶液。分别取不同质量的磁性沸石置于50 mL有机溶液中,采用盐酸或者氢氧化钠溶液调节体系pH值,于不同温度下搅拌反应一定时间。反应结束过滤后采用分光光度计分别于664、552 nm波长下测定MB和RhB溶液的吸光值。考察吸附剂添加量(MB,0.25、0.625、1.25、2.5、5.0、12.5 mg;RhB,0.25、0.625、1.25、2.5、5.0、12.5 mg)、吸附质质量浓度(MB,25、50、100、150、200、300、500 mg·L−1;RhB,1、3、5、7、9、15、20 mg·L−1)、吸附温度(20~50 ℃)、吸附pH值(3、5、7、9、11)、吸附时间(5~120 min)对吸附效率的影响。
饱和吸附量和吸附效率依次按照式(1)以及式(2)计算。
式中:qe表示达到吸附平衡时吸附量,mg·g−1;C0和Ct表示溶液初始质量浓度和t时刻质量浓度,mg·L−1;V表示溶液的体积,mL;m表示吸附剂磁性沸石质量,g。
3)吸附等温线。称取磁性沸石50 mg,分别加入到50 mL质量浓度为25、50、100、150、200、300、500 mg·L−1的MB和0.5、1、3、5、7、9 mg·L−1的RhB溶液中,于不同温度(20、30、40、50 ℃)反应2 h,反应结束过滤分离后,测试溶液吸光值。计算MB和RhB吸附量qe和吸附效率R,进行Langmuir和Freundlich型吸附等温线拟合[15]。
Langmuir型吸附等温线拟合模型如式(3)所示。
Freundlich型吸附等温线拟合模型如式(4)所示。
式中:qm表示最大吸附量,mg·g−1;Ce表示吸附过程达到平衡时,所剩溶质的质量浓度,mg·L−1;KL表示Langmuir吸附等温模型的吸附系数,L·mg−1;KF表示Freundlich吸附等温模型的吸附常数,mg·g−1;n表示与吸附能力相关的常数。
4)吸附动力学。称取磁性沸石300 mg,分别加入到300 mL质量浓度为100 mg·L−1的MB和5 mg·L−1的RhB溶液搅拌反应,于不同时间点取样(5、10、15、25、35、45、60、90、120 min),测试溶液吸光值。计算qt和吸附效率R,拟一级动力学拟合方程、拟二级动力学拟合方程[16]分别如式(5)及(6)所示。
式中:qt表示t时刻的吸附量,mg·g−1;Qe,1表示利用拟一级吸附速率方程计算的饱和吸附量,mg·g−1;k1为拟一级速率常数,min−1;Qe,2表示通过拟二级吸附速率方程计算的饱和吸附量,mg·g−1;k2为拟二级速率常数,min−1。
-
采用X射线荧光光谱仪(XRF,Simultix 12,Tokyo Rigaku Co., Ltd,日本东京理化器械株式会社)对原料煤矸石、赤泥及材料磁性沸石的化学组成进行定量分析;采用X射线衍射仪(XRD,D2 Advance,Bruker,德国布鲁克分析仪器公司)对磁性沸石物相组成进行检测,测试条件:Cu靶,Kα衍射源,电压40 kV,电流40 mA,扫描速率8 °·min−1,2Theta范围为5~80 °;采用扫描电子显微镜(SEM,S-3400 N,Hitachi, Ltd.,日本株式会社日立制作所)对磁性沸石微观形貌进行观测,样品测试前需进行喷金处理;采用物理吸附仪(ASAP 2460,Micrometrics,美国麦克默瑞提克仪器公司)对磁性沸石、吸附MB、RhB后样品的N2-吸脱附曲线进行测试,测试条件:120 °C真空脱气预处理6 h,测试温度77 K;采用紫外可见光分光光度计(UV-Vis,Shimadzu Ltd.,日本岛津仪器公司)测定吸附前后溶液中亚甲基蓝、罗丹明B吸光值,波长分别为664 nm,552 nm;采用zeta电位仪(zeta,Nano ZS 90,英国马尔文公司)测定磁性沸石的表面电荷,测试条件:配置磁性沸石质量分数为0.1%的水溶液,0.1 M HCl、0.1 M NaOH调节pH值为1~10;采用傅里叶红外光谱分析仪(FT-IR,Nicolet6700,ThermoFisher,美国赛默飞世尔科技公司)测定吸附前后样品的红外图谱,测试条件:KBr压片,波数400~4 000 cm−1,分辨率4 cm−1;采用X射线光电子能谱仪(XPS,Axis Supra 600 W),Shimadzu Co. Ltd,日本岛津仪器公司)分析吸附前后样品表面元素状态,测试条件:Al Kα X射线源(1 486.6 eV),室温。
-
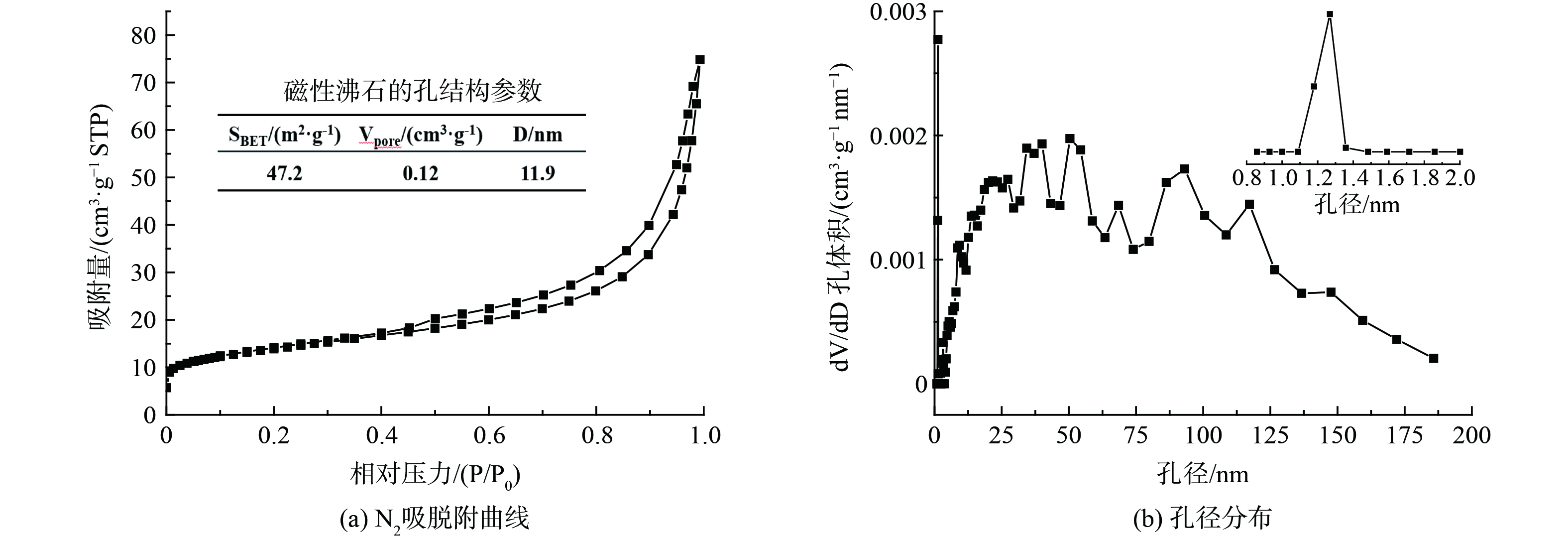
采用系列表征方法测试磁性沸石的物理化学性质,分别见表1和图1、2。由表1可知,煤矸石主要由SiO2和Al2O3组成,其质量分数占比达67.39%,铝硅比为0.54;赤泥化学组成为Al2O3、SiO2、Na2O和Fe2O3,质量分数分别为18.50%、14.32%、6.58%和28.21%,铝硅比为1.52。通过互配合成的磁性沸石其主要化学组成为Al2O3、SiO2、Na2O和Fe2O3,质量分数分别为20.16%、27.38%、13.10%和24.15%,铝硅比为0.96,结合图1(a)物相结构分析表明该磁性沸石主要以A型沸石(Na12Al12Si12O48·27H2O)和磁性Fe3O4物相组成。图1(b)磁性沸石样品的SEM-EDS,呈现出粒径大小均一的立方颗粒与不规则小颗粒,图1(c)EDS结果进一步表明立方形颗粒组成以A型沸石[17]为主,图1(d)则以不规则小颗粒以Fe3O4为主。图2为磁性沸石的N2-吸脱附曲线与孔径分布图,由图2(a)可知,该磁性沸石的N2吸脱附曲线呈现出II型吸脱附曲线,伴有H3型回滞环,表明样品中具有介孔结构,通过Brunauer-Emmett-Teller(BET)模型计算得到其比表面积为47 m2·g−1;图2(b)是采用Barrett-Joyner-Halenda(BJH)模型计算得到磁性沸石的孔径分布曲线图,孔径分布较宽,为0.8~187.5 nm,其中微孔孔径分布于1.09~1.36 nm[18]。
-
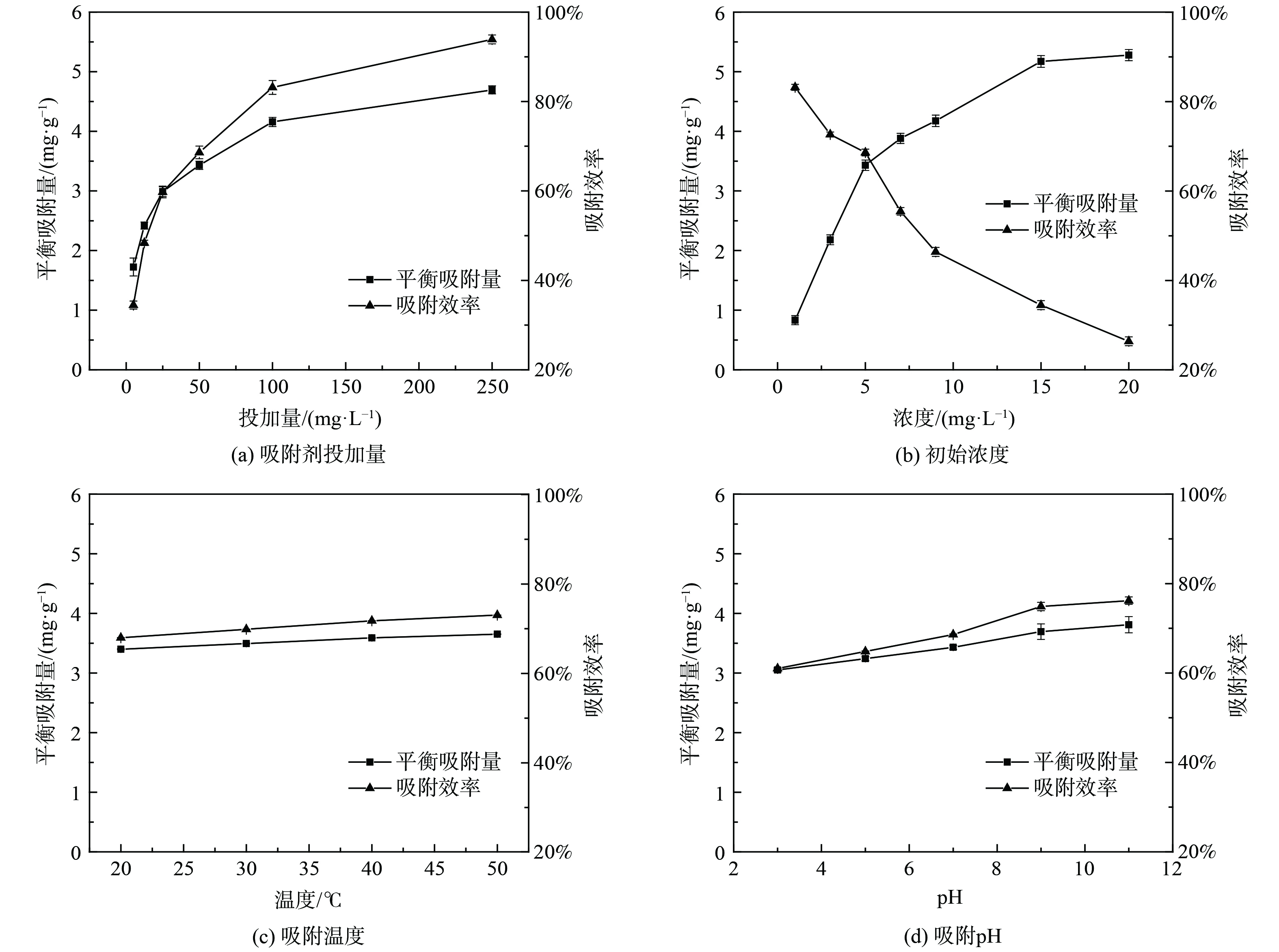
考察吸附条件包括吸附剂添加量、污染物初始质量浓度、吸附温度、吸附pH值对吸附效率的影响,结果分别如图3、4所示。
由图3(a)与图4(a)可知,随着吸附剂添加量的增加,磁性沸石对MB和RhB的平衡吸附量均呈现先增大后趋于稳定的趋势。吸附初期,液膜扩散和表面吸附是控速步骤,此时磁性沸石吸附剂吸附充分,吸附反应较快。当吸附进行到后期,以颗粒内扩散为主,两种有机物质通过扩散进入吸附剂的内表面和孔道内进行吸附[19]。颗粒内扩散反应过程慢,吸附效率逐渐趋于平衡。随着MB和RhB初始溶液质量浓度的增加,磁性沸石的平衡吸附量逐渐增加,最后趋于平稳,而吸附效率呈现逐渐下降的趋势。其中,对MB的吸附约在100 mg·L−1时达到饱和吸附,对RhB的吸附在20 mg·L−1达到饱和吸附,见图3(b)、图4(b)。该结果表明当有机物质量浓度较低时,沸石表面含有大量的活性点空位,能够快速吸附较多的分子;当质量浓度过高,吸附点位有限,污染物质不能被吸附[14]。此外,磁性沸石对于2种污染物的吸附量有明显差异,对MB的吸附量明显高于RhB,这可能与MB和RhB分子尺寸大小差异直接相关(MB分子尺寸为0.59 nm×1.38 nm,RhB分子尺寸为0.98 nm×1.50 nm)。由图3(c)、图4(c)可知,吸附温度对吸附效率的影响较小。随着吸附温度由20 ℃升高到50 ℃,磁性沸石对MB、RhB的吸附效率基本保持不变,表明该磁性沸石对水溶液中有机污染物的吸附在常温下即可进行[19]。随着吸附pH值的增加,磁性沸石对MB、RhB的吸附效率均呈现出先增加后保持稳定的趋势,仅增加幅度有所差异。在pH值较低时,磁性沸石表面带正电,与正电的MB、RhB相斥,吸附效率较低;随着pH值进一步增大,磁性沸石表面带负电,通过静电吸引力与正电的MB、RhB结合,吸附效率增大[18]。基于上述结果,后续实验选取吸附剂磁性沸石添加量100 mg·L−1的沸石分别对100 mg·L−1的MB和5 mg·L−1的RhB进行吸附,此时吸附效率分别为83.2%和68.6%。
-
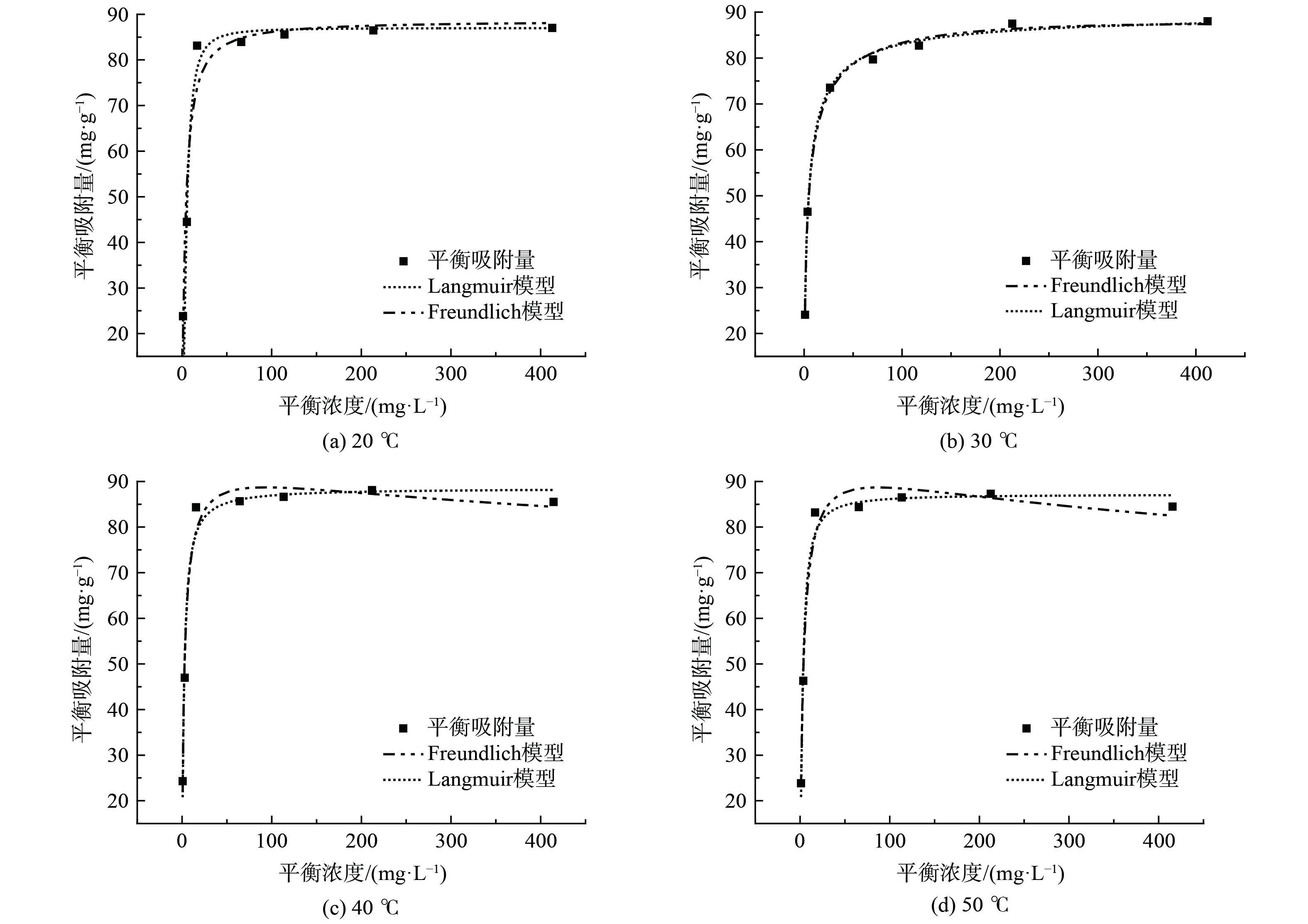
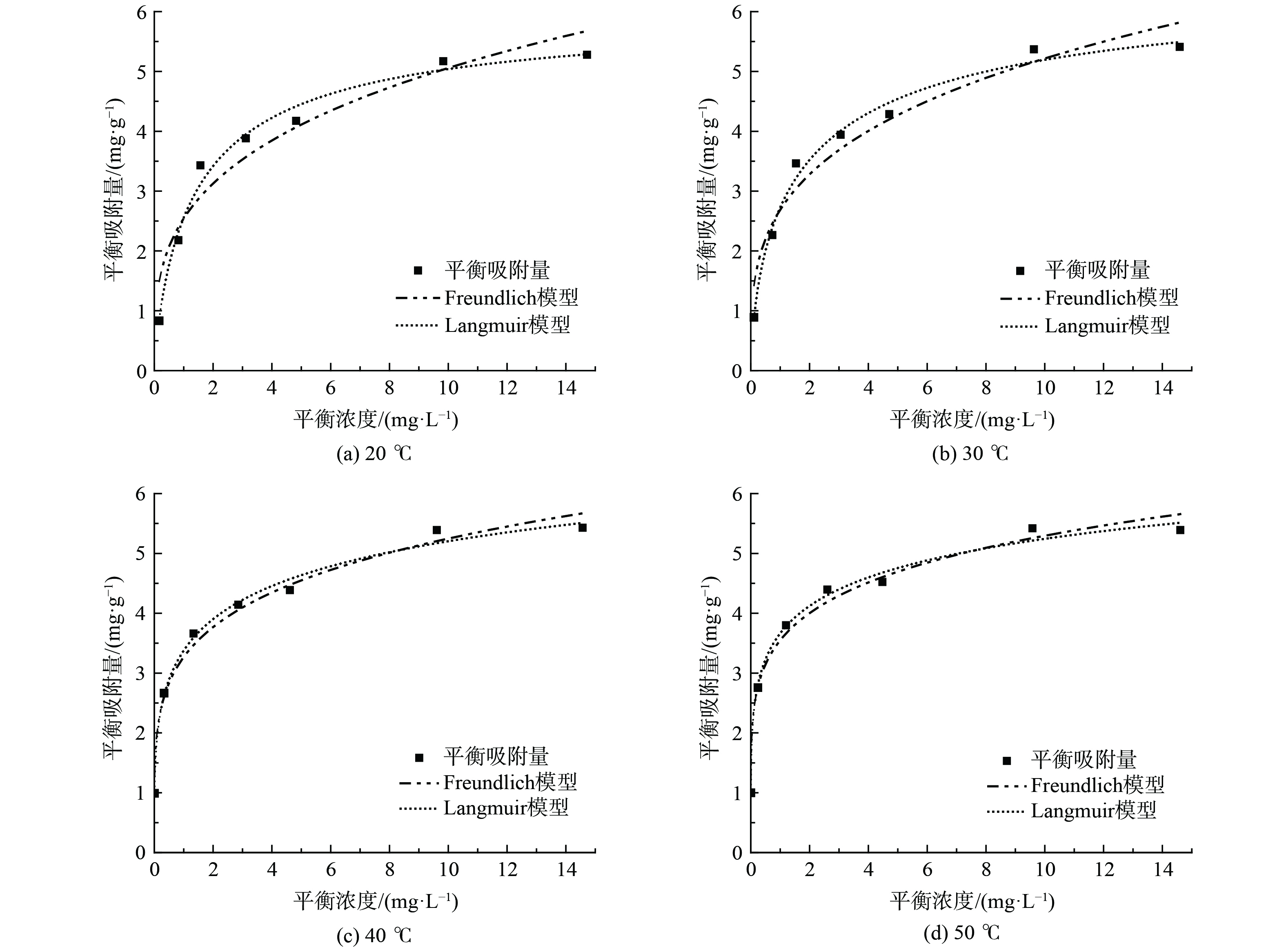
材料的吸附性能和表面特性通常用吸附等温线来表现,Langmuir和Freundlich是最常见的吸附等温线模型[19]。不同温度下磁性沸石对MB和RhB吸附等温线拟合结果如图5和图6所示。相应的拟合参数见表2、3。
由图5和图6可知,磁性沸石对MB、RhB的吸附结果均更符合Langmuir等温吸附模型。对于MB,Langmuir等温吸附相关系数R2介于0.981 5~0.996 5,Freundlich等温吸附相关系数R2介于0.975 4~0.995 7(表2、3)。对于RhB,Langmuir等温吸附相关系数R2介于0.986 9~0.993 7,Freundlich等温吸附相关系数R2介于于0.932 4~0.982 6(表2、3)。该结果表明磁性沸石对MB、RhB的吸附过程更符合Langmuir等温吸附模型,表明磁性沸石对MB、RhB的吸附属于单分子层吸附[19]。磁性沸石的最大吸附量随着吸附温度的升高呈现出轻微增加的趋势,但增加幅度不明显,表明温度对吸附容量影响结果较小,与吸附数据相一致。
此外,本研究中合成的磁性沸石对亚甲基蓝和罗丹明B的吸附量存在较大差异,对MB最大吸附量为90.61 mg∙g−1,优于文献报道(表4);而材料对RhB最大吸附量仅为6.07 mg∙g−1,与文献报道存在差距(表4),该结果与磁性沸石的孔结构性质相关,本研究中磁性沸石孔体积较小,RhB分子在吸附过程会由于孔道堵塞引起吸附量降低。
-
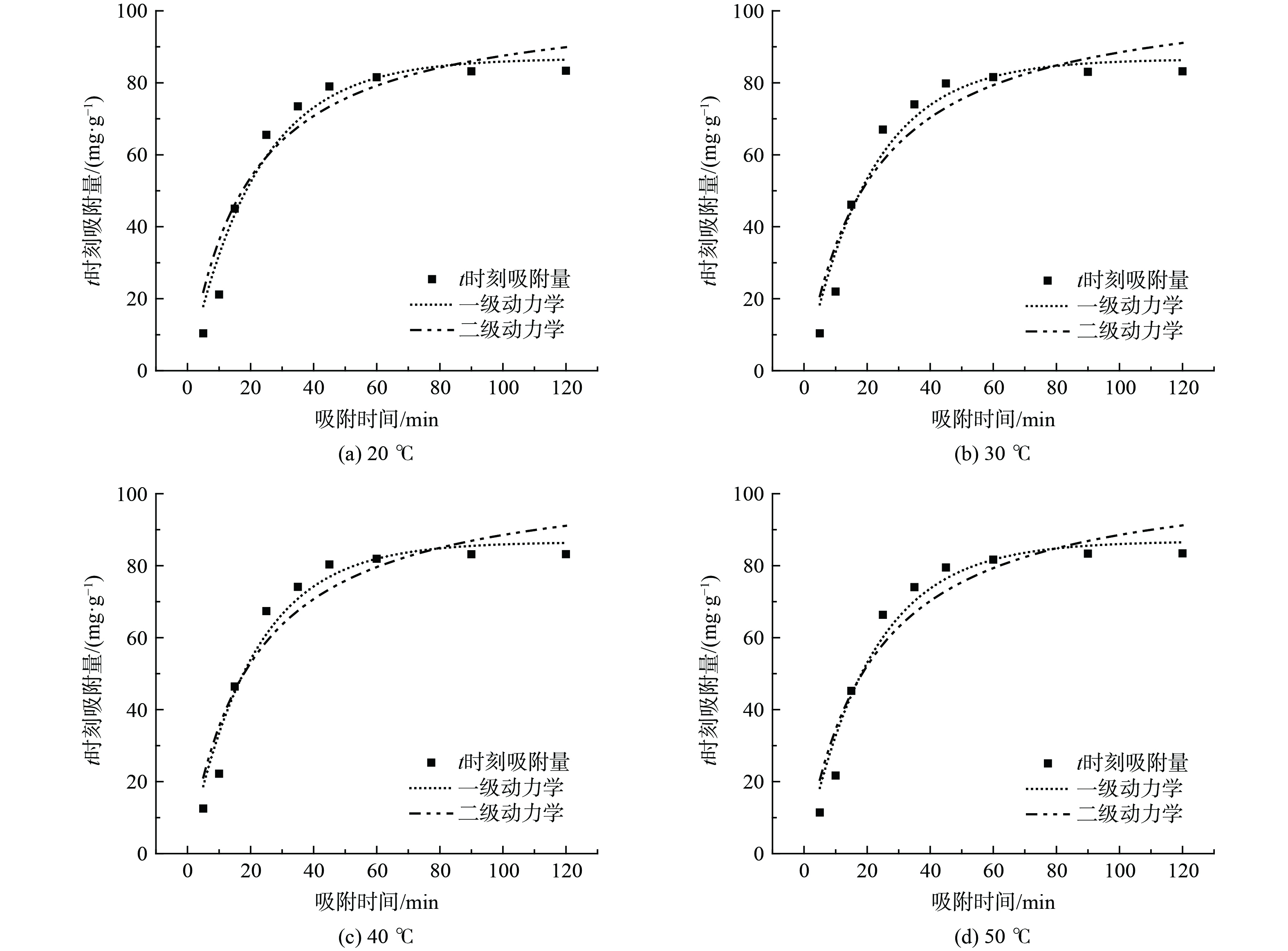
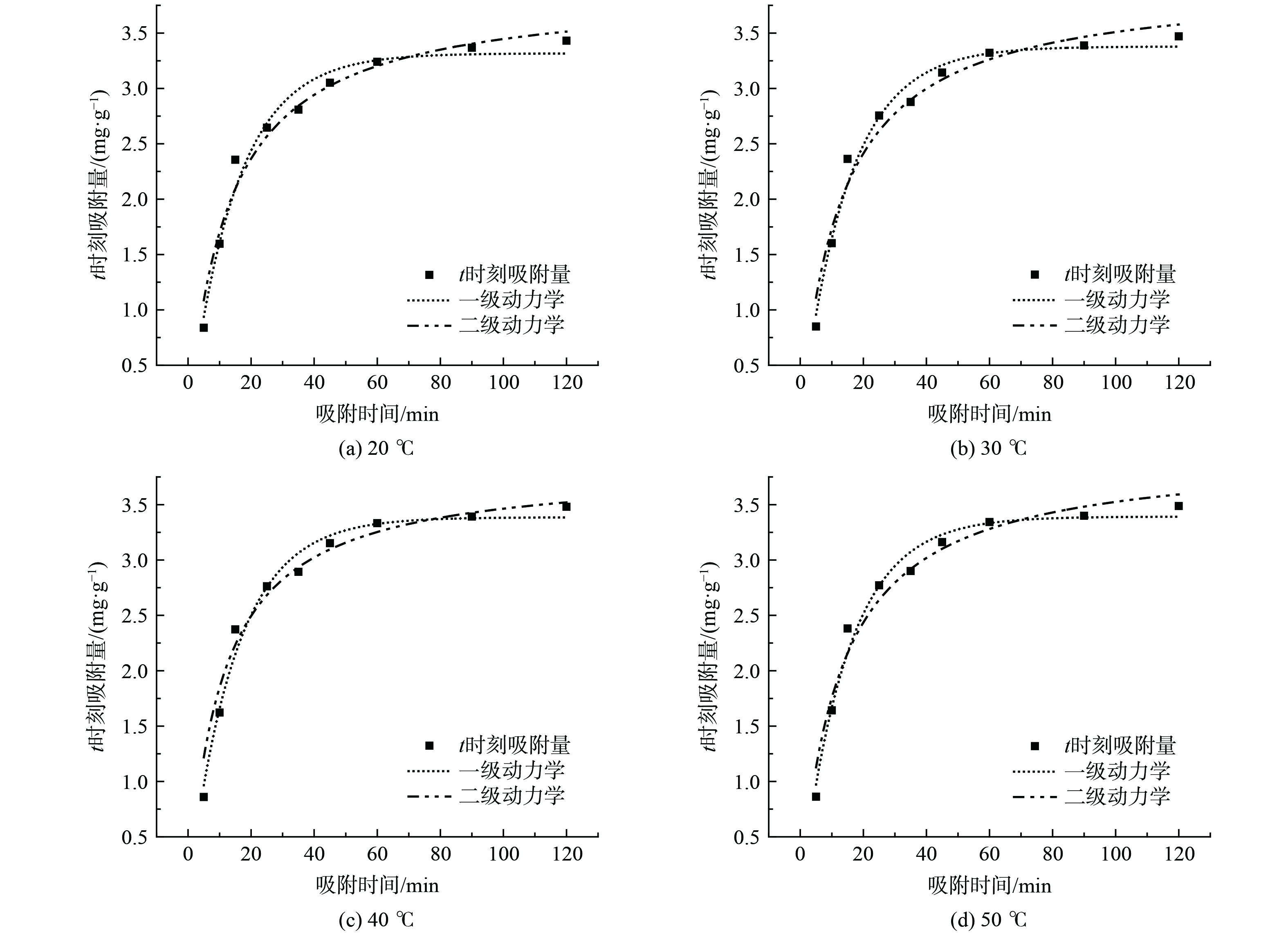
采用拟一级吸附动力学方程、拟二级吸附动力学方程[20-23]对吸附数据进行拟合分析,结果分别如图7、图8所示,相关拟合参数见表5、6。由图7、图8可知,随着吸附时间的增加,磁性沸石对MB和RhB的吸附量逐渐增加,吸附效率逐渐增大,说明吸附剂与污染物之间的结合需要一定时间[20]。磁性沸石对MB的吸附约在60 min时达到吸附饱和;对RhB的吸附约在100 min才达到饱和。对于MB,拟一级吸附动力学相关系数R2介于0.956 9~0.960 5,拟二级吸附动力学相关系数R2介于0.987 1~0.991 9;对于RhB,拟一级吸附动力学相关系数R2介于0.976 8~0.983 4,拟二级吸附动力学相关系数R2介于0.983 7~0.992 2。拟合结果表明不同温度下,磁性沸石对MB、RhB的吸附过程更符合拟二级动力学模型,说明该吸附过程受到化学吸附的影响[21]。此外,当温度从20 ℃升高到50 ℃时,磁性沸石对MB吸附速率常数呈现出先增大后减小的趋势,这表明适度升温有利于磁性沸石对MB的吸附,同时也说明在适度温度下该吸附过程为吸热过程[21, 23]。磁性沸石对RhB吸附速率常数呈现出依次增大的趋势,这表明升温有利于磁性沸石对RhB的吸附。然而,随着温度升高,磁性沸石对MB、RhB吸附的速率常数总体变化较小,基于经济性与能耗考量,均采用20 ℃吸附。
-
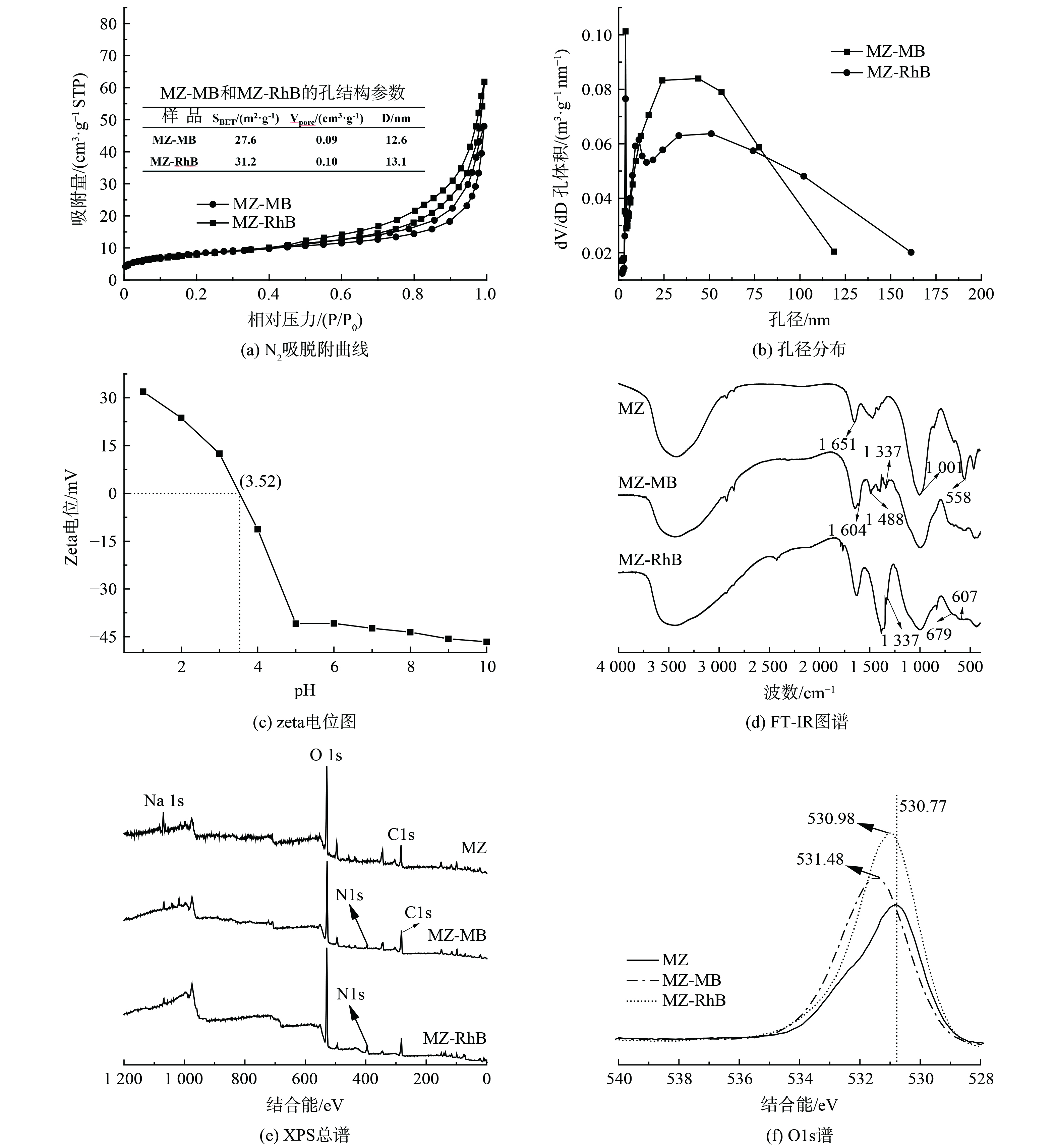
为进一步探究吸附机理,对煤矸石-赤泥基磁性沸石以及吸附MB、RhB前后样品进行表征分析,结果如图9所示。由图9(a)可知,磁性沸石在吸附MB、RhB后样品的N2吸脱附曲线中最高吸附量降低(相比于图2(a)),但吸脱附曲线类型并未发生变化,结合孔径分布曲线(图9(b)),吸附后孔径分布变窄,均表明吸附后部分孔道堵塞;吸附后样品的比表面积、平均孔径、孔体积均有所降低,进一步证明材料对MB、RhB的吸附存在孔道吸附。图9(c)表明磁性沸石材料的表面电荷随pH值的增加呈现出降低的趋势,且在优化吸附条件pH为9时材料zeta电位为-45.6 mV,表明吸附过程磁性沸石表面是负电荷,可通过静电吸引作用吸附正电荷的MB、RhB。此外,由图9(d)吸附前后磁性沸石FT-IR图谱分析可知,其结构中化学键的振动未发生明显变化,包括表面吸附水O-H键的弯曲振动峰(1 651 cm−1)[24]、Si-O-Al的非对称伸缩振动峰(1 001 cm−1)[25]、Fe-O伸缩振动峰(558 cm−1)[26],吸附后样品中出现了属于MB、RhB分子中的特征峰,包括芳香环的伸缩振动(1 604 cm−1)[27]、C-N和C-O的特征吸收峰(1 337、1 001 cm−1)[28]、苯环特征吸收峰(679 cm−1)[29];结合图9(e)磁性沸石吸附前后样品XPS全谱中除磁性沸石结构中Si 2p、Al 2p、C 1s、O 1s、Na 1s之外,吸附后出现了与MB、RhB结构中存在的氮原子相关的新峰N 1s,位于400.2 eV,代表了-NH2和C-N键[30-31];均表明磁性沸石确实吸附了水溶液中MB、RhB。此外,图9(e)磁性沸石吸附MB、RhB后样品XPS总谱中Na 1s峰的峰强减弱,表明吸附过程存在离子交换作用,且通过对O1s图谱分析发现,O1s的峰位向高结合能方向移动,图9(f),表明磁性沸石吸附MB、RhB过程存在氢键作用。这主要归因于磁性沸石表面羟基氧原子的部分负电荷与MB、RhB中氮原子的部分正电荷之间形成氢键,O原子周围电子云密度降低[31]。综合比较分析,以赤泥、煤矸石为原料,通过还原焙烧-水热晶化制备得到的磁性沸石可用于水溶液中有机污染物的吸附,且对污染物的吸附均有一定效果。吸附机制包括孔道吸附、静电吸引、离子交换和氢键作用。然而,上述表征分析也呈现出吸附MB、RhB后样品之间存在差异,如样品比表面积、孔径降低程度不一,O1s峰位偏移程度不一,结合MB、RhB分子尺寸大小与平衡吸附量的差异,均表明分子尺寸较大的RhB进入磁性沸石孔道内部并与其活性位点结合几率较小,导致吸附效率较低(图10)。
-
1)赤泥-煤矸石基磁性沸石对水体中有机物MB的吸附优化条件为吸附温度20 ℃,pH值为9,吸附时间60 min。对RhB的吸附优化条件为吸附温度20 ℃,pH值为9,吸附时间100 min。
2)吸附等温线拟合结果表明磁性沸石对MB、RhB的吸附更符合Langmuir等温吸附模型,最大吸附量分别为90.61、6.07 mg·g−1。动力学拟合结果表明磁性沸石对MB、RhB的吸附符合拟二级动力学模型。
3)赤泥-煤矸石基磁性沸石对水中MB、RhB吸附机制包括孔道吸附、静电吸引、离子交换和氢键作用,但分子尺寸较大的RhB进入磁性沸石孔道内部并与其活性位点结合几率较小,吸附效率较低。
煤矸石-赤泥基磁性沸石对印染有机污染物的吸附性能
Adsorption performance of coal gangue-red mud based magnetic zeolite for dyeing organic compounds
-
摘要: 磁性沸石是一类环境友好型功能材料,其具有优越的吸附性能和易于分离回收特点,可有效用于处理印染废水。本研究以煤矸石-赤泥基磁性沸石作为吸附剂,亚甲基蓝和罗丹明B作为模型印染有机污染物,考察了吸附剂添加量、污染物初始质量浓度、反应温度、pH值等吸附条件对亚甲基蓝和罗丹明B吸附效率的影响,并采用吸附等温线、吸附动力学模型对吸附数据进行拟合;同时,采用N2吸脱附曲线、zeta电位、傅里叶红外光谱(FT-IR)、X射线光电子能谱(XPS)等手段探究了煤矸石-赤泥基磁性沸石对印染有机污染物的吸附机制。结果表明,煤矸石-赤泥基磁性沸石对水溶液中亚甲基蓝和罗丹明B的最大吸附量存在差异,分别为90.61、6.07 mg·g−1;磁性沸石对亚甲基蓝和罗丹明B的吸附过程符合Langmuir等温吸附模型和拟二级吸附动力学模型;表明该吸附过程存在化学吸附作用;结合吸附机理表征发现磁性沸石吸附亚甲基蓝和罗丹明B的机制包括孔道吸附、静电吸引、离子交换和氢键作用。Abstract: Magnetic zeolite as a kind of environment-friendly functional material is widely used to treat printing-dyeing wastewater because of the excellent adsorption and easy separation & recovery properties. In this study, coal gangue-red mud based magnetic zeolite was used as adsorbent to adsorb methylene blue and rhodamine B, respectively. The effects of different conditions (adsorbent dosage, initial concentration, reaction temperature and pH) on the adsorption efficiency of methylene blue and rhodamine B were investigated. The adsorption isotherm and kinetic models were used to fit the adsorption data. Furthermore, the adsorption mechanism was explored by N2 adsorption-desorption curves, zeta potential, Fourier transform infrared spectroscopy (FT-IR) and X-ray photoelectron spectroscopy (XPS). The results showed that the adsorption efficiency of magnetic zeolite for methylene blue and rhodamine B in aqueous solution was significantly different. The maximum adsorption capacities for methylene blue and rhodamine B were 90.61 and 6.07 mg·g−1, respectively. The adsorption process of methylene blue and rhodamine B by magnetic zeolite conformed to the Langmuir isotherm adsorption model and pseudo second-order adsorption kinetic model, indicating that chemical adsorption existed in adsorption process. Combined with the characterization of the adsorption mechanism, it was found that the mechanisms of magnetic zeolite adsorbing methylene blue and rhodamine B includes pore adsorption, electrostatic attraction, ion exchange, and hydrogen bonding.
-
Key words:
- coal gangue /
- red mud /
- magnetic zeolite /
- adsorption /
- methylene blue (MB) /
- rhodamine B (RhB)
-

-
表 1 原料煤矸石、赤泥以及磁性沸石化学组成
Table 1. Chemical compositions of coal gangue, red mud and magnetic zeolite
样品 化学组成 SiO2 Al2O3 Fe2O3 CaO Na2O Others Al∶Si 煤矸石 46.06% 21.33% 2.85% 1.40% 0.45% 27.92% 0.54 赤泥 14.32% 18.50% 28.21% 13.97% 6.58% 18.41% 1.52 磁性沸石 27.38% 20.16% 24.15% 8.69% 13.10% 6.53% 0.96 表 2 磁性沸石对MB的吸附等温模型拟合参数
Table 2. The adsorption isothermal models fitting parameters of MB by magnetic zeolite
温度 Freundlich模型 Langmuir模型 n KF R2 qm KL R2 20 ℃ 1.99 26.89 0.954 1 90.61 0.38 0.990 1 30 ℃ 1.92 26.55 0.995 7 90.39 0.41 0.996 5 40 ℃ 1.46 28.31 0.975 4 91.51 0.44 0.981 5 50 ℃ 1.11 20.38 0.977 4 91.17 0.26 0.989 9 表 3 磁性沸石对RhB的吸附等温模型拟合参数
Table 3. The adsorption isothermal models fitting parameters of RhB by magnetic zeolite
温度 Freundlich模型 Langmuir模型 n KF R2 qm KL R2 20 ℃ 3.33 2.54 0.932 4 6.07 0.73 0.986 9 30 ℃ 3.45 2.69 0.952 1 6.82 0.67 0.989 6 40 ℃ 4.76 3.26 0.981 2 6.95 0.51 0.993 5 50 ℃ 5.88 3.54 0.982 6 6.98 0.54 0.993 7 表 4 沸石对水溶液中亚甲基蓝和罗丹明B的吸附性能比较
Table 4. Comparison of zeolite and its adsorption performance for organic compounds in aqueous solution
沸石类型 SBET/(m2·g−1) Vpore/(cm3·g−1) D/nm 有机物 qm/(mg·g−1) 来源 磁性沸石 47.2 0.12 11.9 亚甲基蓝 90.61 本研究 磁性沸石 47.2 0.12 11.9 罗丹明B 6.07 本研究 天然沸石 20.00 4.598 19.24 罗丹明B 10.53 [16] CTMAB-改性沸石 19.38 4.456 19.48 罗丹明B 7.95 [16] 含Beta型沸石复合材料 249.62 0.246 2.4 罗丹明B 64.47 [17] NaP 16.90 0.124 4 14.58 罗丹明B 15.92 [18] EMRZ电解锰渣沸石 39.38 — — 罗丹明B 18.96 [19] 斜发沸石 32 0.12 — 亚甲基蓝 20 [20] Na-P 82 — 11 亚甲基蓝 9.6 [22] A 18.166 3 0.88 20.02 亚甲基蓝 16.973 [23] X 373.845 0.111 2 2.88 亚甲基蓝 41.309 [23] Y 386.714 9 0.203 3.75 亚甲基蓝 49.266 [23] 表 5 MB的拟一级、拟二级吸附动力学模型拟合参数
Table 5. Adsorption kinetics fitting parameters of pseudo-first-order and pseudo-second-order of MB
温度 拟一级吸附动力学模型 拟二级吸附动力学模型 Qe,1 k1 R2 Qe,2 k2 R2 20 ℃ 86.75 0.046 3 0.959 6 106.92 4.138 2 0.983 9 30 ℃ 86.57 0.047 9 0.956 9 106.84 4.504 5 0.987 1 40 ℃ 86.57 0.048 7 0.959 7 106.39 4.658 8 0.989 2 50 ℃ 86.78 0.047 2 0.960 5 107.25 4.714 1 0.991 9 表 6 RhB的拟一级、拟二级吸附动力学模型拟合参数
Table 6. Adsorption kinetics fitting parameters of pseudo-first-order and pseudo-second-order of RhB
温度 拟一级吸附动力学模型 拟二级吸附动力学模型 Qe,1 k1 R2 Qe,2 k2 R2 20 ℃ 3.32 0.066 4 0.976 8 3.89 0.019 7 0.983 7 30 ℃ 3.38 0.066 7 0.982 9 3.96 0.019 9 0.991 5 40 ℃ 3.39 0.067 2 0.983 4 3.84 0.020 0 0.984 4 50 ℃ 3.39 0.067 6 0.983 4 3.39 0.024 3 0.992 2 -
[1] YAN B T, DAI Y M, XIN L L, et al. Research progress in the degradation of printing and dyeing wastewater using chitosan based composite photocatalytic materials[J]. International Journal of Biological Macromolecules, 2024, 263: 130082. doi: 10.1016/j.ijbiomac.2024.130082 [2] UGOCHUKWU E, OLUWASEYI. D S, KANIKA D, et al. A review on treatment technologies for printing and dyeing wastewater (PDW)[J]. Journal of Water Process Engineering, 2024, 50: 103273. [3] 杨腾飞, 陈伟, 李秋, 等. 用于煤矸石覆盖层的赤泥基密封材料性能及微观结构研究[J]. 硅酸盐通报, 2018, 37: 3037-3041. [4] 王晓丽, 李秋义, 陈帅超, 等. 工业固体废弃物在新型建材领域中的应用研究与展望[J]. 硅酸盐通报, 2019, 38: 3456-3464. [5] 冯坤, 李红艳, 崔建国, 等. MCGA的制备及其吸附有机染料的性能及机理研究[J]. 中南大学学报(自然科学版), 2022, 53(10): 3838-3848. [6] 乔改瑞, 蔡会武, 姬成. 活化煤矸石吸附印染废水的研究[J]. 硅酸盐通报, 2015, 34(4): 1054-1057. [7] 尹娜. 煤矸石合成沸石及其在印染废水中的应用研究[D]. 西安: 陕西师范大学, 2016. [8] 马宏飞, 宁春莹, 李薇, 等. 活化赤泥对染料废水吸附性能研究[J]. 化学研究与应用, 2017, 29(9): 1320-1325. [9] AN D D, YU S, YANG Y L, et al. A strategy-purifying wastewater with waste materials: Zn2+ modified waste red mud as recoverable adsorbents with an enhanced removal capacity of congo red[J]. Journal of Colloid and Interface Science, 2023, 645: 694-704. doi: 10.1016/j.jcis.2023.04.176 [10] 钱翌, 周绍杰. 赤泥基层状金属氧化物对2种常见染料的吸附[J]. 环境工程学报, 2017, 11(3): 1402-1408. [11] 张吉元, 柳丹丹, 郭晓方, 等. 赤泥-煤矸石协同还原焙烧回收Fe、Al有价元素[J]. 环境工程学报, 2021, 15(10): 3306-3315. doi: 10.12030/j.cjee.202107002 [12] YAN K Z, ZHANG J Y, LIU D D, et al. Feasible synthesis of magnetic zeolite from red mud and coal gangue: Preparation, transformation and application[J]. Powder Technology, 2023, 423: 1-13. [13] GADORE V, MISHRA S R, YADAV N, et al. Advances in zeolite-based materials for dye removal: Current trends and future prospects[J]. Inorganic Chemistry Communications, 2024, 166: 112606. doi: 10.1016/j.inoche.2024.112606 [14] OLADOYE P O, KADHOM M, KHAN I, et al. Advancements in adsorption and photodegradation technologies for Rhodamine B dye wastewater treatment: Fundamentals, applications, and future directions[J]. Green Chemical Engineering, 2023, 4(12): 1-21. [15] HA K, FSH M, EIGHAMAZ N A, et al. Experimental and electrical studies of Na-X zeolite for the adsorption of different dyes[J]. Journal of Molecular Liquids, 2021, 332: 115877. doi: 10.1016/j.molliq.2021.115877 [16] 程王玉. 有机改性沸石吸附水中罗丹明B和萘[D]. 广州: 暨南大学, 2016. [17] 李艳香. 氧化石墨烯/分子筛复合材料的制备及其吸附罗丹明B的性能研究[D]. 扬州: 扬州大学, 2016. [18] ZHANG Y N, HAN H J, WANG X H, et al. Utilization of NaP zeolite synthesized with different silicon species and NaAlO2 from coal fly ash for the adsorption of Rhodamine B[J]. Journal of Hazardous Materials, 2021, 415: 125627. doi: 10.1016/j.jhazmat.2021.125627 [19] LI C X, YU Y, ZHANG Q W. Adsorption of Cu2+ and rhodamine B by zeolite obtained from electrolytic manganese residue[J]. Earth and Environmental Science, 2020, 612: 012038. [20] DOSA M, GRIFASI N, GALLETTI C, et al. Natural zeolite clinoptilolite application in wastewater treatment: methylene blue, zinc and cadmium abatement tests and kinetic studies[J]. Materials, 2022, 15(22): 8191. doi: 10.3390/ma15228191 [21] ENDAR H, YONEMURA S, MITOMA Y, et al. Methylene blue removal by chitosan cross-linked zeolite from aqueous solution and other ion effects: Isotherm, kinetic, and desorption studies[J]. Adsorption Science & Technology, 2022, 2022: 1853758. [22] WANG C, YU J, FENG K, et al. Synthesis of porous magnetic zeolite-based material and its performance on removal of Cd2+ ion and methylene blue from aqueous solution[J]. Microporous and Mesoporous Materials, 2022, 345: 112256. doi: 10.1016/j.micromeso.2022.112256 [23] 郭文宁, 杨艳玲, 孙瑜, 等. 粉煤灰基沸石对亚甲基蓝染料的吸附性能研究[J]. 陕西科技大学学报, 2023, 41(4): 15-26. [24] ZAVAREH S, FARROKHZAD Z, DARVISHI F. Modification of zeolite 4A for use as an adsorbent for glyphosate and as an antibacterial agent for water[J]. Ecotoxicology and environmental safety, 2018, 155: 1-8. doi: 10.1016/j.ecoenv.2018.02.043 [25] GUO Y X, YAN K Z, CUI L, et al. Improved extraction of alumina from coal gangue by surface mechanically grinding modification[J]. Powder Technology, 2016, 302: 33-41. doi: 10.1016/j.powtec.2016.08.034 [26] YANG K, PENG H B WEN Y H, et al. Re-examination of characteristic FTIR spectrum of secondary layer in bilayer oleic acid-coated Fe3O4 nanoparticles[J]. Applied surface science, 2010, 256(10): 3093-3097. doi: 10.1016/j.apsusc.2009.11.079 [27] CHEN B, LONG F X, CHEN S J, et al. Magnetic chitosan biopolymer as a versatile adsorbent for simultaneous and synergistic removal of different sorts of dyestuffs from simulated wastewater[J]. Chemical Engineering Journal, 2020, 385: 123926. doi: 10.1016/j.cej.2019.123926 [28] XIAO W N, GARBA Z, SUN S C, et al. Preparation and evaluation of an effective activated carbon from white sugar for the adsorption of rhodamine B dye[J]. Journal of Cleaner Production, 2020, 253: 119989. doi: 10.1016/j.jclepro.2020.119989 [29] WENG X L, GUO M Y, LUO F, et al. One-step green synthesis of bimetallic Fe/Ni nanoparticles by eucalyptus leaf extract: Biomolecules identification, characterization and catalytic activity[J]. Chemical Engineering Journal, 2017, 308: 904-911. doi: 10.1016/j.cej.2016.09.134 [30] YANG Z H, CHEN X H, LI S Y, et al. Effective removal of Cd(II) from aqueous solution based on multifunctional nanoporous silicon derived from solar kerf loss waste[J]. Journal of Hazardous Materials, 2020, 385: 121522. doi: 10.1016/j.jhazmat.2019.121522 [31] CHEN C, FU Q S, CHEN X D, et al. An effective pre-burning treatment boosting adsorption capacity of sorghum distillers grain derived porous carbon[J]. Diamond and Related Materials, 2022, 124: 108914. doi: 10.1016/j.diamond.2022.108914 -




 下载:
下载: