-
目前,我国大部分城市污水处理厂执行《城镇污水厂污染物排放标准》(GB 18918-2002)中一级A排放标准(总氮(TN)<15 mg·L−1),部分城市要求污水排放执行《地表水环境质量标准》(GB 3838-2022)Ⅴ类标准(TN<2 mg·L−1),这对于污水氮的脱除提出了更高的要求。城镇污水处理厂出水中硝酸盐(NO3−-N)是TN的主要组成部分,去除NO3−-N成为了城市污水脱氮处理中最重要的环节之一[1]。利用无机材料硫单质(S0)作为填料和电子供体,NO3−-N作为电子受体的自养反硝化技术具有显著环境和经济优势[2-4],然而该技术存在脱氮速率低,出水硫酸根(SO42-)质量浓度高等问题,限制其广泛应用。
铁是细胞色素的重要组成部分,参与硝酸盐还原酶(Nar)、亚硝酸盐还原酶(Nir)和一氧化氮还原酶(Nor)的合成。在富铁环境下,微生物酶的催化活性显著提升[5-6],同时铁可以促进细菌的生长繁殖[7]。此外,铁腐蚀产生的氢(H2)和二价铁(Fe(Ⅱ))可以作为电子供体,驱动H2自养反硝化和Fe(Ⅱ)自养反硝化脱氮过程,提高脱氮效率。大量研究表明铁介质在提高反硝化脱氮效率上具有潜力。MA等[8]在序批反应器(sequencing batch reactor, SBR)中添加Fe(Ⅱ)后TN去除率比不添加Fe(Ⅱ)提高了5.1%。添加Fe3O4能促进生物膜的生长和活性,提高反硝化菌细胞外电子转移的效率[9]。FENG等[10]在UASB反应器中连续添加零价铁(ZVI),TN的去除率达到(96.4±2.72)%,比不添加ZVI的反硝化工艺TN去除率提高了7.7%。LIU等[11]发现纳米零价铁(Fe0)与反硝化菌具有协同作用,NO3−-N的去除率可达99.8% 。此外,相较于ZVI,Fe0具有更强大的还原能力、更高的生物利用度,并更易于与细菌的细胞表面相互作用。但是目前关于铁介质在提高硫自养反硝化脱氮性能、不同氮负荷下的连续运行效果,以及对污泥特征和微生物群落等方面的影响等问题上,仍需详尽的讨论。
本研究通过批次实验考察了不同铁介质在S0自养反硝化中的作用,筛选出强化S0自养反硝化脱氮性能的铁介质的最佳投加质量浓度,并分析了铁介质对微生物胞外聚合物分泌和电子传递系统活性的影响。在此基础上,在以S0为电子供体的生物反应器中连续投加铁介质,进行长期连续实验,以评估脱氮性能,并研究系统微生物群落的演替规律,旨在为S0自养反硝化技术的应用提供参考。
-
活性污泥采自石家庄某污水处理厂二沉池,该污水处理厂生物处理单元采用 A2O工艺。污泥采集后用自来水清洗3次,置于锥形瓶培养驯化。培养基组分包含:4.96 g·L−1 Na2S2O3·5H2O、2.52 g·L−1NaHCO3、2.02 g·L−1KNO3、2.00 g·L−1 KH2PO4、1.00 g·L−1 NH4Cl、0.80 g·L−1 MgSO4·7H2O、0.06 g·L−1 FeSO4·7H2O、0.01 g·L−1 CaCl2·2H2O。培养温度30 ℃,驯化完成的污泥MLSS为16.97 g·L−1,MLVSS为5.73 g·L−1。
-
考察3种铁介质,即Fe0、硫酸亚铁(FeSO4)和四氧化三铁(Fe3O4)对S0自养反硝化脱氮性能的影响。铁介质投加质量浓度均为0.24 g·L−1 。反应器为250 mL厌氧瓶,在恒温摇床中进行,摇床转速为120 r·min−1,温度控制在30 ℃。向每个反应器中加入200 mL模拟废水、1 g的S0和10 mL驯化好的污泥。模拟废水由0.288 8 g·L−1KNO3、0.288 8 g·L−1KH2PO4 和0.346 5 g·L−1NaHCO3组成。采用 N2鼓吹10 min 以营造微生物适宜生长的缺氧环境,用丁基橡胶塞封住瓶口保持缺氧环境。不同反应器在一定的时间收集水样后,测定NO3−-N、亚硝氮(NO2−-N)和氨氮(NH4+-N)。每组实验均设置2个平行实验。
筛选出最佳铁介质后,进一步考察添加质量浓度对S0自养反硝化性能的影响。有研究表明较低的Fe0投加质量浓度会导致NO2−-N的积累,而较高的Fe0投加质量浓度,NO3−-N会被还原为NH4+-N [10]。因此,设置Fe0为0、0.1、0.24、0.48和1.43 g·L−1。
-
构建了两个相同的实验室规模有机玻璃反应柱,直径9.0 cm,高度30 cm,有效容积为945 mL(图1)。有机玻璃柱顶部加盖密封以保持厌氧环境,并在外部缠绕加热带以维持30 ℃温度。在反应器底部铺设3 cm高的鹅卵石(直径10~30 mm),其上填充S0颗粒(直径4~10 mm),填充高度为16 cm。反应柱内接种500 mL驯化后活性污泥。水样通过底部蠕动泵进入,并通过调节蠕动泵以控制水力停留时间(HRT)。为避免光照对微生物的不利影响,用铝箔胶带包裹反应器。R1为连续流S0自养反应器,R2右为连续添加Fe0的S0自养反应器,Fe0每天由反应器上部添加一次,每次的添加质量浓度为批次实验下的最佳质量浓度0.48 g·L−1。每次添加Fe0后,在不损伤生物膜的条件下用玻璃棒搅动使Fe0分散。两反应器的运行条件相同,如表1所示。氮负荷条件的改变参照DI CAPUA等 [12] 的研究结果。一般而言,S0自养反硝化系统的进水氮负荷在0.1~0.5 kg·(m3·d)−1。工程案例中实际进水氮负荷控制在0.2~0.3 kg·(m3·d)−1左右。根据不同的反应器设计和操作参数,进水氮负荷也可以在高负荷条件下0.8~1.0 kg·(m3·d)−1的运行。反应器在阶段Ⅰ~Ⅲ运行时,R1和R2每天取样一次,运行至阶段Ⅳ~Ⅵ,R1和R2每2 h取样,每天取样6次。
-
NO3−-N、NO2−-N、NH4+-N和硫酸根(SO42-)的质量浓度用紫外分光光度法测定[13]。总无机氮(TIN)为NO3−-N、NO2−-N和NH4+-N之和。经实验测定模拟污水中TN与TIN误差小于2%,在本实验中TN可记为NO3−-N、NO2−-N和NH4+-N之和。用数字式pH计(PHS-2F)测量反硝化过程中pH的变化。微生物电子转移系统活性(ETSA)测定参照温妍[14]的方法,活性污泥细胞外聚合物(EPS)提取采用热提法提取[15],测定EPS的蛋白质(PN)和多糖(PS)。PS和PN测定分别采用蒽酮-硫酸法和Lowry法[16]。数据采用一级动力学模型(式(1))拟合。
式中:C为t 时刻反应体系的 NO3−-N 质量浓度,mg·L−1;t为反应时间,d;C0 为初始时 NO3−-N的 质量浓度,mg·L−1;k为 NO3−-N还原的一级速率常数,d−1。
-
从驯化污泥和反应器R1和R2阶段Ⅱ和Ⅵ的运行样本中采集污泥样品(标记样品编号为 驯化污泥、R1-Ⅱ、R2-Ⅱ、R1-Ⅵ和R2-Ⅵ),进行16S rRNA的V3-V4 区扩增,所用的引物为515F-907R。此测试委托上海美吉生物医药科技有限公司进行。
-
通过对比不同铁介质(FeSO4、Fe0、Fe3O4)与S0组合对NO3−-N去除效果的影响,筛选出最佳铁介质,强化S0自养反硝化脱氮,实验结果如图2所示。不同铁介质对NO3−-N去除效果存在差异。FeSO4添加会抑制NO3−-N的去除,反应5 d后,S0+FeSO4实验组NO3−-N质量浓度为22.39 mg·L−1,比对照组高3.51 mg·L−1,分析认为,FeSO4的加入阻碍了底物的运输,限制了NO3−-N的还原[17-18]。Fe3O4添加对NO3−-N的去除几乎无影响,分析其原因可能是由于它不参与直接的还原反应,也不干扰微生物对硫的利用[19]。Fe0添加可以强化NO3−-N去除效果,反应5 d后,S0+Fe0实验组NO3−-N质量浓度为2.92 mg·L−1,比对照组NO3−-N去除量提高了40.15%(图2(a))。分析认为, Fe0与NO3−-N间化学作用促进了NO3−-N去除[20]。在pH较低、厌氧条件下,Fe0与NO3−-N在pH较低、厌氧条件下可以发生化学反应(式(2))。
实验过程中随反应时间的延长,S0+Fe0实验组中NH4+-N的质量浓度逐渐增加,反应5 d后,NH4+-N生成量为3.68 mg·L−1 (图2(b)),证实了Fe0与NO3−-N间化学反应。根据NH4+-N生成量,结合式(2)计算可知,通过Fe0化学反应去除的NO3−-N量为12.68 mg·L−1。S0+Fe0实验组NO3−-N去除量为36.86 mg·L−1(图2(a)),扣除化学反应去除的NO3−-N量,仍比对照组NO3−-N去除量(20.9 mg·L−1)高3.28 mg·L−1,这表明,Fe0与自养反硝化菌还存在协同作用,能够促进自养反硝化菌的活性。
为此,探究了不同Fe0添加质量浓度下对S0自养反硝化脱氮性能的影响及微生物响应机制。随着Fe0添加量的增加(0.1~0.48 g·L−1),NO3−-N去除量逐渐增加,反应5 d后,添加0.48g·L−1Fe0的实验组NO3−-N完全去除(图3(a)),比对照组NO3−-N去除量提高了18.73 mg·L−1,相应的NO3−-N去除速率为8.04 mg·(L·d)−1,为对照组的1.87倍。继续增加Fe0的添加量到1.43 g·L−1,出水NO3−-N质量浓度略有升高,为0.32 mg·L−1,说明Fe0添加质量浓度不宜再增加。实验观察到,随着Fe0的添加量的增加,NH4+-N的生成质量浓度也逐渐增大(图3(b)),表明较高的Fe0质量浓度增强了与NO3−-N的化学作用,但是当Fe0添加量由0.48 g·L−1增加到1.43 g·L−1,NO3−-N去除量略有下降,这表明除了化学反应外,微生物的代谢活动也影响NO3−-N的去除效果,不同Fe0添加量可能对微生物的影响不同。为此,进一步探究Fe0添加质量浓度对微生物的影响。图4为不同Fe0添加质量浓度下微生物EPS的分泌情况。EPS主要由 PN和 PS等多种成分组成,在维持生物膜结构、促进电子转移、降解污染物、增强微生物粘附等方面发挥着重要作用。对照组的EPS含量为45.41 mg·g−1,投加0.1、0.24、0.48和1.43 g·L−1Fe0的EPS分别比对照组微生物EPS增加了2.73%、16.43%、31.59%和3.52%(图4(a))。可见,添加0.48 g·L−1Fe0对微生物分泌EPS促进作用最强。EPS提高可以增加反硝化体系的电容值,产生更多的氧化还原活性基团,从而促进反硝化作用[21,22]。此外,Fe0促进了PN的分泌,添加0.48 g·L−1Fe0的实验组中PN值最大,为50.59 mg·g−1,是对照组PN值的1.35倍。PN包括色氨酸和酪蛋白类物质等,可以加速电子转移[23]。电子的产生和传递在反硝化过程中起着重要的作用。实验过程中也测定了各实验组的ETSA,如图4(b)所示,添加0.48 g·L−1Fe0的实验组ETSA最大,为0.24 μg·(g·min)−1,是对照组的4.8倍。这与PN增加的实验结果相一致。继续增加Fe0添加量到1.43 g·L−1,实验组ETSA降为0.2 μg·(g·min)−1,这可能是由于Fe0质量浓度增加,与细胞膜的接触增多,对细胞造成毒性和氧化应激,使细胞损伤并抑制细菌活性,ETSA降低,进而影响NO3−-N去除效果。这也解释了虽然将Fe0质量浓度提高至1.43 g·L−1时,强化了其与NO3−-N的化学去除作用,但同时也对微生物造成了一定的损伤。因此,当Fe0质量浓度为1.43 g·L−1时,NO3−-N的去除量反而略低于Fe0添加为0.48 g·L−1。实践中,推荐Fe0添加质量浓度为0.48 g·L−1。
-
Fe0添加对S0自养反硝化工艺去除NO3−-N具有显著的强化作用,但仅从去除量方面仍不足以全面理解其影响,因此,我们进一步通过动力学分析评估了Fe0在提高NO3−-N去除速率方面的表现。对照组和添加了0.1、0.24、0.48和1.43 g·L−1 Fe0的实验组前4 d的NO3−-N变化采用一级反应动力学模型进行拟合。由于第5天时S0+0.48 g·L−1Fe0实验组NO3−-N质量浓度为零,因此,舍弃该段数据,拟合结果如表2所示。有研究[24]表明,当水处理系统生物膜较薄、底物充足时,NO3−-N能够较快的扩散到生物膜表面,此时NO3−-N质量浓度与反应时间成线性关系。从表2可以看出,采用一级反应动力学模型拟合后的 R2均大于 0.9,表明模型与实验数据具有良好的拟合度。对照组一级反应速率常数(k)为0.153 3,添加Fe0实验组k值均高于对照组,其中,添加0.48 g·L−1Fe0实验组k是对照组的4.46倍,说明在添加Fe0的S0自养反硝化系统中,NO3−-N的转化速度加快。
-
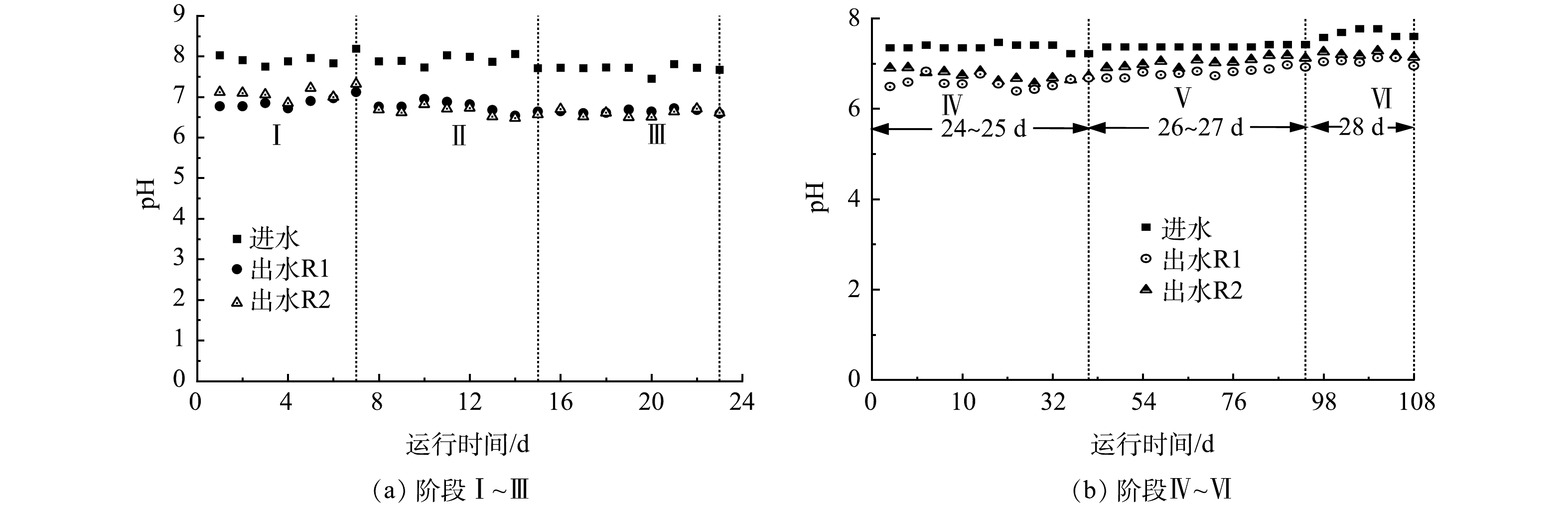
1)氮的去除。R1和R2反应器不同阶段进出水氮元素的变化如图5和图6所示。阶段Ⅰ,进水氮负荷较低,为0.14 kg·(m3·d)−1,R1反应器在运行初期(前4 d),出水NO3−-N质量浓度在4.89~8.35 mg·L−1,运行不稳定(图5(a))。运行到第5天,出水NO3−-N质量浓度趋于稳定,平均为1.62 mg·L−1。在相同实验条件下,连续添加0.48 g·L−1 Fe0的R2反应器,运行1 d后,即保持稳定,出水NO3−-N质量浓度平均值为0.19 mg·L−1。NO2−-N的积累也是反硝化过程中需要关注的参数。R1反应器前4 d出水NO2−-N质量浓度呈上升趋势,由4.87 mg·L−1升至11.61 mg·L−1,第5天后在11.78 mg·L−1左右波动(图5(b))。R2反应器出水NO2−-N累计量较低,平均质量浓度为1.77 mg·L−1。NO2−-N质量浓度增加这可能是反应器中没有足够的微生物进行充分的自养反硝化[25],NO2−-N作为中间产物出现了积累的现象。R1和R2出水TN平均质量浓度分别为13.52 mg·L−1和1.96 mg·L−1,可见,Fe0的连续添加也提高了脱氮效率(图5(c))。测得R1反应器ETSA为0.25 μg·(g·min)−1,R2反应器为0.79 μg·(g·min)−1,电子转移效率的提高可能是提高反硝化脱氮效率的关键因子。
继续增加进水氮负荷至0.19 kg·(m3·d)−1 (阶段II),R1反应器出水NO3−-N质量浓度在0.35~2.62 mg·L−1之间波动,到第14天后NO3−-N完全脱除,但有一定的NO2−-N积累(峰值4.7 mg·L−1),而 R2反应器抗负荷能力较强,出水NO3−-N稳定在0.13 mg·L−1,且没有NO2−-N积累,反硝化进行彻底。以《地表水环境质量标准》(GB 3838-2022)V类水TN指标为判别依据,当出水TN质量浓度降至2 mg·L−1以下时,R2反应器比R1反应器快6 d,这表明连续添加Fe0抗冲击负荷能力较强[11],且可以在短时间内实现较高的反硝化效率。继续进水负荷到0.32 kg·(m3·d)−1 (阶段Ⅲ),R2反应器同样能够迅速适应进水氮负荷的变化,在第16天后,出水氮元素几乎为0 mg·L−1,且脱氮效果稳定。当出水TN质量浓度降至2 mg·L−1以下时,R2反应器比R1反应器所需时间短5 d。
当进水氮负荷增加至0.65 kg·(m3·d)−1 (阶段Ⅳ),为了探究两反应器微观的差别,取样时间由1d·次−1调整为2 h·次−1(图6)。在此阶段进水条件下运行至6 h,R2反应器出水NO3−-N和TN质量浓度趋于稳定,分别为1.14 mg·L−1和1.20 mg·L−1,能够满足《地表水环境质量标准》(GB 3838-2022)V类水TN出水指标要求。相同条件下反应器出水TN质量浓度降至2mg·L−1以下,R2的去除时间仍然比R1快2 h。MA等 [26] 的研究中建立的S0自养反硝化系统的最大氮负荷为0.18 kg·(m3·d)−1。CHEN等[27]以S0-黄铁矿填料为填料,在进水TN质量浓度(20.65±0.24) mg·L−1,HRT为3 h下的氮负荷达0.16 kg·(m3·d)−1,相较于其他硫基自养反硝化系统,本实验建立的系统(氮负荷达0.65 kg·(m3·d)−1)具有脱氮优势。
继续提高进水氮负荷在1.09 kg·(m3·d)−1 (阶段Ⅴ),R2反应器出水NO3−-N和TN质量浓度呈先下降后上升的趋势,在此阶段进水条件下运行至6 h,出水NO3−-N和TN质量浓度分别为 2.62 mg·L−1和 2.73 mg·L−1,再继续运行24 h后,出水NO3−-N和TN质量浓度分别稳定在6.64 mg·L−1和7.74 mg·L−1,能够满足城镇污水厂污染物排放标准》(GB18918-2002)中一级A标准TN排放要求。相同条件下,R1反应器出水NO3−-N(6.98 mg·L−1)和TN(7.99 mg·L−1)相近。可见,较高进水氮负荷下,连续添加Fe0对于S0自养反硝化性能的提高未表现出明显优势。增加进水氮负荷至高氮负荷1.80 kg·(m3·d)−1 (阶段Ⅵ)时,R1和R2反应器出水TN质量浓度分别为22.36 mg·L−1和19.09 mg·L−1,均不能满足《城镇污水厂污染物排放标准》(GB18918-2002)中一级A出水要求。建议在实际运行中,进水氮负荷保持0.65 kg·(m3·d)−1以下,Fe0能够提高硫自养反硝化脱氮性能,出水能够满足《地表水环境质量标准》(GB 3838-2022)V类水TN出水指标要求(<2 mg·L−1)。
值得注意的是,在连续流运行阶段,R2反应器中的NH4+-N未被检出,原因可能是进水NO3−-N可与微生物有效接触,与Fe0之间的化学作用减弱,NH4+-N产生量低于检出限[28]。
2) pH与SO42-的变化。硫自养反硝化反应过程中pH是影响反应脱氮性能的因素之一[29]。图7反映了 R1和R2反应器中出水pH的变化情况。在连续添加Fe0后,R2反应器出水平均pH在阶段Ⅰ(7.10)高于R1(6.87) (图7(a)),可能是由于Fe0被水腐蚀产生OH −导致pH的升高[18]。在阶段Ⅱ~Ⅲ,R1和R2出水pH无明显差别,均在6.6左右(图7(a))。在阶段Ⅳ、Ⅴ和Ⅵ,R2出水的平均pH(6.81、7.04和7.38)略高于R1(6.60、6.74和6.36),分析认为可能是R2中更多的铁氧化菌分担了氮负荷使得pH升高(图7(b))。
硫自养反硝化还原NO3−-N的过程中会有SO42-的产生[30]。SO42-含量在各阶段的变化如图8所示,可以看出,在阶段Ⅰ、II和Ⅲ,R2出水中SO42-平均质量浓度(288.86、234.86和368.05 mg·L−1)略高于R1(224.98、212.68和346.06 mg·L−1) (图8(a)),这可能是由于R2比R1反硝化进行地更彻底,造成出水SO42-质量浓度增加。阶段Ⅳ、Ⅴ和Ⅵ中R2出水的SO42-(257.05、335.37和93.71 mg·L−1)略低于R1 (270.04、355.06和97.06 mg·L−1)(图8(b)),分析其原因可能是铁氧化菌分担了氮负荷,减少了SO42-的产生[31]。
3) Fe0的归趋。Fe0表面的腐蚀可能会释放少量Fe(Ⅱ)和三价铁(Fe(Ⅲ)),MIAO等[32] 建立了硫代硫酸钠-铁基自养反硝化生物滤池,系统中生成的总铁质量浓度小于20 mg·L−1。赵丹[33]搭建的S0/铁基填料反应器,出水总铁质量浓度在10 mg·L−1左右。这些铁离子可以直接随水排出,也可通过进入生物膜促进反硝化酶的合成,或作为电子供体参与反硝化过程[34]。此外,Fe(Ⅱ)和Fe(Ⅲ)还可能与磷酸盐反应形成沉淀,从而去除水中的磷酸盐,并将其转移至污泥中[32]。然而,Fe0的主要保留形式可能仍以零价态存在污泥中,且可继续被腐蚀[11]。在后续研究中,将进一步评估Fe0对系统污泥量及出水水质的影响,以明确Fe0的归趋,从而确保系统在高效反硝化的同时,避免铁离子对出水水质产生负面影响。
-
1)Alpha 多样性分析。在硫自养反硝化过程中,微生物群落通常通过调节细菌种群的组成和分布来适应不同的外部环境[35]。表3对比了R1和R2反应器常规负荷及超高负荷下微生物群落分布多样性情况,表中覆盖率>99%,表明样品文库的覆盖率较高。驯化污泥Ace 指数和Chao指数分别为998.71和962.12,说明微生物物种丰富。在常规负荷及超高负荷下,R1和R2反应器中微生物群落的物种丰富度均降低,R1和R2的Ace指数分别降至331.02和 196.22,Chao指数分别下降至315.98和184.22,分析其原因可能是物种之间优胜劣汰机制使得R1、R2微生物群落的物种丰富度持续下降优势种群富集。Shannon 值越大,Simpson 值越小,微生物群落多样性越高[36-37]。在阶段Ⅱ和Ⅵ中R1的Shannon 指数值(3.53和2.98)均高于R2(3.03和2.26),Simpson 指数(0.13和0.12)均低于R2(0.21和0.18),表明R1的群落多样性高于R2,可能是由于Fe0的氧化和消耗,Fe(Ⅲ)的积累抑制了一些菌群的生存[17]。
2)相对丰度分析。对驯化污泥、R1和R2反应器取得微生物样品在门水平上展开分析,结果如图9所示。由图9可见,变形菌门(Proteobacteria)、绿湾菌门(Chloroflexi)和弯曲菌门(Campilobacterota)是2种反应器中的优势菌门。从阶段Ⅱ到阶段Ⅵ,Proteobacteria在R1中的丰度由30.85%增加至67.39%,而在R2中丰度较为稳定,维持在58.55%~64.92%。Proteobacteria是自养反硝化中最常见的菌门,可以去除污水中的氮素和COD [38]。Campilobacterota在R2中的相对丰度占比(3.15%~13.47%)明显高于R1(0.15%~2.07%),分析其原因可能是Fe0及其氧化产物的刺激,Campilobacterota的一些功能菌的丰度得到了增强,Campilobacterota的存在可能有利于污水中NO3−-N的去除[39]。在阶段Ⅱ和阶段Ⅵ,R1中Chloroflexi的相对丰度分别比R2高出27.03%和6.55%,此门细菌可将死细胞和EPS降解为乳酸和乙醇等简单有机物,这一结果同时反映R2反应器的生物活性得到了增强[40]。在R1和R2反应器中均检测到少量厚壁菌门(Firmicutes)。有研究[41]表明,Firmicutes对极端环境具有很强的抵抗力,这有助于生物膜反应器的稳定运行。
属水平上微生物群落结构的相对丰度如图10所示,在驯化污泥、阶段Ⅱ和Ⅵ检测到的菌属中,硫杆菌属(Thiobacillus)和厌氧绳菌属(unclassified_f__Anaerolineaceae)是R1和R2共同的优势菌属。Thiobacillus专性化能自养的细菌,可通过S2-、S0作为电子供体来进行反硝化,在处理污水中的NO3−-N时起到重要作用[42]。阶段ⅡThiobacillus在R2中的相对丰度比R1高26.98%,由此可以看出Fe0的加入促进了Thiobacillus的生长,从而增加了Thiobacillus的丰度,提高了反应器的脱氮性能。SHI等[31]制备了新型ZVI复合载体,并在悬浮载体生物膜反应器中实施。与不添加ZVI的传统生物膜载体相比,添加了ZVI的复合载体促进了Thiobacillus的富集,Thiobacillus 在ZVI的复合载体反应器中转化为优势菌属。阶段ⅥR2中的Thiobacillus较阶段Ⅰ降低了27.5%,这可能是由于氮负荷的增加造成的其他菌属的富集,从而Thiobacillus的丰度有所降低。
阶段ⅥR1和R2系统中均检测到铁氧化菌属(Ferritrophicum),Ferritrophicum是一种嗜中性嗜微氧环境的菌属,可以利用Fe0和Fe(Ⅱ)等作为电子供体进行NO3−-N还原,并将获得的能量用于细胞合成[42]。但阶段Ⅱ,Ferritrophicum在两系统中相对丰度低于检出限,可能是由于Thiobacillus适宜低氮负荷环境,占主导地位,而Ferritrophicum更适宜高氮负荷环境,造成丰度低[43-44]。阶段ⅥR1系统中未补充Fe0,Ferritrophicum相对丰度较高(27.14%),分析其原因,Ferritrophicum不仅仅是以Fe0和Fe(Ⅱ)作电子供体,还可能是以还原态的硫作为电子供体[45-46]。R2系统中Ferritrophicum的相对丰度比R1高9.7%,Fe0可以为Ferritrophicum提供电子,不断添加Fe0增加了可以利用无机电子供体进行反硝化的细菌数量,可促进自养反硝化。
硫单胞菌属(Sulfurimonas)是一种自养脱氮菌属,能够利用多种氧化还原底物例如H2、还原性硫和NO3−-N[47]。Sulfurimonas在驯化污泥中的丰度为12.58%。然而,在阶段Ⅵ时,Sulfurimonas在R1中降至0.10%,R2为13.44%,这说明Fe0加入促进了Sulfurimonas的富集,Sulfurimonas在污水脱氮上起到重要作用。阶段Ⅱ和Ⅵ,热单胞菌(Thermomonas)也在R1和R2中被检测到,Thermomonas是一类反硝化微生物,并且具有N2O转化为N2显著优势[48]。R1和R2运行过程中发现Norank_f_PHOS-HE36存在,Norank_f_PHOS-HE36菌属可能是一种硫氧化菌,在硫循环过程中发挥着重要的功能[49]。
-
在Fe0强化S0自养反应器中,当进水NO3−-N质量浓度为30 mg·L−1,HRT为1.1 h,并且能够完全去除NO3−-N的情况下,基于耗材市场价格计算了处理成本,S0的吨水处理成本为0.026 元·t−1,Fe0为1.294 元·t−1,合计Fe0强化S0自养反硝化技术为1.32元·t−1。Fe0强化S0自养反硝化技术处理废水虽需一定的成本投入(1.32元·t−1),但其作为实现高效反硝化的潜在措施仍值得关注。此外,研究表明Fe0强化S0自养反应器在去除磷酸盐方面也表现出优势 [32]。进一步的研究将聚焦于Fe0的投加频率,以期降低成本。
-
1)铁介质对S0自养反硝化脱氮性能影响的研究结果表明 ,S0+0.48 g·L−1 Fe0实验组的NO3−-N去除速率达到8.04 mg·(L·d)−1,是单独使用S0(对照组)的1.87倍。添加Fe0与NO3−-N发生化学作用可加速NO3−-N的去除,Fe0的刺激提高了S0自养反硝化系统的ETSA,S0+0.48g·L−1 Fe0 实验组的ETSA为0.24 μg·(g·min)−1,是对照组的4.8倍。此外,外加Fe0的S0自养反硝化NO3−-N去除的反应速率常数与对照组相比均有所提高,S0+0.48 g·L−1Fe0组的 反应速率常数是对照组的4.46倍。
2)在进水氮负荷保持0.65 kg·(m3·d)−1以下时,Fe0能够提高硫自养反硝化脱氮性能,出水能够满足《地表水环境质量标准》(GB
3838 -2022)V类水TN出水指标要求(<2 mg·L−1)。3)经微生物群落结构分析发现,连续添加Fe0可增加优势自养反硝化菌群(Thiobacillus、Sulfurimonas、Ferritrophicum)的丰度,从而增强S0自养反硝化脱氮性能。
纳米零价铁强化硫自养反硝化脱氮性能
Enhanced nitrogen removal performance of sulfur autotrophic denitrification with nano zero-valent iron
-
摘要: 硝酸盐(NO3−-N)污染已成为最重要的水质问题之一,硫(S0)自养反硝化工艺以低成本、污泥产量少的优势受到广泛关注,为了进一步提高脱氮效率,该研究考察了铁介质对S0自养反硝化工艺脱氮速率,脱氮效率及微生物群落结构的影响。通过批次实验,确定了纳米零价铁(Fe0)可强化硫自养反硝化脱氮性能,最佳投加量为0.48 g·L−1,相应NO3−-N的去除速率为8.04 mg·(L·d)−1,为对照组的1.87倍。NO3−-N去除过程符合一级动力学模型,反应速率常数是对照组的4.46倍。Fe0主要通过刺激微生物胞外聚合物分泌,提高电子传递活性,并伴随化学作用进而强化脱氮。连续运行实验结果表明,连续添加0.48 g·L−1Fe0的S0自养反硝化工艺系统稳定性增强,当NO3−-N进水负荷由0.14kg·(m3·d)−1提高到0.32 kg·(m3·d)−1时,出水总氮(TN)稳定达到《地表水环境质量标准》(GB
3838 -2022)的V类水标准(<2 mg·L−1)所需的时间比不添加Fe0系统至少快5 d。微生物群落分析结果表明,连续添加Fe0增加了优势自养反硝化菌群(Thiobacillus、Sulfurimonas、Ferritrophicum)的丰度。以上研究结果可为Fe0强化S0自养反硝化工艺脱氮性能提供数据支持。Abstract: Nitrate (NO3−-N) pollution has become one of the most significant water quality issues. Sulfur (S0) autotrophic denitrification processes are gaining widespread attention due to their low cost and minimal sludge production. To further enhance nitrogen removal efficiency, the impacts of iron media on the denitrification rate, denitrification efficiency, and microbial community structure in S0 autotrophic denitrification processes were investigated. Through batch experiments, it was determined that nano zero-valent iron (Fe0) could enhance the nitrogen removal performance of sulfur autotrophic denitrification, with a corresponding NO3−-N removal rate of 8.04 mg·(L·d)−1 at the optimal dosage of 0.48 g·L−1, which was 1.87 times that of the control group. The NO3−-N removal process followed a first-order kinetic model, with the reaction rate constant being 4.46 times that of the control group. Fe0 enhanced nitrogen removal mainly through stimulating the secretion of extracellular polymeric substances in microorganisms, increase the activity of electron transfer and accompanied chemical interactions. Continuous operation experiments revealed that the stability of the S0 autotrophic denitrification system was enhanced with the continuous addition of 0.48 g·L−1 Fe0. When the influent load of NO3−-N increased from 0.14 kg·(m3·d)−1 to 0.32 kg·(m3·d)−1, the effluent total nitrogen (TN) consistently met the Class V water quality standards (< 2 mg·L−1) according to the "Surface Water Environmental Quality Standards" (GB3838-2022), achieving this at least 5 days faster than the system without Fe0 addition. Microbial community analysis showed that the continuous addition of Fe0 increased the abundance of dominant autotrophic denitrifying bacterial groups (such as Thiobacillus, Sulfurimonas, Ferritrophicum). The research findings can provide a data support for the enhancement of nitrogen removal performance in S0 autotrophic denitrification processes with Fe0. -

-
表 1 运行条件设置
Table 1. Operation condition Settings
反应
阶段时间/d NO3−-N/
(mg·L−1)KH2PO4/
(mg·L−1)NaHCO3/
(mg·L−1)HRT/h 进水氮负荷/
(kg·(m3·d)−1)Ⅰ 0~7 40 288.8 346.5 6.8 0.14 Ⅱ 8~15 30 216.6 259.9 3.7 0.19 Ⅲ 16~23 50 361.0 433.2 3.7 0.32 Ⅳ 24~25 30 216.6 259.9 1.1 0.65 Ⅴ 26~27 50 361.0 433.2 1.1 1.09 Ⅵ 28 30 216.6 259.9 0.4 1.80 表 2 NO3−-N 去除一级动力学模型拟合
Table 2. NO3−-N removal first-order kinetic model fitting
组别 k R2 对照组 0.153 3 0.943 1 S0+0.1 g·L−1Fe0 0.263 1 0.959 7 S0+0.24 g·L−1Fe0 0.498 9 0.997 2 S0+0.48 g·L−1Fe0 0.683 2 0.955 4 S0+1.43 g·L−1Fe0 0.638 4 0.976 3 表 3 Alpha 多样性指数及其对样品的测序结果统计表
Table 3. Statistical table of Alpha diversity index and the sequencing results for samples
样本 Ace Chao Shannon Simpson 覆盖率/% 驯化污泥 998.71 962.12 3.98 0.06 99.68 R1-Ⅱ 817.77 803.56 3.53 0.13 99.90 R2-Ⅱ 773.20 755.55 3.03 0.21 99.87 R1-Ⅵ 331.02 315.98 2.98 0.12 99.85 R2-Ⅵ 196.22 184.22 2.26 0.18 99.93 -
[1] CHEN G F, YUAN Y f, JIANG H F, et al. Electrochemical reduction of nitrate to ammonia via direct eight-electron transfer using a copper–molecular solid catalyst[J]. Nature Energy, 2020, 5(8): 605-613. doi: 10.1038/s41560-020-0654-1 [2] WANG Y M, LIN Z Y, WANG Y, et al. Sulfur and iron cycles promoted nitrogen and phosphorus removal in electrochemically assisted vertical flow constructed wetland treating wastewater treatment plant effluent with high S/N ratio[J]. Water Research, 2019, 151: 20-30. doi: 10.1016/j.watres.2018.12.005 [3] CUI Y Y, BISWAL B B K, Van Loosdrecht Mark CM, et al. Long term performance and dynamics of microbial biofilm communities performing sulfur-oxidizing autotrophic denitrification in a moving-bed biofilm reactor[J]. Water Research, 2019, 166: 115038. doi: 10.1016/j.watres.2019.115038 [4] OBEROI A, HUANG H Q, KHANAL S, et al. Electron distribution in sulfur-driven autotrophic denitrification under different electron donor and acceptor feeding schemes[J]. Chemical Engineering Journal, 2020, 4: 126486. [5] HUANG Y W, ZHANG H H, Liu X, et al. Iron-activated carbon systems to enhance aboriginal aerobic denitrifying bacterial consortium for improved treatment of micro-polluted reservoir water: Performances, mechanisms, and implications[J]. Environmental Science & Technology, 2022, 56(6): 3407-3418. [6] JIANG L, JI F Y, LIAO Y, et al. Denitrification performance and mechanism of denitrification biofilm reactor based on carbon-nitrate counter-diffusional[J]. Bioresource Technology, 2022, 348: 126804. doi: 10.1016/j.biortech.2022.126804 [7] 杨素萍, 赵春贵, 曲音波, 等. 铁和镍对光合细菌生长和产氢的影响[J]. 微生物学报, 2003, 43(2): 257-263. doi: 10.3321/j.issn:0001-6209.2003.02.018 [8] MA H, GAO X L, CHEN Y H, et al. Fe(Ⅱ) enhances simultaneous phosphorus removal and denitrification in heterotrophic denitrification by chemical precipitation and stimulating denitrifiers activity[J]. Environmental Pollution, 2021, 287: 117668. doi: 10.1016/j.envpol.2021.117668 [9] ZHOU Y P, CHEN Y C, YANG JIAYI, et al. Insight into the enhancing mechanism of exogenous electron mediators on biological denitrification in microbial electrolytic cell[J]. Science of the Total Environment, 2023, 896: 165096. doi: 10.1016/j.scitotenv.2023.165096 [10] FENG Z T, MA X, SUN Y J, et al. Promotion of nitrogen removal in a denitrification process elevated by zero-valent iron under low carbon-to-nitrogen ratio[J]. Bioresource Technology, 2023, 386: 129566. doi: 10.1016/j.biortech.2023.129566 [11] LIU C L, GUO Z R, ZHANG H R, et al. Single-cell Raman spectra reveals the cytochrome c-mediated electron transfer in nanoscale zero-valent iron coupled denitrification process[J]. Chemical Engineering Journal, 2022, 454: 140241. [12] Di Capua F, Milone I, Lakaniemi A M, et al. High-rate autotrophic denitrification in a fluidized-bed reactor at psychrophilic temperatures[J]. Chemical Engineering Journal, 2017, 313: 591-598. doi: 10.1016/j.cej.2016.12.106 [13] 刘艳芳, 刘晓帅, 尹思婕, 等. 包埋硫铁生物填料的制备及自养反硝化性能[J]. 中国环境科学, 2022, 42(11): 5136-5143. doi: 10.3969/j.issn.1000-6923.2022.11.020 [14] 温妍. Tween 80约束的多环芳烃功能菌降解特性研究[D]. 苏州: 苏州科技大学, 2022. [15] HE Q L, SONG Q, ZHANG S L, et al. Simultaneous nitrification, denitrification and phosphorus removal in an aerobic granular sequencing batch reactor with mixed carbon sources: reactor performance, extracellular polymeric substances and microbial successions[J]. Chemical Engineering Journal, 2018, 331: 841-849. doi: 10.1016/j.cej.2017.09.060 [16] SHEN R, SHENG G P, YU H Q. Determination of main components in the extracellular polymeric substances extracted from activated sludge using a spectral probing method[J]. Colloids and Surfaces B: Biointerfaces, 2012, 94: 151-156. doi: 10.1016/j.colsurfb.2012.01.045 [17] CHEN S, ZHOU B, CHEN H, et al. Iron mediated autotrophic denitrification for low C/N ratio wastewater: A review[J]. Environmental Research, 2022, 216(P4): 114687. [18] GUAN X H, SUN Y K, QIN H J, et al. The limitations of applying zero-valent iron technology in contaminants sequestration and the corresponding countermeasures: the development in zero-valent iron technology in the last two decades (1994-2014)[J]. Water Research, 2015, 75: 224-248. doi: 10.1016/j.watres.2015.02.034 [19] CHEN Y, YANG J, XIAO L, et al. Role of Nano-Fe3O4 for enhancing nitrate removal in microbial electrolytic cells: Characterizations and microbial patterns of cathodic biofilm[J]. Chemosphere, 2023, 339: 139643. doi: 10.1016/j.chemosphere.2023.139643 [20] CHEN Y M, LI C W, CHEN S S. Fluidized zero valent iron bed reactor for nitrate removal[J]. Chemosphere, 2005, 59: 753-759. doi: 10.1016/j.chemosphere.2004.11.020 [21] HE C S, DING R R, CHEN J Q, et al. Interactions between nanoscale zero valent iron and extracellular polymeric substances of anaerobic sludge[J]. Water Research, 2020, 178: 115817. doi: 10.1016/j.watres.2020.115817 [22] WANG X B, CHEN T T, GAO C Y, et al. Effect of extracellular polymeric substances removal and re-addition on the denitrification performance of activated sludge: carbon source metabolism, electron transfer and enzyme activity[J]. Journal of Environmental Chemical Engineering, 2022, 10(3): 108069. doi: 10.1016/j.jece.2022.108069 [23] TAKEMATSU K, WILLIAMSON HEATHER R, NIKOLOVSKI P, et al. Two tryptophans are better than one in accelerating electron flow through a protein[J]. ACS Central Science, 2019, 5: 192-200. doi: 10.1021/acscentsci.8b00882 [24] HAN S C, CUI Y W, YAN H J, et al. Enhancing simultaneous nitrate and phosphate removal in sulfur-iron (Ⅱ) autotrophic denitrification biofilters by endogenous magnetic fields: Performance and mechanism[J]. Journal of Water Process Engineering, 2023, 53: 103767. doi: 10.1016/j.jwpe.2023.103767 [25] 刘畅, 崔康平, 孙士杰. 硫型免烧自养反硝化填料制备及其脱氮性能研究[J]. 工业用水与废水, 2023, 54(04): 60-65. doi: 10.3969/j.issn.1009-2455.2023.04.012 [26] MA W J, ZhANG H M, TIAN Y. Rapid start-up sulfur-driven autotrophic denitrification granular process: Extracellular electron transfer pathways and microbial community evolution[J]. Bioresource Technology, 2024, 395: 130331. doi: 10.1016/j.biortech.2024.130331 [27] CHEN Z, PANG C, WEN Q. Coupled pyrite and sulfur autotrophic denitrification for simultaneous removal of nitrogen and phosphorus from secondary effluent: Feasibility, performance and mechanisms[J]. Water Research, 2023, 243: 120422. doi: 10.1016/j.watres.2023.120422 [28] 刘晓帅. 硫-铁自养反硝化深度脱氮工艺研究[D]. 石家庄: 河北科技大学, 2022. [29] LIU L H, KOENIG A. Use of limestone for pH control in autotrophic denitrification: Batch experiments[J]. Process Biochemistry, 2002, 37: 885-893. doi: 10.1016/S0032-9592(01)00302-8 [30] 史航, 隆添翼, 柳聪, 等. 基于异养-硫自养反硝化耦合技术的陶粒-硫磺混合生物填料对城市污水处理厂尾水的深度脱氮[J]. 环境工程学报, 2022, 16(4): 1363-1372. doi: 10.12030/j.cjee.202111034 [31] SHI Y P, LIU T, YU H T, et al. Enhancing anoxic denitrification of low C/N ratio wastewater with novel ZVI composite carriers[J]. Journal of Environmental Sciences, 2021, 112: 180-191. [32] MIAO H H, ZENG W, LI J M, et al. Nutrient removal performance and the nitrogen-sulfur conversion pathways in sulfur-iron based biofilter under acidic/alkaline conditions[J]. Chemical Engineering Journal, 2024, 499: 156157. doi: 10.1016/j.cej.2024.156157 [33] 赵丹. Fe2+/Fe0强化硫自养反应器脱氮除磷试验研究[D]. 徐州: 中国矿业大学, 2023. [34] MIAO H, ZENG W, LI J, et al. Simultaneous nitrate and phosphate removal based on thiosulfate-driven autotrophic denitrification biofilter filled with volcanic rock and sponge iron[J]. Bioresource Technology, 2022, 366: 128207. doi: 10.1016/j.biortech.2022.128207 [35] WANG C, XU Y, HOU J, et al. Zero valent iron supported biological denitrification for farmland drainage treatments with low organic carbon: Performance and potential mechanisms[J]. Science of the Total Environment, 2019, 689: 1044-1053. doi: 10.1016/j.scitotenv.2019.06.488 [36] ZHANG T, SHAO M F, YE L. 454 pyrosequencing reveals bacterial diversity of activated sludge from 14 sewage treatment plants[J]. The ISME Journal, 2011, 6: 1137-1147. [37] CAUSEY BEVERLEY D. Parametric estimation of the number of classes in a population[J]. Journal of Applied Statistics, 2002, 29(6): 925-934. doi: 10.1080/02664760220136221 [38] 李政辉, 刘宝河, 余浩然, 等. 硫源对反硝化脱氮性能及微生物群落结构的影响[J]. 环境科学与技术, 2023, 46(9): 1-10. [39] 黄涵, 王继华. 污水处理厂中微生物群落特性与基因功能探究[J]. 环境科学与技术, 2023, 46(S1): 1-7. [40] HAN F, ZHANG M R, SHANG H G, et al. Microbial community succession, species interactions and metabolic pathways of sulfur-based autotrophic denitrification system in organic-limited nitrate wastewater[J]. Bioresource Technology, 2020, 315: 123826. doi: 10.1016/j.biortech.2020.123826 [41] YANG L, QIN Y J, LIU X Y, et al. The performance and microbial communities of Anammox and sulfide-dependent autotrophic denitrification coupling system based on the gel immobilization[J]. Bioresource Technology, 2022, 356: 127287. doi: 10.1016/j.biortech.2022.127287 [42] WANG J J, HUANG B C, LI J, et al. Advances and challenges of sulfur-driven autotrophic denitrification (SDAD) for nitrogen removal[J]. Chinese Chemical Letters, 2020, 31(10): 2567-2574. doi: 10.1016/j.cclet.2020.07.036 [43] 刘宝峰, 郭宇平. 硫自养反硝化技术用于市政污水深度处理[J]. 中国给水排水, 2022, 38(22): 91-95. [44] ZHU T T, CHENG H Y, YANG L H, et al. Coupled sulfur and iron(Ⅱ) carbonate-driven autotrophic denitrification for significantly enhanced nitrate removal[J]. Environmental Science & Technology, 2019, 53: 1545-1554. [45] 李明礼, 高彦宁, 黄丹, 等. 强化型硫铁矿自养反硝化工艺深度处理城市二沉尾水研究[J]. 大连理工大学学报, 2023, 63(5): 454-462. doi: 10.7511/dllgxb202305003 [46] 刘蕊, 施海仁, 常丽如, 等. 硫基自养反硝化处理市政污水的性能研究[J]. 环境化学, 2024, 44(9): 1-14. [47] SIEVERT STEFAN M, SCOTT KATHLEEN M, KLOTZ MARTIN G, et al. Genome of the epsilonproteobacterial chemolithoautotroph Sulfurimonas denitrificans[J]. Applied and Environmental Microbiology, 2007, 74(4): 1145-1156. [48] LIU X Z, ZHAO C S, XU T T, et al. Pyrite and sulfur-coupled autotrophic denitrification system for efficient nitrate and phosphate removal[J]. Bioresource Technology, 2023, 384: 129363. doi: 10.1016/j.biortech.2023.129363 [49] SHI C, XU Y, LIU M, et al. Enhanced bisphenol S anaerobic degradation using an NZVI-HA-modified anode in bioelectrochemical systems[J]. Journal of Hazardous Materials, 2021, 403(23): 124053. -




 下载:
下载: