-
印染纺织行业排放的废水是我国排放量最大的工业废水之一,其组分复杂且水质变化大,含有大量的染料、表面活性剂及其他难降解的有机污染物[1]。废水中近85%的有机污染物经过各种处理工艺后被去除,但排水中仍含有各种降解及代谢产物和难降解污染物,虽然含量低但仍具有致癌、致畸和致突变作用,这对天然接收水体造成了严重的不利影响[2]。其中溶解性有机物(dissolved organic matter, DOM) 作为印染外排废水中污染物最主要的存在形式,其具体成分及含量会直接影响到出水水质,由于DOM不易被完全降解及矿化,常规的有机物指标如化学需氧量,总有机碳等只能反映印染外排废水中有机物的总量,不能反映DOM具体组分构成及含量,难以掌握其对接收水体的环境危害。
三维荧光光谱(excitation-emission maps, EEMs)作为一种可定性定量研究 DOM 的光谱指纹分析技术,可方便快捷地揭示DOM所含的类蛋白(类色氨酸,类酪氨酸等)和类腐殖质(类胡敏酸,类富里酸等)荧光团的组成信息[3]。常用荧光指数(fluorescence index, FI),腐殖化指数(humification index, HIX),自生源指数(biological index, BIX)来分别判断DOM腐殖质的来源[4],估计DOM的腐殖化程度及衡量水体中生物活动对DOM的贡献[5]。EEM光谱通常是由若干相互叠加的荧光团组成,导致部分峰无法识别或者指认不准确。Stedmon[6]率先提出利用三维荧光结合平行因子分析(PARAFAC)技术将DOM三维荧光光谱分为单个荧光团或一组具有独特激发和发射光谱的相似荧光团。但平行因子只能得到单独荧光组分及该组分对应的最大荧光强度,而无法定量分析该荧光组分区域的总荧光强度。荧光区域积分(fluorescence regional integration,FRI)[7]作为另一种荧光光谱解析方法,可对具体区域的荧光强度定量表征,在一定程度上克服了以上不足。通过PARAFAC及FRI的方法,可以准确识别出EEM中荧光峰的个数,位置和具体区域荧光强度等相关信息。
目前的研究主要集中于天然陆地水环境DOM和受污染水体DOM等[4-6, 8-9],有关印染外排废水DOM的光学特性研究还不多见。本研究结合三维荧光光谱和平行因子分析,辅以荧光区域积分法,分析对比经过不同处理工艺后的印染外排废水DOM的荧光特征,丰富关于印染外排废水中DOM的调查资料,为其特征研究提供依据,为优化印染废水处理厂的运行和监控管理提供技术参考。
全文HTML
-
印染外排废水来源于广东省珠三角附近的五家典型印染废水处理厂(textile-dyeing treatment plant, TDP)(图1a)。其废水处理工艺流程可以分为两类(图1b):第一类系统(TDP1和TDP3)是废水从初级沉淀池到厌氧消化池和曝气池,经过生化沉淀池或膜生物反应器后化学深度处理而后排放,代表典型的生物-化学处理工艺。第二类系统(TDP2,TDP4和TDP5)包括厌氧消化池和曝气池,沉淀池及膜过滤或者砂滤,代表典型的生物处理工艺。为避免出水的可变性,每隔2 h取一定体积的外排废水装入一个5 L的聚四氟乙烯塑料瓶中,装满后迅速带回实验室。水样经0.45 μm纤维素滤膜过滤后存储于玻璃瓶中,并储存在4 ℃下以备进行后续化学分析。
-
荧光光谱采用稳态-瞬态荧光光谱仪(FLS1000,爱丁堡,英国)进行测定。为了避免样品浓度过高导致荧光淬灭,利用超纯水对水样进行不同倍数的稀释,使其在波长254 nm处的紫外吸光度小于0.1[8]。EEM光谱的激发波长(λEx)和发射波长(λEm)扫描范围分别为220—480 nm(增量为5 nm)和250—550 nm(增量为2 nm),发射及激发单色仪的狭缝宽度设置为2.5 nm。测量结果扣除空白样(超纯水)的三维荧光数据后进行Delaunay三角形内插值法修正从而减少水拉曼峰散射和瑞利散射及仪器带来的误差。此外,荧光强度以硫酸奎宁(QSU)单位表示(1 QSU=1 μg·L−1硫酸奎宁在激发波长为350 nm,发射波长为450 nm测得的荧光强度,标准曲线为y=1255.645x+1713.97,R2 =0.99415),记录同样激发发射波长下DOM的荧光强度[9]。荧光指数FI是λEx=370 nm时,λEm在470 nm和520 nm处的荧光强度比值;腐殖化指数HIX是λEx=254 nm时,λEm在435—480 nm与300—345 nm波段的荧光积分值之比;自生源指数BIX是λEx=310 nm 时,λEm在380 nm与430 nm处的荧光强度比值[4, 10]。
-
利用Matlab-R2015a软件(美国Mathworks公司),基于DOMFluor工具包采用平行因子算法(PARAFAC)对DOM的EEM光谱进行解谱以识别荧光组分特征。采用拆半及残差分析来验证PARAFAC模型的可靠性及有效性,得到最佳的DOM组分数目及信息。为了增加样本量,每组TDP稀释2倍及4倍(TDP1浓度很低,只稀释2倍)并都进行三维荧光分析,且重复3次。
-
荧光区域积分法是由Chen等[11]学者提出的,实质是将EEM光谱划分为几个独立区域的定量分析方法,基于相同区域的荧光组分特征相似原理,用Origin 2018软件计算出特定的荧光区域积分体积Φi,对Φi进行标准化分析后得到荧光区域积分标准体积Φi,n,反应了该区域特定结构的有机物相对含量;最后计算出该荧光区域积分标准体积占总积分体积的比例Pi,n[12]。基于研究对象的不同,本研究的EEM光谱区域划分为:低激发酪氨酸类(Ⅰ,Ex/Em=220—250/280—330 nm)、高激发酪氨酸蛋白类(Ⅱ,Ex/Em=250—300/280—330 nm)、低激发色氨酸类(Ⅲ,Ex/Em=220—250/330—380 nm)、高激发色氨酸蛋白类(Ⅳ,Ex/Em=250—300/330—380 nm)、紫外区类富里酸(Ⅴ,Ex/Em=220—270/380—550 nm)及可见光区类富里酸(Ⅵ,Ex/Em=270—400/380—550 nm)[13]。
-
采用spearman相关性分析研究不同荧光组分之间的相关性,系统聚类法对TDE水样的各种光谱数据进行聚类分析,用欧式距离将不同TDP分类。实验数据采用SPSS 25.0(IBM,美国)及Origin 2018(Origin Lab,美国)进行统计分析及绘图。
1.1. 样品的采集与预处理
1.2. DOM荧光光谱分析
1.3. 数据处理
1.3.1. 平行因子算法
1.3.2. EEMs区域积分法
1.3.3. 其他分析
-
由表1可知,DOM的荧光强度由大到小依次是:TDP5>TDP4>TDP2>TDP3>TDP1。其中狭义的荧光指数(FI)通常用于表征DOM中腐殖质的来源,小于1.4表明主要来源于非生物代谢过程且具有较高芳香度,而大于1.9是由微生物代谢等过程引起的自生源[14]。本研究中DOM的FI值范围为1.562至2.318,说明这5组样品中微生物来源作用大于非微生物来源,这可能是由于废水经过生物处理所致。研究水样中,DOM的BIX值在0.709至1.243的范围内,Huguet等[15]认为较高的自生源指数(BIX)值(>0.8)表示DOM主要是自生的,包括浮游植物和细菌有机降解产物,本研究的DOM中腐殖质主要为自生源。另外,腐殖化指数(HIX)可以反映DOM中腐殖质含量或腐殖化程度,当HIX小于4时,DOM主要由生物活动产生[16]。本研究DOM的腐殖化指数为0.618至4.033。且TDP1及TDP3的HIX值分别为0.680和0.618,低于传统城市污水处理排水HIX值(0.714)[17],表明这两组外排废水的芳香族化合物中类腐殖质物质的比例低于城市污水处理排水。其余3组HIX值均大于1,且对应的荧光强度值较高,表明他们存在较大比例的腐殖质类芳香族化合物,呈微弱腐殖质特征和具有重要的近期自生源。综上,本研究中外排废水DOM主要来源于微生物代谢产物,且呈现微弱腐殖质特征。
-
大多数荧光物质具有共轭π键等刚性平面结构特征,在废水中常见的有蛋白质、腐殖质和其他芳香族化合物等。EEM光谱包含了被测样品丰富全面的荧光信息,其中Em<380 nm的荧光峰代表类蛋白质,Em>380 nm的荧光峰代表与含芳香环的荧光基团相关的类腐殖质[18-20]。本研究的印染外排废水DOM的EEM光谱如图2所示。
在TDP1的EEM光谱中出现2个非常明显的类蛋白荧光峰(B2,T1)。其中峰B2的荧光中心位置为Ex/Em=280/335 nm,属于酪氨酸荧光,主要由废水处理过程中微生物新陈代谢产物的荧光产生[11],位于图谱的区域Ⅱ。峰T1的荧光中心位置为Ex/Em=230/340 nm,属于色氨酸等芳香蛋白荧光[12],主要由废水中未降解的芳香蛋白构成,位于图谱的区域Ⅲ。另外在图谱的区域Ⅳ,出现荧光强度较弱的紫外区类富里酸荧光峰(A),但并未见明显荧光中心,即代表的类腐殖质在该水样中含量较低。其余四个TDP的EEM图谱都出现明显的荧光峰A,其中心位置为Ex/Em=250/460 nm;在区域Ⅵ还出现一个弱荧光峰(C),属于可见光区类富里酸荧光峰[21],其中心位置为Ex/Em=305/460 nm。此外,TDP2、TDP4和TDP5的EEM图谱中,其峰B2的发射波长由区域Ⅱ逐渐红移到区域Ⅳ,出现这种现象可能是因为这几组水样DOM中含有更多的羰基、羧基和羟基荧光基团,导致共轭效应增强[22]。先前的研究关于印染外排废水DOM的主要荧光峰出现在230/340 nm、280/340 nm、250/460 nm、305/460 nm和350/460 nm附近[18],且类腐殖质区域中峰350/460 nm为主要荧光贡献峰。本研究的EEM光谱中各荧光峰位置与前者几乎吻合,但峰350/460 nm处荧光强度非常弱,推测可能与印染废水的原水组成成分及处理流程有关,本研究中峰250/460 nm占类腐殖质区域的主导地位。
总体上5组TDP水样DOM的EEM光谱中类蛋白荧光峰较为明显,结合基本荧光指数特征,说明DOM受水样内部微生物活动的影响,原水中的有机质在微生物及其蛋白酶作用下,被水解进而释放出氨基酸组分,导致排水中微生物新陈代谢产物的荧光较高[21, 23]。亦有可能与原水样中所含的污染物种类及含量有关,使得处理后的排水中类蛋白质仍占优势,这需要以后进一步研究分析。
-
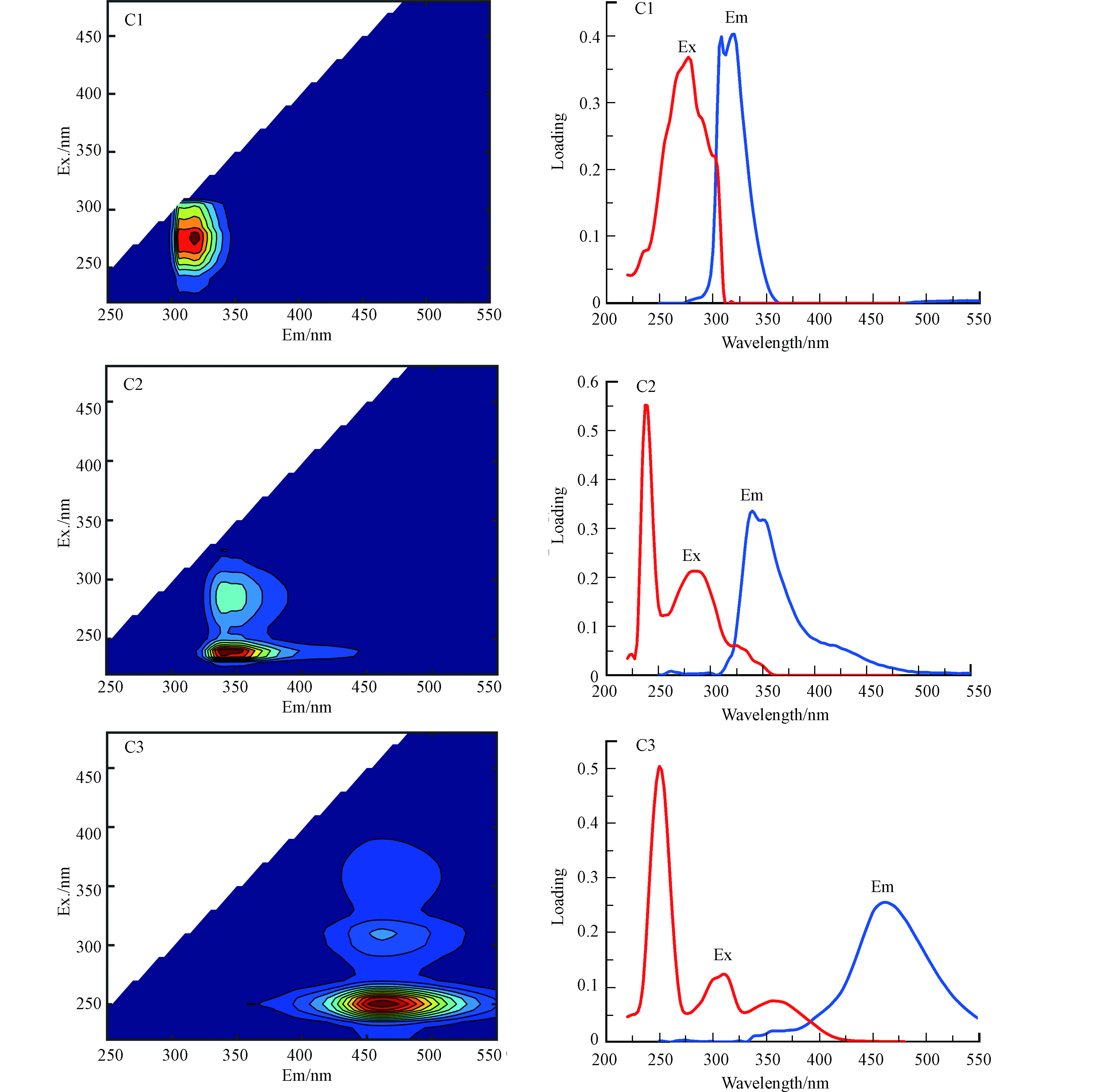
类酪氨酸及类色氨酸是类蛋白质的主要荧光成分。由图2可以发现,原始EEM光谱中类蛋白质荧光区域因光谱的重叠而分离不出具体的荧光组分。现基于PARAFAC对不同印染外排废水DOM的EEM光谱进行模拟,共识别到3个荧光组分(如图3所示),分别是C1(Ex/Em=275/315 nm),C2(Ex/Em=240,280/350 nm)及C3(Ex/Em=250,300,305/460 nm)。
由图3可知,所有组分皆具有单一的发射峰,但激发峰个数各不相同。其中组分C1主要位于荧光区域Ⅰ和Ⅱ,在传统峰B2附近,主要由类酪氨酸物质组成。C2荧光组分位于荧光区域Ⅲ和IV,在传统峰T1及T2附近,以色氨酸为主。城市污水及印染废水中均发现类似的荧光组分[24-25],主要为各种类蛋白荧光物质贡献。C3荧光组分位于荧光区域Ⅴ和Ⅵ,其中对应的250/460 nm峰与传统的A峰吻合,310/460 nm峰位于传统C峰附近,意味着组分C3存在着高芳香度和高分子量的基团[26],属于类腐殖质组分,其微生物利用率较低。经PARAFAC得到的3组荧光组分的最大激发/发射波长及指示意义及性质描述见表2。
为进一步研究三组组分是否同源,将三组分两两进行相关性分析(图4)。分析发现,类酪氨酸组分C1与类腐殖质C3相关性不显著,但与类色氨酸组分C2相关性高达0.7936(P<0.05),表明可能有相似来源,同属于类蛋白质,主要以微生物新陈代谢产物及其附着型胞外聚合物为主[26]。而C2与C3的相关性也达到0.7949(P<0.05),结合荧光指数分析结果,DOM中腐殖质主要来源为微生物活动,且与组分C2类色氨酸蛋白具有同源或同结构性,推断部分有机物被微生物降解或矿化后的产物中具备类腐殖质荧光。
-
在以往的研究基础[11]上,将EEM光谱区域重新划分为6个激发发射区域,如图2所示。其中区域Ⅰ的荧光信号主要与酪氨酸等类蛋白质有关,区域Ⅲ主要由色氨酸等类蛋白有机物产生。而区域Ⅱ和区域Ⅳ主要由废水处理过程中微生物的代谢产物如辅酶,蛋白质和小分子有机酸等的荧光产生。区域Ⅴ主要由富里酸类,醌类及酚类等有机物产生,而区域Ⅵ的荧光信号则与胡敏酸类,富里酸类及多环芳烃等芳构化程度较高的有机物有关[28]。区域Ⅰ - Ⅳ可归类为类蛋白质区域,区域Ⅴ和Ⅵ为类腐殖质区域。
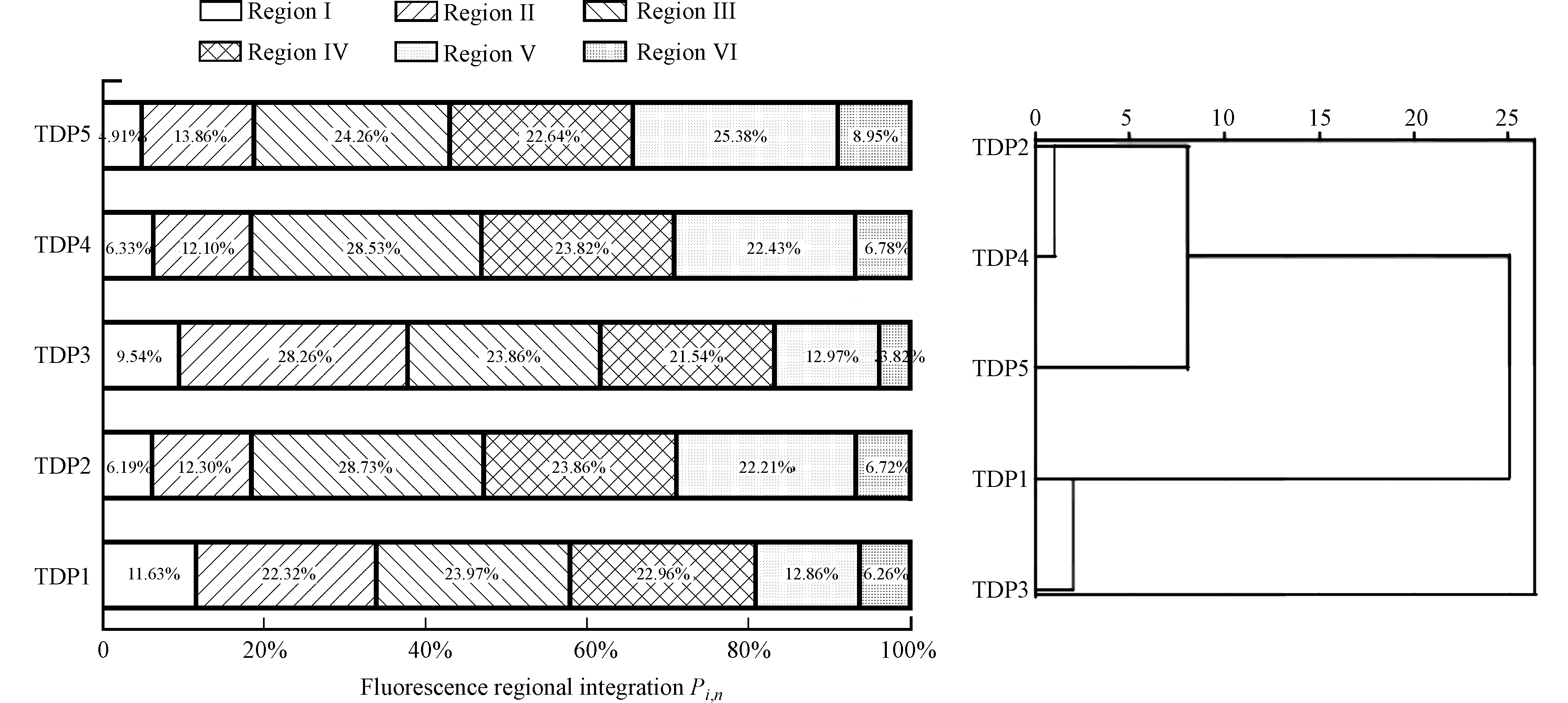
FARAFAC对DOM的EEM光谱进行了定性分析,表3的荧光区域积分标准体积则对具体区域代表有机物的相对含量间接定量表征。分析发现TDP1,TDP2和TDP4中类色氨酸组分(区域Ⅲ)为优势荧光组分,其区域标准体积分别为8.155×105 、61.307×105 、59.148×105 au·nm2;TDP3主要荧光区域为区域Ⅱ,其区域标准体积为32.619×105 au·nm2;TDP5优势荧光区域为区域Ⅴ的类腐殖质荧光区域,对应的标准体积为90.052×105 au·nm2。
进一步分析EEM光谱6个区域的积分体积占比Pi,n情况,如图5a所示。分析发现,类蛋白质荧光区域总占比为65.68%—83.21%,远远大于类腐殖质的区域百分比。其中TDP2、TDP4和TDP5的荧光区域Ⅰ和Ⅱ的贡献率都很低,表明类蛋白荧光主要由色氨酸蛋白及微生物新陈代谢产物的荧光组成。每组TDP的总类蛋白质荧光占比远高于类腐殖质,这可能是因为印染废水的生化处理过程中会产生可溶性微生物代谢产物,及其微生物本身附着的胞外聚合物,导致外排废水中具有类蛋白荧光的物质含量较高。
深入研究发现,所有的区域Ⅵ的贡献率都非常低,只有3.82%—8.95%,表明EEM光谱中类腐殖质区域的荧光主要由类富里酸贡献。TDP2、TDP4和TDP5的DOM类腐殖质区域(V+VI)占比显著高于其他两组DOM,TDP5的类腐殖质占比甚至达到34.33%,可能这几组废水在生物处理过程中,氨基酸等物质被分解或矿化的过程同时有助于类富里酸物质的释放,从而增大相应的荧光强度。结合图1b,也可能是因为TDP1和3处理工艺中的臭氧氧化将生物处理过程中残余的难降解有机物进一步去除,减少了类腐殖质的含量,也使得整体荧光强度相对于其他TDP较低。
上述结果表明,相对于传统的肉眼取峰值方法,基于FRI分析结果可以额外提供一些有价值的信息。为了进一步研究各水样三维荧光指纹特征的相似性,将各水样的荧光指数及荧光区域积分标准体积归一化数据导出进行聚类分析(图5-b)。当欧式距离小于10时,所有样品可以被分为2类:第一类是TDP2、TDP4和TDP5,他们都是经过传统的生物处理后得到的水样,荧光区域Ⅲ,VI和V的积分体积占比相当;第二类是TDP1和TDP3,经过生物处理后还进行化学深度处理,荧光强度较其余几组TDP低,且类腐殖质荧光区域占比相对较低。采用EEM荧光区域积分及聚类分析可以有效辨别印染废水DOM的指纹特征。
2.1. DOM的基本荧光指数
2.2. DOM的三维荧光光谱特征
2.3. DOM的荧光组分
2.4. DOM的荧光区域积分
-
(1) 基于荧光指数及三维荧光光谱发现外排废水DOM中腐殖质主要来源于微生物代谢产物,具有弱腐殖质特征。
(2) 利用PARAFAC模型识别出印染外排废水中DOM主要由3个荧光组分组成,分别是类酪氨酸荧光组分C1(Em/Ex=320/275 nm),类色氨酸荧光组分C2(Em/Ex=350/225,275 nm)和类腐殖质荧光组分C3(Em/Ex=460/250,300 nm);C1与C2,C2与C3组分具有显著强相关性(r>0.79,P<0.05),它们在来源或结构上有一定相似性。
(3)外排废水中DOM的有机物构成以类蛋白质荧光组分为主,类腐殖质的含量相对较低,且荧光组分的构成可能与废水处理工艺有关。
(4) PARAFAC与FRI分析可以定性及定量分析DOM的荧光信息,提供印染外排废水中DOM的特性及形成信息。




 下载:
下载: