-
N-亚硝胺类物质(以下简称亚硝胺),通式为R1(R2)=N—N=O(R是烷基或芳烃),其来源广泛,以极微量的成分分布于大气、水、土壤、食物、烟草、农药、化妆品和化工产品等介质中,也可经消毒过程产生。水中常见的亚硝胺有9种,物质结构图见图1,包括脂肪族(如N-亚硝基二甲胺NDMA)、杂环(如N-亚硝基吗啉NMOR)和芳香族(如N-亚硝基二苯胺NDPhA),一般为黄色液体,或低熔点固体。亚硝胺引起人们的广泛关注有两个原因。首先,亚硝胺是有毒有害物质,其致癌性远高于三卤甲烷等常规消毒副产物[1],亚硝胺的致癌性是其N-硝胺类似物的15倍,三卤甲烷的600倍[2]。美国环境保护署综合风险信息系统(USEPA IRIS)和国际癌症研究机构(IARC)对水中常见的9种亚硝胺的致癌等级进行了评定,结果显示亚硝胺的致癌等级均在2B级及以上[3]。美国等国家的相关部门已经对相应的亚硝胺含量及种类进行了监管,例如对于NDMA,美国环保局建议饮用水中的最大浓度为7 ng·L−1[4];在澳大利亚,饮用水中的最大允许值为10 ng·L−1[5]。近年来还发现了一些新型亚硝胺,比如烟草专属亚硝胺(TSNAs),它是一类仅存在于烟草及烟草制品中的亚硝胺。它可以在调制、加工等过程中,由烟草生物碱亚硝化作用产生[6-7],通过香烟燃烧大量释放。在已知的TSNAs中,N-亚硝基降烟碱(NNN)、4-(甲基亚硝胺基) -1-(3-吡啶基) -1-丁酮(NNK)最具致癌性, 已被IARC确定为1类(最高级别)致癌物[8]。其他的TSNAs包括N-亚硝基新烟草碱(NAT) 和N-亚硝基假木贼碱(NAB) 4-(N-亚硝基胺)-4-(3-吡啶基)-1-丁醛(NNA)等[9],因此需要进一步评估TSNAs对人类健康造成危害的可能性。其次,由于城市化和城市人口规模的发展,人们直接或间接受到被污染水体的危害逐渐增加。而这些水体中,多含有污水有机质或藻类有机质等高含氮的亚硝胺前体物,从而增加亚硝胺生成的概率[10]。这也是近年来在饮用水中常检出亚硝胺的重要原因[11-12]。这又进一步提高了人类接触亚硝胺类物质的可能性。
由于亚硝胺的亨利定律常数(Henry`s law constant)低,因此其主要存在于水体介质中[1]。基于此,迄今为止,对在固体环境基质中的亚硝胺的检测与环境行为的研究相对较少。土壤是生态环境的重要组成部分,更是人类赖以生存和发展的物质基础。目前已有研究表明土壤中亚硝胺可被检出,常见的亚硝胺类物质可以通过工业废水、污水处理厂污泥的填埋处理以及废水的农业利用等途径进入土壤环境中[13-15],需要进一步分析亚硝胺在土壤环境的浸出风险。对于TSNAs,虽然我国是烟草种植大国,但在种植环节中,TSNAs进入土壤的可能性有限。因为目前的研究显示,TSNAs在新鲜烟叶中很少产生或几乎不产生,可以在吸烟过程中直接产生,或经过二、三手烟产生。在吸烟后的最初6 h内,二手烟空气中的NNK浓度每小时增加50%—200%;对于三手烟,TSNAs可能通过尼古丁与臭氧、亚硝酸等大气氧化剂发生反应而产生。癌症风险评估表明,三手烟如:房间降尘等,是没有直接接触二手烟的儿童和非吸烟者接触TSNAs的主要途径[16]。这表明TSNAs有可能通过大气、房间降尘进入土壤环境,这值得进一步关注。
由于亚硝胺较高的水溶性,土壤对亚硝胺的保留作用通常较弱[17]。亚硝胺随污、废水等进入地表河流后,可以随着地表水和地下水的交换作用进入地下水中[18]。土壤作为承接地表水中污染物的载体,同时也是地表水中污染物进入地下水的主要通道,亚硝胺在土壤介质中的环境行为值得关注。另外,土壤可以为亚硝胺的生物降解提供大量的微生物。目前已有研究证实土壤中亚硝胺主要通过微生物降解来降低其含量,因此亚硝胺在土壤介质中的降解可能是影响亚硝胺下渗过程的主要影响因素之一[19]。
监测土壤中亚硝胺的含量、研究亚硝胺的土壤降解有助于进一步了解亚硝胺的环境行为,为亚硝胺污染的治理和修复提供科学依据。但是由于土壤环境的复杂性,以及亚硝胺及其降解产物的难识别等原因,亚硝胺在土壤环境下的降解途径及其降解机理仍需深入研究。同时,土壤中亚硝胺的分析测试方法作为降解研究的基础,仍然不够完善,需进一步优化。本文对土壤中亚硝胺的分析测试方法进行综述,总结目前分析测试的难点及发展方向,阐述目前土壤中亚硝胺的降解机理,进一步探索土壤中亚硝胺降解的路径。最后对未来的研究趋势进行展望。
-
因为大多数的亚硝胺辛醇-水分配系数较低,一般认为亚硝胺主要存在于水体介质中。现有文献研究对亚硝胺的分析测试方法也主要集中于各类水体,基于美国环保署(USEPA)发布的521方法[20],也有研究采取测试水相中的亚硝胺含量,利用土壤、沉积物吸附系数推测土壤吸附相的含量[17, 21]。直接针对土壤及房间降尘中亚硝胺的分析测试方法相对较少。为了进一步推进土壤中亚硝胺的降解研究,迫切需要建立一种高效、准确、简便的分析测试方法。鉴于某些食品(如腌鱼、腌肉、火腿等)均可检测出较高浓度的亚硝胺,且均为固体,在性质上与土壤存在一定相似性,因此可在一定程度上进行参考。分析测试流程主要由两个环节组成:前处理方法及上机分析测试。
-
由于亚硝胺在环境中的含量很低,且容易受到其他杂质干扰。因此,需要进行一定的前处理:首先使土壤或食物中的亚硝胺转移到液相,再进行浓缩富集,之后净化杂质,最终使其能够在仪器中检出。目前应用于亚硝胺的前处理方法主要包括:有机溶液直接提取、固相萃取、固相微萃取、超临界流体萃取等,前处理方法对比见表1。
有机溶液直接提取法,其特点是操作简单,对于仪器和操作的要求较低。传统提取方法需要使用大量的有机溶剂(主要是二氯甲烷(DCM),中等毒性),容易造成污染以及危害健康,且耗时较长,不易自动操作。因此大多进行一定的优化从而减少DCM的用量或选择其他提取溶剂。Herrmann等[22]采用乙腈来提取腌制肉类中的亚硝胺:取2.5 g肉,加入7.5 mL含0.1%(V/V)甲酸的乙腈,离心15 min取上清液。通过冷冻沉淀出不溶物。解冻后,氮吹至0.25 mL,过滤保存。该方法回收率为50%—120%。Venkatesan等[23]采用超声辅助提取污水厂污泥中的亚硝胺:取6 g湿重污泥,加12 mL乙腈,放置于摇床上200 r·min−1 2 h,之后超声1 h,氮吹至接近干燥,用2 mL乙腈复溶,过滤保存。绝对回收率为32%—68%。Gushgari等[24]对该方法进行了改进,采用DCM提取,氮吹后使用甲醇复溶,回收率提高到54%—108%。Sleiman等[25]采用甲醇提取二手烟中的TSNAs:样品收集后加入5 mL含160 ng喹啉的甲醇,10000 r·min−1离心取上清液。该方法回收率为85%—115%。Ramírez等[26]采用加压液体萃取(PLE)室内灰尘中亚硝胺。采用ASE 200萃取系统,将0.5 g灰尘与1 g二氧化硅混合,使用乙酸乙酯在100 ℃、1500 psi条件下进行萃取,重复3次。过滤后氮吹至0.5 mL。上述方法的优点是只使用基本的分析设备,步骤少,但在提取效率方面有一定不足。
固相萃取(SPE)法,是目前比较成熟、应用较广的对微量或痕量目标物进行提取分离及富集的方法,具有溶剂用量少、浓缩倍数高、萃取时间短等优点。常用于亚硝胺富集的吸附材料为活性炭,包括:椰壳活性炭、Ambersorb 572、Ambersorb 572+LiChrolut EN等[27]。Jurado等[13]对比了3种提取方法,选择最适于提取活性污泥、土壤、池塘沉积物中的亚硝胺的方法。通过对比,微波提取与连续固相萃取相结合的方法效果最好。方法流程如下:微波辅助提取法(MAE):取2 g土壤,加入6 mL甲醇,微波处理3 min,再将提取液氮吹至0.1 mL,加入5 mL 0.1 mol·L−1的NaHCO3溶液,提取液通过使用LiChrolut EN作为吸附剂的SPE装置,之后用150 μL(乙腈-乙酸乙酯(V/V,1:9))洗脱液对吸附柱进行洗脱,保存。该方法回收率可达到94%—96%。夏日耀等[28]用碱液处理萃取-C18SPE小柱富集的方法提取腌制鱼干中的亚硝胺:取200 g样品,加30 g Ba(OH)2·8H2O、200 mL水,混匀后置于90 ℃烘箱1.5 h;之后以10000 r·min−1离心10 min,取上清后加入DCM重复萃取离心2次,再次离心,使用C18 SPE柱进行富集,过滤后保存。回收率为76.8%—129.5%。固相萃取法消耗的有机溶剂量少,提取效率高;缺点是操作较复杂、解吸时间长。
固相微萃取(SPME),其原理是样品中的分析物可以直接被熔融石英纤维萃取头上的涂层材料所吸附,从而将分析物从基质中萃取并富集,之后可以直接解吸上机测试。该方法无需有机溶剂、操作简单、能够实现萃取与富集浓缩同时进行。随着SPME的发展,以及色谱技术和质谱技术的普及,SPME在亚硝胺的测定中得到越来越多的应用。Llop等[29]采用加压热水萃取(PHWE)-顶空固相微萃取(HS-SPME)对污泥中9种亚硝胺进行提取,先在Dionex ASE 200仪器上进行PHWE,温度125 ℃,压力1500 psi,萃取5 min,2个循环。取上清液,倒入含3.6 g氯化钠的顶空小瓶进行HS-SPME:在温度到达45 ℃时稳定1 min之后引入萃取纤维,保持60 min,以750 r·min−1进行磁力搅拌,随后将纤维立即插入GC进样口进行解吸。Sun等[30]利用HS-SPME法,提取并富集红肉中的9种挥发性亚硝胺:取2 g肉酱,加入10 mL饱和盐水,以400 r·min−1搅拌,萃取头顶空放置,在50 ℃下萃取30 min。回收率在91.33%—95.43%之间。目前来看萃取涂层价格相对昂贵,且对亚硝胺的选择性不高。如果在将来,更高效的新型萃取涂层得到应用,那么该技术就能够实现对土壤及食品中的亚硝胺进行简便、快速的分析处理。
-
样品在经过一系列前处理过后,可以进行上机分析测试以确定其含量,测试方法及相关参数见表2。目前,土壤中的亚硝胺与水体中的亚硝胺的测试方法类似,最常用的方法是气相色谱法(GC)和液相色谱法(LC),它们具有分离能力强、技术成熟、可与多种检测器联用等优点。与其他的检测器相比,质谱检测器(MS)具有更高的灵敏度和更好的选择性,测试结果可靠,越来越多地应用于亚硝胺这一类痕量污染物的分析测试中。目前常用的方法包括:气相色谱-质谱法及串联质谱法(GC-MS、GC-MS/MS)、液相色谱-质谱法及串联质谱法(LC-MS、LC-MS/MS)等。
-
Jurado等[13]采用GC-MS进行上机分析,柱型号为DB-5 MS,载气为氦气,流速1 mL·min−1。色谱柱初始温度为50 ℃,具体程序见表2。采用分流式进样,进样量为1 μL,溶剂延迟时间为4 min,进样口温度250 ℃。MS条件为:离子源温度200 ℃,传输线温度220 ℃,电子碰撞电离能70 eV。采用选择离子扫描(SIM),检测限为0.03—0.35 ng·g−1。Yang等[19]同样采用GC-MS分析土壤中的NDMA,进样量1 μL,柱型号为DB-1701。采用脉冲不分流进样,进样口温度210 ℃,压力0.17 MPa,不分流时间为0.4 min。NDMA和NDMA-d6的保留时间分别为4.49 min和4.47 min。采用电子电离源(EI),SIM,离子源温度和四极杆温度为230 ℃和150 ℃。NDMA、NDMA-d6定量离子m/z为74和80。检出限为0.2 ng·g−1。Ramírez等[26]采用气相色谱-氮气化学发光检测器(GC×GC-NCD)对室内降尘进行分析。色谱柱升温程序见表2。采用脉冲不分流进样,进样量1 μL,温度210 ℃,压力30 psi。以50 Hz的频率从NCD收集数据。方法检出限为2.5—15.8 ng·g−1。
相较于单极质谱而言,三重四极杆串联质谱(QqQ-MS/MS)具有更高准确度和灵敏度,能够大大降低背景噪音,当前已广泛应用于亚硝胺的检测。杨光等[31]采用气相色谱-电子轰击电离-串联质谱法(GC-EI-MS/MS),对香肠中的13种亚硝胺进行测定,采用多反应监测模式(MRM)分析,内标法定量。定量限为0.03—2.84 ng·g−1。Llop等[29]采用气相色谱-化学电离串联质谱光谱法(GC-CI-MS-MS)对污泥中9种亚硝胺进行测定。采用碰撞诱导解离(CID),NDMA、NMEA、NDEA、NDPA、NDBA、NPYR、NPIP、NDPhA的定量离子m/z分别为47、61、75、89、57、55、69、92。Sleiman等[25]采用气相色谱-离子阱-串联质谱法(GC-IT-MS /MS)测定二手烟中的TSNAs。MS条件如下:采用EI源,电离能为70 eV,采用全扫描模式(full scanning),质荷比范围为50—350,每0.82 s扫描一次。电子倍增器电压+200 V,捕集阱和传输线的温度为200 ℃。NNK、NNN、NNA、NNAL的定量离子分别为m/z146、145、120、106;碰撞能为0.4、0.4、0.6、0.5 V。上述方法均可实现对土壤和烟气降尘的快速、精确检测。总的来说,GC方法应用范围较广、技术成熟,适合对较复杂基质进行检测。但是具有无法直接测定热不稳定性亚硝胺(如NDPhA)的缺陷。
-
除气相色谱(GC)、液相色谱(LC)外,高效液相色谱(HPLC)、超高效液相色谱(UPLC)能够更高效地使目标物得到分离,也逐渐应用于亚硝胺的测定。张伟伟等[32]采用高效液相色谱-大气压化学正电离-串联质谱法(UPLC-APCI+-MS/MS),测定食品中的NDMA,流动相为甲醇和含0.6%(V/V)甲酸的水溶液,进样量5 μL。质谱端采用多反应监测模式(MRM), NDMA的定量离子m/z 43.1,保留时间为1.37 min,检出限为0.5 μg·L−1。Venkatesan等[23]采用液相色谱-电喷雾电离-串联质谱法(LC-ESI-MS/MS)对污水厂活性污泥以及附近的淡水沉积物中的8种亚硝胺进行了测定。流动相为含0.01 mol·L−1醋酸铵和0.01%(V/V)醋酸的水溶液和甲醇。质谱端采用(MRM)模式,NDMA、NMEA、NDEA、NDPA、NDBA、NPYR、NPIP、NDPhA的定量离子m/z分别为75、89、103、131、159、101、115、199。方法检测限为0.06—5.7 ng·g−1。
相比GC法,LC法可以直接测定一些大分子、热不稳定性的亚硝胺,但由于土壤成分复杂,存在各种杂质;在精度不佳的情况下更有可能出现假阳性的结果。因此,应尽量降低样品基质的干扰从而提高LC检测的准确性。可行的方法包括改善样品的前处理方法,改善色谱条件(采用梯度洗脱、在流动相加入添加剂等),使用同位素内标等。
综上所述,目前土壤中亚硝胺检测的前处理方法仍不够完善,如何高效且环保地提取并富集亚硝胺仍然是研究的重点。在未来,前处理方法的发展方向是使用低溶剂甚至无溶剂的萃取技术,实现萃取的自动化;进一步提高富集倍数,获得最大的回收率和良好的选择性和重现性。亚硝胺的上机测试方法可随前处理方法进行一定的调整,从而选择更为高效且经济的方法;其中,液相/气相色谱串联质谱法相对其他检测方法而言具有更高的准确性和灵敏度,是当前应用较多的方法。对于目前新发现的亚硝胺(如TSNAs)这一类大分子、不易挥发的亚硝胺,采用GC法可能会造成一定的偏差,LC法具有更好的应用效果。目前这些方法仍存在效率不高、基质干扰、分析仪器昂贵以及精密度和准确度有限等不足。未来可以从对色谱的参数进行优化以及研发、应用更高精度的检测器等方面入手,从而实现分析测试方法的快速、准确、低成本化。
-
目前亚硝胺类物质的降解方法可分为物理、化学、生物等类型,包括活性炭吸附、反渗透法、光降解法、高级氧化法、金属催化法和微生物处理法等。其中光降解是亚硝胺在自然环境中降解的重要途径之一[33]。亚硝胺在紫外光及可见光条件下均可发生降解,紫外光降解法是目前常用的有效去除污水和饮用水中NDMA的方法,降解产物主要为二级胺和亚硝酸盐[34-35],缺点是处理价格昂贵。与之相比,生物降解经济环保,具有良好的发展前景。对于土壤环境而言,土壤大致可分3层。最上层是表土层,第二层是心土层,第三层是底土层。表土层厚度一般为20 cm左右,生物积累作用较强,含有较多的腐殖质,肥力较高,可以为植物提供有利的生长环境,这层土壤里植物根系最密集。心土层位于表土层与底土层之间,通常是指表土层以下至50 cm左右深度的土层。心土层的结构一般较差,养分含量较低,植物根系少。底土层几乎未受人类耕作影响,植物根系极少。亚硝胺进入土壤后,推测首先会在表土层进行有氧降解,之后可能会在厌氧条件进行一定程度的降解,也可能随水流渗入地下水。亚硝胺在土壤环境中会发生一系列降解反应,主要包括生物降解和非生物降解。根据目前的研究来看,土壤中亚硝胺主要通过微生物降解来降低其含量,根据含氧量的不同,生物降解又可分为好氧微生物降解和厌氧微生物降解。生物降解可能是微生物的共代谢作用,因为到目前为止还没有鉴定出能够将亚硝胺作为唯一碳源或氮源的微生物[36],土壤大多起到提供微生物以及微生物降解所需的营养物质的作用。
-
非生物降解主要是指吸附、挥发、稀释等物理过程。目前已有的土壤降解研究主要集中于典型的亚硝胺类物质——NDMA,因为它是目前在饮用水和废水中检测到的最普遍的亚硝胺[37]。NDMA为半挥发性物质,在土壤环境、尤其是土壤与空气的界面处容易挥发,但目前尚未明确其挥发到大气的比例。目前已对土壤的吸附作用进行了研究,Gunnison等[17]对土壤中的NDMA进行连续解吸试验,在进行1次循环后,几乎所有吸附物质都被解吸,土壤的吸附能力不显著,吸附几乎是完全可逆的;Gan等[38]对草坪植物根系的吸收作用进行了研究,结果显示,吸收相当有限,去除微乎其微。综上所述,现有研究显示,亚硝胺在非生物条件下的降解十分有限。
-
生物降解是亚硝胺在土壤环境中降解的主要途径,起降解作用的主要是微生物,通过共代谢作用将环境中的亚硝胺转化为CO2和H2O或其他物质。研究表明,NDMA的好氧降解速率变化很大,半衰期从5 d到150 d不等[1, 4, 17, 33, 39]。Bradley等[21]收集了受污染的表层土壤来分析降解情况。结果表明,在有氧条件下经过132 d后未检出NDMA,而在无菌条件及无土条件下,均未显著损失,这证明降解来自于微生物活动。Gan等[38]的研究显示,NDMA在地被植物土壤以及草坪土壤的降解半衰期为4—6 d。Yang等[19]选取3种不同植被类型的土壤进行研究,NDMA半衰期分别为(5.6±0.4)d、(22.5±1.2)d、(4.1±0.3)d。Patterson等[4]利用经曝气处理的好氧底泥进行研究,结果发现,好氧降解速率远比厌氧快,半衰期为(8±2)d。目前已有研究尝试将好氧生物降解与其他水处理技术相结合,取得了良好的效果,Webster等[40]将红球菌ENV425接种在流化床反应器(FBR)对地下水中的NDMA进行降解,该反应器利用膜系统供应H2,以维持反应器内生物膜的生长,浓度由12 µg·L−1降低至100 ng·L−1(降解率为99.2%).
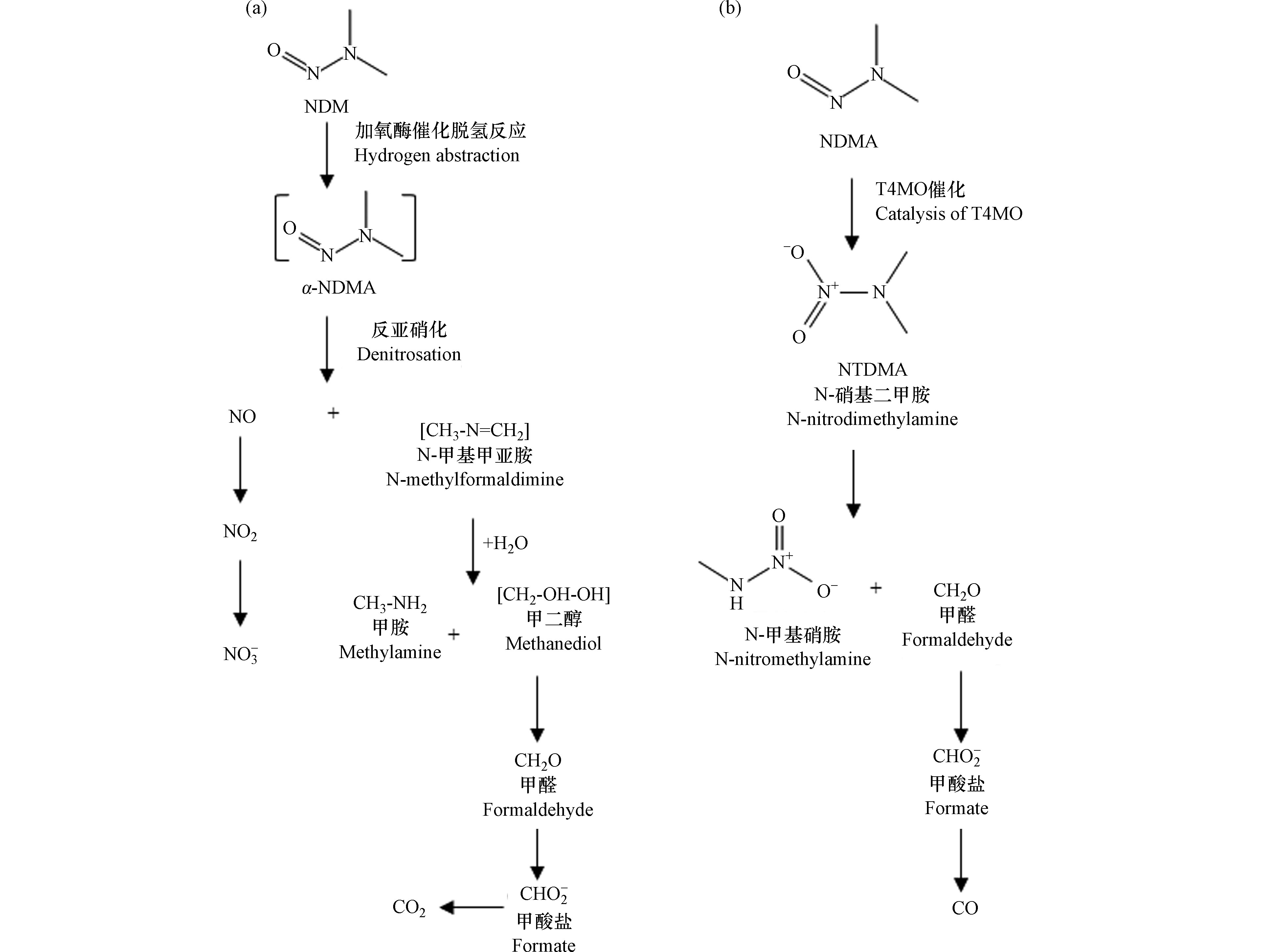
好氧环境中亚硝胺的生物降解作用机制和降解产物的研究还在起步阶段,如何对降解产物进行准确测定以及对降解速率进行量化是进一步推进降解研究的关键。目前的研究表明,NDMA的好氧微生物降解主要依赖于加氧酶的共代谢过程[1, 41-42],尤其是单加氧酶。Sharp等[42-43]进行的纯培养研究发现,在添加诱导酶和生长基质的情况下,NDMA能被5种菌株:甲基弯菌OB3b(Methylosinus trichosporium OB3b)、真空分枝杆菌JOB-5(Mycobacterium vaccae JOB-5)、假单胞菌KR1(Pseudomonas mendocina KR1)、短黄杆菌PKO1(Ralstonia pickettii PKO1)、红球菌RR1(Rhodococcus sp. RR1)所降解。这些菌株可以在诱导酶和适当的生长基质中产生不同的单加氧酶,对于菌株JOB-5、RHA1、RR1,为丙烷单加氧酶(PrMO)。而对于OB3b,为可溶性甲烷单加氧酶(sMMO)。对于PK01及KR1,则是甲苯-4-单加氧酶(T4MO)。目前的降解机理研究主要通过测定降解产物来推测,可以通过利用加入含有同位素标记的目标物(如14C-NDMA),之后对其降解产生的相对应的14C标记产物以及剩余的14C-NDMA进行放射性物质分布的质量平衡,来分析可能的降解类型、产物及机理[4, 17, 21, 44]。已在对红球菌ENV425和假单胞菌KR1的研究中得到不同的降解产物及降解机理[45]。Fournier等[44]人的研究证实,以丙烷为唯一碳源的草坪土壤中的红球菌ENV425在培养后可以迅速降解NDMA,可从mg·L−1降低到ng·L−1浓度级别,降解路径见图2a。
ENV425降解的特定产物可能是甲胺(MA)、一氧化氮、亚硝酸盐、硝酸盐和甲酸盐,以及少量的甲醛和二甲胺。脱氮途径推测为:首先NDMA的两个甲基中的一个氢原子被提取,生成α-羟基烷基亚硝胺;然后失去NO,形成不稳定的N-甲基甲亚胺;随后水解,生成甲胺和甲醛,后者氧化成甲酸盐,再氧化成CO2;NO氧化成
${\rm{NO}}_2^{-} $ 和${\rm{NO}}_3^{-} $ 。对于假单胞菌KR1,降解NDMA具有两种途径[46],途径1(降解路径见图2b),为:KR1生成的T4MO酶先将NDMA初始氧化为N-硝基二甲胺(NTDMA),再代谢为N-硝基甲胺(NTMA)或者通过去甲基化产生甲醛,甲醛进一步氧化可能产生甲酸盐。途径2为:去甲基化(α-羟基化)降解,产生甲醇作为代谢产物。基于该途径中产生的许多其他中间产物是不稳定的,且不易检测,降解所占比例不到10%,所以该途径为次要途径。 -
关于亚硝胺严格厌氧降解的报道较少,因为严格厌氧条件下的降解较为困难。在厌氧条件下,NDMA和NMOR的半衰期可以达到100 d以上。Zhou等[33]通过连续监测地下水中NDMA的含量,研究原位生物降解。通过与实验室数据对比,推测该地区的降解环境主要为厌氧,半衰期在70 d左右。降解符合一级动力学[4, 33]。Patterson等[47]选取澳大利亚地下120—220 m的承压含水层中的厌氧沉积物进行厌氧土柱实验,NDMA和NMOR不能迅速降解,降解半衰期至少为100 d。另一项[4]用14C-NDMA进行的小型生物降解的研究的结果发现,厌氧条件下的生物降解远远比在好氧条件下慢,半衰期为29—46 d。Szecsody等[48]研究发现,在厌氧沉积物中,一种未知的微生物酶对NDMA进行降解,平均半衰期为145 d。Pitoi等[49]利用沉积物进行的土柱研究表明,NMOR可以在厌氧条件下被生物降解,半衰期为100 d。
基于亚硝胺在不同环境条件下微生物群落的不同以及较低的浓度,厌氧降解相比好氧降解更为困难且缓慢,这对研究厌氧条件下的降解机理造成了一定困难。Rowland等[50]认为NDMA在厌氧条件下的生物降解为反硝化途径,即转化为中间体二甲胺(DMA)和亚硝酸盐。Bradley等[21]的研究表明,在厌氧土壤环境中,检测到的主要降解产物是二氧化碳和甲烷,且产生了高达41%的甲烷,这表明降解途径为微生物去甲基化或产甲烷降解。Tezel等[51]认为,NDMA作为电子受体,可以在产甲烷条件下进行生物还原,可能涉及通过亚硝基还原形成中间体偏二甲基肼(UDMH),之后降解为二甲胺,进一步降解为氨和甲烷。Padhye等[52]对美国3个污水厂的污泥中亚硝胺进行分析,并评估它们在厌氧消化系统中的生物降解情况。结果显示,样品中只检测到了NDMA和NPYR,在厌氧条件下的NDMA生物转化途径可能为亚硝基的还原和N—N裂解;H2以及脂肪酸、醇类等复杂有机物的发酵产物作为降解的电子供体。
-
亚硝胺的生物降解主要受3类因素影响,包括微生物的影响、亚硝胺的结构影响和环境因子的影响。
微生物的影响:即微生物的种类、活性、数量等直接影响亚硝胺降解与转化的因素。其中,微生物的活性在亚硝胺的生物降解过程中起着至关重要的作用。Bradley等[21]认为NDMA在好氧条件下的降解程度归因于土壤微生物的活性,如假单胞菌。不同的微生物种类对不同结构的亚硝胺的降解能力存在着很大的差别,目前各地区观察到亚硝胺生物降解的半衰期差异巨大,这可能也归因于各地点的微生物种类、数目的不同。Yang等[19]的研究支持了这一观点,它们对不同土壤植被类型的降解速率进行评估,结果表明,NDMA在种植有草坪和地被植物土壤中的降解速率要快于裸露土壤,推测植物会增加土壤中土壤有机质的质量,从而影响微生物的种类与活性。
亚硝胺结构影响:亚硝胺的分子量、空间结构、取代基的种类及数量等都影响到微生物对其降解的难易程度。一般情况下,高分子化合物以及结构复杂的化合物较难降解。Wang等[53]研究了细菌LT1C对亚硝胺的降解作用,5种亚硝胺的降解率如下:NMEA(51.6%)>NDPA(40.0%)>NDBA(37.1%)>NPYR(24.9%)>NPIP(23.6%)。Wijekoon等[39]设计了好氧膜生物反应器(AMBR)来降解亚硝胺,研究显示,各类亚硝胺的去除率分别为:NDMA(94%)>NDEA(88%)>NMEA(87%)>NDBA(76%)>NPIP(65%)>NPYR(58%)>NDPA(51%)>NMOR(24%)。去除率:链状结构亚硝胺>脂环族结构>吗琳。这些研究结果表明,亚硝胺的降解率取决于官能团的给电子能力,且与相对分子质量呈反比。
环境因子的影响:主要包括温度、营养物质、底物浓度等因素。温度的影响主要表现在微生物代谢过程中,低温会导致微生物的活性降低,从而使酶的活性降低,影响生物降解效果。Yang等[19]的研究结果显示,在10 ℃土壤中NDMA的降解速率比在室温下要慢,温度恢复,降解率明显提升。营养物质对于微生物生长和种群维持都是重要的限制因子。由于微生物主要以共代谢的方式降解亚硝胺,这一过程产生的能量不足以维持微生物生存生长,所以需要其它的碳源和能源物质维持微生物正常生理活动。Gunnison等[17]认为,基于NDMA环境浓度非常低,土壤中应包含必要的营养物质,以支持微生物降解。另外,为了使亚硝胺达到完全降解,通常需要添加额外的营养物。Sharp[41-43]和Fournier等[44]研究发现,可以对NDMA进行快速生物降解的3种菌株均需要丙酮酸、大豆肉汤、培养基、丙烷等物质提供碳源和营养来源。亚硝胺生物降解为酶促反应降解,而底物浓度会影响酶促反应的反应速率。Gunnison等[17]对NDMA的初始浓度从50 μg·L−1到50 mg·L−1的降解程度进行了比较,结果发现降解率在这一区间下降了近3倍。在较高浓度下,降解受到了抑制,推测是缺乏足够的营养物质,或超出了现有微生物的降解能力。Patterson等[4]的研究同样观察到了高浓度的抑制作用,在μg·L−1浓度下,生物降解半衰期比在ng·L−1要长1个数量级。
-
对于亚硝胺这一类具有高毒性和强致癌性的有机污染物,目前的研究主要关注于水体中的亚硝胺,对土壤介质中的亚硝胺的研究相对较少。基于目前的研究情况,为了进一步推进对土壤中亚硝胺的含量及降解机理的研究,加深对亚硝胺类污染物环境行为的了解,未来的研究重点应着重以下几个方面:(1)对目前已有的分析测试方法的参数进行优化并进一步评价其性能,从而形成一套准确、高效、简便的分析测试方法体系,为土壤降解研究提供关键支持。(2)目前的检测方法和降解机理研究主要针对一种或几种已知的典型的亚硝胺,如NDMA、NMOR等,而NDMA只占总亚甲硝胺的5%左右[54],不能代表总亚硝胺含量,当前存在大量未知的亚硝胺,因此缺乏对于土壤中亚硝胺全面且具体的研究分析。如何对土壤中的总亚硝胺进行鉴定并分析其浓度,是未来研究的重点发展方向。(3)目前尚未有关于TSNAs在土壤介质中的研究,尚不明确其能否通过大气沉降等途径进入到土壤环境。我国是烟草大国,且TSNAs具有强致癌性,未来应着重关注这一类物质的环境效应。(4)基于目前已有土壤降解研究中降解产物的不同,以及降解半衰期存在较大差距的现象,推测亚硝胺土壤降解存在点位特异性。这可能归因于不同地区的降解条件(降解微生物、含氧量、pH等)的差异。因此下一步的研究可以重点针对亚硝胺的典型污染地区的土壤降解生物降解作用进行分析,为该地区亚硝胺污染的治理和修复提供科学依据,从而减少亚硝胺对人体的危害,保护公众安全健康。
土壤中N-亚硝胺的预富集、分析测试方法及降解机理
The preconcentration, detection methods and degradation mechanisms of N-nitrosamine in soil: A review
-
摘要: N-亚硝胺(N-nitrosamines)是一类对人类具有高毒性和强致癌性的有机污染物,具有强亲水性,因此易随着水流穿透土壤迁移到地下环境。土壤作为地下水和地表水发生交换作用的重要通道,对亚硝胺的归趋具有重要意义。本文通过对目前已有的土壤中亚硝胺的分析测试方法及降解机理进行综述,研究在该介质中亚硝胺的分析测试难点及解决方法,探索土壤中亚硝胺降解的路径,并对下一步的研究方向进行展望。通过对分析测试方法的总结,为测定土壤中的亚硝胺提供参考,为土壤降解研究提供关键支持。现有的土壤亚硝胺降解研究,集中于几种化合物,缺乏全面的研究分析。已在室内降尘中检测出烟草特有亚硝胺,但目前尚不明确其能否通过大气沉降等途径进入到土壤环境。Abstract: N-nitrosamines are a kind of organic pollutants with high toxicity and strong carcinogenicity to human beings. Furthermore, these compounds are easily migrate to underground environment through the soil due to the water flow. As an important channel of exchange between groundwater and surface water, soil environment is of great significance to the fate of N-nitrosamines in water. Therefore, this paper summarized the existing analysis methods of N-nitrosamines. We studied the difficulties and the corresponding solution methods during the analysis of N-nitrosamines in soil. The degradation mechanisms such as the degradation pathway of these compounds in soil were explored. In the end, future research was prospected. By summarizing the analysis methods, this paper provided references for the determination of N-nitrosamines in soil. The summarization of degradation pathway of N-nitrosamines in soil was important for giving supporting information. However, the existing studies on soil degradation were focused only on a few compounds and lack of comprehensive research. Tobacco-specific nitrosamines have been studied in special environment, such as settled house dust. However, it was not clear whether these N-nitrosamines would enter the soil environment through atmospheric deposition or not.
-
Key words:
- N-nitrosamines /
- soil /
- analysis methods /
- biodegradation
-

-
表 1 土壤、食品及室内降尘中亚硝胺前处理方法对比
Table 1. Comparison of pretreatment methods for nitrosamines in soil, food and room dust
前处理方法
Pretreatment method回收率/%
Recovery操作时间 /min
Operation
time分析对象
Analysis
object样品量/g
Sample
weight提取溶剂
Extraction
solvent溶剂用量/mL
Solvent
weight参考文献
Ref.加压液体萃取(PLE) 大多数>80 10 室内降尘 0.5 乙酸乙酯 33 [26] 有机溶液直接提取 85—115 20 二手烟颗粒 称重 甲醇 5 [25] 有机溶液直接提取 32—68、54—108 60 污水厂污泥、沉积物 6 乙腈、二氯甲烷 12 [23-24] 微波辅助提取-固相萃取 77—130 3 污泥、土壤、沉积物 6 甲醇 6 [13] 加压热水萃取-顶空固相微萃取 — 22 污泥 5 Milli-Q水 44 [29] 有机溶液直接提取 — 240 土壤 50 二氯甲烷 5 [19] 有机溶液直接提取 50—120 30 腌制肉类 2.5 乙腈 7.5 [22] 碱液处理萃取-C18 SPE小柱富集 77—130 90 腌制鱼干 200 二氯甲烷 100 [28] 表 2 土壤及室内降尘中亚硝胺上机测试方法对比
Table 2. Comparison of chromatography analytical methods for nitrosamines in soil and room dust
分析仪器
Detector色谱柱
Chromatographic
column目标亚硝胺
Target Nitrosamine流速/(mL·min−1)
Flow rate升温程序/梯度洗脱程序
Temperature program/Solvent
gradient program检出限/(ng·g−1)
Method detection
limitRSD/% 参考文献
Ref.GC×GC-NCD SGE BPX5、SGE BPX50 9种挥发性亚硝胺和5种TSNAs 1 一维色谱柱初始为55 ℃ 1 min,以
5 ℃·min−1至255 ℃保持1 min;二维柱70 ℃ 1 min,以5 ℃·min−1至
270 ℃保持1 min。2.5—15.8 <8 [26] GC-IT-MS/MS VF-5 ms NNN、NNA、NNK、NNAL 0.8 初始60 ℃ 2 min,以15 ℃·min−1至210 ℃ 保持6 min,以30 ℃·min−1至300 ℃保持4 min。 0.07—0.34 <10 [25] LC-ESI-MS/MS XBridge BEH C8 7种脂肪族和脂环族亚硝胺 0.4 0—2 min B为50%;2—11 min升至90%保持3 min;11—11.1 min返回至50%;平衡2 min。 0.06—5.7 <20 [23-24] GC-MS DB-5 MS 10种脂肪族和芳香族亚硝胺 1 初始50 ℃ 2 min,以5 ℃·min−1至
100 ℃,以9 ℃·min−1至100 ℃0.03—0.35 <6.5 [13] GC-CI-MS-MS Supelco熔融石英毛细管预柱、ZB-5 9种挥发性亚硝胺 1 初始40 ℃ 2.1 min,以25 ℃·min−1至100 ℃保持4.5 min,以 20 ℃·min−1至280 ℃保持2 min <0.15 <19 [29] GC-MS DB‐1701 NDMA 1 初始45 ℃ 2 min,以50 ℃·min−1至100 ℃ 保持2 min,以50 ℃·min−1至280 ℃保持1.5 min 0.2 — [19] HPLC-MS/MS Waters HSS T3 C18 NDMA 0.4 0—0.4 min A为2%;0.4—2 min升至10%; 2—2.5 min升至95%,保持
1.5 min;4—4.5 min降至2%保持2 min1 <11 [32] -
[1] MITCH W A, SHARP J O, TRUSSELL R R, et al. N-nitrosodimethylamine (NDMA) as a drinking water contaminant: A review [J]. Environmental Engineering Science, 2003, 20(5): 389-404. doi: 10.1089/109287503768335896 [2] SHAH A D, MITCH W A. Halonitroalkanes, halonitriles, haloamides, and N-nitrosamines: A critical review of nitrogenous disinfection byproduct formation pathways [J]. Environmental Science and Technology, 2012, 46(1): 119-131. doi: 10.1021/es203312s [3] GUSHGARI A J, HALDEN R U J C. Critical review of major sources of human exposure to N-nitrosamines [J]. Chemosphere, 2018, 210: 1124-1136. doi: 10.1016/j.chemosphere.2018.07.098 [4] PATTERSON B M, PITOI M M, FURNESS A J, et al. Fate of N-Nitrosodimethylamine in recycled water after recharge into anaerobic aquifer [J]. Water Research, 2012, 46(4): 1260-1272. doi: 10.1016/j.watres.2011.12.032 [5] NRMMC E. AHMC, Australian guidelines for water recycling: Managing health and environmental risks[C]. Canberra: Natural Resource Management Ministerial Council, 2008. [6] HAYES J R, MECKLEY D R, STAVANJA M S, et al. Effect of a flue-curing process that reduces tobacco specific nitrosamines on the tumor promotion in SENCAR mice by cigarette smoke condensate [J]. Food and Chemical Toxicology, 2007, 45(3): 419-430. doi: 10.1016/j.fct.2006.08.024 [7] PEELE D M, RIDDICK M G, EDWARDS M E, et al. Formation of tobacco-specific nitrosamines in flue-cured tobacco [J]. Recent Advances in Tobacco Science, 2001, 27: 3-12. [8] RAMíREZ N, VALLECILLOS L, LEWIS A C, et al. Comparative study of comprehensive gas chromatography-nitrogen chemiluminescence detection and gas chromatography-ion trap-tandem mass spectrometry for determining nicotine and carcinogen organic nitrogen compounds in thirdhand tobacco smoke [J]. Journal of Chromatography A, 2015, 1426: 191-200. doi: 10.1016/j.chroma.2015.11.035 [9] KONSTANTINOU E, FOTOPOULOU F, DROSOS A, et al. Tobacco-specific nitrosamines: A literature review [J]. Food and Chemical Toxicology, 2018, 118: 198-203. doi: 10.1016/j.fct.2018.05.008 [10] WESTERHOFF P, MASH H. Dissolved organic nitrogen in drinking water supplies: a review [J]. Journal of Water Supply:Research and Technology:AQUA, 2002, 51(8): 415-448. doi: 10.2166/aqua.2002.0038 [11] PLANAS C, PALACIOS Ó, VENTURA F, et al. Analysis of nitrosamines in water by automated SPE and isotope dilution GC/HRMS: Occurrence in the different steps of a drinking water treatment plant, and in chlorinated samples from a reservoir and a sewage treatment plant effluent [J]. Talanta, 2008, 76(4): 906-913. doi: 10.1016/j.talanta.2008.04.060 [12] WANG W, REN S, ZHANG H, et al. Occurrence of nine nitrosamines and secondary amines in source water and drinking water: Potential of secondary amines as nitrosamine precursors [J]. Water Research, 2011, 45(16): 4930-4938. doi: 10.1016/j.watres.2011.06.041 [13] JURADO-SáNCHEZ B, BALLESTEROS E. GALLEGO M. Comparison of microwave assisted, ultrasonic assisted and Soxhlet extractions of N-nitrosamines and aromatic amines in sewage sludge, soils and sediments [J]. Science of the Total Environment, 2013, 463: 293-301. [14] EKICI P, LEUPOLD G. PARLAR H. Degradability of selected azo dye metabolites in activated sludge systems [J]. Chemosphere, 2001, 44(4): 721-728. doi: 10.1016/S0045-6535(00)00345-3 [15] BRAKSTAD O G, SøRENSEN L, ZAHLSEN K, et al. Biotransformation in water and soil of nitrosamines and nitramines potentially generated from amine-based CO2 capture technology [J]. International Journal of Greenhouse Gas Control, 2018, 70: 157-163. doi: 10.1016/j.ijggc.2018.01.021 [16] RAMíREZ N, ÖZEL M Z, LEWIS A C, et al. Exposure to nitrosamines in thirdhand tobacco smoke increases cancer risk in non-smokers [J]. Environment International, 2014, 71: 139-147. doi: 10.1016/j.envint.2014.06.012 [17] GUNNISON D, ZAPPI M E, TEETER C, et al. Attenuation mechanisms of N-nitrosodimethylamine at an operating intercept and treat groundwater remediation system [J]. Journal of Hazardous Materials, 2000, 73(2): 179-197. doi: 10.1016/S0304-3894(99)00175-2 [18] MA F, WAN Y, YUAN G, et al. Occurrence and source of nitrosamines and secondary amines in groundwater and its adjacent Jialu River Basin, China [J]. Environmental Science and Technology, 2012, 46(6): 3236-3243. doi: 10.1021/es204520b [19] YANG W, GAN J, LIU W, et al. Degradation of N-nitrosodimethylamine (NDMA) in landscape soils [J]. Journal of Environmental Quality, 2005, 34(1): 336-341. doi: 10.2134/jeq2005.0336 [20] MCDONALD J A, HARDEN N B, NGHIEM L D, et al. Analysis of N-nitrosamines in water by isotope dilution gas chromatography–electron ionisation tandem mass spectrometry [J]. Talanta, 2012, 99: 146-154. doi: 10.1016/j.talanta.2012.05.032 [21] BRADLEY P M, CARR S A, BAIRD R B, et al. Biodegradation of N-nitrosodimethylamine in soil from a water reclamation facility [J]. Bioremediation Journal, 2005, 9(2): 115-120. doi: 10.1080/10889860500276607 [22] HERRMANN S S, DUEDAHL-OLESEN L. GRANBY K. Simultaneous determination of volatile and non-volatile nitrosamines in processed meat products by liquid chromatography tandem mass spectrometry using atmospheric pressure chemical ionisation and electrospray ionisation [J]. Journal of Chromatography A, 2014, 1330: 20-29. doi: 10.1016/j.chroma.2014.01.009 [23] VENKATESAN A K, PYCKE B F. HALDEN R U. Detection and occurrence of N-nitrosamines in archived biosolids from the targeted national sewage sludge survey of the US Environmental Protection Agency [J]. Environmental Science and Technology, 2014, 48(9): 5085-5092. doi: 10.1021/es5001352 [24] GUSHGARI A J, HALDEN R U. VENKATESAN A K. Occurrence of N-nitrosamines in US freshwater sediments near wastewater treatment plants [J]. Journal of Hazardous Materials, 2017, 323: 109-115. doi: 10.1016/j.jhazmat.2016.03.091 [25] SLEIMAN M, MADDALENA R L, GUNDEL L A, et al. Rapid and sensitive gas chromatography–ion-trap tandem mass spectrometry method for the determination of tobacco-specific N-nitrosamines in secondhand smoke [J]. Journal of Chromatography A, 2009, 1216(45): 7899-7905. doi: 10.1016/j.chroma.2009.09.020 [26] RAMíREZ N, ÖZEL M Z, LEWIS A C, et al. Determination of nicotine and N-nitrosamines in house dust by pressurized liquid extraction and comprehensive gas chromatography—Nitrogen chemiluminiscence detection [J]. Journal of Chromatography A, 2012, 1219: 180-187. doi: 10.1016/j.chroma.2011.11.017 [27] 李婷, 鲜啟鸣, 孙成, 等. 水中N-亚硝胺类消毒副产物的污染现状及分析技术 [J]. 环境化学, 2012, 31(11): 1767-1774. LI T, XIAN Q M, SUN C, et al. The level and analysis of N-nitrosamines in waters [J]. Environmental Chemistry, 2012, 31(11): 1767-1774(in Chinese).
[28] 夏日耀, 梁棋, 杜莲朵, 等. GC-FID法同时测定腌制鱼干中9种N-亚硝胺类化合物 [J]. 食品工业科技, 2020, 41(10): 213-218,223. XIA R Y, LIANG Q, DU L D, et al. Simultaneous Determination of Nine N-nitrosamine in Pickling Dried Fish by GC-FID [J]. Science and Technology of Food Industry, 2020, 41(10): 213-218,223(in Chinese).
[29] LLOP A, BORRULL F, POCURULL E. Pressurised hot water extraction followed by headspace solid-phase microextraction and gas chromatography–tandem mass spectrometry for the determination of N-nitrosamines in sewage sludge [J]. Talanta, 2012, 88: 284-289. doi: 10.1016/j.talanta.2011.10.042 [30] SUN C, WANG R, WANG T, et al. Primary evaluation of nine volatile N-nitrosamines in raw red meat from Tianjin, China, by HS-SPME-GC–MS [J]. Food Chemistry, 2020, 310: 125945. doi: 10.1016/j.foodchem.2019.125945 [31] 杨光, 李博. 李岳桦. QuEChERS-气相色谱-串联质谱法测定香肠和火腿肠制品中 13 种 N-亚硝胺化合物 [J]. 食品安全质量检测学报, 2019, 10(24): 8436-8443. YANG G, LI B, LI Y H. Determination of 13 kinds of volatile N-nitrosamines in sausage and ham products by gas chromatograpy tandem mass spectrometry [J]. Journal of Food Safety & Quality, 2019, 10(24): 8436-8443(in Chinese).
[32] 张伟伟, 赵春华, 付萌, 等. 水蒸气蒸馏分离-高效液相色谱-串联质谱法测定食品中 N-二甲基亚硝胺的含量 [J]. 理化检验-化学分册, 2019, 55(9): 1028. ZHANG W W, ZHAO C H, FU M, et al. HPLC-MS/MS determination of N-dimethyl nitrosamine in food with separation by steam distillation [J]. Physical Testing and Chemical Analysis(Part B:Chemical Analysis), 2019, 55(9): 1028(in Chinese).
[33] ZHOU Q, MCCRAVEN S, GARCIA J, et al. Field evidence of biodegradation of N-Nitrosodimethylamine (NDMA) in groundwater with incidental and active recycled water recharge [J]. Water Research, 2009, 43(3): 793-805. doi: 10.1016/j.watres.2008.11.011 [34] LEE C, CHOI W. YOON J. UV photolytic mechanism of N-nitrosodimethylamine in water: roles of dissolved oxygen and solution pH [J]. Environmental Science and Technology, 2005, 39(24): 9702-9709. doi: 10.1021/es051235j [35] PLUMLEE M H, REINHARD M. Photochemical attenuation of N-nitrosodimethylamine (NDMA) and other nitrosamines in surface water [J]. Environmental Science and Technology, 2007, 41(17): 6170-6176. doi: 10.1021/es070818l [36] SGROI M, VAGLIASINDI F G, SNYDER S A, et al. N-nitrosodimethylamine (NDMA) and its precursors in water and wastewater: A review on formation and removal [J]. Chemosphere, 2018, 191: 685-703. doi: 10.1016/j.chemosphere.2017.10.089 [37] DAI N, MITCH W A. Relative importance of N-nitrosodimethylamine compared to total N-nitrosamines in drinking waters [J]. Environmental Science and Technology, 2013, 47(8): 3648-3656. doi: 10.1021/es305225b [38] GAN J, BONDARENKO S, ERNST F, et al. Leaching of N-nitrosodimethylamine (NDMA) in turfgrass soils during wastewater irrigation [J]. Journal of Environmental Quality, 2006, 35(1): 277-284. doi: 10.2134/jeq2005.0264 [39] WIJEKOON K C, FUJIOKA T, MCDONALD J A, et al. Removal of N-nitrosamines by an aerobic membrane bioreactor [J]. Bioresource Technology, 2013, 141: 41-45. doi: 10.1016/j.biortech.2013.01.057 [40] WEBSTER T S, CONDEE C. HATZINGER P B. Ex situ treatment of N-nitrosodimethylamine (NDMA) in groundwater using a fluidized bed reactor [J]. Water Research, 2013, 47(2): 811-820. doi: 10.1016/j.watres.2012.11.011 [41] SHARP J O, SALES C M, LEBLANC J C, et al. An inducible propane monooxygenase is responsible for N-nitrosodimethylamine degradation by Rhodococcus sp. strain RHA1 [J]. Applied and Environmental Microbiology, 2007, 73(21): 6930-6938. doi: 10.1128/AEM.01697-07 [42] SHARP J O, WOOD T K. ALVAREZ-COHEN L. Aerobic biodegradation of N-nitrosodimethylamine (NDMA) by axenic bacterial strains [J]. Biotechnol Bioeng, 2005, 89(5): 608-618. doi: 10.1002/bit.20405 [43] SHARP J O, SALES C M. ALVAREZ‐COHEN L. Functional characterization of propane‐enhanced N‐nitrosodimethylamine degradation by two actinomycetales [J]. Biotechnology and Bioengineering, 2010, 107(6): 924-932. doi: 10.1002/bit.22899 [44] FOURNIER D, HAWARI J, HALASZ A, et al. Aerobic biodegradation of N-nitrosodimethylamine by the propanotroph Rhodococcus ruber ENV425 [J]. Applied and Environmental Microbiology, 2009, 75(15): 5088-5093. doi: 10.1128/AEM.00418-09 [45] HOMME C L, SHARP J O. Differential microbial transformation of nitrosamines by an inducible propane monooxygenase [J]. Environmental Science and Technology, 2013, 47(13): 7388-7395. doi: 10.1021/es401129u [46] FOURNIER D, HAWARI J, STREGER S H, et al. Biotransformation of N-nitrosodimethylamine by Pseudomonas mendocina KR1 [J]. Applied and Environmental Microbiology, 2006, 72(10): 6693-6698. doi: 10.1128/AEM.01535-06 [47] PATTERSON B M, SHACKLETON M, FURNESS A J, et al. Fate of nine recycled water trace organic contaminants and metal(loid)s during managed aquifer recharge into a anaerobic aquifer: Column studies [J]. Water Research, 2010, 44(5): 1471-1481. doi: 10.1016/j.watres.2009.10.044 [48] SZECSODY J E, COMFORT S, FREDRICKSON H L, et al., In situ degradation and remediation of energetics TNT, RDX, HMX, and CL-20 and a byproduct NDMA in the sub-surface environment [M]. Biological Remediation of Explosive Residues, Springer International Publishing, 2014: 313-369. [49] PITOI M, PATTERSON B, FURNESS A, et al. Fate of N-nitrosomorpholine in an anaerobic aquifer used for managed aquifer recharge: A column study [J]. Water Research, 2011, 45(8): 2550-2560. doi: 10.1016/j.watres.2011.02.018 [50] ROWLAND I, GRASSO P. Degradation of N-nitrosamines by intestinal bacteria [J]. Applied and Environmental Microbiology, 1975, 29(1): 7-12. doi: 10.1128/am.29.1.7-12.1975 [51] TEZEL U, PADHYE L P, HUANG C-H, et al. Biotransformation of nitrosamines and precursor secondary amines under methanogenic conditions [J]. Environmental Science and Technology, 2011, 45(19): 8290-8297. doi: 10.1021/es2005557 [52] PADHYE L, TEZEL U, MITCH W A, et al. Occurrence and fate of nitrosamines and their precursors in municipal sludge and anaerobic digestion systems [J]. Environmental Science and Technology, 2009, 43(9): 3087-3093. doi: 10.1021/es803067p [53] WANG W, GUO Y, YANG Q, et al. Characterization of the microbial community structure and nitrosamine-reducing isolates in drinking water biofilters [J]. Science of the Total Environment, 2015, 521: 219-225. [54] PIAZZOLI A, BREIDER F, AQUILLON C G, et al. Specific and total N-nitrosamines formation potentials of nitrogenous micropollutants during chloramination [J]. Water Research, 2018, 135: 311-321. doi: 10.1016/j.watres.2018.02.019 -




 下载:
下载: