-
近年来,一系列工农业活动导致重金属铅和铬大量添加于土壤环境中,其对陆生动植物的潜在毒性效应已经引起人们的广泛关注。铅和铬进入土壤后,可能会对土壤生物产生一系列毒性效应,如影响土壤动植物的存活、摄食、行为和繁殖,阻碍生物正常生长,改变有关酶活性及损伤DNA等[1-3]。
蚯蚓作为土壤动物最大的常见类群之一,在陆地生态系统中发挥着十分重要的功能[4-5];其代表了土壤生物总量的80%,对土壤生态系统的健康和肥力起着至关重要的作用[6]。此外,蚯蚓被美洲试验材料协会(ASTM)、经济合作与发展组织(OECD)以及国际标准化组织(ISO)作为陆生生态系统标准毒性测试的模式生物[7]。
目前,有关Pb和Cr等重金属对蚯蚓的生态毒理效应研究[1-3, 5]较多,但主要采用人工土壤,且基本没有考虑污染物在土壤中的老化作用。为了对2种重金属的毒性效应提供更接近实际情况的基础数据,本文研究了河北黄壤中铅和铬对赤子爱胜蚓(Eisenia fetida)的毒性效应及其在蚯蚓体内的富集。
全文HTML
-
Pb(NO3)2(分析纯)和K2Cr2O7(分析纯)购自国药集团化学试剂有限公司,纯度大于98%。
-
试验所用蚯蚓为标准测试生物赤子爱胜蚓,购自北京坤龙养殖中心。新购置的蚯蚓以发酵腐熟的牛粪和燕麦片作为饲料,每星期喂食1次,在室温20—25 ℃,培养基湿度约80%—85%的自然光照条件下长期饲养并进行繁殖。试验选用具有生殖环带、体重约300—600 mg且行为活跃的健壮成蚓。试验前将蚯蚓放入与试验环境相同的条件下驯养1 d。
-
试验土壤采集自保定风帆蓄电池厂厂区附近的农田土。土壤样品采集后运回实验室,置于-20 ℃冰箱中保存备用。供试土壤的基本理化性质见表1。
试验前从冷冻冰箱中取出土壤样品并解冻,在实验室条件下风干,剔除石头以及植物根系,研磨,过筛(<2 mm)。
-
根据Pb(NO3)2和K2Cr2O7对赤子爱胜蚓的21 d急性毒性测试结果,在此基础上分别设置了6个浓度组(Pb(NO3)2浓度分别为0、200、400、600、800、1000 mg·kg−1)和4个浓度组(K2Cr2O7浓度分别为0、30、60、90 mg·kg−1)进行酶活试验。试验所用器皿为1 L的玻璃烧杯,以塑料薄膜封口,然后在其上钻直径约为1 mm的小孔若干供通风和透气。
配置试验土壤时,先将适量的Pb(NO3)2和K2Cr2O7配制(通过母液稀释)成50 mL的水溶液,加入500 g试验土壤中,充分混匀后,再用蒸馏水将土壤湿度调节至35%,平衡28 d后用于试验,每个浓度组设置3个平行。试验前将蚯蚓置于湿润的滤纸上清肠1 d。
土壤平衡28 d后每个浓度组放入12条蚯蚓,然后将测试器皿置于人工气候箱中,持续光照,在光照强度为800 lx、温度为(20±1)℃、湿度为79%—82%的条件下培养,分别于试验第1、3、7、14、21 天后测定蚯蚓体内超氧化物酶(superoxide dismutase,SOD)、过氧化氢酶(peroxidase,POD)和过氧化氢酶(catalase,CAT)的活性;并于试验第7、21 d测定蚯蚓体内Pb和Cr的含量。整个试验期间不喂食。
-
蚯蚓匀浆缓冲液的制备:用万分之一的分析天平称取三羟甲基氨基甲烷(Tris):6.0570 g,二硫苏糖醇(DDT):0.15425 g,乙二胺四乙酸(EDTA):0.29225 g,蔗糖:85.570 g,加入适量蒸馏水溶解(约900 mL),然后用稀盐酸调节为pH 7.8,定容至1 L。最终所得缓冲液各组分浓度:Tris:50 mmol·L−1、DTT:1 mmol·L−1、EDTA:1 mmol·L−1、蔗糖:250 mmol·L−1。为防止高温使酶液失活,酶液提取操作均在4 ℃条件下进行。
每个浓度组取1—2条蚯蚓,用蒸馏水冲洗干净,滤纸吸干表面水分后,称重,然后快速将蚯蚓剪碎,加入9倍匀浆缓冲液(V/W=9),在组织研磨仪中制成10%的组织匀浆。将匀浆液转入2 mL的离心管中,冷冻离心10 min(4000 r·min−1,4 ℃),取上清液,分装于1.5 mL的离心管中,在−80 ℃的超低温冰箱中保存用以测定其酶活性。
酶活性测定时,取出样品,在4 ℃条件下解冻。SOD、POD和CAT的活性以及蛋白质含量的测定均按照所购买的南京建成生物工程研究所试剂盒说明书进行。SOD和POD酶活性以每毫克蛋白质计,CAT酶活性以每克蛋白质计。
-
每个浓度组取2条蚯蚓,用蒸馏水冲洗干净后放入50 mL烧杯中吐泥3 d(保鲜膜封口,扎孔),然后用蒸馏水冲洗干净,于烘箱中烘至衡重(105 ℃)。取出冷却后研磨,用于测定重金属含量。
称取定量研磨后的蚯蚓,放入50 mL小烧杯中,加20 mL浓硝酸。盖上培养皿过夜。然后加入高氯酸5 mL,在通风橱中加热消解,直至冒出大量白烟,如果样品没有完全溶解,冷却后再加入适量浓硝酸和高氯酸,加热,直到溶液变清为止。然后转入50 mL容量瓶中,定容,用ICP-MS测定Pb、Cr的含量。
-
数据结果采用平均值±标准偏差(mean±S.D.)的形式表示,用SPSS20.0软件中的单因素方差分析(one-way ANOVA)对对照组和试验组进行显著性差异分析。其中,P<0.05和P>0.05分别表示对照组和试验组之间具有显著性差异和无显著性差异。若P<0.01,则表示两者之间有极显著性差异。
1.1. 试剂与材料
1.2. 试验所用蚯蚓
1.3. 试验土壤
1.4. 试验方法
1.5. 酶液的提取及酶活性测定
1.6. 蚯蚓体内重金属含量测定
1.7. 数据分析与处理
-
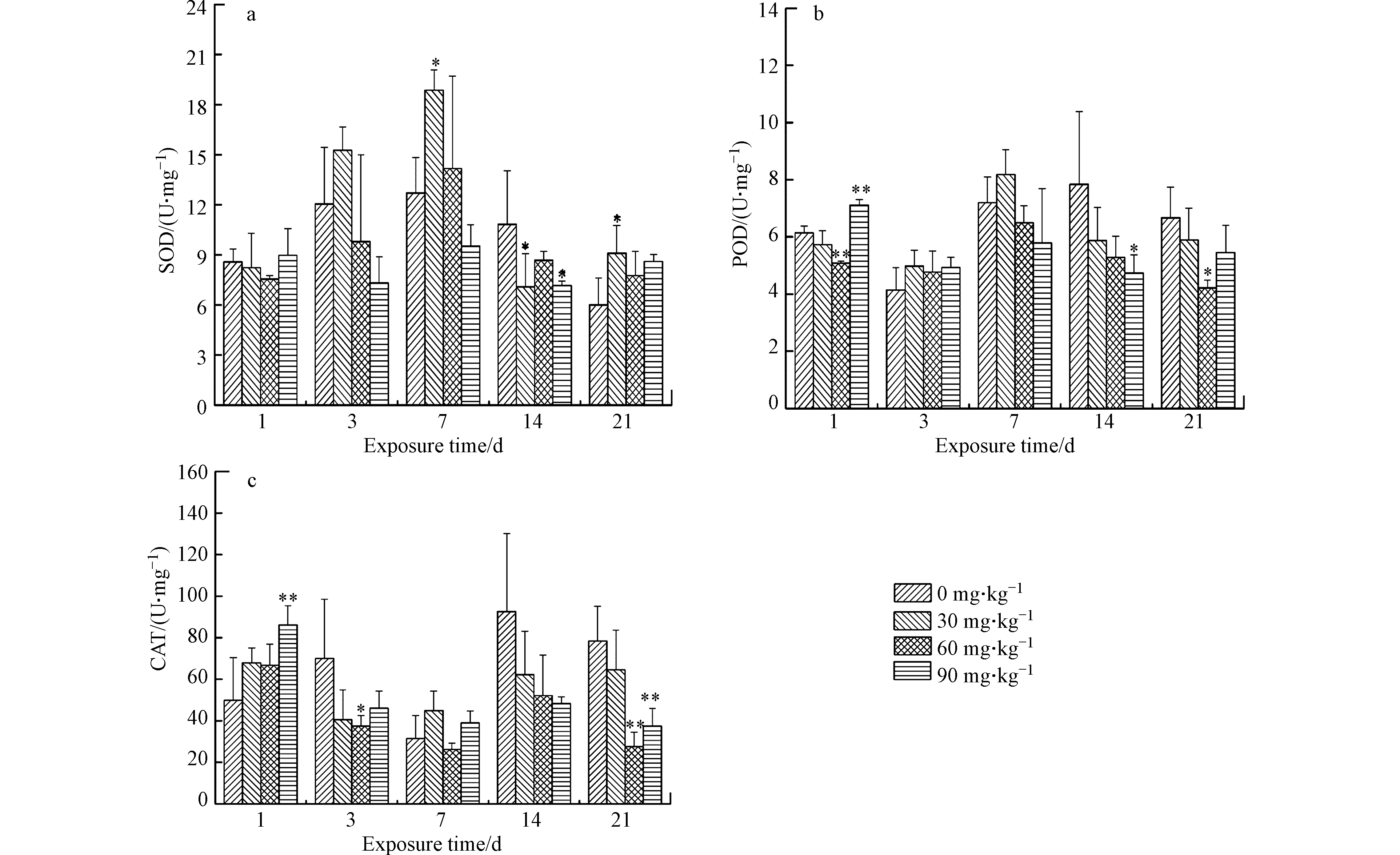
整个试验过程中,对照组和试验组均未出现蚯蚓死亡现象。图1是不同Pb(NO3)2浓度作用下蚯蚓体内SOD、POD和CAD活性测定结果。
由图1可知,除个别浓度组外,试验组SOD活性与对照组相比总体变化趋势不明显。暴露第1天,蚯蚓体内SOD活性在低浓度下(200 mg·kg−1)显著升高(P<0.05),与对照组相比升高了65.8%。暴露第3 天,蚯蚓体内SOD活性随土壤中Pb(NO3)2浓度的升高呈逐渐下降趋势,高浓度1000 mg·kg−1组蚯蚓体内SOD活性显著降低(P<0.05),与对照组相比降低了45.9%。暴露第7天时,各试验组蚯蚓体内SOD活性随土壤中Pb(NO3)2浓度的升高呈先升高后降低趋势,表现出低浓度下刺激高浓度下抑制的现象。当暴露时间延长至14 d和21 d时,各试验组蚯蚓体内SOD活性与对照组相比无显著性差异(P>0.05)。
由图1可知,同SOD一样,暴露第1天,蚯蚓体内POD活性在低浓度下(200 mg·kg−1)显著升高(P<0.05),与对照组相比升高了37.5%。暴露第3天和第7天时,蚯蚓体内POD活性均先升高后降低,表现出低浓度下刺激高浓度下抑制的现象。暴露第14天,各试验组POD活性与对照组无显著性差异(P>0.05)。当暴露达到21 d,各试验组POD活性与对照组相比显著降低(P<0.05),基本均降低了20%—30%。
由图1可知,暴露第1天,蚯蚓体内CAT活性随土壤中Pb(NO3)2浓度的升高而逐渐升高,Pb(NO3)2浓度为800 mg·kg−1和1000 mg·kg−1试验组显著高于对照组(P<0.05),与对照组相比分别升高了55.0%和68.6%。暴露第3天,蚯蚓体内CAT活性随土壤中Pb(NO3)2浓度的升高而显著降低(P<0.05),各试验组与对照组相比基本均降低了50.0%。暴露第7天和第14天,试验组蚯蚓体内CAT活性与对照组相比无显著性差异(P>0.05)。当暴露时间延长至21 d时,各试验组蚯蚓体内CAT活性与对照组相比极显著降低(P<0.01),基本降低了50.0%。
-
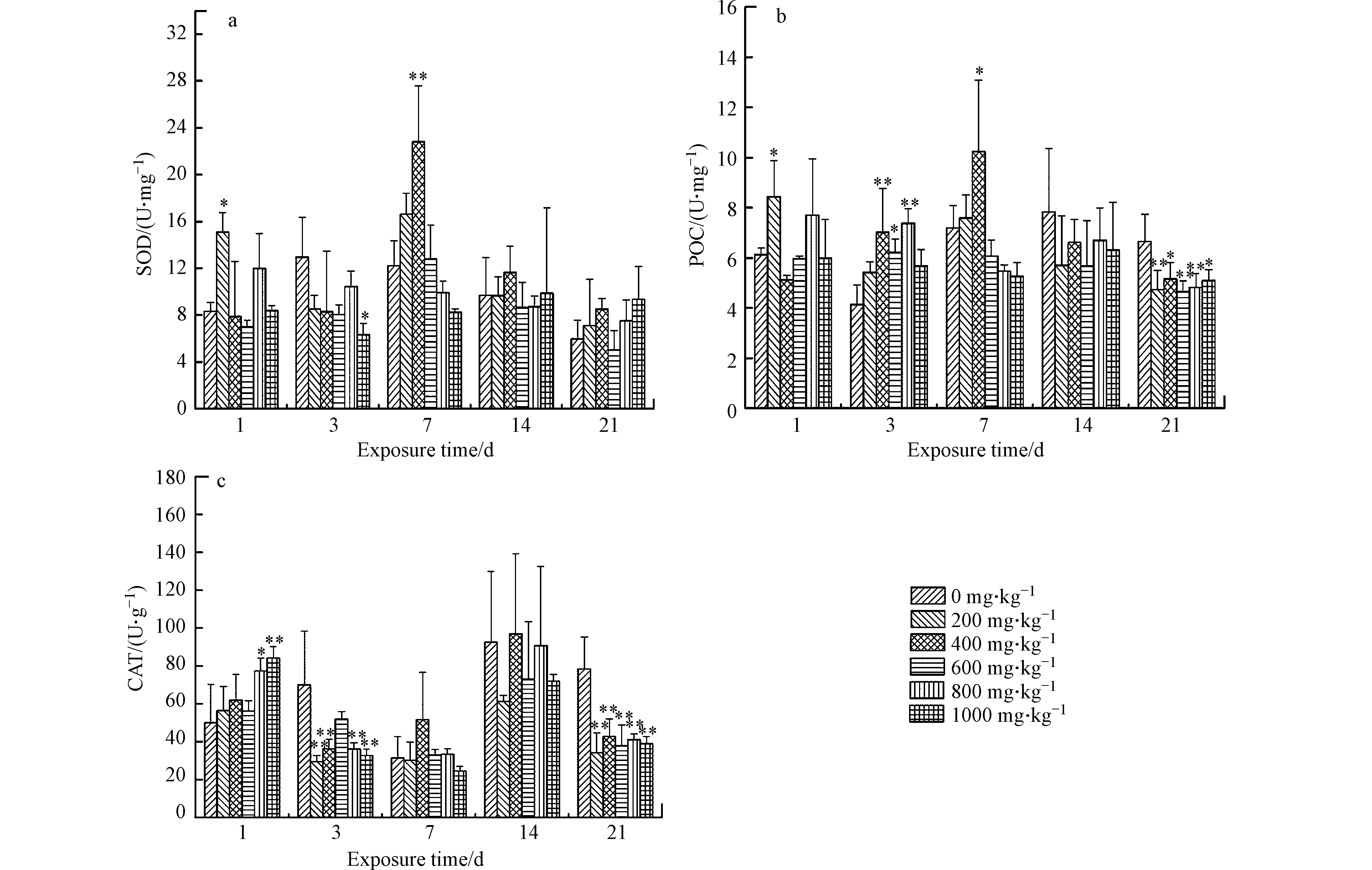
图2是不同K2Cr2O7浓度作用下蚯蚓体内SOD、POD和CAT活性测定结果。由图2可知,暴露第1天和第3天时,各试验组SOD活性与对照组相比无显著性差异(P>0.05)。暴露第7天时,蚯蚓体内CAT活性先升高后降低,表现出低浓度下刺激高浓度下抑制的现象。暴露第14天时,蚯蚓体内CAT活性随土壤中K2Cr2O7浓度的升高而逐渐降低;K2Cr2O7浓度为30 mg·kg−1和90 mg·kg−1试验组与对照相比显著降低(P<0.05),分别下降了34.5%和33.9%。当暴露时间延长到21 d时,蚯蚓体内CAT活性随土壤中K2Cr2O7浓度的升高呈上升趋势,其中K2Cr2O7浓度为30 mg·kg−1试验组显著高于对照组(P<0.05),与对照组相比升高了51.5%。
由图2可知,暴露第1天时,蚯蚓体内POD活性随土壤中K2Cr2O7浓度的升高表现出先降低后升高的趋势。暴露第3天和第7天时,各试验组蚯蚓体内POD活性与对照组相比无显著性差异(P>0.05)。当暴露延长至14 d和21 d时,蚯蚓体内POD活性随土壤中K2Cr2O7浓度的升高而逐渐降低;高浓度试验组与对照组相比显著降低(P<0.05),分别下降了39.6%和36.8%。
由图2可知,暴露第1天时,蚯蚓体内CAT活性随土壤中K2Cr2O7浓度的升高而逐渐升高,K2Cr2O7浓度为90 mg·kg−1试验组POD活性达到最大,与对照组相比升高了72.6%;暴露第3天时,蚯蚓体内CAT活性随土壤中K2Cr2O7浓度的升高而逐渐降低,K2Cr2O7浓度为60 mg·kg−1试验组POD活性显著降低(P<0.05),与对照组相比降低了46.5%。暴露第7天和第14天,各试验组CAT活性与对照组相比无显著性差异(P>0.05)。当暴露时间延长到第21天天时,蚯蚓体内CAT活性随土壤中K2Cr2O7浓度的升高而逐渐降低,其中K2Cr2O7浓度为60 mg·kg−1和90 mg·kg−1试验组POD活性显著降低(P<0.05),与对照组相比分别降低了64.8%和52.3%。
-
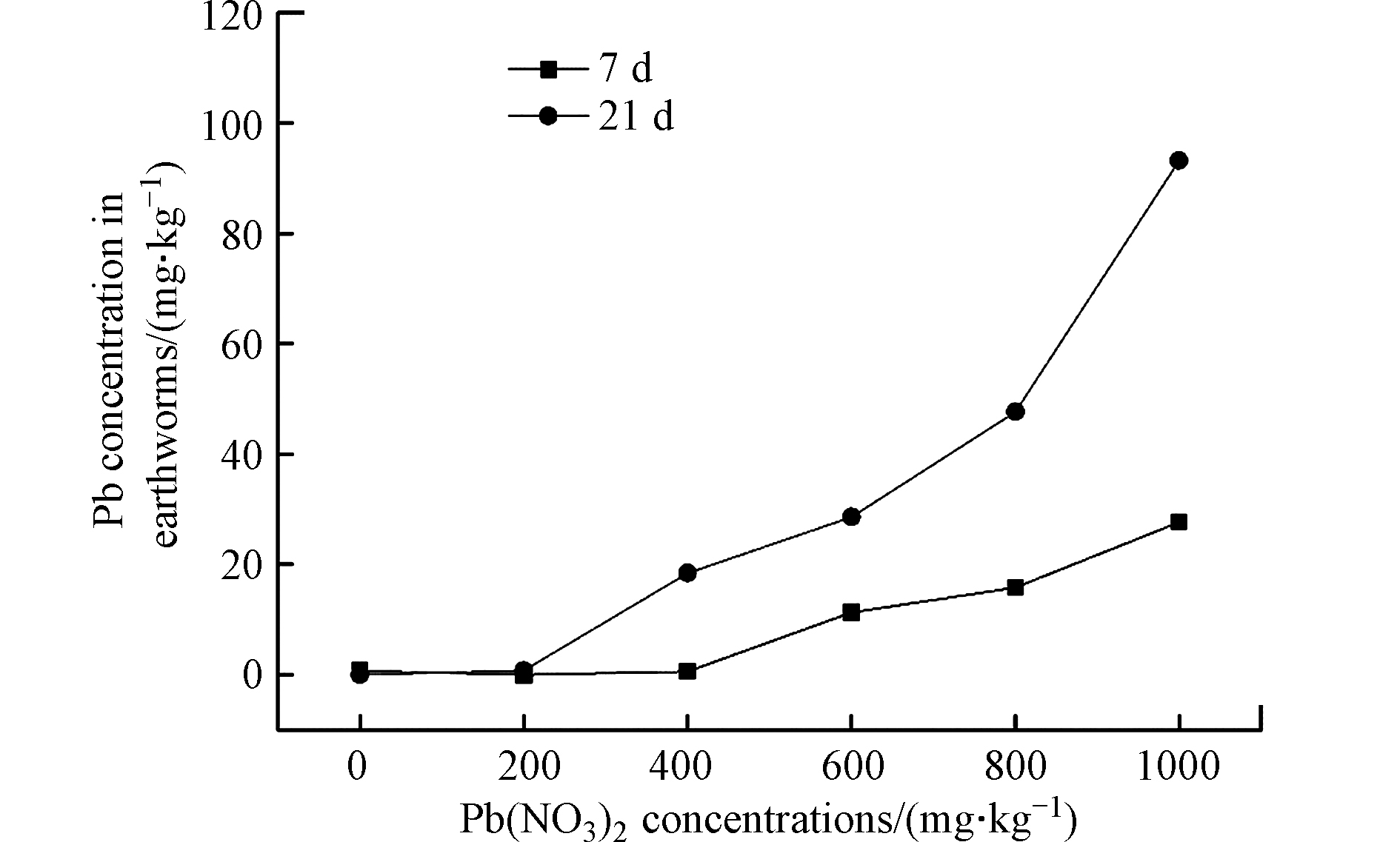
图3是不同Pb(NO3)2浓度作用下蚯蚓体内Pb含量测定结果。由图3可知,土壤中Pb(NO3)2的浓度和暴露时间均对蚯蚓体内Pb含量产生明显影响。蚯蚓体内Pb的含量在同一时间不同浓度下均随土壤中Pb(NO3)2浓度的增加而增加。在低浓度下(200 mg·kg−1),暴露21 d后蚯蚓体内Pb的含量与7 d基本一致,接近0 mg·kg−1。然而在高浓度下(200—1000 mg·kg−1),暴露21 d后蚯蚓体内Pb含量均高于7 d时的含量,说明随着暴露时间的延长,蚯蚓体内Pb含量不断增加。这与前人的研究结果是一致的,朱宇恩[8]的研究结果表明,Pb处理土壤中蚯蚓体内Pb含量随着培养天数的增加而升高。伏小勇等[9]的研究结果表明,蚯蚓对土壤中重金属Pb的富集量随着重金属浓度的增加而增加。
蚯蚓体内Pb含量与土壤中Pb浓度的回归分析见表2。因当土壤中Pb(NO3)2浓度为200 mg·kg−1时,蚯蚓对Pb的吸收量基本为0 mg·kg−1,因此仅对高浓度下蚯蚓体内Pb含量与土壤中Pb浓度进行回归分析。由表2可知,在测试浓度范围内(Pb浓度为248.7—621.8 mg·kg−1),蚯蚓体内Pb含量与土壤中Pb污染浓度的关系可以用一元回归方程表示,两者之间有明显的正相关关系,相关系数(r)均大于0.950(P<0.05)。这与前人的研究结果保持一致,Zhang等[10]的研究结果表明,蚯蚓体内Pb富集与土壤中Pb含量呈显著的正相关关系(R2>0.62)。无论在实验室还是现场实际情况下,蚯蚓体内的重金属富集通常被称为一级动力学过程[11-13]。
蚯蚓体内Pb含量与土壤Pb浓度的比值称为“富集系数”,可以用其来判断蚯蚓对污染土壤中Pb的富集能力。富集系数大于1说明赤子爱胜蚓对Pb有富集,小于1则说明只是一般的吸收,起不到富集的作用[14]。不同Pb试验组蚯蚓体内Pb富集系数见表3。由表3可知,暴露7 d和21 d后,蚯蚓对供试土壤中Pb的富集系数均小于1,说明赤子爱胜蚓对Pb仅有吸收。朱宇恩[8]的研究结果表明,赤子爱胜蚓对3种供试土壤褐土、潮棕壤、酸性棕壤中Pb的富集系数均小于1,说明蚯蚓对Pb没有富集作用,只是部分吸收。
-
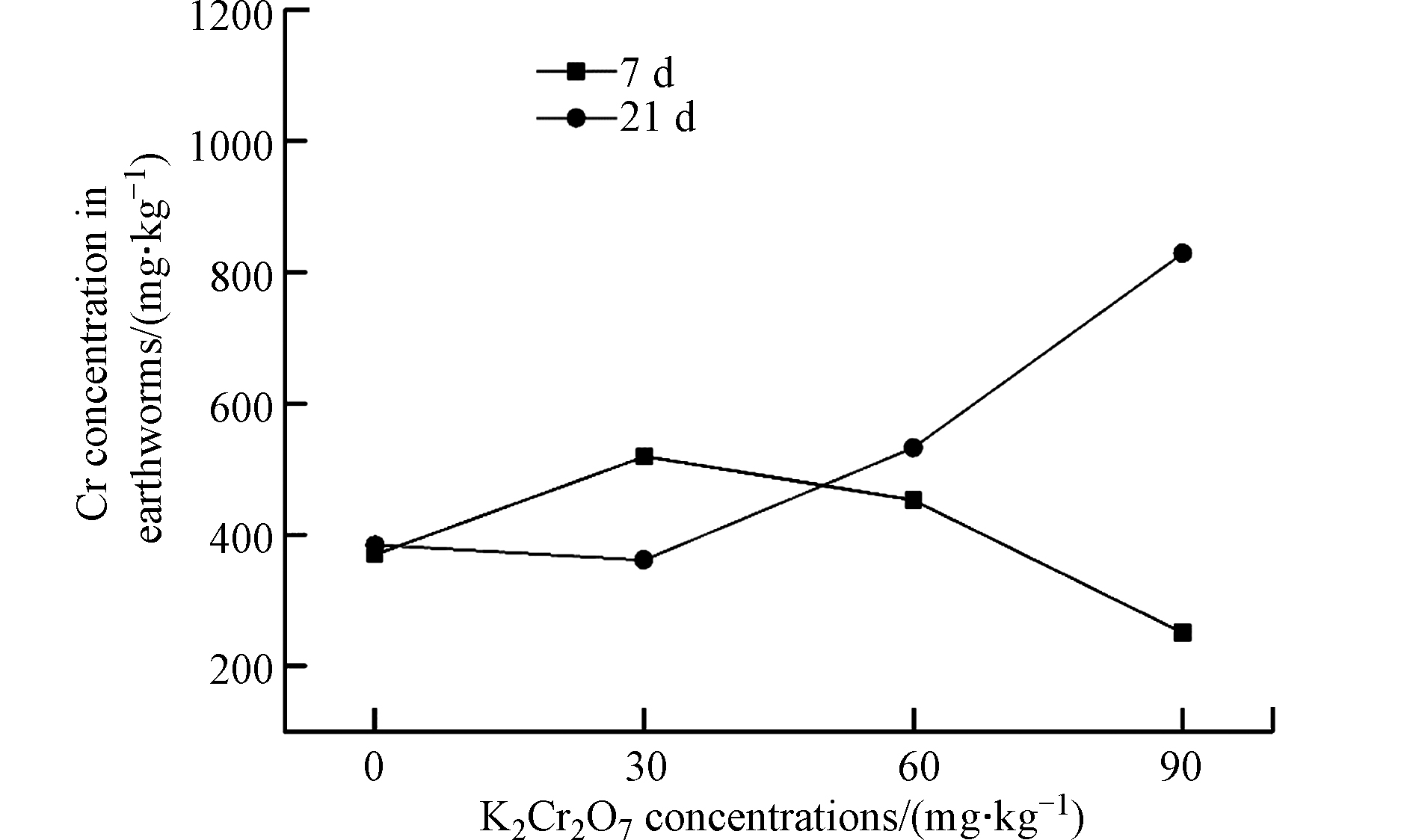
图4是不同K2Cr2O7浓度作用下蚯蚓体内Cr含量测定结果。由图4可知,蚯蚓体内Cr含量要远远高于土壤中的Cr含量,说明赤子爱胜蚓对土壤中的Cr具有很强的富集作用。土壤中K2Cr2O7的浓度和暴露时间均对蚯蚓体内Cr富集量产生明显影响。暴露第7天时,蚯蚓体内Cr的富集量随土壤中K2Cr2O7浓度的增加表现出先升高后降低的趋势,K2Cr2O7浓度为90 mg·kg−1试验组蚯蚓体内Cr的富集量要远低于对照组,可能是因为高浓度K2Cr2O7暴露下,蚯蚓的活动受到了严重的抑制,导致蚯蚓对重金属几乎不富集。然而,暴露达到21 d时,蚯蚓体内Cr的富集量随土壤中K2Cr2O7浓度的增加而增加,可能是因为随着暴露时间的延长,蚯蚓对K2Cr2O7的毒性产生了适应性,所以对Cr的富集量又逐渐回升。
伏小勇等[9]的研究结果表明,若蚯蚓吸收的重金属超过了蚯蚓的忍受范围,则土壤中过高的重金属含量会直接毒害蚯蚓,对其生命活性产生影响。Morgan和Marinussen等[7, 15]的研究表明,锌和铜在正常生理范围内调节,但是当物种暴露于高浓度下除外。本研究表明,Cr同样是在正常生理范围内调节,但是土壤中过高的Cr,会对蚯蚓生命活性产生影响。
蚯蚓体内Cr含量与土壤中Cr浓度的回归分析见表4。由表4可知,在测试浓度范围内(Cr浓度为10.6—31.8 mg·kg−1),暴露7 d和21 d后,蚯蚓体内Cr含量与土壤中Cr污染浓度之间具有一定的相关性,但相关系数没有达到显著的水平(P>0.05),可能是由于试验浓度组较少导致的。
不同Cr试验组蚯蚓体内Cr富集系数见表5。由表5可知,暴露7 d和21 d后,蚯蚓体内Cr富集系数均远大于1,表明赤子爱胜蚓对Cr具有很强的富集能力。
2.1. Pb(NO3)2和K2Cr2O7对蚯蚓酶活性的影响
2.1.1. Pb(NO3)2对蚯蚓酶活性的影响
2.1.2. K2Cr2O7对蚯蚓酶活性的影响
2.2. 蚯蚓对Pb和Cr的富集
2.2.1. 蚯蚓对Pb的富集
2.2.2. 蚯蚓对铬的富集
-
(1)在蚯蚓的耐受浓度范围内,土壤中Pb(NO3)2浓度和暴露时间均对蚯蚓体内Pb含量产生明显影响。暴露7 d和21 d后,蚯蚓体内Pb含量随土壤中Pb(NO3)2浓度的增加而增加。然而,低浓度下,赤子爱胜蚓对Pb基本没有吸收,可能是因为赤子爱胜蚓尽可能排除它们所摄取的重金属,或者是低浓度下Pb与基质中的有机质相互作用从而降低了Pb的生物有效性。蚯蚓体内Pb富集系数均小于1,说明赤子爱胜蚓对土壤中的Pb仅有吸收,没有富集作用。
(2)土壤中K2Cr2O7的浓度和暴露时间均对蚯蚓体内Cr富集量产生明显影响,暴露7 d和21 d后,蚯蚓体内Cr富集系数都远大于1,说明赤子爱胜蚓对土壤中的Cr具有很强的富集作用。用蚯蚓修复重金属Cr污染的土壤具有一定的应用价值。
(3)蚯蚓对Cr的富集量要远远大于Pb,这说明赤子爱胜蚓对不同重金属的富集能力是不同的,其对重金属的富集具有一定的选择性。
(4)土壤中Pb(NO3)2和K2Cr2O7对赤子爱胜蚓体内SOD、POD和CAT活性均产生了显著的影响,暴露1 d后,Pb(NO3)2对蚯蚓体内3种抗氧化酶活性呈现激活作用,暴露21 d后,蚯蚓体内POD和CAT活性均随土壤中Pb(NO3)2和K2Cr2O7浓度的增加而降低;除此之外,3种抗氧化酶活性出现时高时低的波动,呈现不同程度的激活或抑制作用,表明其活性与土壤中Pb(NO3)2和K2Cr2O7浓度的剂量-效应关系不显著。



 下载:
下载: