-
水体富营养化普遍发生于湖泊水库、河口和近岸海域[1],过多的营养物质刺激藻类生长,同时藻类凋亡沉积又可促进沉积物中的微生物活动,导致沉积物缺氧,水体溶解氧含量下降[2]。缺氧沉积环境中的有机质厌氧分解向上覆水和大气释放甲烷[3-4],其主要是缺氧沉积物中的产甲烷古菌生产的,是全球碳生物地球化学循环的重要过程之一[5-6]。
改善缺氧沉积环境的缺氧状况,应当有利于缓解沉积物甲烷释放。由于界面氧纳米气泡可以长时间稳定存在,高效释放氧气完成复氧过程[7-8],氧纳米气泡增氧技术近年来被认为是最有潜力应用于环境修复的绿色技术之一[9]。潘纲课题组首次将矿石材料原位封盖与氧纳米气泡增氧技术结合,利用改性矿石材料的重力沉降将氧纳米气泡输送到缺氧区域[10]。研究表明,原位封盖抑制沉积物耗氧过程的能力是有限的,远不及氧纳米气泡对修复缺氧环境的贡献[11]。两者结合则可以实现界面持续增氧,改善缺氧沉积环境,从根源上解决缺氧及其相关的甲烷释放增加等问题[12]。
现有文献报道主要将该技术应用于湖泊水库沉积物和淡水环境,尚未见有针对河口缺氧沉积物和海水环境的研究。海水的离子强度高于淡水,已有研究表明,高的离子强度不利于氧纳米气泡的稳定存在[13-14],这也是该技术应用于河口缺氧沉积物和海水环境的难点。因此,研究该技术应用于河口缺氧沉积物和海水环境的可行性,对于拓展该技术的应用范围具有重要的现实意义。李村河是穿越青岛城区的主要河流,河口受胶州湾水交换能力弱和城市污水排放量大的影响,营养盐积累导致春夏季生物量大幅增加,引发的季节性缺氧亟待改善。本研究采用改性天然斜发沸石负载氧制备氧纳米气泡,进行河口沉积物-海水界面模拟实验研究,探究了氧改性斜发沸石的封盖和界面增氧作用对缓解甲烷释放的效果,同时从生物学角度初步阐述了其作用机制。旨在为氧纳米气泡缺氧修复技术原位修复河口缺氧环境提供理论依据。
-
取粒径1—2 mm的天然斜发沸石(河南锦源环保有限公司)用去离子水充分洗涤,于电热鼓风干燥箱中110 ℃烘干1 h。待降至室温,称取天然斜发沸石250 g置于马弗炉中,600 ℃下焙烧3 h [15]。
采用氧吸附法[16]制备氧纳米气泡改性斜发沸石。将焙烧后的沸石置于1000 mL耐压玻璃密闭容器中,使用真空泵将沸石孔道中的空气抽出,在−0.095 MPa下维持1 h。然后通氧气在0.1 MPa下维持1 h,使氧气充满沸石孔道,得到新鲜制备的氧改性斜发沸石。采样同样的处理方法,通氮气得到无氧改性斜发沸石。
-
采集李村河河口上覆水和0—20 cm表层沉积物,2 h内运回实验室,置于暗处避光保存。采集新鲜藻类于聚乙烯塑封袋中,−20 ℃冻存。将2.1 L沉积物加入内径12 cm的玻璃柱中,使沉积物高度为20 cm,再缓慢加入11 L水样(尽量避免沉积物受到扰动),使上覆水高度为100 cm,剩余水样密封置于暗处保存。使用黑色遮光布遮住有机玻璃柱,放置两个星期,使沉积物处于缺氧状态后开始模拟实验。
新鲜藻类经冷冻干燥制成藻粉,于实验开始(第0天)取样后向有机玻璃柱中缓慢加入藻粉,以模拟藻类凋亡后的沉降及后续被微生物利用的过程。实验期间温度保持在(21±2)℃,接近采样时河口环境温度。实验分为3组:对照组、氧纳米气泡组(ONBs组)和无氧纳米气泡组(NNBs组)。对照组除加入藻粉外不做其他任何处理,以模拟自然状态下藻类沉降后的河口环境;ONBs组除加入藻粉外,于实验第1天加入250 g新鲜制备的氧改性斜发沸石,使沸石层厚度为2 cm,以探究封盖和氧纳米气泡的协同作用;NNBs组中加入等量藻粉,并于实验第1天加入无氧改性斜发沸石使其厚度亦为2 cm,以模拟仅有沸石封盖作用的情况。
-
于实验第0、1、3、5、7、10、13、16、20天取样,测定上覆水溶解氧(DO)、氧化还原电位(ORP)、硫酸盐(
${\rm{SO}}_4^{2 - }$ )和溶解有机碳(DOC)。在沉积物-水界面上方5 cm处采用便携式水质参数仪(HACH,HQ40d)测定DO含量,并记录上覆水温度。在沉积物-水界面上方5 cm预留的出口处采集适量水样(取水后由玻璃柱上方补充等量暗处保存的水样,下同),通过pH计测定ORP,采用铬酸钡分光光度法测定${\rm{SO}}_4^{2 - } $ 含量[17]。水样经0.22 μm的玻璃纤维滤膜过滤后,采用配有ASI-L自动进样器的总有机碳分析仪(Shimadzu,TOC-L)高温催化氧化法测定DOC含量。 -
在每个取样时间点,取120 mL水样于样品瓶中,加入1 mL饱和叠氮化钠以杀灭微生物,迅速压盖于4 ℃冷藏。采用顶空平衡-气相色谱法[18]对上覆水中溶解甲烷进行定量分析。测定过程简述如下:使用普通医用注射器抽出10 mL水样,将顶空样品内水样瓶涡旋混匀1 min,使甲烷在气-液两相间达成平衡。取1 mL顶空气体注入气相色谱仪(Agilent 8890)分析,采用HP/Plot Q 毛细管色谱柱,柱温首先在90 ℃恒温2 min,然后20 ℃·min−1升温至150 ℃;采用FID检测,检测器温度250 ℃。记录每次采集的水样体积,并根据最终与初始溶解甲烷含量,按照以下公式[19]计算每平方米、每日沉积物-水界面的甲烷通量[20]。
其中,Fn是第n个取样时间点的甲烷通量(μg·m−2·d−1);V是上覆水体积(L);Cn是第n个取样时间点的溶解甲烷浓度(μg·L−1);C0是实验开始时的浓度(μg·L−1);Ci是补偿水的浓度(μg·L−1);Vj是取样水的体积(L);S是玻璃柱的截面面积(m2);t是实验时间(d)。
-
委托青岛志远生物工程有限公司采用荧光定量PCR (qPCR) 对产甲烷古菌的mcrA基因进行绝对定量。在实验开始和第20天,从3个实验组中各取0—5 cm的沉积物(去除覆盖层和藻粉层)。采用Omega soil DNA Kit试剂盒按照制造商提供的使用方法提取基因组DNA,采用1%琼脂糖凝胶电泳检测提取的DNA,使用Axyprep DNA凝胶提取试剂盒提取纯化的产物,作为qPCR反应的模板。使用引物1106F(5′-TTWAGTCAGGCAACGAGC-3′)/1378R(5′-TGTGCAAGGAGCAGGGAC-3′)对产甲烷古菌mcrA基因进行扩增[21]。qPCR反应在30 μL混合物体系中进行,包含15 μL qPCR反应混合物,2 μL模板DNA,两组引物各0.5 μL(10 μmol·L−1),2 μL Mg2+溶液(25 mmol·L−1),0.5 μL染料,补充双蒸水至30 μL。qPCR反应条件为:95 ℃下预变性3 min,然后94 ℃变性30 s,65 ℃退火30 s,72 ℃延伸30 s,进行35个循环。qPCR反应进行3次平行实验,采用不含DNA模板的阴性对照以排除污染的可能。将PCR产物连接至pMD@19-T Vector得到重组质粒,转化大肠杆菌感受态细胞DH5α,选择阳性克隆提取质粒,经线性化处理后进行梯度稀释建立标准曲线,根据qPCR反应的循环次数得到mcrA基因的丰度。
-
DOC含量在上覆水中的变化如图1a所示。对照组中,DOC含量呈逐渐上升的趋势,第13天达到峰值,而后缓慢下降,但始终维持较高水平直至第20天实验结束。NNBs和ONBs组中,DOC的含量在第1天发生了明显的下降,这是由于沸石层阻碍了DOC向上覆水的迁移。之后DOC含量也始终低于对照组,且两组间无明显差异。实验结果表明,无论是否存在氧纳米气泡,沸石层都能够减少上覆水中可利用的有机质含量,从而有利于抑制耗氧过程。
-
上覆水中DO含量变化如图1b所示。覆盖氧改性斜发沸石12 h后,ONBs组上覆水中DO由0.22 mg·L−1上升至4.28 mg·L−1,表明氧改性斜发沸石具有明显的增氧效果;至第5天上覆水的DO小于2 mg·L−1,而后DO进一步逐渐下降。引起DO下降的原因是有机质(或其它还原性物质)与氧反应消耗以及微生物活动利用。NNBs和对照组在整个实验期间均处于缺氧状态,DO含量无明显变化,约为0.3 mg·L−1。
-
氧改性斜发沸石作为有氧层向上覆水中释放氧气,持续逆转缺氧状况,引起上覆水氧化还原性质的改变(图1c)。对照组中,ORP总体呈现下降趋势。可能是加入的藻粉促进了微生物活动,部分有机质以DOC形态向上覆水释放导致上覆水的还原性增强。NNBs组中ORP基本保持不变表明,沸石层的封盖作用阻碍了DOC从沉积物进入上覆水,对缺氧起到一定的缓解作用。ONBs组中,除沸石层的封盖作用外,氧改性斜发沸石释放的氧使ORP从−59 mV提升至2 mV,使上覆水显示出一定的氧化性。随着后期DO逐渐降低,ORP也随之降低,但仍高于NNBs和对照组。
-
氧化还原条件受上覆水中氧化还原反应和微生物过程影响,
${\rm{SO}}_4^{2 - } $ 含量在一定程度上可以作为反映上覆水厌氧和好氧状态的指标[22]。如图1d所示,对照组中${\rm{SO}}_4^{2 - } $ 含量整体呈下降的趋势,20 d的整个实验周期内从683.0 mg·L−1下降至607.1 mg·L−1,下降了11.1%。而NNBs组和ONBs组中,${\rm{SO}}_4^{2 - } $ 含量在前7 天里逐渐升高,分别从699.7 mg·L−1和668.8 mg·L−1 上升至720.9 mg·L−1和748.3 mg·L−1,分别增加了3.03%和11.9%,之后${\rm{SO}}_4^{2 - } $ 含量基本保持不变。除有机质的耗氧过程外,硫酸盐还原菌(SRB)和硫氧化菌(SOB)竞争利用含硫化合物同样影响着${\rm{SO}}_4^{2 - } $ 的消耗和产生[23]。处于缺氧环境下的对照组中,SRB将硫酸盐还原为硫化氢向上覆水释放,不断消耗${\rm{SO}}_4^{2 - } $ 使其含量降低。NNBs和ONBs组中,沸石层阻碍SRB利用上覆水中的${\rm{SO}}_4^{2 - } $ ,减少了${\rm{SO}}_4^{2 - } $ 的消耗。同时,ONBs组中氧的释放抑制了SRB的活性,而刺激微需氧和好氧的SOB将还原性硫化物氧化为${\rm{SO}}_4^{2 - } $ [24]。因此,${\rm{SO}}_4^{2 - } $ 含量表现为:ONBs组>NNBs组>对照组。 -
不同的沉积物处理条件下,沉积物-水界面的甲烷通量存在显著差异(图2)。对照组中,甲烷通量在整个实验期间维持较高水平,第10天达到64.9×10−6 g·m−2·d−1的最高值。NNBs组中,甲烷通量第1天为56.9×10−6 g·m−2·d−1,即为最高值。第5天后甲烷释放基本保持稳定。对照组和NNBs组中,沉积物表现为甲烷的“源”。而对于ONBs组,甲烷通量第3天达到最低值,为−42.3×10−6 g·m−2·d−1,甲烷通量变为负值表明沉积物转变为甲烷的“汇”;第10天后,ONBs与NNBs组的通量变化趋于相似。20 d的整个实验周期内,对照组、NNBs和ONBs组的累积甲烷通量为0.762、0.321 、0.008 mg·m−2,后两组与对照组相比分别下降了57.9%和99.0%。一方面,DOC含量的升高刺激了产甲烷古菌产甲烷的过程,DOC含量与溶解甲烷含量存在显著的正相关性[25-26];另一方面,缺氧条件下甲烷浓度与硫化氢浓度也呈正相关[27],硫酸盐含量的下降促进了沉积物中甲烷向上覆水的扩散。对照组的DOC含量显著高于NNBs和ONBs组,而硫酸盐含量最低,其甲烷释放量最高,这一点与产甲烷古菌的活动也不无关系,在2.3节中将得到更好阐释。而在ONBs和NNBs组中,沸石层阻碍沉积物中产甲烷古菌利用上覆水中的DOC,减缓了沉积物向上覆水释放甲烷。此外,对于ONBs组,氧改性斜发沸石提高了上覆水DO和ORP,缓解了上覆水的缺氧环境,有效抑制了产甲烷古菌的活性,进一步减少了甲烷的产生。氧改性斜发沸石的封盖和氧纳米气泡的协同作用导致实验周期内ONBs组的累积产甲烷量低于NNBs组,更低于对照组。
-
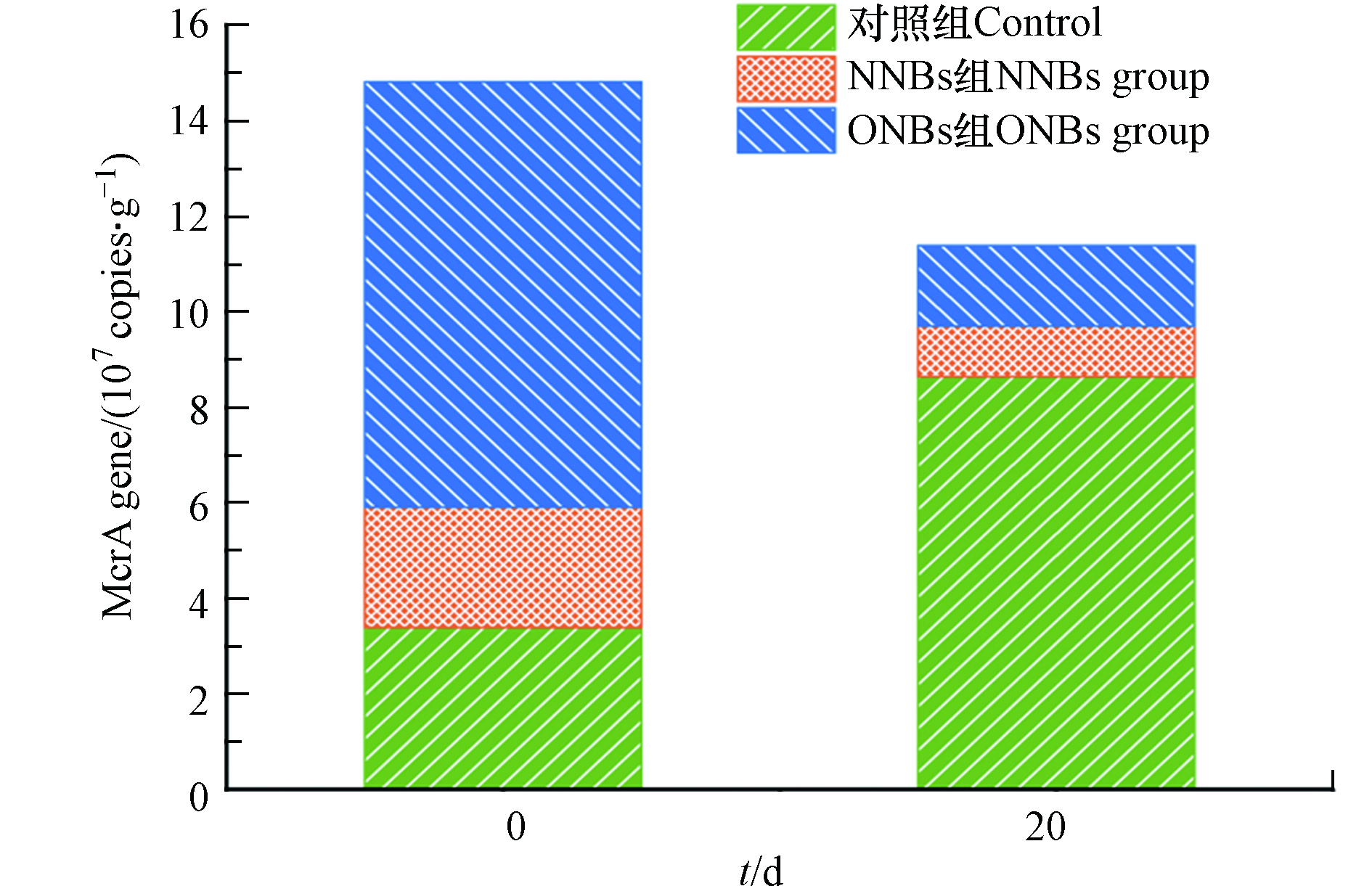
基于产甲烷古菌mcrA基因的绝对定量分析,进一步阐明了氧纳米气泡抑制沉积物-水界面甲烷释放的作用机制。甲基辅酶M还原酶(MCR)是甲烷形成过程的限速酶,由mcrA基因编码的MCR催化所有产甲烷古菌的产甲烷过程,因此可以作为检测产甲烷古菌的生物标志物[28-29]。如图3所示,对照组20 d后的沉积物中产甲烷古菌mcrA基因丰度相较于实验开始时显著增加,从3.39×107 拷贝数·g−1增加至8.65×107 拷贝数·g−1。沉降的藻粉为产甲烷古菌提供了化能异养所需的碳源和能源,促进了产甲烷古菌的生长和繁殖,从而引起甲烷由沉积物向上覆水大量释放。Niu等[30]和Shi等[31]也观察到,高的产甲烷古菌丰度引起了甲烷通量的增加。ONBs组中,mcrA 基因丰度从8.90×107 拷贝数·g−1下降至1.65×107 拷贝数·g−1,进一步印证了加入氧改性斜发沸石后形成的封盖和氧纳米气泡的协同作用抑制了产甲烷古菌的活性,导致产甲烷古菌mcrA基因的丰度显著降低,有效减少了甲烷由沉积物向上覆水的释放。NNBs组中,mcrA 基因丰度有所下降,从2.52×107 拷贝数·g−1下降至1.05×107 拷贝数·g−1,下降幅度明显小于ONBs组,表明仅有沸石层的封盖作用不足以显著抑制产甲烷古菌的活动。
-
本论文通过改性斜发沸石负载氧纳米气泡,模拟研究了其在海水环境中原位抑制河口缺氧沉积物甲烷释放的效果,得出如下结论:
(1)氧改性斜发沸石通过释放氧持续逆转缺氧条件,对上覆水有明显的增氧效果,并在一定程度上改善了上覆水的氧化还原条件。
(2)无氧改性斜发沸石在一定程度上能够抑制产甲烷古菌的活性和缓解甲烷释放,但仅有封盖作用不足以从实质上改善缺氧状况。氧改性斜发沸石覆盖缺氧沉积物后,显著抑制了上层沉积物中产甲烷古菌的活性,有效缓解了甲烷由沉积物向上覆水的释放,封盖和氧纳米气泡的协同作用才能根本性解决原位修复缺氧沉积环境的问题。
致谢:感谢中国海洋大学化学化工学院王旭晨教授课题组、张洪海教授课题组及庄光超教授课题组提供实验仪器设备支持,并协助测试溶解有机碳含量和溶解甲烷浓度。
氧改性斜发沸石缓解缺氧沉积物甲烷释放的模拟研究
Effects of oxygen-modified clinoptilolite on methane emission in sediment-water interface: A laboratory simulated study
-
摘要: 富营养化导致藻类过度繁殖和缺氧频发,易引发甲烷大量释放,已经成为河口和近岸海域严重的环境问题。本研究通过氧改性斜发沸石制备氧纳米气泡,用于模拟研究原位修复缺氧沉积环境和缓解沉积物甲烷释放。氧改性斜发沸石覆盖缺氧沉积物12 h后,上覆水中溶解氧含量从0.22 mg·L−1上升至4.28 mg·L−1,氧化还原电位由−59 mV上升至2 mV;沉积物向上覆水释放的20 d累积甲烷通量比未覆盖组下降了99.0%;荧光定量PCR对产甲烷古菌丰度进行绝对定量的结果表明,上层沉积物中产甲烷古菌丰度从8.90×107 拷贝数·g−1下降至1.65×107 拷贝数·g−1。氧改性斜发沸石形成的有氧覆盖层能够显著抑制产甲烷古菌的活性,有效缓解沉积物甲烷释放,是可行的原位修复缺氧沉积环境的手段。Abstract: Methane emission in sediment-water interface has been a serious environmental problem in hypoxic estuaries and coastal waters. In this study, oxygen nanobubbles were prepared by oxygen-modified clinoptilolite to perform a simulation experiment of remediating anoxic sedimentary environment and mitigating methane emission. After oxygen-modified clinoptilolite were delivered to anoxic sediment, the concentration of dissolved oxygen improved from 0.22 mg·L−1 to 4.28 mg·L−1 and the redox potential increased from −59 mV to 2 mV in 12 hours. The 20-day cumulative methane emission decreased by 99.0% compared with the control group, demonstrating that oxygen-modified clinoptilolite significantly mitigated the release of methane caused by the deposition and remineralization of algae. In addition, methanogens were quantified based on mcrA gene by using qPCR method. Abundances of mcrA gene decreased from 8.90×107 copies·g−1 to 1.65×107 copies·g−1 in surface sediment after the application of oxygen nanobubbles, accompanied by methanogenesis suppression. Hence this could propose a promising strategy for sustainable remediation of anoxia and mitigation of methane emission.
-
Key words:
- natural clinoptilolite /
- anoxic sediment /
- oxygen nanobubbles /
- in-situ remediation /
- methane flux /
- methanogens
-

-
-
[1] KOBETIČOVÁ K, ČERNÝ R. Terrestrial eutrophication of building materials and buildings: An emerging topic in environmental studies [J]. The Science of the Total Environment, 2019, 689: 1316-1328. doi: 10.1016/j.scitotenv.2019.06.423 [2] WANG H J, DAI M H, LIU J W, et al. Eutrophication-driven hypoxia in the East China Sea off the Changjiang Estuary [J]. Environmental Science & Technology, 2016, 50(5): 2255-2263. [3] WEBER T, WISEMAN N A, KOCK A. Global ocean methane emissions dominated by shallow coastal waters [J]. Nature Communications, 2019, 10(1): 4584. doi: 10.1038/s41467-019-12541-7 [4] ZHANG L, LIU C, HE K, et al. Dramatic temporal variations in methane levels in black bloom prone areas of a shallow eutrophic lake [J]. Science of the Total Environment, 2021, 767: 144868. doi: 10.1016/j.scitotenv.2020.144868 [5] NICHOLSON D P, MICHEL A P M, WANKEL S D, et al. Rapid mapping of dissolved methane and carbon dioxide in coastal ecosystems using the ChemYak autonomous surface vehicle [J]. Environmental Science & Technology, 2018, 52(22): 13314-13324. [6] BEAULIEU J J, SMOLENSKI R L, NIETCH C T, et al. High methane emissions from a midlatitude reservoir draining an agricultural watershed [J]. Environmental Science & Technology, 2014, 48(19): 11100-11108. [7] THEODORAKIS P E, CHE Z Z. Surface nanobubbles: Theory, simulation, and experiment. A review [J]. Advances in Colloid and Interface Science, 2019, 272: 101995. doi: 10.1016/j.cis.2019.101995 [8] WANG S, LIU Y S, LYU T, et al. Aquatic macrophytes in morphological and physiological responses to the nanobubble technology application for water restoration [J]. ACS ES& T Water, 2021, 1(2): 376-387. [9] LYU T, WU S B, MORTIMER R J G, et al. Nanobubble technology in environmental engineering: Revolutionization potential and challenges [J]. Environmental Science & Technology, 2019, 53(13): 7175-7176. [10] 苗肖君, 陈俊, 王蕾, 等. 氧微纳气泡改性矿物对水体的增氧效果及机理 [J]. 环境保护科学, 2019, 45(6): 44-52. MIAO X J, CHEN J, WANG L, et al. Oxygenation effect and mechanisms of oxygen micro/nano-bubble (MNBs) modified minerals [J]. Environmental Protection Science, 2019, 45(6): 44-52(in Chinese).
[11] ZHANG H G, LYU T, LIU L X, et al. Exploring a multifunctional geoengineering material for eutrophication remediation: Simultaneously control internal nutrient load and tackle hypoxia [J]. Chemical Engineering Journal, 2021, 406: 127206. doi: 10.1016/j.cej.2020.127206 [12] ZHANG H G, CHEN J, HAN M L, et al. Anoxia remediation and internal loading modulation in eutrophic lakes using geoengineering method based on oxygen nanobubbles [J]. The Science of the Total Environment, 2020, 714: 136766. doi: 10.1016/j.scitotenv.2020.136766 [13] MEEGODA J N, HEWAGE S A, BATAGODA J H. Application of the diffused double layer theory to nanobubbles [J]. Langmuir, 2019, 35(37): 12100-12112. doi: 10.1021/acs.langmuir.9b01443 [14] HEWAGE S A, KEWALRAMANI J, MEEGODA J N. Stability of nanobubbles in different salts solutions [J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2021, 609: 125669. doi: 10.1016/j.colsurfa.2020.125669 [15] 董颖博, 张圆, 林海, 等. 焙烧温度对天然沸石物化性能的影响 [J]. 中国有色金属学报, 2017, 27(7): 1520-1526. DONG Y B, ZHANG Y, LIN H, et al. Effects of calcination temperature on physicochemical properties of natural zeolite [J]. The Chinese Journal of Nonferrous Metals, 2017, 27(7): 1520-1526(in Chinese).
[16] WANG L, MIAO X J, ALI J, et al. Quantification of oxygen nanobubbles in particulate matters and potential applications in remediation of anaerobic environment [J]. ACS Omega, 2018, 3(9): 10624-10630. doi: 10.1021/acsomega.8b00784 [17] 中华人民共和国国家环境保护总局. 中华人民共和国环保行业标准: 水质 硫酸盐的测定 铬酸钡分光光度法 HJ/T 342—2007[S]. 北京: 中国环境科学出版社, 2007. State Environmental Protection Administration of the People's Republic of China. Environmental Protection Standard of the People's Republic of China: Water quality-Determination of sulfate-Barium chromate spectrophotometry. HJ/T 342—2007[S]. Beijing: China Environment Science Press, 2007(in Chinese).
[18] 臧昆鹏, 王菊英, 赵化德, 等. 顶空平衡-双通道气相色谱法测定海水中溶解态甲烷和氧化亚氮 [J]. 环境化学, 2014, 33(12): 2094-2101. doi: 10.7524/j.issn.0254-6108.2014.12.018 ZANG K P, WANG J Y, ZHAO H D, et al. Simultaneous determination of dissolved CH4 and N2O in seawater using head space-dual channel GC system [J]. Environmental Chemistry, 2014, 33(12): 2094-2101(in Chinese). doi: 10.7524/j.issn.0254-6108.2014.12.018
[19] ZHANG H G, LYU T, BI L, et al. Combating hypoxia/Anoxia at sediment-water interfaces: A preliminary study of oxygen nanobubble modified clay materials [J]. Science of the Total Environment, 2018, 637/638: 550-560. doi: 10.1016/j.scitotenv.2018.04.284 [20] BASTVIKEN D, EJLERTSSON J, TRANVIK L. Measurement of methane oxidation in lakes: A comparison of methods [J]. Environmental Science & Technology, 2002, 36(15): 3354-3361. [21] GUO X P, YANG Y, NIU Z S, et al. Characteristics of microbial community indicate anthropogenic impact on the sediments along the Yangtze Estuary and its coastal area, China [J]. Science of the Total Environment, 2019, 648: 306-314. doi: 10.1016/j.scitotenv.2018.08.162 [22] JI X N, LIU C B, ZHANG M Y, et al. Mitigation of methylmercury production in eutrophic waters by interfacial oxygen nanobubbles [J]. Water Research, 2020, 173: 115563. doi: 10.1016/j.watres.2020.115563 [23] SAMKAMALESON A, GONSALVES M J. Role of sulfur-oxidizing bacteria on the ecology in tropical mangrove sediments [J]. Regional Studies in Marine Science, 2019, 28: 100574. doi: 10.1016/j.rsma.2019.100574 [24] CHEN M, JIAO Y Y, ZHANG Y Q, et al. Succession of sulfur bacteria during decomposition of cyanobacterial bloom biomass in the shallow Lake Nanhu: An ex situ mesocosm study [J]. Chemosphere, 2020, 256: 127101. doi: 10.1016/j.chemosphere.2020.127101 [25] ZHOU Y Q, XIAO Q T, YAO X L, et al. Accumulation of terrestrial dissolved organic matter potentially enhances dissolved methane levels in eutrophic lake Taihu, China [J]. Environmental Science & Technology, 2018, 52(18): 10297-10306. [26] 李思琦, 臧昆鹏, 宋伦. 湿地甲烷代谢微生物产甲烷菌和甲烷氧化菌的研究进展 [J]. 海洋环境科学, 2020, 39(3): 488-496. doi: 10.12111/j.mes20200325 LI S Q, ZANG K P, SONG L. Review on methanogens and methanotrophs metabolised by methane in wetland [J]. Marine Environmental Science, 2020, 39(3): 488-496(in Chinese). doi: 10.12111/j.mes20200325
[27] GÜLZOW W, GRÄWE U, KEDZIOR S, et al. Seasonal variation of methane in the water column of Arkona and Bornholm Basin, western Baltic Sea [J]. Journal of Marine Systems, 2014, 139: 332-347. doi: 10.1016/j.jmarsys.2014.07.013 [28] SCHELLER S, GOENRICH M, THAUER R K, et al. Methyl-coenzyme M reductase from methanogenic Archaea: Isotope effects on the formation and anaerobic oxidation of methane [J]. Journal of the American Chemical Society, 2013, 135(40): 14975-14984. doi: 10.1021/ja406485z [29] WONGNATE T, SLIWA D, GINOVSKA B, et al. The radical mechanism of biological methane synthesis by methyl-coenzyme M reductase [J]. Science, 2016, 352(6288): 953-958. doi: 10.1126/science.aaf0616 [30] NIU C Z, HE Z X, GE Y, et al. Effect of plant species richness on methane fluxes and associated microbial processes in wetland microcosms [J]. Ecological Engineering, 2015, 84: 250-259. doi: 10.1016/j.ecoleng.2015.09.007 [31] SHI W Q, PAN G, CHEN Q W, et al. Hypoxia remediation and methane emission manipulation using surface oxygen nanobubbles [J]. Environmental Science & Technology, 2018, 52(15): 8712-8717. -





 下载:
下载: