-
生物膜通常存在于水生系统中,其内存在水通道,水是饱和生物膜中关键的运输介质[1]。生物膜存在形式相比于游离态的细胞能更好地抵抗重金属的毒性[2]。然而,受重金属和其他污染物污染的土壤大多与非饱和生物膜有关[3]。非饱和生物膜内的传质与饱和生物膜内的传质有很大的不同,其内没有水通道[4]。此外,非饱和环境中的水以及土壤的物理化学性质将直接影响生物膜中微生物的生存和代谢活动。非饱和生物膜通常以细胞和微生物分泌的胞外聚合物(EPS)连接而成[5],这也是自然界最常见的细菌生长形式[6]。
胞外聚合物(EPS)主要由蛋白质、多糖以及少量核酸组成,在细菌抵抗外界环境胁迫中起着非常重要的作用[7]。EPS的产生可以形成一种含水微环境,有助于维持细胞环境的稳态,从而保护细胞免受环境压力和有毒物质的胁迫[8]。Zhang等[9]认为,EPS中多糖的增加是细菌抵抗高盐度胁迫的一种保护机制。Sheng等[10]发现,胞外蛋白的增加可以保护细胞免受有毒物质的侵害。EPS还能结合有毒重金属保护细胞免受有毒重金属的胁迫[11]。Sharma等[12]报道了细胞胞外沉淀是木糖氧化无色杆菌去除铅的主要机制。Hou等[13]也证实了EPS在Cu2+固定化中起着关键的作用。以往的研究都集中在饱和环境中环境压力和污染物对EPS的影响,虽然在土壤非饱和生物膜中EPS可能会出现类似的影响,但是EPS的产生和组成取决于生长条件[14]。因此,了解非饱和环境中环境压力和污染物对EPS的影响是生物修复技术的一个重要任务。
研究表明,Shewanella putrefaciens CN32能够降解多种重金属,并能够调节土壤中重金属的迁移[15-17]。本研究选择Shewanella putrefaciens CN32模拟在非饱和环境中生长的生物膜,探究在不同pH、温度、渗透压条件下非饱和生物膜的胞内外大分子物质的产生和组成变化。再将非饱和生物膜暴露于重金属铬,研究非饱和生物膜对铬的结合作用以及结合机理。
-
菌种:腐败希瓦氏菌CN32(Shewanella putrefaciens CN32)。
LB培养基[18]:10 g·L−1 蛋白胨,10 g·L−1 NaCl,5 g·L−1 酵母浸粉,用1 mol·L−1 NaOH和1 mol·L−1 HCl调至pH 7.0后121 ℃ 高压灭菌。
-
将−80 ℃下用70%甘油和30% LB保存的Shewanella putrefaciens CN32用LB培养基在30 ℃活化培养8 h,以此作为接种液。接种前将聚碳酸酯膜在121 ℃灭菌锅中灭菌20 min后,用无菌镊子将降温后的聚碳酸酯膜转移到固体LB培养基表面,用无菌移液枪取10 μL接种液接种到聚碳酸酯膜中心,为了防止培养皿干燥用parafilm封口膜封住培养基,在30 ℃厌氧培养箱中倒置培养以获取Shewanella putrefaciens CN32非饱和生物膜[11, 19]。对于含铬培养的生物膜,将生长Shewanella putrefaciens CN32非饱和生物膜的聚碳酸酯膜平铺于含0.125 mmol·L−1 K2Cr2O7 的固体培养基表面。
-
将聚碳酸酯膜连同Shewanella putrefaciens CN32非饱和生物膜用无菌镊子从固体培养基表面取出,悬浮在2 mL无菌的0.9% NaCl溶液中,涡旋振荡10 s后在OD600波长下测量细菌的生长情况。采用EDTA提取EPS[20-21],在10444 r·min-1、4 ℃下离心30 min后取上清液作为胶状胞外聚合物组分,样品于−20 ℃保存直到分析。剩余沉淀重悬浮于2 mL含10 mmol·L−1 EDTA的0.9% NaCl溶液里,室温静置2 h后在11441 r·min-1、4 ℃下离心30 min,得到的上清液即为蒴状胞外聚合物并且保存于−20 ℃直到分析。剩余菌体加入1 mL 1 mol·L−1 NaOH在80 ℃下水浴加热1 h后,加入1 mL 1 mol·L−1 HCl中和后得到细胞组分并保存于−20 ℃直到分析。多糖采用苯酚硫酸法测定,以葡萄糖为标准物质[22]。蛋白质采用Lowry法测定,以牛血清蛋白为标准物质[23]。
-
将培养好的非饱和生物膜放入聚四氟乙烯消解罐中,加入5 mL硝酸200 ℃消化2 h。将消化后的溶液用5% HCl稀释到最终体积为50 mL。采用电感耦合等离子体发射光谱仪(ICP-OES,AVIO 500)测定总Cr浓度[24]。Cr(Ⅵ)采用DPC分光光度法测定[25]。Cr(Ⅲ)含量即是总Cr与Cr(Ⅵ)的差值。
-
使用F-7000 FL分光光度计来获得EPS的三维荧光光谱(3D-EEM)。激发波长和发射波长范围为200 nm至500 nm,增量为5 nm,扫描速率为12000 nm·min−1[26]。
-
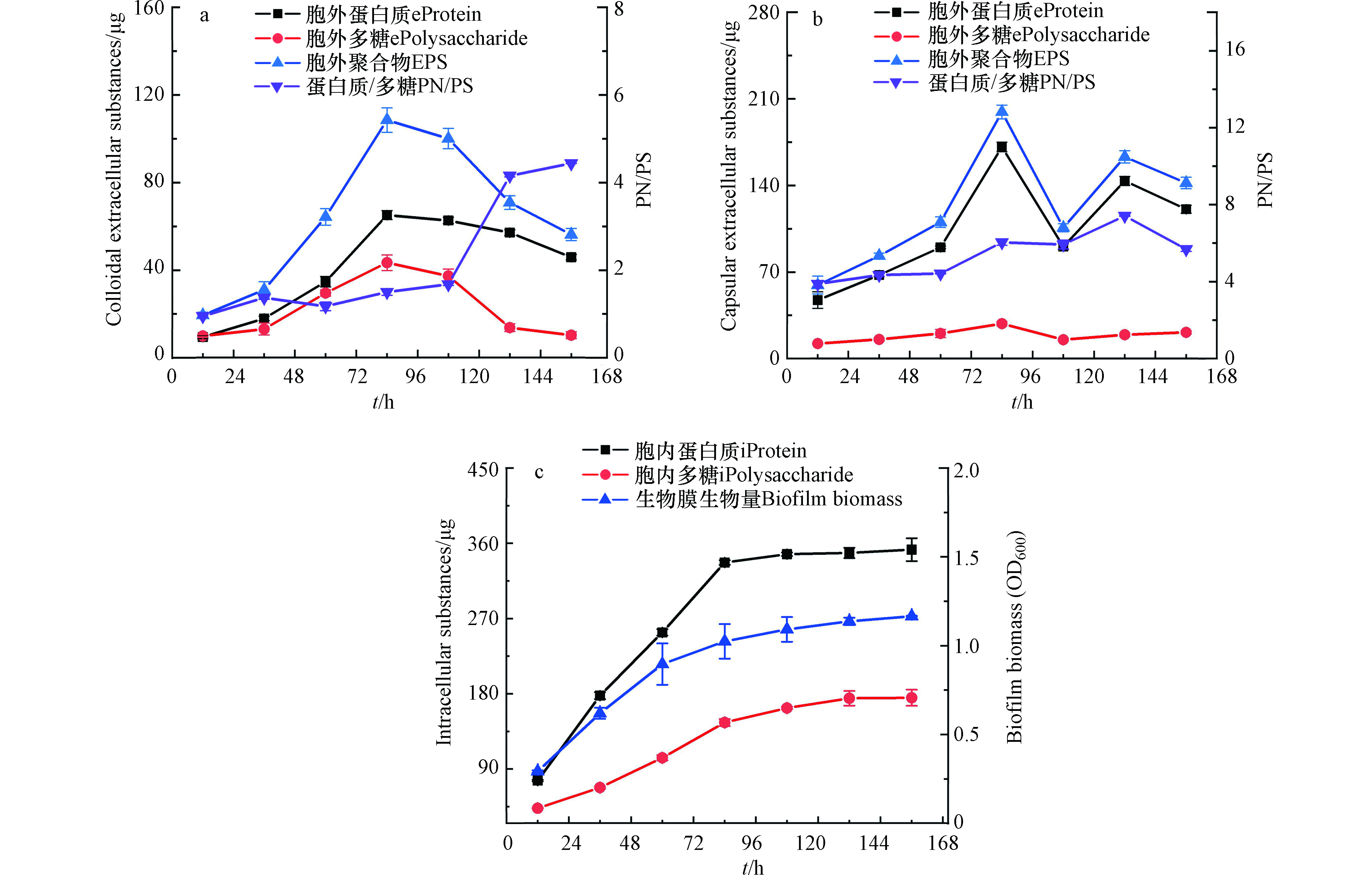
由图1可知,在生物膜培养初期,胞外聚合物就开始分泌,并随着微生物的生长而增加。在84 h时达到最大值,每片生物膜含有108.6 μg胶状胞外聚合物,199.4 μg蒴状胞外聚合物。84 h之后胞外聚合物中的蛋白和多糖浓度随着培养时间的增加逐渐降低。这是由于环境中的营养物质减少,微生物开始消耗胞外聚合物来维持自身生长所需的营养,其中胞外聚合物就为细菌提供了氮源和碳源。在胞外聚合物合成阶段,胞外聚合物以蛋白为主要组分,生长84 h的生物膜中,两种胞外聚合物的PN/PS分别为1.5和6.0。这说明蛋白质在Shewanella Putrefaciens CN32非饱和生物膜合成胞外聚合物中起着非常重要的作用[27]。
由图2可见,培养24 h后,Shewanella Putrefaciens CN32生物膜表面光滑,细胞与细胞之间存在明显的间隙。培养72 h后的生物膜中微生物细胞变得拥挤,细胞表面较24 h的模糊且细胞间有明显的深色物质。这说明随着生物膜的生长,生物膜内微生物分泌了大量的胞外聚合物。同时生物膜表面细胞的大小也发生了变化,培养72 h后的生物膜细胞大小相比于24 h的变小了。James等[28]认为, 减小细胞体积是微生物抵抗饥饿的一种机制。本实验中生物膜上层细胞远离培养基界面,摄取营养物质的阻力也因此增加,所以,在饥饿胁迫下表层细胞会减小细胞体积和分泌胞外聚合物来应对这种环境压力[6]。
-
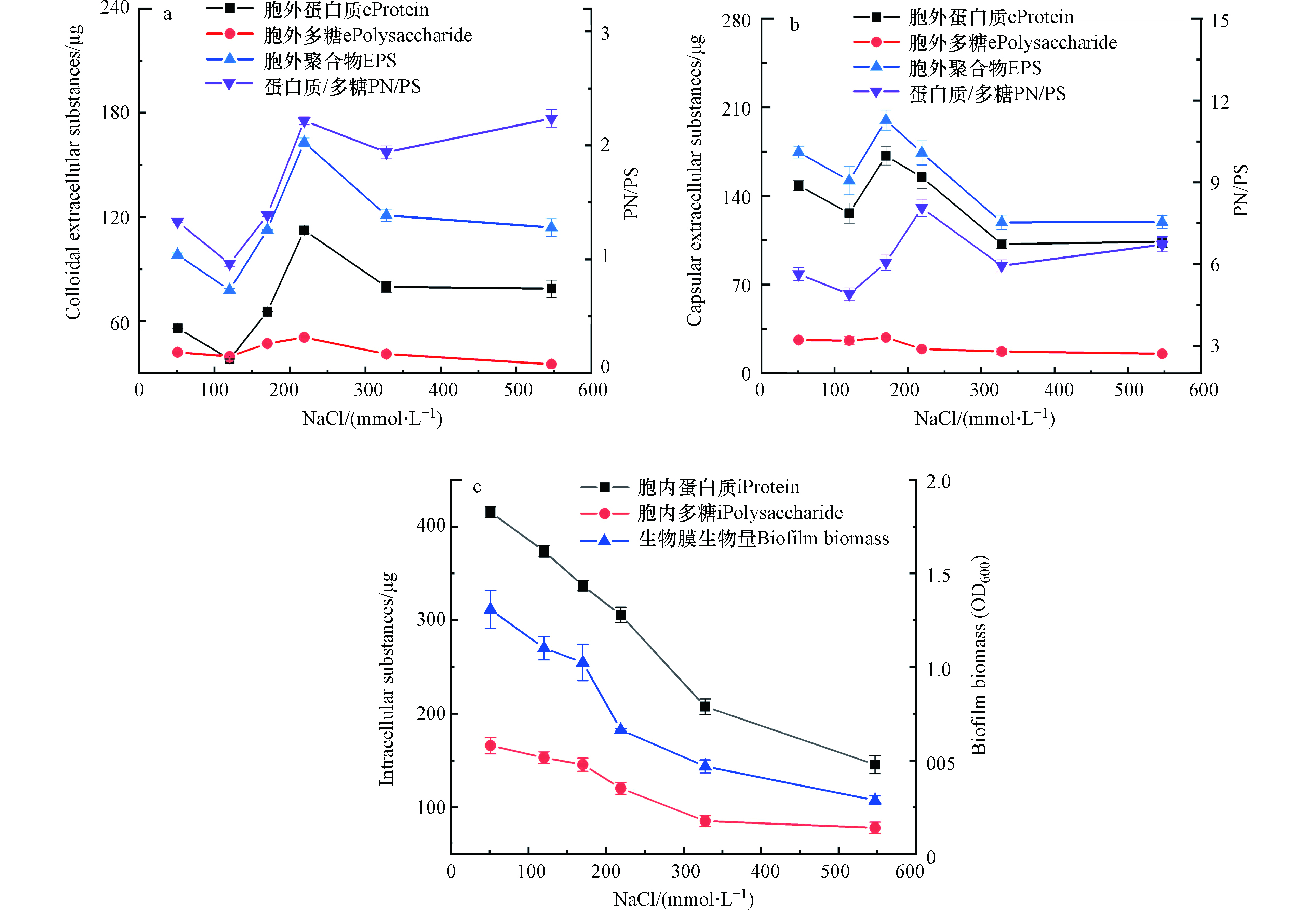
在土壤环境中,由于高盐度或水分蒸发等微生物经常受到高渗透压胁迫[8]。由图3和图4可知,与51 mmol·L−1 NaCl相比,219 mmol·L−1 NaCl下生物膜的生物量下降,OD600从1.3减小到0.66,但胞外聚合物的分泌量却显著增加,其中以胶状胞外聚合物的增加最为明显,从98.2 μg增加到163.0 μg。这说明一定强度的渗透压能促进胞外聚合物的分泌,同时胞外聚合物能减缓高渗透压应力对细胞的影响,这是微生物应对环境压力胁迫的一种保护机制[9]。胞外聚合物的合成可以在细胞周围形成一个含水微环境,这种含水微环境可以作为一道微生物抵抗外界压力胁迫的缓冲屏障[8]。
生物膜生长在高渗透压环境下虽然合成了大量的胞外聚合物,但是细胞褶皱现象依然存在。这说明胞外聚合物能减缓外界环境压力对生物膜中细胞的影响,但不能阻止细胞因高渗透压环境胁迫而引起的细胞褶皱。这与Lin等[20]的研究结果一致。219 mmol·L−1 NaCl下胞外聚合物分泌量达到了最大,每片生物膜胞外聚合物总量为337.1 μg,51 mmol·L−1 NaCl和547 mmol·L−1 NaCl处每片生物膜胞外聚合物总量分别为272.8 μg和233.3 μg。219 mmol·L−1 NaCl显著刺激了胞外蛋白的增加,其中胶状胞外聚合物的PN/PS达到了2.5,约为120 mmol·L−1 NaCl时的2倍。这说明低渗透压和高渗透压都会抑制生物膜分泌胞外聚合物,但一定强度渗透压环境会促进微生物分泌更多胞外聚合物,其中蛋白质占主要成分.
-
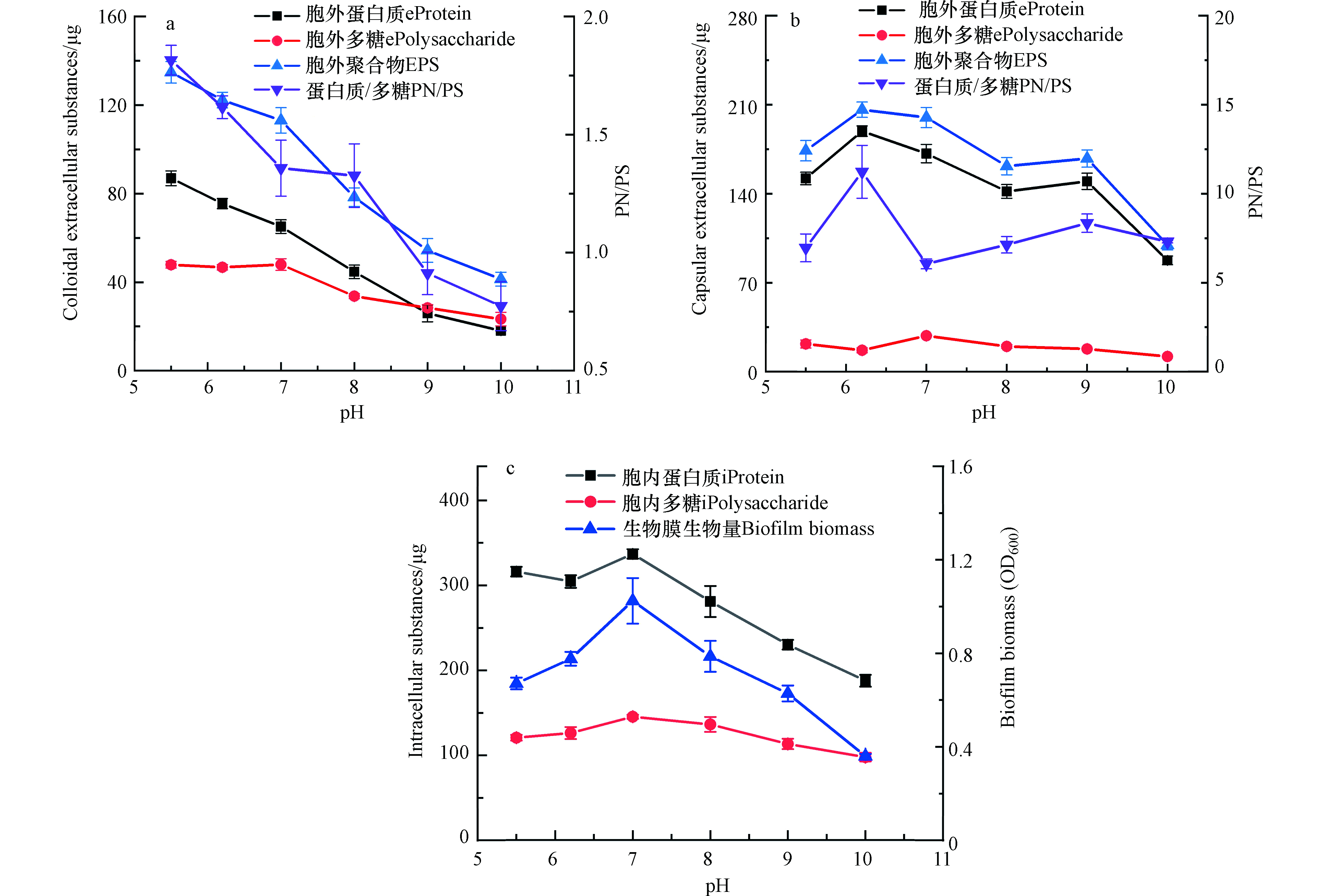
由图5可见,中性环境(pH 7.0)下生物膜的OD600为1.0,酸性环境(pH 5.5)和碱性环境(pH 10.0)下OD600分别为0.7和0.4,说明酸性环境和碱性环境都抑制了生物膜的生长。
但酸性环境下胞外聚合物的量却显著增加,pH 6.2时,每片生物膜胞外聚合物总量达到了320 μg。胞外聚合物的产生有助于维持水化微环境,有助于调节胞内微环境pH和维持胞内水份平衡,从而保护细胞免受pH变化的胁迫[8, 29]。在酸性环境(pH 6.2)下两种胞外聚合物中PN/PS分别为1.6和11.2,而在碱性环境(pH 10.0)下两种胞外聚合物的PN/PS分别为0.8和7.3,蛋白在胞外聚合物中的占比明显降低,说明碱性环境会抑制Shewanella Putrefaciens CN32胞外聚合物合成蛋白质。这也说明微生物在不同环境pH下,其分泌的胞外聚合物组成也会不同。
-
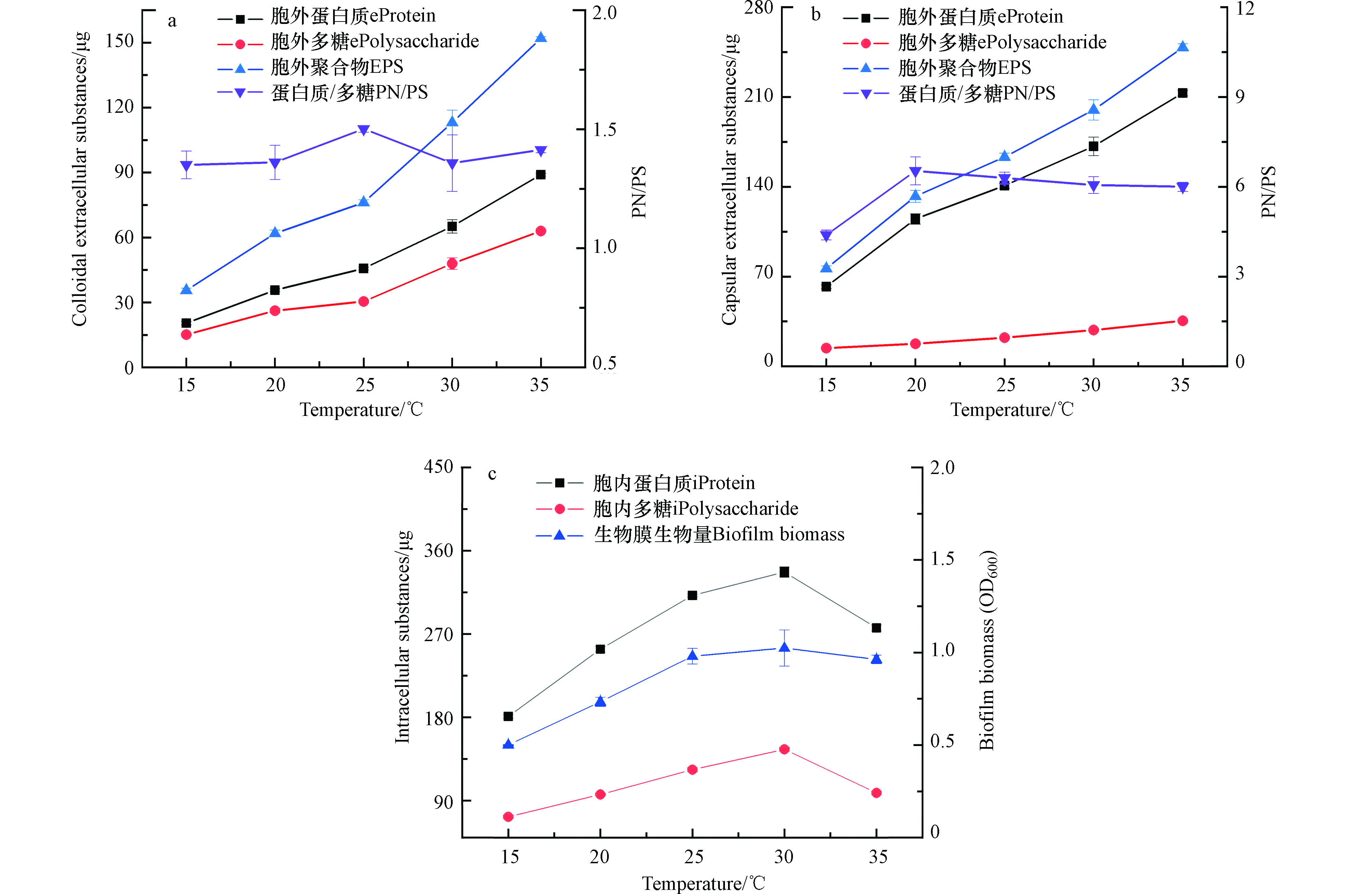
环境中温度的变化也是影响微生物生长的主要因素。由图6可见,30 ℃左右是Shewanella putrefaciens CN32最适生长温度,此时的生物量最大,OD600为1.02。而15 ℃和35 ℃下的生物膜OD600分别为0.5和0.9,低温和高温都抑制了生物膜的生长。但生物膜胞外大分子物质的分泌量随着培养温度的升高都增加,35 ℃的胞外大分子物质分泌量最大,每片生物膜胞外聚合物总量为400.6 μg。35 ℃下两种胞外聚合物的PN/PS分别为1.4和6.0,胞外聚合物的增加主要是由于胞外蛋白的增加,但是微生物细胞在高温下也会裂解,这可能也是胞外大分子物质分泌增加的一种原因[19]。在非饱和环境中,水分在高温下不易保持,微生物分泌胞外聚合物利于生物膜形成一种含水微环境,使微生物不会因高温失水而死亡[8].
-
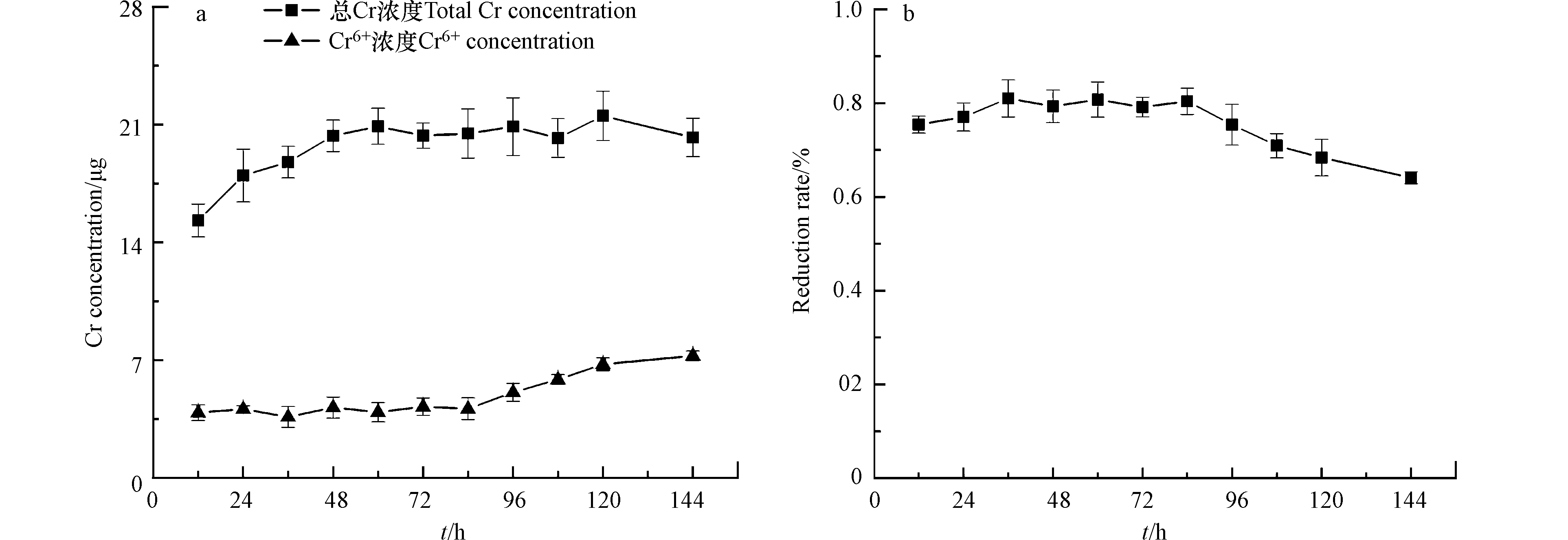
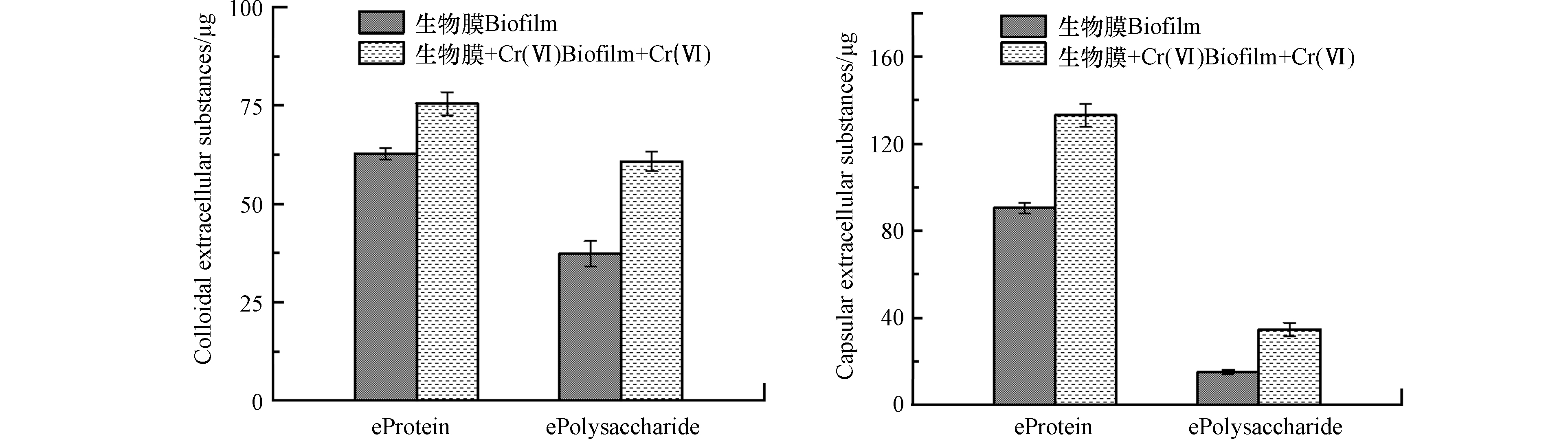
从图7和图8可以看出,在实验初期生物膜对铬的吸附呈增加趋势,72 h之后趋于平缓,120 h处每片生物膜吸附了21.5 μg Cr达到最大值。相比于不添加Cr培养的生物膜,添加Cr培养的生物膜胶状胞外聚合物中蛋白和多糖增加了20.3%和62.6%,蒴状胞外聚合物中蛋白和多糖明显增加了47.0%和127%,说明生物膜在受外界重金属毒害时会刺激分泌更多的胞外聚合物来维持自身活性[30]。72 h Cr的还原率达到最高为80%,144 h的还原率为64%。可以猜测随着铬不断地被吸附到细胞表面,细胞长期处于铬的胁迫下,从而使细胞活性受到影响,导致生物膜对铬的还原效率明显降低。说明生物膜在铬的胁迫下影响了微生物活性,从而对铬的还原随之减小[31]。
-
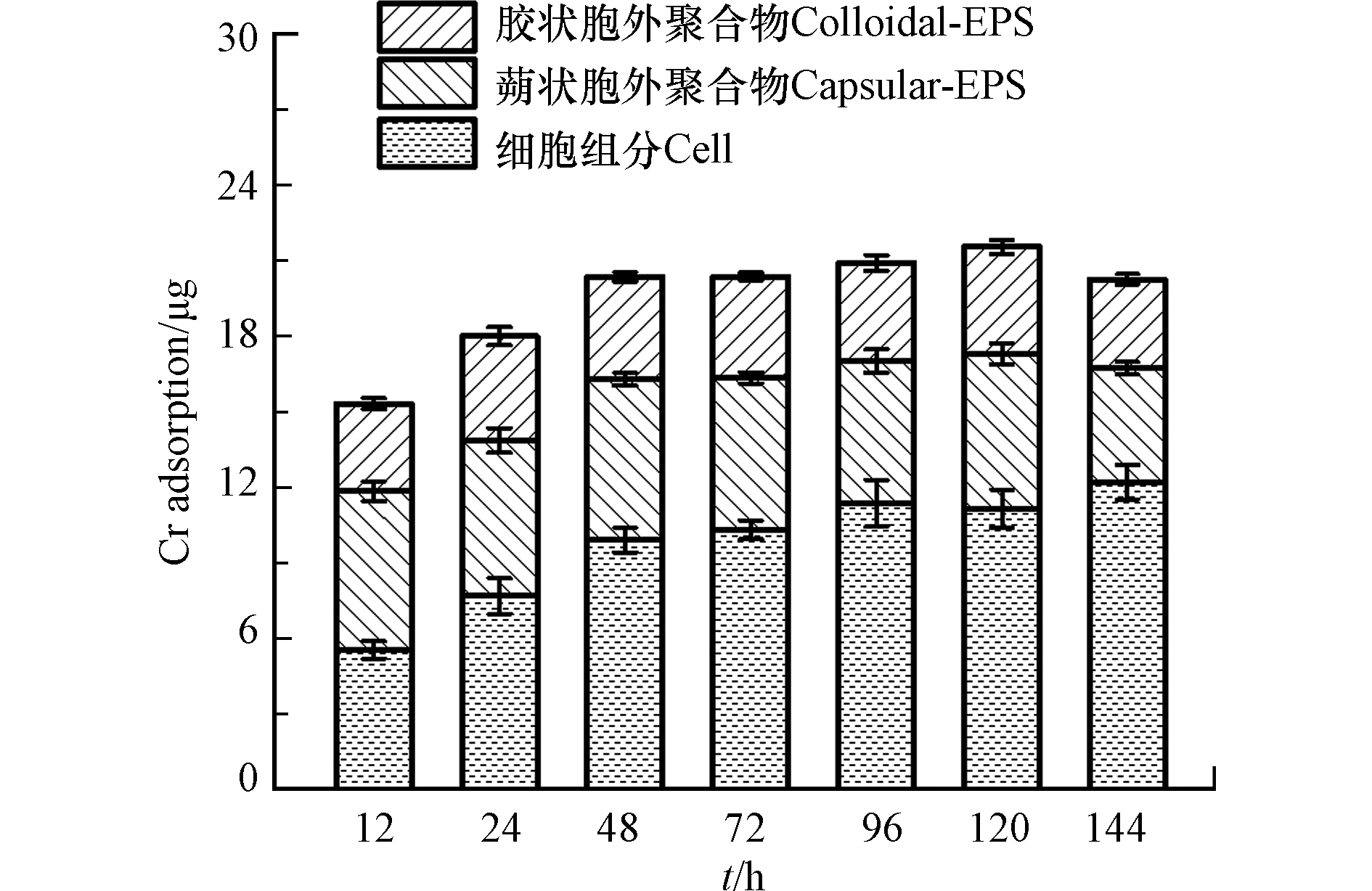
由图9可知,12 h处铬在生物膜不同组分中的占比分别为:胶状胞外聚合物22.7%,蒴状胞外聚合物41.1%,细胞组分36.2%。生长12 h的每片生物膜中胞外聚合物吸附了9.77 μg Cr,占生物膜总吸附量的63.8%。说明胞外聚合物是生物膜中铬的主要络合物,Teng等[32]报道了胞外聚合物组分是重金属的主要分布区。
生长96 h的每片生物膜中细胞组分吸附了11.4 μg Cr,占每片生物膜Cr总吸附量的50%。与水相饱和生物膜吸附重金属不一样,非饱和生物膜中细胞组分也会吸附大量的重金属,这可能是由于细胞在非饱和环境中处于一种营养饥饿状态。Kong等[33]就报道了饥饿状态下的细胞会吸附更多的重金属Cr到细胞壁上,导致细胞组分吸附了大量的重金属。
-
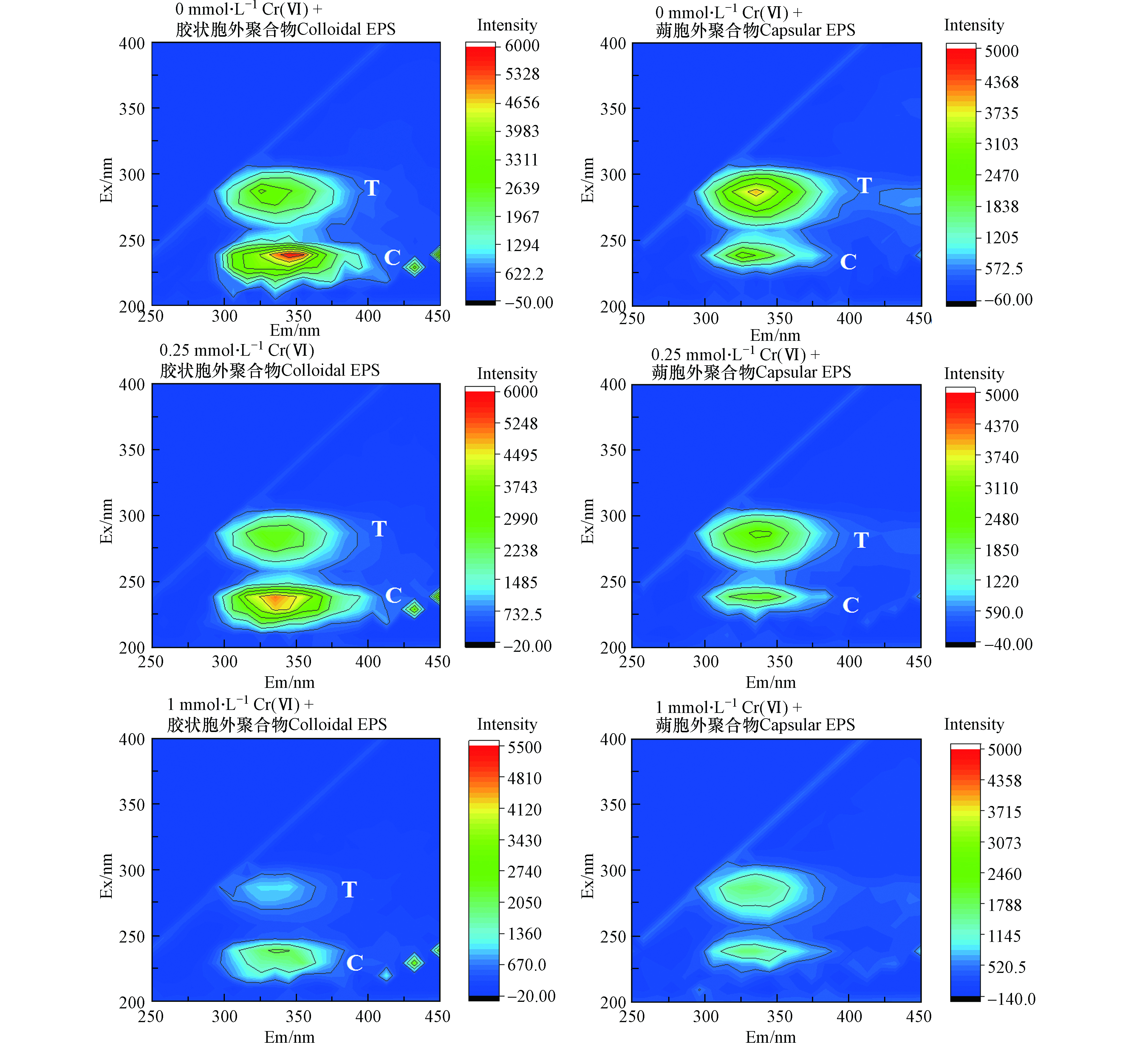
三维荧光光谱(3D-EEM)可以获得激发波长和发射波长的强度信息,由于具有高灵敏度和选择性的优点,被广泛应用于各种环境下有机物的表征[34]。0、0.25、1 mmol·L−1 Cr6+培养120 h后Shewanella putrefaciens CN32不同细胞胞外聚合物组分3D-EEM如图10所示。
从胞外聚合物在激发/发射(Ex/Em)处的EEM荧光光谱中可以很容易地识别出两个峰:280/(330—340) nm(peak T),230/(320—340) nm(peak C)。峰T与色氨酸蛋白类物质有关[35],峰C与芳香类蛋白物质有关如酪氨酸[36]。从图中可以观察到Cr(Ⅵ)对胞外聚合物的3D-EEM荧光强度有很大影响,随着Cr(Ⅵ)浓度增加荧光强度减小。胶状胞外聚合物和蒴状胞外聚合物具有相似荧光峰的位置,但是它们的荧光强度不同。在胶状胞外聚合物中,随着培养基Cr(Ⅵ)的浓度逐渐增加,荧光峰T和C的荧光强度都有所减弱,当Cr(Ⅵ)浓度为1 mmol·L−1时,T峰几乎消失。在蒴状胞外聚合物中,荧光峰T和C也出现了胶状胞外聚合物中同样的情况,当Cr(Ⅵ)浓度为1 mmol·L−1时,峰T和C都几乎消失。这说明峰T和C代表的有机荧光团与Cr(Ⅵ)发生了反应。并且不同胞外聚合物中的荧光团与Cr(Ⅵ)的反应能力也不同。此外,吸附Cr后胞外聚合物的荧光强度明显减小,这说明蛋白类物质中的色氨酸物质与酪氨酸物质可能在吸附过程对铬胁迫的抗性中起重要作用。Wang等[37]报道芳香类蛋白物质的合成更容易受Cr(Ⅵ)浓度的增加的影响,本实验也发现类似的结果,与空白EPS的荧光光谱相比,峰C的位置比峰T的位置变化更明显。Long等[24]报道了在P. saccharolyticum LY10 非饱和生物膜中Cr(Ⅲ)存在形式有Cr(Ⅲ)-半胱胺酸、Cr(Ⅲ)-组氨酸、Cr(Ⅲ)-醋酸等有机络合物的形式存在。因此,Shewanella putrefaciens CN32中的Cr可能是以Cr(Ⅲ)络合物的形式存在。结合三维荧光光谱结果可知很有可能是以Cr(Ⅲ)-色氨酸或者Cr(Ⅲ)-酪氨酸络合物形式存在。
-
本研究结果表明Shewanella putrefaciens CN32非饱和生物膜胞内外大分子物质的组成和产生会随着环境条件的变化而变化,一定强度的渗透压、低pH和高温能促进生物膜分泌更多的胞外聚合物。在非饱和生物膜与Cr相互作用中,发现胞外聚合物(EPS)是生物膜结合Cr的主要部位,其中与饱和生物膜不同的是非饱和生物膜中细胞组分也会吸附大量的Cr,这是由于非饱和环境下的营养不足导致细胞组分较饱和生物膜吸附更多的Cr。三维荧光光谱分析表明非饱和生物膜的胞外聚合物中主要含色氨酸和酪氨酸蛋白类物质,并且在与Cr的络合中起着重要的作用。这些结果显著提高了我们对Cr在非饱和生物膜系统中的存在和分布的理解,为土壤生物修复技术提供了更多的可能。
Shewanella putrefaciens CN32非饱和生物膜对环境压力的响应以及与铬的作用
Responses of Shewanella putrefaciens CN32 unsaturated biofilms to environmental stress and interaction with chromium
-
摘要: Shewanella putrefaciens CN32模拟在非饱和环境中生长的生物膜,探究不同环境条件对非饱和生物膜胞内外大分子物质的影响,以及生物膜对重金属Cr的作用。在84 h、219 mmol·L−1 NaCl、pH 6.2和35 ℃条件下,生物膜分泌胞外聚合物的量达到最大,每片生物膜胞外聚合物总量为400.6 μg;生长12 h的每片生物膜中胞外聚合物吸附了9.77 μg Cr,占生物膜总吸附量的63.8%;三维荧光光谱表明,生物膜吸附Cr后胞外聚合物中色氨酸蛋白类物质与酪氨酸蛋白类物质荧光强度明显降低。结果表明,一定强度的渗透压、低pH和高温能促进生物膜分泌更多的胞外聚合物。非饱和生物膜中,胞外聚合物是重金属Cr的主要结合区域,并且胞外聚合物中的色氨酸蛋白类物质与酪氨酸蛋白类物质可能在与Cr络合中起重要作用。Abstract: Shewanella putrefaciens CN32 was selected to simulate the biofilm growing in unsaturated environment. The influence of different environmental factors on the extracellular and intracellular macromolecular substances of unsaturated biofilms, as well as the interactions between the unsaturated biofilms and heavy metal Cr were explored. Under the conditions of 84 h, 219 mmol·L−1 NaCl, pH 6.2 and 35°C, the extracellular polymeric substances (EPS) secreted by biofilms reached the maximum content of 400.6 μg per biofilm. The EPS in each biofilm grown for 12 h adsorbed 9.77 μg Cr, accounting for 63.8% of the total amount of the adsorbed Cr. Three-dimensional fluorescence spectroscopy shows that the fluorescence intensities of tryptophan and tyrosine proteins in the EPS was significantly reduced after Cr adsorption. In addition, a certain strength of osmotic pressure, low pH and high temperature could promote the EPS secretion by the biofilms. The EPS in the unsaturated biofilms were the main binding area of Cr, and the tryptophan and tyrosine proteins were suggested to play an important role in the complexation between biofilms and Cr.
-
Key words:
- unsaturated biofilms /
- Cr /
- extracellular polymeric substances /
- complexation
-

-
-
[1] PHOENIX V R, HOLMES W M. Magnetic resonance imaging of structure, diffusivity, and copper immobilization in a phototrophic biofilm [J]. Applied and Environmental Microbiology, 2008, 74(15): 4934-4943. doi: 10.1128/AEM.02783-07 [2] JOE J H, HOWARD C, RAYMOND J T. Multimetal resistance and tolerance in microbial biofilms [J]. Nature Reviews Microbiology, 2007, 5(12): 928-938. doi: 10.1038/nrmicro1774 [3] YAO Y J, SHEN R, PENNELL K G, et al. Examination of the influence of environmental factors on contaminant vapor concentration attenuation factors using the US EPA's vapor intrusion database [J]. Environmental Science & Technology, 2013, 47(2): 906-913. [4] HOLDEN P A, HUNT J R, FIRESTONE M K. Toluene diffusion and reaction in unsaturated Pseudomonas putida biofilms [J]. Biotechnology and Bioengineering, 1997, 56(6): 656-670. doi: 10.1002/(SICI)1097-0290(19971220)56:6<656::AID-BIT9>3.0.CO;2-M [5] MERCAN DOGAN N, KANTAR C, DOGAN G. Effect of chromium and organic acids on microbial growth and exopolymeric substance production by Pseudomonas Bacteria [J]. Clean Soil Air Water, 2014, 42(5): 674-681. doi: 10.1002/clen.201300158 [6] STEINBERGER R E, ALLEN A R, HANSMA H G, et al. Elongation correlates with nutrient deprivation in Pseudomonas aeruginosa unsaturated biofilms [J]. Microbial Ecology, 2002, 43(4): 416-423. doi: 10.1007/s00248-001-1063-z [7] JEFFERSON K K. What drives bacteria to produce a biofilm? [J]. FEMS Microbiology Letters, 2004, 236(2): 163-173. doi: 10.1111/j.1574-6968.2004.tb09643.x [8] CHANG W S, VAN M, NIELSEN L, et al. Alginate production by Pseudomonas putida creates a hydrated microenvironment and contributes to biofilm architecture and stress tolerance under water-limiting conditions [J]. Journal of Bacteriology, 2007, 189(22): 8290-8299. doi: 10.1128/JB.00727-07 [9] ZHANG Z J, CHEN S H, WANG S M, et al. Characterization of extracellular polymeric substances from biofilm in the process of starting-up a partial nitrification process under salt stress [J]. Applied Microbiology and Biotechnology, 2011, 89(5): 1563-1571. doi: 10.1007/s00253-010-2947-y [10] SHENG G P, YU H Q, YUE Z B. Production of extracellular polymeric substances from Rhodopseudomonas acidophila in the presence of toxic substances [J]. Applied Microbiology and Biotechnology, 2005, 69(2): 216-222. doi: 10.1007/s00253-005-1990-6 [11] PRIESTER J H, OLSON S G, WEBB S M, et al. Enhanced exopolymer production and chromium stabilization in Pseudomonas putida unsaturated biofilms [J]. Applied and Environmental Microbiology, 2006, 72(3): 1988-1996. doi: 10.1128/AEM.72.3.1988-1996.2006 [12] SHARMA J, SHAMIM K, DUBEY S K. Phosphatase mediated bioprecipitation of lead as pyromorphite by Achromobacter xylosoxidans [J]. Journal of Environmental Management, 2018, 217: 754-761. doi: 10.1016/j.jenvman.2018.04.027 [13] HOU W, MA Z, SUN L, et al. Extracellular polymeric substances from copper-tolerance Sinorhizobium meliloti immobilize Cu2+ [J]. Journal of Hazardous Materials, 2013, 261: 614-620. doi: 10.1016/j.jhazmat.2013.06.043 [14] SUTHERLAND I. Biofilm exopolysaccharides: A strong and sticky framework [J]. Microbiology (Reading, England), 2001, 147(1): 3-9. doi: 10.1099/00221287-147-1-3 [15] BURGOS W D, SENKO J M, DEMPSEY B A, et al. Soil humic acid decreases biological uranium (Ⅵ) reduction by Shewanella putrefaciens CN32 [J]. Environmental Engineering Science, 2007, 24(6): 755-761. doi: 10.1089/ees.2006.0009 [16] PAUL C C, STONE J J. Effects of nickel and soil humic acid during biological hematite reduction by Shewanella putrefaciens CN32 [J]. Environmental Engineering Science, 2009, 26(4): 841-848. doi: 10.1089/ees.2008.0254 [17] BURKHARDT E M, BISCHOFF S, AKOB D M, et al. Heavy metal tolerance of Fe(Ⅲ)-reducing microbial communities in contaminated creek bank soils [J]. Applied and Environmental Microbiology, 2011, 77(9): 3132-3136. doi: 10.1128/AEM.02085-10 [18] LIU L C, LIU G F, ZHOU J T, et al. Improved bioreduction of nitrobenzene by black carbon/biochar derived from crop residues [J]. RSC Advances, 2016, 6(87): 84388-84396. doi: 10.1039/C6RA11671J [19] AUERBACH I D, SORENSEN C, HANSMA H G, et al. Physical morphology and surface properties of unsaturated Pseudomonas putida biofilms [J]. Journal of Bacteriology, 2000, 182(13): 3809-3815. doi: 10.1128/JB.182.13.3809-3815.2000 [20] LIN H R, CHEN G C, LONG D Y, et al. Responses of unsaturated Pseudomonas putida CZ1 biofilms to environmental stresses in relation to the EPS composition and surface morphology [J]. World Journal of Microbiology and Biotechnology, 2014, 30(12): 3081-3090. doi: 10.1007/s11274-014-1735-8 [21] AGUILERA A, SOUZA-EGIPSY V, SAN MARTÍN-ÚRIZ P, et al. Extraction of extracellular polymeric substances from extreme acidic microbial biofilms [J]. Applied Microbiology and Biotechnology, 2008, 78(6): 1079-1088. doi: 10.1007/s00253-008-1390-9 [22] DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances [J]. Analytical Chemistry, 1956, 28(3): 350-356. doi: 10.1021/ac60111a017 [23] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry, 1976, 72: 248-254. doi: 10.1016/0003-2697(76)90527-3 [24] LONG D Y, ZOU L N, HASHMI M Z, et al. Determination of the accumulation, spatial distribution and reduction of Cr in unsaturated Pseudochrobactrum saccharolyticum LY10 biofilms by X-ray fluorescence and absorption methods [J]. Chemical Engineering Journal, 2015, 280: 763-770. doi: 10.1016/j.cej.2015.06.013 [25] URONE P F. Stability of colorimetric reagent for chromium, s-diphenylcarbazide, in various solvents [J]. Analytical Chemistry, 1955, 27(8): 1354-1355. doi: 10.1021/ac60104a048 [26] LIU J, YANG Q, WANG D, et al. Enhanced dewaterability of waste activated sludge by Fe(Ⅱ)-activated peroxymonosulfate oxidation [J]. Bioresource Technology, 2016, 206: 134-140. doi: 10.1016/j.biortech.2016.01.088 [27] YUE Z B, LI Q, LI C C, et al. Component analysis and heavy metal adsorption ability of extracellular polymeric substances (EPS) from sulfate reducing bacteria [J]. Bioresource Technology, 2015, 194: 399-402. doi: 10.1016/j.biortech.2015.07.042 [28] JAMES G A, KORBER D R, CALDWELL D E, et al. Digital image analysis of growth and starvation responses of a surface-colonizing Acinetobacter sp [J]. Journal of Bacteriology, 1995, 177(34): 907-915. [29] REVA O N, WEINEL C, WEINEL M, et al. Functional genomics of stress response in Pseudomonas putida KT2440 [J]. The Journal of Bacteriology, 2006, 188(11): 4079-4092. doi: 10.1128/JB.00101-06 [30] ZHANG L L, CHEN X, CHEN J M, et al. Role mechanism of extracellular polymeric substances in the formation of aerobic granular sludge [J]. Chinese Journal of Environmental Science, 2007, 28(4): 795-799. [31] MIDDLETON S S, LATMANI R B, MACKEY M R, et al. Cometabolism of Cr(VI) by Shewanella oneidensis MR-1 produces cell-associated reduced chromium and inhibits growth [J]. Biotechnology and Bioengineering, 2003, 83(6): 627-637. doi: 10.1002/bit.10725 [32] TENG Z, SHAO W, ZHANG K, et al. Pb biosorption by Leclercia adecarboxylata: Protective and immobilized mechanisms of extracellular polymeric substances [J]. Chemical Engineering Journal, 2019, 375: 122113. doi: 10.1016/j.cej.2019.122113 [33] KONG S, YONGE D R, JOHNSTONE D L, et al. Chromium distribution in subcellular components between fresh and starved subsurface bacterial consortium [J]. Biotechnology Letters, 1992, 14(6): 521-524. doi: 10.1007/BF01023179 [34] SHENG G P, XU J, LUO H W, et al. Thermodynamic analysis on the binding of heavy metals onto extracellular polymeric substances (EPS) of activated sludge [J]. Water Research, 2013, 47(2): 607-614. doi: 10.1016/j.watres.2012.10.037 [35] CHEN W, WESTERHOFF P, LEENHEER J A, et al. Fluorescence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter [J]. Environmental Science & Technology, 2003, 37(24): 5701-5710. [36] ZHU L, QI H Y, LV M L, et al. Component analysis of extracellular polymeric substances (EPS) during aerobic sludge granulation using FTIR and 3D-EEM technologies [J]. Bioresource Technology, 2012, 124: 455-459. doi: 10.1016/j.biortech.2012.08.059 [37] WANG Z, GAO M, WANG S, et al. Effect of hexavalent chromium on extracellular polymeric substances of granular sludge from an aerobic granular sequencing batch reactor [J]. Chemical Engineering Journal, 2014, 251: 165-174. doi: 10.1016/j.cej.2014.04.078 -



 下载:
下载: