-
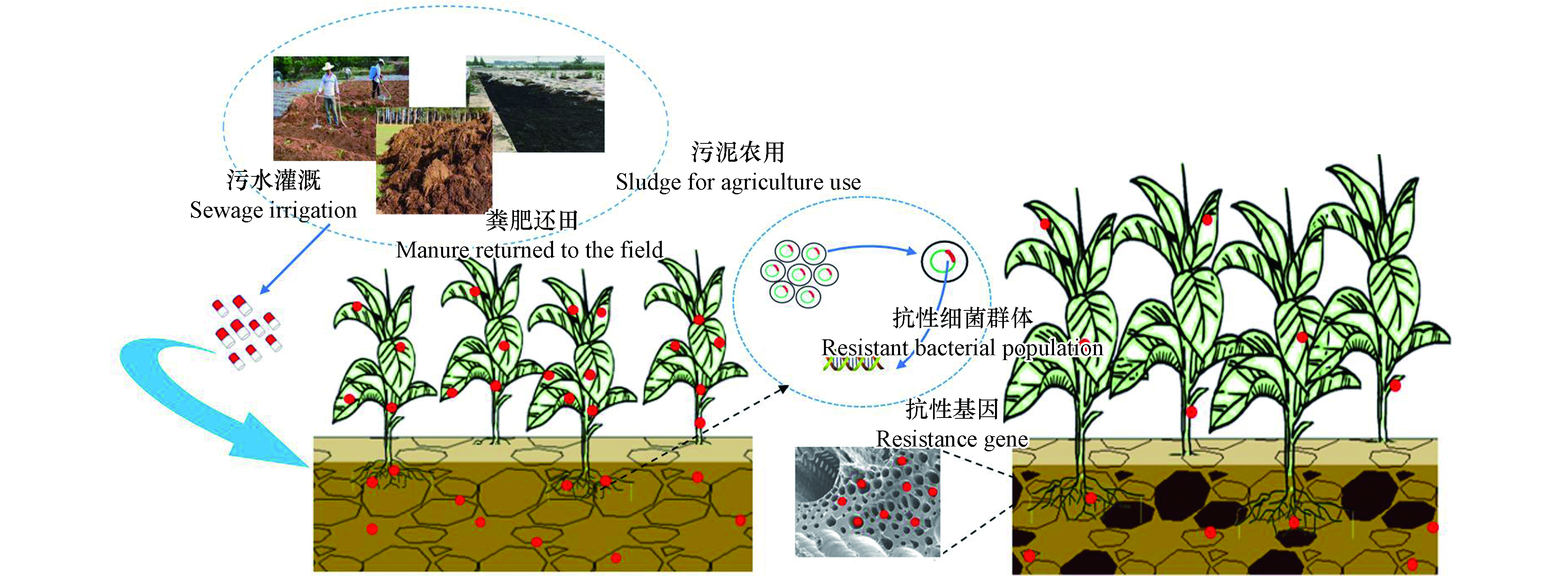
抗生素在世界范围内广泛应用于人类医疗和养殖疾控、增产,污水灌溉、污泥农用、粪肥还田等是抗生素进入土壤的主要途径。土壤中的抗生素一方面会在农作物中富集,并可能通过食物链直接进入人体;另一方面,对土壤生态系统产生影响,并可能通过地表径流释放到水生态系统中。更重要的是,抗生素残留物有可能诱导产生抗生素抗性细菌(antibiotic‒resistant bacteria,ARB),并促进抗生素抗性基因的出现(antibiotic resistance genes,ARGs),构成严重的公共健康风险[1]。全球与耐药性有关的疾病已经每年导致至少70万人死亡,如果不能减缓耐药性上升,到2050年,耐药感染人数的增加将导致每年1000万人死亡和累计100万亿美元的经济损失[2]。因此,如何降低土壤中抗生素和ARGs及其生物有效性已成为全球日益关注的问题。
生物炭作为一种土壤改良剂,不仅在增加土壤碳汇、提高土壤持水能力和促进土壤肥力等方面具有重要的作用,而且因其多级孔隙结构和丰富的表面官能团具有较强的吸附能力,同时具有固定土壤中重金属和有机污染物的能力,从而降低污染物在土壤中的迁移和生物利用度[3-5]。生物炭通过分配作用、静电引力、表面络合、离子交换、π−π电子供受体相互作用等对吸附抗生素具有潜力[6-7],添加到土壤中可通过改良土壤的孔隙结构,增强土壤的吸附能力,降低抗生素可迁移态,减少抗生素污染地下水和地表水[8]。
本文从我国土壤中抗生素和ARGs污染现状和潜在风险出发,就生物炭添加对土壤吸附-解吸抗生素的影响及其机理,对土壤中抗生素和ARGs迁移、消散和生物有效性的影响,对土壤中酶和微生物的影响分别进行了概述,并对生物炭控制土壤中抗生素和抗性基因的研究前景进行了展望。
-
我国是世界上抗生素生产和使用量最大的国家,2013年生产和使用量分别约为24.8万吨和16.2万吨,其中48%用于人类,其余用于动物,使用量是美国的9倍,英国的150倍[9]。我国人类疾病治疗处方中有70%是抗生素,而西方国家只有30%[10]。动物施用抗生素后,30%—90%的母体化合物被排泄,另外抗生素代谢产物在排泄后也可以转化回母体化合物[11],其中超过一半最终进入土壤颗粒[12]。我国频繁检出的36种抗生素的排放量约为5.38万吨,其中54%进入土壤环境[9]。
我国关于土壤样品中抗生素残留的研究主要集中在人口密集区,包括海河流域(北京和天津)、长江流域(特别是上海周边)、黄河流域(陕西周边)、珠江流域(广州周边)、东南诸河流域(厦门周边);土壤样品中检出44种抗生素,包括9种大环内酯类,16种喹诺酮类、15种磺胺类和4种四环素类,检出率分别为81.0%、100%、98.7%和88.2%,平均浓度分别为34.5、34.5、14.7、94.3 μg·kg−1,不同抗生素在不同地区的浓度有所不同,浓度范围为1.55 μg·kg−1—1.85 mg·kg−1;其中,四环素类和喹诺酮类更容易被土壤吸收并持久残留,是土壤样品中检测到的主要抗生素[1]。
土壤中抗生素残留所产生的选择压力是影响ARGs在土壤中传播的主要因素[13]。四川省、乌梁素海流域和长江三角洲农业土壤样品中ARGs检出率分别为58.7%、75.0%和100.0%,相对丰度分别为6×10−3—1.8×10−2、2.18×10−6—1.9×10−2和1.01×10−7—2.31×10−1[14-16]。全国农业土壤中的磺胺和四环素抗性基因的相对丰度范围分别为10−6—10−2和10−8—10−2[17]。
土壤中残留的抗生素能被植物吸收积累,影响植物的生长发育;对土壤动物产生基因毒性,影响动物体内微生物组;降低土壤微生物的生物量和多样性,影响土壤中酶活性;诱导产生ARB,并促进ARGs的出现。土壤中的抗生素可能通过作物吸收和食物链富集,地表径流和饮用水进入人体,经长期积累后引起器官病变或产生耐药性,导致一系列疾病或者无药可医。磺胺二甲基嘧啶、金霉素和强力霉素是畜禽粪便改良土壤中最关键的抗生素,在施用量为9500 kg dm·(ha year)−1时为高风险[18]。
-
生物炭可以定义为一种通过生物质热解产生的材料,施用于土壤可持续地固碳并同时改善土壤质量,来源广泛、制备简单、成本低廉、环境友好[4-5]。生物炭对抗生素吸附效果好[6-7],而吸附-解吸是影响抗生素在土壤中迁移、消散以及生物有效性的主要过程,大多数研究表明生物炭添加提高了土壤对抗生素的吸附[19-27],且通常随着生物炭添加量的增加,吸附量逐渐增加[19, 21-22, 26-27],另外,低初始浓度下,初始反应速率提高,高初始浓度下,延长反应速率提高[19]。然而,Vithanage等[28]、Srinivasan和Sarmah[29]研究表明添加低温热解生物炭的土壤对磺胺二甲基嘧啶、磺胺甲恶唑的吸附潜力有限,轩盼盼等[30]和He等[31]研究表明土壤中施用新鲜的生物炭降低了环丙沙星、氧氟沙星和氧四环素的吸附量,可能是由于紫色土的吸附能力较强,而新鲜施炭土中能释放大量的溶解性有机物,可与抗生素结合增加其可溶性,或者与抗生素竞争土壤颗粒表面的有效吸附位点,导致新鲜施炭土对抗生素的吸附量降低。何杨等[32]研究表明添加生物炭对土壤吸附抗生素的影响与平衡浓度有关,只有低浓度范围内(小于2 mg·L−1)为强化作用(表1)。
生物炭添加到土壤中对抗生素的吸附等温线能够采用Langmuir模型、Freundlich模型、Hill模型、Linear模型和Dubinin-Radushkevich模型进行较好的拟合[20-30]。吸附-解吸过程表现为初始迅速后持续缓慢[19, 21-22, 30]。伪二级动力学模型、Elovich模型、颗粒内扩散模型和双常数模型对生物炭添加土壤吸附抗生素的拟合效果存在差异,可能是生物炭、土壤、抗生素和吸附条件都存在高度异质性,导致了其吸附动力学的复杂性[19, 21-22, 30, 32]。
-
生物炭添加对土壤吸附抗生素的影响受生物炭特性、土壤类型、抗生素种类,和温度、pH值、共存物质等吸附条件的影响。原材料和热解温度是影响生物炭特性的主要因素,进而通过影响生物炭-土壤系统影响对抗生素的吸附。450 ℃热解的马尾松树干生物炭的表面积和总孔隙率明显高于杉木生物炭,对氟苯尼考的吸附能力相应较高[20]。850 ℃热解的硬木生物炭比900 ℃热解的软木生物炭C含量高、比表面积大,对泰乐菌素的吸附量高10%—18%[19]。700 ℃热解的松木屑生物炭和650 ℃以上热解的玉米芯生物炭添加到土壤后对磺胺甲恶唑的吸附亲和力分别提高了20倍和4倍[29]。总体而言,硬木作为生物炭原料优于软木和草木。在350 ℃、450 ℃和550 ℃热解温度范围内,生物炭的热解温度对其添加到土壤中吸附抗生素没有显著性影响,可能是由于生物炭添加量较小,不同热解温度制备的生物炭在土壤中的吸附差异没有充分体现[21-22],也可能是比较的温度不能确定在最佳温度范围内[29]。添加300 ℃热解的大芒生物炭的土壤对磺胺二甲基嘧啶的吸附潜力有限,而700 ℃热解的大芒生物炭的添加大大提高了土壤对磺胺二甲基嘧啶的吸附能力[28]。而添加400 ℃热解的大芒生物炭的土壤对磺胺噻唑的吸附能力高于700 ℃热解的大芒生物炭,归因于更多的含氧官能团和亲水表面积[23]。热解温度对生物炭添加对土壤吸附抗生素的影响尚无定论,可能主要与抗生素种类有关,磺胺二甲基嘧啶在水中几乎不溶,而磺胺噻唑高度可溶且可电离[23]。Vithanage等[33]研究表明酸活化大幅度提高生物炭比表面积,添加到土壤中对吸附抗生素有进一步促进作用。
不同土壤类型对生物炭-土壤系统对抗生素吸附的影响可能主要与土壤pH、有机质、阳离子交换量和土水比有关。酸性土壤对3种磺胺类抗生素表现出较强的吸附能力,添加生物炭后吸附能力略有增强;添加生物炭后中性土壤的吸附能力显著增强[24]。砂壤土有机质含量较高,可能由于对吸附位点的竞争,较壤砂土对磺胺二甲基嘧啶表现出较低的吸附能力[28]。苍溪和嘉陵土样对四环素的吸附量相比南部和合川土样大,吸附量与阳离子交换量显著正相关,与总有机碳显著负相关[25]。阴文敏等[27]研究表明不同土水比条件下3种抗生素的吸附机制没有明显差异,接近田间土壤环境的高土水比条件下的吸附量和吸附容量常数远大于实验室常用的低土水比。
生物炭-土壤系统对抗生素吸附与抗生素离子化程度、水溶性和疏水性有关。新鲜施用生物炭不利于环丙沙星和氧氟沙星的吸附,但能促进恩诺沙星的吸附且与生物炭施用量正相关[30]。3种磺胺类抗生素吸附强弱顺序为磺胺嘧啶、磺胺甲恶唑和磺胺二甲基嘧啶,平衡溶液pH值在7.2—7.5之间,磺胺嘧啶和磺胺甲恶唑主要以阴离子形态存在,磺胺嘧啶离子化程度低,带负电的土壤对其的吸附量大;磺胺二甲基嘧啶主要以中性分子存在,但水溶性远大于、疏水性远小于磺胺嘧啶和磺胺甲恶唑,不易通过分配作用吸附[26]。He等[31]研究发现新鲜生物炭改性降低了氧四环素的吸附,增强了氟苯尼考的吸附。阴文敏等[27]研究发现生物炭添加对土壤吸附疏水性较差的磺胺二甲基嘧啶和氟苯尼考的增加幅度更大。
温度对生物炭添加土壤吸附抗生素的影响与吸附过程的吸放热有关,如果是吸热反应,温度升高有利于生物炭添加土壤对抗生素的吸附,如氟苯尼考[20]和四环素[25]。pH值通过改变生物炭和土壤表面电荷分布,以及抗生素形态影响生物炭-土壤复合系统对抗生素的吸附[20]。生物炭添加土壤对抗生素的吸附量随着pH值降低而升高[20, 23-25, 28],可以解释为随着pH值的降低,抗生素形成更多带正电荷的形式,很容易被带负电的土壤和生物炭吸附[20, 24]。Vithanage等[28]研究表明pH值为3时吸附能力高可能是由于π-π电子供受体相互作用和静电阳离子交换,而pH值为5和7时,阳离子交换是主要的吸附机制。pH值为2时生物炭添加土壤对磺胺噻唑吸附量最高的原因也是π-π电子供受体相互作用,而pH值为7时吸附量最低的原因是带负电的磺胺噻唑分子与带负电生物炭添加土壤表面之间存在静电排斥作用[23]。共存物质对生物炭添加土壤吸附抗生素的影响与共存物质性质、土壤类型和抗生素种类等相关。尿素的共存通过破坏氢键降低生物炭添加土壤对氟苯尼考的吸附[20]。Cu2+的存在通过竞争土壤中的疏水吸附区抑制了磺胺二甲基嘧啶和磺胺嘧啶的吸附,但是通过提供阳离子桥增强了磺胺甲恶唑的吸附,可能由于磺胺甲恶唑的pKa2值较低、空间效应较小。腐殖酸通过桥梁作用对生物炭改性酸性土壤吸附3种磺胺类抗生素有促进作用,但通过静电斥力抑制了在生物炭改性碱性土壤中的吸附[24]。添加生物炭的沿岸土对四环素的吸附量随离子浓度(Na+、Cl−)的增加先增大后减小,生物炭的添加可以缓解土壤对四环素吸附量受离子强度的影响[25]。
-
生物炭添加到土壤中对抗生素的解吸等温线能够采用Langmuir模型、Freundlich模型进行较好的拟合[21-23, 26, 32]。添加生物炭后土壤对抗生素的解吸过程并非吸附的可逆过程,其吸附-解吸过程存在明显的迟滞效应[21-23, 26],占据高能结合位点的抗生素不易解吸[23],3种磺胺类抗生素解吸难易与吸附强弱基本一致,吸附容量最大的磺胺嘧啶最不易解吸,磺胺二甲基嘧啶吸附容量最小可逆性最强;经过田间老化后土壤中的磺胺甲恶唑和磺胺二甲基嘧啶更易解吸,而磺胺嘧啶更不易解吸[26]。添加生物炭使得土壤中的抗生素以不可提取形式截留,随着生物炭添加量的增加,解吸量降低,硬木生物炭解吸量低于软木生物炭,同时玉米田淤泥土解吸量低于森林砂壤土,归因于玉米田淤泥土的低有机质含量、高pH值和淤泥含量[19]。然而,轩盼盼等[30]研究发现施炭促进了环丙沙星和氧氟沙星在土壤中的解吸,且解吸程度与施炭量正相关,对恩诺沙星解吸的影响不显著,老化处理的解吸程度小于新鲜施炭土,老化施炭土抑制了恩诺沙星的解吸。3种氟喹诺酮类抗生素在不同处理土壤中无解吸迟滞现象。何杨等[32]研究表明只有低浓度范围内(小于2 mg·L−1)解吸量明显低于未施炭紫色土。He等[31]研究发现添加5%生物炭的新鲜土壤对氧四环素的解吸最高。
-
在“生物炭-土壤-抗生素”三元体系中,老化过程一方面可吸附大量有机、无机物质,部分吸附点位被占据,降低对抗生素的吸附;另一方面,在干湿交替作用下,生物炭表面具有的丰富化学官能团可能进一步增强,促进吸附。生物炭土壤对抗生素的吸附亲和力在老化后或减弱[31, 34],或增强[30]。低温生物炭添加土壤受老化影响较大,老化使得含氧官能团增加,对抗生素吸附能力提高;高温生物炭含碳量高,含氧量低,受老化影响较小[23]。周志强等[26]研究表明添加生物炭对土壤吸附抗生素的促进作用经过老化过程后由于吸附点位被占据有所减弱,而对于以中性分子存在的磺胺二甲基嘧啶,生物炭添加比例较高时老化提供了更多的官能团,吸附量显著增加。阴文敏等[27]研究表明生物炭新鲜施用时效果更好,而老化后这种增强作用由于生物炭不稳定、可溶解的有机质组分减少而明显减弱,而在低土水比条件下,受pH值对磺胺类抗生素形态的影响,磺胺嘧啶和磺胺二甲基嘧啶在老化后吸附能力较大。
-
生物炭添加后土壤中抗生素迁移是复杂的耦合调控过程,涉及土壤水文过程和“生物炭-土壤-抗生素”三元吸附[8],添加生物炭提高了抗生素在土壤中的滞留并减少了迁移[19, 24, 26, 32]。研究表明,添加5%硬木屑生物炭比对照土壤对泰乐菌素产生了更高的阻滞作用,且玉米田淤泥土比森林砂壤土具有更低的流动性[19]。与未处理土壤相比,添加生物炭(0.5%、1.0%)对3种磺胺类抗生素的滞留率提高了12%—20%[24]。坡底生物炭(5%)可渗透反应墙能有效地控制氟苯尼考在紫色土坡耕地中淋溶迁移及深层侧向迁移[32]。3种磺胺类抗生素在生物炭土壤柱中迁移更慢[26]。而与吸附能力对应,添加300 ℃热解的大芒生物炭没有显著减少土壤中磺胺二甲基嘧啶的迁移,但是添加2%的700 ℃热解的大芒生物炭对磺胺二甲基嘧啶的迁移潜力有显著影响[28]。由于土壤对四环素的强吸附作用,添加生物炭后反而通过降低土壤容重和吸附量促进了四环素的垂直迁移[35]。由于未考虑生物降解作用,Zhang等[36]研究表明生物炭普遍降低了抗生素在土壤中的表观分布系数,增加了淋溶。
-
自然衰减是土壤中抗生素消散的主要因素,生物炭有助于更好的吸附抗生素,并为微生物提供广阔的生存空间和丰富的营养物质,通过降解作用进一步促进土壤中抗生素的消散[37-39],水溶性和交换性组分下降最显著乃至于基本消失,残留抗生素主要以紧密和松散结合态为主[37, 39-40]。然而,Li等[40]研究发现1.0%生物炭改良土壤后,磺胺嘧啶、磺胺甲恶唑和林可霉素在土壤中的持久性延长。Zhang等[36]研究发现,250 ℃热解生物炭对土壤中抗生素的非生物散失有积极影响,400 ℃和600 ℃热解生物炭对土壤中抗生素消散的影响与生物炭类型和抗生素分子结构有关,生物炭类型对磺胺类结合分数的影响最大,其次是四环素类,而对喹诺酮类的影响最小,与之前研究结论的差异可能在于未考虑生物降解的作用。
ARGs的环境行为与抗生素有关[41],生物炭添加降低了土壤中ARGs的总相对丰度[38-39],但是对不同ARGs消散的影响不同,tetC和tetG降低,但是tetW明显增加,intI1变化不大,细菌群落演替是影响ARGs和intI1变异的主要机制[38],较高的细菌多样性对应于降低的ARGs含量[42]。另外,土壤中抗生素浓度升高导致人类致病菌含量更高,但是生物炭添加使得土壤中人类致病菌完全消失[38]。Jiao等[39]研究表明蔬菜种植对生物炭添加土壤中抗生素和ARGs的消散表现为协同效应,然而,Chen等[42]研究表明蔬菜种植通过改变微生物群落结构减弱生物炭添加对土壤中ARGs消散的促进作用,结论存在差异可能原因是方法论和生物炭的不同。Cui等[41]研究表明养猪废水反复灌溉下,生物炭添加明显降低土壤中抗生素、土壤和根内生菌ARGs的作用具有时间依赖性,60 d后反而高于对照。
另外,研究表明生物炭-噬菌体协同提高了土壤和生菜内生细菌群落的结构多样性和功能稳定性,阻碍了ARB和ARGs的垂直迁移,显著降低了土壤和生菜中的ARB和ARGs[43-44]。生物炭复合材料添加降低了有效重金属含量,增加了土壤中细菌群落的多样性,显著降低了ARGs宿主放线菌和硬壁菌的丰度,有助于ARGs的去除[45-46]。
-
生物炭添加可以有效降低土壤中抗生素、ARB和ARGs在作物中的积累,施用生物炭是保护蔬菜安全的一种实用策略[37-39, 47]。土壤中磺胺类抗生素、ARB和ARGs在生菜不同部位积累的顺序为根>老叶>新叶,施用生物炭后生菜生长和生理生化指标显著提高,抗生素浓度降低了1—2个数量级,ARB种类和数量明显减少,ARGs相对丰度大幅下降,新叶中未检出ARB和ARGs[37]。氧四环素的积累顺序为土壤>根>叶,生物炭处理可显著降低生菜根和叶中的氧四环素浓度和ARGs,及生菜对氧四环素的吸收能力,但对氧四环素从生菜根部到叶片的转运没有显著性影响[38]。
生物炭施用有效降低了马铃薯可食用部分磺胺嘧啶、氯霉素和罗红霉素浓度,以及ARB和ARGs的种类和累积丰度,并通过增加淀粉、蛋白质、脂肪和维生素改善食品品质[39]。然而,Chen等[42]研究表明小白菜叶片上ARGs含量没有显著降低。Caban等[48]研究表明生物炭添加对磺胺二甲氧嘧啶对水芹的毒性与土壤类型和生物炭添加量有关。Li等[46]研究发现施用1.0%生物炭土壤中的萝卜中磺胺嘧啶、磺胺甲恶唑、甲氧苄啶、土霉素、泰乐菌素的累积量显著降低,莫能菌素保持不变,但是林可霉素的浓度增加。
而对于土壤动物而言,大部分生物炭添加不影响土壤和弹尾虫肠道中ARGs的相对丰度,但可以通过改变肠道微生物群落和土壤特性(包括土壤中的ARGs组成)来影响肠道相关的ARGs组成,这与生物炭特性密切相关,值得注意的是,粪便来源生物炭中高浓度的重金属可以增加弹尾虫肠道中ARGs的相对丰度,可能通过弹尾虫的运行促进ARGs在环境中的扩散[49]。
-
酶和微生物参与土壤中各种生化过程,在能量转化和物质循环中发挥重要作用,一方面是土壤生态系统质量的敏感指标,另一方面作用于污染物的矿化和降解。有机污染物降解效率与酶活性和微生物生物量正相关[50]。低含量(1%)的生物炭添加通过提供少量有效养分和改善土壤理化性质刺激磺胺甲恶唑污染湿地土壤中脱氢酶和脲酶活性[4],提高降解效率;高含量(5%)的生物炭表现出负面影响,脱氢酶活性下降[50]。原因在于一方面生物炭热解过程中产生的某些化合物和持久性自由基在高浓度下存在时会对微生物产生直接毒性或氧化应激[51-52],生物炭对信号分子的吸附和水解会中断微生物的种间通信[52-54];另一方面生物炭对磺胺甲恶唑的过量吸附导致微生物可生物降解的部分减少[50]。高含量生物炭通过引入更多外源优势菌株和抑制一些劣势菌株,提高细菌多样性,但降低了丰富度;低含量生物炭添加则通过增强本土优势种,保留一些劣势种,表现出较低的多样性和较高的丰富度[50];适量(2%)的生物炭添加细菌多样性和丰富度均提高了[38]。然而,Chen等[42]研究结果表明生物炭添加较植物种植对细菌群落结构的影响较小。
高含量生物炭添加相比于低含量提高了氨基和脂类代谢基因的相对丰度,降低了碳水化合物代谢基因相对丰度[50]。值得注意的是,由于老化过程中元素/养分的释放和表面官能团的变化,生物炭存在延迟效应,可以作为缓释肥料,对土壤肥力和微生物生长带来长期效益[52],5%的生物炭添加56 d时微生物生物量高于低含量[50]。适量生物炭刺激土壤中的有效碳[55],促进共生细菌(如放线菌和变形菌)的生长[35, 38],降低厚壁菌和拟杆菌丰度[38],从而显著改变土壤中的细菌群落结构,放线菌和鞘氨醇单胞菌等变形菌能够降解难降解污染物[56-57];生物炭能降低土壤pH值,改变真菌群落组成,并通过限制四环素与微生物的接触部分抵消其作用[35]。总体而言,低含量和适量添加生物炭提高土壤中酶活性和微生物生物量,促进抗生素微生物降解;而无论含量高低都会改变微生物群落结构。
综上所述,生物炭添加对土壤中抗生素和抗性基因的环境行为的影响如图1所示。
-
我国是世界上抗生素生产和使用量最大的国家,土壤中已广泛检出抗生素和抗性基因,对生态环境和人类健康具有潜在风险。生物炭作为一种可持续多效土壤改良剂,添加到土壤中会对抗生素和抗性基因的环境行为产生影响。
(1)大多数研究结果表明生物炭添加提高了土壤对抗生素的吸附,且吸附量随着添加量的增加而增加。生物炭-土壤系统对抗生素的吸附与生物炭热解材料和温度,土壤pH、有机质、阳离子交换量和土水比,抗生素离子化程度、水溶性和疏水性有关。温度升高和pH值降低有利于生物炭添加土壤对抗生素的吸附,而共存物质对生物炭添加土壤吸附抗生素的影响与共存物质性质、土壤类型和抗生素种类等相关。生物炭-土壤系统对抗生素的解吸难易与吸附强弱基本一致,老化的影响具有双面性。
(2)与吸附性能类似,大多数研究结果表明添加生物炭提高了抗生素在土壤中的滞留并减少了迁移,通过降解作用促进了抗生素的消散,降低了土壤中ARGs的总相对丰度。生物炭添加可以有效降低土壤中抗生素、ARB和ARGs在作物中的积累,施用生物炭是保护蔬菜安全的一种实用策略。对于土壤中酶和微生物,低含量和适量添加生物炭提高土壤中酶活性和微生物生物量,促进抗生素微生物降解;而无论含量高低都会改变微生物群落结构。
虽然生物炭作为环境友好材料可有效降低土壤中抗生素和ARGs浓度,及其生物有效性,符合我国的可持续发展目标,但由于生物炭原料来源广泛、我国土壤类型丰富和抗生素种类多样,仍有诸多亟待解决的问题。
(1)由于生物炭原料来源广泛,包括工业废物、污泥、畜禽粪便等,施用到土壤中可能会释放有毒金属、挥发性有机物、多环芳烃等;生物炭理化结构和表面官能团、吸附能力和其他特性会随着时间的推移而变化,生物炭吸附的污染物解吸将成为二次污染源,对“土壤-植物-人类”系统产生潜在风险。由于生物炭施用的不可逆性,其负面效应及在土壤中的长期影响有待进一步研究。
(2)土壤中酶和微生物一方面通过影响土壤质量影响作物生产,另一方面通过影响抗生素微生物降解影响抗生素和ARGs的迁移消散,生物炭添加对土壤中酶活性、微生物生物量和群落结构、ARB和降解菌等的影响研究有待进一步深入。
(3)由于生物炭、土壤和抗生素的多样性,一些实验得到了负面的结果,虽然可以通过生物炭特性、土壤类型、生物炭和土壤的比例、抗生素种类、实验持续时间等实验条件来解释,但是生物炭在现场试验中的有效性仍然是一个挑战。筛选最合适的原料,优化生物炭生产条件,根据特定目的,研发清洁高效生物炭原料;优化生物炭施用条件,验证长期田间效益;是生物炭快速商业化和大规模推广前需要消除的障碍。
生物炭添加对土壤中抗生素和抗性基因的环境行为影响研究进展
Research advances in the effect of biochar amendment on environmental behaviors of antibiotics and antibiotic resistance genes in soils
-
摘要: 近年来,土壤抗生素和抗性基因污染已成为我国新兴的环境问题,生物炭作为土壤改良剂施用到土壤后会影响抗生素和抗性基因的环境行为。本文从我国土壤中抗生素和抗性基因污染现状和潜在风险出发,概述了生物炭添加土壤对抗生素的吸附、解吸及老化的影响,分析了生物炭特性、土壤类型、抗生素种类,和温度、pH值、共存物质等吸附条件对生物炭添加土壤吸附抗生素的影响,阐述了生物炭添加对土壤中抗生素和抗性基因迁移、消散、生物有效性,以及酶和微生物的影响,并对生物炭控制土壤中抗生素和抗性基因的研究前景进行了展望,拟为土壤中生物炭调控技术的发展提供参考。Abstract: In recent years, the soil pollution of antibiotics and antibiotic resistance genes has become an emerging environmental problem in China. Biochar, as soil amendment, has an effect on the environmental behavior of antibiotics and antibiotic resistance genes. Based on the pollution situation and potential risks of antibiotics and antibiotic resistance genes in soils of China, the adsorption and desorption of biochar amendment soil and the effect by aging were summarized. The effect of biochar characteristics, soil type, antibiotic species, and adsorption conditions such as temperature, pH, and coexisting substances on the adsorption of antibiotics on biochar amendment soil were analyzed. The effects of biochar amendment on migration, dissipation, bioavailability of antibiotics, antibiotic resistance genes and enzymes and microorganisms in soils were discussed. The research prospect of biochar controlling antibiotics and antibiotic resistance genes in soils was expected, which would provide a reference for the development of biochar regulation technology in soils.
-
Key words:
- biochar /
- antibiotics /
- antibiotic resistance genes /
- soils /
- environmental behaviors
-

-
表 1 生物炭添加对土壤吸附抗生素的影响
Table 1. Effect of biochar amendment on adsorption of antibiotics by soils
生物炭 Biochars 土壤 Soils 抗生素 Antibiotics 吸附模型拟合 Adsorption model fitting 吸附机理 Adsorption mechanism 参考文献 Reference 原料 Raw material 热解温度/℃ Pyrolysis temperature 添加比例/%(W/W) Amendment ratio Kf 1/n qmax/ (mmol·kg−1) 硬木屑 850 0、1、3、5、10 森林砂壤土 泰乐菌素 — — — 离子键、疏水相互作用 [19] 软木屑 900 玉米田淤泥土 — — — 大芒 300、700 0、2 农业壤砂土 磺胺二甲嘧啶 9.96—65.77 0.41—0.58 0.77—1.13 静电阳离子交换、π-π电子供受体相互作用 [28] 农业砂壤土 2.64—47.71 0.37—1.00 0.46—0.93 甘蔗渣 350、450、550 0、0.1、0.2、0.5、0.8、1 砖红壤 环丙沙星 2.85—3.76 0.65—0.91 1.48—5.23 分配作用、表面吸附 [21] 氧氟沙星 3.09—3.48 0.59—0.78 1.65—7.12 [22] 绿色废物 350、450、550 0、0.5、1 粉壤土 磺胺甲恶唑 2.18—2.86 0.72—0.78 — — [29] 玉米芯 >650 0、0.5、1 粉壤土 磺胺甲恶唑 8.55—11.89 0.55—0.75 — — [29] 松木屑 700 0、0.5、1 粉壤土 磺胺甲恶唑 28.51—66.99 0.45—0.75 — — [29] 马尾松树干 450 0、2 红壤 氟苯尼考 17.30—3.10 0.49—0.53 0.06—0.24 静电作用、氢键、范德华力 [20] 杉木树干 3.10—7.80 0.53—0.61 0.06—0.20 麦秸 650 0、0.5 农田土S1 磺胺甲恶唑 12.06—8.74 0.74—0.91 — 静电作用、范德华力、氢键 [24] 磺胺二甲嘧啶 16.00—6.55 0.62—0.80 — 磺胺嘧啶 11.41—9.60 0.99—1.01 — 农田土S2 磺胺甲恶唑 4.83—2.80 1.02—1.09 — 静电作用、范德华力、氢键 [24] 磺胺二甲嘧啶 4.64—5.99 1.22—1.77 — 磺胺嘧啶 8.02—3.03 0.99—1.14 — 农作物秸秆 500 0、1、5 紫色土 环丙沙星 2.38—2.65 1.10—1.56 — — [30] 氧氟沙星 2.31—2.61 0.93—1.26 — 恩诺沙星 2.36—2.43 0.89—1.17 — 混合秸秆 — 0、5 紫色土 氟苯尼考 3.52—5.32 1.06—2.94 — — [32] 大芒 400、700 0、5 农业砂壤土 磺胺噻唑 2.60—22.30 0.51—0.75 — π-π电子供受体相互作用 [23] 混合秸秆 500 0、1、5 紫色土 磺胺嘧啶 0.48—40.83 0.24—0.70 — 静电引力、阳离子交换、疏水分配作用、 [26] 磺胺二甲基嘧啶 0.34—5.72 0.93—1.53 — 磺胺甲恶唑 0.47—3.92 0.47—0.66 — 混合秸秆 500 0、1、5 紫色土 氧四环素 71.57—351.43 0.53—1.03 — 疏水分配 [31] 氟苯尼考 3.32—6.94 1.06—5.00 — 静电相互作用、氢键、范德华力、分配作用 混合秸秆 500 0、1、5 紫色土 磺胺嘧啶 2.11—18.35 1.63—1.96 — 物理吸附、分配作用、孔道填充作用、氢键、范德华力 [27] 磺胺二甲基嘧啶 2.50—34.82 1.21—1.51 — 氟苯尼考 0. 75—21. 82 0.89—1.43 — — — 0、1 嘉陵江苍溪沿岸土壤 四环素 — — 5.89—15.2 物理吸附、氢键作用、离子交换作用 [25] 嘉陵江南部沿岸土壤 — — 5.69—11.6 嘉陵江嘉陵沿岸土壤 — — 7.44—19.9 嘉陵江合川沿岸土壤 — — 4.81—12.2 -
[1] LYU J, YANG L S, ZHANG L, et al. Antibiotics in soil and water in China-a systematic review and source analysis [J]. Environmental Pollution, 2020, 266: 115147. doi: 10.1016/j.envpol.2020.115147 [2] O’NEILL J. Tacking drug resistant infections globally: Final report and recommendations. The review on antimicrobial resistance[R/OL]. [2020-12-22].https://amr-review.org/sites/default/files/160518_Final%20paper_with%20cover. Pdf. [3] 石红蕾, 周启星. 生物炭对污染物的土壤环境行为影响研究进展 [J]. 生态学杂志, 2014, 33(2): 486-494. SHI H L, ZHOU Q X. Research progresses in the effect of biochar on soil-environmental behaviors of pollutants [J]. Chinese Journal of Ecology, 2014, 33(2): 486-494(in Chinese).
[4] YUAN P, WANG J Q, PAN Y J, et al. Review of biochar for the management of contaminated soil: Preparation, application and prospect [J]. Science of the Total Environment, 2019, 659: 473-490. doi: 10.1016/j.scitotenv.2018.12.400 [5] KAMALI M, JAHANINAFARD D, MOSTAFAIE A, et al. Scientometric analysis and scientific trends on biochar application as soil amendment [J]. Chemical Engineering Journal, 2020, 395: 125128. doi: 10.1016/j.cej.2020.125128 [6] PEIRIS C, GUNATILAKE S R, MLSNA T E, et al. Biochar based removal of antibiotic sulfonamides and tetracyclines in aquatic environments: A critical review [J]. Bioresource Technology, 2017, 246: 150-159. doi: 10.1016/j.biortech.2017.07.150 [7] 邓雅雯, 晏彩霞, 聂明华, 等. 生物炭对抗生素的吸附/解吸研究进展 [J]. 环境污染与防治, 2020, 42(3): 376-384. DENG Y W, YAN C X, NIE M H, et al. Study on the antibiotic adsorption/desorption of biochar: A review [J]. Environmental Pollution & Control, 2020, 42(3): 376-384(in Chinese).
[8] 何杨, 肖宇凡, 张建强. 生物炭阻控土壤中抗生素迁移的研究进展 [J]. 环境科学与技术, 2020, 43(3): 95-100. HE Y, XIAO Y F, ZHANG J Q. A review of biochar controlling antibiotics transport in soils [J]. Environmental Science & Technology, 2020, 43(3): 95-100(in Chinese).
[9] ZHANG Q Q, YING G G, PAN C G, et al. Comprehensive evaluation of antibiotics emission and fate in the river basins of China: Source analysis, multimedia modeling, and linkage to bacterial resistance [J]. Environmental Science & Technology, 2015, 49(11): 6772-6782. [10] RICHARDSON B J, LAM P K S, MARTIN M. Emerging chemicals of concern: Pharmaceuticals and personal care products (PPCPs) in Asia, with particular reference to Southern China [J]. Marine Pollution Bulletin, 2005, 50(9): 913-920. doi: 10.1016/j.marpolbul.2005.06.034 [11] SARMAH A K, MEYER M T, BOXALL A B A. A global perspective on the use, sales, exposure pathways, occurrence, fate and effects of veterinary antibiotics (VAs) in the environment [J]. Chemosphere, 2006, 65(5): 725-759. doi: 10.1016/j.chemosphere.2006.03.026 [12] XIE W Y, SHEN Q, ZHAO F J. Antibiotics and antibiotic resistance from animal manures to soil: A review [J]. European Journal of Soil Science, 2018, 69(1): 181-195. doi: 10.1111/ejss.12494 [13] 张宁, 李淼, 刘翔. 土壤中抗生素抗性基因的分布及迁移转化 [J]. 中国环境科学, 2018, 38(7): 2609-2617. doi: 10.3969/j.issn.1000-6923.2018.07.029 ZHANG N, LI M, LIU X. Distribution and transformation of antibiotic resistance genes in soil [J]. China Environmental Science, 2018, 38(7): 2609-2617(in Chinese). doi: 10.3969/j.issn.1000-6923.2018.07.029
[14] 何燕, 朱冬, 王东, 等. 四川省稻田土壤的抗生素抗性基因多样性研究 [J]. 农业环境科学学报, 2020, 39(6): 1249-1258. doi: 10.11654/jaes.2019-1355 HE Y, ZHU D, WANG D, et al. Diversity of antibiotic resistance genes in paddy soils in Sichuan Province, China [J]. Journal of Agro-Environment Science, 2020, 39(6): 1249-1258(in Chinese). doi: 10.11654/jaes.2019-1355
[15] SHI W, LIU Y, LI J J, et al. Distribution pattern of antibiotic resistance genes and bacterial community in agricultural soil samples of Wuliangsuhai watershed. China [J]. Agriculture, Ecosystems & Environment, 2020, 295: 106884. [16] SUN J T, JIN L, HE T T, et al. Antibiotic resistance genes (ARGs) in agricultural soils from the Yangtze River Delta, China [J]. Science of the Total Environment, 2020, 740: 140001. doi: 10.1016/j.scitotenv.2020.140001 [17] ZHOU Y T, NIU L L, ZHU S Y, et al. Occurrence, abundance, and distribution of sulfonamide and tetracycline resistance genes in agricultural soils across China [J]. Science of the Total Environment, 2017, 599/600: 1977-1983. doi: 10.1016/j.scitotenv.2017.05.152 [18] GHIRARDINI A, GRILLINI V, VERLICCHI P. A review of the occurrence of selected micropollutants and microorganisms in different raw and treated manure - Environmental risk due to antibiotics after application to soil [J]. Science of the Total Environment, 2020, 707: 136118. doi: 10.1016/j.scitotenv.2019.136118 [19] JEONG C Y, WANG J J, DODLA S K, et al. Effect of biochar amendment on tylosin adsorption-desorption and transport in two different soils [J]. Journal of Environmental Quality, 2012, 41(4): 1185-1192. doi: 10.2134/jeq2011.0166 [20] JIANG C L, CAI H, CHEN L L, et al. Effect of forestry-waste biochars on adsorption of Pb(Ⅱ) and antibiotic florfenicol in red soil [J]. Environmental Science and Pollution Research, 2017, 24(4): 3861-3871. doi: 10.1007/s11356-016-8060-8 [21] 陈淼, 唐文浩, 葛成军, 等. 生物炭对环丙沙星在热带土壤中吸附行为的影响 [J]. 热带作物学报, 2015, 36(12): 2260-2268. doi: 10.3969/j.issn.1000-2561.2015.12.025 CHEN M, TANG W H, GE C J, et al. Effects of sugarcane bagasse-derived biochar on adsorption and desorption of ciprofloxacin in tropical soils [J]. Chinese Journal of Tropical Crops, 2015, 36(12): 2260-2268(in Chinese). doi: 10.3969/j.issn.1000-2561.2015.12.025
[22] 陈淼, 唐文浩, 葛成军, 等. 蔗渣生物炭对砖红壤吸附氧氟沙星的影响 [J]. 环境工程学报, 2015, 9(10): 5083-5090. doi: 10.12030/j.cjee.20151075 CHEN M, TANG W H, GE C J, et al. Effects of biochar made from bagasse on adsorption behavior of ofloxacin in latosols [J]. Chinese Journal of Environmental Engineering, 2015, 9(10): 5083-5090(in Chinese). doi: 10.12030/j.cjee.20151075
[23] KIM H, KIM J, KIM M, et al. Sorption of sulfathiazole in the soil treated with giant Miscanthus-derived biochar: Effect of biochar pyrolysis temperature, soil pH, and aging period [J]. Environmental Science and Pollution Research, 2018, 25(26): 25681-25689. doi: 10.1007/s11356-017-9049-7 [24] LIU Z F, HAN Y T, JING M, et al. Sorption and transport of sulfonamides in soils amended with wheat straw-derived biochar: Effects of water pH, coexistence copper ion, and dissolved organic matter [J]. Journal of Soils and Sediments, 2017, 17(3): 771-779. doi: 10.1007/s11368-015-1319-8 [25] 李文斌, 陈芯怡, 邓红艳, 等. 外源生物炭对嘉陵江流域川渝段沿岸土壤四环素吸附特征的影响 [J]. 土壤通报, 2020, 51(2): 487-495. LI W B, CHEN X Y, DENG H Y, et al. Effects of exogenous biochar on tetracycline adsorption by different riverbank soils from Sichuan and Chongqing section of Jialing river [J]. Chinese Journal of Soil Science, 2020, 51(2): 487-495(in Chinese).
[26] 周志强, 刘琛, 杨红薇, 等. 生物质炭对磺胺类抗生素在坡耕地紫色土中吸附-解吸及淋溶过程的影响 [J]. 土壤, 2018, 50(2): 353-360. ZHOU Z Q, LIU C, YANG H W, et al. Effects of biochar application on sorption-desorption process and leaching behaviour of sulfonamide antibiotics [J]. Soils, 2018, 50(2): 353-360(in Chinese).
[27] 阴文敏, 关卓, 刘琛, 等. 生物炭施用及老化对紫色土中抗生素吸附特征的影响 [J]. 环境科学, 2019, 40(6): 2920-2929. YIN W M, GUAN Z, LIU C, et al. Effects of biochar application and ageing on the adsorption of antibiotics in purple soil [J]. Environmental Science, 2019, 40(6): 2920-2929(in Chinese).
[28] VITHANAGE M, RAJAPAKSHA A U, TANG X Y, et al. Sorption and transport of sulfamethazine in agricultural soils amended with invasive-plant-derived biochar [J]. Journal of Environmental Management, 2014, 141: 95-103. doi: 10.1016/j.jenvman.2014.02.030 [29] SRINIVASAN P, SARMAH A K. Characterisation of agricultural waste-derived biochars and their sorption potential for sulfamethoxazole in pasture soil: A spectroscopic investigation [J]. Science of the Total Environment, 2015, 502: 471-480. doi: 10.1016/j.scitotenv.2014.09.048 [30] 轩盼盼, 唐翔宇, 鲜青松, 等. 生物炭对紫色土中氟喹诺酮吸附-解吸的影响 [J]. 中国环境科学, 2017, 37(6): 2222-2231. doi: 10.3969/j.issn.1000-6923.2017.06.029 XUAN P P, TANG X Y, XIAN Q S, et al. Effects of biochar on adsorption-desorption of fluoroquinolones in purple soil [J]. China Environmental Science, 2017, 37(6): 2222-2231(in Chinese). doi: 10.3969/j.issn.1000-6923.2017.06.029
[31] HE Y, LIU C, TANG X Y, et al. Biochar impacts on sorption-desorption of oxytetracycline and florfenicol in an alkaline farmland soil as affected by field ageing [J]. Science of the Total Environment, 2019, 671: 928-936. doi: 10.1016/j.scitotenv.2019.03.414 [32] 何杨, 唐翔宇, 张建强, 等. 生物炭墙对紫色土坡耕地中氟苯尼考迁移影响 [J]. 中国环境科学, 2018, 38(3): 1039-1046. doi: 10.3969/j.issn.1000-6923.2018.03.030 HE Y, TANG X Y, ZHANG J Q, et al. Effects of biochar-amended wall in a sloping farmland plot of purple soil on florfenicol transport [J]. China Environmental Science, 2018, 38(3): 1039-1046(in Chinese). doi: 10.3969/j.issn.1000-6923.2018.03.030
[33] VITHANAGE M, RAJAPAKSHA A U, ZHANG M, et al. Acid-activated biochar increased sulfamethazine retention in soils [J]. Environmental Science and Pollution Research, 2015, 22(3): 2175-2186. doi: 10.1007/s11356-014-3434-2 [34] TEIXIDÓ M, HURTADO C, PIGNATELLO J J, et al. Predicting contaminant adsorption in black carbon (biochar)-amended soil for the veterinary antimicrobial sulfamethazine [J]. Environmental Science & Technology, 2013, 47(12): 6197-6205. [35] LIU H Y, SONG C, ZHAO S, et al. Biochar-induced migration of tetracycline and the alteration of microbial community in agricultural soils [J]. Science of the Total Environment, 2020, 706: 136086. doi: 10.1016/j.scitotenv.2019.136086 [36] ZHANG G X, ZHAO Z H, ZHU Y E. Changes in abiotic dissipation rates and bound fractions of antibiotics in biochar-amended soil [J]. Journal of Cleaner Production, 2020, 256: 120314. doi: 10.1016/j.jclepro.2020.120314 [37] YE M, SUN M M, FENG Y F, et al. Effect of biochar amendment on the control of soil sulfonamides, antibiotic-resistant bacteria, and gene enrichment in lettuce tissues [J]. Journal of Hazardous Materials, 2016, 309: 219-227. doi: 10.1016/j.jhazmat.2015.10.074 [38] DUAN M L, LI H C, GU J, et al. Effects of biochar on reducing the abundance of oxytetracycline, antibiotic resistance genes, and human pathogenic bacteria in soil and lettuce [J]. Environmental Pollution, 2017, 224: 787-795. doi: 10.1016/j.envpol.2017.01.021 [39] JIAO W T, DU R J, YE M, et al. ‘Agricultural Waste to Treasure’-Biochar and eggshell to impede soil antibiotics/antibiotic resistant bacteria (genes) from accumulating in Solanum tuberosum L [J]. Environmental Pollution, 2018, 242: 2088-2095. doi: 10.1016/j.envpol.2018.06.059 [40] LI Y B, HE J Z, QI H N, et al. Impact of biochar amendment on the uptake, fate and bioavailability of pharmaceuticals in soil-radish systems [J]. Journal of Hazardous Materials, 2020, 398: 122852. doi: 10.1016/j.jhazmat.2020.122852 [41] CUI E P, GAO F, LIU Y, et al. Amendment soil with biochar to control antibiotic resistance genes under unconventional water resources irrigation: Proceed with caution [J]. Environmental Pollution, 2018, 240: 475-484. doi: 10.1016/j.envpol.2018.04.143 [42] CHEN Q L, FAN X T, ZHU D, et al. Effect of biochar amendment on the alleviation of antibiotic resistance in soil and phyllosphere of Brassica chinensis L [J]. Soil Biology and Biochemistry, 2018, 119: 74-82. doi: 10.1016/j.soilbio.2018.01.015 [43] YE M, SUN M M, ZHAO Y C, et al. Targeted inactivation of antibiotic-resistant Escherichia coli and Pseudomonas aeruginosa in a soil-lettuce system by combined polyvalent bacteriophage and biochar treatment [J]. Environmental Pollution, 2018, 241: 978-987. doi: 10.1016/j.envpol.2018.04.070 [44] SUN M M, YE M, ZHANG Z Y, et al. Biochar combined with polyvalent phage therapy to mitigate antibiotic resistance pathogenic bacteria vertical transfer risk in an undisturbed soil column system [J]. Journal of Hazardous Materials, 2019, 365: 1-8. doi: 10.1016/j.jhazmat.2018.10.093 [45] LI Y, WANG X J, LI J, et al. Effects of struvite-humic acid loaded biochar/bentonite composite amendment on Zn(II) and antibiotic resistance genes in manure-soil [J]. Chemical Engineering Journal, 2019, 375: 122013. doi: 10.1016/j.cej.2019.122013 [46] LI Y, WANG X J, WANG Y, et al. Struvite-supported biochar composite effectively lowers Cu bio-availability and the abundance of antibiotic-resistance genes in soil [J]. Science of the Total Environment, 2020, 724: 138294. doi: 10.1016/j.scitotenv.2020.138294 [47] RAJAPAKSHA A U, VITHANAGE M, LIM J E, et al. Invasive plant-derived biochar inhibits sulfamethazine uptake by lettuce in soil [J]. Chemosphere, 2014, 111: 500-504. doi: 10.1016/j.chemosphere.2014.04.040 [48] CABAN M, FOLENTARSKA A, LIS H, et al. Critical study of crop-derived biochars for soil amendment and pharmaceutical ecotoxicity reduction [J]. Chemosphere, 2020, 248: 125976. doi: 10.1016/j.chemosphere.2020.125976 [49] DING J, YIN Y, SUN A Q, et al. Effects of biochar amendments on antibiotic resistome of the soil and collembolan gut [J]. Journal of Hazardous Materials, 2019, 377: 186-194. doi: 10.1016/j.jhazmat.2019.05.089 [50] LIANG J, TANG S Q, GONG J L, et al. Responses of enzymatic activity and microbial communities to biochar/compost amendment in sulfamethoxazole polluted wetland soil [J]. Journal of Hazardous Materials, 2020, 385: 121533. doi: 10.1016/j.jhazmat.2019.121533 [51] LIAO S H, PAN B, LI H, et al. Detecting free radicals in biochars and determining their ability to inhibit the germination and growth of corn, wheat and rice seedlings [J]. Environmental Science & Technology, 2014, 48(15): 8581-8587. [52] ZHU X M, CHEN B L, ZHU L Z, et al. Effects and mechanisms of biochar-microbe interactions in soil improvement and pollution remediation: A review [J]. Environmental Pollution, 2017, 227: 98-115. doi: 10.1016/j.envpol.2017.04.032 [53] MASIELLO C A, CHEN Y, GAO X D, et al. Biochar and microbial signaling: Production conditions determine effects on microbial communication [J]. Environmental Science & Technology, 2013, 47(20): 11496-11503. [54] GAO X D, CHENG H Y, VALLE I D, et al. Charcoal disrupts soil microbial communication through a combination of signal sorption and hydrolysis [J]. ACS Omega, 2016, 1(2): 226-233. doi: 10.1021/acsomega.6b00085 [55] JONES D L, MURPHY D V, KHALID M, et al. Short-term biochar-induced increase in soil CO2 release is both biotically and abiotically mediated [J]. Soil Biology and Biochemistry, 2011, 43(8): 1723-1731. doi: 10.1016/j.soilbio.2011.04.018 [56] KIRBY R. Actinomycetes and lignin degradation [J]. Advances in Applied Microbiology, 2005, 58: 125-168. [57] LEYS N M, BASTIAENS L, VERSTRAETE W, et al. Influence of the carbon/nitrogen/phosphorus ratio on polycyclic aromatic hydrocarbon degradation by Mycobacterium and Sphingomonas in soil [J]. Applied Microbiology and Biotechnology, 2005, 66(6): 726-736. doi: 10.1007/s00253-004-1766-4 -



 下载:
下载:

