-
自2019年底,由新冠病毒(SARS-CoV-2)引起的新型冠状病毒肺炎(COVID-19)在世界范围内广泛传播,不但对世界各国经济产生严重影响,更造成了全球数百万人死亡。根据世界卫生组织的统计,截至2021年1月27日11时,全球累计确诊病例已超过1亿例,死亡人数超过210万人,单日新增确诊病例达到50万例[1]。正如许多专家所预测,2020年冬季在北半球出现了新一轮的COVID-19疫情高发期,这为各国疫情防控带来了极大的压力。加强病毒传播机制的研究和理解,完善疫情防控措施,及时有效阻断SARS-CoV-2的传播、减少人群感染几率被认为是当前各国面临的重要任务。
SARS-CoV-2是冠状病毒的一种,其传播途径一般包括飞沫传播,密切接触传播和在密闭空间中的气溶胶传播[2]。基于2002年冬季暴发的非典型肺炎的防控经验和研究结果,人们普遍认为高温对于病毒的消失起到了关键作用,许多研究也证实了环境因素(温度、湿度、大气颗粒物等)对病毒传播产生的重要影响[3]。然而,对于已在全球持续传播一年时间的SARS-CoV-2,人们仍然无法清楚地掌握其致病能力、传播途径和环境影响,导致即使在采取比较严密的防控措施后,仍然出现局部疫情暴发的现象,为疫情控制和预防措施实施带来不利影响。本文在检索现有文献资料的基础上,综述了SARS-CoV-2的研究进展,尤其针对影响SARS-CoV-2传播的环境因素进行了总结归纳,并对COVID-19产生的影响进行了梳理,以期为深入理解SARS-CoV-2的传播机制以及COVID-19疫情防控研究提供参考。
-
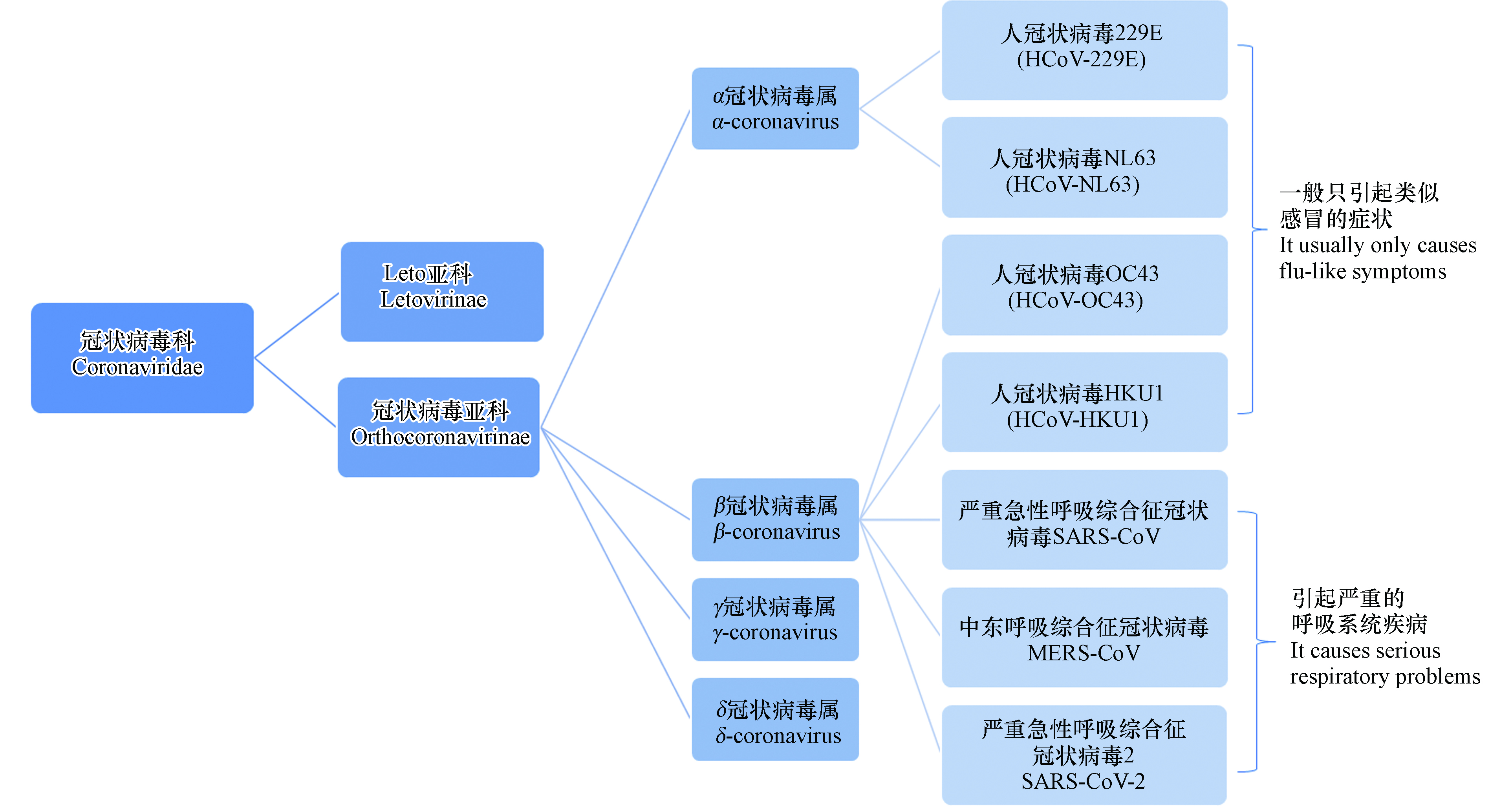
冠状病毒(Coronaviruses,CoVs)是一类包膜的单股正链核糖核酸(RNA)病毒,也是目前已知基因组最大的RNA病毒,在自然界中广泛存在,目前共发现有7种可致人感染的冠状病毒。图1为冠状病毒的分类,7种冠状病毒均属冠状病毒亚科,HCoV-229E、HCoV-NL63、HCoV-OC43、HCoV-HKU1仅引起类似感冒的症状,SARS-CoV、MERS-CoV、SARS-CoV-2会引起严重的呼吸系统疾病[4-5]。表1为SARS-CoV、MERS-CoV、SARS-CoV-2的基本信息[6-10]。
SARS-CoV-2颗粒呈圆形或椭圆形,直径60—140 nm,基因组全长约为30k nt,编码核衣壳蛋白(N)、包膜蛋白(E)、膜蛋白(M)和刺突蛋白(S)4种结构蛋白及非结构蛋白[4]。S蛋白是由S1和S2亚基组成的膜融合蛋白。S1亚基包含一个信号肽,N末端域和受体结合域(RBD),RBD负责与宿主细胞受体结合;S2亚基包含保守的融合肽,七肽重复序列HR1和HR2,跨膜结构域和胞质域,负责与宿主细胞膜融合[3, 9, 11]。在SARS-CoV-2 S蛋白的S1和S2亚基的连接处还存在Furin酶切位点(PRRA),可降低SARS-CoV-2 S蛋白的稳定性,有利于RBD与受体结合[12-14]。
由于新冠病毒的广泛传播,目前新冠病毒出现了多个变种,在英国发现的B.1.1.7毒株在S蛋白中携带一个突变(N501Y),从而影响受体结合域的构象,除此之外还有其他13个突变位点。这些突变不仅使得新冠病毒传播风险增加,而且可能影响某些诊断性实时荧光定量逆转录-聚合酶链反应(RT-PCR)检测的准确性[15],目前并没有证据表明该变种会导致更严重的临床表现或增加死亡风险。在南非发现的B.1.351变异株有3个主要突变:K417N、E484K和N501Y,研究表明该变异株可能通过逃避抗体的识别从而增加了病毒在人群中的传播风险[16]。
-
关于SARS-CoV-2的溯源工作仍在持续进行中,研究人员获取SARS-CoV-2的基因序列后,与两种蝙蝠源性SARS类冠状病毒进行对比,同源性达88%,另一研究团队发现SARS-CoV-2与蝙蝠冠状病毒同源性为96%,因此推测病毒源头可能是蝙蝠[17-18]。
但也有研究认为SARS-CoV-2的天然宿主是穿山甲,且可能存在中间宿主[19]。华南农业大学的研究人员在马来亚穿山甲中分离到的穿山甲病毒S蛋白的RBD与SARS-CoV-2的RBD的氨基酸序列仅有一个氨基酸的差异。通过比较基因组分析发现,SARS-CoV-2可能起源于一种类似穿山甲病毒与一种类似于蝙蝠RaTG 13病毒的重组[20]。从穿山甲中分离出与SARS-CoV-2密切相关的冠状病毒,表明这些动物有可能成为SARS-CoV-2的中间宿主。研究人员在东南亚进行蝙蝠和穿山甲的调查表明,SARS类冠状病毒存在于亚洲许多地区的蝙蝠之中,血清学证据表明穿山甲易感染SARS类冠状病毒,且病毒在该地区穿山甲群体中传播了17年[21]。香港大学的研究人员发现穿山甲中检出的冠状病毒属于SARS-CoV-2的两个亚种,其中一种的RBD与SARS-CoV-2有很强的相似性[22]。
近期,Oreshkova等发现荷兰两个水貂养殖场的SARS-CoV-2感染可能是由人引入,随后在水貂之间传播[23],之后又将病毒传给人[24],导致病毒在水貂场内动物与人之间来回溢出。多个国家(荷兰、丹麦、西班牙、法国、瑞典、意大利、美国和希腊等)都发现了水貂农场的SARS-CoV-2感染事件[25]。此外,也有研究人员认为蛇、海龟等也可能是潜在的中间宿主[25-26]。目前关于病毒的源头以及中间宿主并没有明确结论,溯源工作仍需深入开展。值得关注的是,多个国家报道了在COVID-19暴发之前采集的人血清样本中检测出新冠病毒抗体,这表明SARS-CoV-2的出现时间先于武汉报道的首例病例,这为溯源带来了新的视角,病毒溯源工作需要在全世界范围内开展。
-
病毒感染人依赖于细胞表面的主要受体。如图2所示,SARS-CoV-2和SARS-CoV主要受体都是血管紧张素转化酶2(ACE2)[12, 27]。张永振团队对SARS-CoV-2和SARS-CoV的RBD的氨基酸序列及蛋白质三维结构进行对比发现,两者高度相似,表明SARS-CoV-2可以有效利用人类ACE2作为进入细胞的受体[27]。这一结果也得到其他研究团队的证实[18]。SARS-CoV-2的传染源主要是有症状的SARS-CoV-2感染者和无症状的SARS-CoV-2感染者(从未出现症状),有症状的SARS-CoV-2感染者他们在发病后的5—6 d病毒载量达到峰值,无症状感染者传播病毒的可能性低于有症状的感染者[28-30]。病毒传播的途径主要是呼吸道飞沫以及密切接触者的传播,接触病毒污染的物品也有可能造成感染[31],在受污染的冷链物品中传播风险更大[32]。此外,长时间暴露于封闭的高浓度病毒的气溶胶环境中可能会导致气溶胶介导的病毒感染[33]。
新冠肺炎的一般症状为:发热、乏力、干咳、腹泻并逐渐出现呼吸困难[35-37]。除此之外,部分患者会出现嗅觉、味觉失常[36];有些患者会出现皮炎、湿疹、紫癜等皮肤疾病,部分患者仅出现皮炎症状[37-38]。严重者会引起急性呼吸窘迫综合征、脓毒症休克、难以纠正的代谢性酸中毒、出凝血功能障碍等并发症[35]。易感人群感染后或者接种SARS-CoV-2疫苗后可获得一定的免疫力,但持续时间尚不明确[39]。
-
COVID-19疑似病例的诊断主要是针对病毒的核酸进行检测分析。SARS-CoV-2的核酸检测主要包括两种分析方法,第一种是对患者呼吸道或血液标本中病毒颗粒的核酸进行实时荧光定量逆转录-聚合酶链反应(RT-PCR)试验,该方法被认为是鉴定SARS-CoV-2的金标准[40-41]。第二种是呼吸道标本或血液标本病毒基因测序,与已知的SARS-CoV-2高度同源即可确诊。除了以上两种方法,核酸检测法还有CRISPR技术和逆转录环介导等温扩增法(RT-LAMP)也可作为替代方法[42-44]。作为辅助核酸检测的手段,胸部 CT 影像在确诊 COVID-19 中也发挥了重要作用[41]。但在影像学中,COVID-19与其他病毒性肺炎的差别并不是很明显,特异性比较低,仅可作为一种辅助性的检测手段。免疫学检测方法中特异性IgM和IgG抗体检测阳性也被作为COVID-19确诊的标准之一。由于抗体检测存在窗口期,对于早期感染者无法诊断,因此采用核酸检测与特异性抗体检测相结合提高诊断效率[45].
COVID-19的治疗目前尚无特效药,治疗时主要加强对病人的支持性治疗和生命体征的监测工作,维持病人内环境的稳定以及血氧饱和度[46]。重型以及危重型患者自身的基础疾病较多,在治疗时更加要防范基础疾病以及由肺炎引起的并发症的风险,及时对器官功能进行支持(如呼吸支持、循环支持、抗凝治疗、急性肾损伤和肾替代治疗等)[46]。
COVID-19的潜在治疗方法包括抗病毒药物、输血等。截至2021年1月15日,用于治疗COVID-19的药物约有478种,人体临床实验的药物约有391种[47]。早期广受关注的瑞德西韦属于核苷类似物,主要是通过阻断病毒RNA合成来实现抗病毒的目的,是RNA依赖的RNA聚合酶抑制剂[48-49]。但美国过敏和传染病研究所和世界卫生组织(WHO)进行的瑞德西韦临床实验都表明,瑞德西韦对于降低新冠肺炎患者死亡率收效甚微[50-51]。洛匹那韦与利托那韦均具有体外抗病毒活性,但两者联合用药对新冠肺炎重症患者几乎没有治疗效果[52]。阿比多尔是一种广谱抗病毒药物,可阻断病毒包膜和宿主细胞膜的接触、粘附和融合,并阻断病毒复制[53]。除以上3种类型的抗病毒药物外,各种生物制剂也被用于治疗新冠肺炎患者。比如:干扰素、单克隆抗体和恢复期血浆等[49]。
作为防控疫情蔓延的重要手段,疫苗的研发工作必不可少。新冠疫苗根据其技术路线可分为减毒疫苗、灭活疫苗、亚单位疫苗、病毒载体疫苗、DNA疫苗和RNA疫苗等,已有多款疫苗进入临床三期试验阶段[14]。国药集团研发的灭活疫苗中和抗体阳性率为99%,疗效率为79.34%[54]。我国已于7月对重点人群紧急接种了灭活疫苗,普通民众于2020年12月开始疫苗的免费接种工作,已累计接种达4052万剂,严重不良反应报告发生率约为百万分之一[55-56]。陈薇院士团队与康诺西合作的Ad5-nCoV疫苗是将新冠病毒S蛋白(YP_009724390)构建到复制缺陷型Ad5腺病毒载体中,接种后合成S蛋白作为抗原被机体识别产生免疫效应[57]。现已进入第三期试验,主要是疫苗对健康成年人有效性的试验,在巴基斯坦进行的三期临床试验中期分析显示,单针疫苗对重症新冠肺炎的保护效力为100%,总体保护效力为74.8%[58]。
-
温度会影响病毒蛋白质的活性和病毒基因组稳定性,从而影响病毒的存活率。一般来说,随着温度的升高,病毒的存活率会下降[59]。澳大利亚的研究团队在P4实验室中模拟了温度对物体表面SARS-CoV-2存活时间的影响,湿度控制在50%左右,在20 ℃下,物体表面的活病毒可存活长达28 d,而在40 ℃下的存活不超过24 h[60]。Bukhari等分析了全球受COVID-19影响的各地区天气模式,发现COVID-19的报告病例中约有85%发生在气温为3—17 ℃、绝对湿度为1—9 g·m−3的地区,超出这些范围的炎热和潮湿地区报告病例仅为15%[61],这表明天气可能是影响新冠肺炎在世界各地蔓延的主要因素之一。Lowen等设计了流感病毒在20 ℃和5种不同的相对湿度(RH)下感染豚鼠的实验,实验结果表明,不同RH条件下流感病毒气溶胶传播效率不同。在RH值为20%或35%时,传代效率较高[62]。研究不同温度和RH条件下病毒在不锈钢表面存活情况发现,随着温度和RH的升高,病毒失活更快[63],相对温度在5.04—8.2 ℃范围内时,RH每增加1%,每日确诊病例减少11%—22%[64]。Xie等采用广义加性模型和分段线性回归来确定平均温度与新冠确诊病例之间的关系,发现在平均气温低于3 ℃时,两者之间近似线性关系[65]。澳大利亚的研究也表明低温有利于病毒更长时间的存活[60],中国近期暴发的小范围疫情与进口冷链食品的运输有关,北京新发地批发市场的疫情暴发经流行病学调查与大数据分析也发现其与进口受污染的冷链食品有关[66-67],受污染食品经过低温潮湿环境的运输,病毒的生存周期和传播距离大大延长,从而增加感染风险[68]。
多数研究认为温度会影响SARS-CoV-2的传播,但也有研究发现温度与SARS-CoV-2传播无明显关联。Yao等对中国224个城市的日平均气温、最高气温、最低气温、相对湿度和紫外线辐射进行多元回归分析,发现其对SARS-CoV-2的传播无明显影响[69]。此外,一项研究调查了中国的4个城市(北京、上海、重庆和武汉)以及意大利的5个地区(贝加莫,克雷莫纳,洛迪,米兰和布雷西亚)日确诊病例数与最大相对湿度(RHmax)、最高温度(Tmax)和最高风速(WSmax)之间的关系,结果发现日确诊病例数与Tmax的关系并不显著,而RHmax和WSmax的影响几乎可以忽略[70]。这也意味着“夏天”并不能阻止新冠肺炎在世界任何地方的蔓延[61]。2020年COVID-19已在全球范围内持续传播了一年,亦表明气温升高带来的影响有限,并不能完全阻止SARS-CoV-2的传播和疫情反弹。
-
大气颗粒物可作为病毒传播的运输载体,附着在颗粒物上的病毒随着人体呼吸进入体内,从而引起呼吸道疾病。空气中的氮氧化物会损害人体的免疫系统,降低肺部清除病毒的效率,增加感染的严重程度[71-72]。Cui等采用生态学分析法探讨了2003年4—5月空气污染与SARS病死率的关系,结果表明,空气污染指数(API)为中度的地区比低API地区的SARS患者死亡风险高84%,而高API地区的SARS患者死亡风险是低API地区的两倍,统计学分析结果显示,SARS病死率随着空气污染水平的升高而上升[73]。Zhu等采用高斯分布的广义加性模型估计了空气污染物浓度与COVID-19确诊病例的关系,PM2.5、PM10、CO、NO2和O3与COVID-19确诊病例呈显著正相关,而SO2与每日确诊病例数呈负相关[74]。为了有效控制COVID-19大流行,需要研究环境空气污染和病毒之间的相互作用及其综合影响。
除了室外空气污染,对室内气溶胶的研究也至关重要,在特定的室内环境中病毒通过空气中气溶胶传播感染的风险可能比室外更高[75]。一项关于医院内SARS-CoV-2的研究显示,医院重症监护室内的气溶胶检测结果呈阳性,院内医护的感染可能由落在防护服上的病毒沉积以及再悬浮所介导的,而在彻底消毒后的气溶胶中几乎检测不到病毒的存在[76]。
-
粪-口途径是部分传染病的主要传播方式。某些传染病的病原体随排泄物从患者或携带者体内排出后,可通过下水道污染水源进而导致易感者感染[77]。COVID-19爆发后,钟南山院士与李兰娟院士团队均从患者的粪便中分离出了SARS-CoV-2,表明SARS-CoV-2存在粪-口传播的风险[78]。一些COVID-19患者的粪便和尿液被排放到下水道系统,然后进入废水和污水处理工厂,被认为是SARS-CoV-2进入水环境中的主要途径[79]。2003年香港淘大花园聚集性感染事件发生后,研究人员利用计算流体力学以及多区域模型进行研究,推测SARS-CoV通过污水处理完成早期传播,随后又在人与人之间进行了广泛的传播[80]。然而,荷兰、澳大利亚、意大利、美国、法国等国家的科研人员均在污水中发现了SARS-CoV-2的存在,但尚未发现由污水引发的SARS-CoV-2传播案例[81-83]。
-
SARS-CoV-2是人畜共患病毒,荷兰水貂场病毒在人与水貂之间的不断溢出,增加了病毒变异的可能性,可能提高病毒的传播能力[24]。猫狗等家养宠物检测出新冠病毒阳性,但没有传播到人的案例[84]。蚊虫也可能是病毒传播的载体之一,蚊虫可能通过接触患者的分泌物和受污染的物体表面等方式参与COVID-19的扩散。但目前尚无有关通过昆虫传播SARS-CoV-2的报道[85]。生物因素和水环境传播等相关研究仍然较少,需要进一步深入开展。
-
SARS-CoV-2在众多无生命物体表面被检出且导致接触人群感染的事件屡有报道,这表明SARS-CoV-2具有一定的环境持久性。表2列出不同物体表面冠状病毒的存活时间[86-91]。
澳大利亚的一项模拟研究结果表明,在20 ℃的环境中,纸钞、玻璃、不锈钢等物品表面的活病毒,最长可存活时间为28 d,仅在温湿度影响的极端条件下,病毒才会在物体表面存活很久[60]。由此可见,SARS-CoV-2在物体表面的存活期普遍超过1 d,这为其感染接触人群提供了便利条件。
2020年6月北京新发地市场爆发小范围的疫情,溯源结果表明,病毒源头极有可能是境外疫情高发区的冷链进口食品,冷链运输或为新冠病毒传播新途径[32, 68]。2020年9月在青岛的常规核酸检测中发现两名冷链工人属于COVID-19无症状感染者,随后中国疾病预防控制中心在对无症状感染COVID-19的溯源过程中,在进口的冷冻鳕鱼外包装中分离出活病毒,对两名工人的咽拭子样本和冷冻鳕鱼外包装表面拭子样本进行了病毒分离和全基因组测序发现,病毒高度同源[92]。之后我国陆续在多地(北京新发地、新疆喀什、山东青岛、辽宁大连)冷冻产品以及食品包装袋上检测出SARS-CoV-2呈阳性,表明低温环境有利于病毒存活,物体及其外包装表面污染均可能导致该病毒传染到人,继而形成人传人的综合传播模式。目前关于SARS-CoV-2从被污染的物体表面传播到人体的效率并不清楚,还需进一步的研究[68]。
2003年部分患者在感染SARS-CoV 30 d后,即使咽拭子病毒核酸检测呈阴性,但是粪便中病毒核酸检测仍呈现阳性[93]。基于SARS-CoV-2与SARS-CoV的相似性,有研究对73名感染SARS-CoV-2的患者的每日粪便进行检测,病毒核酸检测1—12 d呈阳性[94],另有研究发现,55%患者的粪便样本中SARS-CoV-2病毒检测连续9—27 d呈阳性,而呼吸道样本病毒核酸检测连续7—16 d呈阳性[78],这表明即使在呼吸道病毒清除后,病毒仍有可能通过粪便排出,进入到污水处理系统。
而病毒在水环境中的存活时长取决于温度、pH及有机物等因素,其他拮抗微生物也会影响其存活[80, 95]。此外,早期研究发现,SARS-CoV可以在医院废水、生活污水和自来水中存活2 d[96], SARS-COV可在4 ℃的污水中存活14 d,在20 ℃下存活2 d[97]。芬兰的研究人员发现SARS-CoV-2可在4 ℃废水中存在29 d[98],意大利的研究人员对废水样本进行SARS-CoV-2病毒核酸检测,发现尽管废水样本中存在病毒RNA,但未产生由此引发的感染现象[99]。即使如此,仍有必要制定消毒措施,防止病毒通过水环境进行传播。研究指出,废水监测可以提供关于SARS-CoV-2在社区中广泛传播的预警信号,废水监测可作为一种监测病毒在人群中传播的指示方法,但监测的效率和灵敏度尚不清楚[100]。
医院中多数病原体会在无生命的物体表面持续存在数周甚至数月,而医院又是病毒最集中的地方,医院中病毒感染也是最常见的。采用 75% 乙醇溶液、过氧化物类和含氯类消毒剂对特定患者生活区域的物体表面进行消毒,可以有效灭活病毒,降低医院病原体从物体表面传播到易感患者的风险[72, 101]。人群密集、通风不良的室内空间,冷链食品环境,污水处理厂等都有必要进行病毒检测,以降低病毒的传播风险[102]。
-
为了应对新冠疫情而实行严格的居家隔离政策,使得多地生产生活活动基本处于“静止”状态,国内一些城市的环境污染问题在此期间得到了很大程度的改善,NOx浓度和PM2.5水平均有所下降[103]。与2019年同期相比,2020年初,武汉、湖北(不包括武汉)和中国(不包括湖北)的NO2、SO2和CO浓度显著下降[104],中国10个城市的PM2.5下降20%[105]。文献报道,受疫情影响,2020年全球的CO2排放量减少约26亿吨,较2019年下降7%[106]。此外,由于实行严格的居家隔离,公共活动的减少也使得噪音污染得到了极大的改善[107]。Chen等研究指出,由于空气质量的改善,一些慢性病人的死亡率亦有所降低[103]。
但与此同时,由于COVID-19全球大流行,医疗资源消耗巨大,产生的医疗废物也呈现急剧上升的趋势,从而增加了废物处理的压力,而医疗垃圾的不当处置也可能造成环境污染问题,需引起政府和社会的高度重视。如口罩的大量使用可能造成环境中微塑料的累积加剧,一些塑料进入海洋中,可能对水生生物的生存造成威胁[108-109]。对于微塑料的环境影响已有较多研究报道,其环境持久性以及附着的有机和无机污染物将可能带来一系列的生态问题[110-111]。此外,在COVID-19疫情期间,为了遏制SARS-CoV-2的传播,许多公共场所和办公区域等均增加了消毒措施和频次,可能导致环境中普遍存在消毒副产物,尽管研究表明生活废水和饮用水中的典型消毒副产物并没有明显增加[112],但仍可能存在未知的环境风险。
-
(1)尽管目前国内疫情得到了有效的控制,但是全球疫情形势依旧严峻,感染人群不断扩大。这为我国疫情的整体防控带来极大压力,目前的防控效果亦需持续观察。此外,SARS-CoV-2病毒变异株较多,潜伏期尚不明确,无症状感染者不能被及时发现,或者病毒携带者的多次采样检测假阴性等现状对防疫工作造成了极大的困难。因此,在疫情防控方面仍需做好打持久战的准备,科学有序开展防疫和病毒防治等工作。
(2)病毒的快速变异和花样翻新的传播途径如冷链运输传播等可能导致其更广泛的传播,因此病毒检测需要开发高通量和更灵敏的监测方法,及时获取其序列变化信息,综合多种检测手段判断,以提高病毒感染的确诊能力和防治效果。由于病毒的变异是在不断传播和增殖中产生的,因此有效控制病毒的传播也是防止新冠病毒变异的重要手段,这就要求人们保持一定的社交距离和个人卫生习惯,从而降低病毒传播和变异的几率。
(3)研究表明,SARS-CoV-2可以在一些物品表面存活数小时甚至数十天。通过低温(冷冻)食品、食品包装等传播SARS-CoV-2的可能性大大增加,这进一步拓展了人们对于SARS-CoV-2环境传播能力的认识,同时也为疫情防控带来新的挑战。如何从环境角度来控制病毒的传播成为当下亟需开展的研究工作,尤其是冷链运输传播途径可能造成的影响需加以评估。这一研究方向亦可能成为将来新的研究领域,对于认识病毒的环境过程、行为特征、感染机制、消杀控制等具有重要意义,同时对保障人们群众生命财产安全,维护国家安全具有重要意义。
(4)COVID-19疫情对人们的生活和工作方式造成了广泛的影响,一定程度上提升了人们的公共卫生意识,对于区域环境质量改善具有推动作用。然而疫情导致的生活垃圾和医疗废物增加等污染问题也将带来一定的环境风险,这对市政服务能力(如垃圾处理等)提出了新的要求;此外大量消毒防疫措施带来的环境隐患(如消毒副产物的环境影响)等需做全面评价,相关研究工作亦应深入开展。
新型冠状病毒(SARS-CoV-2)的环境传播研究进展
A review on the environmental transmission of novel coronavirus (SARS-CoV-2)
-
摘要:
自2019年12月暴发新型冠状病毒肺炎(COVID-19)以来,疫情已在全球200多个国家造成数百万人死亡,对世界经济产生了极大冲击。针对引起此次疫情的新型冠状病毒(SARS-CoV-2),世界各国积极开展了科学研究和预防控制措施,取得了许多重要的进展,为疫情防控做出了重要贡献。然而,作为疫情防控成效最显著的国家,在2020年6月份以后,我国多地出现了由“物传人”进而引发“人传人”的小范围疫情,表明SARS-CoV-2传播的复杂性;此外,国外疫情形势严峻,多国出现SARS-CoV-2变异毒株感染病例,使得疫情防控难度进一步加大。本文针对SARS-CoV-2的最新研究进行简要综述,包括病毒来源与感染机制,诊断和治疗方法,传播特征及环境影响等,重点对SARS-CoV-2传播的环境影响因素进行了梳理,以期提升对SARS-CoV-2环境传播的认识。
-
关键词:
- SARS-CoV-2 /
- 感染机制 /
- 诊断与治疗 /
- 环境传播 /
- 影响因素
Abstract:Since the outbreak of the new coronavirus pneumonia (COVID-19) in December 2019, it has caused millions of deaths in more than 200 countries all over the world, and the global economic development has been severely impacted. Concerning the new type of coronavirus (SARS-CoV-2) that caused the epidemic, scientific research has been actively carried out around the world as well as various prevention and control measures, which made important contribution to protect human health. However, as one of the countries that made outstanding achievements in the prevention and control of the epidemic, there were some regional epidemics of “object-to-human transmission” and then “human-to-human transmission” occurred after June 2020, indicating the complexity of the spread of SARS-CoV-2. In addition, the development of COVID-19 in some contraries is going uncontrollable recently, and infection cases of the SARS-CoV-2 variant strain have appeared in many countries, which made the prevention and control of the epidemic more difficult. This article briefly reviewed the updated research works on SARS-CoV-2, including possible sources of virus and infection mechanisms, diagnosis and treatment approaches, transmission characteristics and environmental impact, etc. In particular, the environmental factors affecting the transmission of SARS-CoV-2 are summarized in order to enhance the understanding of environmental transmission of SARS-CoV-2.
-

-
表 1 SARS-CoV、MERS-CoV和SARS-CoV-2的基本信息
Table 1. The basic information of Basic information of SARS-CoV, MERS-CoV and SARS-CoV-2
冠状病毒
Coronavirus暴发时间
Outbreak
time暴发地点
Outbreak
location死亡率
Mortality识别受体
Recognition receptor病毒-受体互作机制
Virus-Receptor Mechanism of action参考文献
ReferencesSARS-CoV(严重急性呼吸综合征冠状病毒) 2002.11 中国广东 10% 血管紧张转化
酶2(ACE2)其S蛋白的受体结合域中的突变(N497L和T487S)可以显著增加病毒与人体细胞表面受体血管紧张转化酶2(ACE2)的亲和力,从而具备较强的“人传人”能力 [6 - 7] MERS-CoV(中东呼吸综合征冠状病毒) 2012.9 沙特阿拉伯 34% 二肽基肽酶
4(DPP4)S蛋白被人的蛋白酶切割激活,然后与人体细胞表面受体二肽基肽酶4(DPP4)结合 [8] SARS-CoV-2(严重急性呼吸综合征冠状病毒2) 2019.12 中国武汉 估计值
6.6%血管紧张转化酶2(ACE2) 跨膜丝氨酸蛋白酶(TMPRSS2)启动S蛋白启动,S蛋白再以血管紧张转化酶2(ACE2)为受体进入细胞 [9 - 10] 表 2 冠状病毒在各种物体表面存活时间
Table 2. Coronavirus survival time on the surface of various objects
表面介质
Surface medium病毒
Virus接种量/mL
Inoculum TCID50温度/℃
Temperature相对湿度/%
Relative humidity存活时间
Survival time参考文献
References塑料 SARS-CoV 105 21—23 40 3 d [86] SARS-CoV 105 室温 NR1 4 d [87] SARS-CoV 105 22—25 40—50 5 d [88] MERS-CoV 105 20 40 2 d [89] SARS-CoV-2 105 21—23 40 3 d [86] SARS-CoV-2 106 室温 65 7 d [90] 不锈钢 SARS-CoV 105 21—23 40 2 d [86] MERS-CoV 105 20 40 2 d [89] SARS-CoV-2 105 21—23 40 2 d [86] SARS-CoV-2 106 室温 65 7 d [90] 纸质 SARS-CoV 104 室温 NR <5 min [91] SARS-CoV 105 室温 NR 3 h [91] SARS-CoV 106 室温 NR 24 h [91] SARS-CoV 105 21—23 40 8 h [86] SARS-CoV 105 室温 NR 4 d [87] SARS-CoV-2 105 21—23 40 1 d [86] SARS-CoV-2 106 室温 65 4 d [90] 铜 SARS-CoV 105 21—23 40 8 h [86] SARS-CoV-2 105 21—23 40 4 h [86] 玻璃 SARS-CoV 105 室温 NR 4 d [87] SARS-CoV-2 106 室温 65 4 d [90] 棉布 SARS-CoV 104 室温 NR 5 min [91] SARS-CoV 105 室温 NR 1 h [91] SARS-CoV 106 室温 NR 24 h [91] 木材 SARS-CoV 105 室温 NR 4 d [87] 1NR(Not Reported):未报告. -
[1] World Health Organization. WHO Coronavirus Disease (COVID-19) Dashboard [EB/OL]. [2021-1-27]. https://covid19.who.int/. [2] LAI C C, SHIH T P, KO W C, et al. Severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) and coronavirus disease-2019 (COVID-19): The epidemic and the challenges [J]. International Journal of Antimicrobial Agents, 2020, 55(3): 105924. doi: 10.1016/j.ijantimicag.2020.105924 [3] KUMAR S, SINGH R, KUMARI N, et al. Current understanding of the influence of environmental factors on SARS-CoV-2 transmission, persistence, and infectivity [J]. Environmental Science and Pollution Research, 2021, 28(6): 6267-6288. doi: 10.1007/s11356-020-12165-1 [4] CHAN F W, KOK K H, ZHU Z, et al. Genomic characterization of the 2019 novel human-pathogenic coronavirus isolated from a patient with atypical pneumonia after visiting Wuhan [J]. Emerging Microbes and Infections, 2020, 9(1): 221-236. doi: 10.1080/22221751.2020.1719902 [5] ABOUBAKR H A, SHARAFELDIN T A, GOYAL S M. Stability of SARS-CoV-2 and other coronaviruses in the environment and on common touch surfaces and the influence of climatic conditions: A review [J]. Transboundary and Emerging Diseases, 2021, 68(2): 296-312. doi: 10.1111/tbed.13707 [6] HILGENFELD R, PEIRIS M. From SARS to MERS: 10 years of research on highly pathogenic human coronaviruses [J]. Antiviral Research, 2013, 100(1): 286-295. doi: 10.1016/j.antiviral.2013.08.015 [7] GE X Y, LI J L, YANG X L, et al. Isolation and characterization of a bat SARS-like coronavirus that uses the ACE2 receptor [J]. Nature, 2013, 503(7477): 535-538. doi: 10.1038/nature12711 [8] KANDEIL A, GOMAA M, NAGEH A, et al. Middle East respiratory syndrome coronavirus (MERS-CoV) in dromedary camels in Africa and Middle East [J]. Viruses, 2019, 11(8): 717. doi: 10.3390/v11080717 [9] HOFFMANN M, KLEINE-WEBER H, SCHROEDER S, et al. SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor [J]. cell, 2020, 181(2): 271-280. doi: 10.1016/j.cell.2020.02.052 [10] TOYOSHIMA Y, NEMOTO K, MATSUMOTO S, et al. SARS-CoV-2 genomic variations associated with mortality rate of COVID-19 [J]. Journal of Human Genetics, 2020, 65(12): 1075-1082. doi: 10.1038/s10038-020-0808-9 [11] YAN R H, ZHANG Y Y, LI Y N, et al. Structural basis for the recognition of SARS-CoV-2 by full-length human ACE2 [J]. Science, 2020, 367(6485): 1444-1448. doi: 10.1126/science.abb2762 [12] WALLS A C, PARK Y J, TORTORICI M A, et al. Structure, function, and antigenicity of the SARS-CoV-2 spike glycoprotein [J]. Cell, 2020, 181(2): 281-292.e6. doi: 10.1016/j.cell.2020.02.058 [13] WRAPP D, WANG N, CORBETT K S, et al. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation [J]. Science, 2020, 367(6483): 1260-1263. doi: 10.1126/science.abb2507 [14] HU B, GUO H, ZHOU P, et al. Characteristics of SARS-CoV-2 and COVID-19 [J]. Nature Reviews Microbiology, 2020, 19(3): 141-154. doi: 10.1038/s41579-020-00459-7 [15] GALLOWAY S E, PAUL P, MACCANNELL D R, et al. Emergence of SARS-CoV-2 b. 1.1. 7 lineage—united states, december 29, 2020–january 12, 2021 [J]. Morbidity and Mortality Weekly Report, 2021, 70(3): 95-99. doi: 10.15585/mmwr.mm7003e2 [16] TEGALLY H, WILKINSON E, GIOVANETTI M, et al. Emergence and rapid spread of a new severe acute respiratory syndrome-related coronavirus 2 (SARS-CoV-2) lineage with multiple spike mutations in South Africa[J]. medRxiv, 2020 (preprint), [2021-2-27]. https://www.medrxiv.org/content/10.1101/2020.12.21.20248640v1.full. [17] LU R, ZHAO X, LI J, et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: Implications for virus origins and receptor binding [J]. The Lancet, 2020, 395(10224): 565-574. doi: 10.1016/S0140-6736(20)30251-8 [18] ZHOU P, YANG X L, WANG X G, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin [J]. Nature, 2020, 579(7798): 270-273. doi: 10.1038/s41586-020-2012-7 [19] ZHANG T, WU Q F, ZHANG Z G. Probable pangolin origin of SARS-CoV-2 associated with the COVID-19 outbreak [J]. Current Biology, 2020, 30(7): 1346-1351.e2. doi: 10.1016/j.cub.2020.03.022 [20] XIAO K P, ZHAI J Q, FENG Y Y, et al. Isolation of SARS-CoV-2-related coronavirus from Malayan pangolins [J]. Nature, 2020, 583(7815): 286-289. doi: 10.1038/s41586-020-2313-x [21] WACHARAPLUESADEE S, TAN C W, MANEEORN P, et al. Evidence for SARS-CoV-2 related coronaviruses circulating in bats and pangolins in Southeast Asia [J]. Nature Communications, 2021, 12(1): 972. doi: 10.1038/s41467-020-20314-w [22] LAM T T Y, JIA N, ZHANG Y W, et al. Identifying SARS-CoV-2-related coronaviruses in Malayan pangolins [J]. Nature, 2020, 583(7815): 282-285. doi: 10.1038/s41586-020-2169-0 [23] ORESHKOVA N, MOLENAAR R J, VREMAN S, et al. SARS-CoV-2 infection in farmed minks, the Netherlands, April and May 2020 [J]. Eurosurveillance, 2020, 25(23): 2001005. [24] MUNNINK B B O, SIKKEMA R S, NIEUWENHUIJSE D F, et al. Transmission of SARS-CoV-2 on mink farms between humans and mink and back to humans [J]. Science, 2021, 371(6525): 172-177. doi: 10.1126/science.abe5901 [25] ZHOU P, SHI Z-L. SARS-CoV-2 spillover events [J]. Science, 2021, 371(6525): 120-122. doi: 10.1126/science.abf6097 [26] LIU Z X, XIAO X, WEI X L, et al. Composition and divergence of coronavirus spike proteins and host ACE2 receptors predict potential intermediate hosts of SARS-CoV-2 [J]. Journal of Medical Virology, 2020, 92(6): 595-601. doi: 10.1002/jmv.25726 [27] WU F, ZHAO S, YU B, et al. A new coronavirus associated with human respiratory disease in China [J]. Nature, 2020, 579(7798): 265-269. doi: 10.1038/s41586-020-2008-3 [28] World Health Organization. Transmission of SARS-CoV-2: implications for infection prevention precautions: scientific brief, 09 July 2020. [EB/OL]. [2021-1-27]. https://apps.who.int/iris/handle/10665/333114. [29] WEI W E, LI Z B, CHIEW C J, et al. Presymptomatic transmission of SARS-CoV-2 - Singapore, January 23-March 16, 2020 [J]. MMWR. Morbidity and Mortality Weekly Report, 2020, 69(14): 411-415. doi: 10.15585/mmwr.mm6914e1 [30] PAN Y, ZHANG D T, YANG P, et al. Viral load of SARS-CoV-2 in clinical samples [J]. The Lancet. Infectious Diseases, 2020, 20(4): 411-412. doi: 10.1016/S1473-3099(20)30113-4 [31] CHAN J F W, YUAN S, KOK K H, et al. A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster [J]. The lancet, 2020, 395(10223): 514-523. doi: 10.1016/S0140-6736(20)30154-9 [32] HU L G, GAO J, YAO L L, et al. Evidence of foodborne transmission of the coronavirus (COVID-19) through the animal products food supply chain [J]. Environmental Science & Technology, 2021, 55(5): 2713-2716. [33] JAYAWEERA M, PERERA H, GUNAWARDANA B, et al. Transmission of COVID-19 virus by droplets and aerosols: A critical review on the unresolved dichotomy [J]. Environmental Research, 2020, 188: 109819. doi: 10.1016/j.envres.2020.109819 [34] ORTIZ-PRADO E, SIMBAñA-RIVERA K, GÓMEZ-BARRENO L, et al. Clinical, molecular and epidemiological characterization of the SARS-CoV2 virus and the Coronavirus disease 2019 (COVID-19), a comprehensive literature review [J]. DiagnosTic Microbiology and Infectious Disease, 2020, 98(1): 115094. doi: 10.1016/j.diagmicrobio.2020.115094 [35] HUANG C, WANG Y, LI X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China [J]. The lancet, 2020, 395(10223): 497-506. doi: 10.1016/S0140-6736(20)30183-5 [36] MENNI C, VALDES A M, FREIDIN M B, et al. Real-time tracking of self-reported symptoms to predict potential COVID-19 [J]. Nature Medicine, 2020, 26(7): 1037-1040. doi: 10.1038/s41591-020-0916-2 [37] YOUNG T K, SHAW K S, SHAH J K, et al. Mucocutaneous manifestations of multisystem inflammatory syndrome in children during the COVID-19 pandemic [J]. JAMA Dermatology, 2021, 157(2): 207-212. doi: 10.1001/jamadermatol.2020.4779 [38] HUBICHE T, CARDOT-LECCIA N, LE DUFF F, et al. Clinical, laboratory, and interferon-alpha response characteristics of patients with chilblain-like lesions during the COVID-19 pandemic [J]. JAMA Dermatology, 2021, 157(2): 202-206. doi: 10.1001/jamadermatol.2020.4324 [39] LONG Q X, TANG X J, SHI Q L, et al. Clinical and immunological assessment of asymptomatic SARS-CoV-2 infections [J]. Nature Medicine, 2020, 26(8): 1200-1204. doi: 10.1038/s41591-020-0965-6 [40] CHEN N, ZHOU M, DONG X, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: A descriptive study [J]. The lancet, 2020, 395(10223): 507-513. doi: 10.1016/S0140-6736(20)30211-7 [41] 詹菁, 刘倩, 张雨竹, 等. 新型冠状病毒2019-nCoV的一些初步认识 [J]. 环境化学, 2020, 39(2): 283-291. doi: 10.7524/j.issn.0254-6108.2020021501 ZHAN J, LIU Q, ZHANG Y Z, et al. Preliminary understanding of the novel coronavirus 2019-nCoV [J]. Environmental Chemistry, 2020, 39(2): 283-291(in Chinese). doi: 10.7524/j.issn.0254-6108.2020021501
[42] 王洁, 高嵩钰, 朱仁心, 等. 当前新冠病毒的主要检测手段 [J]. 中国比较医学杂志, 2021, 31(1): 120-124. WANG J, GAO S Y, ZHU R X, et al. Main detection methods of SARS-CoV-2 [J]. Chinese Journal of Comparative Medicine, 2021, 31(1): 120-124(in Chinese).
[43] MATHEW R P, JOSE M, JAYARAM V, et al. Current status quo on COVID-19 including chest imaging [J]. World Journal of Radiology, 2020, 12(12): 272. doi: 10.4329/wjr.v12.i12.272 [44] CARTER L J, GARNER L V, SMOOT J W, et al. Assay techniques and test development for COVID-19 diagnosis [J]. ACS Central Science, 2020, 6(5): 591-605. doi: 10.1021/acscentsci.0c00501 [45] 王春霞, 曲广波, 陈拥军. 新型冠状病毒肺炎疫情防控中的化学力量 [J]. 科学通报, 2020, 65(22): 2321-2325. doi: 10.1360/TB-2020-0600 WANG C X, QU G B, CHEN Y J. Coronavirus (COVID-19) combat: The power of chemistry [J]. Chinese Science Bulletin, 2020, 65(22): 2321-2325(in Chinese). doi: 10.1360/TB-2020-0600
[46] LI Z, LIU G L, WANG L, et al. From the insight of glucose metabolism disorder: Oxygen therapy and blood glucose monitoring are crucial for quarantined COVID-19 patients [J]. Ecotoxicology and Environmental Safety, 2020, 197: 110614. doi: 10.1016/j.ecoenv.2020.110614 [47] COVID-19 Vaccine & Therapeutics Tracker [EB/OL]. [2021-1-15]. https://biorender.com/covid-vaccine-tracker. [48] LI H, LIU Z, GE J B. Scientific research progress of COVID-19/SARS-CoV-2 in the first five months [J]. Journal of Cellular and Molecular Medicine, 2020, 24(12): 6558-6570. doi: 10.1111/jcmm.15364 [49] 邢颖, 刘文彬. 抗击新型冠状病毒肺炎的药物和治疗方案的阶段性研究进展 [J]. 科学通报, 2020, 65(22): 2326-2333. doi: 10.1360/TB-2020-0194 XING Y, LIU W B. Recent research for COVID-19 drugs and therapies [J]. Chinese Science Bulletin, 2020, 65(22): 2326-2333(in Chinese). doi: 10.1360/TB-2020-0194
[50] MALIN J J, SUÁREZ I, PRIESNER V, et al. Remdesivir against COVID-19 and other viral diseases [J]. Clinical Microbiology Reviews, 2020, 34(1). doi: 10.1128/CMR.00162-20 [51] CONSORTIUM W S T. Repurposed antiviral drugs for COVID-19—interim WHO SOLIDARITY trial results [J]. New England Journal of Medicine, 2021, 384(6): 497-511. doi: 10.1056/NEJMoa2023184 [52] CAO B, WANG Y M, WEN D N, et al. A trial of lopinavir-ritonavir in adults hospitalized with severe covid-19 [J]. The New England Journal of Medicine, 2020, 382(19): 1787-1799. doi: 10.1056/NEJMoa2001282 [53] YANG C G, KE C J, YUE D Y, et al. Effectiveness of arbidol for COVID-19 prevention in health professionals [J]. Frontiers in Public Health, 2020, 8: 249. doi: 10.3389/fpubh.2020.00249 [54] 国药集团. 国药集团中国生物新冠灭活疫苗获批附条件上市 [EB/OL]. [2020-12-31]. http://www.sinopharm.com/s/1223-4126-38840.html. SINOPHARM.. Sinopharm China Biotech Covid-19 Inactivated Vaccine Approved for Conditional Listing [EB/OL]. [2020-12-31]. http://www.sinopharm.com/s/1223-4126-38840.html(in Chinese).
[55] 央视网. 我国新冠疫苗研发进度持续推进 已于7月22日启动疫苗紧急使用[EB/OL]. [2020-8-23]. https://news.cctv.com/2020/08/23/ARTIWp0QA3GdDkgXxmPSrBWX200823.shtml. CCTV. The progress of my country’s new crown vaccine research and development continues, and emergency use of the vaccine has been launched on July 22 [EB/OL]. [2020-8-23]. https://news.cctv.com/2020/08/23/ARTIWp0QA3GdDkgXxmPSrBWX200823.shtml(in Chinese).
[56] 央广网. 国家卫健委: 全国累计报告接种新冠疫苗4052万剂次[EB/OL]. [2021-2-10]http://health.cnr.cn/yg/20210210/t20210210_525412739.shtml. Cnr. cn. National Health Commission: 40.52 million doses of COVID-19 vaccine reported nationwide [EB/OL]. [2021-2-10]http://health.cnr.cn/yg/20210210/t20210210_525412739.shtml(in Chinese).
[57] ZHU F C, GUAN X H, LI Y H, et al. Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: A randomised, double-blind, placebo-controlled, phase 2 trial [J]. Lancet, 2020, 396(10249): 479-488. doi: 10.1016/S0140-6736(20)31605-6 [58] 京报网. 陈薇团队新冠疫苗三期临床试验结果 [EB/OL]. [2021-2-9]. https://news.bjd.com.cn/2021/02/09/48641t100.html. JBW. The phase Ⅲ clinical trial results results of Ad5-nCoV [EB/OL]. [2021-2-9]. https://news.bjd.com.cn/2021/02/09/48641t100.html (in Chinese).
[59] TANG J W. The effect of environmental parameters on the survival of airborne infectious agents [J]. Journal of the Royal Society, Interface, 2009, 6(Suppl 6): S737-S746. [60] RIDDELL S, GOLDIE S, HILL A, et al. The effect of temperature on persistence of SARS-CoV-2 on common surfaces [J]. Virology Journal, 2020, 17(1): 145. doi: 10.1186/s12985-020-01418-7 [61] BUKHARI Q, MASSARO J M, D’AGOSTINO R B, et al. Effects of weather on coronavirus pandemic [J]. International Journal of Environmental Research and Public Health, 2020, 17(15): 5399. doi: 10.3390/ijerph17155399 [62] LOWEN A C, MUBAREKA S, STEEL J, et al. Influenza virus transmission is dependent on relative humidity and temperature [J]. PLoS Pathogens, 2007, 3(10): 1470-1476. [63] CASANOVA L M, JEON S, RUTALA W A, et al. Effects of air temperature and relative humidity on coronavirus survival on surfaces [J]. Applied and Environmental Microbiology, 2010, 76(9): 2712-2717. doi: 10.1128/AEM.02291-09 [64] QI H C, XIAO S, SHI R Y, et al. COVID-19 transmission in Mainland China is associated with temperature and humidity: A time-series analysis [J]. The Science of the Total Environment, 2020, 728: 138778. doi: 10.1016/j.scitotenv.2020.138778 [65] XIE J, ZHU Y. Association between ambient temperature and COVID-19 infection in 122 cities from China [J]. Science of the Total Environment, 2020, 724: 138201. doi: 10.1016/j.scitotenv.2020.138201 [66] FISHER D, REILLY A, ZHENG A K E, et al. Seeding of outbreaks of COVID-19 by contaminated fresh and frozen food[J]. BioRxiv, 2020, (BioRxiv). https://www.biorxiv.org/content/10.1101/2020.08.17.255166v1.abstract. [67] PANG X H, REN L L, WU S S, et al. Cold-chain food contamination as the possible origin of COVID-19 resurgence in Beijing [J]. National Science Review, 2020, 7(12): 1861-1864. doi: 10.1093/nsr/nwaa264 [68] CEYLAN Z, MERAL R, CETINKAYA T. Relevance of SARS-CoV-2 in food safety and food hygiene: Potential preventive measures, suggestions and nanotechnological approaches [J]. VirusDisease, 2020, 31(2): 154-160. doi: 10.1007/s13337-020-00611-0 [69] YAO Y, PAN J, LIU Z, et al. No association of COVID-19 transmission with temperature or UV radiation in Chinese cities [J]. European Respiratory Journal, 2020, 55(5): 2000517. doi: 10.1183/13993003.00517-2020 [70] BHATTACHARJEE S. Statistical investigation of relationship between spread of coronavirus disease (COVID-19) and environmental factors based on study of four mostly affected places of China and five mostly affected places of Italy[J]. arXiv preprint arXiv: 200311277, 2020 https://arxiv.org/abs/2003.11277 (preprint). [71] QU G B, LI X D, HU L G, et al. An imperative need for research on the role of environmental factors in transmission of novel coronavirus (COVID-19) [J]. Environmental Science & Technology, 2020, 54(7): 3730-3732. [72] ZHAN J, LIU Q S, SUN Z D, et al. Environmental impacts on the transmission and evolution of COVID-19 combing the knowledge of pathogenic respiratory coronaviruses [J]. Environmental Pollution, 2020, 267: 115621. doi: 10.1016/j.envpol.2020.115621 [73] CUI Y, ZHANG Z-F, FROINES J, et al. Air pollution and case fatality of SARS in the People's Republic of China: an ecologic study [J]. Environmental Health, 2003, 2(1): 1-5. doi: 10.1186/1476-069X-2-1 [74] ZHU Y J, XIE J G, HUANG F M, et al. Association between short-term exposure to air pollution and COVID-19 infection: Evidence from China [J]. The Science of the Total Environment, 2020, 727: 138704. doi: 10.1016/j.scitotenv.2020.138704 [75] CONTINI D, COSTABILE F. Does air pollution influence COVID-19 outbreaks?[M]. Multidisciplinary Digital Publishing Institute. 2020, 11(4). DOI: 10.1016/j.scitotenv.2020.138704. [76] LIU Y, NING Z, CHEN Y, et al. Aerodynamic analysis of SARS-CoV-2 in two Wuhan hospitals [J]. Nature, 2020, 582(7813): 557-560. doi: 10.1038/s41586-020-2271-3 [77] de GRAAF M, BECK R, CACCIO S M, et al. Sustained fecal-oral human-to-human transmission following a zoonotic event [J]. Current Opinion in Virology, 2017, 22: 1-6. doi: 10.1016/j.coviro.2016.11.001 [78] WU Y J, GUO C, TANG L T, et al. Prolonged presence of SARS-CoV-2 viral RNA in faecal samples [J]. The Lancet. Gastroenterology & Hepatology, 2020, 5(5): 434-435. [79] TRAN H N, LE G T, NGUYEN D T, et al. SARS-CoV-2 coronavirus in water and wastewater: A critical review about presence and concern [J]. Environmental Research, 2020, 193: 110265. doi: 10.1016/j.envres.2020.110265 [80] YU I T S, LI Y G, WONG T W, et al. Evidence of airborne transmission of the severe acute respiratory syndrome virus [J]. The New England Journal of Medicine, 2004, 350(17): 1731-1739. doi: 10.1056/NEJMoa032867 [81] AHMED W, ANGEL N, EDSON J, et al. First confirmed detection of SARS-CoV-2 in untreated wastewater in Australia: A proof of concept for the wastewater surveillance of COVID-19 in the community [J]. The Science of the Total Environment, 2020, 728: 138764. doi: 10.1016/j.scitotenv.2020.138764 [82] LA R G, IACONELLI M, MANCINI P, et al. First detection of SARS-CoV-2 in untreated wastewaters in Italy [J]. The Science of the Total Environment, 2020, 736: 139652. doi: 10.1016/j.scitotenv.2020.139652 [83] MEDEMA G, HEIJNEN L, ELSINGA G, et al. Presence of SARS-coronavirus-2 RNA in sewage and correlation with reported COVID-19 prevalence in the early stage of the epidemic in the Netherlands [J]. Environmental Science & Technology Letters, 2020, 7(7): 511-516. [84] SALAJEGHEH TAZERJI S, MAGALHÃES DUARTE P, RAHIMI P, et al. Transmission of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) to animals: An updated review [J]. Journal of Translational Medicine, 2020, 18(1): 358. doi: 10.1186/s12967-020-02534-2 [85] ESLAMI H, JALILI M. The role of environmental factors to transmission of SARS-CoV-2 (COVID-19) [J]. AMB Express, 2020, 10(1): 92. doi: 10.1186/s13568-020-01028-0 [86] van DOREMALEN N, BUSHMAKER T, MORRIS D H, et al. Aerosol and surface stability of SARS-CoV-2 as compared with SARS-CoV-1 [J]. The New England Journal of Medicine, 2020, 382(16): 1564-1567. doi: 10.1056/NEJMc2004973 [87] DUAN S M, ZHAO X S, WEN R F, et al. Stability of SARS coronavirus in human specimens and environment and its sensitivity to heating and UV irradiation [J]. Biomedical and Environmental Sciences, 2003, 16(3): 246-255. [88] CHAN K H, PEIRIS J S M, LAM S Y, et al. The effects of temperature and relative humidity on the viability of the SARS coronavirus [J]. Advances in Virology, 2011, 2011: 734690. [89] VAN D N, BUSHMAKER T, Munster V J. Stability of Middle East respiratory syndrome coronavirus (MERS-CoV) under different environmental conditions [J]. Eurosurveillance, 2013, 18(38): 20590. [90] CHIN A W H, CHU J T S, PERERA M R A, et al. Stability of SARS-CoV-2 in different environmental conditions [J]. The Lancet. Microbe, 2020, 1(1): e10. doi: 10.1016/S2666-5247(20)30003-3 [91] LAI M Y Y, CHENG P K C, LIM W W L. Survival of severe acute respiratory syndrome coronavirus [J]. Clinical Infectious Diseases, 2005, 41(7): e67-e71. doi: 10.1086/433186 [92] LIU P, YANG M, ZHAO X, et al. Cold-chain transportation in the frozen food industry may have caused a recurrence of COVID-19 cases in destination: Successful isolation of SARS-CoV-2 virus from the imported frozen cod package surface [J]. Biosafety and Health, 2020, 2(4): 199-201. doi: 10.1016/j.bsheal.2020.11.003 [93] CHAN K H, POON L L L M, CHENG V C C, et al. Detection of SARS coronavirus in patients with suspected SARS [J]. Emerging Infectious Diseases, 2004, 10(2): 294-299. doi: 10.3201/eid1002.030610 [94] XIAO F, TANG M W, ZHENG X B, et al. Evidence for gastrointestinal infection of SARS-CoV-2 [J]. Gastroenterology, 2020, 158(6): 1831-1833.e3. doi: 10.1053/j.gastro.2020.02.055 [95] CARRATURO F, del GIUDICE C, MORELLI M, et al. Persistence of SARS-CoV-2 in the environment and COVID-19 transmission risk from environmental matrices and surfaces [J]. Environmental Pollution, 2020, 265(Pt B): 115010. [96] WANG X, LI J, GUO T, et al. Concentration and detection of SARS coronavirus in sewage from Xiao Tang Shan Hospital and the 309th Hospital of the Chinese People’s Liberation Army [J]. Water Science and Technology, 2005, 52(8): 213-221. doi: 10.2166/wst.2005.0266 [97] AL HURAIMEL K, ALHOSANI M, KUNHABDULLA S, et al. SARS-CoV-2 in the environment: Modes of transmission, early detection and potential role of pollutions [J]. The Science of the Total Environment, 2020, 744: 140946. doi: 10.1016/j.scitotenv.2020.140946 [98] HOKAIRVI A M, RYTKNEN A, TIWARI A, et al. The detection and stability of the SARS-CoV-2 RNA biomarkers in wastewater influent in Helsinki, Finland [J]. Science of The Total Environment, 2021, 770: 145274. doi: 10.1016/j.scitotenv.2021.145274 [99] RIMOLDI S G, STEFANI F, GIGANTIELLO A, et al. Presence and vitality of SARS-CoV-2 virus in wastewaters and rivers [J]. Science of The Total Environment, 2020: 140911. doi: 10.1016/j.scitotenv.2020.140911 [100] WU F, ZHANG J, XIAO A, et al. SARS-CoV-2 Titers in wastewater are higher than expected from clinically confirmed cases [J]. mSystems, 2020, 5(4): e00614-20. doi: 10.1128/mSystems.00614-20 [101] KRAMER A, SCHWEBKE I, KAMPF G. How long do nosocomial pathogens persist on inanimate surfaces?A systematic review [J]. BMC Infectious Diseases, 2006, 6(1): 130. doi: 10.1186/1471-2334-6-130 [102] YAO L, ZHU W, SHI J, et al. Detection of coronavirus in environmental surveillance and risk monitoring for pandemic control [J]. Chemical Society Reviews, 2021, 50(6): 3656-3676. doi: 10.1039/D0CS00595A [103] CHEN K, WANG M, HUANG C H, et al. Air pollution reduction and mortality benefit during the COVID-19 outbreak in China [J]. The Lancet. Planetary Health, 2020, 4(6): e210-e212. doi: 10.1016/S2542-5196(20)30107-8 [104] CHU B W, ZHANG S P, LIU J, et al. Significant concurrent decrease in PM2.5 and NO2 concentrations in China during COVID-19 epidemic [J]. Journal of Environmental Sciences (China), 2021, 99: 346-353. doi: 10.1016/j.jes.2020.06.031 [105] ESPEJO W, CELIS J E, CHIANG G, et al. Environment and COVID-19: Pollutants, impacts, dissemination, management and recommendations for facing future epidemic threats [J]. The Science of the Total Environment, 2020, 747: 141314. doi: 10.1016/j.scitotenv.2020.141314 [106] LE QUÉRÉ C, PETERS G P, FRIEDLINGSTEIN P, et al. Fossil CO2 emissions in the post-COVID-19 era [J]. Nature Climate Change, 2021, 11(3): 197-199. doi: 10.1038/s41558-021-01001-0 [107] ZAMBRANO-MONSERRATE M A, RUANO M A, SANCHEZ-ALCALDE L. Indirect effects of COVID-19 on the environment [J]. The Science of the Total Environment, 2020, 728: 138813. doi: 10.1016/j.scitotenv.2020.138813 [108] FADARE O O, OKOFFO E D. Covid-19 face masks: A potential source of microplastic fibers in the environment [J]. The Science of the Total Environment, 2020, 737: 140279. doi: 10.1016/j.scitotenv.2020.140279 [109] ARAGAW T A. Surgical face masks as a potential source for microplastic pollution in the COVID-19 scenario [J]. Marine Pollution Bulletin, 2020, 159: 111517. doi: 10.1016/j.marpolbul.2020.111517 [110] GHAYEBZADEH M, TAGHIPOUR H, ASLANI H. Estimation of plastic waste inputs from land into the Persian Gulf and the Gulf of Oman: An environmental disaster, scientific and social concerns [J]. Science of The Total Environment, 2020, 733: 138942. doi: 10.1016/j.scitotenv.2020.138942 [111] MAGALHES S, ALVES L, MEDRONHO B, et al. Microplastics in ecosystems: From current trends to bio-based removal strategies [J]. Molecules, 2020, 25(17): 3954. doi: 10.3390/molecules25173954 [112] LI Z G, SONG G F, BI Y H, et al. Occurrence and distribution of disinfection byproducts in domestic wastewater effluent, tap water, and surface water during the SARS-CoV-2 pandemic in China [J]. Environmental Science & Technology, 2021, 55(7): 4103-4114. -



 下载:
下载:


