-
随着现代社会与工业发展的不断进步,人类对能源的需求日益增加。化石能源燃烧引发的环境污染问题,迫切要求人类开发清洁高效的新能源。氢气具有热值高、能量利用率高、来源广泛等优点,且燃烧产物为水,不会造成环境污染,被视为是21世纪最具应用前景的清洁能源[1-2]。目前工业上常用的制氢方法包括甲醇蒸汽重整制氢[3]、电解水制氢[4]、煤气化制氢[5]、天然气或裂解石油气制氢[6]、氨分解制氢[7]等。其中氨分解制氢具有工艺简单、制得氢气纯度高且不会产生COx、投资少、成本低等优点,受到广泛的关注和研究[8]。
氨分解制氢反应主要采用高温催化裂解,反应方程如下:
该反应为可逆的吸热反应,据热力学计算可知,在常压、400 ℃时,理论上可实现NH3几乎完全转化。然而由于该反应活化能非常高,受动力学控制,实际上在常压、700 ℃及不添加催化剂条件下,NH3的转化率不到10%[9]。因此,氨分解制氢反应的关键在于催化剂的选择与构建。
目前,应用于氨分解的催化剂主要包括贵金属催化剂(Ru、Ir、Pt等)、过渡金属催化剂(Fe、Ni、Co、Mo等)以及FeCx、MoCx、FeNx等碳化物催化剂和氮化物催化剂[10-13]。尽管贵金属催化剂(特别是Ru基催化剂)具有很高的氨分解反应活性,但其资源稀少、价格昂贵,从而限制了大规模的应用。而过渡金属催化剂资源丰富、价格低廉,并且具有一定的氨分解活性,因此得到了广泛的关注。其中Fe基催化剂相较于其他过渡金属催化剂具有较高的氨催化活性,催化剂的原料来源广泛,相对于Ni基等催化剂成本更低并且具有更好的稳定性,已经成为现今研究和应用的重要催化剂之一。目前报道的Fe基催化剂主要集中于负载型催化剂、核壳结构催化剂以及助剂修饰的催化剂[14]。Hu等[15]通过固相离子交换法制备了一系列脱铝ZSM-5分子筛负载的Fe基催化剂用于氨分解制氢,表征测试结果显示当负载量为9%时,Fe物种高度分散在载体表面,并且在650 ℃时几乎实现NH3完全转化;当Fe负载量进一步增加到12%时,催化剂活性出现了明显的下降,可能是因为较高的负载量使得载体表面形成结块状的Fe颗粒,降低了活性Fe物种的分散度从而抑制了反应活性。Mathias等[16]研究了具有核壳结构的α-Fe2O3@多孔氧化硅催化剂的氨分解催化性能,实验中首先采用水热法合成α-Fe2O3纳米颗粒,其次通过碱性条件下水解硅源(正硅酸乙酯)进行颗粒的包覆从而合成所需材料。该核壳结构催化剂在空速120000 cm3·(gcat·h)−1、温度750 ℃的条件下能稳定运行33 h,保持转化率约为80%,催化性能相对于物理混合的α-Fe2O3和氧化硅催化剂有了明显提升。为了进一步提升催化剂在氨分解反应中的活性和稳定性,助催化剂的使用是一种有效的方法。碱金属和碱土金属都是比较理想的氨催化分解反应助剂,碱金属能够改善金属活性物种周围的电子环境,促进N原子在催化剂表面的吸附,进而提高催化剂的活性;能够调节催化剂的几何结构和电子结构,提高催化剂的催化活性和热稳定性[17]。Jaclyn等[18]研究了以La2O3和Ce-Zr氧化物为助剂对Al2O3负载的Fe-Mo双金属催化剂在氨分解反应中的性能影响,活性测试和表征技术的结果显示,La2O3修饰的催化剂具有最高的反应活性,在700 ℃时NH3的转化率达到99%以上,其原因在于La2O3使催化剂具有一定的表面碱性,有利于反应产物中氮的脱附。目前的研究中,负载型催化剂面临的主要问题是可负载的活性Fe物种的含量受到限制,提高负载量容易使表面活性金属发生团聚,从而导致催化剂的氨分解活性降低,并且负载型催化剂的热稳定性有待进一步提高。对于核壳结构催化剂,其合成过程通常较为复杂,因此在一定程度上限制此类催化材料在氨分解制氢中的应用。
六铝酸盐是一种具有独特热稳定性的催化材料,其通式为AAl12O19(A位离子为碱金属离子、碱土金属离子或稀土金属离子),在工业上常被用于甲烷催化燃烧反应和重整制合成气等反应中。六铝酸盐其纵向有序、横向无序的立体结构决定了它耐高温、稳定性强的特点,同时晶格的特殊排布可以容纳其它离子在A位和B位(Al)的取代,而过渡金属取代后所得催化剂中活性组分间呈原子级均匀分布、具有较强的协同效应,表现出更高的催化活性。在本研究中,以Fe进行B位Al的部分取代,催化剂的A位选择能够改善活性组分几何结构和电子结构的稀土金属La,合成了一系列不同Fe取代量的LaFexAl12-xO19六铝酸盐催化剂,通过取代量的改变调节催化剂的结构,系统考察了不同Fe取代量对催化剂结构和氨催化分解活性的影响。
-
采用并流共沉淀法制备LaFexAl12-xO19(LaFex,其中x=0,2,4,6,8)六铝酸盐催化剂。具体过程描述如下:将一定量的La(NO3)3·6H2O、Fe(NO3)3·9H2O和Al(NO3)3·9H2O按摩尔比La∶Fe∶Al=1∶x∶12-x溶解于100 mL的60 ℃去离子水中,搅拌混合均匀,得到浓度为1 mol·L−1的混合硝酸盐溶液,记为溶液A;用去离子水配制1 mol·L−1的(NH4)2CO3溶液,记为溶液B;然后在60 ℃水浴搅拌下,采用双股并流法将溶液A和溶液B同时滴加到150 mL去离子水中,并调节pH保持在8左右。待硝酸盐沉淀完毕之后,继续在60 ℃静置老化4 h;将所得沉淀物离心、洗涤,在110 °C烘箱中干燥12 h,得到固体材料。将固体材料研磨成粉后,先在马弗炉500 ℃煅烧2 h,再在1200 ℃煅烧4 h,得到所需LaFexAl12-xO19六铝酸盐催化剂。所有制备的催化剂均简化缩写为LaFex(x=0,2,4,6,8),如LaFe2代表催化剂LaFe2Al10O19。
-
利用X射线衍射技术(XRD)测定催化剂的物相结构。本实验采用荷兰PANalytical X’pert PRO粉末衍射仪测得催化剂的XRD谱图。采用Cu Kα 作为激发光源,λ为0.154 nm,管压为40 kV,管流为40 mA,测试范围为5°—90°,扫描速率为1(°)·min−1。利用国际衍射数据中心(ICDD)的PDF数据库分析晶相。采用Scherrer公式计算催化剂晶粒尺寸。
其中,K为Scherrer常数(K=0.89),β为实测样品衍射峰半高宽度,θ为XRD衍射角,λ为X射线波长(λ=1.54056 nm)。
催化剂的比表面积、孔结构等性质通过在液氮温度下测定其氮气的吸脱附等温线得到,等温线在Micromeritics ASAP-2020 PLUS HD88气体分析仪上获得。操作过程为:称取一定量的催化剂置于样品管中,在300 ºC真空条件下脱气处理3 h,然后对催化剂进行分析。BET模型用来计算催化剂的比表面积(SBET),t-plot方法用来计算催化剂的微孔比表面积和微孔孔容,相对压力范围为0.03—0.30;BJH模型用来计算得到介孔分布,DFT方法用来计算得到微孔分布。根据最大压力下氮气的吸附量计算可得催化剂的总孔体积(Vp),根据公式Dp=4Vp/SBET计算可得催化剂的平均孔径。
催化剂表面的元素组成和化学价态在Thermo ESCALAB 250 X射线光电子能谱仪进行测试,采用Al Kα为X射线的激发光源,C1s结合能峰为内标(结合能为284.6 eV)。
催化剂的紫外-可见漫反射光谱(DR UV-vis)通过Hitachi UV3000紫外光谱仪进行测试,采用漫反射技术,硫酸钡作为参比,扫描范围为200—900 nm。
催化剂的程序升温还原(H2-TPR)在Micrometrics AutoChem Ⅱ程序升温仪上进行,在TPR运行之前,对装填在U型石英管中的50 mg催化剂进行预处理,即在He气流(50 mL·min−1)下在300 ºC保持1 h,然后切换至He吹扫冷却至室温,切换至2 %(体积分数). H2/He混合气(50 mL·min−1),以10 ºC·min−1的速率升温到600 ºC,流出的气体采用热导检测器(TCD)进行检测,计算机在线记录得到TPR谱图。
拉曼光谱(Raman)采用共聚焦显微镜多通道拉曼光谱仪Horiva Jobin Yvon LabRam HR800测定,激光器波长为532 nm,测量波数范围100—1000 cm−1,光谱分辨率1cm−1。
-
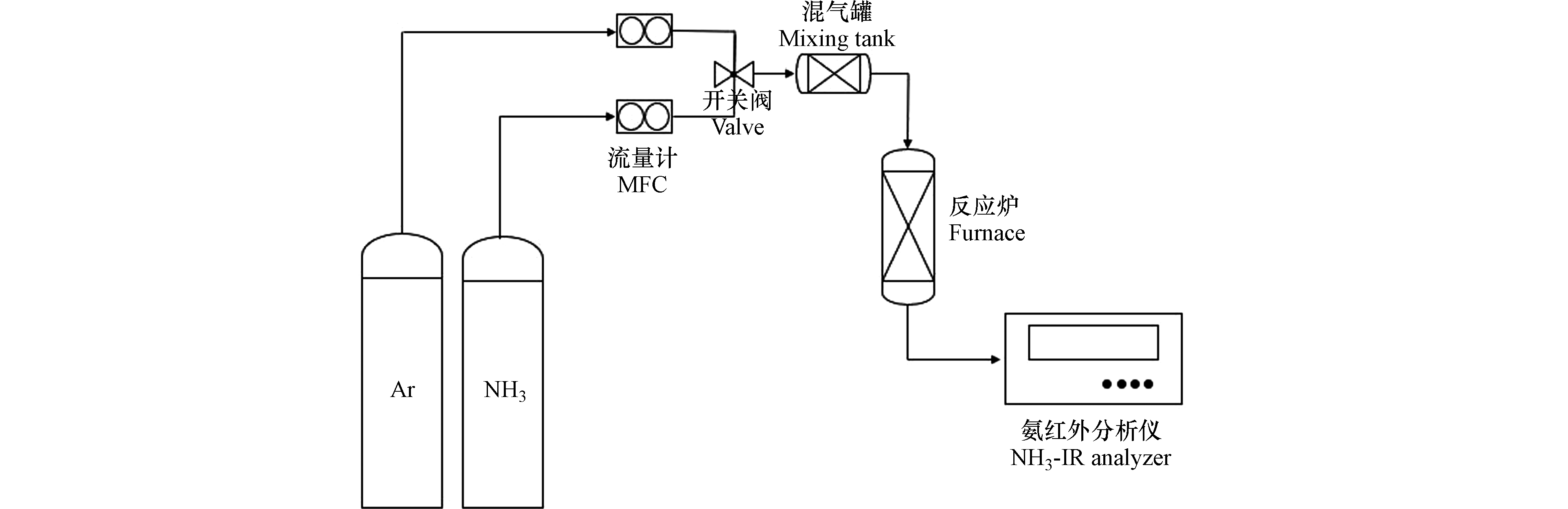
在400—800 ℃的固定床反应器中进行了常压下的NH3分解活性测定。在石英管反应器中填充0.5 mL的40—60目催化剂,并用石英棉固定催化剂的位置,反应气体组成如下:体积分数为0.5%的NH3和平衡气Ar,气体总流速为150 mL·min−1,气体体积空速(GHSV)为18000 h−1。通过红外气体分析仪连续监测催化反应器尾气的气体浓度,分解反应装置如图1所示。NH3分解活性依据NH3转化率表示,计算方法如下:
-
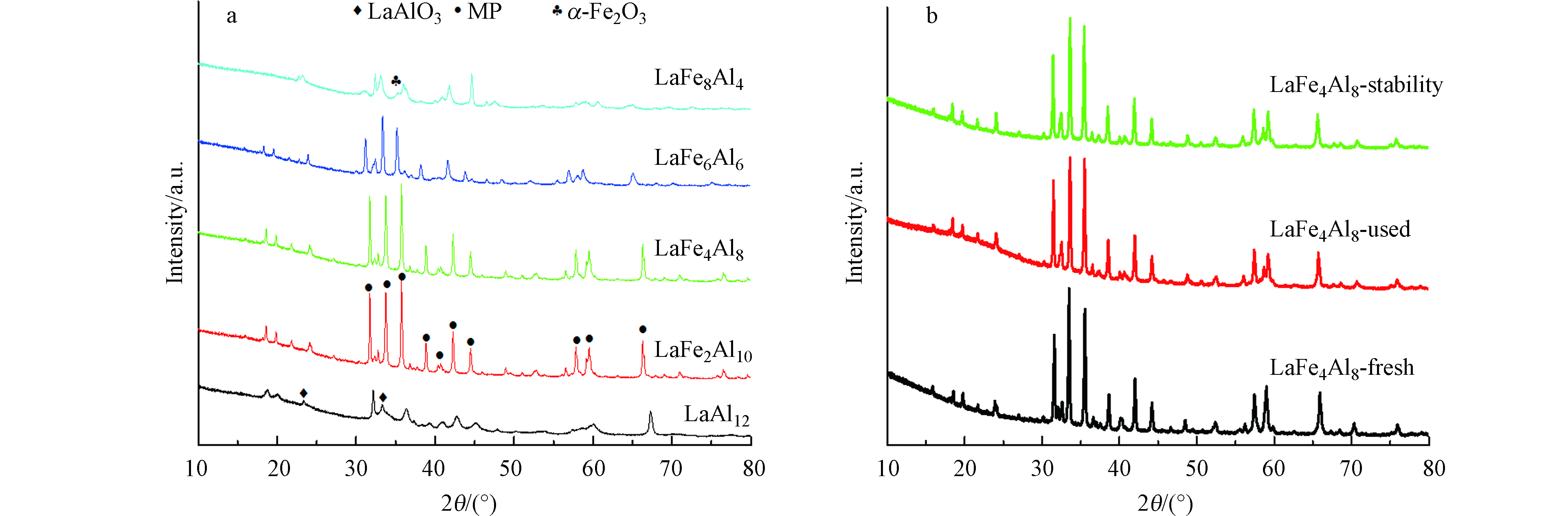
不同取代量的LaFex催化剂的XRD谱图结果如图2所示。通过与标准卡片比对,未取代的LaAl12催化剂具有的衍射峰对应于磁铅石相六铝酸盐(magneto plumbite,MP,ICPDS 33-0699),该催化剂的衍射峰较宽,表明其结晶度较低,所形成的晶相较弱;而Fe取代的LaFex催化剂除了呈现MP相的衍射峰外,还出现了α-Fe2O3(JCPDS 84-0310)的特征衍射峰,且随着Fe取代量x的增加,Fe2O3特征峰更明显。这可能是由于Fe离子的离子半径较大, 随着Fe离子取代量的增加, 导致催化剂的晶体结构发生改变, 使得少量Fe以分离相的α-Fe2O3形式析出[19]。
此外,XRD谱图中还出现了LaAlO3的衍射峰,这种合成过程中出现杂质的现象可以用六铝酸盐的形成机制来解释[20],其中六铝酸盐的结构是由 [LaAlO3]0镜面对称的[AlO6]+尖晶石块体形成的,形成了一个高度缺陷的磁铅矿晶体结构。因此,在合成过程中很容易形成杂相。由图2 XRD的表征结果以及其在30°—40°的局部放大图可以看出,相比于未取代的LaAl12催化剂,随着Fe取代量x的增加,LaFex催化剂对应MP相的衍射峰逐渐向低角度方向偏移,据文献可知[19],这可能是由于离子半径较大的Fe离子取代部分Al离子,导致六铝酸盐晶相的晶胞参数增大,由此也说明Fe成功取代了六铝酸盐结构中的部分Al,且随着Fe取代量的增加,成功进入六铝酸盐晶格中的Fe也越多。另外,与LaAl12催化剂相比,Fe取代的LaFex催化剂MP相的衍射峰更为尖锐,这说明Fe的取代有利于促进六铝酸盐物相的生成,提高晶体的结晶度。同时,根据谢乐公式可以计算各样品的晶粒尺寸,结果如表1所示,通过对比可以发现,催化剂的晶粒尺寸随着Fe取代量的增加由18.1 nm增大到54.5 nm。
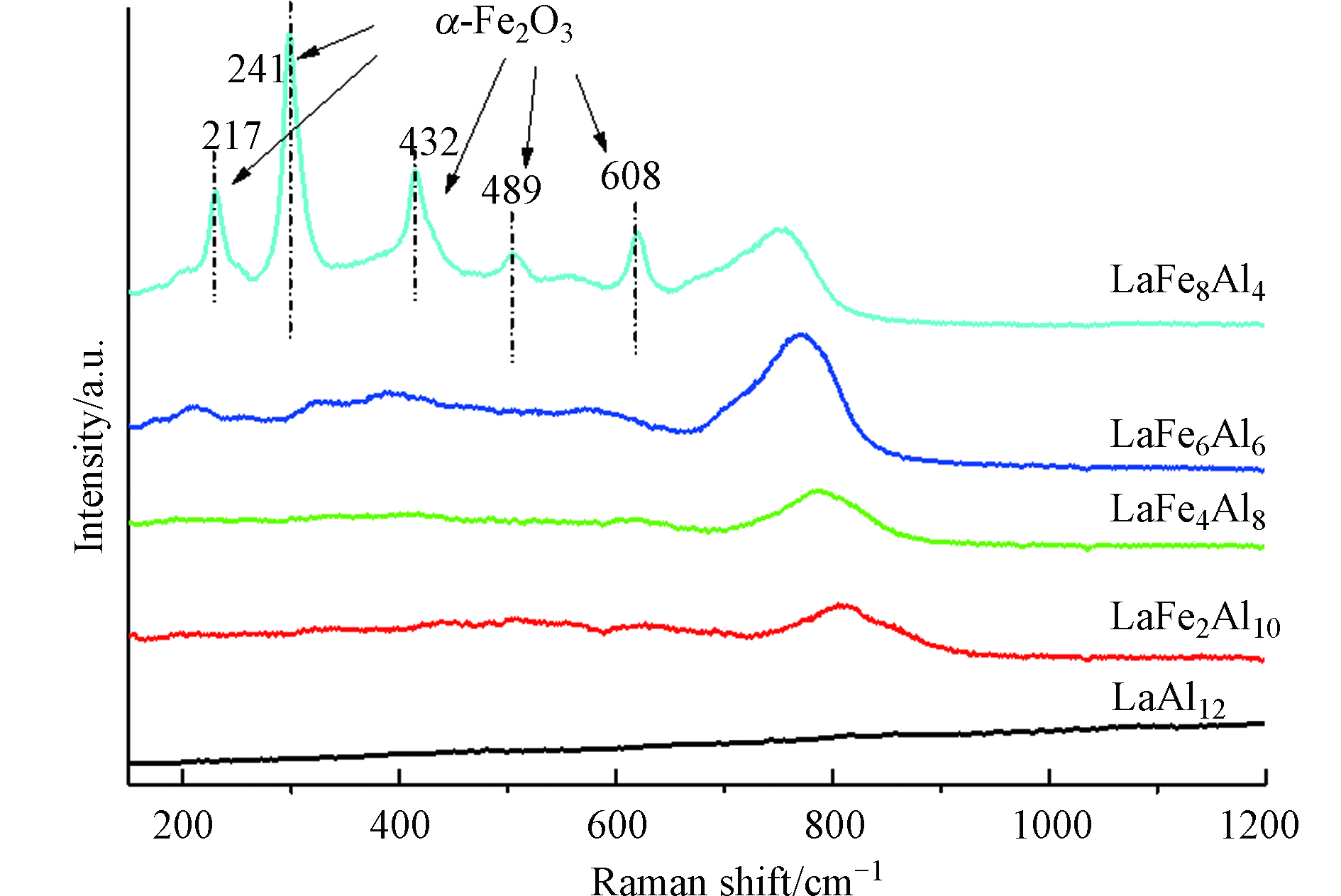
图3显示了LaFex催化剂的Raman光谱图。除LaAl12催化剂没有明显的拉曼信号之外,LaFe2催化剂在800 cm−1出现的特征振动峰,主要来自于六铝酸盐晶体结构中四面体和三角双锥振动[21];LaFe8催化剂在750 cm-1出现的特征振动峰归属于六铝酸盐结构中八面体单元的拉伸模式。随着Fe取代量从2增加到8,800 cm-1处振动峰逐渐向低波数方向移动,说明当取代量增大时,催化剂中八面体配位的Fe3+逐渐增多。对于LaFe8催化剂,在217、241、286、398、489 cm−1处出现的特征峰与α-Fe2O3的存在有关[22]。
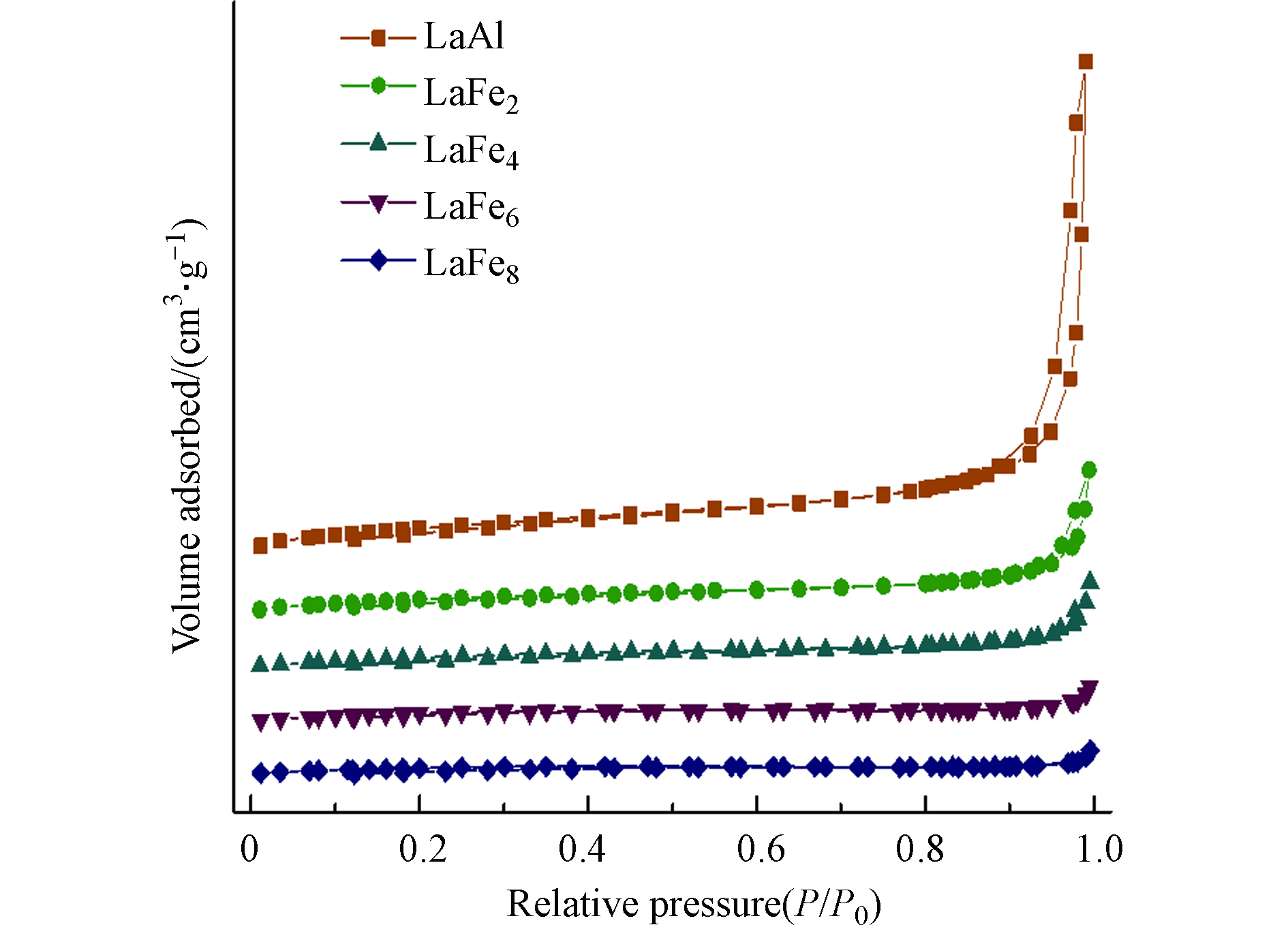
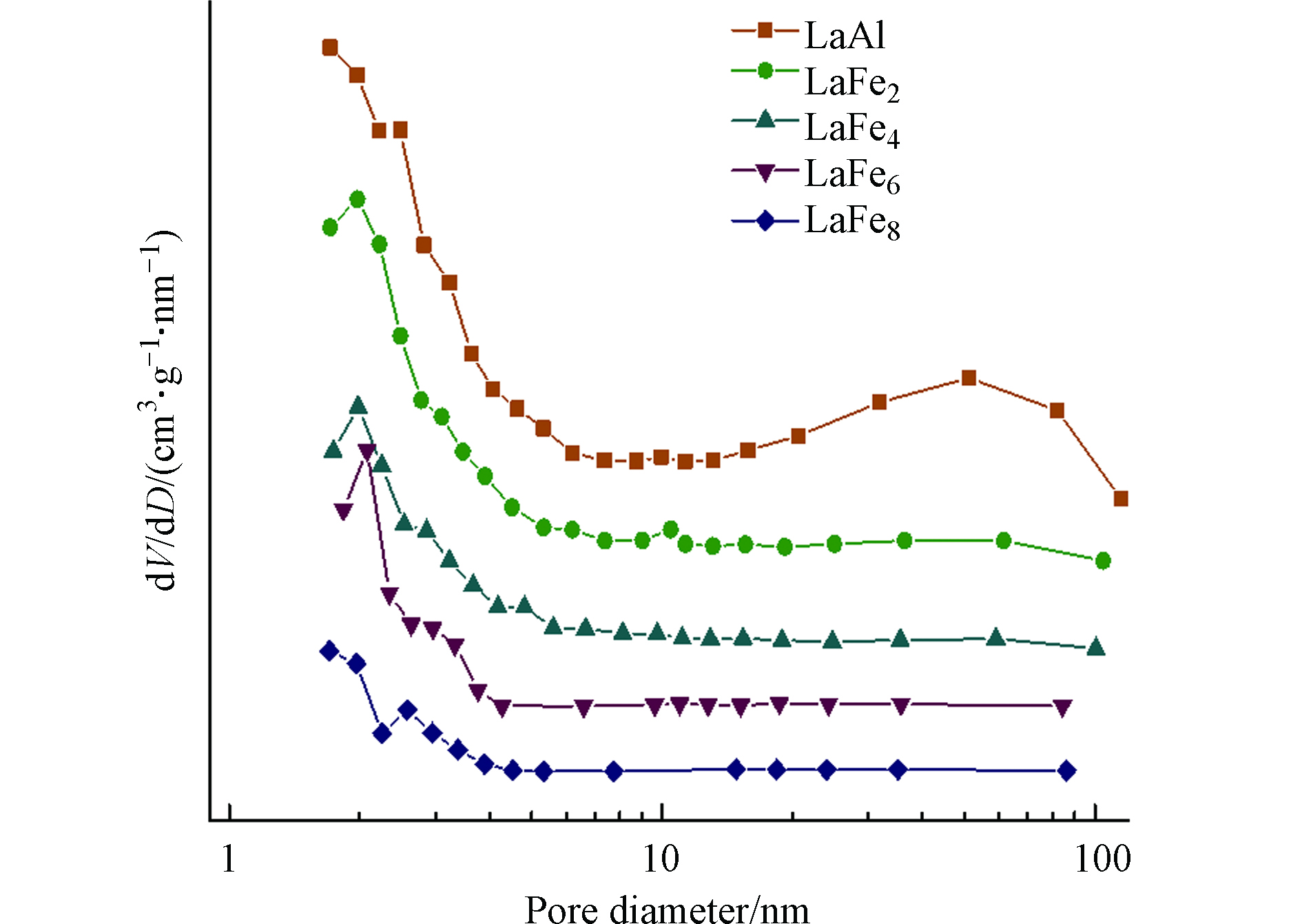
图4和图5给出了各LaFex催化剂的N2吸脱附等温线和孔径分布图,表1总结了各催化剂的织构参数。由图4可以得知,所有催化剂都呈现出类似H3型滞后环的Ⅱ型等温线,表明催化剂的孔主要包括平板狭缝结构、裂缝和楔形结构;同时,由图5可以得知,所有样品的孔径尺寸均属于介孔范围。从表1的结果可以发现,随着Fe取代量的增加,样品比表面积、孔体积以及孔径都逐渐减小,这一方面可能是因为表面析出的Fe物种在高温条件下产生烧结、颗粒变大,另一方面可能是Fe的取代引起六铝酸盐催化剂晶粒的增大,与XRD的分析结果相一致。
-
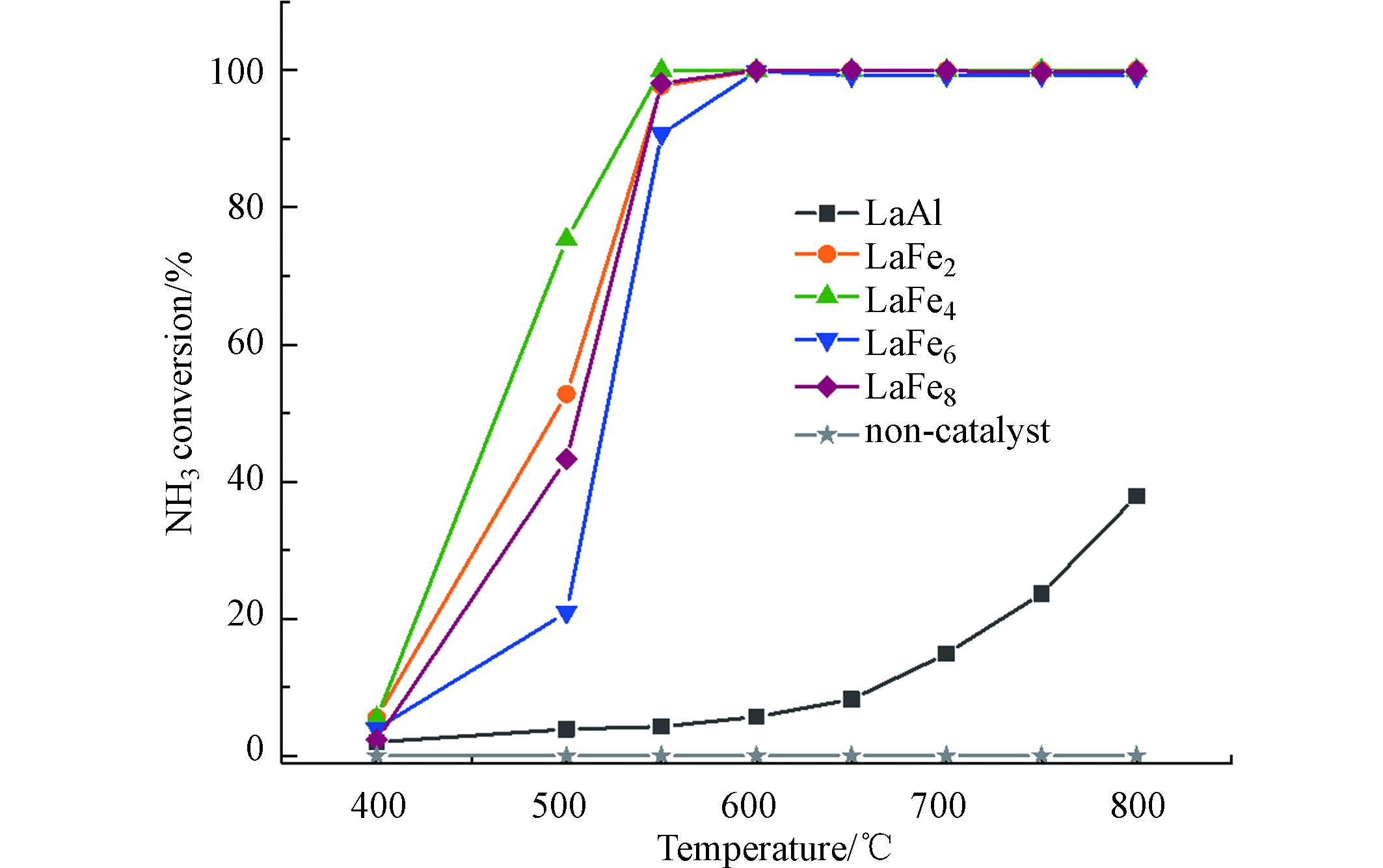
图6所示为LaAl12催化剂及不同Fe取代量的LaFex催化剂在400—800 ℃范围内的氨分解活性曲线。空管实验说明,NH3在没有催化剂存在的情况下,温度达到800 ℃时也几乎不会发生转化。而在有催化剂的条件下,随着温度的提升,所有催化剂上NH3的转化率均逐渐增大。LaAl12表现出较低的氨分解活性,在800 ℃时转化率仅为38%;经过Fe取代之后,LaFex催化剂上氨催化分解的转化率明显增加,表明其催化活性得到了显著提高,在温度大于600 ℃时均可实现NH3的100%转化。进一步对比不同Fe取代量的LaFex催化剂在400—600 ℃之间氨的分解活性曲线可以发现,当Fe取代量由2增加到4时,催化剂的活性得到了明显提升;进一步增加Fe取代量至6和8时,催化剂的活性呈现下降趋势,整体表现出的活性顺序为LaFe4 > LaFe2 > LaFe8 > LaFe6。其中LaFe4展现出最优异的催化活性,500 ℃时的转化率达到了75%,并且能在550 ℃时实现NH3的完全转化。
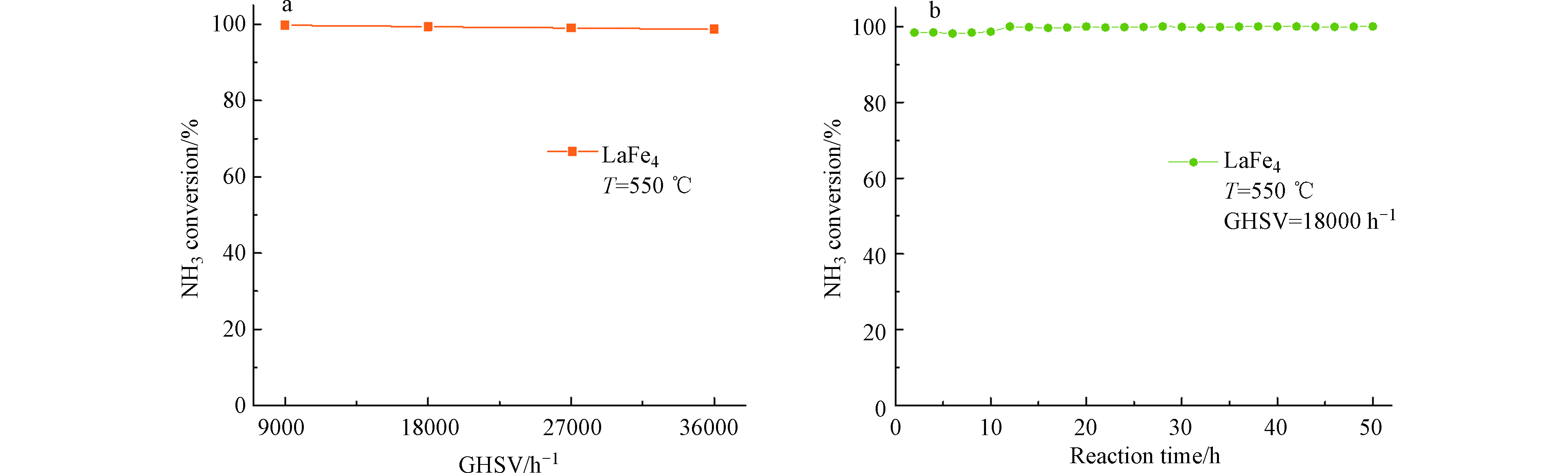
实验中考察体积空速对转化率的影响,由图7(a)可以看出,在空速为9000—36000 h−1范围内,氨分解的转化率维持在100%,几乎没有发生改变,这表明LaFe4具有较强的催化能力,在高空速条件下仍能实现氨的完全分解。此外,为了考察催化剂的稳定性,实验将新鲜的LaFe4催化剂装入反应装置中,在550 ℃、空速为18000 h−1的条件下进行稳定性测试,图7(b)展示了在LaFe4上氨分解的稳定性测试结果,可以发现,LaFe4催化剂在550 ℃条件下可以连续50 h保持将近100%的转化率而没有出现明显的活性下降,呈现出优异的稳定性。
此外,对反应后的LaFex催化剂以及稳定性测试之后的LaFe4催化剂进行XRD表征分析,结果如图8所示。将反应后各催化剂的XRD结果(图8(a))与新鲜催化剂(图2)进行对比,可以发现,所有催化剂在经历氨分解反应之后没有没有产生明显的物相结构的变化,也没有氮化物的生成;同时,经过50 h的稳定性测试之后,LaFe4催化剂的XRD谱图也几乎没有发生改变(图8(b))。这些结果表明,实验中所合成的六铝酸盐催化剂具有良好的稳定性,在高温反应过程中能保持结构不发生明显变化。
-
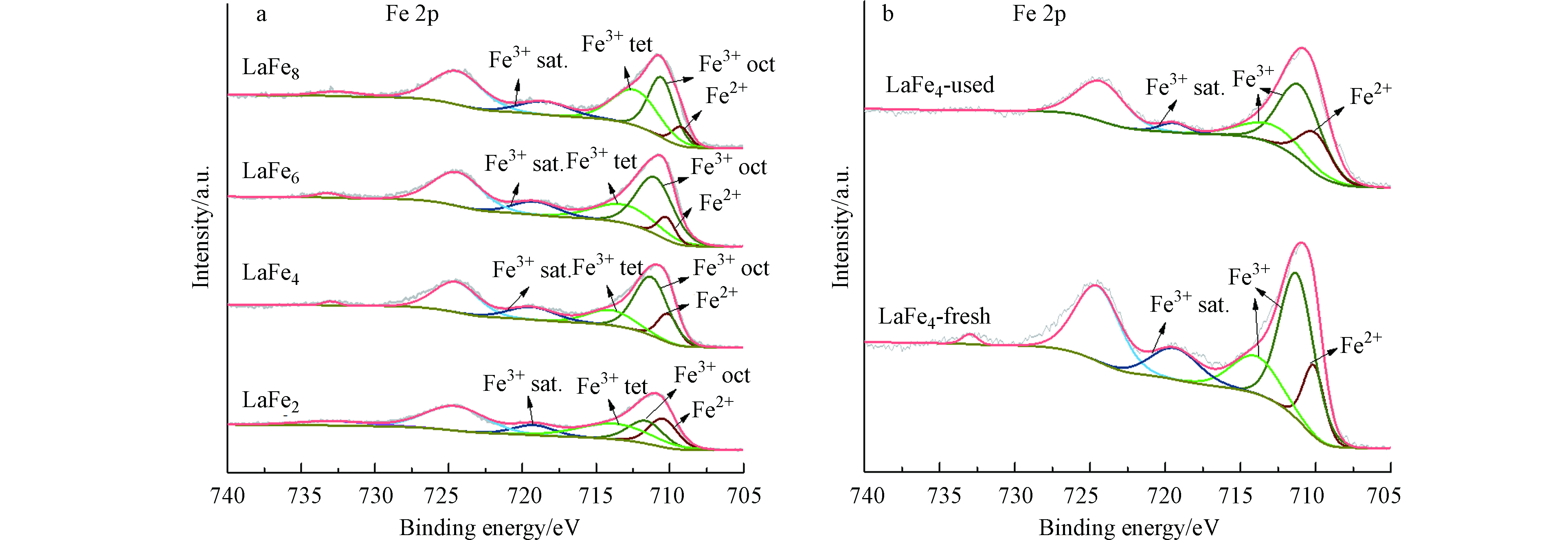
XPS用于研究催化剂表面Fe物种的化学状态。图9(a)显示的是LaFex催化剂的Fe 2p谱图,其中Fe 2p3/2结合能为709.6 eV、711.0 eV和712.9 eV左右的峰应分别归属于Fe2+、八面体配位的Fe3+(Fe3+ oct)和四面体配位的Fe3+(Fe3+ tet)[23],此外位于719.4 eV左右的峰归属为Fe3+的卫星峰(Fe3+ sat.),从谱图及表2的结果可以发现,催化剂表面的Fe物种主要以Fe3+的状态存在。
催化剂中不同配位的Fe3+的比值如表2中所示,随着Fe取代量的增大,催化剂表面的Fe3+比例逐渐增加,值得注意的是,催化剂LaFe4中八面体配位的Fe3+比例最高,与其催化性能结合分析,可以推测氨分解活性应该与催化剂中八面体配位的Fe3+的含量密切相关。反应前后LaFe4催化剂的Fe 2p谱图如图9(b)所示,反应后Fe物种的结合能以及Fe3+ oct的比例与反应前没有明显差别,表明催化剂具有较强的结构稳定性。
-
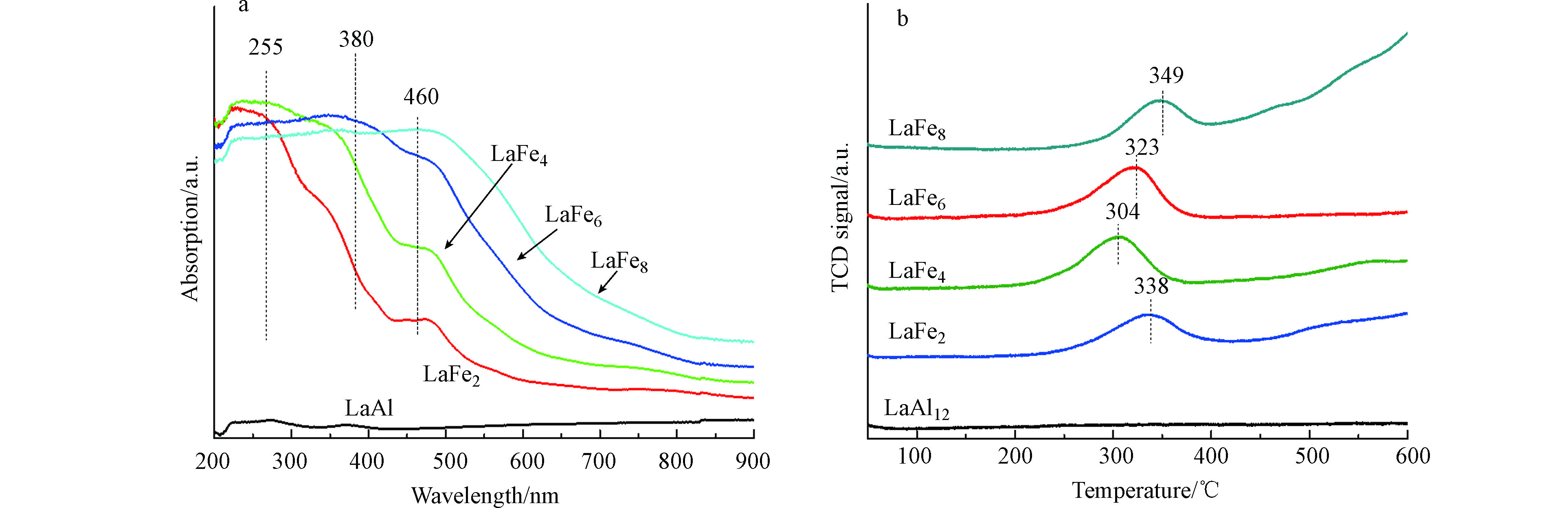
图10(a)为所有六铝酸盐催化剂的紫外可见漫反射光谱,可以观察到催化剂在600—900 nm范围内均无明显吸收;除LaAl12之外,Fe取代后的LaFex催化剂在200—900 nm范围内出现吸收峰。其中位于约255 nm处的吸收峰对应于四面体配位的Fe3+,位于380 nm处的吸收峰与八面体配位的Fe3+离子的d-d跃迁有关,位于460 nm处的吸收峰应归因于聚合α-Fe2O3颗粒[24-25]。谱图的分析结果表明,Fe3+主要存在于六铝酸盐催化剂的八面体中,与XPS结果相符。
-
过渡金属取代的六铝酸盐催化剂的氧化还原性对催化反应活性起到重要的作用,因此本实验通过H2-TPR考察不同Fe取代量的LaFex催化剂的还原性。由图10(b)可见,未取代的六铝酸盐催化剂LaAl12在升温过程中几乎没有出现H2的消耗信号,说明该催化剂很难被还原;而经Fe取代后的LaFex催化剂在200—400 ℃之间出现了明显的H2消耗峰,应该归因于于Fe3+被还原为Fe2+;起始还原峰温度的顺序为:LaFe4 < LaFe6 < LaFe2 < LaFe8,其中LaFe4的还原峰起始温度最低,表明该样品具有最优的氧化还原性,与催化剂的氨分解活性规律一致。
通过对催化剂的XPS和紫外-可见漫反射光谱分析可知,Fe取代后的LaFex催化剂中的Fe物种主要以Fe3+的形式存在,表面Fe3+又包括四面体配位的Fe3+ tet和八面体配位的Fe3+ oct。随着Fe取代量从2增加到8,LaFex催化剂表面的Fe3+含量逐渐升高,但Fe3+ oct所占的比例呈现先上升后下降的趋势,其中LaFe4含有最高比例的Fe3+ oct。此外,H2-TPR的结果也表明LaFe4催化剂中的Fe3+更容易被还原,表现出更强的氧化还原性。将LaFex催化剂的化学性质与其NH3分解性能结合分析,可以发现,LaFe4具有更高含量的Fe3+ oct和更强的可还原性,并且表现出了更为优异的NH3催化分解活性。因此可以推断,催化剂上的Fe3+oct是NH3分解反应中的活性相,在反应过程中,气相NH3首先解离吸附在催化剂表面的Fe3+oct活性位点上,活化后的NH3通过直接脱氢过程完成转化,分解为H2和N2。
-
本研究中,利用Fe部分取代La-Al六铝酸盐B位上的Al制备出不同Fe取代量的LaFex(x =2,4,6,8)催化剂,并对其氨分解制氢的催化性能进行了探究。其中,LaFe4表现出最佳的催化性能,在550 ℃能实现NH3的完全转化,并且在该条件下能连续稳定运行至少50 h,保持氨的转化率在99%以上。同时,气体空速的增加不会降低该催化剂的反应活性。实验中通过XRD、BET、TPR、XPS、Raman等表征技术对催化剂的物理化学结构进行了分析,LaFe4具有更好的氧化还原性能,其表面的Fe3+含量更高并且含有更多的Fe3+oct。而Fe3+oct被认为是NH3分解反应的活性相,反应过程中的气相NH3首先吸附在催化剂表面的Fe3+oct活性位点上,然后通过直接脱氢过程完成分解转化。Fe的不同取代量与催化剂的物理结构和化学性质密切相关,直接影响了反应活性物种(Fe3+oct)的含量,从而造成了LaFex六铝酸盐催化剂催化性能上的差异。
LaFexAl12-xO19六铝酸盐催化剂上氨分解制氢性能
Hydrogen production from ammonia decomposition over LaFexAl12-xO19 hexaaluminate catalysts
-
摘要: 采用并流共沉淀法制备了系列Fe取代的LaFexAl12-xO19(LaFex,其中x=0,2,4,6,8)六铝酸盐催化剂,分别考察了Fe取代量、反应温度、空速对NH3分解反应活性的影响。研究结果表明,升高温度有利于提高NH3的转化率;NH3分解反应活性随着Fe取代量的增加先增加后降低,其中LaFe4具有最佳的催化性能,在550 ℃即可实现NH3的完全转化,并能稳定运行50 h以上。采用X射线衍射仪(XRD)、氮气吸脱附(BET)、程序升温还原(TPR)和X射线光电子能谱(XPS)等技术手段对催化剂进行了表征,结果表明,氨分解活性应该与反应温度、催化剂的氧化还原性能以及催化剂中八面体配位的Fe3+的数量密切相关。Abstract: A series of Fe-substituted LaFexAl12-xO19 (where x=0, 2, 4, 6, 8) catalysts were prepared by the co-precipitation method, and the impacts of Fe substitution, reaction temperature and space velocity on reaction activity were investigated. The research results showed that raising temperature was beneficial to improve the conversion of NH3. Meanwhile, the activity of NH3 decomposition increased firstly and then decreased accompanied with the augment of Fe substitution. LaFe4 catalyst exhibited the best catalytic performance among the catalysts, which could achieve complete conversion of NH3 at 550 °C and run stably for more than 50 h. X-ray diffraction (XRD), N2 adsorption-desorption (BET), Temperature programmed reduction (TPR) and X-ray photoelectron spectroscopy (XPS) were used to characterize the catalysts. The research results showed that the activity of NH3 decomposition is closely related to the reaction temperature, redox ability of the catalysts and the amounts of Fe3+ in octahedral coordination in the catalysts.
-

-
表 1 LaFex催化剂的织构参数
Table 1. Textural properties of LaFex catalysts
催化剂名称
Catalysts比表面积/(m2·g−1)
Surface area孔体积/(cm3·g−1)
Pore volume孔尺寸/nm
Average pore size晶粒尺寸/nm
Crystallite sizeLaAl 27.9 0.15 19.4 18.1 LaFe2 14.9 0.05 11.4 37.1 LaFe4 11.1 0.03 10.8 40.7 LaFe6 8.0 0.01 7.3 42.7 LaFe8 5.6 0.01 8.4 54.5 表 2 LaFex催化剂中不同配位Fe3+比例对比
Table 2. Comparison of different coordination Fe3+ ratios in LaFex catalysts
催化剂
CatalystsFe3+/(Fe2++Fe3+) Fe3+oct/ Fe3+ Fe3+oct/(Fe2++Fe3+) LaFe2 0.70 0.41 0.29 LaFe4 0.80 0.74 0.59 LaFe6 0.89 0.65 0.58 LaFe8 0.91 0.49 0.44 LaFe4稳定性后 0.77 0.73 0.56 Fe3+oct,八面体配位Fe3+。 Fe3+oct,Octahedral coordination of Fe3+ -
[1] YE L, HE W, LI J F, et al. Microfibrous entrapped Ni-Al2O3 using SS-316 fibers for H2 production from NH3 [J]. AIChE Journal, 2007, 53: 1845-1849. doi: 10.1002/aic.11208 [2] CAO M F, THOMSON W J. Ammonia decomposition kinetics over Ni-Pt Al2O for PEM fuel cell applications[J]. Applied Catalysis A: General, 2002, 227 231-240. [3] SRISIN E, NAN C, APANEE L, et al. Ceria nanorod supported gold nanoparticles as structured catalysts for the oxidative steam reforming of methanol: Effect of CTAB concentration on physiochemical properties and catalyst performance [J]. Journal of Catalysis, 2020, 392: 254-265. doi: 10.1016/j.jcat.2020.10.023 [4] ZHU J, HU L S, ZHAO P X, et al. Recent advances in electrocatalytic hydrogen evolution using nanoparticles [J]. Chemical Reviews, 2020, 120(2): 851-918. doi: 10.1021/acs.chemrev.9b00248 [5] LI J J, WANG C. Comparative life cycle energy consumption, carbon emissions and economic costs of hydrogen production from coke oven gas and coal gasification [J]. International Journal of Hydrogen Energy, 2020, 45: 27979-27993. doi: 10.1016/j.ijhydene.2020.07.079 [6] JIE X Y, GONZALEZ-CORTES S, XIAO T C, et al. The decarbonisation of petroleum and other fossil hydrocarbon fuels for the facile production and safe storage of hydrogen [J]. Energy & Environmental Science, 2019, 12(1): 238-249. [7] HU X C, WANG W, ZHAO J N, et al. Transition metal nanoparticles supported La-promoted MgO as catalysts for hydrogen production via catalytic decomposition of ammonia [J]. Journal of Energy Chemistry, 2019, 38: 41-49. doi: 10.1016/j.jechem.2018.12.024 [8] CHOUDHARY V R, B S U MAMMAN A S. Oxidative conversion of methane to syngas over nickel supportedon commercial low surface area porous catalyst carriers precoated with alkaline and rare earth oxides [J]. Journal of Catalysis, 1997, 172: 281-293. doi: 10.1006/jcat.1997.1838 [9] KANAME O T, HIROKI M. Ammonia decomposition over nickel catalysts supportedon rare-earth oxides for the on-site generation of hydrogen [J]. ChemCatChem, 2016, 8: 2988-2995. doi: 10.1002/cctc.201600610 [10] KEIJI H N T. Decomposition of ammonia over a catalyst consisting of ruthenium metal and cerium oxides supported on Y-fom zeolite [J]. Journal of Molecular Catalysis A: Chemical, 2000, 161(1-2): 171-178. [11] KRAUPNER A, ANTONIETTI M, PALKOVITS R, et al. Mesoporous Fe3C sponges as magnetic supports and as heterogeneous catalyst [J]. Journal of Materials Chemistry, 2010, 20(29): 6019-6022. doi: 10.1039/c0jm00774a [12] ZHENG W Q, COTTER T P, KAGHAZCHI P, et al. Experimental and theoretical investigation of molybdenum carbide and nitride as catalysts for ammonia decomposition [J]. Journal of the American Chemical Society, 2013, 135(9): 3458-3464. doi: 10.1021/ja309734u [13] SCHNEPP Z, THOMAS M, GLATZEL S, et al. One pot route to sponge-like Fe3N nanostructures [J]. Journal of Materials Chemistry, 2011, 21(44): 17760-17764. doi: 10.1039/c1jm12842f [14] GU Y, CHEN X, ZHAO S, et al. FeCe nanocomposite with high iron content as efficient catalyst for generation of CO -free hydrogen via ammonia decomposition [J]. Journal of Rare Earths, 2020, 38(10): 1053-1059. doi: 10.1016/j.jre.2020.02.009 [15] HU Z P, LI C, WENG C C, Fe nanocatalysts supported on dealuminated ZSM-5 for efficient decomposition of ammonia to COx-Free hydrogen[J]. Chemistry Select, 2018, 3: 4439-4447. [16] MATHIAS F, CAO W, ROBERT G. High-temperature stable, iron-based core–shell catalysts for ammonia decomposition[J]. Chemistry European Journal, 2011, 17: 598-605. [17] ZHANG J, HE X, LI W Z. Kinetic study of NH3 decomposition over Ni nanoparticles: The role of La promoter, structure sensitivity and compensation effect [J]. Applied Catalysis A: General, 2005, 296: 257-267. doi: 10.1016/j.apcata.2005.08.046 [18] JACLYN D, ENKKHSARUUL B, YASUO O. Novel carbon-based Ni/Fe catalysts derived from peat for hot gas ammonia decomposition in an inert helium atmosphere [J]. Applied Catalysis A: General, 2010(375): 124-133. [19] 马丽景, 王林宏, 李殿卿, 等. Mn、Fe取代六铝酸盐的结构和甲烷催化燃烧性能 [J]. 化工学报, 2006, 57(11): 2604-2609. doi: 10.3321/j.issn:0438-1157.2006.11.014 MA L J, WANG L H, LI D Q, et al. Structure and catalytic activity of Mn- and Fe-substituted hexaaluminates for methane combustion [J]. Journal of Chemical Industry and Engineering (China), 2006, 57(11): 2604-2609(in Chinese). doi: 10.3321/j.issn:0438-1157.2006.11.014
[20] WANG J C. On the charge compensation mechanism in β-alumina [J]. The Journal of Chemistry Physics, 1980, 73: 5786. doi: 10.1063/1.440062 [21] KREISEL J. VINCENT H. Raman spectra and vibrational analysis of BaFe12O19 hexagonal ferrite [J]. Journal of Solid State Chemistry, 1998, 137: 127-137. doi: 10.1006/jssc.1997.7737 [22] FARIA D, OLIVEIRAL D. Raman microspectroscopy of some iron oxides and oxyhydroxides [J]. Joural of Raman Spectroscopy, 1997, 28: 873-878. doi: 10.1002/(SICI)1097-4555(199711)28:11<873::AID-JRS177>3.0.CO;2-B [23] TAN P L. Active phase, catalytic activity, and induction period of Fe/zeolite material in nonoxidative aromatization of methane [J]. Journal of Catalysis, 2016, 338: 21-29. doi: 10.1016/j.jcat.2016.01.027 [24] 蒋政, 李进军, 郝郑平, 等. 铁取代六铝酸盐的制备及其对甲烷燃烧的催化性能 [J]. 催化学报, 2004, 25(6): 485-489. doi: 10.3321/j.issn:0253-9837.2004.06.014 JIANG Z, LI J J, HAO Z P, et al. Preparation of Fe substituted hexaaluminate and its catalytic performance for methane combustion [J]. Chinese Journal of Catalysis, 2004, 25(6): 485-489(in Chinese). doi: 10.3321/j.issn:0253-9837.2004.06.014
[25] ZHANG F L, ZHANG X, JIANG G X, Selective oxidation of H2S over Fe supported on Zr-intercalated Laponite clay mesoporous composite catalysts at low temperature[J]. Catalysis Today, 2019, 355: 366-374. -



 下载:
下载: