-
塑料在世界范围内被广泛使用,由于其产量大,耐腐蚀等特点,已带来了一系列的环境问题。在这些塑料残体当中,尺寸小于5 mm的塑料被定义为微塑料,目前已作为一种新型污染物广受关注[1-5]。微塑料的来源非常广泛,一部分的初级微塑料来自于个人护理用品,而次级微塑料的主要来源则是光照、热解、机械磨损以及生物作用引起的大块塑料的老化降解[6-11]。
由于独特的物理化学性质,聚氯乙烯(PVC)塑料被广泛用于各种工业产品和生活日用品。自2006年以来,中国的PVC产量已经超越美国,成为世界上最大的PVC生产国[12]。然而,大部分PVC塑料被随意丢弃,在环境中可以广泛检出不同尺寸的PVC塑料残体[13-14]。据报道,PVC是沙滩微塑料的主要组成部分,大约占总量的25%[13-15]。由于PVC微塑料(PVC微塑料)的密度(1.20—1.45 g·cm−3)大于淡水和海水,天然水体中PVC微塑料的含量往往被低估。最近的研究发现,珠江流域每立方水体中PVC微塑料的含量可以高达400个[16]。此外,毒性评估结果发现,PVC微塑料一旦被摄取,会引起海蚯蚓Arenicola marina摄食活力的降低,斑马鱼Danio rerio的肠道损伤,以及线虫Caenorhabditis elegans死亡率的增加[15, 17]。除了自身的毒性之外,微塑料还可以作为无机和有机污染物的载体。一旦被动物摄取,微塑料上吸附的污染物会发生快速的解吸,从而提高污染物的生物毒性[18- 19]。最近的研究发现,微塑料可以被植物根系所摄取,从而在植物体内迁移,分布在不同的器官和组织中[20]。当微塑料与重金属共存时,吸附了重金属的微塑料被植物根系摄取很有可能提高重金属的生物毒性效应。Wang等探究了原始PVC微塑料与镉(Cd)对苦草Vallisneria natans的联合毒性,发现PVC微塑料可以提高镉对苦草的生长抑制[21]。原始和老化的微塑料对重金属的吸附能力存在显著性差异,且老化微塑料表面的含氧官能团可以提高重金属的吸附量[22],从而影响微塑料与重金属的联合毒性效应。然而,目前有关老化PVC微塑料与重金属对植物的联合毒性很少报道。
由于Cd具有较强的毒性、迁移性和蓄积能力,Cd成为农业生产中对人类健康危害最大的重金属之一。2014年,我国生态环境部和国土资源部调查公报表明,全国无机污染土壤中Cd的超标率高达7.0%。本研究评估了Cd、原始PVC微塑料以及老化PVC微塑料对小麦生物量的单独和联合毒性,分析了Cd与PVC微塑料之间的吸附机理以及对小麦的联合毒性效应,从而为进一步研究重金属-微塑料对生物的联合作用提供理论依据。
-
本实验使用的商品化分析纯PVC微塑料来自于上海冠步机电科技有限公司,产品不含塑化剂、阻燃剂等塑料添加剂。硫酸钠、硫酸镁、硝酸镉、乙二胺四乙酸二钠盐(EDTA)、浓硝酸和过氧化氢(30%)购自国药集团化学试剂有限公司。Milli-Q超纯水用于配制溶液。
-
将PVC微塑料置于石英培养皿中于南京大学环境学院(北纬N32°07′10.16″,东经E118°56′52.71″)楼顶进行光照暴露。为保证PVC微塑料样品充分接触光照,样品倾斜角度为30°,并每隔24 h进行搅拌混匀。暴露时间为2020年4月1日——2021年2月1日,共计10个月。分别使用温度计和光强仪(CEL-NP2000-10, Ceaulight Inc., Beijing, China)测定了9:00、12:00和15:00温度和光照强度。365 nm波长的平均光照强度为(1.12±0.62)mW·cm−2,平均温度(22±9)℃。原始的PVC微塑料和老化后的PVC微塑料分别命名为PVCpristine和PVCaged。为避免老化期间PVC微塑料吸附空气中的污染物,在微塑料表征和毒性暴露之前,应使用Milli-Q超纯水(18.2 MΩ cm)对其进行清洗至少3遍。
-
激光粒度分析仪(ZEN3500,Malvern Instruments,UK)用来测定PVC微塑料的粒径分布。傅里叶变换红外光谱(FTIR)(Tensor 27,Bruker,Germany)溴化钾压片技术用于测定光照前后PVC微塑料在600—4000 cm−1范围的红外光谱,实验采用32扫描次数,4 cm−1分辨率。场发射扫描电子显微镜(SEM,FEG Quanta 250,FEI Co.,Netherland)被用来采集微塑料的SEM图片,用于分析微塑料光照前后的形貌变化以及粒径分布。采用测角仪(Rame-Hart 250, Succasumna, NJ, USA)测定PVC微塑料光照前后的接触角(θW)。Brunauer-Emmett-Teller(BET)分析仪(Micrometrics ASAP2020,Micromeritics Instrument corp.,Atlanta,GA,USA)被用来测定老化前后PVC微塑料的BET比表面积。X射线光电子能谱仪(XPS)(PHI 5000 Versaprobe,UIVAC-PHI,Japan)用于测定微塑料表面的元素含量,并采用O/C比评估微塑料的老化程度。
-
本实验选用杨麦13号作为受试生物。毒性实验设计和操作根据美国环保署(USEPA)的标准进行[23]。毒性实验前,先将小麦种子清洗消毒,均匀置于铺有Milli-Q超纯水润湿的滤纸的玻璃培养皿中,放在人工气候箱中培养48 h。气候箱参数设置为:20 ℃,80%湿度,无光照。育种期间,定时加水保持滤纸湿润。育种结束后,选取发芽良好且有3根1 cm短根的种子进行水培和土培毒性暴露实验。
水培毒性暴露实验流程:选取5颗发芽状况良好的种子固定于尼龙网上,然后将尼龙网置于含有水培养液溶液的玻璃杯中。然后将玻璃杯置于人工气候箱中进行培养(光照16 h,黑夜8 h,25 ℃,75%空气湿度)。毒性暴露7 d后,测定每株小麦最长的3个根和叶的长度并进行记录。实验过程中为维持离子浓度恒定,每隔2 d更换1次培养液。Cd、PVCpristine和PVCaged单一毒性实验浓度梯度分别为0、1.0、2.5、5.0、10、25、50、100 µmol·L−1,0、0.1、0.5、1.0、5.0、10、50 mg·L−1和0、0.1、0.5、1.0、5.0、10、50 mg·L−1。PVC微塑料和Cd联合毒性实验中PVC微塑料的浓度为5 mg·L−1,Cd浓度梯度为0、1.0、2.5、5.0、10、25、50、100 µmol ·L−1。此外,暴露于不含微塑料或重金属的小麦作为空白对照。
土培毒性暴露实验流程:选取5颗发芽状况良好移栽到染毒土壤中,然后置于人工气候箱中进行培养(光照16 h,黑夜8 h,25 ℃,75%空气湿度),每天浇水1次保持土壤持水量在70%左右。毒性暴露7 d后,将小麦连同土壤一起拔出用Milli-Q水清洗,测定每株小麦最长的3个根和叶的长度并进行记录。Cd、PVCpristine和PVCaged单一毒性实验浓度梯度分别为0、1.0、2.5、5.0、10、25、50、100 mg·kg−1,0、10、50、100、500、1000、5000 mg ·kg−1和0、10、50、100、500、1000、5000 mg·kg−1。PVC微塑料和Cd联合毒性实验中PVC微塑料的浓度为100 mg·kg−1,Cd浓度梯度为0、1.0、2.5、5.0、10、25、50、100 mg·kg−1。此外,暴露于不含微塑料或重金属土壤中的小麦作为空白对照。土培实验中的土壤采自江苏省宜兴市丁蜀镇。
-
PVC微塑料对Cd的吸附采用标准的吸附热力学实验方法。每一组吸附实验中,PVC微塑料(PVCpristine或PVCaged)的浓度为500 mg·L−1,Cd的设定浓度为1.0、2.5、5.0、10.0、25.0、50.0、100 µmol·L−1。震荡24 h后,5000 r·min−1离心60 min,采用电感耦合等离子体发射光谱仪(ICP-OES; PQ9000, Analytik, Jena, Germany)测定上清液中的Cd浓度。ICP-OES也用来测定空白对照(不加PVC微塑料)中Cd的实际浓度。Cd的吸附量通过计算空白样品和上清液中Cd浓度的差值得到。
-
暴露培养7 d后的小麦经100 g L−1 EDTA清洗残留的Cd之后,置于烘箱内于50 ℃烘96 h。然后称取100 mg烘干小麦样品于聚四氟乙烯消解管中,加入10 mL浓硝酸和5 mL过氧化氢(30%),微波消解至残留少量消解液(少于1 mL)。然后将残留的消解液转移至15 mL离心管,加入Milli-Q超纯水定容至10 mL,采用石墨炉原子吸收分光光度计(PerkinElmer AA800, Thermo, USA)测定Cd的浓度,并计算小麦体内Cd的富集量。
-
如图1(a)所示,原始PVC微塑料的粒径分布为50—3000 nm,平均粒径为180 nm。SEM的结果进一步证实了原始微塑料的粒径分布(图1(b))。图2为PVC微塑料光照老化前后的红外光谱图,608、682、835、960、1246、1327、1428、2950 cm−1处的红外吸收峰分别对应间同立构PVC序列中的C—Cl伸缩振动、全同立构PVC序列中的C—Cl伸缩振动、—CH2—的摇摆振动、顺式—CH的非平面摇摆振动、—CH—的摇摆振动、—CH2—的变形振动、—CH—的变形振动以及C—H的伸缩振动[24-25]。与原始PVC微塑料相比,光照10个月后的老化PVC微塑料在1715 cm−1处出现一个新的红外吸收峰,对应于C=O的伸缩振动[26]。这是由于PVC微塑料中的C—Cl键被太阳光中的紫外线打断,在氧气作用下发生过氧化反应,进而形成C=O[27]。
除表面官能团的变化,光照前后,微塑料的表面形貌也发生显著改变。光照之前,PVC微塑料表面光滑均一,光照老化之后出现明显的凹痕(图3(a,b))。表面凹痕的增加也改变了PVC微塑料的比表面积,光照前后的比表面积分别为87.6 m2·g−1和98.3 m2·g−1,比表面积增加了12.2%。前人研究发现,微塑料自然光照老化之后会改变其表面疏水性[12]。本研究也发现了类似的现象,如图3(c,d)所示,光照老化的PVC微塑料水滴的接触角从124.6°减小为49.5°。接触角的减小表明老化之后的微塑料表面的亲水性增强[28],而亲水性的增强归因于PVC微塑料表面含氧官能团(即表面C=O)可以与水分子之间发生分子间氢键作用。此外,测定了PVC微塑料老化前后的元素含量,进而定量其老化程度。如表1所示,PVC微塑料老化前后O元素的百分含量从3.45%增加到5.77%,相应的O/C比从0.04升高到0.11。
-
图4为老化前后PVC微塑料对小麦的毒性效应,原始和老化的PVC微塑料对小麦的毒性没有显著性差异。水培实验中,当微塑料浓度低于10 mg·L−1时,小麦的生物量没有发生显著抑制,而50 mg·L−1的PVC微塑料可以显著降低小麦根和叶的生物量,PVCpristine将小麦的根和叶分别较少了40%和25%,PVCaged则可将小麦的根和叶分别较少了39%和24%(图4(a))。土培实验中,当微塑料浓度大于等于1000 mg·kg−1时,小麦根的生物量会被显著降低而小麦叶没有显著影响,PVCpristine和PVCaged将小麦的根生物量降低了42%以上(图4(b))。
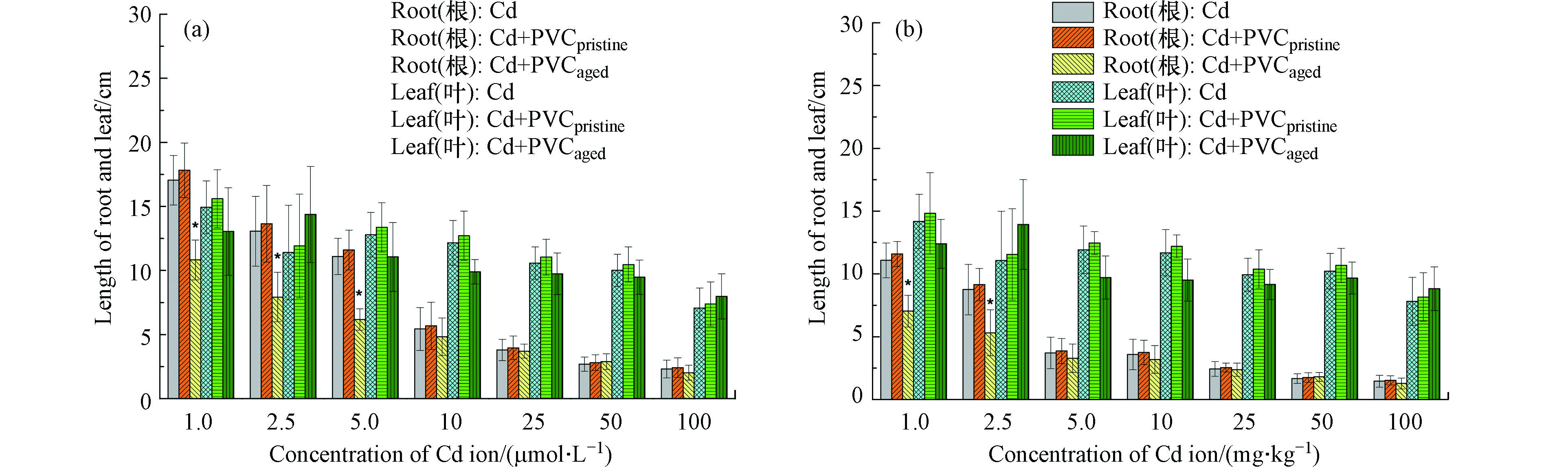
如图5所示,水培和土培实验中,相比于小麦的叶,小麦根系对Cd更加敏感,水培和土培条件下Cd对小麦根系的半数抑制浓度约为7 µmol·L−1和3.5 mg·kg−1。水培条件下,5 mg·L−1 PVCpristine对Cd的毒性效应没有显著影响,而PVCaged的存在显著提高了Cd对小麦根系生物量的抑制作用,而小麦叶的生物量没有显著性差异(图5(a))。类似的,土培条件下,100 mg·kg−1 原始PVC微塑料不影响Cd对小麦根和叶的毒性效应,而老化的PVC微塑料可以显著提高了Cd对小麦根系生物量的抑制作用(图5(b))。此外,不管水培还是土培,老化PVC微塑料只对低浓度Cd的毒性表现出明显的协同效应,而对高浓度Cd对小麦根系的抑制没有显著促进。
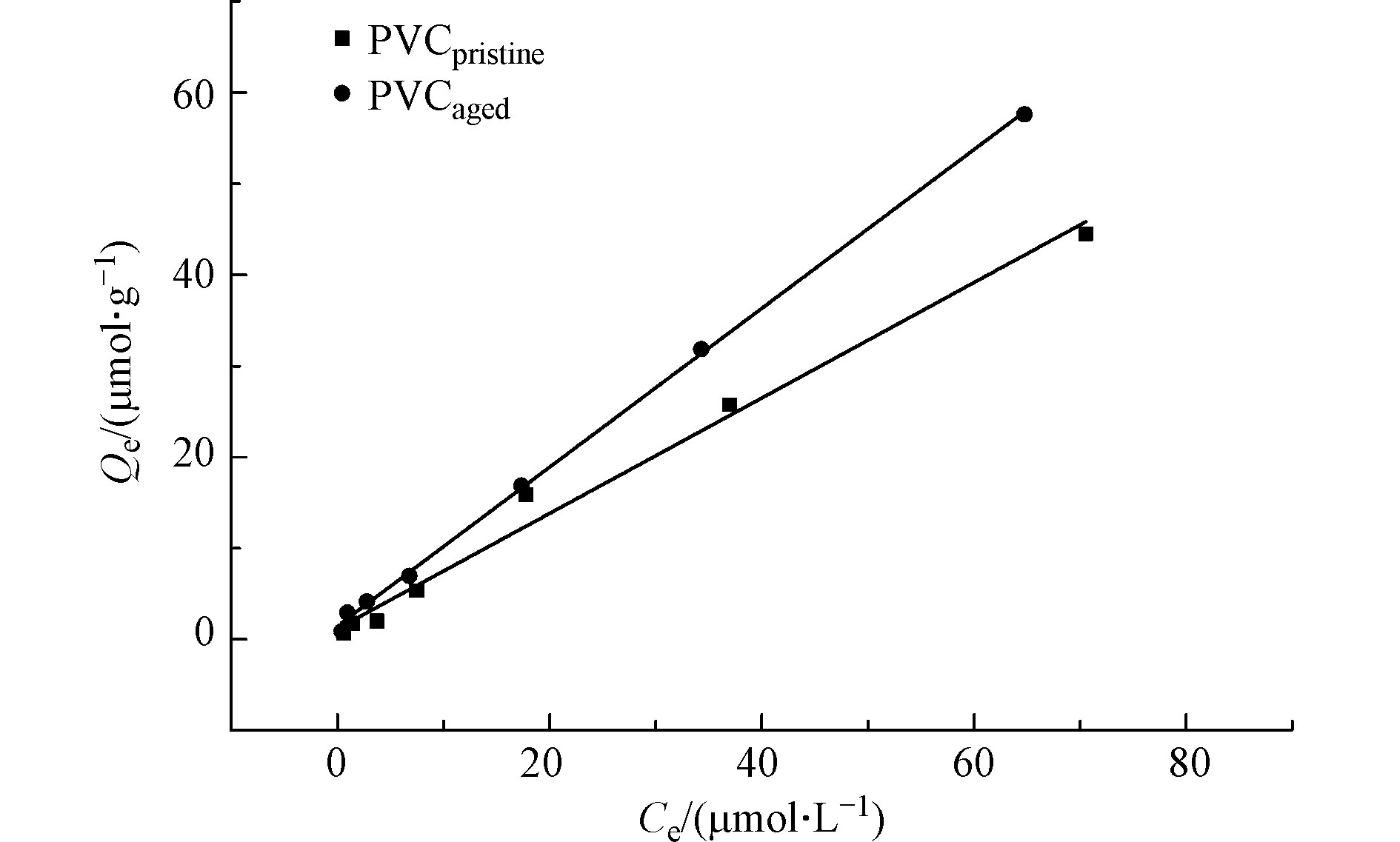
为揭示PVC微塑料与Cd对小麦的联合毒性作用机理,测定了原始PVC微塑料和老化PVC微塑料对Cd的吸附热力学。如图6所示,Cd在老化PVC微塑料上的吸附量显著高于原始PVC微塑料。原始PVC微塑料和老化PVC微塑料对Cd的吸附系数分别为0.63 L·g−1和0.87 L·g−1。吸附量的增加是由于老化后微塑料的亲水性增强,PVC微塑料表面的羰基与Cd之间静电吸引作用可以促进PVC微塑料对Cd的吸附。文献也报道了类似的研究结果,如老化的PVC和聚苯乙烯可以显著提高海洋中重金属铜和锌的吸附[29],自然老化的微塑料表面含氧官能团可以提高重金属铅的吸附量[22]。前人研究发现,微塑料可以被小麦和拟南芥根系吸收,并在植物体内传输[20, 30]。因此,吸附了Cd的PVC微塑料有可能被小麦根系摄取进入生物体内,从而提高Cd的生物可利用性,抑制小麦的生长发育。
-
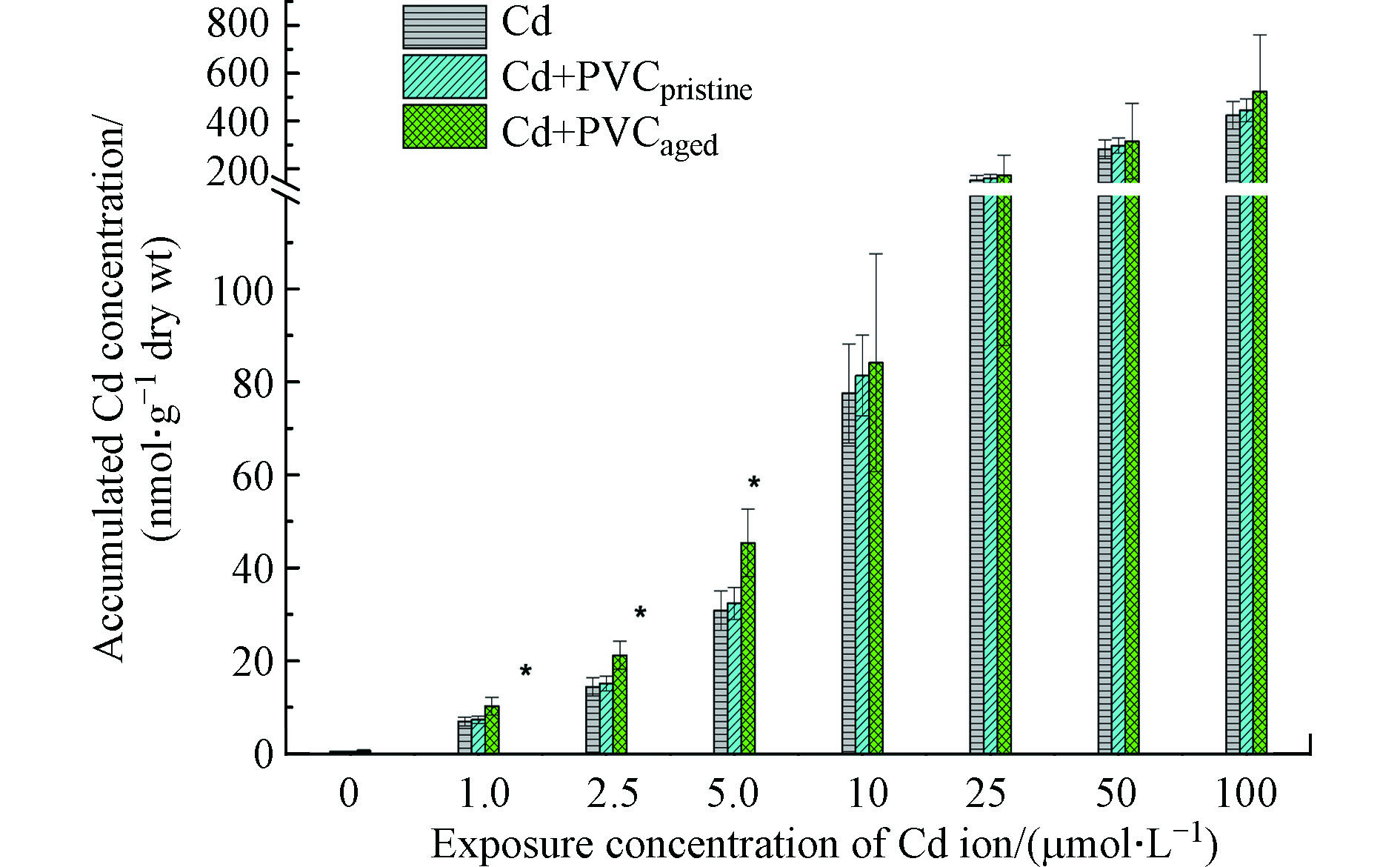
为探究微塑料和重金属Cd对小麦的联合毒性作用机理,测定了不同浓度Cd暴露下小麦体内Cd的生物富集量。如图7所示,当Cd暴露浓度为1.0、2.5、5.0、10、25、50、100 µmol·L−1时,小麦体内富集Cd的浓度分别为6.9、14.4、30.8、77.5、151.2、282.2、423.3 nmol·g−1 dry wt,小麦体内Cd的生物富集量随暴露浓度的增加而增加;原始PVC微塑料的存在对Cd的生物富集量没有显著影响;老化PVC微塑料可以将1.0、2.5、5.0 µmol·L−1 Cd暴露时的生物富集量显著提高至10.2、21.2、45.3 nmol·g−1 dry wt,但是对高浓度Cd没有显著影响。当Cd浓度<10 µmol·L−1时,小麦根长抑制率小于36%;当Cd浓度≥10 µmol·L−1时,小麦根长抑制率大于69%。相比于低浓度Cd暴露,高浓度Cd可以显著抑制小麦根的生长发育。小麦根的生长发育受到抑制又可能反过来抑制PVC微塑料被小麦根系的吸收。老化PVC微塑料可以显著提高Cd的吸附量,一旦PVC微塑料被小麦吸收,可以显著提高Cd的生物可利用性和富集量。因此,老化微塑料在低Cd浓度暴露下可以显著提高Cd的生物富集量,从而解释了老化微塑料与低浓度Cd具有毒性协同效应的原因。
-
自然光解老化后的PVC微塑料表面发生C—Cl键断裂并伴随C=O的生成,而C=O的出现提高了PVC微塑料表面的亲水性,进一步提高了PVC微塑料对Cd的吸附量。PVC微塑料与Cd联合毒性评估结果显示:当原始或老化PVC微塑料水培浓度达到50 mg·L−1时,会显著抑制小麦根和叶的生长;当PVC微塑料土培浓度达到1000 mg·kg−1时,会显著抑制小麦根的生物量;原始的PVC微塑料(5 mg·L−1水培浓度和100 mg·kg−1土培浓度)不影响Cd对小麦的毒性效应;老化后的PVC微塑料与低浓度Cd会发生对小麦根生长的协同抑制作用。老化微塑料与Cd的协同效应可能是由于老化微塑料可以提高Cd在小麦体内的生物富集量,从而提高了Cd的生物可利用性。
老化聚氯乙烯微塑料与镉对小麦的联合毒性
Joint toxicity of aged polyvinyl chloride microplastics and cadmium to the wheat plant
-
摘要: 微塑料是一种广受关注的新型污染物。本研究探讨了老化前后的聚氯乙烯(PVC)微塑料(PVC微塑料)与镉(Cd)对小麦的联合毒性。自然光解老化后的PVC微塑料表面发生C—Cl键断裂并伴随C=O的生成,而C=O的出现提高了PVC微塑料表面的亲水性,进一步提高了老化PVC微塑料对Cd的吸附量。根据小麦生长发育期间叶和根生物量的差异,评估PVC微塑料对Cd毒性作用,研究结果发现,原始和老化的PVC微塑料不影响Cd对小麦叶的毒性,但是老化后的PVC微塑料可以提高低浓度Cd对小麦根的生长抑制作用。老化PVC微塑料与Cd的协同效应可能归因于老化微塑料可以提高Cd在小麦体内的生物富集量。Abstract: Microplastic is a new type of pollutant that has received wide attention. This study explored the combined toxicity of polyvinyl chloride (PVC) microplastics and cadmium (Cd) to wheat before and after natural aging treatment. The surface of PVC microplastic after natural photo-aging under C—Cl bond breakage accompanied by the generation of C=O, and the appearance of C=O improves the hydrophilicity of the surface of PVC microplastic, which subsequently enhances the adsorption capacity of Cd. According to the difference in leaf and root biomass during wheat growth and development, the joint toxicity of PVC microplastic and Cd was evaluated: virgin and aged PVC microplastic exhibit negligible effects on the toxicity of Cd to wheat leaves, while aged PVC microplastic exhibit great potential to increase the inhibitory effect on the growth of wheat roots for low concentrations of Cd. The synergistic effect of altered PVC microplastic and Cd may be attributed to the fact that aged microplastics can increase the bioaccumulation of Cd in wheat.
-
Key words:
- polyvinyl chloride /
- aged microplastics /
- heavy metals /
- wheat /
- joint toxicity
-

-
表 1 PVC微塑料老化前后的元素含量(%)
Table 1. Percentages of elements in pristine and aged PVC microplastics.
C1s O1s Cl2p PVCpristine 77.79 3.45 18.77 PVCaged 78.12 8.77 13.11 -
[1] von MOOS N, BURKHARDT-HOLM P, KÖHLER A. Uptake and effects of microplastics on cells and tissue of the blue mussel Mytilus edulis L. after an experimental exposure [J]. Environmental Science & Technology, 2012, 46(20): 11327-11335. [2] SUSSARELLU R, SUQUET M, THOMAS Y, et al. Oyster reproduction is affected by exposure to polystyrene microplastics [J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(9): 2430-2435. doi: 10.1073/pnas.1519019113 [3] 林陆健, 汤帅, 王学松, 等. 聚乙烯微塑料对水溶液中孔雀石绿的吸附机理 [J]. 环境化学, 2020, 39(9): 2559-2566. doi: 10.7524/j.issn.0254-6108.2019070305 LIN L J, TANG S, WANG X S, et al. Adsorption mechanism of malachite green from aqueous solution by polyethylene microplastics [J]. Environmental Chemistry, 2020, 39(9): 2559-2566(in Chinese). doi: 10.7524/j.issn.0254-6108.2019070305
[4] 白璐, 刘宪华, 陈燕珍, 等. 天津近岸海域微塑料污染现状分析 [J]. 环境化学, 2020, 39(5): 1161-1168. doi: 10.7524/j.issn.0254-6108.2019062901 BAI L, LIU X H, CHEN Y J, et al. Current status of microplastics pollution in tianjin coastal waters [J]. Environmental Chemistry, 2020, 39(5): 1161-1168(in Chinese). doi: 10.7524/j.issn.0254-6108.2019062901
[5] 张晓菲, 汪磊. 环境中纳米塑料的分离与检测 [J]. 环境化学, 2020, 39(1): 8-11. doi: 10.7524/j.issn.0254-6108.2019102701 ZHANG X F, WANG L. The separation and detection methods of nanoplastics in the environment [J]. Environmental Chemistry, 2020, 39(1): 8-11(in Chinese). doi: 10.7524/j.issn.0254-6108.2019102701
[6] COLE M, LINDEQUE P, HALSBAND C, et al. Microplastics as contaminants in the marine environment: A review [J]. Marine Pollution Bulletin, 2011, 62(12): 2588-2597. doi: 10.1016/j.marpolbul.2011.09.025 [7] ANDRADY A L. Microplastics in the marine environment [J]. Marine Pollution Bulletin, 2011, 62(8): 1596-1605. doi: 10.1016/j.marpolbul.2011.05.030 [8] BROWNE M A, GALLOWAY T, THOMPSON R. Microplastic: an emerging contaminant of potential concern? [J]. Integrated Environmental Assessment and Management, 2007, 3(4): 559-561. [9] FENDALL L S, SEWELL M A. Contributing to marine pollution by washing your face: microplastics in facial cleansers [J]. Marine Pollution Bulletin, 2009, 58(8): 1225-1228. doi: 10.1016/j.marpolbul.2009.04.025 [10] ZITKO V, HANLON M. Another source of pollution by plastics: Skin cleaners with plastic scrubbers [J]. Marine Pollution Bulletin, 1991, 22(1): 41-42. doi: 10.1016/0025-326X(91)90444-W [11] 李昇昇, 李良忠, 李敏, 等. 环境样品中微塑料及其结合污染物鉴别分析研究进展 [J]. 环境化学, 2020, 39(4): 960-974. doi: 10.7524/j.issn.0254-6108.2019102304 LI S S, LI L Z, LI M, et al. Study on identification of microplastics and the combined pollutants in environmental samples [J]. Environmental Chemistry, 2020, 39(4): 960-974(in Chinese). doi: 10.7524/j.issn.0254-6108.2019102304
[12] WANG C, XIAN Z Y, JIN X, et al. Photo-aging of polyvinyl chloride microplastic in the presence of natural organic acids [J]. Water Research, 2020, 183: 116082. doi: 10.1016/j.watres.2020.116082 [13] BROWNE M A, GALLOWAY T S, THOMPSON R C. Spatial patterns of plastic debris along estuarine shorelines [J]. Environmental Science & Technology, 2010, 44(9): 3404-3409. [14] THOMPSON R C, OLSEN Y, MITCHELL R P, et al. Lost at sea: Where is all the plastic? [J]. Science, 2004, 304(5672): 838. doi: 10.1126/science.1094559 [15] GREEN D S, BOOTS B, SIGWART J, et al. Effects of conventional and biodegradable microplastics on a marine ecosystem engineer (Arenicola marina) and sediment nutrient cycling [J]. Environmental Pollution, 2016, 208(Pt B): 426-434. [16] YAN M T, NIE H Y, XU K H, et al. Microplastic abundance, distribution and composition in the Pearl River along Guangzhou city and Pearl River estuary, China [J]. Chemosphere, 2019, 217: 879-886. doi: 10.1016/j.chemosphere.2018.11.093 [17] LEI L, WU S, LU S, et al. Microplastic particles cause intestinal damage and other adverse effects in zebrafish Danio rerio and nematode Caenorhabditis elegans [J]. Science of The Total Environment, 2018, 619-620: 1-8. doi: 10.1016/j.scitotenv.2017.11.103 [18] BAIRD R W, HOOKER S K. Ingestion of plastic and unusual prey by a juvenile harbour porpoise [J]. Marine Pollution Bulletin, 2000, 40: 719-720. doi: 10.1016/S0025-326X(00)00051-5 [19] VELZEBOER I, KWADIJK C J A F, KOELMANS A A. Strong sorption of PCBs to nanoplastics, microplastics, carbon nanotubes, and fullerenes [J]. Environmental Science & Technology, 2014, 48(9): 4869-4876. [20] LI L, LUO Y, LI R, et al. Effective uptake of submicrometre plastics by crop plants via a crack-entry mode [J]. Nature Sustainability, 2020. [21] WANG L, GAO Y, JIANG W, et al. Microplastics with cadmium inhibit the growth of Vallisneria natans (Lour.) Hara rather than reduce cadmium toxicity [J]. Chemosphere, 2021, 266: 128979. doi: 10.1016/j.chemosphere.2020.128979 [22] FU Q, TAN X, YE S, et al. Mechanism analysis of heavy metal lead captured by natural-aged microplastics [J]. Chemosphere, 2020, 270: 128624. [23] USEPA, Ecological effects test guidelines 850.4230: Earlyseedling growth toxicity test[R], Washington DC: UnitedStates Environmental Protection Agency, 2012. [24] QUENUM B M, BERTICAT P, VALLET G. Chlorinated Polyethylene. I. Infrared Study [J]. Polymer Journal, 1975, 7(3): 277-286. doi: 10.1295/polymj.7.277 [25] RAMESH S, LEEN K H, KUMUTHA K, et al. FTIR studies of PVC/PMMA blend based polymer electrolytes [J]. Spectrochim Acta A Mol Biomol Spectrosc, 2007, 66(4-5): 1237-1242. doi: 10.1016/j.saa.2006.06.012 [26] RAJENDRAN S, UMA T. FTIR and conductivity studies of PVC based polymer electrolyte systems [J]. Ionics, 2001, 7(1/2): 122-125. [27] DECKER C, BALANDIER M. Laser-induced degradation of polyvinyl chloride II: Oxygen bleaching of polyenes [J]. Journal of Photochemistry, 1981, 15(3): 221-228. doi: 10.1016/0047-2670(81)87006-2 [28] LIU G Z, ZHU Z L, YANG Y X, et al. Sorption behavior and mechanism of hydrophilic organic chemicals to virgin and aged microplastics in freshwater and seawater [J]. Environmental Pollution, 2019, 246: 26-33. doi: 10.1016/j.envpol.2018.11.100 [29] BRENNECKE D, DUARTE B, F PAIVA, et al. Microplastics as vector for heavy metal contamination from the marine environment [J]. Estuarine Coastal and Shelf Science, 2016, 178: 189-195. doi: 10.1016/j.ecss.2015.12.003 [30] SUN X D, YUAN X Z, JIA Y B, et al. Differentially charged nanoplastics demonstrate distinct accumulation in Arabidopsis thaliana [J]. Nature Nanotechnology, 2020, 15(9): 755-760. doi: 10.1038/s41565-020-0707-4 -




 下载:
下载: