-
砷污染是一个全球性的环境问题。针对轻中度砷污染土壤,通过合理的调控将所产农产品中的砷含量控制在安全范围内,可实现轻中度砷污染土壤的安全利用。硒是人和动物必需的一种微量营养元素,硒的生物强化是当前生产应用研究的热点。研究表明,硒在一定的环境介质中可参与砷的生物化学循环过程,适宜浓度的硒能降低植物对砷的吸收;另一方面,砷在一定条件下也可能改变硒在植物中的代谢及积累进而影响植物硒的生物强化[1]。因此,研究硒和砷之间的交互作用,通过合理调控硒的生物强化,降低植物可食用部位的砷含量,将富硒产业的发展和砷污染治理相结合,为轻中度砷污染土壤的科学利用提供依据。
硒与砷的相互作用较为复杂。在一定条件下,硒能拮抗砷的毒性,砷也能抑制植物对硒的吸收。在水稻中的研究表明,硒能降低砷对水稻的毒害作用和水稻不同部位的砷浓度[2-5]。适宜的硒浓度(如0.1 mg·L−1)可以缓解高砷对烟草的毒害作用,并促进植物生长[6]。在对绿豆的研究中发现,5 μmol·L−1硒处理可缓解砷对绿豆细胞膜、叶绿体和细胞活力的毒害作用,硒能降低砷引起的氧化损伤,提高了相关保护酶和非酶类抗氧化物质水平[7]。胡莹等[8]在水稻中的研究发现,As(Ⅲ)或As(Ⅴ)处理显著降低了水稻茎叶对硒的吸收积累。另一方面,硒和砷也可能表现出协同作用。Ebbs和Weinstein [9]认为,砷促进了大麦对硒的吸收和转运作用,并且会降低大麦体内挥发性硒化物的产生。Srivastava等[10]在蜈蚣草中的研究发现5 μmol·L−1的硒可促进蜈蚣草对砷的吸收。可见,硒和砷的交互作用不仅受硒和砷的浓度影响,在不同作物种类或者同一作物的不同部位的表现不尽相同。
白菜是一种富硒能力较强的芸薹属蔬菜,在中国各地被广泛种植,深受人们喜爱。本研究以白菜为供试作物,通过土壤盆栽试验研究硒-砷交互作用对白菜砷、硒含量及形态组成的影响,为富硒蔬菜的安全生产提供科学依据。
-
供试土壤类型为红壤,采自广西武鸣县双桥镇柑橘地0—20 cm的耕层,自然风干后,去除残茬、碎砾,过2 mm筛。土壤基本理化性质为:pH 5.48,有机质19.9 g·kg−1,水解性氮88.3 mg·kg−1,有效磷167 mg·kg−1,速效钾179 mg·kg−1,总砷17.3 mg·kg−1,总硒0.50 mg·kg−1。供试砷为Na2HAsO4.7H2O,供试硒为Na2SeO3,均为分析纯。盆栽作物为白菜,品种为早熟长江5号快菜,购买于广西横县子龙种业有限公司。
-
根据GB 15618-2018《土壤环境质量 农用地土壤污染风险管控标准》和预实验结果,砷设置不施砷(A0)、轻度砷污染(100 mg·kg−1,A1)和中度砷污染(200 mg·kg−1,A2)3个水平;硒设置0、2.5、5.0、7.5 mg·kg−1 等4个水平(分别表示为S0、S1、S2、S3)。将砷与硒各水平进行完全交互设计,共12个处理,每个处理重复3次。
试验用盆钵为聚乙烯盆(直径23 cm,高16 cm),每盆装土5 kg,配置对应浓度的砷酸钠、亚硒酸钠溶液,用小型喷雾器均匀喷入土壤中,混匀。底肥N、P、K肥分别以尿素、磷酸二氢钾、氯化钾形式施加,施加量分别为N-0.2 g·kg−1,P-0.044 g·kg−1,K-0.25 g·kg−1。用称重法控制土壤水分为田间持水量的80%,平衡6个月。
白菜种子用1%(质量浓度)的高锰酸钾水溶液浸泡30 min杀菌,自来水洗净并浸泡6 h后播种,采用穴播的方式,每盆播种8颗,6 d后间苗,14 d后定苗至4株。生长期间保持土壤湿度为田间持水量的80%左右,50 d后收获。收获时,将快菜连根收获,将地上部、地下部分离后分别用自来水、去离子水洗净,吸水纸擦干,打成匀浆,-20 ℃保存,用于测定总砷、总硒、砷形态、硒形态含量。根际土壤采用抖土法收集,土壤风干后混合均匀,研磨过20目筛和100目筛,分别测定有效态砷、有效态硒含量和总砷、总硒含量。
-
植物样品总砷、总硒含量测定按照GB 5009.268-2016《食品中多元素的测定》,采用ICP-MS法。根际土壤总砷、总硒含量测定按照HJ 680-2013《土壤和沉积物 汞、砷、硒、铋、锑的测定》。根际土壤pH值的测定参照标准NY/T 1121.2-2006《土壤pH值的测定》。用国家标准物质圆白菜GBW10014、土壤GBW07404作为质控样,对样品测定过程进行质量监控。
-
称取2.0 g(精确至0.001 g)样品于样品管中,加入8 mL 1%硝酸溶液,置于电热板上90 ℃加热提取2.5 h,冷却后转移至离心管,10000 r·min−1离心10 min,上清液依次过0.2 μm水系滤膜、RP净化小柱后使用HPLC-ICP-MS测定。砷形态采用Dionex IonPac AS7 阴离子交换柱分离,25—80 mmol·L−1碳酸铵溶液梯度洗脱,在标准模式下测定砷甜菜碱(AsB)、二甲基砷酸(DMA)、亚砷酸(As(Ⅲ))、砷胆碱(AsC)、一甲基砷酸(MMA)、砷酸(As(Ⅴ))共6种砷形态化合物。硒形态采用Agela MP-C18色谱柱分离,30 mmol·L−1磷酸氢二铵+0.5 mmol·L−1四丁基氢氧化铵+1%甲醇溶液等度洗脱,在甲烷模式下测定硒代胱氨酸(SeCys2)、甲基硒代半胱氨酸(MSC)、亚硒酸根(Se(Ⅳ))、硒代蛋氨酸(SeMet)、硒酸根(Se(Ⅵ))共5种硒形态化合物。
-
参考NY/T 3420-2019:称取1.0 g(精确至0.001 g)土壤样品于25 mL离心管中,加入0.10 mol·L−1磷酸二氢钾溶液15 mL,置于水浴振荡器30 ℃、150 r·min−1条件下振荡80 min,3000 r·min−1离心15 min;取5 mL上清液,加入5 mL HCl(1∶1)、5 mL 5%硫脲-抗坏血酸混合溶液,定容至50 mL,放置2 h后原子荧光光度计测有效砷含量;取5 mL上清液,加入3 mL HCl(1∶1)于120 ℃还原15 min,冷却,定容至10 mL,原子荧光光度计测有效硒含量。
-
富集系数(BEC)反应白菜对元素的吸收富集能力,转运系数(TF)反应了白菜根部吸收硒、砷后转运到地上部分的能力。计算公式如下:
式中,Cp为植物地上/地下部位元素含量,mg·kg−1;Cs为土壤中元素含量,mg·kg−1;Cpy为植物地上部分元素含量,mg·kg−1;Cpr为植物地下部位元素含量,mg·kg−1。
-
用SPSS 22.0软件和Origin 2019b软件对数据进行计算和统计分析,采用F检验,多重比较用Duncan’法。
-
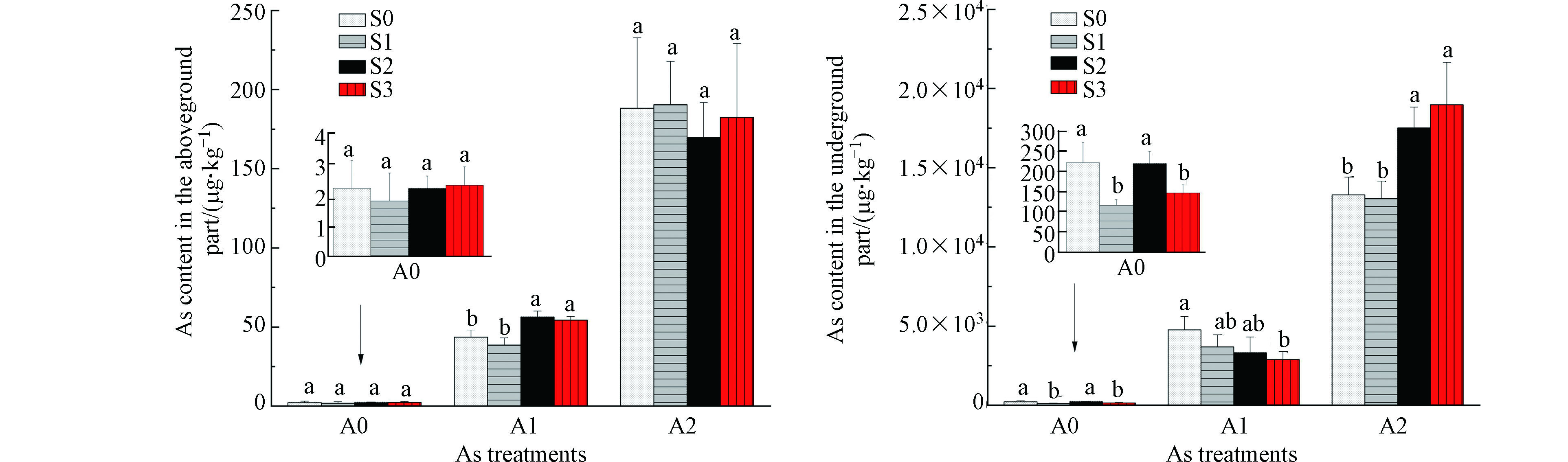
由图1可知,白菜地上部位砷含量低于地下部位砷含量,地上、地下部砷含量均随着外源砷浓度的增加而明显增加。在A0浓度下,S1、S3处理地下部位砷含量分别较S0显著降低47.7%、33.8%(P<0.05,下同)。在A1浓度下,S2、S3处理地上部位砷含量分别较S0显著升高29.1%、24.5%;S3处理地下部位砷含量较S0显著降低39.6%。在A2浓度下,S2、S3处理地下部位砷含量分别较S0显著升高31.5%、42.9%。
-
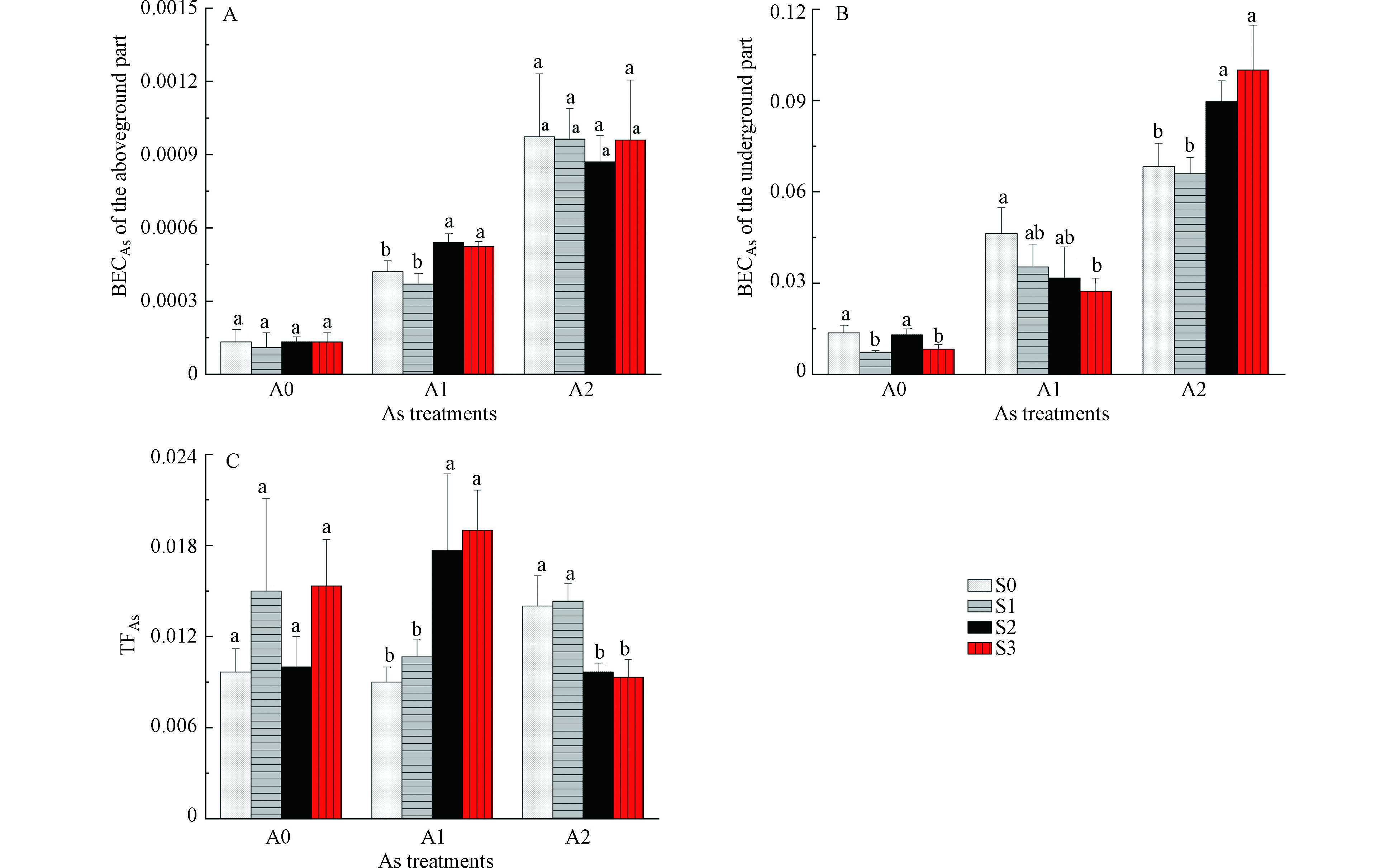
白菜地上、地下部位砷的富集系数见图2(A、B),白菜对砷的转运系数见图2(C)。由图2可知,白菜地上部位BECAs低于地下部位,表明砷更容易在白菜根部富集。地上、地下部位BECAs均随着外源砷浓度的增加而明显增加。在A0浓度下,S1、S3处理地下部位BECAs较S0显著降低,说明2.5 mg·kg−1和7.5 mg·kg−1 硒处理抑制了根系对砷的吸收。在A1浓度下,S3处理地下部位BECAs较S0显著降低,说明7.5 mg·kg−1 硒处理抑制了根系对砷的吸收;同时,S2、S3处理TFAs和地上部位BECAs较S0显著升高,说明5.0 mg·kg−1和7.5 mg·kg−1 硒处理促进了砷从根系向地上部位转运。在A2浓度下,S2、S3处理地下部位BECAs较S0显著升高,TFAs较S0显著降低,说明5.0 mg·kg−1和7.5 mg·kg−1 硒处理促进了根系对砷的吸收,但同时抑制了砷从根系向地上部位转运,使得砷富集于白菜根部。
轻度砷污染条件下,硒处理促进了砷向地上部位转运,提高了白菜地上部位砷含量,可能与硒的抗氧化作用有关。硒作为一种抗氧化剂,可通过增加硫醇和谷胱甘肽的含量及降低脂质过氧化作用,减轻氧化应激,激活植物的保护机制[1]。研究表明,As(Ⅲ)是植物从根系转运至地上部位的主要砷形态,中度砷污染条件下,硒处理抑制砷向地上部位转运,促进砷在根系富集可能是由于部分As(Ⅲ)与硒形成螯合物并封存在根系细胞壁与液泡中[11],降低砷由根系向地上部的转运,从而缓解砷对植物的毒害作用。胡莹等[8]在水稻中的研究结果表明,添加Se(Ⅳ)能显著提高水稻根系对砷的吸收,在1.0 μmol·L−1 As(Ⅴ)处理下添加1.0 μmol·L−1 Se(Ⅳ)导致水稻根系砷含量提高21.3%,Se(Ⅳ)显著抑制砷从水稻根系向地上部位的转运能力。殷行行等[12]在旱稻中的研究结果也表明硒促进了根系砷吸收,显著降低了砷从根系向地上部位转运。赵秀峰等[13](2017)在小白菜的水培试验中发现,2.0 mg·L−1的硒能抑制砷向小白菜地上部转运,促使砷富集在小白菜地下部。由于硒对白菜吸收转运砷的影响与砷污染程度有关,因此,在实际生产中,应根据土壤砷污染程度,考虑富硒蔬菜生产带来的砷污染风险。
-
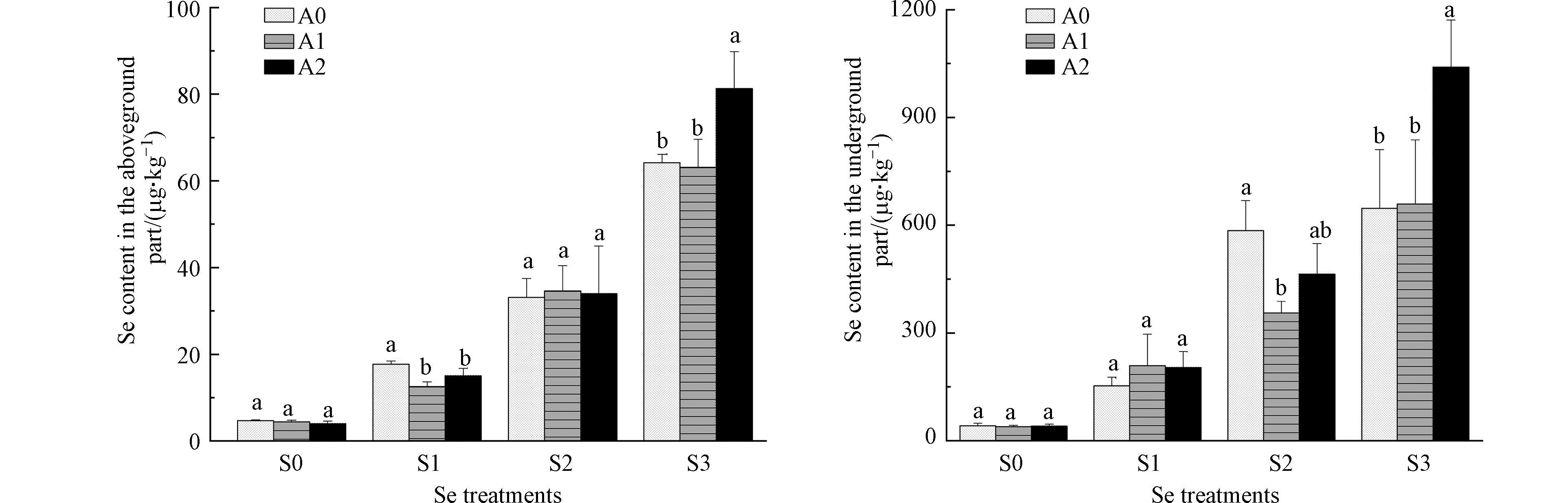
由图3可知,白菜地上部位硒含量低于地下部位硒含量,地上、地下部硒含量均随着外源硒浓度的增加而明显增加。在S1浓度下,A1、A2处理地上部位硒含量分别较A0显著降低29.4%、15.3%。在S2浓度下,A1处理地下部位硒含量较A0显著降低39.1%。在S3浓度下,A2处理地上、地下部位硒含量分别较A0显著升高26.6%、60.7%。
-
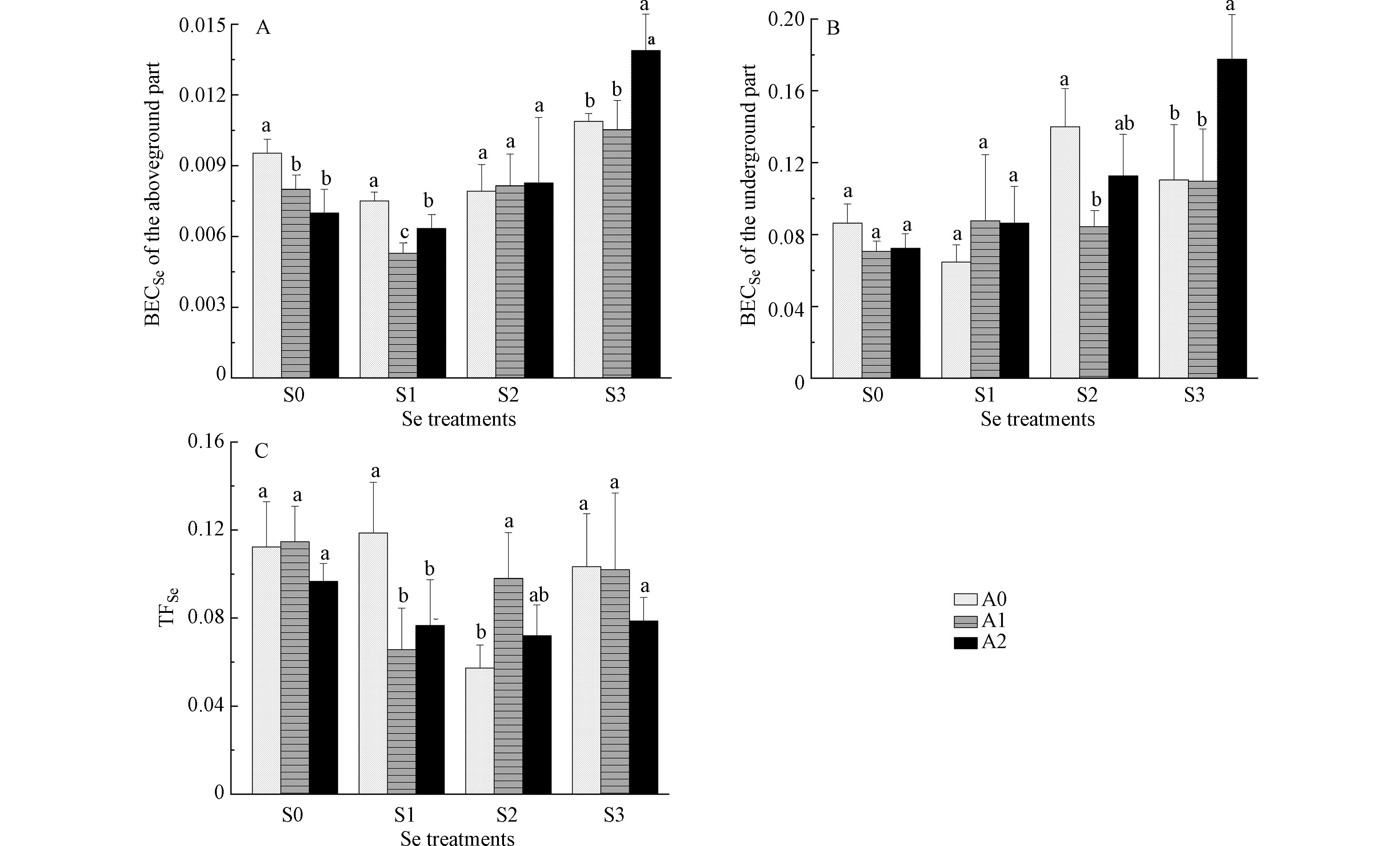
白菜地上、地下部位硒的富集系数见图4(A、B),白菜对硒的转运系数见图4(C)。由图4可知,白菜地上部位BECSe低于地下部位,表明硒更容易在白菜根部积累。在S0浓度下,A1、A2处理地上部位BECSe较A0显著降低。在S1浓度下,A1、A2处理地上部位BECSe和TFSe较A0均显著降低,说明100 mg·kg−1和200 mg·kg−1 砷处理显著抑制硒从地下向地上部位转运,减少了硒在地上部位富集。在S2浓度下,A1处理地下部位BECSe较A0显著降低,TFSe较A0显著升高,说明100 mg·kg−1 砷处理显著抑制根系对硒的吸收,促进硒从地下向地上部位转运。在S3浓度下,A2处理地上、地下部位BECSe较A0显著升高,说明200 mg·kg−1 砷处理显著促进根系对硒的吸收。
低硒水平下(2.5 mg·kg−1),砷处理抑制硒从地下向地上部位转运,降低了白菜地上部位硒含量;但高硒水平下(7.5 mg·kg−1),中度砷污染处理促进根系对硒的吸收,提高了地上、地下部位硒含量。这种差异一方面可能与根际土壤pH变化有关,pH较低时(pH=3.0)亚硒酸盐主要以中性分子H2SeO3的形式为植物所被动吸收;相对较高的pH环境中(pH=5.0),亚硒酸盐主要以HSeO3−的形式存在,被磷酸盐转运蛋白所主动吸收,磷酸盐转运蛋白同时也是砷酸盐的吸收通道[14],此时亚硒酸盐和砷酸盐可能表现出抑制效应;在pH=8.0条件下,SeO32-是亚硒酸盐的主要存在形态,主要通过阴离子通道进入植物体内[15];高硒水平下,中度砷污染处理土壤pH显著升高,土壤pH的变化可能影响了硒的吸收途径。另一方面也可能与植物体内硒形态组成的变化有关,低硒水平下,中度砷污染处理SeCys2比例显著升高,而高硒水平下,中度砷污染处理MSC比例显著升高,SeMet比例显著降低;且高硒水平较低硒水平植物体内Se(Ⅳ)比例减小,Se(Ⅵ)比例增大,不同硒形态的转运速率存在较大差异,Se(Ⅵ)极容易被转运到地上部位,Se(Ⅳ)则大部分在根系直接转化为有机硒。在烟草中的研究结果也表明,低硒水平下,低浓度砷刺激硒的吸收,高浓度砷抑制硒的吸收;高硒水平下,砷对硒的吸收表现为抑制作用[6]。在水培蜈蚣草中发现,硒浓度小于2.5 mg·L−1时,砷有利于了蜈蚣草根对硒的吸收和硒向叶片转移;硒浓度大于2.5 mg·L−1时,砷抑制了蜈蚣草根对硒的吸收,同时硒也抑制了蜈蚣草根和叶对砷的吸收[16]。
-
由表1可知,白菜地上部分砷形态主要为As(Ⅲ)、DMA 和As(Ⅴ),未检测到MMA、AsB和AsC。不同处理中,As(Ⅲ)含量最高,占总砷比例为47.4%—94.5%;其次为As(Ⅴ),比例为9.4%—42.1%;DMA在总砷中的比例较低,为0.5%—1.3%。外源砷显著提高了白菜地上部分As(Ⅲ)比例,降低了As(Ⅴ)比例,处理组A1、A2 的As(Ⅲ)比例显著高于A0组,As(Ⅴ)比例显著低于A0组,由于添加的外源砷形态为As(Ⅴ),说明外源砷的添加促进了白菜体内的As(Ⅴ)还原为As(Ⅲ)。同一砷浓度下,不同浓度硒处理之间As(Ⅲ)比例、As(Ⅴ)比例和DMA比例均差异不显著,说明外源硒对白菜地上部分砷形态组成没有显著影响。
研究表明,As(Ⅲ)是植物中砷存在的主要形式,大多数植物都具有很强的As(Ⅴ)还原能力,进入植物体内的As(Ⅴ)可被高效地还原为As(Ⅲ) [17]。As(Ⅴ)还原为As(Ⅲ)是一个较为复杂的过程,离不开砷酸还原酶的参与。早期的研究发现,酵母等真核生物体内的PTP酶Acr2p能够利用谷胱甘肽等作为还原物将As(Ⅴ)还原为As(Ⅲ) [14]。植物在砷胁迫下会诱导产生活性氧自由基,损伤蛋白质并引起膜脂过氧化,但同时体内的抗氧化系统酶以及非酶类抗氧化剂等也会响应砷造成的氧化胁迫,从而减轻植物受到的砷毒害。因此,外源砷促进白菜体内As(Ⅴ)还原为As(Ⅲ)可能与外源砷改变植物体内氧化还原环境相关。
-
本试验采用1%硝酸提取的仅为游离态存在的硒。由表1可知,白菜地上部分游离硒形态包括SeCys2、MSC、SeMet、Se(Ⅳ)、Se(Ⅵ),游离硒形态占总硒的比例为22.4%—45.3%,无机硒占总硒的比例为18.1%—37.2%。未添加硒处理(S0)游离硒形态只检测到Se(Ⅳ)和Se(Ⅵ),添加外源硒处理后,增加了MSC、SeCys2和SeMet,其中MSC含量较高。A0处理下,S2和S3 SeMet比例较S1显著升高;A1处理下,S3 SeCys2比例较S1显著升高;A2处理下,S3 MSC比例较S1显著升高。外源硒处理显著降低白菜地上部分Se(Ⅳ)比例,升高Se(Ⅵ)比例。处理组S1、S2、S3的Se(Ⅳ)比例较S0显著降低,S2、S3的Se(Ⅵ)比例较S0显著升高。说明外源硒的添加促进了白菜体内Se(Ⅳ)向Se(Ⅵ)及有机硒形态转化。
外源砷对硒形态组成的影响在不同硒浓度水平下存在差异。S0处理下,A1 Se(Ⅳ)比例较A0显著降低;S1处理下,A2 SeCys2比例较A0显著升高;S2处理下,A1、A2 SeMet比例较A0显著降低;S3处理下,A2 MSC比例较A0显著升高,SeMet比例较A0显著降低。研究表明,硒代谢途径的改变能够影响植物对硒的积累。非聚硒植物体内的有机硒主要为SeCys和SeMet,这些硒代氨基酸能随机参与蛋白质的合成,从而改变了蛋白质的正常结构,对植物产生毒害作用,不利于植物硒的积累[18]。而聚硒植物能够有效的将SeCys和SeMet转化为毒性较小的非蛋白质硒代氨基酸(如MSC),从而有利于硒在植物体内的积累。高硒水平下,中度砷污染处理降低了SeMet比例,提高了MSC比例,说明砷处理可能改变了硒的代谢途径,促进了非蛋白质硒代氨基酸的合成。
-
土壤有效态是能够被植物直接吸收利用的部分,包括水溶态、可交换态及少量的有机态,土壤硒、砷的有效度是土壤有效态硒、砷与对应土壤总量的百分比,可以反映土壤供硒、砷能力的高低。Mehdawi和Pilon-Smits[19]的研究结果表明植物能够通过根系分泌物改变周边土壤中硒的有效性,进而影响植物硒含量。由表2可知,对照(处理A0S0)根际土壤pH最低,且显著低于其他处理,说明外源砷或硒处理均能提高根际土壤pH。添加外源砷显著提高根际土壤有效态砷含量和砷有效度,处理A2组有效态砷含量提高幅度大于处理A1组,砷有效度提高幅度小于处理A1组。A2处理下,S3有效态砷含量显著低于S0,说明中度砷污染条件下,7.5 mg·kg−1 硒处理显著降低根际土壤有效态砷含量,而此时对应的地下部位砷含量显著升高,说明土壤有效态砷含量的降低可能是由于根系对砷吸收量增大引起。郭璐[20]在小白菜中的研究发现亚硒酸盐处理中,土壤中有效硒含量随着小白菜生长对硒的吸收会下降。添加外源硒显著提高根际土壤有效态硒含量和硒有效度,且同一砷浓度下,随着外源硒浓度升高,根际土壤有效态硒含量和硒有效度均逐渐升高。同一硒浓度下,外源砷对根际土壤有效态硒含量和硒有效度的影响均不显著。
-
(1)硒对白菜吸收转运砷的影响与砷污染程度有关。在轻度砷污染的条件下,较高浓度的硒处理(5.0 mg·kg−1和7.5 mg·kg−1)促进砷向地上部位转运,提高白菜可食用部位砷污染风险,建议土壤施硒以低浓度为宜(<2.5 mg·kg−1)。中度砷污染条件下,较高浓度硒处理抑制砷向地上部位转运,促进砷在根系富集,硒处理对白菜可食用部位砷含量影响不显著。
(2)砷对白菜吸收转运硒的影响在不同硒水平下也存在差异。较低硒水平下(2.5 mg·kg−1),砷处理抑制硒从地下向地上部位转运,减少硒在地上部位富集,降低了白菜可食用部位的硒含量;高硒水平下(7.5 mg·kg−1),中度砷污染处理促进根系对硒的吸收,提高了地上、地下部位硒含量。
(3)白菜地上部分砷形态主要为As(Ⅲ)和As(Ⅴ),外源砷的添加促进As(Ⅴ)还原为As(Ⅲ),外源硒对白菜地上部分砷形态组成没有显著影响。白菜地上部分硒形态以有机硒为主,外源硒的添加显著降低白菜地上部分Se(Ⅳ)比例,升高Se(Ⅵ)比例,促进了Se(Ⅳ)向Se(Ⅵ)及有机硒形态转化。
硒-砷交互作用对白菜砷和硒吸收转运的影响
Interactions between arsenic and selenium uptake and translocation in Chinese cabbage
-
摘要: 本文为研究硒和砷的交互作用对白菜砷和硒吸收转运的影响,采用土壤盆栽试验,研究无添加砷、轻度砷污染(100 mg·kg−1)和中度砷污染(200 mg·kg−1)条件下,施硒(0、2.5、5.0、7.5 mg·kg−1)对白菜不同部位砷、硒含量及地上部位砷、硒形态组成的影响。结果表明,无添加砷条件下,2.5 mg·kg−1和7.5 mg·kg−1 硒处理显著降低地下部位砷含量;轻度砷污染条件下,7.5 mg·kg−1 硒处理显著降低地下部位砷含量,5.0 mg·kg−1和7.5 mg·kg−1 硒处理促进砷向地上部位转运,显著提高地上部位砷含量;中度砷污染条件下,5.0 mg·kg−1和7.5 mg·kg−1 硒处理抑制砷向地上部位转运,显著提高地下部位砷含量。硒处理浓度为2.5 mg·kg−1时,100 mg·kg−1和200 mg·kg−1 砷处理抑制硒向地上部位转运,显著降低地上部位硒含量;硒处理浓度为5.0 mg·kg−1时,100 mg·kg−1 砷处理促进硒向地上部位转运,显著降低地下部位硒含量;硒处理浓度为7.5 mg·kg−1时,200 mg·kg−1 砷处理促进根系对硒的吸收,地上、地下部位硒含量显著提高。外源砷的添加促进As(Ⅴ)还原为As(Ⅲ);外源硒对白菜地上部分砷形态组成没有显著影响。外源硒的添加促进了Se(Ⅳ)向Se(Ⅵ)及有机硒转化。外源砷或硒处理均能提高根际土壤pH。中度砷污染条件下,7.5 mg·kg−1 硒处理显著降低根际土壤有效态砷含量。硒对白菜吸收转运砷的影响在不同砷污染条件下存在差异,轻度砷污染条件下,较高浓度硒处理提高白菜可食用部位砷污染风险,建议土壤施硒以低浓度为宜(<2.5 mg·kg−1)。Abstract: Interactive effects between arsenic (As) and selenium (Se) on uptake and translocation of As and Se in Chinese cabbage (Brassica pekinensis L.) were investigated in pot experiment. Three levels of As additions (0, 100 mg·kg−1 and 200 mg·kg−1) and 4 Se levels (0, 2.5, 5.0 mg·kg−1 and 7.5 mg·kg−1) for each As addition were designed, and As contents, Se contents, As speciation and Se speciation in Chinese cabbage were determined. The results showed that 2.5 mg·kg−1 and 7.5 mg·kg−1 Se treatments significantly reduced As content in underground part under the condition of without As addition. Under mild As pollution condition (100 mg·kg−1), 7.5 mg·kg−1 Se treatments decreased As content in underground part, and 5.0 mg·kg−1 and 7.5 mg·kg−1 Se treatments promoted the transport of As from root to aboveground, thus leading to the significantly increased of As in aboveground part. Under moderate As pollution condition (200 mg·kg−1), 5.0 mg·kg−1 and 7.5 mg·kg−1 Se treatments significantly increased As content in underground part and inhibited the transport of As from root to aboveground. 100 mg·kg−1 and 200 mg·kg−1 As treatments inhibited the transport of Se from root to aboveground, and significantly reduced Se content in aboveground part at 2.5 mg·kg−1 Se level. While 100 mg·kg−1 As treatment promoted the transport of Se from root to aboveground, and significantly reduced Se content in the underground part at 5.0 mg·kg−1 Se level. When the application of Se at 7.5 mg·kg−1, 200 mg·kg−1 As treatment significantly increased Se content in the aboveground and underground parts. The addition of exogenous As promoted the reduction of As(Ⅴ) to As(Ⅲ), and the exogenous Se had no significant effect on As speciation in the aboveground part. The addition of exogenous Se promoted the transformation of Se(Ⅳ) to Se(Ⅵ) and organic Se. Both exogenous As and Se addition could increase the pH of rhizosphere soil. Under moderate As pollution condition, 7.5 mg·kg−1 Se treatment significantly reduced the content of available As in rhizosphere soil. The effect of Se on the uptake and translocation of As in Chinese cabbage was different under different As pollution conditions. Under mild As pollution condition, higher Se addition could increase the risk of As contamination in edible part, thus the recommended Se in soil was below 2.5 mg·kg−1.
-
Key words:
- selenium /
- arsenic /
- Chinese cabbage /
- translocation /
- speciation
-

-
表 1 不同处理下白菜地上部分砷、硒形态占总量比例(%)
Table 1. Percentage of main As and Se speciation in aboveground part under different treatments (%)
砷处理
As treatment硒处理
Se treatmentAs (Ⅲ) DMA As(Ⅴ) SeCys2 MSC SeMet Se (Ⅳ) Se (Ⅵ) A0 S0 47.4±3.2 d 0.8±0.3 abcd 42.1±10.7 a ND ND ND 29.2±13.2 a 3.7±1.5 d S1 56.4±9.2 d 1.3±0.6 a 37.7±4.9 a 0.8±0.1 d 3.7±1.2 c 1.0±0.2 b 5.4±3.3 c 13.3±2.8 cd S2 52.7±12.1 d 1.1±0.3 ab 36.3±3.6 a 1.3±0.3 bcd 4.7±1.5 bc 2.0±0.6 a 2.8±1.3 c 31.4±5.5 ab S3 56.0±4.4 d 1.0±0.4 abcd 32.6±7.0 a 1.5±0.3 bcd 4.6±1.2 c 1.9±1.0 a 1.1±0.1 c 34.4±6.4 ab A1 S0 76.1±10.2 bc 0.9±0.1 abcd 17.7±2.5 bc ND ND ND 19.0±3.9 b 3.4±0.4 d S1 83.8±8.5 abc 1.1±0.3 abc 18.0±4.0 bc 1.0±0.1 cd 6.1±1.8 abc 1.0±0.6 b 8.8±2.3 c 15.0±4.2 cd S2 74.5±11.7 c 0.9±0.3 abcd 20.4±7.2 b 1. 3±0.3 bcd 3.9±1.1 c 0.9±0.3 b 2.1±0.6 c 26.7±7.8 ab S3 72.9±10.0 c 0.6±0.2 bcd 12.5±6.8 bc 1.9±0.3 ab 4.8±0.4 bc 1.3±0.2 ab 0.9±0.3 c 36.3±4.1 a A2 S0 90.7±6.3 ab 0.6±0.2 cd 9.7±1.5 c ND ND ND 24.8±4.7 ab 4.4±0.9 d S1 94.5±1.8 a 0.6±0.2 cd 9.4±0.8 c 2.6±0.3 a 4.9±0.7 bc 0.6±0.3 b 3.3±0.3 c 14.8±1.1 cd S2 91.1±1.3 ab 0.5±0.1 d 11.2±2.1 bc 1.6±0.9 bc 7.7±2.8 ab 1.0±0.3 b 0.7±0.4 c 22.8±7.3 bc S3 83.0±6.5 abc 0.5±0.1 d 11.8±1.7 bc 1.7±0.4 bc 7.9±0.5 a 0.8±0.1 b 0.5±0.1 c 30.6±14.4 ab 注(Note):ND表示未检出(ND means not detected), 表中同列数据后不同小写字母表示在0.05水平上存在显著差异(Different small alphabets at the same column represent significant difference at 0.05 level), 下同(The same was applied) 表 2 根际土壤pH及有效态含量
Table 2. pH, As and Se Available contents in rhizosphere soil
砷处理
As treatment硒处理
Se treatmentpH 有效态砷/(mg·kg-1)
Available As砷有效度/%
Availability As有效态硒/(mg·kg-1)
Available Se硒有效度/%
Availability SeA0 S0 5.01±0.09 d 0.40±0.02 d 2.47±0.06 c 0.05±0.004 d 9.67±0.55 d S1 5.22±0.07 c 0.40±0.03 d 2.43±0.12 c 0.42±0.04 c 17.77±1.48 abc S2 5.34±0.09 abc 0.40±0.01 d 2.40±0.10 c 0.77±0.09 b 18.47±2.35 ab S3 5.29±0.08 bc 0.44±0.02 d 2.53±0.25 c 1.12±0.08 a 19.00±0.76 ab A1 S0 5.46±0.05 ab 16.16±0.74 c 15.67±0.78 a 0.05±0.01 d 9.40±1.97 d S1 5.32±0.07 abc 16.49±0.91 c 15.83±0.91 a 0.39±0.06 c 16.27±2.38 bc S2 5.41±0.13 abc 16.89±0.72 c 16.13±0.75 a 0.74±0.05 b 17.47±1.36 abc S3 5.34±0.12 abc 16.67±0.60 c 16.00±0.26 a 1.16±0.04 a 19.30±1.31 a A2 S0 5.46±0.13 ab 29.50±0.92 a 15.13±0.35 ab 0.05±0.007 d 9.53±1.01 d S1 5.34±0.15 abc 29.09±1.35 a 14.70±0.44 ab 0.37±0.02 c 15.50±0.69 c S2 5.54±0.16 a 28.72±0.38 a 14.70±0.36 ab 0.74±0.03 b 18.03±0.42 abc S3 5.51±0.12 a 25.26±6.14 b 13.33±3.36 b 1.15±0.14 a 19.60±2.17 a 注(Note):砷有效度(Availability As)=有效态砷(Available As)×100/总砷(Total As); 硒有效度(Availability Se)=有效态硒(Available Se)×100/总硒(Total Se) -
[1] 韩丹. 硒在烤烟中的累积、形态转化及缓解砷毒害的机理研究[D]. 武汉: 华中农业大学, 2015: 9-10. HAN D. The accumulation and species of selenium in Flue-Cured tobacco and the mechanisms of selenium alleviating arsenic toxicity[D]. Wuhan: Huazhong Agricultural University, 2015: 9-10(in Chinese).
[2] KAUR S, SINGH D, SINGH K. Effect of selenium application on arsenic uptake in rice (Oryza sativa L.) [J]. Environmental Monitoring and Assessment, 2017, 189(9): 1-8. [3] 徐向华, 刘传平, 唐新莲, 等. 叶面喷施硒硅复合溶胶抑制水稻砷积累效应研究 [J]. 生态环境学报, 2014, 23(6): 1064-1069. doi: 10.3969/j.issn.1674-5906.2014.06.025 XU X H, LIU C P, TANG X L, et al. Foliar application of selenium-silicon sol reduced arsenic accumulation in rice [J]. Ecology and Environmental Sciences, 2014, 23(6): 1064-1069(in Chinese). doi: 10.3969/j.issn.1674-5906.2014.06.025
[4] PANDEY C, GUPTA M. Selenium and auxin mitigates arsenic stress in rice (Oryza sativa L.) by combining the role of stress indicators, modulators and genotoxicity assay [J]. Journal of Hazardous Materials, 2015, 287(apra28): 384-391. [5] PANDEY C, RAGHURAM B, SINHA A K, et al. miRNA plays a role in the antagonistic effect of selenium on arsenic stress in rice seedlings [J]. Metallomics, 2015, 7(5): 857-866. doi: 10.1039/C5MT00013K [6] HAN D, XIONG S, TU S, et al. Interactive effects of selenium and arsenic on growth, antioxidant system, arsenic and selenium species of Nicotiana tabacum L [J]. Environmental and Experimental Botany, 2015, 117: 12-19. doi: 10.1016/j.envexpbot.2015.04.008 [7] MALIK J A, GOEL S, KAUR N, et al. Selenium antagonises the toxic effects of arsenic on mungbean (Phaseolus aureus Roxb.) plants by restricting its uptake and enhancing the antioxidative and detoxification mechanisms [J]. Environmental and Experimental Botany, 2012, 77: 242-248. doi: 10.1016/j.envexpbot.2011.12.001 [8] 胡莹, 黄益宗, 刘云霞. 砷-硒交互作用对水稻吸收转运砷和硒的影响 [J]. 环境化学, 2013, 32(6): 952-958. doi: 10.7524/j.issn.0254-6108.2013.06.005 HU Y, HUANG Y, LIU Y X. Interactions between arsenic and selenium uptake and translocation in rice (Oryza sativa L.) seedlings [J]. Environmental Chemistry, 2013, 32(6): 952-958(in Chinese). doi: 10.7524/j.issn.0254-6108.2013.06.005
[9] EBBS S, WEINSTEIN L. Alteration of selenium transport and volatilization in barley (Hordeum vulgare) by arsenic [J]. Journal of Plant Physiology, 2001, 158: 1231-1233. doi: 10.1078/0176-1617-00440 [10] SRIVASTAVA M, MA L Q, RATHINASABAPATHI B, et al. Effects of selenium on arsenic uptake in arsenic hyperaccumulator Pteris vittata L [J]. Bioresource Technology, 2009, 100: 1115-1121. doi: 10.1016/j.biortech.2008.08.026 [11] ZHAO F J, MA J F, MEHARG A A, et al. Arsenic uptake and metabolism in plants [J]. The New Phytologist, 2009, 181(4): 777-794. doi: 10.1111/j.1469-8137.2008.02716.x [12] 殷行行, 郑向群, 丁永祯, 等. 亚硒酸盐对旱稻吸收、转运砷及其氧化性胁迫的影响研究 [J]. 农业环境科学学报, 2017, 36(5): 817-825. doi: 10.11654/jaes.2017-0285 YIN X X, ZHENG X Q, DING Y Z, et al. Effect of selenite on arsenic uptake, translocation, and oxidative stress in upland rice [J]. Journal of Agro-Environment Science, 2017, 36(5): 817-825(in Chinese). doi: 10.11654/jaes.2017-0285
[13] 赵秀峰, 张强, 程滨, 等. 硒对砷胁迫下小白菜生理特性及砷吸收的影响 [J]. 环境科学学报, 2017, 37(9): 3583-3589. ZHAO X F, ZHANG Q, CHENG B, et al. Effects of selenium on the physiological characteristics and As uptake of pak choi under As stress [J]. Acta Scientiae Circumstantiae, 2017, 37(9): 3583-3589(in Chinese).
[14] 汪京超, 李楠楠, 谢德体, 等. 砷在植物体内的吸收和代谢机制研究进展 [J]. 植物学报, 2015, 50(4): 516-526. doi: 10.11983/CBB14209 WANG J C, LI N N, XIE D T, et al. Mechanisms of arsenic uptake and metabolism in plants [J]. Bulletin of Botany, 2015, 50(4): 516-526(in Chinese). doi: 10.11983/CBB14209
[15] 陈松灿, 孙国新, 陈正, 等. 植物硒生理及与重金属交互的研究进展 [J]. 植物生理学报, 2014, 50(5): 612-624. CHEN S C, SUN G X, CHEN Z, et al. Progresses on selenium metabolism and interaction with heavy metals in higher plants [J]. Plant Physiology Journal, 2014, 50(5): 612-624(in Chinese).
[16] FENG R W, WEI C Y, TU S X, et al. Interactive effects of selenium and arsenic on their uptake by Pteris vittata L. under hydroponic conditions [J]. Environmental and Experimental Botany, 2009, 65: 363-368. doi: 10.1016/j.envexpbot.2008.11.013 [17] 刘艳丽, 徐莹, 杜克兵, 等. 无机砷在植物体内的吸收和代谢机制 [J]. 应用生态学报, 2012, 23(3): 842-848. LIU Y L, XU Y, DU K B, et al. Absorption and metabolism mechanisms of inorganic arsenic in plants: A review [J]. Chinese Journal of Applied Ecology, 2012, 23(3): 842-848(in Chinese).
[18] HONDAL R J, MARINO S M, GLADYSHEV V N. Selenocysteine in thiol/disulfide-like exchange reactions [J]. Antioxidants & Redox Signaling, 2013, 18(13): 1675-1689. [19] EL MEHDAWI A F, PILON-SMITS E A H. Ecological aspects of plant selenium hyperaccumulation [J]. Plant Biology (Stuttgart, Germany), 2012, 14(1): 1-10. doi: 10.1111/j.1438-8677.2011.00535.x [20] 郭璐, 满楠, 梁东丽, 等. 小白菜对外源硒酸盐和亚硒酸盐动态吸收的差异及其机制研究 [J]. 环境科学, 2013, 34(8): 3272-3279. GUO L, MAN N, LIANG D L, et al. Differences of selenium uptake pattern of pakchoi and the possible mechanism when amended with selenate and selenite [J]. Environmental Science, 2013, 34(8): 3272-3279(in Chinese).
-



 下载:
下载: