-
汞(Hg)是一种天然存在的有毒持久性污染物,是环境中毒性最强的重金属元素之一[1]。甲基汞(MeHg)是一种毒性极强的有机汞化合物[2],可通过食物链生物放大效应在高营养级生物体中高度富集[3]。MeHg进入人体会对人的中枢神经系统产生极大危害,导致中枢神经系统发育障碍,还可引起神经衰弱、精神障碍等神经精神症状[4]。人类暴露MeHg的主要途径之一是食用水产品[5]。由于MeHg在鱼类等水产品中富集造成了严重的人体暴露风险,汞已经被各国列为优先控制污染物,汞污染已经成为全球最重要环境问题之一[6]。
自20世纪80年代以来,渔业资源的匮乏使得全球水产养殖业迅速发展。高密度网箱养殖模式向水中投放的大量饵料只有25%—35%被鱼类摄食,其余部分残留在水体中[7]。饵料中富含氮、磷等营养盐随水溶出进入水体[8],是造成水体富营养化加重,进而导致藻华发生的重要原因之一。在水生生态系统,藻类死亡后大量残体沉积进入水底,导致沉积物中有机质大量积累,进一步诱导水质恶化,污染物形态也随之发生改变[9],对水生生态系统环境质量造成显著影响。
溶解性有机物(dissolved organic matter, DOM)是多种化学成分组成、结构复杂且具有较宽分子量分布的有机化合物复杂混合体[10],其中包括蛋白质、氨基酸、糖类、木质素、脂类和腐殖酸等化合物[11],主要来源于生物分泌物和动植物残体碎屑[12]。DOM广泛分布于河流、湖泊、海洋等水环境中,是水生生态系统中最活跃的有机质组分。由于其含有大量官能团,可以与水体中重金属络合形成配合物[13],从而影响水体中痕量金属离子物理迁移、化学转化以及生物可利用性等[14]。
由于DOM组成复杂,目前关于DOM对无机汞(IHg)甲基化影响观点并不统一。已有研究表明,DOM对汞甲基化的影响具有双重效应,一方面能促进汞甲基化过程—这是因为DOM能够作为碳/氮来源,为微生物对汞甲基化过程提供丰富的营养物质,增强微生物活性,从而促进IHg向MeHg转化[15]。Gascon等[16-17]研究结果证实了水库、湖泊和海洋水体中MeHg浓度与水体内源DOM浓度相关。在Fellman等[18]研究发现,欧洲溪流中MeHg浓度与内源DOM的含量呈正相关,这说明内源DOM对于水体中MeHg的形成具有非常重要的影响。另一方面,有研究认为DOM对汞甲基化起到抑制作用。DOM是天然水体中最重要的汞络合剂之一。一些研究认为DOM抑制汞甲基化主要是因为与汞离子发生吸附、络合等作用,影响了汞在介质中的迁移转化,降低了其生物有效性,从而影响了MeHg的产生[19]。
藻类残体作为水体中主要的内源有机物,藻华大面积爆发必然引起水体有机质含量和组成性质的变化。大量研究表明,水生态系统中MeHg浓度变化与藻类产生量有密切关系,藻源有机物的存在能够加快水体中IHg向MeHg的转化[1, 20-22]。由于渔业养殖区水体氮、磷等营养盐含量较高,易造成水体富营养化加重和藻华爆发,藻类中DOM进一步影响养殖区水体汞形态变化,进而对人类健康产生危害而目前关于渔业养殖区藻源DOM对汞甲基化研究还鲜有报道。
本研究以渔业养殖区藻类DOM为研究目标,研究藻源DOM在汞甲基化过程中影响,同时结合傅里叶红外光谱与三维荧光光谱技术,剖析藻源DOM组成及结构特征,从微观角度探究藻源DOM影响汞甲基化的作用机制,以期为控制养殖水体中汞甲基化的形成提供理论依据。
-
本研究所用藻类样品采集于浙江省宁波市渔业网箱养殖区(29°25.71′N,121°31.93′E)。在秋季收集养殖区内新鲜藻类,将采好的新鲜藻类保存在4 ℃恒温箱内带回实验室。除去已腐烂的藻及其他杂物后,用水清洗掉藻中掺杂的泥沙,并用去离子水淋洗数次。将洗净的藻类置于冷冻干燥机中冷冻干燥,粉碎机粉碎后保存备用。
DOM样本的提取及制备,采用超纯水浸提法[23]:取粉碎过筛后筛粉3 g,与超纯水按1:10的比例进行混合,放置在25 ℃的恒温振荡箱中避光振荡24 h后高速离心,转速12000 r·min−1,时间20 min。取上清液过0.45 µm醋酸纤维素滤膜,获得过滤产物即为DOM样品,置于4 ℃冰箱内保存备用。
-
将提取好的DOM样品冷冻干燥,获得的结晶样品与KBr按1∶100质量比混合压片制样后,用傅里叶变换红外光谱仪(IR Prestige-21)测定DOM的红外光谱,扫描波数范围为500—4000 cm−1,波数精度0.01 cm−1,每个光谱经32次扫描搜集而得到,并通过H2O、CO2以及环境空气矫正光谱。每个光谱分析前测定光谱背景值以降低干扰。
-
紫外吸收光谱和三维荧光光谱(3D-EEM)采用Horiba公司Aqualog®荧光光谱仪进行测定。具体测定方法及光谱参数参照高洁等[24]的实验方法:紫外-可见吸收光谱以Milli-Q水为空白,用10 mm石英比色皿在230—800 nm范围内扫描,间隔1 nm,以355 nm处吸收系数a(355)表示有色DOM相对浓度;荧光光谱以Milli-Q水为空白,激发波长(Ex)范围230—450 nm,增量5 nm,发射波长(Em)范围250—620 nm,扫描信号积分时间3 s,光源为150 W无臭氧氙弧灯,系统自动校正瑞利和拉曼散射。DOM浓度以总有机碳(TOC)表示,采用总有机碳分析仪(multi N/C 2100)测定。
-
一般来说,养殖水体TOC浓度在5.11—19.42 mg·L−1[25],但在富营养化水体中,溶解性有机质含量可以高达37.28 mg·L−1[26],且为使实验结果更明显,将提取好的DOM用超纯水分别调至TOCDOM=10 mg·L−1、TOCDOM=50 mg·L−1备用。水体中汞本底浓度在0.03—2.00 µg·L−1[27],考虑外源污染的输入以及测汞仪的检测精度,本实验用HgCl2溶液汞浓度按照实验梯度分别设为100、200、400、800、1600、3200 ng·L−1。DOM溶液与汞溶液按1:2的体积比混合均匀,室温条件下培养2 d[28],使其充分反应,采用蒋红梅等[29]建立的蒸馏—乙基化结合气相色谱(GC)—冷原子荧光(CVAFS)法测定其MeHg含量,方法回收率为88.2%—108.4%,方法空白为(0.045±0.003)ng·L−1,检出限为0.009 ng·L−1。取培养好的样品于二连通Teflon蒸馏瓶中,125 ℃加热蒸馏瓶,使气相中的MeHg随氮气进入有冰水浴冷却的接收瓶中;将蒸馏液转移到气泡瓶中定容至80 mL,加入NaBEt4试剂密闭条件下反应17 min后氮吹,使MeHg富集在Tenax管上。将Tenax管接入测汞仪(BROOKS RAND Model Ⅲ,美国)测定样品中MeHg含量。实验共计12个处理,以超纯水与汞溶液混合做对照,每个处理设4个重复。实验用超纯水pH为6.45,水温为21℃。
-
数据处理采用Microsoft Excel 2016,由SPSS 25进行数据统计分析,P<0.05表示各组处理之间存在显著差异,图表制作采用Origin 2018。MeHg实验测量按10%的平行操作,做标准曲线并测定空白及标样,对数据进行质量控制。分析重复样品的相对标准误差< 4.5%。
-
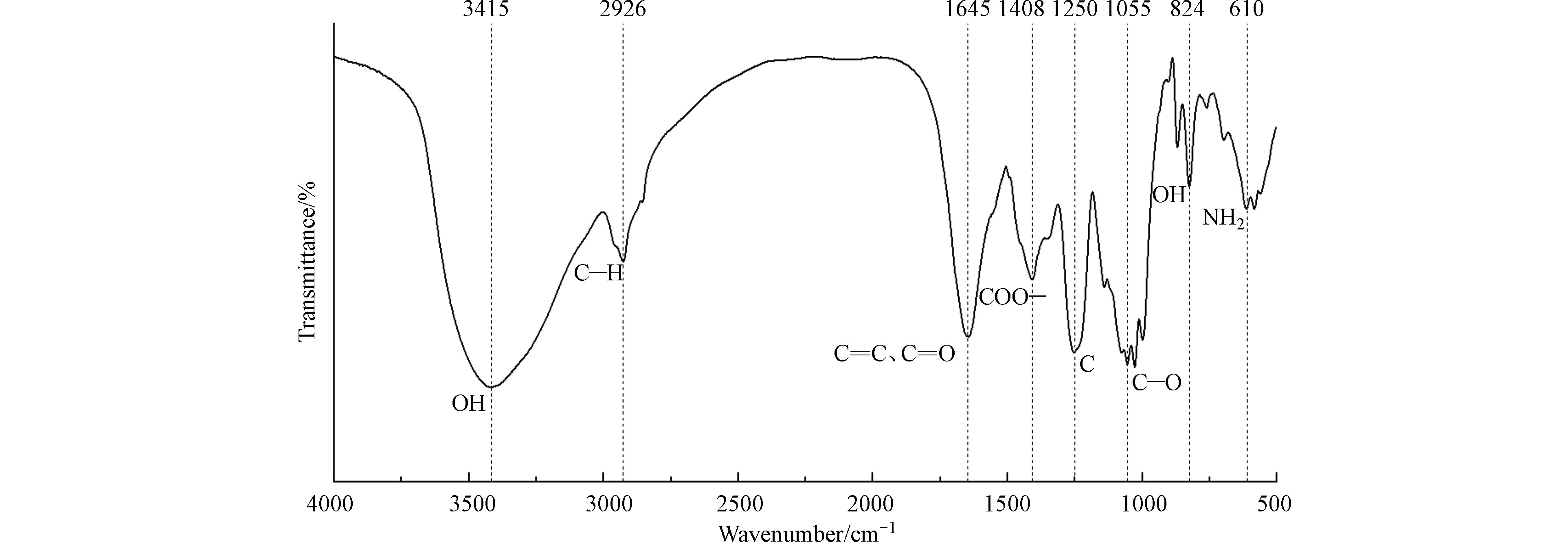
渔业养殖区海藻DOM的红外光谱特征如图1 所示。藻源DOM在3415 cm−1处有一个明显的吸收峰,为O—H的伸缩振动产生[30],表明藻源DOM中含有较多的羟基。峰值出现在2850—3000 cm−1处的吸收峰,为脂肪族C—H的伸缩振动(包括—CH3、—CH2—的反对称伸缩),说明该DOM中可存在脂肪族甲基或亚甲基[31]。出现在1645 cm−1和1408 cm−1处的吸收峰分别对应C=C、C=O和COO—的伸缩振动,824 cm−1对应羧酸中OH的伸缩振动,说明海藻DOM中羧酸基团较为丰富。海藻DOM在表征芳香结构的1250 cm−1处出现了较为明显的吸收峰,表明尽管作为内源有机碳的代表,藻源DOM中仍含有一定量的芳香性组分。而在1055 cm−1附近出现了多个峰,意味着存在多糖类物质C—O拉伸带,这表明海藻DOM中可能含有较多的碳水化合物或水溶性多糖类物质[32]。此外,在610 cm−1处的吸收峰表明DOM中可能含有酰胺类物质[33]。
-
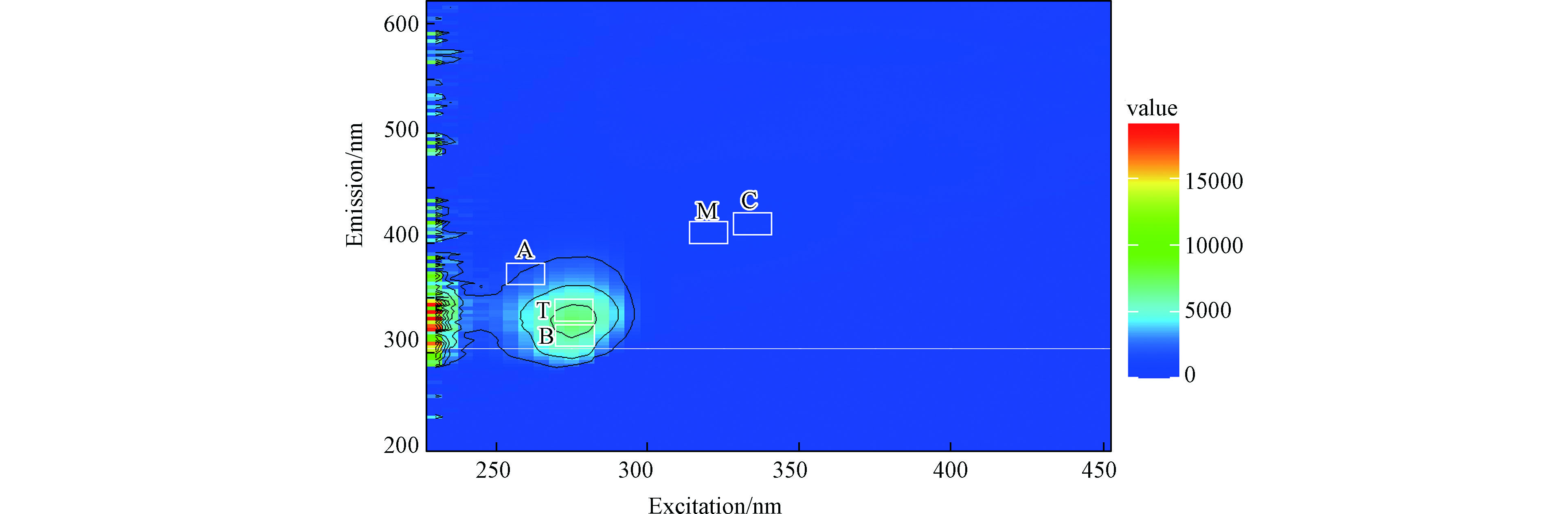
已有研究指出,三维荧光光谱法对DOM的表征快速且灵敏[34],可以检测到DOM中不同类型的荧光峰[35],是对DOM特性进行“指纹识别”的有效工具,已经被广泛应用于不同环境系统中DOM的表征[36]。本研究中,共观察到两类5个荧光峰(图2),分别属于类腐殖质和类蛋白质两大类:荧光峰A (Ex/Em=260 nm/380 nm) 为紫外光区类腐殖质荧光峰;荧光峰B (Ex/Em=275 nm/320 nm) 为类酪氨酸荧光峰;荧光峰C (Ex/Em=335 nm/420 nm) 为可见光区类腐殖质荧光峰;荧光峰M (Ex/Em=320 nm/406 nm) 为微生物源类腐殖质荧光峰;荧光峰T (Ex/Em=275 nm/330 nm) 为类色氨酸荧光峰[37]。各荧光峰强度见表1。从藻源DOM三维荧光光谱图中观察到的多个荧光峰说明了藻源DOM组成的复杂。且由图2可以看出,藻类DOM中类蛋白质荧光峰表现出了较高的吸收强度,说明藻源DOM中蛋白质类组分所占比例较大。对比其他类型DOM可以发现(表1),该藻源DOM在有机组成上与其他类型DOM存在较大差异,其有机组分整体低于鱼粮和鱼粪便来源DOM,这可能是由于鱼饲料中人为添加的有机质较多。
表2列出了本研究所用海藻DOM紫外吸收光谱特征参数,并与其他来源DOM进行比较。SUVA254常用来表征DOM的芳香性大小,其值越大,DOM的芳香化程度越高。SUVA260通常用来表征DOM疏水性的高低,与疏水性组分呈正相关关系;SUVA260与SUVA254的变化趋势一致,即DOM芳香性越高,其疏水性也越强[39]。Her等[40]的研究结果表明,藻源DOM中含有较多的蛋白和多糖类有机物质。对样本的紫外吸收结果进行分析,发现该种藻源DOM的SUVA值较低(SUVA<0.7),说明藻源DOM中对紫外吸收较低的多糖类和蛋白质类有机物质所占比例较大,而对紫外吸收较高的腐殖酸类物质所占比例较小[41],这与三维荧光光谱检测结果一致,也与Her等研究结果相符。光谱斜率S275-295和SR均可反映DOM分子量大小,其值越小,DOM分子量越大[39]。藻源DOM较低的光谱斜率表明其中含有较多大分子量物质,进一步说明藻源DOM中大分子多糖和蛋白质类有机物质的存在。相比于鱼粮、狗牙根和猪粪便中DOM,该种藻源DOM芳香化程度较低,DOM中所含疏水性组分较少,但其芳香性和疏水性略高于鱼粪便和底泥来源DOM。
-
已有研究表明,DOM对汞甲基化的影响具有双面性,He等[15]认为有机质可以提供汞甲基化过程需要的电子供体,从而促进汞向MeHg转变,同时,由于DOM中疏水性有机组分与Hg2+结合能力较弱,对Hg2+活性影响较小,有利于汞甲基化发生[42];而Chirenje等[43]认为,由于DOM中含有大量羟基、羧基、甲基等官能团,可以与重金属汞产生络合作用,降低汞在水体中的迁移转化,从而限制汞甲基化过程,另一方面,DOM中亲水性物质与Hg2+有较强的络合能力,可以降低水体中参与汞甲基化的离子浓度,也可以减弱汞甲基化过程[44]。此外,还有一些研究表明,水体中MeHg含量会随着有机物含量的升高而增加[45];然而也有学者认为,高浓度DOM在某种程度上也可以抑制甲基化的进行。
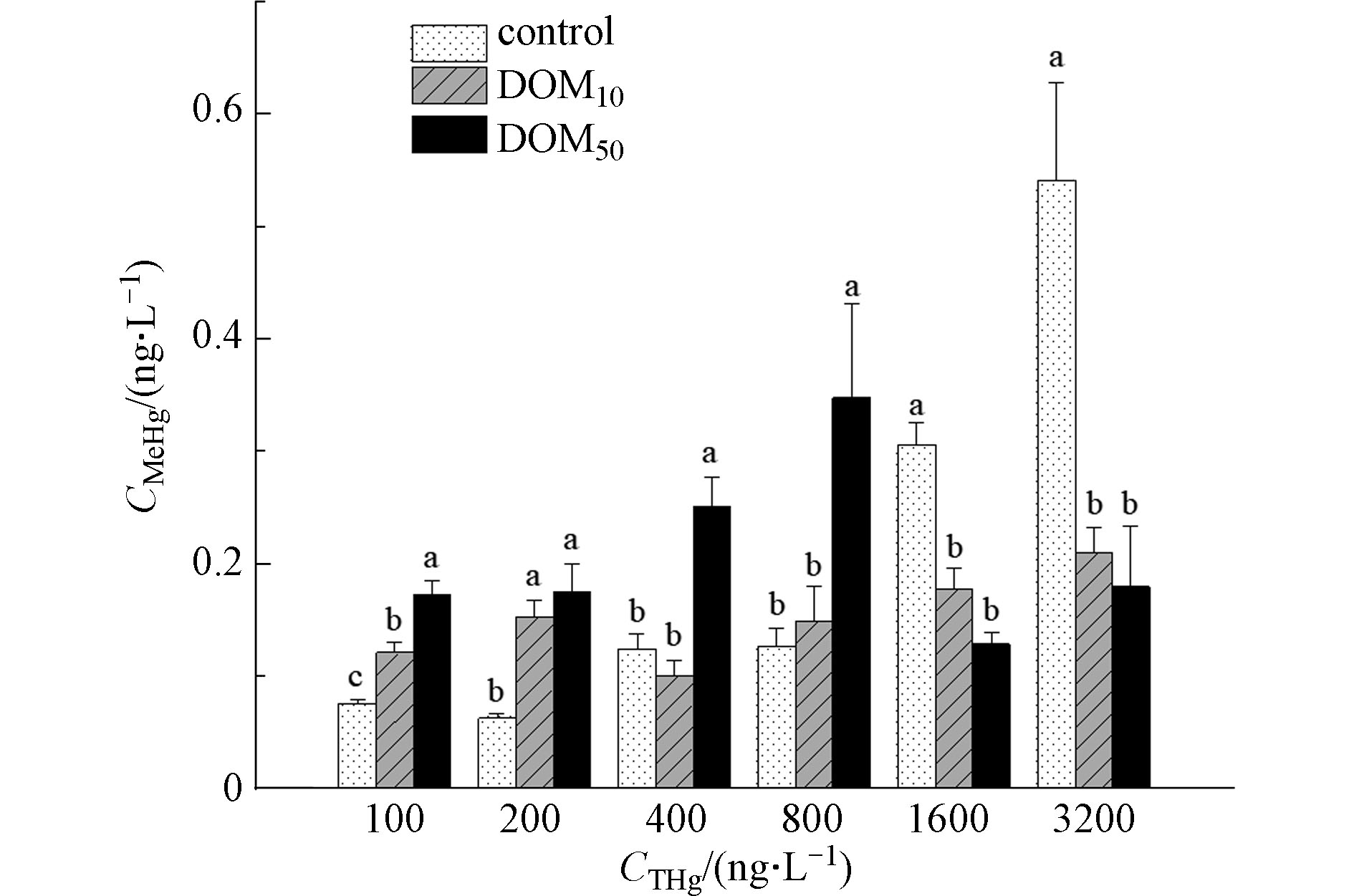
图3显示了在不同汞浓度水平下,DOM浓度对MeHg产生的影响。由图3可以看出,不同汞浓度下DOM对汞甲基化的影响并不相同。随着汞浓度增加,对照组MeHg产生量逐渐增加,这可能是由于实验环境条件带有部分微生物,在没有DOM存在的条件下,溶液中的微生物也会与Hg2+反应生成MeHg。在本实验较低浓度汞溶液中(THg≤200 ng·L−1),添加DOM的处理组MeHg产生量高于对照组,即两种浓度DOM均促进了MeHg的产生,且促进作用达到显著水平(P<0.05),这可能是由于DOM中含C官能团可以作为汞甲基化过程的甲基供体,参与汞甲基化反应,进而对汞甲基化过程产生促进作用。随着汞浓度逐渐升高(200 ng·L−1<THg≤800 ng·L−1),低浓度DOM(DOM10)所提供的甲基供体可能不足以满足汞甲基化过程需求,因而其对MeHg的产生促进效果不显著,基本与对照组持平,而高浓度DOM(DOM50)由于浓度较高,其中含C官能团相对较多,可以提供足够多的甲基供体,从而仍能表现出明显的促进作用,且MeHg产生量显著高于对照组,此时两种浓度DOM对汞甲基化的影响产生了显著差异(P<0.05);而在更高汞浓度条件下(THg≥1600 ng·L−1),在添加DOM的处理组中,MeHg产生量明显低于对照组,两种浓度DOM均表现出抑制MeHg生成,且抑制作用达到极显著水平(P<0.01)。此时DOM对汞甲基化的影响呈现出与中低汞浓度条件下相反的趋势。这可能是由于汞浓度较高时,DOM50中的甲基供体也无法满足汞甲基化需求,且DOM中中疏水性组分较少,大量亲水性物质也可与Hg2+发生络合,使得溶液中游离的自由离子浓度降低,参与甲基化的Hg2+活性降低,DOM表现出抑制汞甲基化的作用;此外,导致溶液中MeHg含量降低的另一个原因可能是由于溶液中汞浓度过高,较高的汞对微生物产生毒害作用,导致微生物活性降低。
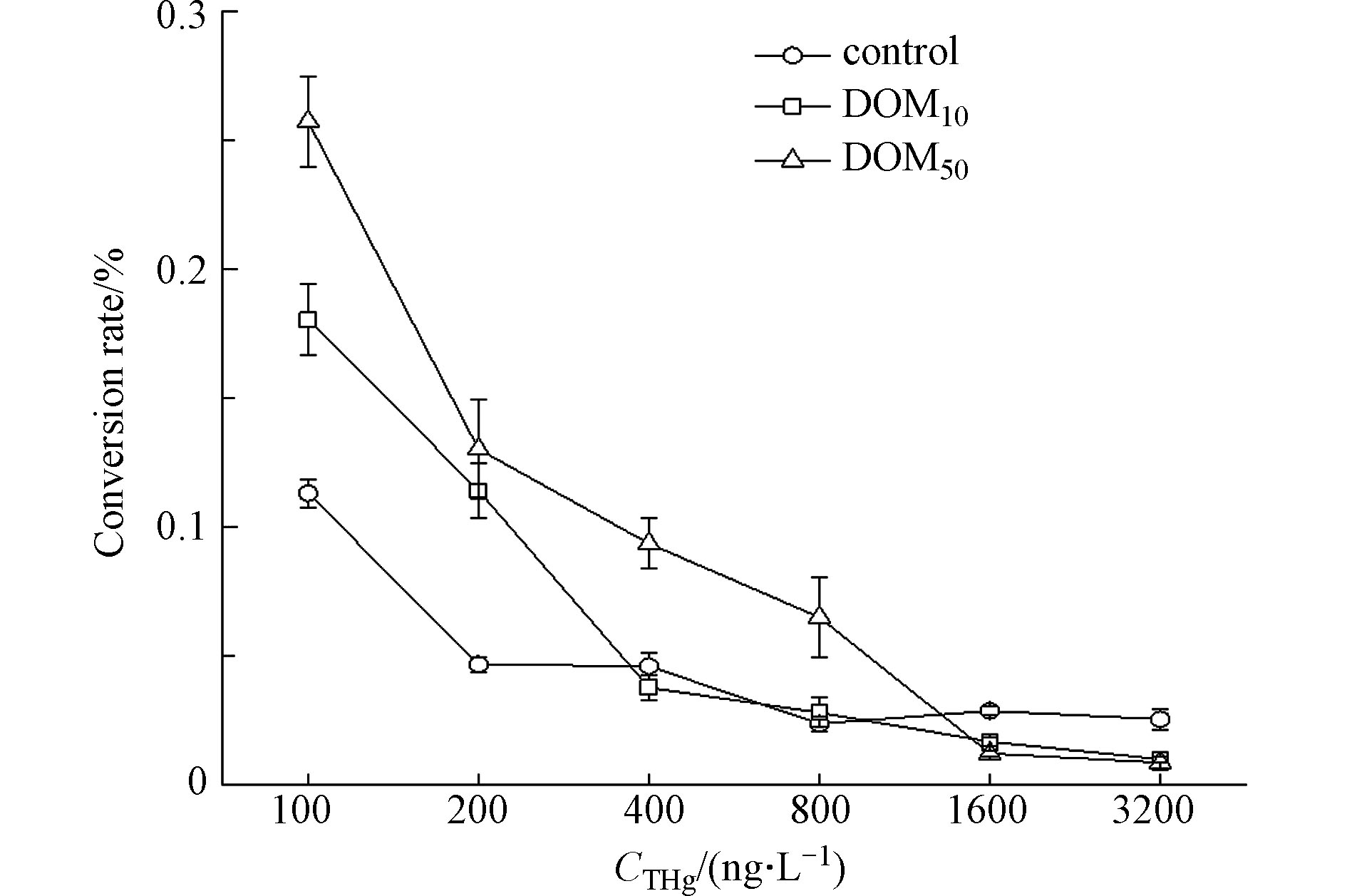
图4为不同浓度DOM在汞浓度不同时对甲基汞转化率(%MeHg)的影响。结果表明,随着溶液中汞浓度升高,无论是对照组还是添加DOM的处理组,甲基汞转化率均呈现整体降低的趋势,对照组%MeHg由0.113%降至0.025%,添加DOM的处理组%MeHg分别从0.18%和0.257%降至0.009%和0.008%。在THg≤200 ng·L−1时,与对照组相比,添加DOM均可以提高MeHg的转化率,推动IHg向MeHg的转变,且DOM50的促进作用比DOM10更明显,在两个汞浓度下分别高出了0.077%和0.016%。在中高汞浓度的条件下(200 ng·L−1<THg≤800 ng·L−1),DOM10对于IHg向MeHg转化基本没有影响,而 DOM50仍表现出较显著的促进作用,%MeHg可以达到0.093%和0.065%。THg浓度进一步升高,DOM不仅没有表现出促进汞甲基化的能力,反而降低了甲基汞转化率,其%MeHg均低于未添加DOM的对照组,抑制了汞向MeHg转化,此时不同浓度DOM对汞甲基化的影响差异不明显。
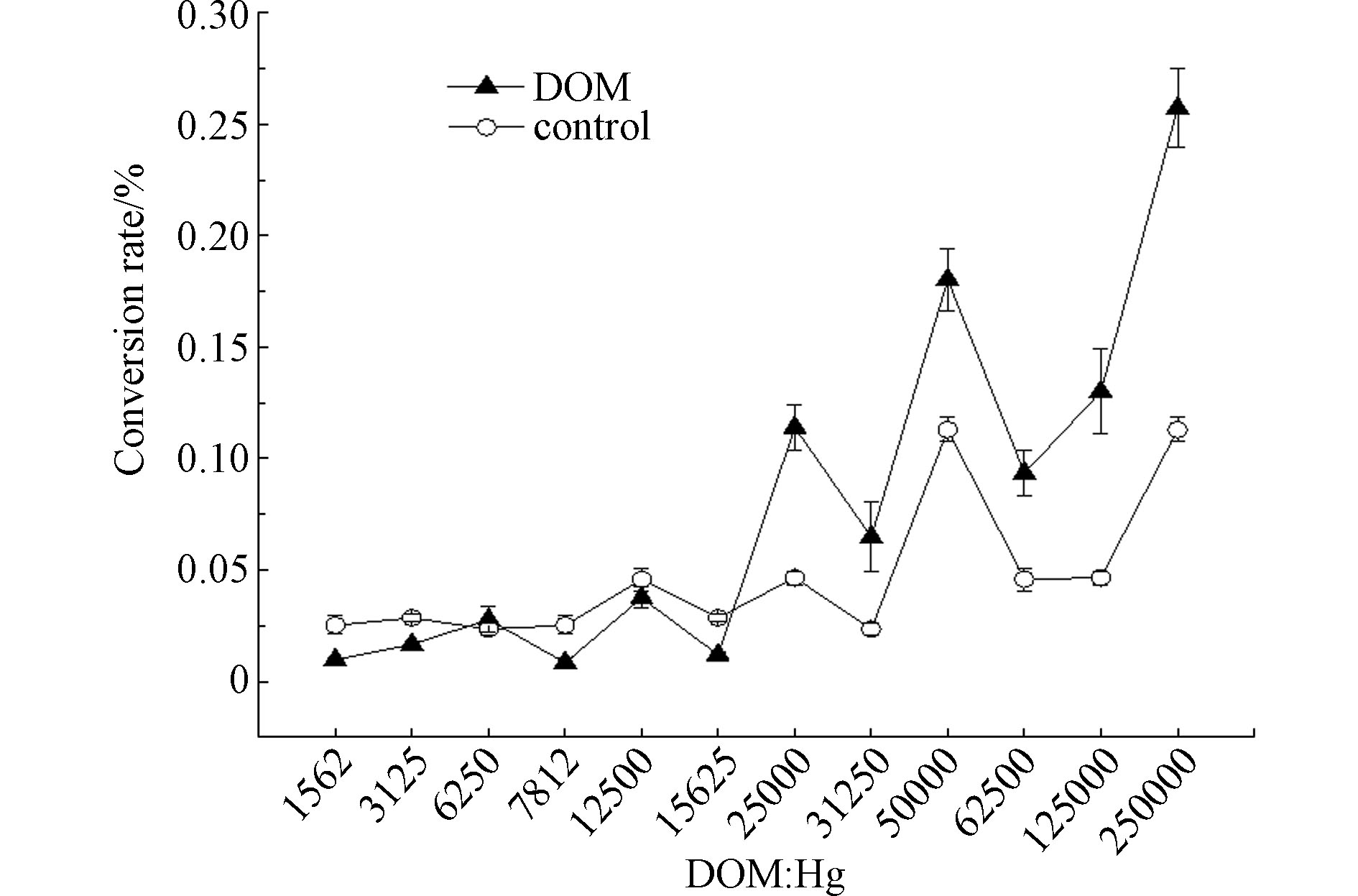
综合分析两种浓度DOM对汞甲基化影响结果,可以得出其与DOM和THg质量比之间的大致联系。如图5所示,随着溶液中DOM含量逐渐增大,溶液中MeHg转化率整体呈现增大趋势。与对照组相比,在DOM∶Hg≤15625时,添加了DOM的处理组%MeHg与对照组无明显差异(P>0.05),而随着溶液中DOM含量升高,在DOM∶Hg>15625时,DOM显著促进了溶液中MeHg的转化,其%MeHg比空白组高出0.60—1.79倍,这与龚贵清等[38]研究结果一致。Markus等[46]对汞与DOM的结合机理进行研究,发现在DOM∶Hg=500时,溶液中汞几乎全部作用于DOM上的强结合位点,随着比例增大,DOM上的强结合位点已经过量,DOM与Hg不再发生络合作用。本实验所选用DOM∶Hg浓度比均大于500,因此无论DOM含量多少,其上络合位点均已达到饱和,低浓度DOM中甲基供体数量有限,不足以满足汞甲基化过程;随着DOM含量逐渐增大,其中大量含C官能团作为甲基供体,参与溶液中汞甲基化反应,推动了汞向MeHg的转化。何小松等[47]研究了垃圾渗滤液中水溶性有机质与汞相互作用,发现DOM中容易被生物利用的类蛋白组分是Hg2+的强有机配位体。因此在实验DOM浓度较高时,其中的类蛋白组分也能够与Hg2+结合,提高Hg2+生物可利用性,继而促进溶液中汞的甲基化,且DOM中脂肪链烃结构也可以作为碳氮来源提高微生物活性,促进MeHg产生。
-
(1)渔业养殖区藻源DOM主要由类腐殖质和类蛋白质两大类物质组成,其中类蛋白质所占比重较大;藻源DOM含有羟基、甲基、亚甲基、芳香性C=C等官能团,可能含有羧酸类、脂肪烃类、芳香族化合物和酰胺类等物质;DOM芳香化程度较低,所含疏水性物质较少,大分子多糖和蛋白类物质含量较高。
(2)不同汞浓度下,DOM对汞甲基化影响不同。在汞浓度较低时,DOM上含C官能团作为甲基供体可显著促进汞甲基化过程;随着汞浓度升高,不同浓度DOM提供的甲基供体量不同,因而低浓度DOM没有明显促进作用,而高浓度DOM仍能促进汞甲基化;汞浓度更高时,DOM中大量亲水性物质与IHg络合,降低了溶液中IHg活性,从而抑制汞甲基化。
(3)不同浓度DOM对汞甲基化过程的影响不完全相同。在高汞浓度范围内,DOM的络合作用表现出降低汞甲基化的趋势,而在低汞浓度范围内,DOM上的类蛋白组分提高了汞的生物利用性,且DOM作为甲基供体和碳氮来源显著促进了汞的甲基化。考虑外源污染输入和仪器检测精度的影响,本实验选用了较高浓度的汞溶液和DOM提取液,而从实验完整性出发,后续应设置低汞浓度和较小DOM浓度梯度进行研究。
渔业养殖区藻源溶解性有机质性质特征对汞甲基化影响
Characteristics of algae dissolved organic matter composition in coastal fishery farming area and its effect on mercury methylation
-
摘要: 溶解性有机质(dissolved organic matter, DOM)是水生生态系统中的重要成分,能够显著影响汞的甲基化等形态变化过程。以近岸渔业养殖区藻源DOM为研究对象,运用傅里叶变换红外光谱和三维荧光光谱技术,对其结构特征进行表征;并选取总有机碳浓度TOCDOM=10 mg·L−1(DOM10)和TOCDOM=50 mg·L−1(DOM50)两种水平藻源DOM提取液,分析其在不同汞浓度条件下对汞甲基化过程的影响。结果表明,藻源DOM主要由类蛋白和类腐殖质组分组成,其中前者含量较高,疏水及芳香组分含量较低;红外光谱显示藻源DOM中含有—OH、—CH3、—CH2、芳香性C=C等官能团。甲基化实验表明,在溶液中DOM含量相对较少时(DOM∶Hg浓度比≤15625),DOM表现出抑制汞甲基化的趋势,而当溶液中 DOM 含量逐渐升高(DOM∶Hg浓度比>15625),DOM可以显著促进水体中汞向甲基汞的转化。藻源DOM既能作为碳氮来源提高微生物活性,为汞的甲基化提供甲基供体,又可以与溶液中Hg2+发生络合,从而影响汞甲基化过程。在汞溶液浓度相对较低时,DOM对汞甲基化过程的影响主要表现为提供大量的甲基供体,同时作为微生物利用的底物,促进无机汞向甲基汞的转化,甲基汞转化率最高可达0.257%;但在高汞浓度条件下,DOM对汞的络合作用降低了无机汞的微生物可利用性,水体中甲基汞下降,表现出抑制作用。Abstract: Dissolved organic matter (DOM) is an essential component in aquatic ecosystems, significantly affecting mercury speciation changes such as the methylation process. In this study, DOM was leached from algae in the coastal fishery culture area. Fourier transform infrared spectroscopy and three-dimensional (3D) excitation-emission matrix (EEM) fluorescence spectroscopy were used to explore the composition and characteristics of algal DOM. The effect of DOM on the mercury methylation process was investigated using two DOM concentrations (according total organic carbon, TOCDOM=10 mg·L−1 and TOCDOM=50 mg·L−1 denoted as DOM10 and DOM50, respectively) and different mercury concentrations. The result shows that the algal DOM is mainly composed of protein-like and humic-like components which the former is higher. DOM has less aromaticity and hydrophobicity. The algal DOM contains —OH groups, —CH3 and —CH2 groups, C=C in aromatic structure, and other functional groups. DOM can inhibit mercury methylation in a lower content (DOM : Hg≤15625) while it significantly promote the conversion of mercury to methylmercury in solution as the content gradually increases (DOM : Hg>15625).It could promote mercury methylation by providing methyl donors or as the resource of C and N to improve microbial activity. In contrast, it can also be complex with Hg2+ during their reaction process and further inhibit mercury methylation. At lower mercury concentrations DOM mainly provides a large amount of methyl donors and as a substrate for microbial to enhance the methylation process, the methylmercury conversion rate is up to 0.257%. However, DOM reduced bioavailability of inorganic mercury at higher mercury concentration and showing an inhibitory effect as for the complexation mechanism.
-
Key words:
- mercury /
- methylation /
- dissolved organic matter /
- algae /
- fisheries and aquaculture
-

-
表 1 藻源DOM的三维荧光光谱参数与其他物质的比较
Table 1. Comparison of fluorescence spectrum parameters of DOM from algae and other substances
表 2 藻源DOM的紫外吸收光谱参数
Table 2. Comparison of Ultraviolet absorption spectrum parameters of DOM from algae and other substances
-
[1] BRAVO A G, KOTHAWALA D N, ATTERMEYER K, et al. The interplay between total mercury, methylmercury and dissolved organic matter in fluvial systems: A latitudinal study across Europe [J]. Water Research, 2018, 144: 172-182. doi: 10.1016/j.watres.2018.06.064 [2] 闫海鱼, 冯彩艳. 水产养殖对水生生态系统中汞甲基化影响研究进展 [J]. 环境化学, 2012, 31(11): 1782-1786. YAN H Y, FENG C Y. Resesrcher necessity and advances about influence on methlylation of mercury in aquatic ecosystem from the aquaculture [J]. Environmental Chemistry, 2012, 31(11): 1782-1786(in Chinese).
[3] MOREL F M M, KRAEPIEL A M L, AMYOT M. The chemical cycle and bioaccumulation of mercury [J]. Annual Review of Ecology and Systematics, 1998, 29(1): 543-566. doi: 10.1146/annurev.ecolsys.29.1.543 [4] 冯新斌, 仇广乐, 付学吾, 等. 环境汞污染[J]. 化学进展, 2009, 21(增刊1): 436-457. FENG X B, QIU G L, FU X W, et al. Mercury pollution in the environment[J]. Progress in Chemistry, 2009, 21(Sup 1): 436-457(in Chinese).
[5] ZHANG H, FENG X B, LARSSEN T, et al. Bioaccumulation of methylmercury versus inorganic mercury in rice (Oryza sativa L. ) grain [J]. Environmental Science & Technology, 2010, 44(12): 4499-4504. [6] 张玉涛, 程劲松, 李琳, 等. 溶解性有机质对水体汞还原反应影响机制研究进展 [J]. 三峡大学学报(自然科学版), 2015, 37(1): 101-104. doi: 10.13393/j.cnki.issn.1672-948X.2015.01.023 ZHANG Y T, CHENG J S, LI L, et al. Progress in research on influences of dissolved organic matter on mercury reduction in water [J]. Journal of China Three Gorges University (Natural Sciences), 2015, 37(1): 101-104(in Chinese). doi: 10.13393/j.cnki.issn.1672-948X.2015.01.023
[7] 程素珍, 许尚杰, 刁汇文. 水库网箱养鱼对水质的影响及防治对策 [J]. 水利与建筑工程学报, 2010, 8(1): 30-31,147. doi: 10.3969/j.issn.1672-1144.2010.01.010 CHENG S Z, XU S J, DIAO H W. Influence of fish culturing with cages in reservoir on water quality and countermeasures to it [J]. Journal of Water Resources and Architectural Engineering, 2010, 8(1): 30-31,147(in Chinese). doi: 10.3969/j.issn.1672-1144.2010.01.010
[8] 王立明, 刘德文. 网箱养鱼对潘家口水库水质的影响分析 [J]. 河北渔业, 2008(6): 42-44,49. doi: 10.3969/j.issn.1004-6755.2008.06.021 WANG L M, LIU D W. Influence of cage culture on water quality in Panjiakou reservoir [J]. Hebei Fisheries, 2008(6): 42-44,49(in Chinese). doi: 10.3969/j.issn.1004-6755.2008.06.021
[9] CHEN M J, CHEN F Z, XING P, et al. Microbial eukaryotic community in response to Microcystis spp. bloom, as assessed by an enclosure experiment in Lake Taihu, China [J]. FEMS Microbiology Ecology, 2010, 74(1): 19-31. doi: 10.1111/j.1574-6941.2010.00923.x [10] AIKEN G R, HSU-KIM H, RYAN J N. Influence of dissolved organic matter on the environmental fate of metals, nanoparticles, and colloids [J]. Environmental Science & Technology, 2011, 45(8): 3196-3201. [11] NEBBIOSO A, PICCOLO A. Molecular characterization of dissolved organic matter (DOM): A critical review [J]. Analytical and Bioanalytical Chemistry, 2013, 405(1): 109-124. doi: 10.1007/s00216-012-6363-2 [12] WETZEL R G. Death, detritus, and energy flow in aquatic ecosystems [J]. Freshwater Biology, 1995, 33(1): 83-89. doi: 10.1111/j.1365-2427.1995.tb00388.x [13] SCHARTUP A T, NDU U, BALCOM P H, et al. Contrasting effects of marine and terrestrially derived dissolved organic matter on mercury speciation and bioavailability in seawater [J]. Environmental Science & Technology, 2015, 49(10): 5965-5972. [14] DUNNIVANT F M, JARDINE P M, TAYLOR D L, et al. Cotransport of cadmium and hexachlorobiphenyl by dissolved organic carbon through columns containing aquifer material [J]. Environmental Science & Technology, 1992, 26(2): 360-368. [15] HE T R, FENG X B, GUO Y N, et al. Distribution and speciation of mercury in the Hongfeng reservoir, Guizhou Province, China [J]. Chinese Journal of Geochemistry, 2008, 27(1): 97-103. doi: 10.1007/s11631-008-0097-z [16] GASCÓN DÍEZ E, LOIZEAU J L, COSIO C, et al. Role of settling particles on mercury methylation in the oxic water column of freshwater systems [J]. Environmental Science & Technology, 2016, 50(21): 11672-11679. [17] NOH S, KIM J, HUR J, et al. Potential contributions of dissolved organic matter to monomethylmercury distributions in temperate reservoirs as revealed by fluorescence spectroscopy [J]. Environmental Science and Pollution Research, 2018, 25(7): 6474-6486. doi: 10.1007/s11356-017-0913-2 [18] FELLMAN J B, HOOD E, SPENCER R G M. Fluorescence spectroscopy opens new windows into dissolved organic matter dynamics in freshwater ecosystems: A review [J]. Limnology and Oceanography, 2010, 55(6): 2452-2462. doi: 10.4319/lo.2010.55.6.2452 [19] 陈春羽, 王定勇. 水溶性有机质对土壤及底泥中汞吸附行为的影响 [J]. 环境科学学报, 2009, 29(2): 312-317. doi: 10.3321/j.issn:0253-2468.2009.02.013 CHEN C Y, WANG D Y. Effect of dissolved organic matter on adsorption of mercury by soils and sediment [J]. Acta Scientiae Circumstantiae, 2009, 29(2): 312-317(in Chinese). doi: 10.3321/j.issn:0253-2468.2009.02.013
[20] SOERENSEN A L, SCHARTUP A T, SKROBONJA A, et al. Organic matter drives high interannual variability in methylmercury concentrations in a subarctic coastal sea [J]. Environmental Pollution, 2017, 229: 531-538. doi: 10.1016/j.envpol.2017.06.008 [21] BRAVO A G, BOUCHET S, TOLU J, et al. Molecular composition of organic matter controls methylmercury formation in boreal lakes [J]. Nature Communications, 2017, 8: 14255. doi: 10.1038/ncomms14255 [22] SCHARTUP A T, MASON R P, BALCOM P H, et al. Methylmercury production in estuarine sediments: Role of organic matter [J]. Environmental Science & Technology, 2013, 47(2): 695-700. [23] BARRIUSO E, BAER U, CALVET R. Dissolved organic matter and adsorption-desorption of dimefuron, atrazine, and carbetamide by soils [J]. Journal of Environmental Quality, 1992, 21(3): 359-367. [24] 高洁, 江韬, 李璐璐, 等. 三峡库区消落带土壤中溶解性有机质(DOM)吸收及荧光光谱特征 [J]. 环境科学, 2015, 36(1): 151-162. GAO J, JIANG T, LI L L, et al. Ultraviolet-visible(UV-vis) and fluorescence spectral characteristics of dissolved organic matter(DOM) in soils of water-level fluctuation zones of the Three Gorges reservoir region [J]. Environmental Science, 2015, 36(1): 151-162(in Chinese).
[25] 杨大佐. 刺参养殖池塘有机碳周年变化的初步研究 [J]. 科技致富向导, 2011(20): 108-109. [26] LYU L L, LIU G, SHANG Y X, et al. Characterization of dissolved organic matter (DOM) in an urbanized watershed using spectroscopic analysis [J]. Chemosphere, 2021, 277: 130210. doi: 10.1016/j.chemosphere.2021.130210 [27] 刘金铃, 丁振华. 汞的甲基化研究进展 [J]. 地球与环境, 2007, 35(3): 215-222. LIU J L, DING Z H. Progress in research on mercury methylation in environment [J]. Earth and Environment, 2007, 35(3): 215-222(in Chinese).
[28] MOREAU J W, GIONFRIDDO C M, KRABBENHOFT D P, et al. The effect of natural organic matter on mercury methylation by Desulfobulbus propionicus 1pr3 [J]. Frontiers in Microbiology, 2015, 6: 1389. [29] 蒋红梅, 冯新斌, 梁琏, 等. 蒸馏-乙基化GC-CVAFS法测定天然水体中的甲基汞 [J]. 中国环境科学, 2004, 24(5): 130-135. doi: 10.3321/j.issn:1000-6923.2004.05.014 JIANG H M, FENG X B, LIANG L, et al. Determination of methyl mercury in waters by distillation-GC-CVAFS technique [J]. China Environmental Science, 2004, 24(5): 130-135(in Chinese). doi: 10.3321/j.issn:1000-6923.2004.05.014
[30] 倪文海, 刘欢, 刘振涛, 等. 水稻秸杆腐解过程溶解性有机质红外光谱研究 [J]. 土壤, 2013, 45(2): 1220-1226. doi: 10.3969/j.issn.0253-9829.2013.02.005 NI W H, LIU H, LIU Z T, et al. Study on Fourier-transform infrared spectra of dissolved organic matters extracted from rice straw at different decay stages [J]. Soils, 2013, 45(2): 1220-1226(in Chinese). doi: 10.3969/j.issn.0253-9829.2013.02.005
[31] LEENHEER J A. Comprehensive approach to preparative isolation and fractionation of dissolved organic carbon from natural waters and wastewaters [J]. Environmental Science & Technology, 1981, 15(5): 578-587. [32] CHEFETZ B, HADER Y, CHEN Y. Dissolved organic carbon fractions formed during composting of municipal solid waste: Properties and significance [J]. Acta Hydrochimica et Hydrobiologica, 1998, 26(3): 172-179. doi: 10.1002/(SICI)1521-401X(199805)26:3<172::AID-AHEH172>3.0.CO;2-5 [33] 吴东明, 李勤奋, 武春媛. 铁铝土对溶解性有机质的吸附特性 [J]. 环境化学, 2016, 35(4): 639-650. doi: 10.7524/j.issn.0254-6108.2016.04.2015112205 WU D M, LI Q F, WU C Y. Adsorption of dissolved organic matter on ferrallitic soils [J]. Environmental Chemistry, 2016, 35(4): 639-650(in Chinese). doi: 10.7524/j.issn.0254-6108.2016.04.2015112205
[34] GALINHA C F, CARVALHO G, PORTUGAL C A M, et al. Real-time monitoring of membrane bioreactors with 2D-fluorescence data and statistically based models [J]. Water Science and Technology, 2011, 63(7): 1381-1388. doi: 10.2166/wst.2011.195 [35] 卢松, 江韬, 张进忠, 等. 两个水库型湖泊中溶解性有机质三维荧光特征差异 [J]. 中国环境科学, 2015, 35(2): 516-523. LU S, JIANG T, ZHANG J Z, et al. Three-dimensional fluorescence characteristic differences of dissolved organic matter(DOM) from two typical reservoirs [J]. China Environmental Science, 2015, 35(2): 516-523(in Chinese).
[36] YU H B, SONG Y H, LIU R X, et al. Identifying changes in dissolved organic matter content and characteristics by fluorescence spectroscopy coupled with self-organizing map and classification and regression tree analysis during wastewater treatment [J]. Chemosphere, 2014, 113: 79-86. doi: 10.1016/j.chemosphere.2014.04.020 [37] 陈诗雨, 李燕, 李爱民. 溶解性有机物研究中三维荧光光谱分析的应用 [J]. 环境科学与技术, 2015, 38(5): 64-68,73. CHEN S Y, LI Y, LI A M. Application of three-dimensional fluorescence spectroscopy in the study of dissolved organic matter [J]. Environmental Science & Technology, 2015, 38(5): 64-68,73(in Chinese).
[38] 龚贵清, 唐兴萍, 孙涛, 等. 不同类型DOM对三峡库区消落带土壤汞甲基化的影响 [J]. 环境科学学报, 2019, 39(9): 3073-3079. doi: 10.13671/j.hjkxxb.2019.0190 GONG G Q, TANG X P, SUN T, et al. Effects of different DOMs on mercury methylation in soil in water-level-fluctuating zone of the Three Gorges Reservoir area [J]. Acta Scientiae Circumstantiae, 2019, 39(9): 3073-3079(in Chinese). doi: 10.13671/j.hjkxxb.2019.0190
[39] 江韬, Joeri Kaal, 梁俭, 等. 三峡库区消落带土壤溶解性有机质溯源: 基于氮/碳比值的线性双端元源负荷分析 [J]. 环境科学, 2019, 40(6): 2647-2656. JIANG T, KAAL J, LIANG J, et al. Use of the nitrogen/carbon ratio(N/C) and two end-member sources mixing model to identify the origins of dissolved organic matter from soils in the water-level fluctuation zones of the Three Gorges reservoir [J]. Environmental Science, 2019, 40(6): 2647-2656(in Chinese).
[40] HER N, AMY G, MCKNIGHT D, et al. Characterization of DOM as a function of MW by fluorescence EEM and HPLC-SEC using UVA, DOC, and fluorescence detection [J]. Water Research, 2003, 37(17): 4295-4303. doi: 10.1016/S0043-1354(03)00317-8 [41] 丰桂珍, 董秉直. 水中藻类溶解性有机物特性研究 [J]. 环境科学与技术, 2016, 39(11): 144-149. FENG G Z, DONG B Z. Study on the characteristics of algogenic organic matters [J]. Environmental Science & Technology, 2016, 39(11): 144-149(in Chinese).
[42] GUGGENBERGER G, GLASER B, ZECH W. Heavy metal binding by hydrophobic and hydrophilic dissolved organic carbon fractions in a Spodosol A and B horizon [J]. Water, Air, and Soil Pollution, 1994, 72(1/2/3/4): 111-127. [43] CHIRENJE T, MA L Q. Effects of acidification on metal mobility in a papermill-ash amended soil [J]. Journal of Environmental Quality, 1999, 28(3): 760-766. [44] LIANG P, SHAO D D, WU S C, et al. The influence of mariculture on mercury distribution in sediments and fish around Hong Kong and adjacent mainland China waters [J]. Chemosphere, 2011, 82(7): 1038-1043. doi: 10.1016/j.chemosphere.2010.10.061 [45] BALOGH S J, SWAIN E B, NOLLET Y H. Characteristics of mercury speciation in Minnesota rivers and streams [J]. Environmental Pollution, 2008, 154(1): 3-11. doi: 10.1016/j.envpol.2007.11.014 [46] HAITZER M, AIKEN G R, RYAN J N. Binding of mercury(II) to dissolved organic matter: The role of the mercury-to-DOM concentration ratio [J]. Environmental Science & Technology, 2002, 36(16): 3564-3570. [47] 何小松, 席北斗, 魏自民, 等. 三维荧光光谱研究垃圾渗滤液水溶性有机物与汞相互作用 [J]. 分析化学, 2010, 38(10): 1417-1422. HE X S, XI B D, WEI Z M, et al. Three-dimensional excitation emission matrix fluorescence spectroscopic characterization of complexation between mercury(Ⅱ) and dissolved organic matter extracted from landfill leachate [J]. Chinese Journal of Analytical Chemistry, 2010, 38(10): 1417-1422(in Chinese).
-



 下载:
下载: