-
据估计,全球有超过25%—30%的人口患有过敏性疾病[1]. 近年来,世界范围内过敏性疾病的发病率仍在急剧上升,已成为世界上患病率增长速度最快的慢性疾病之一[2]. 尽管发病率增加的原因尚未完全被揭示,许多研究已经发现,空气污染会加剧过敏性哮喘等疾病[3-5]. Franze等[6]发现暴露于空气污染物中的桦树花粉过敏原发生了有效的硝基化反应,并提出了过敏原的硝基化在空气污染对过敏性疾病的促进作用中发挥了关键作用.
过敏原的硝基化通常是指过敏原蛋白质酪氨酸在硝化剂的作用下反应形成3-硝基酪氨酸(3-nitrotyrosine)[7]. 过敏原的硝基化会对其免疫原性产生影响[8],硝基化可能导致本是过敏原的蛋白质的致敏性增强,或者导致细胞表位的暴露或新表位的产生[9-10],从而增加其人体健康风险. Gruijthuijsen[11]以及 Karle等[12]通过动物实验和体外实验证实了硝基化反应会增强桦树花粉过敏原Bet v 1的致敏潜力. 然而,蛋白质的硝基化具有位点选择性,并非过敏原上所有酪氨酸都能发生硝基化反应[8]. 对过敏原硝基化过程中酪氨酸位点发生特异性反应的研究对于阐明硝基化影响过敏原致敏性的机制以及控制硝基化所带来的致敏性健康风险具有重要的意义.
目前,环境中已经检测到了硝基化的花粉过敏原[6],对过敏原硝基化的分子机制以及敏化机制(对致敏性影响)的研究也多集中于花粉过敏原. 而环境中其它过敏原的硝基化状况鲜有报道. 尘螨(house dust mites, HDM)是人类生活和工作的各类室内环境中最为常见的过敏来源,其产生的过敏原可引起哮喘、特应性皮炎等多种过敏性疾病[13-14]. 高达50%的过敏患者对尘螨过敏原过敏[15]. 在至今已鉴定出的38组尘螨过敏原中,来自粉尘螨(Dermatophagoides farina,Der f)和屋尘螨(Dermatophagoides pteronyssinus,Der p)的组分Ⅰ(Der f 1和Der p 1)和组分Ⅱ(Der f 2和Der p 2)为最主要的尘螨致敏原[16-18]. Der p 1和Der p 2的IgE抗体结合频率分别超过了80%[19]与90%[17],长期以来,Der p 1和Der p 2被认为是诊断和治疗尘螨过敏疾病所必须关注的两种过敏原[16]. 在本课题组最近的研究中,已经检测出了环境灰尘样本中Der f 1和Der p 1的硝基化产物[20]. 然而,由于尘螨过敏原含有多个酪氨酸位点,其在硝基化过程中的位点选择性还有待进一步的研究.
以往的研究,通常使用基于免疫化学的酶联免疫吸附或蛋白质印迹法、紫外分光光度法、以及液相色谱与紫外-可见光吸收二极管阵列等方法,通过定量蛋白质中酪氨酸与硝基酪氨酸来测定蛋白质的平均硝基化程度(nitration degree,ND)[6,21-23]. 然而,这些方法均无法分析单个酪氨酸位点发生硝基化反应的情况. 虽然传统蛋白组学的方法可用于定性分析某些酪氨酸位点是否发生硝基化,但很难精确定量单个酪氨酸位点的硝基化程度[24-26]. 近年来,定向蛋白组学的发展为精确地定量分析过敏原中单个酪氨酸位点的硝化程度提供了技术手段[27]. 该方法可通过将过敏原蛋白质进行酶解后,利用液相色谱-串联质谱联用(LC-MS/MS)技术,测定过敏原酶解产物中各条含有酪氨酸或硝基化酪氨酸的多肽,从而对酪氨酸位点的硝基化程度(nitration degree of tyrosine,NDY)进行定量分析[28-29].
本文选择Ⅰ类和Ⅱ类尘螨过敏原为研究对象,建立基于超高效液相色谱-三重四极杆串联质谱联用技术,同时检测含酪氨酸的酶解多肽及其对应的硝基化多肽的方法,以此准确地定量分析两类尘螨过敏原在硝基化反应中各酪氨酸的NDY,并将该方法应用于经硝化试剂过氧亚硝酸盐(ONOO-)硝基化的尘螨过敏原,探究各过敏原发生硝基化反应的位点选择性.
-
超高效液相色谱-电喷雾电离-三重四极杆串联质谱仪(UPLC/ESI-MS/MS,Xevo TQ-S;Waters,美国);色谱柱Waters BEH C18柱(2.1 mm × 50 mm × 1.7 µm),前端串联保护柱VanGuardTM(C18柱,2.1 mm × 5 mm × 1.7 µm);分析天平(220 g / 0.1 mg,ME204, Mettler Toledo,瑞士);QL-901涡旋振荡器(Waters,美国);高速冷冻离心机(Sorvall Legend Micro 17R, Thermo Fisher Scientific,德国);金属恒温孵育仪(D1200-230V,Labnet,美国);真空离心浓缩仪(RVC 2-18, Christ,德国);超滤离心管(Amicon® Ultra 3K/10K超滤管,Millipore,爱尔兰);无菌注射器(1 mL,华福,浙江);聚四氟乙烯针式过滤器(滤膜)(φ13 mm×0.22 μm,津腾,天津).
Ⅰ类尘螨过敏原Der f 1重组蛋白(Uniprot Accession:P16311,纯度>95%)与Der p 1重组蛋白(Uniprot Accession:P08176,纯度>95%)购自MyBioSource;Ⅱ类尘螨过敏原Der p 2重组蛋白(Uniprot Accession:Q1H8P8,纯度>95%)购自Raybiotech. 尘螨过敏原蛋白的理论胰酶酶解多肽及其相应的硝基化多肽委托吉尔生化(上海)有限公司合成(纯度均≥98%). 过氧亚硝酸盐溶液(peroxynitrite,纯度≥90%)购自上海脉铂医药科技有限公司. 乙腈(LC-MS级)和Tween-20购买自美国Sigma-Aldrich公司. 质谱级胰蛋白酶购自北京生夏蛋白技术有限公司. 二硫苏糖醇(DL-1,4-Dithiothreitol,DTT,≥98%),碘乙酰胺(Iodoacetamide,IAA,纯度≥98%)和甲酸(纯度≥98%)均购买自北京百灵威科技公司.
-
同一组类的粉尘螨和屋尘螨过敏原通常具有较高的序列同源性(80%—85%)和交叉反应性[30]. 比较Ⅱ类尘螨过敏原的结构,可以发现Der f 2和Der p 2的一级结构和二级结构极为相似,全序列均由146个氨基酸构成,蛋白质相对分子质量均约为16 kDa. 至于酪氨酸位点,Der f 2仅有两条胰酶酶解肽GQQYDIK(GK-7)和YTWNVPK(YK-7)含有酪氨酸残基Y103和Y107,而Der p 2除了拥有这两个相同的酪氨酸位点(Y103和Y107)外,主链(氨基酸序列18-146)上还有一个位于胰酶酶解肽ASIDGLEVDVPGIDPNACHYMK(AK-22)上的酪氨酸残基Y92. 因此在定量Ⅱ类尘螨过敏原各酪氨酸位点的硝基化程度时,只需对Der p 2进行分析. 尽管Ⅰ类过敏原Der f 1和Der p 1也有较高的同源性,但未发现完全相同的含酪氨酸位点的酶解肽,因此对于Ⅰ类尘螨过敏原,需要分别对Der f 1和Der p 1进行分析与讨论.
Ⅰ类和Ⅱ类尘螨过敏原蛋白Der f 1、Der p 1以及Der p 2的氨基酸序列见表1. Ⅰ类尘螨过敏原Der f 1和Der p 1的全序列分别由321和320个氨基酸构成,蛋白质相对分子质量均约为36kDa,且主链上(氨基酸序列19-321/320)均含有20个酪氨酸残基. 但是,由于质谱检测范围的有限性、目标多肽需要具备特异性、以及酶解过程中存在难以避免的化学诱导修饰,目前无法检测所有酪氨酸的硝基化程度. 为了尽可能多地监测酪氨酸位点的硝基化状况,本实验计算了所有含酪氨酸的理论胰酶酶解多肽,并利用蛋白数据库(www.uniprot.org/peptidesearch和www.peptideatlas.org)的搜索功能检查其特异性,选择具备特异性并且能被仪器检测(m/z < 2048)的理论酶解肽作为待测过敏原的目标肽段. 最终,12条含有酪氨酸的多肽(氨基酸序列信息见表1)及其对应的14条硝基化多肽被选作目标多肽并委托合成,这些目标多肽包含了Der f 1的7个硝基化位点,Der p 1的3个硝基化位点,以及Der p 2的3个硝基化位点.
-
使用合成的目标多肽标准物质,建立同时测定含3种主要尘螨过敏原13个酪氨酸位点的硝基化和非硝基化的26条目标多肽的超高效液相色谱-电喷雾电离-三重四极杆串联质谱(UPLC/ESI-MS/MS,Xevo TQ-S;Waters,美国)检测方法. 通过自动调谐和参数优化,筛选出各目标多肽的定量以及定性离子对,并对其所对应的锥孔电压、碰撞压力等参数进行优化. 各目标多肽的仪器检测参数见表2. 其它仪器参数包括:离子源为正离子(ESI+)模式;毛细管电压设置为3.5 kV;碰撞气体为氩气;脱溶剂气为氮气,流速为800 L·h−1,温度为350 ℃. 待测溶液的进样量为30 μL. 二元洗脱流动相为含0.1%甲酸的乙腈(A相)和含0.1%甲酸的水(B相),色谱柱的温度为40 ℃,设置流速为0.2 mL·min−1的连续梯度洗脱:0 min:5% A;4 min:25% A;7min:95% A;7.5min:95% A;8min:5% A;8.5 min:5% A.
-
根据REINMUTH-SELZLE等[32]的方法用过氧亚硝酸盐硝化尘螨过敏原蛋白Der f 1,Der p1和Der p 2. 首先,将ONOO-溶液在冰上缓慢解冻,将不同体积浓度为3.42 mmol·L−1的ONOO-溶液分别加入到含有10 μg 的3种过敏原的低蛋白吸附管中(其中Der f 1与Der p 1的浓度为1 mg·mL−1,Der p 2的浓度为0.34 mg·mL−1),配制成ONOO-与各蛋白质中酪氨酸摩尔浓度比值(ONOO-/Y)为0:1、1:1、3:1、5:1、10:1、15:1 和30:1的混合溶液. 3组混合溶液混匀后,在4 ℃条件下反应100 min. 最后通过超滤离心将蛋白质与硝化剂分离从而终止反应,Der f 1与Der p 1使用截留分子量为10 kDa的超滤管,Der p 2使用截留分子量为3 kDa的超滤管,并用50 mmol·L−1 的NH4HCO3缓冲溶液(pH 7.5—8.5)清洗2次,最终使蛋白质反应产物溶于20 μL的NH4HCO3缓冲液.
将同一反应条件下(ONOO-/Y相等)的3种尘螨过敏原反应产物各取10 μL混合之后在低蛋白吸附管中进行酶解. 首先,在混合蛋白溶液中加入40 μL乙腈,20 μL NH4HCO3 缓冲溶液以及10 μL 浓度为100 mmol·L−1的DTT,充分混匀后,60 ℃恒温孵育45 min;随后加入20 μL浓度为100 mmol·L−1的IAA,将还原后的蛋白质烷基化,涡旋混匀后,37 ℃恒温避光孵育45 min;孵育结束后,用280 μL的NH4HCO3缓冲液将乙腈的终浓度稀释至10%(V/V),并加入7.5 μL 浓度为40 ng·μL−1的胰蛋白酶,使蛋白质在酶/底物为1:50(W/W)的条件下进行酶解,37 °C恒温孵育15 h后,加入5 μL 50%的甲酸终止酶解反应. 将酶解后的混合溶液在真空离心浓缩仪中浓缩至近干,最后用 200 μL 5%乙腈复溶并过0.22 μm滤膜除杂,待进行仪器分析. 使用1.2节中建立的UPLC-MS/MS检测方法定量目标多肽,对某酪氨酸而言,通过公式(1)可计算得到该酪氨酸的硝基化程度(NDY).
其中,Ca和Cb分别表示含有某酪氨酸的非硝基化多肽和硝基化多肽的浓度(ng·mL−1);Mra和Mrb表示非硝基化多肽和硝基化多肽的相对分子质量.
-
使用目标多肽的标准物质建立了包含Ⅰ、Ⅱ类尘螨过敏原蛋白Der f 1、Der p 1和Der p 2共13个酪氨酸硝基化位点的26条目标多肽的HPLC-MS/MS检测方法. 图1为该方法条件下100 ng·mL−1目标多肽标准溶液的总离子流出色谱图. 结果显示,该方法能够用于检测Der f 1的7个酪氨酸位点,Der p 1的3个酪氨酸位点,和Der p 2的3个酪氨酸位点的硝基化程度.
为了评价检测方法的可靠性,本文对26种目标多肽的仪器日内偏差、方法精密度以及加标回收率进行了测定,测定结果见表3. 结果显示,在标准多肽浓度为50 ng·mL−1和500 ng·mL−1时,仪器日内偏差≤7.6%(n=5),方法精密度≤15.2%(n=3),相对回收率在64.8%—95.3%之间(n=3),表明该方法使用UPLC-MS/MS定量分析尘螨过敏原的目标多肽,有良好的准确度和精密度,能有效地用于分析尘螨过敏原的硝基化状况.
-
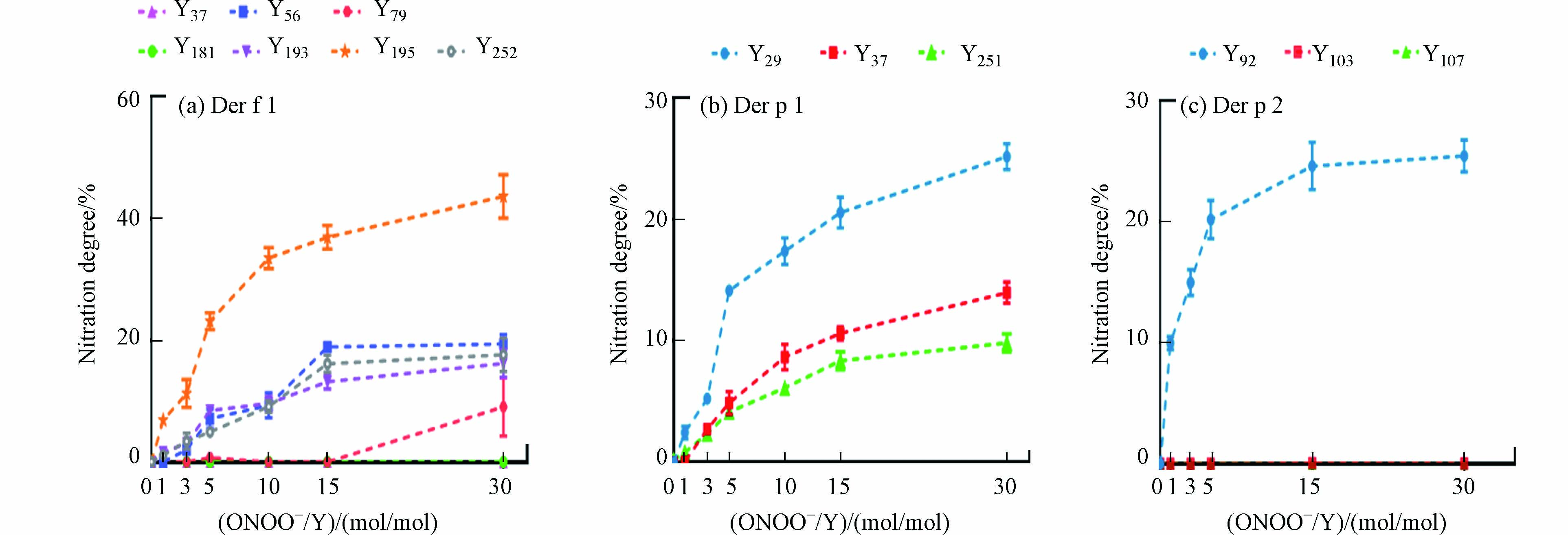
应用建立的检测方法,监测重组尘螨过敏原Der f 1、Der p 1和Der p 2在不同浓度的ONOO-溶液中各酪氨酸的硝基化反应状况,图2总结了各酪氨酸在不同硝化剂浓度下的NDY值. 随着ONOO-/Y物质的量比的增加,各尘螨过敏原的硝基化程度也在增加. 但由于硝基化反应的位点选择性,各酪氨酸有不同的硝基化反应性[8,25,32],因此同一过敏原上的不同酪氨酸在相同ONOO-反应条件下会有不同的NDY,且NDY的增长速率也各不相同. 具体而言,对于Der f 1能检测到的7个酪氨酸位点,Y195的硝基化反应活性最高,在任何ONOO-/Y的物质的量比浓度下均有最大的NDY值. 当ONOO-/Y为30:1时,NDY能达到43.61%. 而酪氨酸Y37、Y79和Y181在ONOO-溶液中几乎不发生硝基化. 其余3个酪氨酸Y56、Y193和Y252在ONOO-溶液中的硝基化程度相似,当ONOO-/Y为30:1时,3种酪氨酸的NDY分别为19.42%、16.19%以及17.61%. 对于Der p 1能检测到的3个酪氨酸硝基化位点Y29、Y37和Y251,随着ONOO-浓度的增加,3个酪氨酸的NDY分别能增加到25.19%、13.97%以及9.82%(ONOO-/Y为30:1). Y29是3个酪氨酸中硝基化反应活性相对较高的酪氨酸硝基化位点. 对于Der p 2的3个酪氨酸,仅Y92在ONOO-溶液中发生了明显的硝基化反应,NDY为0—25.46%.
蛋白质上不同的酪氨酸残基具有不同的硝基化反应性. 蛋白质的初级序列、二级结构以及酪氨酸的溶剂可及性均可影响酪氨酸的反应活性[8]. 在对尘螨过敏原的硝基化研究中,发现3种尘螨过敏原在ONOO-溶液中均发生了位点选择性的硝基化. Y195、Y92和Y29分别是Der f 1、Der p 2和Der p 1硝基化过程中的优势位点. 通过蛋白质结构预测网站(www.predictprotein.org)对3种尘螨过敏原的蛋白质结构进行预测,各酪氨酸的结构信息见表4. Der f 1 的Y195以及Der p 2的Y92均处于溶剂可及的蛋白质暴露表面,并且处于结构较为灵活的环状(Loop)区域,这可能是Y195和Y92能成为硝基化优势位点的主要原因[8,25]. 此外,有研究发现,酪氨酸附近存在带负电荷的氨基酸,如天冬氨酸(D)和谷氨酸(E),也会促进酪氨酸的硝基化[33,34]. 因此,在一级结构紧邻(-1与-2)的两个谷氨酸的促进作用下,Y29成为了Der p 1中硝基化反应活性相对较高的酪氨酸位点.
3种尘螨过敏原在硝基化条件下均发生了位点选择性的硝基化,而一些能/易发生硝基化的酪氨酸已经被证实是这些尘螨过敏原抗原决定簇(细胞表位)的组成部分,例如,酪氨酸Y92、Y103和Y107均是Der p 2的线性表位的组成部分[35,36],而Y92极易发生硝基化,因此Y92可能在硝基化导致Der p 2致敏性变化的过程中发挥着重要作用. 此外,酪氨酸的硝基化可能改变蛋白质结构,导致细胞表位的暴露或新表位的产生,从而引过敏原的致敏性增强[9-11]. 因此尘螨过敏原硝基化所带来的致敏性健康风险不可忽视,而探究位点特异性的硝基化对尘螨过敏原致敏性的影响也将是进一步的研究重点.
-
本文建立了定量尘螨过敏原各酪氨酸硝基化程度的分析方法,该方法可同时检测Ⅰ、Ⅱ类3种尘螨过敏原(Der f 1、Der p 1和Der p 2)共13个酪氨酸位点的硝基化程度,并成功运用于分析3种尘螨过敏原在ONOO-硝基化作用下各酪氨酸的硝基化状况以及各过敏原硝基化的位点选择性. 结果发现,在ONOO-作用下,3种尘螨过敏原均发生了位点特异性的硝基化,其中,Y195、Y29分别是Der f 1和Der p 1硝基化反应性较高的酪氨酸位点,Y92是Der p 2最容易发生硝基化的酪氨酸位点.
尘螨过敏原硝基化的位点选择性分析
Analysis of site-selective nitration in house dust mite allergens
-
摘要: 过敏原的硝基化会引起其致敏潜能的增强,进而带来更大的致敏性健康风险. 过敏原蛋白质通常含有多个酪氨酸硝基化位点,分析过敏原硝基化的位点选择性是探究硝基化对过敏原致敏性影响的重要基础. 本文以尘螨过敏原为研究对象,建立了基于超高效液相色谱-串联质谱(UPLC-MS/MS)同时定量分析3种尘螨过敏原(Der f 1、Der p 1和Der p 2)的13个酪氨酸位点硝基化程度的方法,并应用于分析3种尘螨过敏原在过氧亚硝酸盐硝基化作用下的位点选择性. 结果表明,3种尘螨过敏原均发生了位点特异性的硝基化,Y195、Y37和Y92分别为Der f 1、Der p 1和Der p 2中反应活性最高的硝基化位点. 尘螨过敏原位点选择性的硝基化表明,在评价硝基化尘螨过敏原的致敏性变化时应当考虑其位点特异性的硝基化状况.
-
关键词:
- 尘螨过敏原 /
- 酪氨酸 /
- 硝基化 /
- 位点选择性 /
- 液相色谱-串联质谱.
Abstract: Nitration of allergens can enhance their allergenic potential, consequently contributing to higher allergenic health risks. Allergen proteins usually contain more than one tyrosine which could be nitrated. Analysis of site-selective nitration is critical for exploring the effect of nitration on allergenicity of allergen. In this study, a method was developed for the quantitative analysis of the nitration degrees of total 13 tyrosine sites of three house dust mite (HDM) allergens (Der f 1, Der p 1 and Der p 2) by ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS). The method was then applied to analyze the site-specific nitration of tyrosine in the three HDM allergens under nitration of peroxynitrite (ONOO-). The results showed that HDM allergens were nitrated by ONOO- and the reactions were site-selectivity. Y195, Y37 and Y92 were the most reactive nitration sites of Der f 1, Der p 1 and Der p 2, respectively. The site-selective nitration of HDM allergens indicated that site-specific nitration should be considered and included when assessment of the changes of their allergenicity caused by nitration. -

-
表 1 尘螨过敏原Der f 1、Der p 1和Der p 2的氨基酸序列
Table 1. Amino acid sequences of HDM allergens Der f 1, Der p 1 and Der p 2
蛋白质
Protein氨基酸序列
Amino acid sequences非硝基化的目标多肽
Non-nitrated target peptides粉尘螨Ⅰ类
过敏原
Der f 1MKFVLAIASLLVLSTVY17ARPASIKTFEEFKKAFNKNY37ATVEEEEVARKNFLESLKY56VEANKGAINHLSDLSLDEFKNRY79LMSAEAFEQLKTQFDLNAETSACRINSVNVPSELDLRSLRTVTPIRMQGGCGSCWAFSGVAATESAY146LAY149RNTSLDLSEQELVDCASQHGCHGDTIPRGIEY181IQQNGVVEERSY193PY195VAREQRCRRPNSQHY210GISNY215CQIY219PPDVKQIREALTQTHTAIAVIIGIKDLRAFQHY252DGRTIIQHDNGY264QPNY268HAVNIVGY276GSTQGDDY284WIVRNSWDTTWGDSGY300GY302FQGNNLMMIEQY315PY317VVIM NY37ATVEEEEVAR(NR-12)
Y56VEANK(YK-6)
Y79LMSAEAFEQLK(YK-12)
GIEY181IQQNGVVEER(GR-14)
SY193PY195VAR(SR-7)
AFQHY252DGR(AR-8)屋尘螨Ⅰ类
过敏原
Der p 1MKIVLAIASLLALSAVY17ARPSSIKTFEEY29AKAFNKSY37ATFEDEEAARKNFLESVKY56VQSNGGAINHLSDLSLDEFCNRFLMSAEAFEHLKTQFDLNAETNACSINGNAPAEIDLRQMRTVTPIRMQGGCGSCWAFSGVAATESAY145LAY148RNQSLDLAEQELVDCAQHGCHGDTIPRGIEY180IQHNGVVQESY191Y192RY194SVAREQSCRRPNAQRFGISNY214CQIY218PPNVNKIREALAQTHSAIAVIIGIKDLDAFRHY251DGRTIIQRDNGY263QPNY267HAVNIVGY275SNAQGVDY283WIVRNSWDTNWGDNGY299GY301FAANIDLMMIEEY314PY316VVIL TFEEY29AK(TK-7)
SY37ATFEDEEAAR(SR-12)
HY251DGR(HR-5)屋尘螨Ⅱ类
过敏原
Der p 2MMY3KILCLSLLVAAVARDQVDVKDCANHEIKKV
LVPGCHGSEPCIIHRGKPFQLEAVFEANQNTKTAKIEIKASIDGLEVDVPGIDPNAGHY92MKCPLVKGQQ
Y103DIKY107TWNVPKIAPKSENVVVTVKVMGDDGVLACAIATHAKIRDASIDGLEVDVPGIDPNAGHY92MK(AK-22)
GQQY103DIK(GK-7)
Y107TWNVPK(YK-7)表 2 目标多肽的仪器检测参数
Table 2. Instrumental parameters of targeted peptides in UPLC/ESI-MS/MS
多肽
Peptides硝基酪氨酸
Nitrotyrosine保留时间/min
RT反应离子对(锥孔电压/V,碰撞能量/eV)
Transition (Cone, Collision energy)检测限*/(ng·mL−1)
LODNR-12 4.28 705.4 > 861.4** (64, 25); 705.4 > 1061.6 (64,28) 0.035 NO2-NR-12 Y37 4.83 727.7 > 861.4** (32, 25); 727.7 > 960.5 (32,28) 0.077 YK-6 2.35 362.1 > 461.3** (4, 10); 362.1 > 560.4 (4, 15) 0.002 NO2-YK-6 Y56 3.11 384.5 > 461.2** (4,10); 384.5 > 332.2 (4, 10) 0.003 YK-12 6.10 715.5 > 1154.0** (22, 20); 715.5 > 1022.6 (22, 25) 0.010 NO2-YK-12 Y79 6.21 737.9 > 147.1** (22, 15); 737.9 > 1022.5 (22, 20) 0.021 GR-14 4.81 817.6 > 143.1** (24, 52); 817.6 > 802.7 (24, 25) 0.022 NO2-GR-14 Y181 5.34 839.8 > 433.2** (70, 30); 839.8 > 802.4 (70, 25) 0.015 SR-7 4.09 428.2 > 605.5** (6, 15); 428.2 > 303.3 (6, 10) 0.004 NO2-SR-7(1) Y193 4.36 450.6 > 605.5** (10, 10); 450.6 >508.3 (10, 20) 0.010 NO2-SR-7(2) Y195 4.74 450.6 > 650.3** (10, 10); 450.6 > 553.3 (10, 20) 0.015 NO2-SR-7(3) Y193、Y195 4.76 473.1 > 695.3** (10, 10); 473.1 > 175.1 (10,10) 0.013 AR-8 3.24 497.3 > 647.3** (60, 20); 497.3 > 232.1 (60, 30) 0.011 NO2-AR-8 Y252 3.91 519.8 > 692.3** (60, 20); 519.8 > 820.3 (60, 20) 0.012 TK-7 3.26 472.7 > 696.5** (34, 18); 472.7 > 275.2 (34, 25) 0.025 NO2-TK-7 Y29 3.94 495.0 > 471.4** (14, 15); 495.0 > 147.1 (14, 25) 0.020 SR-12 4.44 695.1 > 819.3** (16, 20); 695.1 > 966.4 (16, 20) 0.010 NO2-SR-12 Y37 5.06 717.6 > 819.3** (70, 25); 717.6 > 268.1 (70, 25) 0.014 HR-5 1.30 324.0 > 232.1** (16, 15); 324.0 >510.2 (16, 15) 0.001 NO2-HR-5 Y252 2.42 346.4 > 232.1** (8, 15); 346.4 > 347.2 (8, 6) 0.007 AK-22 6.10 771.4 > 931.5** (25, 35); 771.4 > 86.0 (25, 30) 0.025 NO2-AK-22 Y92 6.14 786.4 > 976.5** (8, 30); 786.4 > 86.0 (8, 60) 0.025 GK-7 3.57 426.4 > 260.2** (25, 15); 426.4 > 147.1 (25, 20) 0.025 NO2-GK-7 Y103 4.36 448.5 > 260.1** (8, 16); 448.5 > 147.1 (8, 25) 0.020 YK-7 5.01 454.4 > 244.2** (25, 20); 454.4 > 643.5 (25, 15) 0.015 NO2-YK-7 Y107 5.65 476.5 > 244.0** (16, 20); 476.5 > 643.4 (16, 15) 0.006 *由EPA[31]推荐的方法测定. *Determined based on the methods recommended by EPA. 表 3 目标多肽方法学参数
Table 3. Methodology parameters of targeted peptides
多肽
Peptides仪器日内偏差/%
Instrument intraday deviation (RSD)/%方法精密度/%
Method precision (RSD)/%相对回收率(平均值±SD)/%
Relative recovery (Mean±SD)5 ng·mL−1 50 ng·mL−1 5 ng·mL−1 50 ng·mL−1 5 ng·mL−1 50 ng·mL−1 NR-12 5.3 5.1 6.1 3.9 75.1±4.5 78.9±3.1 NO2-NR-12 6.1 3.5 6.1 6.5 77.6±4.7 79.1±5.1 YK-6 0.4 0.6 2.2 4.8 91.4±2.0 91.9±4.4 NO2-YK-6 4.7 2.4 5.3 4.3 95.3±5.0 93.1±4.0 YK-12 1.0 1.3 9.1 12.8 79.0±7.2 79.4±10.1 NO2-YK-12 2.6 3.3 4.9 6.9 78.8±3.9 85.5±5.9 GR-14 1.8 4.9 5.1 1.0 86.4±4.4 81.7±0.8 NO2-GR-14 2.3 3.1 4.7 1.6 85.1±4.0 86.1±1.4 SR-7 2.0 2.8 4.3 3.1 94.1±4.1 85.2±2.6 NO2-SR-7(1) 5.6 1.3 7.1 7.7 81.0±5.7 87.6±6.8 NO2-SR-7(2) 2.0 1.5 4.1 5.2 90.7±3.7 88.0±6.8 NO2-SR-7(3) 1.8 2.8 3.3 5.8 94.4±3.2 90.4±5.3 AR-8 2.0 3.5 3.0 2.4 87.0±2.6 88.5±2.1 NO2-AR-8 2.0 4.1 2.4 3.0 86.9±2.1 87.3±2.6 TK-7 3.1 3.9 5.8 4.2 86.5±5.0 90.2±3.8 NO2-TK-7 3.1 5.2 1.4 3.6 88.3±1.2 89.3±3.2 SR-12 5.7 3.2 14.2 2.8 79.9±11.3 92.2±2.6 NO2-SR-12 7.6 1.2 4.3 3.8 84.4±3.6 90.3±3.4 HR-5 4.4 3.7 3.0 1.5 88.6±2.6 87.5±1.3 NO2-HR-5 1.6 2.8 1.5 9.1 89.1±1.3 85.8±7.8 AK-22 4.3 6.2 14.4 6.6 64.8±9.3 75.6±5.0 NO2-AK-22 2.5 4.9 15.2 9.5 74.5±11.3 79.1±7.5 GK-7 5.4 2.6 14.6 2.8 74.4±10.8 82.0±2.3 NO2-GK-7 2.7 2.8 4.1 2.4 83.7±3.5 94.1±2.3 YK-7 3.7 1.4 9.0 4.3 78.3±7.1 88.8±3.8 NO2- YK-7 4.0 1.9 5.1 3.0 85.8±4.3 89.3±2.7 表 4 Der f 1、Der p 1和Der p 2的酪氨酸的结构预测
Table 4. Predicted structure of tyrosines in Der f 1, Der p 1 and Der p 2
蛋白质
Protein酪氨酸
Tyrosine酶解肽的氨基酸序列
Amino acid sequence of tryptic peptide二级结构
Secondary structure溶剂可及性
Solvent AccessibilityDer f 1 Y37 NYATVEEEEVAR Loop Buried Y56 YVEANK Helix Exposed Y79 YLMSAEAFEQLK Helix Buried Y181 GIEYIQQNGVVEER Helix Buried Y193 SYPYVAR Loop Buried Y195 SYPYVAR Loop Exposed Y252 AFQHYDGR Strand Buried Der p 1 Y29 TFEEYKK Helix Helix Y37 SYATFEDEEAAR Loop Buried Y251 HYDGR Strand Buried Der p 2 Y92 ASIDGLEVDVPGIDPNACHYVK Loop Exposed Y103 GQQYDIK Strand Buried Y107 YTWNVPK Strand Exposed 注:加粗字母“Y”代表酪氨酸,倾斜的字体代表带负电荷的氨基酸:天冬氨酸(D)和谷氨酸(E).
Note: The bold character is the tyrosine residue and the slanted characters are the negatively charged amino acids (aspartate D and glutamate E). -
[1] WEINBERG E G. The WAO white book on allergy 2011-2012 [J]. Current Allergy & Clinical Immunology, 2011, 24(3): 156-161. [2] PAWANKAR R. Allergic diseases and asthma: A global public health concern and a call to action [J]. The World Allergy Organization Journal, 2014, 7(1): 12. [3] SVARTENGREN M, STRAND V, BYLIN G, et al. Short-term exposure to air pollution in a road tunnel enhances the asthmatic response to allergen [J]. European Respiratory Journal, 2000, 15(4): 716-724. doi: 10.1034/j.1399-3003.2000.15d15.x [4] RING J, EBERLEIN-KOENIG B, BEHRENDT H. Environmental pollution and allergy[J]. Annals of Allergy, Asthma & Immunology, 2001, 87(6 Suppl 3): 2-6. [5] BRUNEKREEF B, SUNYER J. Asthma, rhinitis and air pollution: Is traffic to blame? [J]. European Respiratory Journal, 2003, 21(6): 913-915. doi: 10.1183/09031936.03.00014903 [6] FRANZE T, WELLER M G, NIESSNER R, et al. Protein nitration by polluted air [J]. Environmental Science & Technology, 2005, 39(6): 1673-1678. [7] SELZLE K, ACKAERT C, KAMPF C J, et al. Determination of nitration degrees for the birch pollen allergen Bet v 1 [J]. Analytical and Bioanalytical Chemistry, 2013, 405(27): 8945-8949. doi: 10.1007/s00216-013-7324-0 [8] ABELLO N, KERSTJENS H A M, POSTMA D S, et al. Protein tyrosine nitration: Selectivity, physicochemical and biological consequences, denitration, and proteomics methods for the identification of tyrosine-nitrated proteins [J]. Journal of Proteome Research, 2009, 8(7): 3222-3238. doi: 10.1021/pr900039c [9] OHMORI H, KANAYAMA N. Immunogenicity of an inflammation-associated product, tyrosine nitrated self-proteins [J]. Autoimmunity Reviews, 2005, 4(4): 224-229. doi: 10.1016/j.autrev.2004.11.011 [10] HARDY L L, WICK D A, WEBB J R. Conversion of tyrosine to the inflammation-associated analog 3'-nitrotyrosine at either TCR- or MHC-contact positions can profoundly affect recognition of the MHC class I-restricted epitope of lymphocytic choriomeningitis virus glycoprotein 33 by CD8 T cells [J]. Journal of Immunology, 2008, 180(9): 5956-5962. doi: 10.4049/jimmunol.180.9.5956 [11] GRUIJTHUIJSEN Y K, GRIESHUBER I, STÖCKLINGER A, et al. Nitration enhances the allergenic potential of proteins [J]. International Archives of Allergy and Immunology, 2006, 141(3): 265-275. doi: 10.1159/000095296 [12] KARLE A C, OOSTINGH G J, MUTSCHLECHNER S, et al. Nitration of the pollen allergen Bet v 1.0101 enhances the presentation of bet v 1-derived peptides by HLA-DR on human dendritic cells [J]. PLoS One, 2012, 7(2): e31483. doi: 10.1371/journal.pone.0031483 [13] MARKS G B. House dust mite exposure as a risk factor for asthma: Benefits of avoidance [J]. Allergy, 2008, 53: 108-114. [14] TUPKER R A, de MONCHY J G R, COENRAADS P J, et al. Induction of atopic dermatitis by inhalation of house dust mite [J]. Journal of Allergy and Clinical Immunology, 1996, 97(5): 1064-1070. doi: 10.1016/S0091-6749(96)70259-2 [15] BOULET L P, TURCOTTE H, LAPRISE C, et al. Comparative degree and type of sensitization to common indoor and outdoor allergens in subjects with allergic rhinitis and/or asthma [J]. Clinical & Experimental Allergy, 1997, 27(1): 52-59. [16] CARABALLO L, VALENTA R, PUERTA L, et al. The allergenic activity and clinical impact of individual IgE-antibody binding molecules from indoor allergen sources [J]. World Allergy Organization Journal, 2020, 13(5): 100118. doi: 10.1016/j.waojou.2020.100118 [17] PITTNER G, VRTALA S, THOMAS W R, et al. Component-resolved diagnosis of house-dust mite allergy with purified natural and recombinant mite allergens [J]. Clinical & Experimental Allergy, 2004, 34(4): 597-603. [18] RESCH Y, MICHEL S, KABESCH M, et al. Different IgE recognition of mite allergen components in asthmatic and nonasthmatic children [J]. Journal of Allergy and Clinical Immunology, 2015, 136(4): 1083-1091. doi: 10.1016/j.jaci.2015.03.024 [19] CHAPMAN M, PLATTS-MILLS T. Purification and characterization of the major allergen from Dermatophagoides pteronyssinus-antigen P1 [J]. Journal of Immunology, 1980, 125(2): 587-592. [20] 徐帆, 杨方星. 尘螨过敏原蛋白及其硝化产物的鉴别 [J]. 环境化学, 2021, 40(7): 1969-1977. doi: 10.7524/j.issn.0254-6108.2020030202 XU F, YANG F X. Identification of house dust mite allergens and their nitrated products [J]. Environmental Chemistry, 2021, 40(7): 1969-1977(in Chinese). doi: 10.7524/j.issn.0254-6108.2020030202
[21] GREENACRE S A B, ISCHIROPOULOS H. Tyrosine nitration: Localisation, quantification, consequences for protein function and signal transduction [J]. Free Radical Research, 2001, 34(6): 541-581. doi: 10.1080/10715760100300471 [22] GHIANI A, BRUSCHI M, CITTERIO S, et al. Nitration of pollen aeroallergens by nitrate ion in conditions simulating the liquid water phase of atmospheric particles [J]. Science of the Total Environment, 2016, 573: 1589-1597. doi: 10.1016/j.scitotenv.2016.09.041 [23] YANG H, ZHANG Y Y, PÖSCHL U. Quantification of nitrotyrosine in nitrated proteins [J]. Analytical and Bioanalytical Chemistry, 2010, 397(2): 879-886. doi: 10.1007/s00216-010-3557-3 [24] WALCHER W, FRANZE T, WELLER M G, et al. Liquid- and gas-phase nitration of bovine serum albumin studied by LC-MS and LC-MS/MS using monolithic columns [J]. Journal of Proteome Research, 2003, 2(5): 534-542. doi: 10.1021/pr034034s [25] ZHANG Y Y, YANG H, PÖSCHL U. Analysis of nitrated proteins and tryptic peptides by HPLC-chip-MS/MS: Site-specific quantification, nitration degree, and reactivity of tyrosine residues [J]. Analytical and Bioanalytical Chemistry, 2011, 399(1): 459-471. doi: 10.1007/s00216-010-4280-9 [26] WILLARD B B, RUSE C I, KEIGHTLEY J A, et al. Site-specific quantitation of protein nitration using liquid chromatography/tandem mass spectrometry [J]. Analytical Chemistry, 2003, 75(10): 2370-2376. doi: 10.1021/ac034033j [27] MARX V. Targeted proteomics [J]. Nature Methods, 2013, 10(1): 19-22. doi: 10.1038/nmeth.2285 [28] PICOTTI P, AEBERSOLD R. Selected reaction monitoring-based proteomics: Workflows, potential, pitfalls and future directions [J]. Nature Methods, 2012, 9(6): 555-566. doi: 10.1038/nmeth.2015 [29] 刘永福, 贾小芳, 腾珍林, 等. 液质联用多反应监测法定量目标多肽或蛋白质 [J]. 中国生物化学与分子生物学报, 2012, 28(1): 86-92. doi: 10.13865/j.cnki.cjbmb.2012.01.014 LIU Y F, JIA X F, TENG Z L, et al. Quantification of target peptides or proteins by liquid chromatography-mass spectrometry with multiple reaction monitoring [J]. Chinese Journal of Biochemistry and Molecular Biology, 2012, 28(1): 86-92(in Chinese). doi: 10.13865/j.cnki.cjbmb.2012.01.014
[30] YASUEDA H, MITA H, YUI Y, et al. Comparative analysis of physicochemical and immunochemical properties of the two major allergens from Dermatophagoides pteronyssinus and the corresponding allergens from Dermatophagoides farinae [J]. International Archives of Allergy and Applied Immunology, 1989, 88(4): 402-407. doi: 10.1159/000234724 [31] USEPA. Revised assessment of detection and quantification approaches[R]. EPA-821-B-04-005, 2004. [32] REINMUTH-SELZLE K, ACKAERT C, KAMPF C J, et al. Nitration of the birch pollen allergen Bet v 1.0101: Efficiency and site-selectivity of liquid and gaseous nitrating agents [J]. Journal of Proteome Research, 2014, 13(3): 1570-1577. doi: 10.1021/pr401078h [33] SOUZA J M, DAIKHIN E, YUDKOFF M, et al. Factors determining the selectivity of protein tyrosine nitration [J]. Archives of Biochemistry and Biophysics, 1999, 371(2): 169-178. doi: 10.1006/abbi.1999.1480 [34] ISCHIROPOULOS H. Biological selectivity and functional aspects of protein tyrosine nitration [J]. Biochemical and Biophysical Research Communications, 2003, 305(3): 776-783. doi: 10.1016/S0006-291X(03)00814-3 [35] CRACK L R, CHAN H W, MCPHERSON T, et al. Identification of an immunodominant region of the major house dust mite allergen Der p 2 presented by common human leucocyte antigen alleles [J]. Clinical and Experimental Dermatology, 2012, 37(3): 266-276. doi: 10.1111/j.1365-2230.2011.04227.x [36] VERHOEF A, HIGGINS J A, THORPE C J, et al. Clonal analysis of the atopic immune response to the group 2 allergen of Dermatophagoides spp. : Identification of HLA-DR and-DQ restricted T cell epitopes [J]. International Immunology, 1993, 5(12): 1589-1597. doi: 10.1093/intimm/5.12.1589 -




 下载:
下载: