-
漆酶(Laccase, EC 1. 10. 3. 2)是一类含铜多酚氧化酶, 它的起源可追溯到19世纪, 从漆树的汁液中提取分离出来[1]. 漆酶广泛分布于植物、真菌和昆虫中, 如茶树、白腐真菌、灰色链霉菌等[2-4]. 根据它的来源, 植物漆酶和真菌漆酶是主要的两大漆酶类群. 漆酶具有高效的催化氧化功能, 可通过酶促反应氧化耦合环境体系中有机化合物, 它也被视为值得研发的一项生态环保污染修复技术[5]. 然而, 植物漆酶提取工艺的复杂性限制了它的实际应用, 而从真菌中成功提取纯化的漆酶已多达上百种, 并且多数真菌漆酶已经投入到工业化生产和商业化应用中[6-7] .
由于游离漆酶应用的经济成本以及操作不稳定性, 固定化技术为真菌漆酶在环境污染修复的运用开拓了道路. 已有相关研究报道了多种固定化载体的应用潜力, 如纳米氧化物、金属有机骨架材料、多糖物质等[8-10] . 作为优良的吸附剂或催化剂, 活性炭、生物炭、碳纳米管、石墨烯、富勒烯等炭基材料在环境和能源领域的应用吸引了广泛关注[11-12]. 它们均为高度芳香化的富炭材料, 却因其孔隙特征、表面基团、或电子密度差异呈现结构的异质性, 在吸附或催化有机化合物行为上承担着互有不同的作用[13-14]. 以污染物去除角度来看,炭基材料固定化真菌漆酶的复合体以降解环境体系的污染物为主, 且具有明显的去除效果. 此方向研究要求更多的工作进一步挖掘. 本文针对多种炭基材料固定化真菌漆酶的性能以及固定化复合材料催化氧化环境有机物的效果进行了系统归纳和讨论, 旨为拓展真菌漆酶在环境有机污染治理中可循环应用的视野.
-
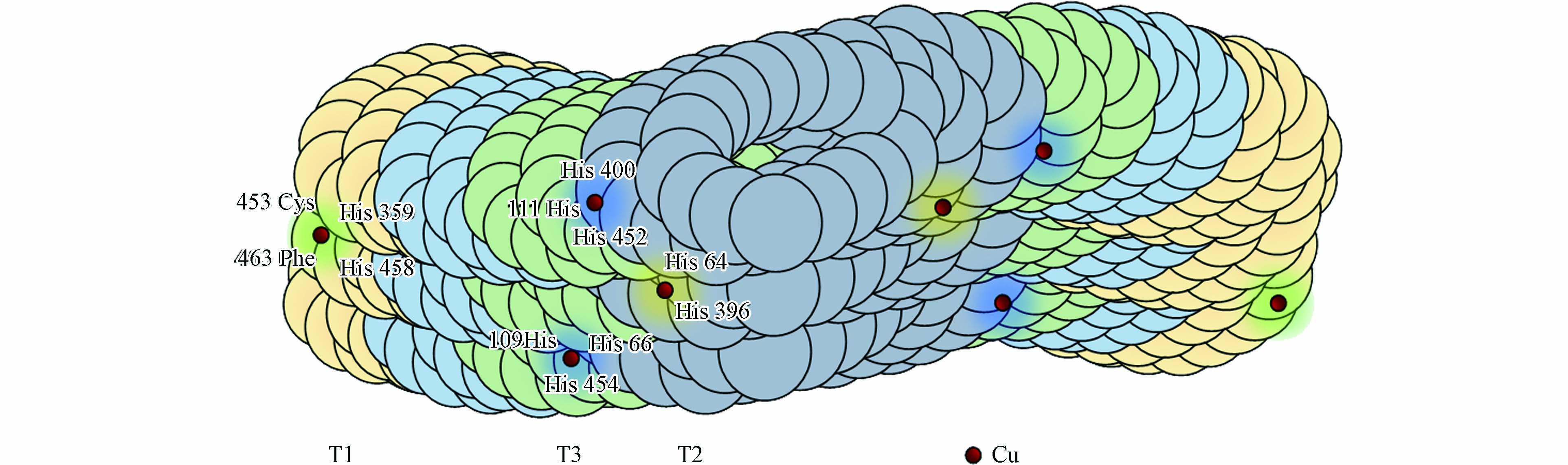
真菌漆酶为高度糖基化的单亚基蛋白, 其分子量可达60—90 kDa, 大约包含500—550个氨基酸. 氨基酸缩合的肽链缠绕着活性铜(Cu)原子形成螯合物, 如图1所示.
真菌漆酶结构中常含有4个Cu原子与其氨基酸结构的特定位置相结合, 没有其他辅助因子[15]. 在酶促反应过程中, Cu原子构成了真菌漆酶催化氧化的关键位点, 它们起着电子转移的作用. 根据电磁学特征, 可划分为3类: I型Cu2+(T1 Cu)和 II型Cu2+(T2 Cu)均含有一个Cu原子, 为单电子受体, 呈现顺磁性. III型Cu24+(T3 Cu)含有两个铜原子, 且两个铜原子为反磁性的双电子受体, 依靠羟基进行相连. T1 Cu参与分子内的电子传递, 把电子从污染物传递到其他铜原子上. T2 Cu 和T3 Cu共同构成了一个三核铜簇中心, 该三核铜簇中心能够接收T1 Cu传递的电子, 并将其分配给水中溶解的分子氧, 还原转化为水, 其反应机制如下所示:
本质上, 漆酶的催化氧化能力是利用它与化合物的氧化还原电势差将污染物氧化[16-17] . 显然, 真菌漆酶的三核铜簇中心区域也可将电子转移至氧化还原电势低的介质(如没食子酸、2, 2-联氮-二-3-乙基苯并噻唑啉-6-磺酸 (ABTS)), 间接形成特定的自由基或中间体, 进而催化氧化水体污染物[18].
-
真菌漆酶的催化氧化性能被广泛应用于制浆造纸、纺织印染、食品加工、环境修复等多个领域[19-21]. 例如, 真菌漆酶可以协同木聚糖酶可对废弃报纸进行脱墨处理[22]. Couto 等[23]从Trametes hirsute 中提取的粗酶对于4种偶氮染料均有超过50%的脱色效果. Wang 等[24]通过真菌漆酶澄清苹果汁中所含酚类物质, 发现苹果汁的酚类化合物降低了16. 3%, 透光率提高了20. 2%, 有利避免苹果汁长期储存的变质问题. 真菌漆酶在环境污染修复领域的应用也被视为是一种高效、绿色的技术手段. 它可有效降解酚类、羧酸类、芳胺类、以及雌激素等有机污染物. 例如, Chairin 等[25]从Trametes polyzona WR710-1中提取了粗制漆酶, 在1-羟基苯并三唑 (HBT)介体存在的条件下, 发现3 h真菌漆酶可完全去除100 mg·L−1的水体中双酚A. Liu 等[26]利用真菌漆酶对雌二醇(17β-estradiol)进行降解, 发现2 h内10 μmol·L−1的17β-estradiol的去除率可高达99. 24%. Sun 等[27]通过金属离子和天然有机质介导真菌漆酶催化氧化偶联反应过程, 可完全降解水体中的三氯生, 能有效降低三氯生的毒性. 然而, 游离态真菌漆酶的应用也存在局限性. 第一, 稳定性较弱. 漆酶活性易受体系的温度、酸碱度、溶剂成分等因素影响. 通常, 真菌漆酶在适宜的温度区间(30—60 °C)内反应活性相对较高. 若超出最适温度区间, 则漆酶的活性会显著降低[28]. 第二, 重复利用率低. 游离的漆酶是水溶性物质, 通常难以从废水溶液中回收并加以循环利用, 这造成了资源的巨大浪费. 第三, 生产成本高. 现有的真菌漆酶的提纯工艺技术仍难以降低漆酶生产成本, 这是限制真菌漆酶大规模生产应用的主要障碍之一[29]. 因此, 为提高真菌漆酶的循环利用效率, 漆酶固定化技术越来越受到关注, 比如, 利用支撑材料吸附漆酶、或通过共价结合增强负载漆酶效果、或将漆酶包埋在膜或凝胶内等. 固定化漆酶是克服游离漆酶难回收的有效途径, 也是在温度、pH、贮存、以及操作等方面提高漆酶稳定性的有利方法.
-
固定化漆酶在修复技术领域有着巨大潜在应用价值, 特别是针对难处理的环境污染物. 真菌漆酶的固定化方法主要是通过物理或化学方法使水溶性酶与稳定的固态载体相结合, 为了提高酶在连续使用时的稳定性和防止酶活性的丧失[30-31]. 炭基材料如活性炭、生物炭、纳米碳管、石墨等, 因其高度芳香化的炭质结构, 被视为稳定的、机械支撑性能优异的固定化载体[32]. 炭基材料与漆酶分子的相互作用属于弱力作用, 例如范德华力、疏水性作用、离子架桥作用、氢键效应等. 它们不会改变真菌漆酶的原始构型而导致漆酶失活. 炭基材料通常具有多层级孔隙结构或丰富的表面官能团, 为真菌漆酶的固载也提供了重要的位点支撑[33]. 例如,Ramire-Motoya等[34]利用三氯化铁溶液浸渍山核桃壳 于800 °C 在CO2氛围下,裂解制备活性炭. 按1:1000固液比将活性炭分散于漆酶溶液中, 离心分离后获得固定化漆酶, 此漆酶固载率可达63%. 这是由于活性炭丰富介孔结构有利于漆酶的固定. 介孔度越高, 漆酶的负载率越高. Dong等[35]以多层石墨烯为载体制备了石墨烯-漆酶的复合材料, 这种四层石墨烯结构, 因其高比表面积和非共价π-π堆叠作用, 对于漆酶的负载可达211. 1 mg·g−1. 载体表面的酶特异性基团越多, 载体与漆酶的亲和力越高, 从而漆酶在炭基材料表面的负载越多. 松木、猪粪和杏仁壳裂解的生物炭已经被证明是固定粗漆酶的优良吸附材料[36]. 为了能够使生物炭基体高效固载真菌漆酶, 也可通过基团修饰方法引入活性基团如环氧基、羟基、羧基等, 来增加载体表面的结合位点, 促进漆酶的固定化效果(表1). Imam等[37]酸化水稻秸秆裂解的生物炭来丰富炭基表面极性官能团, 发现漆酶的固载效率高达66%. 而且, 经6次循环试验后生物炭对漆酶的固持仍可保留了40%. 而且, 固定化漆酶的储存稳定性和化学耐受能力也可能有所提升. 相较于游离漆酶, 柠檬酸改性猪粪生物炭固定的漆酶, 具有较高的酶活性和贮存能力. 酶性能的提升可能是由于漆酶分子被固相载体多孔结构所保护, 避免了漆酶蛋白的构象变化[38]. 综上, 炭基材料因其物理强度高、表面积大、孔隙率高、表面官能团丰富、热稳定性优良等优点, 为真菌漆酶固定化载体材料提供了一条选择路径. 将炭基材料用于漆酶的固定化载体是一种可探究的途径来实现漆酶的循环利用.
-
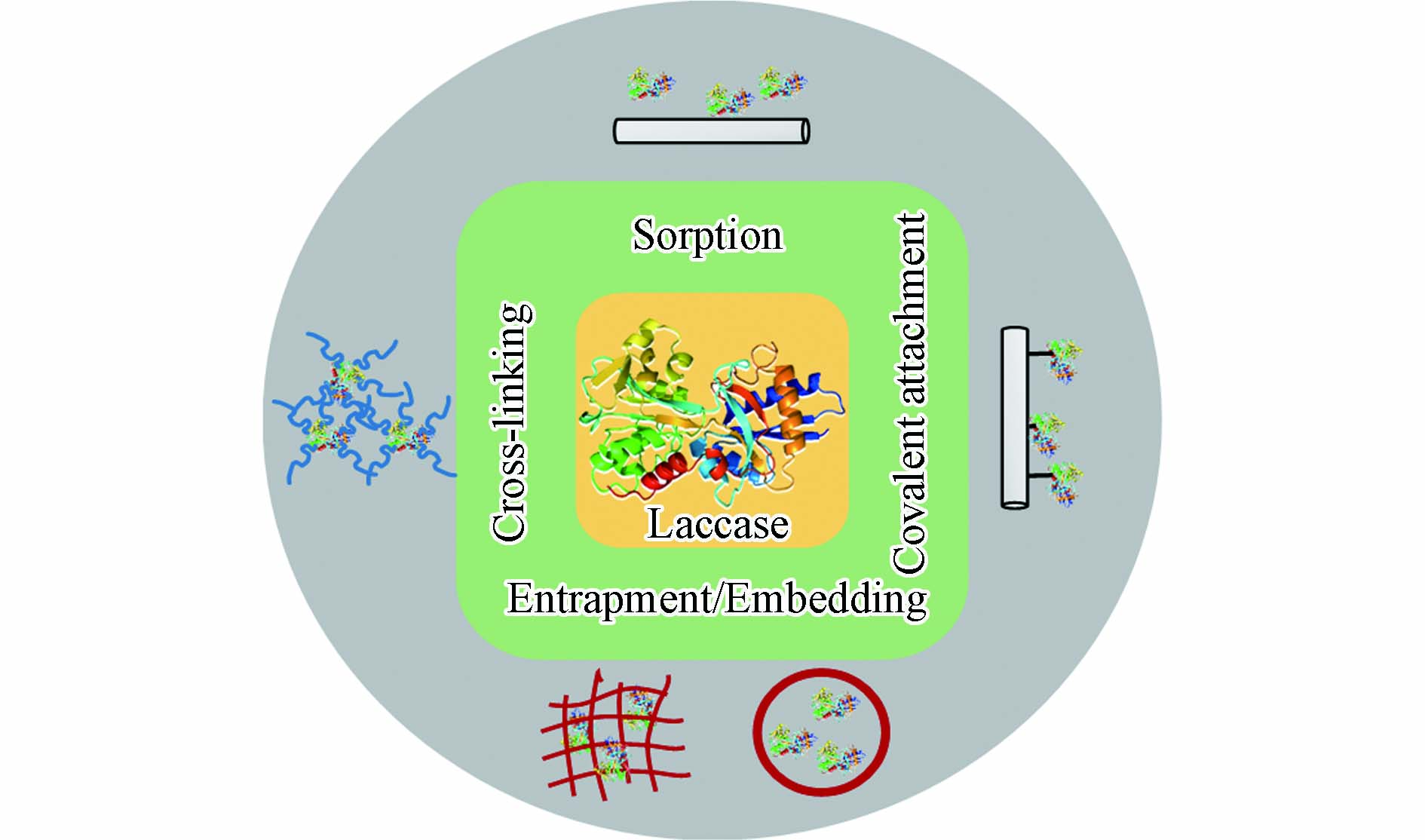
固定化技术是在保持真菌漆酶功能条件下, 通过物理或化学方法使溶液中游离态漆酶固载于不溶性载体上. 一旦真菌漆酶附着或包埋于载体基质后, 游离态漆酶便转化为固定化漆酶. 它有助于漆酶的回收, 并可循环重复使用, 进而降低了操作成本[37-48]. 如图2所示, 炭基材料固定真菌漆酶的方法可以分为物理固定和化学固定.
-
物理方法涉及非特异性相互作用来固定真菌漆酶, 例如, 吸附法、包埋法. 通过范德华力、疏水性作用或氢键等弱力作用将酶吸附于固态载体表面[49-51] . 物理吸附法被广泛应用于酶生物传感器的开发中. 它相对操作简单, 吸附前载体不需要官能化, 载体本身对于酶的固定也没有选择性. 因此, 吸附过程导致真菌漆酶非均一地固定于载体上. 炭基载体吸附真菌漆酶后, 酶结构不会发生明显改变, 活性中心不易被破坏. Lonappan 等[52]利用不同源生物炭吸附漆酶, 于猪粪生物炭、杏仁壳生物炭、松木生物炭上负载量分别为31. 4、24. 3、14. 58 U·g−1. Skoronski等[53], 通过大比表面的石墨烯纳米片层吸附漆酶, 并发现漆酶负载量可达179 mg·g−1. 然而, 由于漆酶吸附于载体的作用力较弱, 循环利用过程中漆酶也易于再次脱落, 漆酶的负载率会不断降低. 包埋或镶嵌法是将漆酶物理包裹或镶嵌于在微囊或高聚物网格内. 由于酶蛋白分子相对较大, 漆酶易于被限制在微囊或网格的空间内, 且漆酶的分子结构也不会发生改变[5,54]. 而分子量较小的污染物则可以畅通进入微囊或网格空间内, 当污染物分子接近该空间时, 被固定化的漆酶将参与污染物的催化氧化过程[55]. Shao等[41]通过空心介孔炭纳米球固定了游离的漆酶, 发现漆酶的固定化效果极为稳定, 且对于抗生素类污染物具有良好的去除效果.
-
化学固定包括共价结合、交联法等, 可以有效提高固定化漆酶的负载率, 增强炭基载体与真菌漆酶之间的结合作用. 相较于物理方法, 化学固定使得固定化漆酶具有更好稳定性, 耐酸碱性, 从而更好地实现固定化漆酶在实际应用中重复利用[56-57]. 共价固定法主要是通过共价键结合的形式, 促使漆酶蛋白的官能团与载体上的活性基团以共价键结合, 避免漆酶蛋白结构的断裂, 促进真菌漆酶更为有效地附着到载体上. 通常, 真菌漆酶结构中半胱氨酸、赖氨酸、天冬氨酸和谷氨酸的侧链可与载体上的醚基、羧基、酰胺键形成共价键[58]. 共价键的连接增强了真菌漆酶在固体载体上负载, 在循环利用过程中真菌漆酶不易发生脱落, 提高了固定化酶的操作稳定性[59]. Xu等[42]利用多壁纳米碳管以共价结合的方式负载漆酶, 获得了具有高稳定性的固定化漆酶. 交联法是使用交联剂促使漆酶分子发生交联反应, 诱导蛋白结构彼此连接, 从而增加漆酶分子负载在固体载体上的效果. 常见的交联试剂有戊二醛、己二胺、顺丁烯二酸酐、双偶氮苯等. 但是, 由于交联剂也会参与漆酶蛋白的结合, 这会导致漆酶本身构象结构或活性中心发生改变, 可能会降低漆酶分子的催化活性[60]. 在许多研究中, 共价结合与交联法被协同运用来增强炭基材料固载漆酶的效果. 例如, Lonappan等[36]以戊二醛作为交联剂连接漆酶蛋白, 并通过酸化过程丰富生物炭界面含氧官能团(如羧基官能团), 以共价结合的方式利用官能化生物炭对交联的漆酶蛋白进行有效固载. 即使在pH =10. 5条件下, 生物炭固定化漆酶的活性也可达到61%.
-
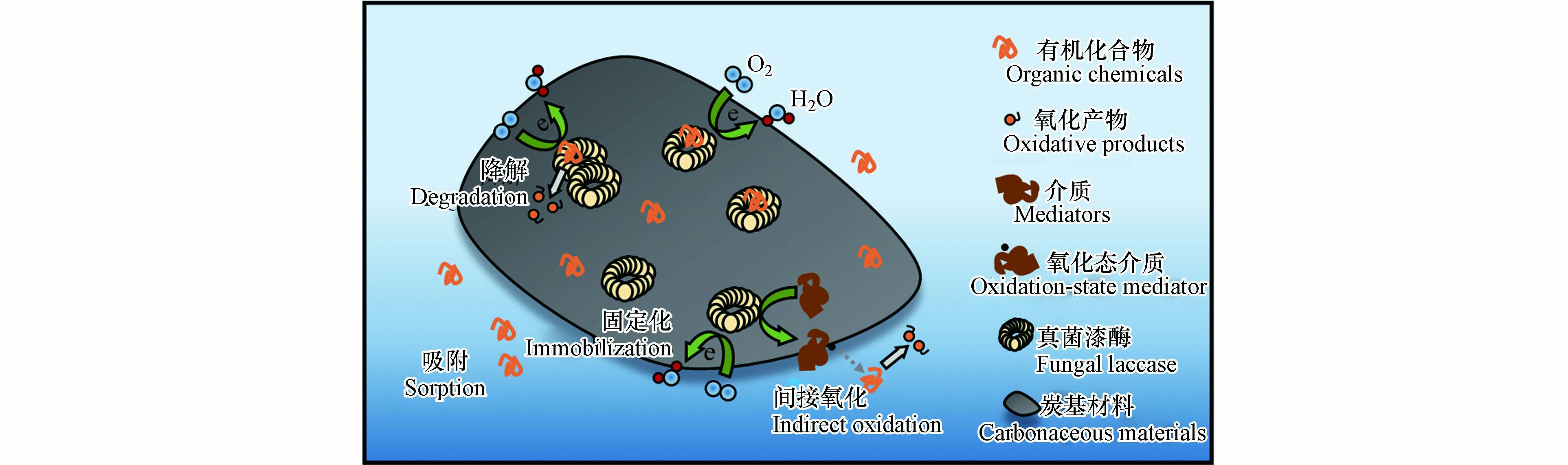
已有大量研究表明, 炭基材料在控制水体有机化合物运移方面具有重要作用. 它们对有机污染物的吸附过程涉及多重吸附机制. 例如, 非特异性的范德华力(色散力, 诱导力, 取向力)被认为普遍存在于炭基材料与有机化合物之间. 通常, 范德华力的能量相对较低, 约在0. 4—4 kJ·mol-1[61]. 由于有机化合物的自身疏水性, 这导致液相溶质化合物易于疏水性分配到固相炭基材料表面. Peng等[62]研究了两种抗生素药物(氧氟沙星和诺氟沙星)在碳纳米管(CNTs)上的吸附行为, 评价它们的结构和疏水性对吸附过程的重要作用. 研究发现, 单点吸附系数(Kd)与高疏水性有显著正相关关系, 而与结构含氧量无显著关系. 这结果表明, 位点特异性吸附没有起到主要作用, 而疏水效应可能是CNTs吸附氧氟沙星和诺氟沙星的重要机制. Dong等[35]以石墨烯为基体, 经过非共价π-π堆叠自组装过程固定化漆酶, 形成石墨烯-漆酶复合材料. 合成的复合材料具有优良的吸附性能和催化活性, 能有效地去除β-受体阻滞剂拉贝洛尔(Labetalol). 漆酶的催化中心的暴露增强了有机化合物的转化过程. 磷酸催化交联机制有助于制备活性炭的活化能降低, 且使活性炭的微孔大量生成. 分子型化合物双酚A 和卡马西平在磷酸改性活性炭的吸附均有数量级增长, 这主要归因于活性炭的微孔填充作用[63]. 固定化漆酶复合结构的炭基材料依然保持着其独特的结构优势, 它有利于富集水相里有机物. Shao等[41]利用空心的碳纳米小球将漆酶封锁于球体内部, 固定的漆酶呈现出优良的循环效率和稳定性能. 为了解碳纳米小球自身在吸附过程中所起的作用, 他们对漆酶固定化炭球进行灭活, 并利用灭活后的复合材料去除四环素和环丙沙星, 去除率分别可达55%和77%. 两种抗生素在炭球上的高效截留可能是由于碳纳米小球的构象结构所致. Ramírez-Montoya等[34]采用介孔炭基支撑漆酶, 该固定化漆酶炭基材料能有效对酸橙7染料溶液进行脱色处理. 研究者发现, 炭基载体除了作为漆酶的固定支撑外, 其本身也通过物理吸附移除有机化合物.
-
固定化漆酶结构中T1 Cu同样承担分解污染物夺取电子的功能, 其氧化还原电势高低直接影响着固定化漆酶的催化氧化能力(图3). Sun等[64]设计了一种海藻酸钙交联捕获漆酶的流化床反应器, 并发现固定化漆酶对雌激素的持续清除能力具有优异潜力. 然而, 他们发现相对较低或较高pH下, 交联捕获的漆酶分子的催化氧化能力减弱, 这主要是由于阻断了雌激素在T1 Cu位点的单电子氧化或阻碍了T1 Cu 和T2/T3 Cu 位点之间的分子内电子转移. Nguyen等[65]采用活性炭固定化漆酶材料催化降解一系列小分子污染物 (如磺胺甲恶唑、卡马西平、双氯酚酸和双酚A). 与等浓度游离漆酶相比, 发现固定化漆酶对污染物的去除率均有所提高, 同时也指出漆酶与污染物之间电子转移受阻可能会限制漆酶氧化效率. 活性炭固定漆酶后, 吸附于炭基的污染物与漆酶分子之间的电子转移增强, 有助于污染物降解转化效率的提升. 曾涵等[66]以聚芳酰胺与碳纳米管为载体, 固定化云芝漆酶后, 将其对玻璃电极进行修饰, 可实现漆酶与电极间的直接电子转移. 这表明炭基材料协助漆酶传递电子的作用. 另一方面, 真菌漆酶本身可能不能有效氧化一些聚合度高的有机化合物, 但可在漆酶作用下形成高氧化还原电势的中间介质或具有强反应活性的自由基参与到污染物的降解过程中. 固定化漆酶以溶解氧作为电子受体间接催化氧化酚类或非酚类化合物, 不仅可以形成小分子产物, 也可以通过聚合形成大分子聚合物, 这极大地拓宽了可反应的目标污染物范围[67]. 例如, 真菌漆酶反应体系中引入介质ABTS, ABTS可被漆酶氧化形成稳定的ABTS+自由基, 可以提高漆酶的底物特异性. Dong等[35]探讨了ABTS 对于石墨烯-漆酶复合材料去除拉贝他洛尔效率的影响. 由于漆酶不能直接作用于拉贝洛尔, 因此将介质ABTS转化为高氧化性能的ABTS+ 自由基有助于拉贝洛尔的降解转化. 研究发现, ABTS+自由基可将拉贝洛尔氧化为过渡态中间体, 随即过渡态中间体在N-Cβ键处断裂, 进而生成两个构象不稳定的中间体. 其中, 一个中间体可与H+反应形成分子量149的最终产物, 而另一个携有一个未配对电子的中间体的酰胺基可能发生水解反应, 形成分子量182的最终产物.
-
近年来, 频繁在湖泊、河流等水体中检测出酚类、雌激素、药物等环境污染物. 它们可在水体生物体内富集, 并影响生物内分泌系统和人类健康. 许多研究已经报道, 固定化漆酶在氧化分解酚类化合物和雌激素污染方面的功效. Wang等[36]利用溴化十六烷基三甲基铵和氢氧化钾溶液改性秸秆生物炭, 并以其固定化漆酶, 利用该复合材料对于2, 4-二氯苯酚的去除效果. 研究者发现, 60 min内生物炭吸附2, 4-二氯苯酚的效率仅为42. 5%, 而固定化漆酶对2, 4-二氯苯酚的去除率接近100%. Lonappan等[47]利用杏仁壳、猪粪和松木制备生物炭进行漆酶固定化, 研究了二氯苯酚在3种固定化漆酶炭材料上的氧化降解过程. 研究发现, 5 h内3种固定化漆酶炭材料对二氯苯酚的去除均可达到100%. Liu等[68]利用磁性介孔炭固定化漆酶对苯酚和对氯苯酚进行去除. 相较于磁性介孔炭, 固定化漆酶对两种酚类污染物的去除率分别提高了58%和64%. Zhang等[40]以丝瓜海绵基磁性碳纳米材料为载体固定漆酶, 去除水中雌激素双酚A. 该团队发现与游离漆酶相比, 100 mg·g−1的双酚A 经固定化漆酶反应4 h后, 目标污染物几乎被完全移除, 脱除效率提高了37. 28%. 工业生产带来的药物、染料类废水的不合理排放也造成了日益突出的环境污染问题, 导致生态环境破坏和生物安全危害. Masjoudi等[44]利用了碳纳米管复合漆酶对水体中卡马西平和双氯芬酸氧化降解. 由于卡马西平含有酰胺(-CONR2)吸电子基团, 它削弱了固定化漆酶结构中T1 Cu捕获电子的能力, 其降解效率约为27%. 然而, 碳纳米管-漆酶复合材料对于双氯酚酸的去除则高达95%. 杨奇等[28]研究了碳纳米管固定化漆酶脱除水中刚果红染料效果. 研究发现, 漆酶固定化前后, 碳纳米管对刚果红染料的最大去除量由363. 4 mg·g−1增加到769. 23 mg·g−1. Habimana等[45]利用交联聚合方法对包覆二氧化硅的磁性碳纳米管进行漆酶的固定化, 并对几种偶氮染料(酸性红88、铬黑T和活性黑5)进行脱色处理. 酸性红88、铬黑T、活性黑5经固定化漆酶氧化分解, 去除率分别可达99%、98%、66%.
-
固定化漆酶的目的在于重复循环利用, 这是工业和环境应用的必要需求. 炭基材料固定真菌漆酶的技术极大程度上避免了游离漆酶在应用上的资源浪费. 例如, 据Habimana等[45]研究报道, 固定化漆酶的稳定性能得到大幅度提高, 通过ABTS的10 次氧化, 其余量酶活仍可保留87% (生物催化剂的运行稳定性得到了提高, 循环10次后仍能保持原有活性的87%. Dong等[35]发现在完全脱除拉贝洛尔物质条件下, 石墨烯-漆酶复合材料可重复使用10次以上, 完美实现了固定化漆酶的循环利用. 通过刚果红染料脱色研究, Samak 等[39]发现螯合了Cu2+的磁性氧化石墨烯所固载的漆酶, 经过5次反复使用, 对于刚果红的脱色率仍高于95%, 10次循环后, 固定化漆酶的降解效率才下降至89. 4%. 据Zhang 等[40]报道, 以丝瓜络制备的磁性活性炭所固载的漆酶, 展现出良好的循环性能. 循环5次测试, 固定化漆酶活性仍可高达92. 51%, 而水中超过80%的双酚A可通过固定化漆酶被净化. Thiyagarajan 等[69]利用Prosopis juliflora 树皮制备的活性碳纳米管用于固定化漆酶, 研究了固定化漆酶的稳定性、循环性以及对于品红染料的吸附性能. 循环性试验中, 6次循环试验后游离漆酶的活性下降到仅20%, 而固定化漆酶的活性仍然保持在80%以上. Li等[70]利用枫树生物炭作为固定化材料, 通过物理吸附固定化漆酶, 并利用ABTS测试了该种固定化漆酶循环性能, 他们发现7次循环试验后, 固定化漆酶的酶活损失了66. 2%. Ramírez-Montoya等[34]利用核桃与坚果壳制备的活性炭对漆酶进行固定, 并利用酸性橙7测试固定化漆酶循环性能. 研究发现, 4次循环试验后, 该种固定化漆酶对酸性橙7的去除率保持在60%. 此外, 相较于其他类型固定化载体, 炭基材料也呈现出优越的机械支撑性能. 同作为固定化载体, 乳酸-甘醇酸共聚体和多壁碳纳米管均可固定化漆酶, 且均能有效降解水体中双氯芬酸. 但是, 乳酸-甘醇酸共聚体固定化漆酶5次循环后双氯芬酸转化效率低于60%, 而多壁碳纳米管固定化漆酶7次循环利用后却仍可保持62.7 %的双氯芬酸去除效率[42,71].
-
综上所述, 炭基材料固定化真菌漆酶是一种具有潜力的绿色环保技术. 该方法可以提高游离漆酶反应活性和贮存稳定性, 降低游离漆酶在水处理应用中产生的成本. 本文结合国内外前沿的科学研究, 系统概述了真菌漆酶结构和性质、炭基材料固定漆酶的方法、以及污染物和固定化漆酶的反应机制和循环效率, 为固定化漆酶技术在绿色化学应用研究提供了新的视角. 目前, 关于炭基材料固定化漆酶技术仍可从以下几方面着手进一步研究:
(1)结合改性修饰等方法, 突破炭基材料固定化漆酶技术, 进一步增强真菌漆酶负载量、贮存稳定性、催化氧化性能、以及循环利用效率等.
(2) 重点关注实际工程应用的局限, 拓宽炭基材料固定化漆酶在环境有机污染治理方面的前景价值.
炭基材料固定化真菌漆酶在污水处理领域的应用
Application of immobilized fungal laccase on carbonaceous materials for wastewater treatment
-
摘要: 漆酶是一种多功能含铜氧化还原酶,被广泛研究或应用于多个学科领域. 然而,实际应用中,漆酶因成本昂贵、易流失,稳定性不足等缺陷,限制了其工业化应用和商业化价值. 炭基材料固定化真菌漆酶技术提供了一种值得探索的途径,来改善真菌漆酶的贮存稳定性、催化氧化活性、以及重复使用的性能. 本文详细介绍了真菌漆酶的来源、结构和性质;系统归纳了生物炭、活性炭、碳纳米管、石墨烯等炭基材料固定化真菌漆酶的物理-化学方法(物理吸附、诱捕包埋、共价结合、交联聚合);概述了酚类、雌激素、染料、药物等环境有机污染物在炭基固定化真菌漆酶复合材料上的去除效果和循环性能,并深入讨论了化合物在炭质界面的吸附机制(如疏水性作用、π-π作用、孔隙填充等)和固定化真菌漆酶利用氧化还原电势差催化氧化有机物的反应机制. 本文旨在为真菌漆酶固定化载体材料的选择提供参考依据,也将为开拓固定化真菌漆酶应用于有机污染治理的视野提供技术支撑.Abstract: Laccase is one of multi-copper containing oxidoreductases, which has been widely studied or applied in multiple subject fields. However, the industrial application and commercial value of laccase is limited in practical production due to expensive cost, difficult recycling, insufficient stability. The immobilization of fungal laccase by carbonaceous materials provides an approach to explore to improve the storage stability, catalytic oxidation activity, and reusability. This work described the origin, structure and properties of fungal laccase, and systematically concluded the physico-chemical methods including physical adsorption, trapping and embedding, covalent binding, crosslinking. Meanwhile, a series of carbonaceous materials such as biochar, activated carbon, carbon nanotubes, graphene was summarized to immobilize the fungal laccase. The removal of organic contaminants (phenols, estrogen, dyes, and drugs) and recycling performance of immobilized laccase were outlined and its reactive mechanisms including sorption and catalytic oxidation were deeply discussed between immobilized laccase and environmental contaminants. This article aims at providing an insight to select the carrier materials to the immobilization of fungal laccase, and also providing a technical support for expanding the application scope of immobilized laccase in organic pollution control.
-
Key words:
- carbonaceous material /
- fungal laccase /
- immobilization methods /
- sorption and degradation /
- reusability
-

-
表 1 不同种类的炭基材料固定化漆酶以及其对污染物的去除效率和循环利用率
Table 1. Immobilization of laccase by different types of carbonaceous materials and the efficiency of removal and recycling of organic pollutants
漆酶来源
Source of
laccase炭基材料
Carbonaceous
materials炭基原料
Feedstock
漆酶固定方法Laccase immobilization methods 固定量
Immobilized
amount目标污染物
Pollutants去除效率
Removal efficiency循环活性/去除率
Cycle activity参考文献
ReferencesTrametes versicolor 石墨烯 石墨烯 物理吸附
(非共价自组装)221. 1 mg·g−1 拉贝洛尔(Labetalol) 100%(初始浓度: 5 µmol·L−1) 10次循环 100%(污染物去除) [35] Bacillus Subtilis 负载Cu2+磁性
氧化石墨烯石墨烯 物理吸附 177 mg·g−1 刚果红(Congo red) 100%(初始浓度: 1 mg·L−1) 10次循环 89. 4%(污染物去除) [39] Trametes versicolor 活性炭 核桃坚果壳 物理吸附 17. 6 mg·g−1 酸性橙7(Acid Orange 7) 100%(初始浓度: 30 mg·L−1) 4次循环 60%(污染物去除) [34] Bacillus Subtilis 磁性活性炭 丝瓜海绵 物理吸附 82. 57 mg·g−1 双酚A(Bisphenol A) 100%(初始浓度: 100 mg·L−1) 5次循环 79. 76%(污染物去除) [40] Trametes versicolor 磁性介孔炭 SBA-15 物理吸附 491. 7 mg·g−1 苯酚(phenol, PHE)
对氯苯酚
(р-chlorophenol, PNP)PNE: 78%
PNP: 84%
(初始浓度: 2 mmol·L−1)— [24] Trametes versicolor 空心介孔炭球 四丙氧基硅烷 物理吸附 835 mg·g−1 盐酸四环素(Tetracycline hydrochloride, TCH)
盐酸环丙沙星(Ciprofloxacin hydrochloride, CPH)TCH: 高于55%
CPH: 接近80%
(初始浓度: 20 mg·L−1)4次循环 70%(酶活) [41] Trametes versicolor 复合纳米纤维膜 多壁碳纳米管 共价结合 907 mg·g−1 双氯芬酸(diclofenac) 100%(初始浓度: 12. 5 mg·L−1) 7次循环 62. 7%(污染物去除) [42] Aspergillus oryzae 功能化多壁碳纳米管 多壁碳纳米管 交联聚合 8620 U·g−1 4-甲氧基苯酚(4-methoxyphenol) 100%(初始浓度: 10 mg·L−1) 3次循环 40%(污染物去除) [43] Trametes hirsuta 纳米复合膜 羟基化多壁碳纳米管 共价结合 30. 40 mg·cm−2 卡马西平
(Carbamazepine, CBA)
双氯芬酸(diclofenac, DCF)CBZ: 27%
DCF: 95%
(初始浓度: 5 mg·L−1)5次循环 22%(酶活) [44] — 介孔二氧化硅负载
磁性多壁碳纳米管多壁碳纳米管 交联聚合 — 铬黑T(Eriochrome Black T, EBT)
酸性红88(Acid Red 88, AR 88)
活性黑5(Reactive Black 5, RB 5)EBT: 99%
AR88: 98%
RB5: 66%
(初始浓度: 40 mg·L−1)10次循环 87%(酶活) [45] Trametes versicolor 纳米生物炭 松木 共价结合 5 U·g−1 — — 4次循环 30%(酶活) [46] Trametes versicolor 生物炭(BC) 松木(PW)
猪粪(PM)
杏仁壳(AS)交联聚合 BC-PW: 20. 1 U·g−1
BC-PM: 40. 2 U·g−1
BC-AS: 31. 8 U·g−1双氯芬酸
(Diclofenac)BC-PW: 100%
BC-PM: 100%
BC-AS: 100%
(初始浓度: 0. 5 mg·L−1)BC-PW5次循环46%
BC-PM5次循环40%
BC-AS5次循环43%
(污染物去除)[36] Trametes maxima 功能化生物炭 水稻秸秆 交联聚合 92. 3%
(25 mg, 50 U·mL−1)蒽(Anthracene) 98%(初始浓度: 50 mg·L−1) 3次循环 高于90%(酶活) [37] — 改性生物炭 秸秆 交联聚合 — 2, 4-二氯芬酸(2, 4-diclofenac) 95. 5%(初始浓度: 200 mg·L−1) 6次循环 27. 8%(酶活) [47] 注: “—”的表格代表参考文献中对该内容并未提及. -
[1] YOSHIDA H. LXIII. —chemistry of lacquer (urushi). part I. communication from the chemical society of tokio [J]. J Chem Soc, Trans, 1883, 43: 472-486. doi: 10.1039/CT8834300472 [2] FAURE D, BOUILLANT M, BALLY R. Comparative study of substrates and inhibitors of Azospirillum lipoferum and Pyricularia oryzae laccases [J]. Applied and Environmental Microbiology, 1995, 61(3): 1144-1146. doi: 10.1128/aem.61.3.1144-1146.1995 [3] DWIVEDI U N, SINGH P, PANDEY V P, et al. Structure-function relationship among bacterial, fungal and plant laccases [J]. Journal of Molecular Catalysis B:Enzymatic, 2011, 68(2): 117-128. doi: 10.1016/j.molcatb.2010.11.002 [4] ENDO K, HOSONO K, BEPPU T, et al. A novel extracytoplasmic phenol oxidase of Streptomyces: Its possible involvement in the onset of morphogenesis[J]. Microbiology (Reading, England), 2002, 148(Pt 6): 1767-1776. [5] DARONCH N A, KELBERT M, PEREIRA C S, et al. Elucidating the choice for a precise matrix for laccase immobilization: A review [J]. Chemical Engineering Journal, 2020, 397: 125506. doi: 10.1016/j.cej.2020.125506 [6] LEONOWICZ A, CHO N, LUTEREK J, et al. Fungal laccase: Properties and activity on lignin [J]. Journal of Basic Microbiology, 2001, 41(3/4): 185-227. [7] ZUCCA P, COCCO G, SOLLAI F, et al. Fungal laccases as tools for biodegradation of industrial dyes [J]. Biocatalysis, 2016, 1(1): 82-108. [8] 王苗苗. 介孔二氧化硅磁性复合微球的制备及漆酶固定化[D]. 北京: 北京工业大学, 2012. WANG M M. Mesoporous silica magnetic composite microspheres: Preparation and laccase immobilization[D]. Beijing: Beijing University of Technology, 2012(in Chinese).
[9] 谢柏盛, 贾红华, 谢迎春, 等. 金属框架结构材料MOF-199对漆酶的固定化及其性质 [J]. 生物加工过程, 2011, 9(5): 6-10. doi: 10.3969/j.issn.1672-3678.2011.05.02 XIE B S, JIA H H, XIE Y C, et al. Immobilized laccase and its properties by metal organic framework MOF-199 [J]. Chinese Journal of Bioprocess Engineering, 2011, 9(5): 6-10(in Chinese). doi: 10.3969/j.issn.1672-3678.2011.05.02
[10] 彭凌洁. 壳聚糖基水滑石复合材料合成及漆酶固定化研究[D]. 青岛: 青岛科技大学, 2018. PENG L J. Synthesis of chitosan/layered double hydroxides composite material and immobilization of laccase[D]. Qingdao: Qingdao University of Science & Technology, 2018(in Chinese).
[11] LIU W J, JIANG H, YU H Q. Emerging applications of biochar-based materials for energy storage and conversion [J]. Energy & Environmental Science, 2019, 12(6): 1751-1779. [12] LEE S J, THEERTHAGIRI J, NITHYADHARSENI P, et al. Heteroatom-doped graphene-based materials for sustainable energy applications: A review [J]. Renewable and Sustainable Energy Reviews, 2021, 143: 110849. doi: 10.1016/j.rser.2021.110849 [13] YIN Z F, CUI C J, CHEN H, et al. The application of carbon nanotube/graphene-based nanomaterials in wastewater treatment [J]. Small, 2020, 16(15): 1902301. doi: 10.1002/smll.201902301 [14] JIANG L H, LIU Y G, LIU S B, et al. Adsorption of estrogen contaminants by graphene nanomaterials under natural organic matter preloading: Comparison to carbon nanotube, biochar, and activated carbon [J]. Environmental Science & Technology, 2017, 51(11): 6352-6359. [15] JONES S M, SOLOMON E I. Electron transfer and reaction mechanism of laccases [J]. Cellular and Molecular Life Sciences:CMLS, 2015, 72(5): 869-883. doi: 10.1007/s00018-014-1826-6 [16] CLAUS H. Laccases: structure, reactions, distribution [J]. Micron, 2004, 35(1/2): 93-96. [17] ARESKOGH D, LI J B, NOUSIAINEN P, et al. Oxidative polymerisation of models for phenolic lignin end-groups by laccase [J]. Holzforschung, 2010, 64(1): 21-34. [18] GAVRILAS S, DUMITRU F, STANESCU M D. Commercial laccase oxidation of phenolic compounds [J]. UPB Scientific Bulletin, Series B: Chemistry and Materials Science, 2012, 74: 3-10. [19] FENG Y P, COLOSI L M, GAO S X, et al. Transformation and removal of tetrabromobisphenol A from water in the presence of natural organic matter via laccase-catalyzed reactions: Reaction rates, products, and pathways [J]. Environmental Science & Technology, 2013, 47(2): 1001-1008. [20] 季立才, 胡培植. 漆酶的结构、功能及其应用 [J]. 氨基酸和生物资源, 1996, 18(1): 25-29. doi: 10.14188/j.ajsh.1996.01.010 I L C, HU P Z. Structure, fucntion and application of laccase [J]. Amino Acids & Biotic Resources, 1996, 18(1): 25-29(in Chinese). doi: 10.14188/j.ajsh.1996.01.010
[21] 初华丽, 梁宗琦. 漆酶的潜在应用价值 [J]. 山地农业生物学报, 2004, 23(6): 529-533. doi: 10.15958/j.cnki.sdnyswxb.2004.06.015 CHU H L, LIANG Z Q. New potential application of laccase [J]. Journal of Mountain Agriculture and Biology, 2004, 23(6): 529-533(in Chinese). doi: 10.15958/j.cnki.sdnyswxb.2004.06.015
[22] VIRK A P, PURI M, GUPTA V, et al. Combined enzymatic and physical deinking methodology for efficient eco-friendly recycling of old newsprint [J]. PLoS One, 2013, 8(8): e72346. doi: 10.1371/journal.pone.0072346 [23] COUTO S R. Decolouration of industrial azo dyes by crude laccase from Trametes hirsuta [J]. Journal of Hazardous Materials, 2007, 148(3): 768-770. doi: 10.1016/j.jhazmat.2007.06.123 [24] WANG F, OWUSU-FORDJOUR M, XU L, et al. Immobilization of laccase on magnetic Chelator nanoparticles for apple juice clarification in magnetically stabilized fluidized bed [J]. Frontiers in Bioengineering and Biotechnology, 2020, 8: 589. doi: 10.3389/fbioe.2020.00589 [25] CHAIRIN T, NITHERANONT T, WATANABE A, et al. Biodegradation of bisphenol A and decolorization of synthetic dyes by laccase from white-rot fungus, Trametes polyzona [J]. Applied Biochemistry and Biotechnology, 2013, 169(2): 539-545. doi: 10.1007/s12010-012-9990-3 [26] LIU Q Z, LIU J, HONG D, et al. Fungal laccase-triggered 17β-estradiol humification kinetics and mechanisms in the presence of humic precursors [J]. Journal of Hazardous Materials, 2021, 412: 125197. doi: 10.1016/j.jhazmat.2021.125197 [27] SUN K, KANG F X, WAIGI M G, et al. Laccase-mediated transformation of triclosan in aqueous solution with metal cations and humic acid [J]. Environmental Pollution, 2017, 220: 105-111. doi: 10.1016/j.envpol.2016.09.028 [28] 杨奇. 碳纳米管固定化漆酶吸附降解水中刚果红染料的研究[D]. 广州: 广东工业大学, 2019. YANG Q. Study on the adsorption of Congo red dye in water by carbon nanotubes immobilized laccase[D]. Guangzhou: Guangdong University of Technology, 2019(in Chinese).
[29] KHATAMI S H, VAKILI O, MOVAHEDPOUR A, et al. Laccase: Various types and applications [J]. Biotechnology and Applied Biochemistry, 2022: 1-15. [30] HOMAEI A A, SARIRI R, VIANELLO F, et al. Enzyme immobilization: An update [J]. Journal of Chemical Biology, 2013, 6(4): 185-205. doi: 10.1007/s12154-013-0102-9 [31] GOMES-RUFFI C R, da CUNHA R H, ALMEIDA E L, et al. Effect of the emulsifier sodium stearoyl lactylate and of the enzyme maltogenic amylase on the quality of pan bread during storage [J]. LWT, 2012, 49(1): 96-101. doi: 10.1016/j.lwt.2012.04.014 [32] NJOKU V O, FOO K Y, ASIF M, et al. Preparation of activated carbons from rambutan (Nephelium lappaceum) peel by microwave-induced KOH activation for acid yellow 17 dye adsorption [J]. Chemical Engineering Journal, 2014, 250: 198-204. doi: 10.1016/j.cej.2014.03.115 [33] FANG G D, LIU C, WANG Y J, et al. Photogeneration of reactive oxygen species from biochar suspension for diethyl phthalate degradation [J]. Applied Catalysis B:Environmental, 2017, 214: 34-45. doi: 10.1016/j.apcatb.2017.05.036 [34] RAMÍREZ-MONTOYA L A, HERNÁNDEZ-MONTOYA V, MONTES-MORÁN M A, et al. Correlation between mesopore volume of carbon supports and the immobilization of laccase from Trametes versicolor for the decolorization of Acid Orange 7 [J]. Journal of Environmental Management, 2015, 162: 206-214. [35] DONG S P, JING X P, CAO Y, et al. Non-covalent assembled laccase-graphene composite: Property, stability and performance in beta-blocker removal [J]. Environmental Pollution, 2019, 252: 907-916. doi: 10.1016/j.envpol.2019.05.053 [36] LONAPPAN L, LIU Y X, ROUISSI T, et al. Covalent immobilization of laccase on citric acid functionalized micro-biochars derived from different feedstock and removal of diclofenac [J]. Chemical Engineering Journal, 2018, 351: 985-994. doi: 10.1016/j.cej.2018.06.157 [37] IMAM A, SUMAN S K, SINGH R, et al. Application of laccase immobilized rice straw biochar for anthracene degradation [J]. Environmental Pollution, 2021, 268: 115827. doi: 10.1016/j.envpol.2020.115827 [38] KAUR N, BHARDWAJ P, SINGH G, et al. Applicative insights on nascent role of biochar production, tailoring and immobilization in enzyme industry-A review [J]. Process Biochemistry, 2021, 107: 153-163. doi: 10.1016/j.procbio.2021.05.017 [39] SAMAK N A, TAN Y Q, SUI K Y, et al. CotA laccase immobilized on functionalized magnetic graphene oxide nano-sheets for efficient biocatalysis [J]. Molecular Catalysis, 2018, 445: 269-278. doi: 10.1016/j.mcat.2017.12.004 [40] ZHANG C Y, YOU S P, LIU Y D, et al. Construction of Luffa sponge-based magnetic carbon nanocarriers for laccase immobilization and its application in the removal of bisphenol A [J]. Bioresource Technology, 2020, 305: 123085. doi: 10.1016/j.biortech.2020.123085 [41] SHAO B B, LIU Z F, ZENG G M, et al. Immobilization of laccase on hollow mesoporous carbon nanospheres: Noteworthy immobilization, excellent stability and efficacious for antibiotic contaminants removal [J]. Journal of Hazardous Materials, 2019, 362: 318-326. doi: 10.1016/j.jhazmat.2018.08.069 [42] XU R, TANG R Z, ZHOU Q J, et al. Enhancement of catalytic activity of immobilized laccase for diclofenac biodegradation by carbon nanotubes [J]. Chemical Engineering Journal, 2015, 262: 88-95. doi: 10.1016/j.cej.2014.09.072 [43] COSTA J B, LIMA M J, SAMPAIO M J, et al. Enhanced biocatalytic sustainability of laccase by immobilization on functionalized carbon nanotubes/polysulfone membranes [J]. Chemical Engineering Journal, 2019, 355: 974-985. doi: 10.1016/j.cej.2018.08.178 [44] MASJOUDI M, GOLGOLI M, GHOBADI NEJAD Z, et al. Pharmaceuticals removal by immobilized laccase on polyvinylidene fluoride nanocomposite with multi-walled carbon nanotubes [J]. Chemosphere, 2021, 263: 128043. doi: 10.1016/j.chemosphere.2020.128043 [45] HABIMANA P, GAO J, MWIZERWA J P, et al. Improvement of laccase activity via covalent immobilization over mesoporous silica coated magnetic multiwalled carbon nanotubes for the discoloration of synthetic dyes [J]. ACS Omega, 2021, 6(4): 2777-2789. doi: 10.1021/acsomega.0c05081 [46] NAGHDI M, TAHERAN M, BRAR S K, et al. Pinewood nanobiochar: A unique carrier for the immobilization of crude laccase by covalent bonding [J]. International Journal of Biological Macromolecules, 2018, 115: 563-571. doi: 10.1016/j.ijbiomac.2018.04.105 [47] WANG Z, REN D, WU J, et al. Study on adsorption-degradation of 2, 4-dichlorophenol by modified biochar immobilized laccase [J]. International Journal of Environmental Science and Technology, 2022, 19(3): 1393-1406. doi: 10.1007/s13762-021-03151-2 [48] NAGHDI M, TAHERAN M, BRAR S K, et al. Immobilized laccase on oxygen functionalized nanobiochars through mineral acids treatment for removal of carbamazepine [J]. Science of the Total Environment, 2017, 584/585: 393-401. doi: 10.1016/j.scitotenv.2017.01.021 [49] GENNARI A, FÜHR A J, VOLPATO G, et al. Magnetic cellulose: Versatile support for enzyme immobilization - A review [J]. Carbohydrate Polymers, 2020, 246: 116646. doi: 10.1016/j.carbpol.2020.116646 [50] QIU H J, XU C X, HUANG X R, et al. Immobilization of laccase on nanoporous gold: Comparative studies on the immobilization strategies and the particle size effects [J]. The Journal of Physical Chemistry C, 2009, 113(6): 2521-2525. doi: 10.1021/jp8090304 [51] LIN J H, LIU Y J, CHEN S, et al. Reversible immobilization of laccase onto metal-ion-chelated magnetic microspheres for bisphenol A removal [J]. International Journal of Biological Macromolecules, 2016, 84: 189-199. doi: 10.1016/j.ijbiomac.2015.12.013 [52] LONAPPAN L, LIU Y X, ROUISSI T, et al. Adsorptive immobilization of agro-industrially produced crude laccase on various micro-biochars and degradation of diclofenac [J]. Science of the Total Environment, 2018, 640/641: 1251-1258. doi: 10.1016/j.scitotenv.2018.06.005 [53] SKORONSKI E, SOUZA D H, ELY C, et al. Immobilization of laccase from Aspergillus oryzae on graphene nanosheets [J]. International Journal of Biological Macromolecules, 2017, 99: 121-127. doi: 10.1016/j.ijbiomac.2017.02.076 [54] ASGHER M, NOREEN S, BILAL M. Enhancement of catalytic, reusability, and long-term stability features of Trametes versicolor IBL-04 laccase immobilized on different polymers [J]. International Journal of Biological Macromolecules, 2017, 95: 54-62. doi: 10.1016/j.ijbiomac.2016.11.012 [55] le T T, MURUGESAN K, LEE C S, et al. Degradation of synthetic pollutants in real wastewater using laccase encapsulated in core-shell magnetic copper alginate beads [J]. Bioresource Technology, 2016, 216: 203-210. doi: 10.1016/j.biortech.2016.05.077 [56] QIU X, WANG Y, XUE Y, et al. Laccase immobilized on magnetic nanoparticles modified by amino-functionalized ionic liquid via dialdehyde starch for phenolic compounds biodegradation [J]. Chemical Engineering Journal, 2020, 391: 123564. doi: 10.1016/j.cej.2019.123564 [57] RAHMANI H, LAKZIAN A, KARIMI A, et al. Efficient removal of 2, 4-dinitrophenol from synthetic wastewater and contaminated soil samples using free and immobilized laccases [J]. Journal of Environmental Management, 2020, 256: 109740. doi: 10.1016/j.jenvman.2019.109740 [58] FERNÁNDEZ-FERNÁNDEZ M, SANROMÁN M Á, MOLDES D. Recent developments and applications of immobilized laccase [J]. Biotechnology Advances, 2013, 31(8): 1808-1825. doi: 10.1016/j.biotechadv.2012.02.013 [59] MOHAMAD N R, MARZUKI N H C, BUANG N A, et al. An overview of technologies for immobilization of enzymes and surface analysis techniques for immobilized enzymes [J]. Biotechnology & Biotechnological Equipment, 2015, 29(2): 205-220. [60] YANG J J, MA X X, ZHANG Z S, et al. Lipase immobilized by modification-coupled and adsorption-cross-linking methods: A comparative study [J]. Biotechnology Advances, 2010, 28(5): 644-650. doi: 10.1016/j.biotechadv.2010.05.014 [61] KAH M, SIGMUND G, XIAO F, et al. Sorption of ionizable and ionic organic compounds to biochar, activated carbon and other carbonaceous materials [J]. Water Research, 2017, 124: 673-692. doi: 10.1016/j.watres.2017.07.070 [62] PENG H B, PAN B, WU M, et al. Adsorption of ofloxacin and norfloxacin on carbon nanotubes: Hydrophobicity- and structure-controlled process [J]. Journal of Hazardous Materials, 2012, 233/234: 89-96. doi: 10.1016/j.jhazmat.2012.06.058 [63] CHU G, ZHAO J, HUANG Y, et al. Phosphoric acid pretreatment enhances the specific surface areas of biochars by generation of micropores [J]. Environmental Pollution, 2018, 240: 1-9. doi: 10.1016/j.envpol.2018.04.003 [64] SUN K, HONG D, LIU J, et al. Trametes versicolor laccase-assisted oxidative coupling of estrogens: Conversion kinetics, linking mechanisms, and practical applications in water purification [J]. Science of the Total Environment, 2021, 782: 146917. doi: 10.1016/j.scitotenv.2021.146917 [65] NGUYEN L N, HAI F I, DOSSETO A, et al. Continuous adsorption and biotransformation of micropollutants by granular activated carbon-bound laccase in a packed-bed enzyme reactor [J]. Bioresource Technology, 2016, 210: 108-116. doi: 10.1016/j.biortech.2016.01.014 [66] 曾涵, 龚兰新. 高分子聚合物-多壁碳纳米管复合物固定漆酶及其在玻碳电极上的直接电子转移 [J]. 应用化学, 2012, 29(6): 682-690. ZENG H, GONG L X. Immobilization of laccase on multiwall carbon nanotubes-polymers composites and their direct electron transfer on glassy carbon electrode [J]. Chinese Journal of Applied Chemistry, 2012, 29(6): 682-690(in Chinese).
[67] 陈明雨, 倪烜, 司友斌, 等. 固定化真菌漆酶在环境有机污染修复中的应用研究进展 [J]. 生物技术通报, 2021, 37(6): 244-258. CHEN M Y, NI X, SI Y B, et al. Advances in the application of immobilized fungal laccase for the bioremediation of environmental organic contamination [J]. Biotechnology Bulletin, 2021, 37(6): 244-258(in Chinese).
[68] LIU Y Y, ZENG Z T, ZENG G M, et al. Immobilization of laccase on magnetic bimodal mesoporous carbon and the application in the removal of phenolic compounds [J]. Bioresource Technology, 2012, 115: 21-26. doi: 10.1016/j.biortech.2011.11.015 [69] THIYAGARAJAN P, SELVAM K, SUDHAKAR C, et al. Enhancement of adsorption of magenta dye by immobilized laccase on functionalized biosynthesized activated carbon nanotubes [J]. Water, Air, & Soil Pollution, 2020, 231(7): 1-9. [70] LI N, XIA Q Y, NIU M H, et al. Immobilizing laccase on different species wood biochar to remove the chlorinated biphenyl in wastewater [J]. Scientific Reports, 2018, 8: 13947. doi: 10.1038/s41598-018-32013-0 [71] SATHISHKUMAR P, CHAE J C, UNNITHAN A R, et al. Laccase-poly(lactic-co-glycolic acid) (PLGA) nanofiber: Highly stable, reusable, and efficacious for the transformation of diclofenac [J]. Enzyme and Microbial Technology, 2012, 51(2): 113-118. doi: 10.1016/j.enzmictec.2012.05.001 -



 下载:
下载: