-
人类活动严重影响河流、湖泊等淡水生态系统,导致水生态系统富营养化和有害藻华的高频次爆发. 目前的藻类防治技术可分为物理防治、化学防治和生物防治三大类. 物理方法包括超声波、紫外线、膜分离等[1];化学方法包括絮凝剂、除藻剂和高级氧化等[2]. 物理和化学防治虽然可以有效抑制藻类的生长,但也存在成本高、生态风险高、可持续性低等缺点. 生物方法通过使用水生动物、水生植物和杀藻微生物来控制藻类[3],其中溶藻细菌控制藻类具有高效、可持续、经济和环境友好的特点[4]. 因此,应用溶藻细菌具有更广阔的前景.
人工湿地控藻是一种显著的生态修复技术,由于其高效、环保的特点,已成为解决我国水体富营养化的有效途径[5]. 水生植物是湿地的重要组成部分,它们可以通过吸收直接去除氮,也可以通过改变湿地内部的氧化还原环境提高微生物的活性来间接去除氮[6]. 然而,据报道,通过吸收直接去除的总氮仅占整体去除效率的20%左右[7]. 水生植物在反硝化过程中更重要的作用是释放各种有机化合物,可供细菌用于反硝化[8]. 虽然单一的水生植物可以成为解决有害藻华(HABs)的有用工具,但它们的效果可能会受到限制. 此外,植物可能会增加 N2O 的排放通量,这主要是因为植物提供了更多的氧气或有机物来增加硝化-反硝化过程[9]. 植物在反硝化过程中更重要的作用是释放各种有机化合物,可供细菌用于反硝化. 通过将溶藻细菌与植物相结合的人工湿地会将两者的优点相结合.
本文通过搭建芦苇湿地试验装置,利用投加溶藻细菌胶囊,模拟太湖近岸原生态控藻体系,进行水生植物控藻与溶藻细菌胶囊强化相结合方式进行Microcystis aeruginosa的生态学生物操控试验,从藻类生长、藻胆蛋白、抗氧化系统、膜脂值活性、藻毒素释放、微生物群落特征等方面的研究来探究原生控藻体系的溶藻原理,并通过高通量技术与主成分分析来探索溶藻细菌与藻类之间的微生物群落动态关系.
-
试验菌种:菌株HL(Bacillius sp.)筛选自本课题组溶藻菌R1与反硝化聚磷菌B8原生质体融合的菌群,于4 ℃冰箱中保存,已在“中国微生物菌种保藏管理委员会普通微生物中心”保藏,保藏编号:CGMCC No.21172. 铜绿微囊藻(Microcystis aeruginosa,藻种编号为FACHB-905)购自中国科学院武汉水生生物研究所. 培养条件为:12 h : 12 h(明暗比),2500 Lux,(25 ± 1)℃.
试验胶囊:由海藻酸钠与乙基纤维素对上述菌株进行包埋,外观见图1.
-
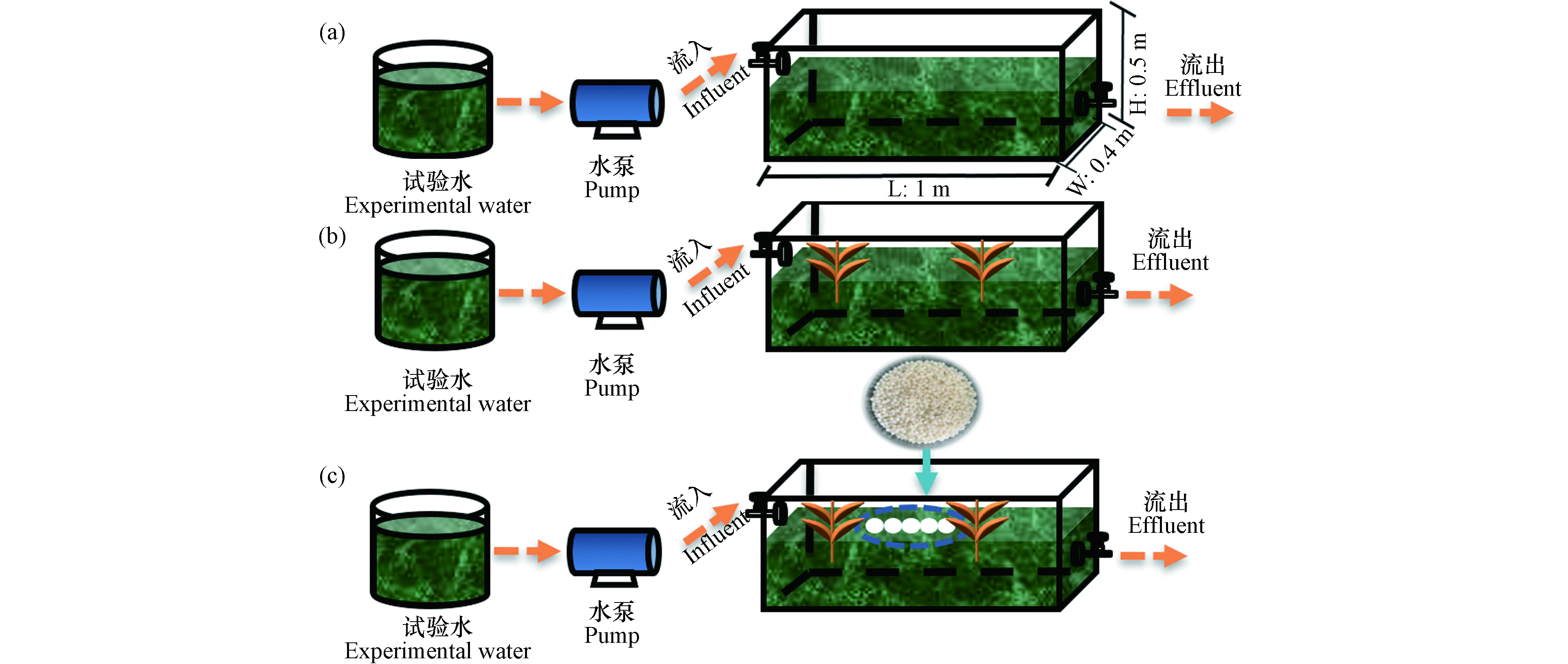
三个试验装置均为相同的尺寸为1.0 m×0.4 m×0.5 m(长×宽×高,见图2),分为对照组组(CK);芦苇植物试验装置(R1);芦苇和溶藻细菌胶囊处理组(R2). 其中各试验装置所用的水采自常州市滆湖(坐标为31°68′N, 119°96′E). 所采用的试验水的藻浓度为3×105 cells·mL−1.
-
Microcystis aeruginosa的生长是由藻细胞密度和Chlorophyll-a浓度所决定[10]. 采用光密度法和血细胞计数法测定藻细胞密度. 测定Microcystis aeruginosa在680 nm下的吸光度(x,nm),并用显微镜计数该吸光度的Microcystis aeruginosa藻细胞密度(y,105 cells·mL−1),拟合吸光度与藻密度的标准曲线如公式(1). 细胞色素—Chlorophyll-a浓度的测定,是根据之前的研究确定的[11],如公式(2)所示.
式(2)中,D630、D645、D663、D750分别代表提取物在630、645、663、750 nm处的吸光度值;V1为样品体积,即藻液体积,mL;V2为提取液产物,即90%乙醇体积,8 mL;δ表示比色皿光程,1 cm.
Microcystis aeruginosa的溶藻率按公式(3)计算[12]:
其中,Nt为处理t h后的藻细胞密度,cells·mL−1,N0为处理开始时的藻细胞密度,cells·mL−1.
取5 mL各处理组及对照组的藻样品,利用Zetasizer (Nano-ZS90, UK)测定藻细胞表面的Zeta电位,其中对照组为反应器中的水(a).
-
对于各处理组及对照组每日进行8 mL藻样品的采集,并用PBS溶液洗涤3次. 然后加入4 mL PBS溶液,将混合物进行涡旋混匀. 随后,在−20 °C/25 °C条件下分别冻融3次后,用超声波细胞破坏器(Bill - 950e,中国)处理10 min,确保藻细胞完全破坏. 取离心后的上清液用于测定PB. 分别在紫外吸光度仪为565、620、650 nm处测定藻蓝蛋白(PC)、别藻蓝蛋白(APC)和藻红蛋白(PE)的吸光度. 根据公式(4、5、6、7)分别计算PC、APC、PE和藻胆蛋白(PB)的含量[13].
式(4—6)中,D565、D620、D650分别代表藻样品在565、620、650 nm处的吸光度值.
-
采用相对应的化学检测试剂盒(南京建成生物研究所),测定R2试验装置中经处理的藻细胞中超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)的含量,并评价其酶活性.
-
丙二醛(MDA)是额外自由基脂质过氧化的最终产物,通常被认作生理应激和细胞氧化损伤的生物标志物[14]. 采用相对应的化学检测试剂盒(中国南京建成生物研究所)测定丙二醛含量.
采用透射电镜(TEM)观察了R2试验装置处理7d和14d后藻细胞的超微结构. 藻细胞在2.5%戊二醛中4℃孵育过夜固定,用0.1 mol·L−1 PBS溶液洗涤3次. 经FEI Tecnai Spirit(G2 bitwin, Netherlands)获得藻样的TEM图像.
-
对藻样品进行离心处理10000 r·min−1,离心25 min,将每个藻样品的上清液并转移到新试管中进行细胞外MC-LR测定. 用无菌水重悬藻细胞颗粒,经液氮反复冷冻后,室温解冻3次,10000 r·min−1, 4 ℃离心10 min,取上清液用于细胞内MC-LR测量. MC-LR的含量由酶联免疫吸附测定试剂盒(中国南京建成生物工程研究所)按照制造商的说明测量. 对照组为同样体积的矿物培养基也添加到藻类培养中.
-
试验数据至少重复3次,表示为平均值 ± 标准误差. 所有的统计检验采用SPSS 22 (IBM,美国)进行,方差分析(Anova)后采用Duncan的多范围检验,以P<0.05的显著性水平评价显著性效应.
-
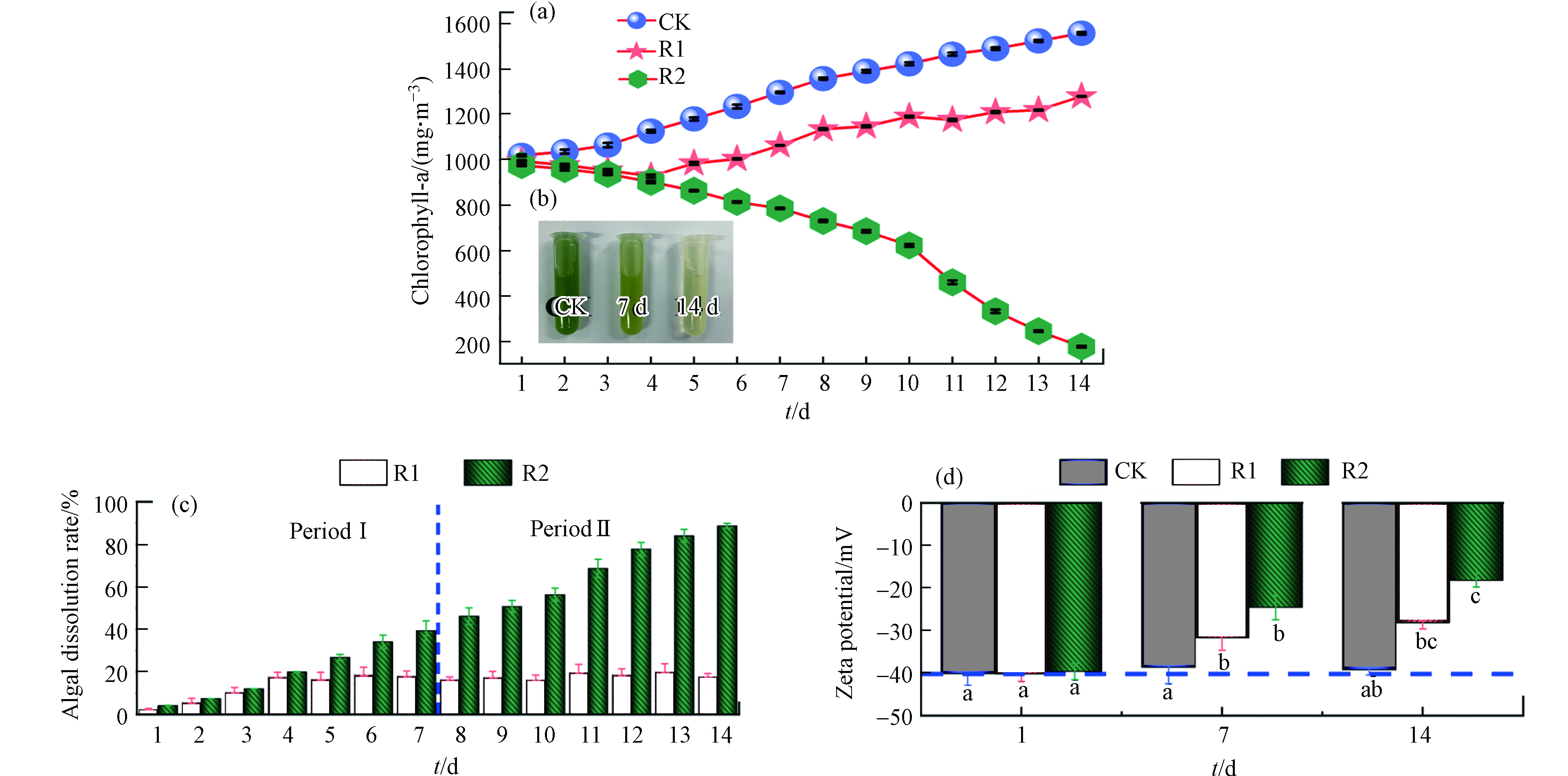
光合色素(Chlorophyll-a)含量的测定可作为藻类生长的重要指标[15]. 图3(a)中对照组的Chlorophyll-a含量稳步上升,在第14 天达到(1557.19 ± 5.34)mg·m−3,处理组R1、R2的Chlorophyll-a 含量均分别相对显著地下降. 图3(b)展示出了对照组与R2的7 d和14 d的藻样照片. 图3(c)为建立抑藻装置过程中R1和R2的溶藻率. 总的来说,试验可分为两个阶段:预处理阶段(Period I)和生物修复阶段(Period II),其中R1的溶藻率在7 d后趋于稳定,溶藻率在20%左右. 在溶藻细菌胶囊的作用下,R2相对于R1在第II期表现更较强的溶藻能力. 在第14 天时,R1和R2的溶藻率分别为(17.84% ± 1.31%)和(88.74% ± 1.10%). 结果表明,R2抑藻装置体系成功地建立起来,其中填料和植物均具有一定的吸附能力,国内外不少研究表明,水生植物对于受污染水体有着不错的处理效果[16-17]. 而本试验分析表明,装置长期运行后,椰丝填料表面的孔隙结构会被藻细胞、微生物及其代谢产物所占据[18]. 此外,R2试验装置是以生物修复为主,植物修复为辅. 其中植物修复主要是在试验前期起吸附作用,而在试验后期时,溶藻细菌胶囊发挥其间接溶藻的作用,通过分泌活性物质来达到溶藻的目的.
在自然水体中,藻类由于细胞壁上的羧酸基团或附着在细胞表面的胞外聚合物官能团的离解而带负电荷. 如图3(d)所示,对照组Zeta电位从初始值(−40.15 ± 2.67)mV到最终值(−39.25 ± 1.19)mV,几乎没有变化. R1和R2处理14 d后,Zeta电位值分别由(−40.23 ± 1.73)mV和(−39.65 ± 1.91)mV显著下降至(−28.17 ± 1.45)mV和(−18.19 ± 1.62)mV. 一般来说,Zeta电位越低,整个系统越倾向于聚集. 具体来说,当藻细胞聚集时,藻细胞表面电荷受到影响,其吸引力大于排斥力. 例如,苏俊峰等[19]在Microcystis aeruginosa中添加Raoultella sp. R11菌液,会导致藻细胞表面Zeta电位的降低.
-
藻胆蛋白是一个由藻胆素和载脂蛋白组成的系统,通过捕获光和转运蛋白质复合物来维持藻类细胞的基本能量转换[20]. 通过测定Microcystis aeruginosa的藻胆蛋白组成,分析R1和R2对藻细胞光合系统的影响. 从图4中可以看出,R2试验装置环境下PB中PE、APC和PC的含量逐渐下降,而对照组和R1试验装置环境中PE、APC和PC的含量变化不大. 在第14 天,PC、APC和PE的含量分别下降到1.4、4、28 mg·L−1,这表明此时大部分的PB已被破坏. 与PE、APC和PC的下降趋势相比,PC的下降幅度最大,为79.41%,说明PC可能是一个更敏感的靶目标. 蛋白质缺乏会影响藻类细胞的正常生长和代谢,这是藻类控制系统的机制之一. 这些时间依赖性趋势表明,溶藻细菌胶囊严重破坏了Microcystis aeruginosa藻细胞的光合系统.
-
抗氧化系统是Microcystis aeruginosa抵御外源性胁迫的关键藻细胞防御体系[21],是由抗氧化酶(SOD、CAT和POD)和抗氧化剂(GSH)组成. 当藻类细胞在面对不利的外部条件下会产生活性氧(ROS)来抵抗氧化损伤. SOD通常被认为是处理过剩超氧化物并将其转化为H2O2的先锋防御,以避免ROS和超氧化物对藻细胞的损害[22]. 而过度的H2O2则由SOD作用产生,从而诱导藻类细胞产生POD、CAT和GSH,协助SOD防御,将H2O2分解为H2O和O2,从而避免了有害H2O2在藻细胞中的积累[23]. 如图5(a)所示,R2暴露后ROS水平显著升高(P<0.05),R2试验装置在14d时诱导出最大ROS强度,其值为对照组的2.94倍. R2处理后藻细胞的ROS水平急剧升高,说明藻细胞受到了巨大的损伤. 图5(b-d)显示,R2处理1d后,各处理组的SOD、CAT和POD酶活性均显著升高,并在7 d时达到最大值. 14 d后各处理组抗氧化酶含量明显降低,但仍高于对照组. 这些结果表明,在R2的作用下,尤其是溶藻细菌胶囊作用下,破坏了藻类的抗氧化系统,导致藻细胞无法产生活性酶来抵御自身的氧化反应. 谷胱甘肽(GSH)作为一种非酶促抗氧化剂,是机体抗氧化防御系统中最丰富的清道夫,由于其氧化还原特性,可减少和降解有毒物质[24]. 从图5(e)可以看出,在整个R2处理过程中,GSH的含量不断增加,以(8.91 ± 0.68)U·mg−1 Protein的含量最高. 之前的研究报道GSH含量的大量增加意味着氧化应激程度的不断上升[25].
-
当氧自由基攻击藻细胞膜中的不饱和脂肪酸时,就会产生丙二醛(MDA),MDA的积累会加剧藻细胞膜的损伤[26]. 因此,MDA含量反映了藻类膜脂过氧化的程度,间接反映了R2对膜系统造成损伤的严重程度. 如图5(f)所示,第7 天时,R2表现出显著的刺激效应(P<0.05),MDA含量较对照组提高87.2%. 同时,第14天时MDA含量的变化趋势与SOD、CAT和POD的酶活性相似.
通过透射电镜(图6(a-b))图像观察溶藻细菌胶囊对第14天 时Microcystis aeruginosa形态的影响. 如图6(a)所示,对照组中藻细胞完整而健康,细胞壁和细胞膜结合紧密,空白胶囊处理过程中藻细胞生长正常. 细胞膜被多聚磷酸酯颗粒、类囊体、囊泡和液泡状结构包围. 然而,胶囊处理组中的藻类细胞内部结构发生了显著变化(图6(b)). 藻细胞壁和细胞膜变形破坏,细胞内物质开始渗漏. 最后,还观察到明显的胞浆分裂. 透射电镜图像表明,在溶藻细菌胶囊的存在下,Microcystis aeruginosa的死亡模式是坏死样的. 试验结果表明,溶藻细菌胶囊可能通过破坏藻类细胞结构而溶死藻细胞.
-
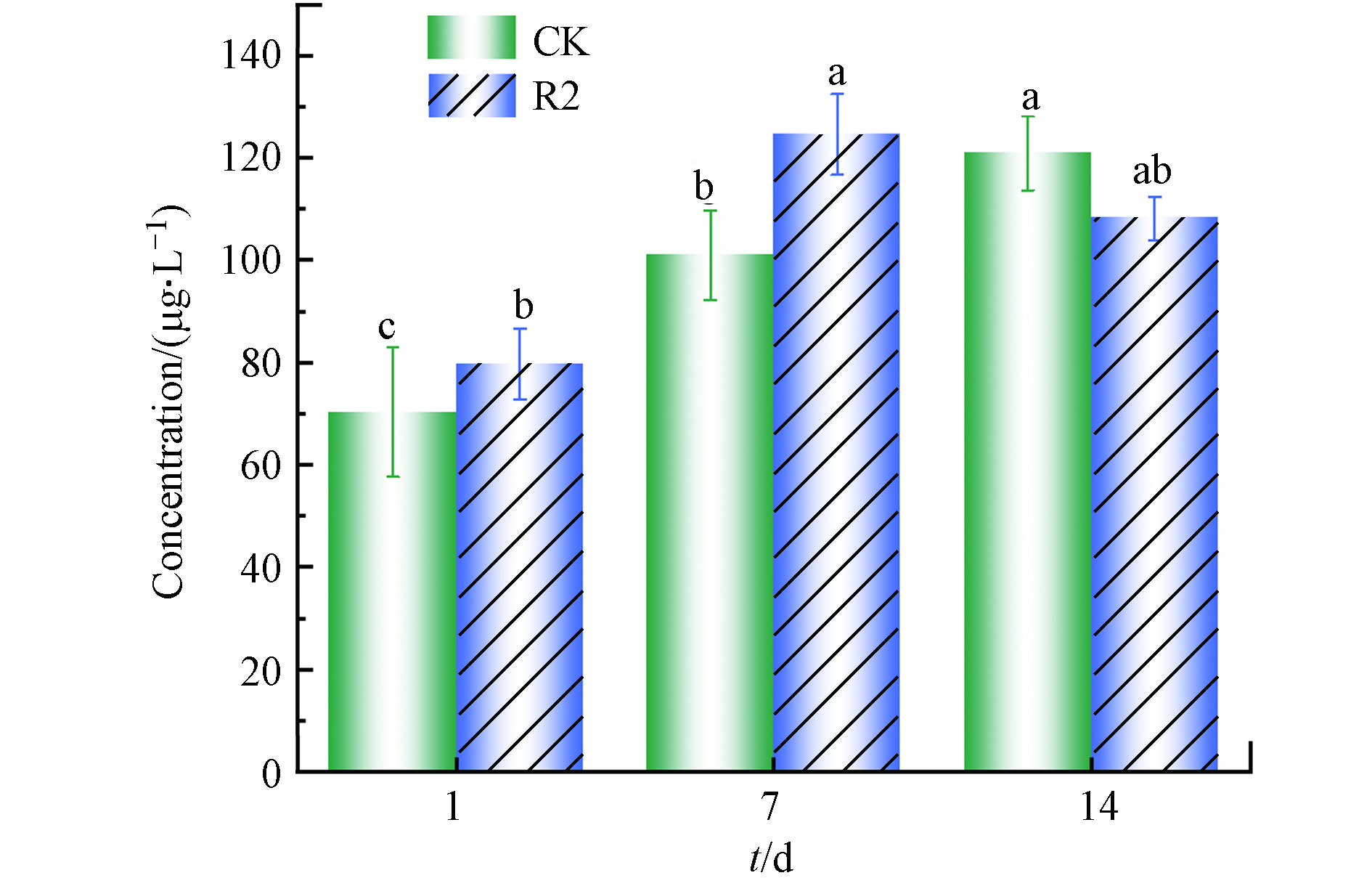
微囊藻毒素(Microcystins, MCs)是Microcystis aeruginosa释放的主要MC,是蓝藻水华的次生代谢产物[27]. 一般情况下来说,自然水环境中MCs的含量大概在0.04—25000 μg·L−1之间,当而含量达到100 μg·L−1时,此时对人类身心健康产生不利影响的风险较高[28]. 因此,在考虑对水生环境和人类健康的潜在威胁时,研究R2的MCs变化是很必要的.
如图7所示,随着时间的延长,对照组中的MCs含量稳步上升,7 d和14 d分别是第1 天(70.34 ± 12.67)μg·L−1的1.44倍和1.72倍,说明此时藻细胞的自然凋亡或崩解促进了MCs的合成并释放到周围水体中. 第7 天时,R2中MCs含量显著升高(P<0.05),在第14天时MCs含量相对降低至(108.19 ± 4.26)μg·L−1. 藻细胞中的MCs含量增加,可以认为是藻细胞对受外源环境影响的一种保护机制,藻细胞通透性的增加或藻细胞的分解是MCs被刺激释放的主要原因. 这些结果表明,R2实验装置最终抑制了Microcystis aeruginosa的生长,从而减少了MCs的释放.
-
为了进一步研究溶藻细菌胶囊在原位控藻系统R2中的重要性,采集R2试验装置中的藻样品进行16S rRNA高通量测序[29]. 从样本中获得60360个有效读数. 操作分类单元(Operational Taxonomic Units, OTUs)的相似性为97%. OTU、Chao、Ace、shannon和simpson指数分别为169、179、179、2.25和0.19.
对照组和R2试验装置的微生物群落结构分析如图8(a)所示.
对照组中4个门在门水平上的相对丰度均大于1%. 其中蓝藻细菌(Cyanobacteria_Choroplast)最多(59.82%),其次分别是Proteobacteria(11.34%)、Unclassified_Bacteria(1.51%)和other(2.02%). 试验结果表明,对照组中Microcystis aeruginosa生长情况良好. 而在经R2试验装置进一步培养后,蓝藻(Cyanobacteria_Choroplast)的相对丰度普遍下降至2.51%. 与此同时,拟杆菌门(Bacteroidetes)、变形杆菌门(Proteobacteria)厚壁菌门(Firmicutes)和芽单胞菌门(Gemmatimonadetes)分别增加到3.99%、1.75%、1.28%和89.74%. 在属水平上,各部位的相对丰度也具有相同的趋势. 图7(b-c)为对照组和R2的进化树. 在属水平上,对照组中主要属为蓝藻属(Cyanobacteria_Choroplast),而在R2中开始出现芽孢杆菌(Bacillus). 结果表明,在R2的作用下,Microcystis aeruginosa生长受到了极大的抑制,溶藻细菌胶囊在其中起着重要作用. 综上所述,控藻系统R2成功富集了能有效抑制藻类生长的溶藻细菌,为原位控藻系统提供了高效的溶藻能力.
-
通过主成分分析(PCA)来评估试验样品之间和被测定生物指标之间的关系[30]. 利用生化数据来进行主成分分析(PCA)来表明试验装置R2中的响应模式(图9). PC1和PC2分别解释了总变异的80.2%和12.6%. 将对照组和R2处理组用PC1和PC2分开,进一步揭示了R2影响变化机制. Zeta电位、SOD、MDA、POD、ROS水平、GSH与PC1呈正相关. Chlorophyll-a、APC、PC、PE和MCs含量与PC2呈显著负相关. PCA双标图也表明了生理生化变量和处理组R2之间的关系. R2与Zeta电位、ROS水平及抗氧化系统密切相关. 统计分析表明,R2环境下光合色素含量与ROS、MDA、抗氧化系统呈显著负相关.
这些结果表明,R2促进藻体内ROS水平的提高,增强藻细胞的Zeta电位和抗氧化酶活性,从而抑制了Microcystis aeruginosa的生长.
-
(1)高效的原位控藻系统R2已经成功地建立,14 d最高溶藻率为(88.74% ± 1.10%). 溶藻细菌胶囊在原位控藻体系中占主导地位,植物修复为辅.
(2)原位藻类控制系统效率高,生态风险低. 其中植物在试验前期起吸附作用,而溶藻细菌胶囊通过对藻蛋白的破坏和抗氧化系统的摧毁来导致藻细胞膜结构的受损,胞内物质流出而死亡.
(3)利用高通量技术发现,在高效原位控藻体系中,溶藻细菌胶囊所包埋的菌株Bacillus sp. HL与Microcystis aeruginosa之间存在动态平衡关系. 主成分分析结果表明高效原位溶藻体系R2的控藻机制为藻体内ROS水平的提高,增强了藻细胞表面的Zeta电位和抗氧化酶活性,从而抑制了Microcystis aeruginosa的生长.
溶藻细菌胶囊与植物共生系统的建立及其对Microcystis aeruginosa的控制
Establishment of symbiotic system between algicidal bacteria capsules and plants and its control of Microcystis aeruginosa
-
摘要: 当前,蓝藻水华时常爆发,其中铜緑微囊藻(Microcystis aeruginosa)是我国蓝藻水华的典型代表. 微生物控藻技术具有高效、生态安全性好、原位修复等特点,近年来已经成为治理蓝藻水华的主要手段. 本文通过搭建芦苇湿地试验装置,模拟太湖近岸水域原生环境,以水生植物控藻与溶藻细菌胶囊强化相结合的方式对Microcystis aeruginosa进行生态学-微生物操控试验. 从藻胆蛋白、抗氧化系统、膜脂值活性等方面的研究来探究控藻系统的溶藻机制,并通过高通量技术与主成分分析来探索溶藻细菌与藻之间的群落动态关系. 试验结果表明,原位藻类控制系统效率高,14 d溶藻率为(88.74% ± 1.10%),其中溶藻细菌胶囊占主导地位,植物修复为辅. 通过对藻胆蛋白的破坏和藻类抗氧化系统的摧毁来导致藻类膜结构的受损,胞内物质流出而死亡. 利用高通量技术发现,溶藻细菌胶囊所包埋的菌株Bacillus sp. HL在微生物体系中成为优势菌种. 主成分分析结果表明高效原位控藻体系促进了藻体内ROS水平,增强了藻的Zeta电位和抗氧化酶活性,从而抑制了Microcystis aeruginosa的生长.Abstract: At present, cyanobacteria blooms often erupt, and Microcystis aeruginosa is a typical algal bloom in China. In recent years, microbial algae control technology has been the main way to control cyanobacteria blooms due to its high efficiency, good ecological safety and in-situ remediation. In this paper, an experimental device of reed wetland was set up to simulate the native environment of the coastal waters of Taihu Lake, and the ecology-microbial manipulation experiment of Microcystis aeruginosa was carried out through the enhanced combination by aquatic plants and algicidal bacteria capsules. The mechanism of the algae control system was studied from the aspects of phycobili-protein, antioxidant system and membrane lipid value activity, and the dynamic relationship between algicidal bacteria and algae was explored by high-throughput technology and principal component analysis. The test results show that in-situ algae control system has high efficiency and the algae dissolution rate on the 14th day was (88.74% ± 1.10%), in which algicidal bacteria capsules played a dominant role, and phyto-remediation was a supplement. Through the destruction of phycobili-protein and antioxidant system, the membrane structure of algae was damaged, and the intracellular substances flowed out and died. It was found that Bacillus sp. HL was the dominant strain in the high efficiency in-situ algae control system by high throughput technique. The results of principal component analysis showed that the high efficiency in-situ algae control promoted the ROS level of algae, enhanced the Zeta potential and the activity of antioxidant enzymes, and inhibited the growth of Microcystis aeruginosa.
-
Key words:
- algicidal bacteria /
- Microcystis aeruginosa /
- capsule /
- algicidal mechanism /
- antioxidation system
-

-
-
[1] 刘智军. 超声波除藻抑藻及藻渣最终处理系统研究[D]. 重庆: 重庆大学, 2011. LIU Z J. Research on removal and inhibition of algae by ultrasound and algal residue final processing system[D]. Chongqing: Chongqing University, 2011(in Chinese).
[2] 宋琪. Fe2+/过硫酸盐去除铜绿微囊藻及其生态风险研究[D]. 广州: 华南理工大学, 2020. SONG Q. Removal of Microcystis aeruginosa by Fe2+/persulfate and its ecological risk[D]. Guangzhou: South China University of Technology, 2020(in Chinese).
[3] 于广丽. 微囊藻毒素降解方法研究进展 [J]. 安徽农业科学, 2008, 36(2): 714-715,740. doi: 10.3969/j.issn.0517-6611.2008.02.141 YU G L. Research progress of degradation methods of microcystins [J]. Journal of Anhui Agricultural Sciences, 2008, 36(2): 714-715,740(in Chinese). doi: 10.3969/j.issn.0517-6611.2008.02.141
[4] 吴刚, 席宇, 赵以军. 溶藻细菌研究的最新进展 [J]. 环境科学研究, 2002, 15(5): 43-46. doi: 10.3321/j.issn:1001-6929.2002.05.011 WU G, XI Y, ZHAO Y J. The latest development of research on algae-lysing bacteria [J]. Research of Environmental Sciences, 2002, 15(5): 43-46(in Chinese). doi: 10.3321/j.issn:1001-6929.2002.05.011
[5] 肖海文, 刘馨瞳, 翟俊, 等. 人工湿地类型的选择及案例分析 [J]. 中国给水排水, 2021, 37(22): 11-17. doi: 10.19853/j.zgjsps.1000-4602.2021.22.002 XIAO H W, LIU X T, ZHAI J, et al. Type selection of constructed wetlands and related design case analysis [J]. China Water & Wastewater, 2021, 37(22): 11-17(in Chinese). doi: 10.19853/j.zgjsps.1000-4602.2021.22.002
[6] 何娜, 张玉龙, 孙占祥, 等. 水生植物修复氮、磷污染水体研究进展 [J]. 环境污染与防治, 2012, 34(3): 73-78. doi: 10.3969/j.issn.1001-3865.2012.03.016 HE N, ZHANG Y L, SUN Z X, et al. Research advances on phytoremediation of nitrogen and phosphorus polluted water by aquatic macrophytes [J]. Environmental Pollution & Control, 2012, 34(3): 73-78(in Chinese). doi: 10.3969/j.issn.1001-3865.2012.03.016
[7] 廖明晶, 范敬龙, 匡代洪, 等. 种植多枝柽柳的模拟人工湿地对模拟污水中氮、磷、铅和镉的去除率研究 [J]. 湿地科学, 2021, 19(6): 715-725. doi: 10.13248/j.cnki.wetlandsci.2021.06.008 LIAO M J, FAN J L, KUANG D H, et al. Removal rates of nitrogen, phosphorus, lead and cadmium from simulated effluent in simulated constructed wetlands planted with Tamarix ramosissima [J]. Wetland Science, 2021, 19(6): 715-725(in Chinese). doi: 10.13248/j.cnki.wetlandsci.2021.06.008
[8] 李先宁, 吕锡武, 宋海亮, 等. 水耕植物过滤法净水系统底泥硝化反硝化潜力 [J]. 环境科学, 2005, 26(2): 93-97. doi: 10.3321/j.issn:0250-3301.2005.02.019 LI X N, LU X W, SONG H L, et al. Potential of nitrification and denitrification in water purification system with hydroponic bio-filter method [J]. Environmental Science, 2005, 26(2): 93-97(in Chinese). doi: 10.3321/j.issn:0250-3301.2005.02.019
[9] 吕成旭. 蓝藻衰亡分解对N2O释放通量及产生途径的影响研究[D]. 南京: 南京师范大学, 2021. LU C X. Effect of cyanobacteria decay decomposition on N2O emission flux and production pathway[D]. Nanjing: Nanjing Normal University, 2021(in Chinese).
[10] 田勇. 南水北调中线总干渠叶绿素a与藻密度相关性研究 [J]. 人民长江, 2019, 50(2): 65-69. doi: 10.16232/j.cnki.1001-4179.2019.02.012 TIAN Y. Study on correlation of Chlorophyll-a and Algal density in main canal of Middle Route of South-to-North Water Diversion Project [J]. Yangtze River, 2019, 50(2): 65-69(in Chinese). doi: 10.16232/j.cnki.1001-4179.2019.02.012
[11] 董小娜, 陈泽慧, 毛林强, 等. 微生物溶藻进程与机制的三维荧光分析方法 [J]. 环境化学, 2018, 37(6): 1337-1342. doi: 10.7524/j.issn.0254-6108.2017091206 DONG X N, CHEN Z H, MAO L Q, et al. Three-dimensional fluorescence analysis of the processes and mechanisms of algae-lysing by microorganism [J]. Environmental Chemistry, 2018, 37(6): 1337-1342(in Chinese). doi: 10.7524/j.issn.0254-6108.2017091206
[12] 许明宸, 张文艺, 毛林强. 太湖土著田螺消化道中溶藻菌XMC溶藻进程与叶绿素a降解动力学研究 [J]. 环境化学, 2021, 40(6): 1855-1861. doi: 10.7524/j.issn.0254-6108.2020020602 XU M C, ZHANG W Y, MAO L Q. Study on algae-lysing process and chlorophyll-a degradation kinetics of algicidal bacteria XMC in the digestive tract of indigenous field snails of Taihu Lake [J]. Environmental Chemistry, 2021, 40(6): 1855-1861(in Chinese). doi: 10.7524/j.issn.0254-6108.2020020602
[13] FAN D, DU B H, ZHOU J J, et al. Porous self-floating 3D Ag2O/g-C3N4 hydrogel and photocatalytic inactivation of Microcystis aeruginosa under visible light [J]. Chemical Engineering Journal, 2021, 404: 126509. doi: 10.1016/j.cej.2020.126509 [14] 张薛薇, 开振鹏, 宋卫国, 等. 50种常用香料对铜绿微囊藻的生态毒性效应 [J]. 中国环境科学, 2021, 41(3): 1429-1435. doi: 10.3969/j.issn.1000-6923.2021.03.047 ZHANG X W, KAI Z P, SONG W G, et al. Ecotoxicological effects of 50 kinds of fragrance materials on Microcystis aeruginosa [J]. China Environmental Science, 2021, 41(3): 1429-1435(in Chinese). doi: 10.3969/j.issn.1000-6923.2021.03.047
[15] CRUCES E, BARRIOS A C, CAHUE Y P, et al. Similar toxicity mechanisms between graphene oxide and oxidized multi-walled carbon nanotubes in Microcystis aeruginosa [J]. Chemosphere, 2021, 265: 129137. doi: 10.1016/j.chemosphere.2020.129137 [16] VYMAZAL. J. Emergent plants used in free water surface constructed wetlands: A review [J]. Ecological Engineering, 2013, 61: 582-592. doi: 10.1016/j.ecoleng.2013.06.023 [17] ZHENG Y C, SUN Z Z, LIU Y, et al. Phytoremediation mechanisms and plant eco-physiological response to microorganic contaminants in integrated vertical-flow constructed wetlands [J]. Journal of Hazardous Materials, 2022, 424: 127611. doi: 10.1016/j.jhazmat.2021.127611 [18] GU, X S, CHEN D Y, WU F, et al. Function of aquatic plants on nitrogen removal and greenhouse gas emission in enhanced denitrification constructed wetlands: Iris Pseudacorus for example [J]. Journal of Cleaner Production, 2022, 330: 129842. doi: 10.1016/j.jclepro.2021.129842 [19] SU J F, SHAO S C, MA F, et al. Bacteriological control by Raoultella sp. R11 on growth and toxins production of Microcystis aeruginosa [J]. Chemical Engineering Journal, 2016, 293: 139-150. doi: 10.1016/j.cej.2016.02.044 [20] ZHOU S Q, BU L J, SHI Z, et al. Electrochemical inactivation of Microcystis aeruginosa using BDD electrodes: Kinetic modeling of microcystins release and degradation [J]. Journal of Hazardous Materials, 2018, 346: 73-81. doi: 10.1016/j.jhazmat.2017.12.023 [21] 尹黎燕, 黄家权, 沈强, 等. 烟草悬浮细胞抗氧化系统对微囊藻毒素-RR的响应 [J]. 中国环境科学, 2005, 25(5): 576-580. doi: 10.3321/j.issn:1000-6923.2005.05.016 YIN L Y, HUANG J Q, SHEN Q, et al. Responses of antioxidant systems in tobacco BY-2 suspension cells to the toxicity of microcystin-RR [J]. China Environmental Science, 2005, 25(5): 576-580(in Chinese). doi: 10.3321/j.issn:1000-6923.2005.05.016
[22] 刘国锋, 韩士群, 刘学芝, 等. 藻华聚集的环境效应: 对漂浮植物水葫芦(Eichharnia crassipes)抗氧化酶活性的影响 [J]. 湖泊科学, 2016, 28(1): 31-39. doi: 10.18307/2016.0104 LIU G F, HAN S Q, LIU X Z, et al. The environmental effects of algae bloom cluster: Impact on the antioxidant enzyme activities of water hyacinth(Eichharnia crassipes) [J]. Journal of Lake Sciences, 2016, 28(1): 31-39(in Chinese). doi: 10.18307/2016.0104
[23] SU J F, MA M, WEI L, et al. Algicidal and denitrification characterization of Acinetobacter sp. J25 against Microcystis aeruginosa and microbial community in eutrophic landscape water [J]. Marine Pollution Bulletin, 2016, 107(1): 233-239. doi: 10.1016/j.marpolbul.2016.03.066 [24] HE L, LIN Z Y, WANG Y M, et al Facilitating harmful algae removal in fresh water via joint effects of multi-species algicidal bacteria[J]. Journal of Hazardous Materials, 2021, 403: 123662. [25] NI L X, ACHARYA K, HAO X Y, et al. Isolation and identification of an anti-algal compound from Artemisia annua and mechanisms of inhibitory effect on algae [J]. Chemosphere, 2012, 88(9): 1051-1057. doi: 10.1016/j.chemosphere.2012.05.009 [26] 韩梅傲雪. 赤潮微藻米氏凯伦藻对亚油酸抑制作用的响应及其细胞凋亡机制研究[D]. 曲阜: 曲阜师范大学, 2018. HAN M A X. Studies on the inhibiting effect and the mechanisms of cell apoptosis in Karenia mikimotoi exposed to linoleic acid[D]. Qufu: Qufu Normal University, 2018(in Chinese).
[27] MOURA D S, PESTANA C J, MOFFAT C F, et al. Adsorption of cyanotoxins on polypropylene and polyethylene terephthalate: Microplastics as vector of eight microcystin analogues [J]. Environmental Pollution, 2022, 303: 119135. doi: 10.1016/j.envpol.2022.119135 [28] XU M L, TSONA N T, LI J L, et al. Atmospheric chemical processes of microcystin-LR at the interface of sea spray aerosol [J]. Chemosphere, 2022, 294: 133726. doi: 10.1016/j.chemosphere.2022.133726 [29] 郑琳琳, 李海滨, 唐厚全, 等. 高通量测序分析小清河济南段微生物群落结构 [J]. 济南大学学报(自然科学版), 2022, 36(2): 221-224,236. doi: 10.13349/j.cnki.jdxbn.20211216.001 ZHENG L L, LI H B, TANG H Q, et al. High-throughput sequencing analysis of microbial community structure in Jinan section of the Xiaoqing River [J]. Journal of University of Jinan (Science and Technology), 2022, 36(2): 221-224,236(in Chinese). doi: 10.13349/j.cnki.jdxbn.20211216.001
[30] 梁倩, 李书琴, 杨会君. PCA-SVM在芳香族化合物生物降解性QSBR研究中的应用 [J]. 计算机与应用化学, 2012, 29(3): 355-359. doi: 10.3969/j.issn.1001-4160.2012.03.024 LIANG Q, LI S Q, YANG H J. Application of PCA-SVM in the QSBR study on biodegradability of aromatic compounds [J]. Computers and Applied Chemistry, 2012, 29(3): 355-359(in Chinese). doi: 10.3969/j.issn.1001-4160.2012.03.024
-




 下载:
下载: