-
抗生素是常用来治疗人类和动物疾病或者促进生长的药品,其以治疗效果显著、抗菌谱广等优点被大量使用[1];据报道,使用的抗生素约90%会进入水体和土壤,不仅污染生态环境,且会对水生动植物、土壤微生物和植物的生存及人类的健康造成较大的威胁[2-4]。研究表明辽河流域地表水中大环内酯类抗生素检测出浓度高达201.88 ng·L−1[5];三峡库区检出的数十种抗生素,林可霉素的浓度高达218 ng·L−1[6];氧氟沙星在美国的医院废水检测中浓度达36 μg·L−1[7];目前世界多地的水源及水厂已检测到抗生素[8],众多的抗生素中,硫酸阿米卡星(amikacin sulfate, AMI)是临床上一种常用的氨基糖苷类抗生素,用于治疗细菌感染的革兰氏阴性的患者,其由于难以降解,在环境中具有生物累积性和持久性,易通过污废水处理厂、陆地生态系统的径流及渗透作用进入水环境[9];研究表明,AMI对蛋白核小球藻的时间依赖毒性较为显著,最大抑制率超过80%[10];此外AMI对人体的肾、耳会造成一定的损伤[11];对环境和人体健康存在风险和危害。
另外,重金属也是环境中典型的污染物之一,常伴随着生活污水、采矿和冶炼等废水进入水环境,微量浓度就可产生较强的毒性作用,对河湖以及地表饮用水产生污染与危害[12];由于重金属具有富集性和不易降解性,且可以通过食物链直接或间接对生物产生累积毒性[13]。铜作为人类最早开采并使用的金属,在历史进程中充当重要的角色,但过量的铜进入生物体内,会引发一系列生物效应,进而产生毒性[14]。
环境中的污染物种类繁多,且以各种形式或浓度混合存在[15],各种污染物的毒性及相互作用不容忽视。此外环境能够影响污染物在其中迁移转化过程的性能,同时影响生活在其中生物的活动行为及代谢方式,所以研究中,污染物所处的环境介质情况越来越受关注[14],成为不可忽视的条件,探究不同环境介质(如pH值)下污染物对生物的毒性作用也成为热门课题。荣宏伟等[16]发现,水体环境的pH值会影响重金属铜对活性污泥的毒性作用;赵娜等[17]发现,pH值会影响Cr6+对小球藻的毒性大小,其表现的毒性为pH值为7时毒性最小,pH值为8时毒性最大;Xu等[18]发现,pH值对个人护理产品的青海弧菌发光抑制率有一定影响。研究表明,pH在化学物质的毒性中具有非常重要的作用,它影响细胞膜对离子的吸收速率和化合物的水解速率[19]。目前有大量的毒性研究是关于重金属和抗生素的,二者的混合物毒性也有一定的报道,但缺少在不同pH值下二者毒性相互作用变化规律的研究,因此,开展不同pH值下重金属和抗生素时间毒性的研究具有重要的实际意义。
该研究拟以硫酸阿米卡星(AMI)和五水硫酸铜(CuSO4·5H2O)为污染物对象,青海弧菌(Vibrio qinghaiensis sp. -Q67, Q67)为受试生物,为确保Q67正常生长[18,20],选用6、7、8、9共4个pH值条件分别进行实验,运用直接均分射线法(direct equipartition ray,EquRay)[21]设计AMI和Cu共5组不同浓度配比的混合物,应用时间毒性微板分析法(Time-dependent microplate toxicity analysis, t-MTA)[22]测定AMI和Cu及其混合物在不同pH值条件、不同暴露时间下的毒性,考虑到浓度加和模型(concentration addition,CA)适用于具有相似毒作用模式/作用机制(mode /mechanism of toxic action,MOA)污染物的混合物毒性评估,而独立作用模型(independent action,IA)适用于具有相异MOA污染物的混合物毒性评估[15,23-25],本研究拟选用IA模型评估在不同暴露时间的AMI和Cu的毒性相互作用,并应用改进的面积浓度比法(the area-concentration ratio method was modified,MACR)[26]评价AMI和Cu之间的毒性相互作用强度,揭示不同pH值条件下AMI和Cu的毒性相互作用变化规律,以期为抗生素与重金属混合物的环境风险评估提供数据和方法参考。
-
硫酸阿米卡星(Amikacin sulfate,AMI)、五水硫酸铜(CuSO4·5H2O, Cu)均购自上海麦克林生化科技有限公司,用超纯水配制储备液备用,用氢氧化钠溶液分别调节pH值至6、7、8、9并置于4℃冰箱保存,试剂的基本性质见表1。
主要实验仪器:spectramax i3x酶标仪(美谷分子仪器(上海)有限公司)、超净工作台(鑫贝西生物技术有限公司)、YAMATO立式压力蒸气灭菌锅SQ810C(上海天呈科技有限公司)、宾德Binder KBF P240恒温恒湿箱(上海坤权生物科技有限公司)。
-
实验菌种为青海弧菌(Vibrio qinghaiensis sp. -Q67,Q67),购自北京滨松光子技术股份有限公司。将Q67冻干粉复苏、活化,转移至固体培养基上,置于(22±1)℃恒温培养箱中培养,待平板长出菌种后置于4 ℃冰箱中保存、备用。实验前将Q67接种至1倍液体培养基中,振荡培养((22±1)℃,120 r·min−1)至对数生长期备用,培养基配置与具体实验操作参照文献[27]。
实验采用白色96孔微板作为实验载体,微板周边36孔加入200 μL超纯水减小边缘效应,第2、6、7和11列作为空白对照,加入100 μL超纯水,余下的微孔作为处理组分别加入12组不同浓度梯度的毒物,每组3个平行。对照组和处理组加入体积100 μL菌液,使每个孔的总体积为200 μL。以上操作重复3次,共3块微板。实验微板置于温度(22±1)℃恒温培养箱中,在暴露时间0.25、2、4、8、12 h时, 用酶标仪测定微板各孔的发光值,计算各孔抑制率,公式如下,具体操作及测定过程参见文献[27]。
式中,E表示抑制率(0<E<1);I0表示空白对照的发光平均值,I表示各浓度梯度的发光平均值。
-
AMI和Cu的混合物组分浓度配比设计中,采用EquRay构建不同pH值下的AMI和Cu混合物体系[28],每个pH值下设计5条不同浓度配比(pi)的混合物射线(R1、R2、R3、R4、R5)。具体浓度配比见表2。
-
各污染物在不同暴露时间下的浓度-效应数据经处理后使用APTox软件中Weibull函数进行非线性拟合[15],得到浓度-效应曲线(Concentration-response curve,CRC)及其95%置信区间(Observation-based confidence interval,OCI)。拟合函数公式表示如下:
式中,E表示抑制率(0<E<1);α表示位置参数,β表示斜率;C表示污染物的浓度,mol·L−1。
-
混合物毒性评估中常用IA和CA 2种参考模型。通过查阅文献,王滔等[25]研究抗生素与重金属的毒性相互作用时,发现IA预测曲线与实验观测值更加接近,认为IA模型更适用于相异MOA污染物的混合物毒性评估,宋晓青等[29]对除草剂与重金属的毒性研究也佐证了这一结论。考虑到该研究的混合物同样是重金属与抗生素,而CA模型更适用于具有相似MOA污染物之间的毒性评估[15],故采用IA模型用于混合物Cu和AMI的毒性评估,IA预测线在其观测值95%OCI之间、之上或之下,则表明该混合物呈现加和、拮抗或协同作用[30-31]。IA模型表达式如下:
式中,ci表示混合物第i个组分的浓度,mol·L−1;Cmix表示混合物总浓度,mol·L−1;E(ci)是第i个组分单独存在时浓度为ci时产生的效应,%;E(Cmix)是混合物在浓度为Cmix时产生的总效应,%。
MACR是用以表示混合物毒性相互作用强度的指标,通过对95%OCI与预测曲线之间积分,得到协同或拮抗面积,除以相应的浓度范围即为MACR值,通过MACR值评价抗生素与重金属之间的毒性相互作用强度,计算方法详见参考文献[26]。
-
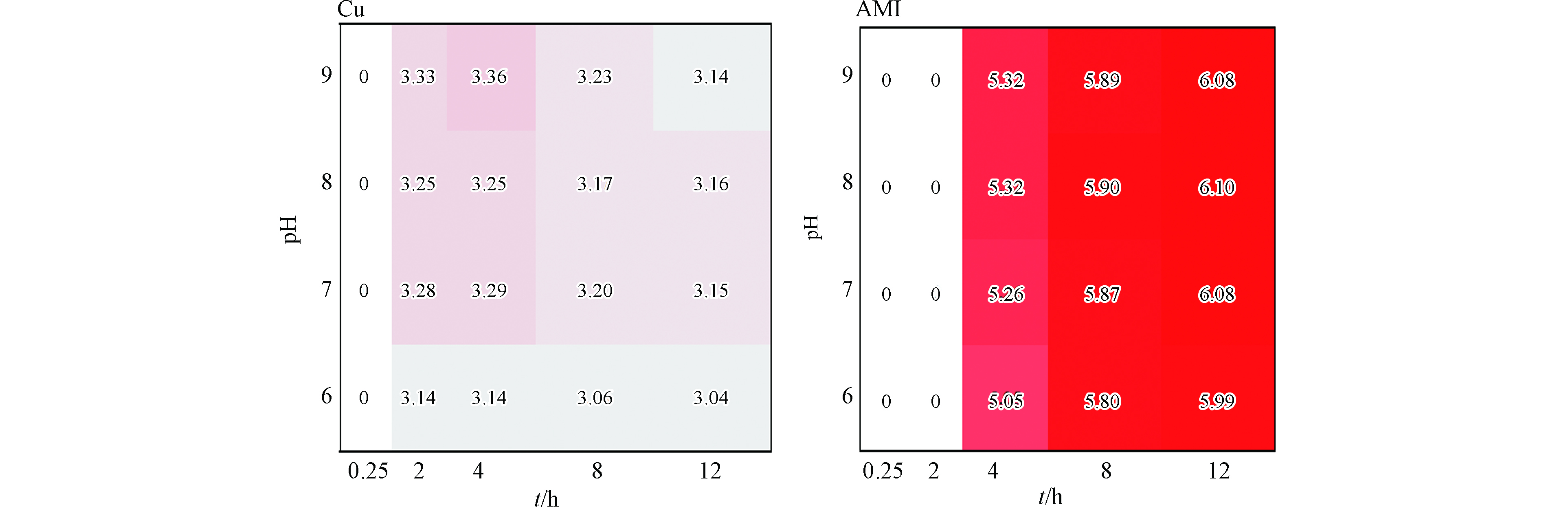
采用WeibullT函数拟合不同pH值下Cu和AMI对Q67在不同暴露时间的浓度-效应数据,时间-浓度-效应曲线统一绘于图1。从图1可以看出,在一定浓度下,随着暴露时间延长,Cu和AMI对Q67的浓度效应曲线呈现不同的变化规律。Cu在低浓度区域对Q67的抑制率都较低,随着浓度增加,抑制率有明显提高,同时发现Cu对Q67的抑制率达到最高的暴露时间点均出现在2 h或4 h,暴露时间为8 h和12 h时的抑制率不再增加,毒性稍有减弱,班龙科等[32]研究重金属对蛋白核小球藻的毒性作用,发现48 h后Cu对蛋白核小球藻的抑制率同样不再增加,与本研究结果相似。AMI在0—2 h对Q67的抑制率较低,随着暴露时间的延长,AMI对Q67的毒性增强,表现出明显的时间依赖性。为表征Cu和AMI在不同暴露时间、不同pH值下的毒性大小,以半数效应浓度的负对数pEC50作为毒性指标,并绘制了pEC50热图(图2)(热图中颜色越深表示值越大,下同),由图2可得,除12 h外,Cu在各个pH值体系下的毒性大小顺序均为(pH=9)>(pH=7)>(pH=8)>(pH=6),可能是pH值降低,H+浓度增加并和自由Cu2+竞争生物体表面的结合位点,作用于生物体表面的自由Cu2+被H+取代,从而使毒性降低[20];也有研究认为H+改变了溶液中Cu2+的毒性形态,通过增强羟基的络合竞争能力而实现[14,20];韦东普[20]在研究中发现高pH值(6.5—8.5)范围,pH值增加会降低Cu对Q67的毒性,与本研究两个pH值下的结果相一致。AMI表现出显著的时间依赖毒性,即随着暴露时间的增加,毒性增强,4个pH值条件下的毒性总体来说相差较小,AMI的毒性高Cu的毒性2—3数量级。
-
Cu和AMI在4个不同pH值下组成4组混合物体系,每组含5条射线,共20条射线。4组混合物体系的毒性数据均可用Weibull函数有效拟合,不同暴露时间的pEC50热图如图3、图4所示。
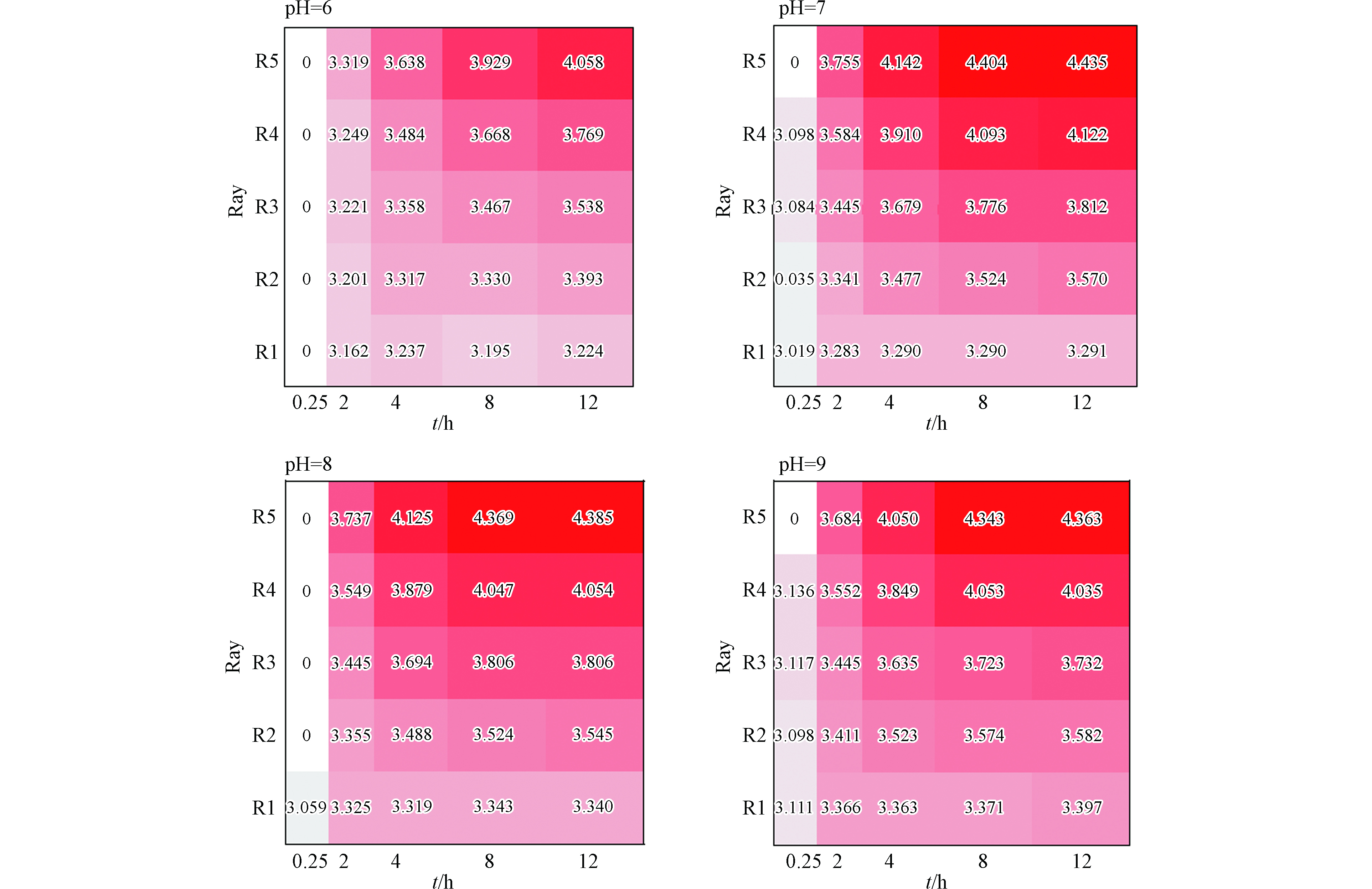
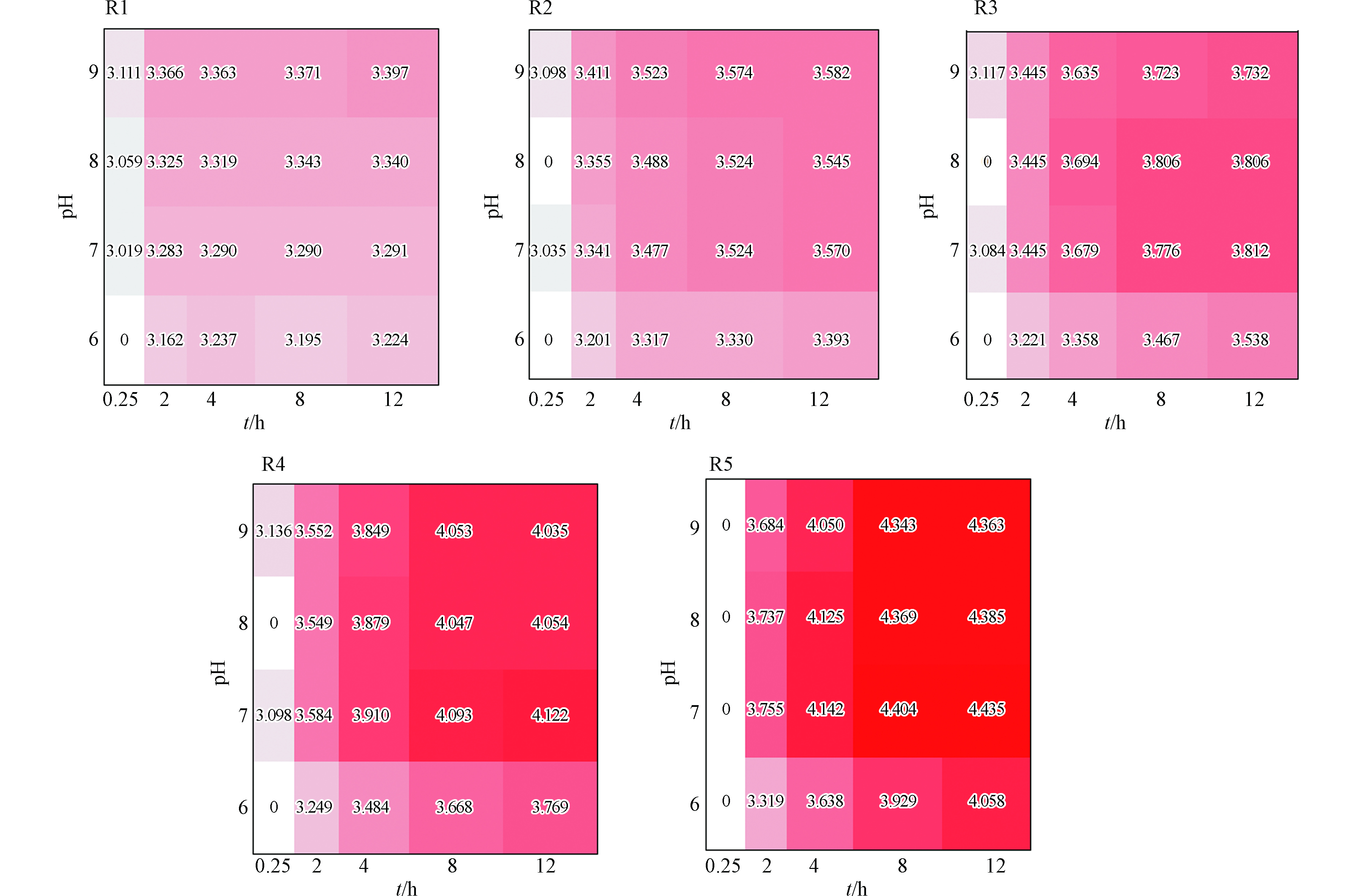
从图3可以看出,随着暴露时间的延长,射线R2、R3、R4、R5的毒性呈增大趋势,表现出明显的时间依赖毒性,R1表现的时间依赖毒性则不显著;随着射线R2—R5中AMI浓度的增大,AMI对混合体系的毒性效应产生了一定的影响,Cu和AMI混合物具有明显的组分依赖毒性,即混合物体系AMI组分越高,热图中的红色越深,即混合体系的毒性越大,且随着暴露时间的增长,5条射线的毒性差异更为显著;另外射线R1的毒性变化趋势与Cu单独作用相似,在暴露时间为8 h和12 h时出现毒性减弱的现象,可能是由于射线R1中Cu浓度较高,影响了混合物毒性随时间的变化规律,陈敏等[10]在研究氨基糖苷类抗生素与重金属对蛋白核小球藻毒性作用时,发现妥布霉素浓度配比最高的射线呈现的毒性作用与妥布霉素的单一毒性相似,与本文实验分析结果一致。
从图4可以看出,5组射线中,pH值为6的混合物体系的pEC50值较小,明显低于pH值为7、8、9混合物体系的pEC50值,pH值为7、8、9的混合物体系在pEC50热图中表现的颜色深浅相差较小,即说明其混合物体系之间的毒性值相差不大。
-
本研究采用IA预测模型探究Cu和AMI混合物体系的毒性相互作用,发现4个pH值条件下混合物体系的20条射线,存在不同程度的协同或加和作用,宋崇崇等[33]研究抗生素与重金属对蛋白核小球藻毒性作用时,发现IA预测线的位置几乎都在CRC以下,整体呈现的混合物联合毒性与本文一致,仅有协同或加和两种作用;图5、图6、图7、图8分别给出了4个pH值条件下的各射线的实验数据点及其95%置信区间、拟合曲线以及IA预测曲线(IA预测曲线位于95%置信区间下方,毒性相互作用表现为协同作用,图中用红色区域表示,IA预测曲线位于95%置信区间内,则表现为加和作用)。
从图5中可以看出,pH=6条件下Cu和AMI的混合物体系,R1在各个暴露时间未表现出毒性相互作用,其余射线均出现了不同程度的协同作用。暴露时间为0.25、2 h时,仅R5的IA预测线落在置信区间的下方,毒性相互作用表现为协同作用,R1、R2、R3、R4则没有表现出毒性相互作用,即为加和作用;暴露时间为4、8、12 h,射线R2、R3、R4、R5的IA预测线在低浓度范围内表现为加和作用,中高浓度范围内,4条射线则转变为不同程度的协同作用。且随着AMI浓度的增大,混合物体系在中高浓度范围内的毒性相互作用表现出更显著的协同作用,具有典型的浓度比依赖关系。该结果说明Cu和AMI的混合物毒性相互作用与混合物组分的浓度配比、暴露时间等有关,这与丁婷婷等[34]研究的3种氨基糖苷类抗生素之间毒性相互作用变化结果一致。
从图6中可以看出,pH=7条件下,射线R1仅在0.25 h的高浓度范围内表现出协同作用,其余暴露时间表现为加和作用;射线R2、R3、R4、R5在5个暴露时间点的毒性相互作用均有协同作用,随着暴露时间的延长,射线R2、R3、R4、R5在一定的浓度范围内的毒性相互作用呈现了显著的协同作用,4条射线的IA预测线在低浓度范围内表现为加和作用,在中高浓度范围内则落在置信区间下方,混合物毒性相互作用转变为协同作用。此pH值条件下仍有浓度比依赖关系,即AMI浓度增大,中高浓度范围内呈现出显著的协同作用。与陈敏等[10]研究的抗生素与重金属对蛋白核小球藻毒性相互作用结果一致,即混合物的毒性相互作用与组分浓度配比有关。
从图7中可以看出,pH=8条件下,暴露时间为0.25 h时,仅射线R1在较高浓度范围内的毒性相互作用表现为协同作用,射线R2、R3、R4、R5均表现为加和作用;暴露时间为2 h时,仅射线R2表现为加和作用,射线R1、R3、R4、R5的IA预测线在中高浓度范围内毒性相互作用表现为协同作用;暴露时间为4、8 h时,仅射线R1表现为加和作用,射线R2、R3、R4、R5的IA预测线在中高浓度范围内毒性相互作用则表现出明显的协同作用;暴露时间为12 h时,5条射线的IA预测线在中高浓度范围内均落在置信区间下方,毒性相互作用表现为协同作用。整体来说此pH值条件下混合物组分浓度比对混合物体系的毒性相互作用也有一定影响,有典型的浓度比依赖关系,但出现协同作用的频次和强度相较于pH值为7的条件下有所下降,可能由于pH值在7.5以上时,铜离子因产生Cu(OH)2沉淀使其毒性降低[16],进而导致混合物毒性相互作用发生变化。
从图8中可以看出,pH=9条件下,暴露时间为0.25 h时,5条射线在低浓度范围内表现为加和作用,在较高浓度范围内毒性相互作用均转变为协同作用;暴露时间为2 h时,射线R1、R2表现为加和作用,射线R3、R4、R5的IA预测线在中高浓度范围内毒性相互作用表现为协同作用;暴露时间为4、8、12 h时,仅射线R1表现为加和作用,射线R2、R3、R4、R5的IA预测线在中高浓度范围内毒性相互作用表现为协同作用。此pH值条件下自由Cu2+活度急剧降低[20],毒性理应减弱,但从结果上来看并不能解释,同样有研究表明,随着pH的增加,金属对一些生物如费氏弧菌[35]和小麦根系[36]的毒性增加或者不产生影响,此结论与该研究的实验结果较为吻合,但其具体机理仍需进一步研究。
为进一步探究pH值对混合物产生的协同作用强度的影响,计算各射线12 h的MACR值用以定量评估毒性相互作用,并绘制MACR热图(图9),同时记录各射线首次出现协同作用时混合物的浓度,见表3。
从图9可以看出,射线R1在pH值为6、7、9的条件下没有表现出毒性相互作用,即MACR值为0,在pH值为8时,表现出较弱的协同作用强度,MACR值为0.014;射线R2、R3、R4、在4个pH值条件下的MACR值顺序大小均为:R4>R3>R2,即射线R2—R4的协同作用越来越强,MACR的最大值出现在pH=7条件的R4射线中,达到0.247;射线R5的MACR值介于射线R3与R4之间,可能与Cu的浓度配比降低或者AMI浓度配比升高有关。另一方面,5组射线中,pH值为6的混合物体系的MACR值较小,明显低于pH值为7、8、9的混合物体系,说明一定范围内,pH值较低可能会使Cu和AMI的混合物体系协同作用减弱,而pH值为7、8、9的混合物体系在MACR热图中表现的颜色深浅相差较小,没有明显的变化规律,说明其混合物体系之间的毒性相互作用强度相差不大。另外从表3可以看出,pH值为6的条件下,除去没有协同作用的体系,射线R2、R3、R4、R5首次出现协同作用时的混合物浓度均大于其它pH值条件下的浓度,与MACR值较小相匹配,表明MACR可以有效表征混合物毒性相互作用的强度。同时MACR值随pH值的变化规律与前述pEC50值的变化规律十分相似,其具体机制需进一步研究;XU等[18]发现pH会影响个人护理产品成分对Q67发光的刺激效应,个人护理产品组分的毒性在不同的暴露时间下表现出的pH依赖性,因此认为在评估化学品对环境的风险时,应将pH作为一个潜在的环境因素。
-
(1)Cu在低浓度区域对Q67的抑制率较低,抑制率最高的暴露时间点均出现在2 h或4 h,暴露时间为8 h和12 h时,抑制率有所下降,毒性减弱。AMI则对Q67表现出明显的时间依赖毒性。Cu在不同pH值条件下对Q67的毒性大小顺序为(pH=9)>(pH=7)>(pH=8)>(pH=6),AMI在4个pH值条件下的毒性总体来说相差较小,AMI的毒性高Cu的毒性2—3数量级。
(2)Cu和AMI混合物体系毒性具有明显的组分依赖毒性,混合物体系随AMI组分增加,AMI开始对混合体系的毒性效应产生影响,即混合物体系AMI组分越高,混合体系的毒性越大,且随着暴露时间的增长,五条射线的毒性差异更为显著。
(3)不同pH值条件下,pH值为6的混合物体系的pEC50值较小,明显低于pH值为7、8、9混合物体系的pEC50值,pH值为7、8、9的混合物体系之间的毒性值则相差不大。
(4)4个pH值条件下的混合物体系共20条射线,存在协同或加和作用;pH值为6的混合物体系的MACR值低于pH值为7、8、9混合物体系的MACR值,即pH值较低的混合物体系出现的协同作用强度较弱,pH值为7、8、9的混合物体系之间的MACR值则相差不大,毒性相互作用强度较为一致;同时发现pH值较低的混合物体系首次出现协同作用时的混合物浓度较大,与计算的MACR值相匹配,表明MACR可以有效表征混合物毒性相互作用的强度。
不同pH值对铜和硫酸阿米卡星的青海弧菌时间依赖毒性相互作用的影响
Effects of different pH values on the time-dependent toxic interactions of copper and Amikacin sulfate in Vibrio qinghaiensis sp. -Q67
-
摘要: 自然条件下,污染物以各种形式或浓度混合存在,其累积毒性与相互作用对环境健康存在潜在风险,而pH对化学物质的毒性产生非常重要的作用。为了探究不同pH值下污染物的累积毒性与相互作用,该研究以硫酸阿米卡星(Amikacin sulfate, AMI)和五水硫酸铜(CuSO4·5H2O, Cu)为目标污染物,以青海弧菌(Vibrio qinghaiensis sp. -Q67)为受试生物,选用6.0、7.0、8.0、9.0共4个pH值条件分别进行实验,采用直接均分射线法(Direct equipartition ray, EquRay)设计不同浓度配比的代表性混合物,应用时间毒性微板分析法(Time-dependent microplate toxicity analysis, t-MTA)测定其时间-浓度-效应数据,以独立作用(independent action,IA)为参考模型,分析混合物的毒性相互作用,并应用改进的面积浓度比法(the modified area-concentration ratio method,MACR)评价AMI与Cu之间的毒性相互作用强度。结果表明:(1) Cu在不同pH值条件下对Q67的毒性大小顺序为(pH=9)>(pH=7)>(pH=8)>(pH=6),AMI在4个pH值条件下的毒性总体来说相差较小,AMI的毒性高Cu的毒性2—3数量级。(2) Cu和AMI混合物体系毒性具有明显的组分依赖性,混合物体系随AMI组分增加,毒性呈增大趋势,且随着暴露时间的增长,毒性差异更为显著。(3) 不同pH值条件下,pH值为6的混合物体系的pEC50值较小,明显低于pH值为7、8、9混合物体系的pEC50值,pH值为7、8、9的混合物体系之间的毒性值则相差不大。(4) 4个pH值条件下的混合物体系共20条射线,存在协同或加和作用;pH值为6的混合物体系的MACR值低于pH值为7、8、9混合物体系的值,即pH值较低的混合物体系出现的协同作用强度较弱,pH值为7、8、9的混合物体系之间的MACR值则相差不大,毒性相互作用强度较为一致。Abstract: Pollutants are mixed in various forms or concentrations, and their cumulative toxicity and interaction have potential risks to environmental health under the natural condition. While pH plays a very important role in the toxicity of chemical substances. Using Vibrio qinghaiensis sp.-Q67 (Q67) as the test organism, the cumulative toxicity and interction of mixtures of Amikacin sulfate (AMI) and heavy metal Cu were investigated using the time-dependent microplate toxicity analysis method. The experiments were carried out under four pH conditions of 6.0, 7.0, 8.0 and 9.0, respectively. The representative mixtures with different concentrations and ratios were designed by direct equipartition ray (EquRay). The independent action model (IA) was used as reference to analyze the mixture toxicity interactions. The intensity of toxic interaction between AMI and Cu was evaluated using the modified area-concentration ratio method (MACR) .The results showed that: (1) The toxicity order of Cu to photobaterium Q67 at different pH values was: (pH=9)>(pH=7)>(pH=8)>(pH=6). The toxicity difference of AMI to Q67 at four pH values was relatively small, and the toxicity of AMI was 2—3 orders of magnitude higher than that of Cu. (2) The toxicity of Cu and AMI mixture system was obviously component-dependent. The toxicity of the mixture system increased with the addition of AMI components, and the difference of toxicity was more significant with the extension of exposure time. (3) The mixture system at pH 6 showed the highest toxicity and others had the similar toxicity. (4) There were 20 rays in the mixture system at 4 pH values, and synergistic or additive effects existed; The mixture system at pH 6 showed the lowest MACR values and the synergy effects. The mixture system at pH 7, 8 and 9 had the similar MACR values and toxic interaction intensity.
-

-
表 1 实验试剂的基本性质
Table 1. Basic properties of experimental reagents
化合物名称
Chemical Name简称Abbreviation 分子式
Molecular formulaCAS号
CAS No.分子量/(g·mol−1)
Molecular weight纯度/%
Purity储备液浓度/(mol.L−1)
Stock solution硫酸阿米卡星 AMI C22H45N5O17S 149022-22-0 683.68 ≥97.0 2.0×10−5 五水硫酸铜 Cu CuSO4·5H2O 7758-99-8 249.68 ≥99.0 2.0×10−3 表 2 混合物体系各组分浓度配比(pi)
Table 2. Concentration ratio of each component in mixture system (pi)
射线 pH=6 pH=7 pH=8 pH=9 pCu pAMI pCu pAMI pCu pAMI pCu pAMI R1 9.998×10−1 2.200×10−4 9.998×10−1 2.400×10−4 9.998×10−1 2.300×10−4 9.998×10−1 2.300×10−4 R2 9.995×10−1 5.500×10−4 9.994×10−1 5.900×10−4 9.994×10−1 5.700×10−4 9.994×10−1 5.700×10−4 R3 9.989×10−1 1.110×10−3 9.988×10−1 1.180×10−3 9.989×10−1 1.130×10−3 9.989×10−1 1.150×10−3 R4 9.978×10−1 2.210×10−3 9.976×10−1 2.360×10−3 9.977×10−1 2.260×10−3 9.977×10−1 2.290×10−3 R5 9.945×10−1 5.510×10−3 9.941×10−1 5.880×10−3 9.944×10−1 5.630×10−3 9.943×10−1 5.710×10−3 表 3 各射线首次出现协同作用时混合物的浓度
Table 3. The concentration of the mixture when the rays first act synergistically
pH R1 R2 R3 R4 R5 pH=6 — 2.95×10−4 2.21×10−4 8.87×10−5 5.89×10−5 pH=7 — 1.58×10−4 9.31×10−5 2.61×10−5 1.96×10−5 pH=8 4.76×10−4 2.56×10−4 7.68×10−5 4.95×10−5 2.70×10−5 pH=9 — 1.76×10−4 1.07×10−4 4.29×10−5 2.94×10−5 注:“—”表示该条件下没有出现协同作用. Note: “—” indicates that there is no synergistic effect under this condition. -
[1] SERNA-GALVIS E A, MONTOYA-RODRÍGUEZ D, ISAZA-PINEDA L, et al. Sonochemical degradation of antibiotics from representative classes-Considerations on structural effects, initial transformation products, antimicrobial activity and matrix [J]. Ultrasonics Sonochemistry, 2019, 50: 157-165. doi: 10.1016/j.ultsonch.2018.09.012 [2] JJEMBA P K. The potential impact of veterinary and human therapeutic agents in manure and biosolids on plants grown on arable land: A review [J]. Agriculture, Ecosystems & Environment, 2002, 93(1/2/3): 267-278. [3] LIU Y, GAO B Y, YUE Q Y, et al. Influences of two antibiotic contaminants on the production, release and toxicity of microcystins [J]. Ecotoxicology and Environmental Safety, 2012, 77: 79-87. doi: 10.1016/j.ecoenv.2011.10.027 [4] CHRISTIAN T, SCHNEIDER R J, FÄRBER H A, et al. Determination of antibiotic residues in manure, soil, and surface waters [J]. Acta Hydrochimica et Hydrobiologica, 2003, 31(1): 36-44. doi: 10.1002/aheh.200390014 [5] 张晓娇, 柏杨巍, 张远, 等. 辽河流域地表水中典型抗生素污染特征及生态风险评估 [J]. 环境科学, 2017, 38(11): 4553-4561. doi: 10.13227/j.hjkx.201704206 ZHANG X J, BAI Y W, ZHANG Y, et al. Occurrence, distribution, and ecological risk of antibiotics in surface water in the Liaohe River Basin, China [J]. Environmental Science, 2017, 38(11): 4553-4561(in Chinese). doi: 10.13227/j.hjkx.201704206
[6] 封丽, 程艳茹, 封雷, 等. 三峡库区主要水域典型抗生素分布及生态风险评估 [J]. 环境科学研究, 2017, 30(7): 1031-1040. doi: 10.13198/j.issn.1001-6929.2017.02.33 FENG L, CHENG Y R, FENG L, et al. Distribution of typical antibiotics and ecological risk assessment in main waters of Three Gorges reservoir area [J]. Research of Environmental Sciences, 2017, 30(7): 1031-1040(in Chinese). doi: 10.13198/j.issn.1001-6929.2017.02.33
[7] BROWN K D, KULIS J, THOMSON B, et al. Occurrence of antibiotics in hospital, residential, and dairy effluent, municipal wastewater, and the Rio Grande in New Mexico [J]. Science of the Total Environment, 2006, 366(2/3): 772-783. [8] 董欣琦, 陈敏, 张瑾, 等. 氨基糖苷类抗生素混合物对蛋白核小球藻的时间依赖毒性 [J]. 安徽建筑大学学报, 2016, 24(6): 67-73. doi: 10.11921/j.issn.2095-8382.20160615 DONG X Q, CHEN M, ZHANG J, et al. Time-dependent toxicity of aminoglycoside antibiotics to Chlorella pyrenoidosa [J]. Journal of Anhui Jianzhu University, 2016, 24(6): 67-73(in Chinese). doi: 10.11921/j.issn.2095-8382.20160615
[9] WOLLENBERGER L, HALLING-SØRENSEN B, KUSK K O. Acute and chronic toxicity of veterinary antibiotics to Daphnia magna [J]. Chemosphere, 2000, 40(7): 723-730. doi: 10.1016/S0045-6535(99)00443-9 [10] 陈敏, 张瑾, 董欣琪, 等. 多元抗生素与重金属混合物对蛋白核小球藻的时间依赖性协同与拮抗作用 [J]. 农业环境科学学报, 2018, 37(5): 850-859. doi: 10.11654/jaes.2017-1159 CHEN M, ZHANG J, DONG X Q, et al. Time-dependent synergism and antagonism within multi-component mixtures of heavy metals and antibiotics towards Chlorella pyrenoidosa [J]. Journal of Agro-Environment Science, 2018, 37(5): 850-859(in Chinese). doi: 10.11654/jaes.2017-1159
[11] SIEBINGA H, ROBB F, THOMSON A H. Population pharmacokinetic evaluation and optimization of amikacin dosage regimens for the management of mycobacterial infections [J]. Journal of Antimicrobial Chemotherapy, 2020, 75(10): 2933-2940. doi: 10.1093/jac/dkaa277 [12] PAN K, WANG W X. Trace metal contamination in estuarine and coastal environments in China [J]. Science of the Total Environment, 2012, 421/422: 3-16. doi: 10.1016/j.scitotenv.2011.03.013 [13] ISLAM M S, AHMED M K, HABIBULLAH-AL-MAMUN M, et al. Assessment of trace metals in fish species of urban rivers in Bangladesh and health implications [J]. Environmental Toxicology and Pharmacology, 2015, 39(1): 347-357. doi: 10.1016/j.etap.2014.12.009 [14] 陈瑞. 不同水质参数以及抗生素存在条件下铜对剑水蚤的毒性影响[D]. 昆明: 昆明理工大学, 2017. CHEN R. Toxic effect of copper on Cyclops under different water quality parameters and antibiotic[D]. Kunming: Kunming University of Science and Technology, 2017(in Chinese).
[15] 刘树深, 张瑾, 张亚辉, 等. APTox: 化学混合物毒性评估与预测 [J]. 化学学报, 2012, 70(14): 1511-1517. doi: 10.6023/A12050175 LIU S S, ZHANG J, ZHANG Y H, et al. APTox: Assessment and prediction on toxicity of chemical mixtures [J]. Acta Chimica Sinica, 2012, 70(14): 1511-1517(in Chinese). doi: 10.6023/A12050175
[16] 荣宏伟, 李健中, 张可方. 环境因素对铜离子毒性的影响 [J]. 广州大学学报(自然科学版), 2011, 10(2): 74-78. RONG H W, LI J Z, ZHANG K F. The effects of environmental factors on copper toxicity [J]. Journal of Guangzhou University (Natural Science Edition), 2011, 10(2): 74-78(in Chinese).
[17] 赵娜, 冯鸣凤, 朱琳. 不同pH值条件下Cr6+对小球藻和斜生栅藻的毒性效应 [J]. 东南大学学报(医学版), 2010, 29(4): 382-386. ZHAO N, FENG M F, ZHU L. Toxic effects of chromium(Cr6+) on Chlorella vulgaris and Scenedesmus obliquus at different pH [J]. Journal of Southeast University (Medical Science Edition), 2010, 29(4): 382-386(in Chinese).
[18] XU Y Q, LIU S S, CHEN F, et al. pH affects the hormesis profiles of personal care product components on luminescence of the bacteria Vibrio qinghaiensis sp.-Q67 [J]. Science of the Total Environment, 2020, 713: 136656. doi: 10.1016/j.scitotenv.2020.136656 [19] YAO L, ZHAO J L, LIU Y S, et al. Personal care products in wild fish in two main Chinese rivers: Bioaccumulation potential and human health risks [J]. Science of the Total Environment, 2018, 621: 1093-1102. doi: 10.1016/j.scitotenv.2017.10.117 [20] 韦东普. 应用发光细菌法测定我国土壤中铜、镍毒性的研究[D]. 北京: 中国农业科学院, 2010. WEI D P. Application of bioluminescent bacteria bioassay on determination the toxicity of copper and nickel in Chinese soils[D]. Beijing: Chinese Academy of Agricultural Sciences, 2010(in Chinese).
[21] DOU R N, LIU S S, MO L Y, et al. A novel direct equipartition ray design (EquRay) procedure for toxicity interaction between ionic liquid and dichlorvos [J]. Environmental Science and Pollution Research International, 2011, 18(5): 734-742. doi: 10.1007/s11356-010-0419-7 [22] 袁静, 刘树深, 王丽娟, 等. 蛋白核小球藻(Chlorella pyrenoidosa)微板毒性分析方法优化 [J]. 环境科学研究, 2011, 24(5): 553-558. YUAN J, LIU S S, WANG L J, et al. Optimization of microplate toxicity analysis method based on Chlorella pyrenoidose [J]. Research of Environmental Sciences, 2011, 24(5): 553-558(in Chinese).
[23] HUANG W Y, LIU F, LIU S S, et al. Predicting mixture toxicity of seven phenolic compounds with similar and dissimilar action mechanisms to Vibrio qinghaiensis sp. nov. Q67 [J]. Ecotoxicology and Environmental Safety, 2011, 74(6): 1600-1606. doi: 10.1016/j.ecoenv.2011.01.007 [24] 覃礼堂, 刘树深, 莫凌云. 改进的整合加和模型INFCIM及其应用于混合物毒性预测 [J]. 中国环境科学, 2014, 34(7): 1890-1896. QIN L T, LIU S S, MO L Y. Improved integrated addition model INFCIM and its application on prediction of mixture toxicity [J]. China Environmental Science, 2014, 34(7): 1890-1896(in Chinese).
[25] 王滔, 张瑾, 卞志强, 等. 2种经典模型对抗生素与重金属锌的蛋白核小球藻时间依赖联合毒性作用的评估比较 [J]. 生态毒理学报, 2019, 14(4): 130-139. WANG T, ZHANG J, BIAN Z Q, et al. Comparative evaluation on the time-dependent joint toxicity of antibiotics and heavy metal zinc towards Chlorella pyrenoidosa between two classical models [J]. Asian Journal of Ecotoxicology, 2019, 14(4): 130-139(in Chinese).
[26] TAO M T, ZHANG J, LUO Z Z, et al. Dynamic and quantitative characterization of antagonism within disinfectant mixtures by a modified area-concentration ratio method [J]. Ecotoxicology and Environmental Safety, 2021, 221: 112455. doi: 10.1016/j.ecoenv.2021.112455 [27] 陈琼, 张瑾, 李小猛, 等. 几种抗生素对蛋白核小球藻的时间毒性微板分析法 [J]. 生态毒理学报, 2015, 10(2): 190-197. doi: 10.7524/AJE.1673-5897.20140630004 CHEN Q, ZHANG J, LI X M, et al. Time-dependent microplate toxicity analysis(T-MTA) of several antibiotics to Chlorella pyrenoidosa [J]. Asian Journal of Ecotoxicology, 2015, 10(2): 190-197(in Chinese). doi: 10.7524/AJE.1673-5897.20140630004
[28] 陈敏. 抗生素与重金属混合物对蛋白核小球藻的时间依赖毒性作用研究[D]. 合肥: 安徽建筑大学, 2017: 34-38. CHEN M. Study on the time-dependent toxicity interaction within mixtures of antibiotics and heavy metals to Chlorella pyrenoidosa[D]. Hefei: Anhui Jianzhu University, 2017: 34-38. (in Chinese).
[29] 宋晓青, 刘树深, 刘海玲, 等. 部分除草剂与重金属混合物对发光菌的毒性 [J]. 生态毒理学报, 2008, 3(3): 237-243. SONG X Q, LIU S S, LIU H L, et al. Mixture toxicity of herbicides and heavy metal compounds to photobacteria (Vibrio qinghaiensis sp.-Q67) [J]. Asian Journal of Ecotoxicology, 2008, 3(3): 237-243(in Chinese).
[30] 陶梦婷, 张瑾, 姜慧, 等. 3种农药对青海弧菌Q67的联合毒性作用特征 [J]. 环境科学与技术, 2019, 42(6): 12-20. doi: 10.19672/j.cnki.1003-6504.2019.06.002 TAO M T, ZHANG J, JIANG H, et al. Combined toxicity characteristics of three pesticides to Vibrio qinghaiensis sp.-Q67 [J]. Environmental Science & Technology, 2019, 42(6): 12-20(in Chinese). doi: 10.19672/j.cnki.1003-6504.2019.06.002
[31] QIN L T, LIU S S, ZHANG J, et al. A novel model integrated concentration addition with independent action for the prediction of toxicity of multi-component mixture [J]. Toxicology, 2011, 280(3): 164-172. doi: 10.1016/j.tox.2010.12.007 [32] 班龙科, 丁婷婷, 陈敏, 等. 五种重金属对蛋白核小球藻的动态毒性研究 [J]. 安徽建筑大学学报, 2017, 25(4): 24-28. doi: 10.11921/j.issn.2095-8382.20170406 BAN L K, DING T T, CHEN M, et al. Study on the dynamic toxiciy of five heavy metals on Chlorella pyrenodosa [J]. Journal of Anhui Jianzhu University, 2017, 25(4): 24-28(in Chinese). doi: 10.11921/j.issn.2095-8382.20170406
[33] 宋崇崇, 陶梦婷, 张瑾, 等. 抗生素与重金属对蛋白核小球藻时间依赖协同作用的动态定量表征 [J]. 环境化学, 2021, 40(6): 1691-1704. doi: 10.7524/j.issn.0254-6108.2021011503 SONG C C, TAO M T, ZHANG J, et al. Dynamic and quantitative characterization of time-dependent synergism between antibiotics and heavy metals on Chlorella pyrenoidosa [J]. Environmental Chemistry, 2021, 40(6): 1691-1704(in Chinese). doi: 10.7524/j.issn.0254-6108.2021011503
[34] 丁婷婷, 董欣琪, 张瑾, 等. 3种氨基糖苷类抗生素对水生生物的时间依赖联合毒性作用比较 [J]. 生态毒理学报, 2018, 13(1): 126-137. doi: 10.7524/AJE.1673-5897.20170528001 DING T T, DONG X Q, ZHANG J, et al. Comparison of time-dependent joint toxicity interaction of three aminoglycosides antibiotics between two aquatic organisms [J]. Asian Journal of Ecotoxicology, 2018, 13(1): 126-137(in Chinese). doi: 10.7524/AJE.1673-5897.20170528001
[35] FULLADOSA E, MURAT J C, VILLAESCUSA I. Study on the toxicity of binary equitoxic mixtures of metals using the luminescent bacteria Vibrio fischeri as a biological target [J]. Chemosphere, 2005, 58(5): 551-557. doi: 10.1016/j.chemosphere.2004.08.007 [36] LUO X S, LI L Z, ZHOU D M. Effect of cations on copper toxicity to wheat root: Implications for the biotic ligand model [J]. Chemosphere, 2008, 73(3): 401-406. doi: 10.1016/j.chemosphere.2008.05.031 -




 下载:
下载: