-
浮游植物是生活在河流、湖泊、海洋等水体中的一类营光合作用的微型生物,含原核生物(蓝藻)和各种真核生物. 浮游植物群落结构受各种环境因素和污染物的影响,当水体中的氮、磷、硅等营养物质过量时,浮游植物会暴发性增殖形成赤潮(也称藻华)[1]. 赤潮暴发可对渔业、海洋资源、水产养殖、公共健康等造成直接或间接的危害[2]. 赤潮暴发期会造成养殖水体光照、二氧化碳等严重不足,从而破坏水体生态系统. 赤潮消亡时由于微生物分解作用也会造成水体缺氧而引发水生生物的死亡. 同时,一些赤潮种,如亚历山大藻(Alexandrium spp.)可产生毒素并通过食物链在水生生物体内富集或引起鱼类死亡[3].
裸甲藻类是我国近海常见的一类赤潮生物,其中链状裸甲藻(Gymnodinium catenatum)已经在澳大利亚、墨西哥、日本等23个国家引发赤潮[3–4]. 链状裸甲藻可产生麻痹性贝类毒素,2017年我国福建省沿海海域发生了由该藻引起的数十人中毒事件[5]. 伊姆裸甲藻(Gymnodinium impudicum)是裸甲藻属(Gymnodinium)下的另一常见赤潮肇事种,已在埃及、韩国、西班牙等多地暴发赤潮[6–8]. 该种与链状裸甲藻形态极为相近,常发生两种藻鉴定混淆的情况,如发生在帕加西蒂科斯湾(Pagassitikos Gulf)的链状裸甲藻赤潮后经鉴定肇事藻应为伊姆裸甲藻[8],因此推测伊姆裸甲藻赤潮的暴发频数可能因错误鉴定而被低估.
广东省海门湾位于练江流域入海口. 根据2020至2022年海门湾闸桥断面监测站点每月入海河流监测信息显示,该区域过去3年水质污染严重[9] . 2021年8月,广东省海门湾暴发了一起裸甲藻类赤潮,本文对此次赤潮进行了采样,对肇事种进行形态学鉴定与系统发育学分析,并探究了赤潮种的温度适应性、溶血活性和急性生物毒性,以期为我国近海有毒有害赤潮的监测与研究提供参考.
-
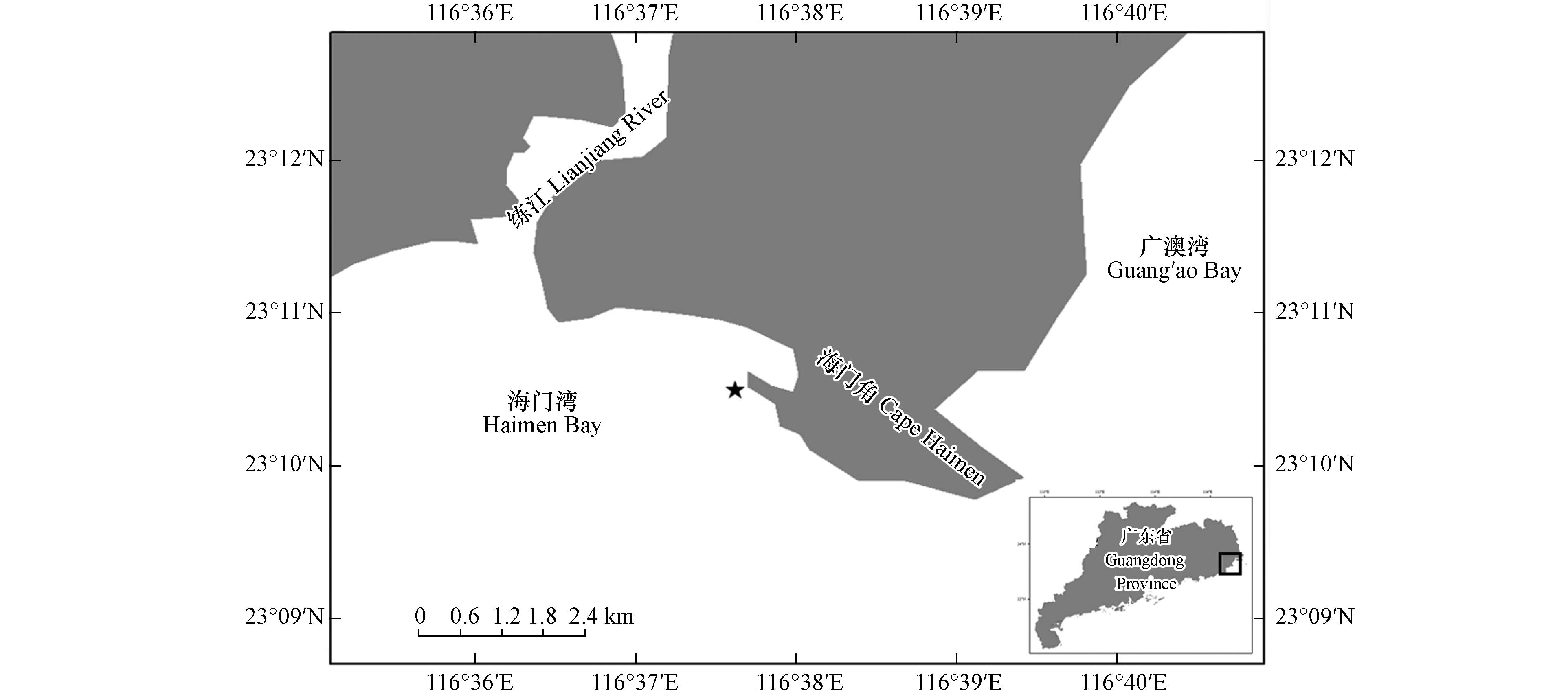
于2021年8月26日于赤潮暴发区采集海水样品(图1),使用采水器采集现场表层水样,混匀后装入1 L广口塑料瓶,保存现场活体水样和固定样品各一份. 固定样品使用Lugol’s液固定,于实验室内在显微镜下进行藻类鉴定和计数藻密度. 活体水样带回实验进行藻类分离培养及急性生物毒性研究. 使用多参数水质分析仪(YSI-professional,USA)测定采样站位(23°10′30′′N,116°37′39′′E)的现场水温、盐度、溶解氧、pH等环境因子.
-
使用玻璃毛细管对赤潮肇事种进行分离,单细胞以L1培养基培养于96孔板中,培养温度为(20±1) ℃,光照强度为120 μmol·m−2·s−1,光暗周期12 h:12 h. 藻细胞生长15 d后将其转移培养在含50 mL L1培养基的玻璃试管中生长.
-
使用研究型荧光显微镜(Olympus BX61,Japan)对本次赤潮肇事种进行观察,用Image-pro Plus6.0进行图像采集,并随机挑选50个细胞测量大小. 吸取1 mL藻液加入SYBR® Safe DNA Gel Stain染料(Invitrogen,S33102)对藻细胞核染色10 min,在荧光显微镜下观察细胞核形态与位置. 使用戊二醛(终浓度为2.5%)对肇事种样品进行固定,4 °C下静置12 h,随后用不同浓度(10%、30%、50%、70%、90%、100%)酒精进行梯度脱水,使用二氧化碳超临界点干燥仪(CPD300,Leica,Wetzler,Germany)对样品进行干燥处理,使用电子溅射仪(Leica EM SCD 500,Leica,Wetzler,Germany)对干燥后的样品进行喷金处理,最后在扫描电子显微镜(Carl Zeiss Inc,Oberkochen,Germany)下观察藻细胞的电子显微结构.
-
DNA提取与扩增:取赤潮藻纯培养液50 mL,按照HP Plant DNA Kit提取试剂盒(Omega Bio-tek Inc,USA)提供的实验流程提取纯培养藻细胞DNA. 以藻细胞DNA为模板,以D1R(5'-ACCCGCTGAATTTAAGCATA-3'),D3B(5′-GCATCGCCAGTTCTGCTTACC-3′)为引物[10]对其LSU rDNA基因进行扩增. 使用ITSA (5′-CAAGCTTCTAGATCGTAACAAGGHTCCGTAGGT-3'),ITSB (5′-CTGCAGTCGACAKATGCTTAARTTCAGCRGG-3′)[11]引物对其ITS rDNA序列进行扩增. PCR反应程序:94 ℃预变性30 s,98 ℃变性10 s,56 ℃退火30 s,共34个循环;最后72 ℃延伸2 min. PCR扩增产物送往生工生物工程有限公司(上海)进行测序. 所得到的LSU rDNA和ITS序列提交至GenBank (https://www.ncbi.nlm.nih.gov/genbank/). PCR扩增获得的伊姆裸甲藻LSU rDNA(D1–D3区)和ITS rDNA片段长度分别为930 bp (Genbank收录号:OP278931)、549 bp (Genbank收录号:ON795173).
系统发育分析:将所获得的LSU rDNA和ITS rDNA序列在GenBank数据库进行BLAST同源性检测,下载近缘序列,通过MEGA6软件采用最大似然法(Maximum likelihood,ML)构建系统发育树,使用MrBayes3.2.6软件构建贝叶斯树(Bayesian inference,BI). ML分析时进行1000次随机重复取样,并通过自展分析检验分支置信度.
-
赤潮水样对海洋青鳉鱼的急性生物毒性实验:用2.5 L的白色塑料桶采集1.5 L的现场赤潮水样(藻细胞密度为3.39×103 cells·mL−1),向其中放入15尾健康、运动力强、大小一致(约30日龄)的海洋青鳉鱼幼鱼对其进行观察,于0 h、6 h、12 h、24 h、48 h记录幼鱼死亡数. 本实验每组设置3个平行,以无藻细胞的过滤海水为空白对照组.
赤潮肇事藻细胞对卤虫的急性生物毒性实验:在6孔细胞培养板中加入10 mL实验室纯培养的赤潮藻藻液(藻细胞密度为4.32×103 cells·mL−1),取20尾健康、运动力强、大小一致的卤虫加入到各孔对其进行观察,于0 h、6 h、12 h、24 h、48 h记录卤虫死亡数量,以卤虫在碰触10 s内附肢无明显摆动判定为死亡标准. 本实验每组设置3个平行,以无藻细胞的L1培养基为空白对照组.
-
赤潮肇事种纯培养细胞溶血毒素的提取方法参照Eschbach等[12],溶血活性测定方法参照周成旭等[13]并加以改进. 取50 mL的赤潮肇事种纯培养液(藻细胞密度为3.66×103 cells·mL−1) 5000 r·min−1离心10 min,弃上清后加入2 mL的溶血毒素缓冲液进行超声破碎,得到溶血毒素提取液. 取1 mL的EDTA抗凝兔血加入兔血缓冲液洗涤兔血2次,并配制为0.6%的兔血红细胞溶液备用. 随后取溶血毒素缓冲液、兔血缓冲液、0.6%兔血红细胞溶液、溶血毒素提取液各150 μL,按照反应体系配制在光照强度为100 μmol·m−2·s−1的环境中反应5 h,3000 r·min−1离心10 min,取上清液在414 nm波长下测得吸光值. 将所得吸光值代入溶血百分数计算公式得到赤潮肇事种的溶血活性百分数.
其中,As为溶血毒素提取液加兔血红细胞溶液反应后的吸光值;Ab为溶血毒素提取液加兔血缓冲液反应后的吸光值;Aa为毒素缓冲液加兔血红细胞溶液反应后的吸光值;Ac为TritonX·100加兔血红细胞溶液反应后的吸光值.
每个实验组设置3个平行,以无溶血活性[13]的钝头原甲藻(Prorocentrum obtusidens,曾命名为东海原甲藻) (藻细胞浓度为4.89×103 cells·mL−1)为阴性对照组,以灭菌的天然海水为空白对照组.
-
将于温度20 ℃、盐度27条件下保种的赤潮肇事种进行扩大培养至1 L. 随后将藻细胞转接培养于4个500 mL锥形瓶中,分别置于20℃、25℃、30℃、33℃ 等温度的光照培养箱培养2代(培养箱光照周期14 h:10 h,光照强度(100—120) μmol·m−2·s−1). 随后将4个温度下藻细胞再次转接,使得藻液初始密度为5.00×102 cells·mL−1,将其置于4个温度下观察藻细胞对温度的适应性. 每隔2天取混匀藻液0.5 mL于正置显微镜(Olympus CX31,Japan)下,使用浮游植物计数框进行计数,每次计数0.1 mL,每个样品计数3次,根据所得密度计算伊姆裸甲藻不同温度下的比生长速率(specific growth rate,μ). 同时,取混匀藻液1 mL,黑暗处理15 min,使用浮游植物荧光仪(PHYTO−ED,Germany)测定不同温度组不同时间藻细胞的最大光化学效率(Fv/Fm).
其中,Nt和N0分别为培养第t天和刚接种时的藻细胞密度[14].
-
使用Origin2018、ArcMap10.7软件绘图,实验数据采用IBM SPSS Statistics22软件进行统计学分析,组间差异比较采用单因素方差分析(one-way ANOVA),多重比较检验采用Fisher’s least significant difference(LSD)法,当P < 0.05时为差异显著.
-
本次赤潮于2021年8月24日—8月29日期间暴发于我国广东省海门湾(23°10′30′′N,116°37′39′′E),现场藻细胞密度为3.39×103 cells·mL−1,已达到赤潮标准密度(赤潮生物细胞大小在10—29 μm范围内,密度超过1×103 cells·mL−1可定义为赤潮[15]). 其中,主优势种密度为2.75×103 cells·mL−1. 赤潮发生时,海域水温为26.1 ℃,盐度32.77,溶解氧为5.84 mg·L−1,pH为8.27. 本次赤潮面积为7.8 km2,赤潮期间未出现海洋生物异常死亡或人员中毒事件[16].
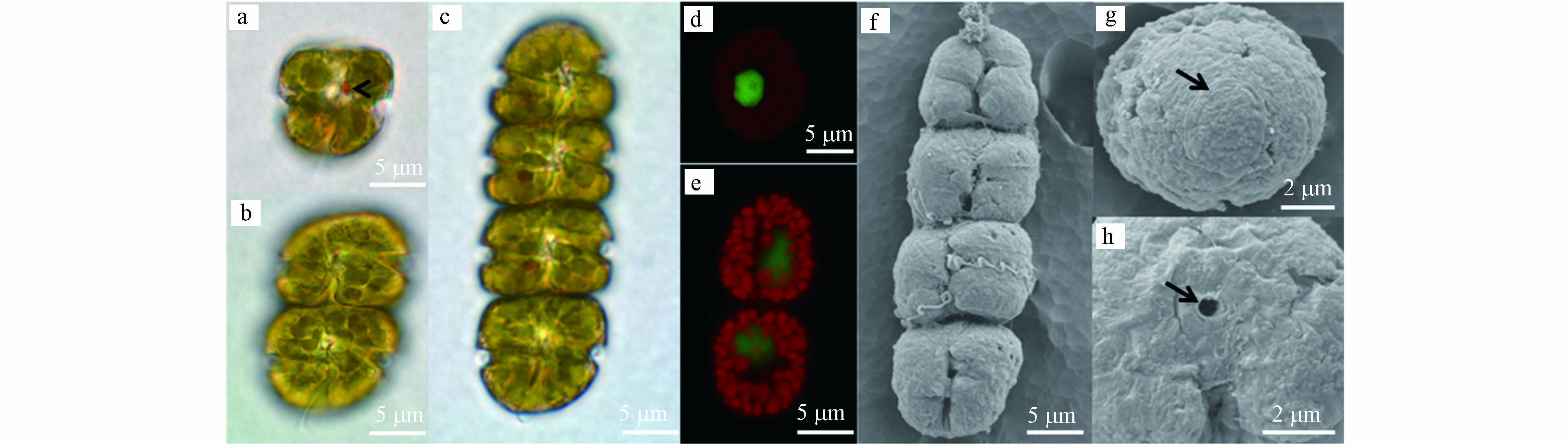
对赤潮优势种形态学鉴定结果表明,该种细胞长14.2—26.1 μm,平均为(20.5±2.9)μm (n=50),宽13.2—23.6 μm,平均为(18.6±2.4) μm (n=50),常见形态为2或4个细胞组成的链状结构,偶有8细胞链状结构或单细胞形态(图 2a—c). 链状群体顶端细胞上壳部呈半圆球状,下壳部扁平,链中细胞上壳部和下壳部的顶端扁平(图2c). 细胞核圆形,位于细胞中央(图 2d). 叶绿体数量多,位于细胞的外周部(图 2e). 细胞间通过细胞顶端的连接孔彼此相连成链状(图2h). 细胞的横沟始末位移约为2倍横沟宽度,横沟截距为细胞全长的1/3—1/4. 纵沟狭窄,且入侵到上壳顶部. 细胞顶沟呈“鱼钩”状(图2g). 光学显微镜下,该种具有清晰可见的红色眼点(图2a). 细胞呈快速直线游动或静止不游动两种状态,扩大培养期间发现水体中有粘液产生. 该种细胞形态(包含细胞链长、顶沟结构)、游动状态和粘液分泌等特征符合文献[8]对伊姆裸甲藻的描述.
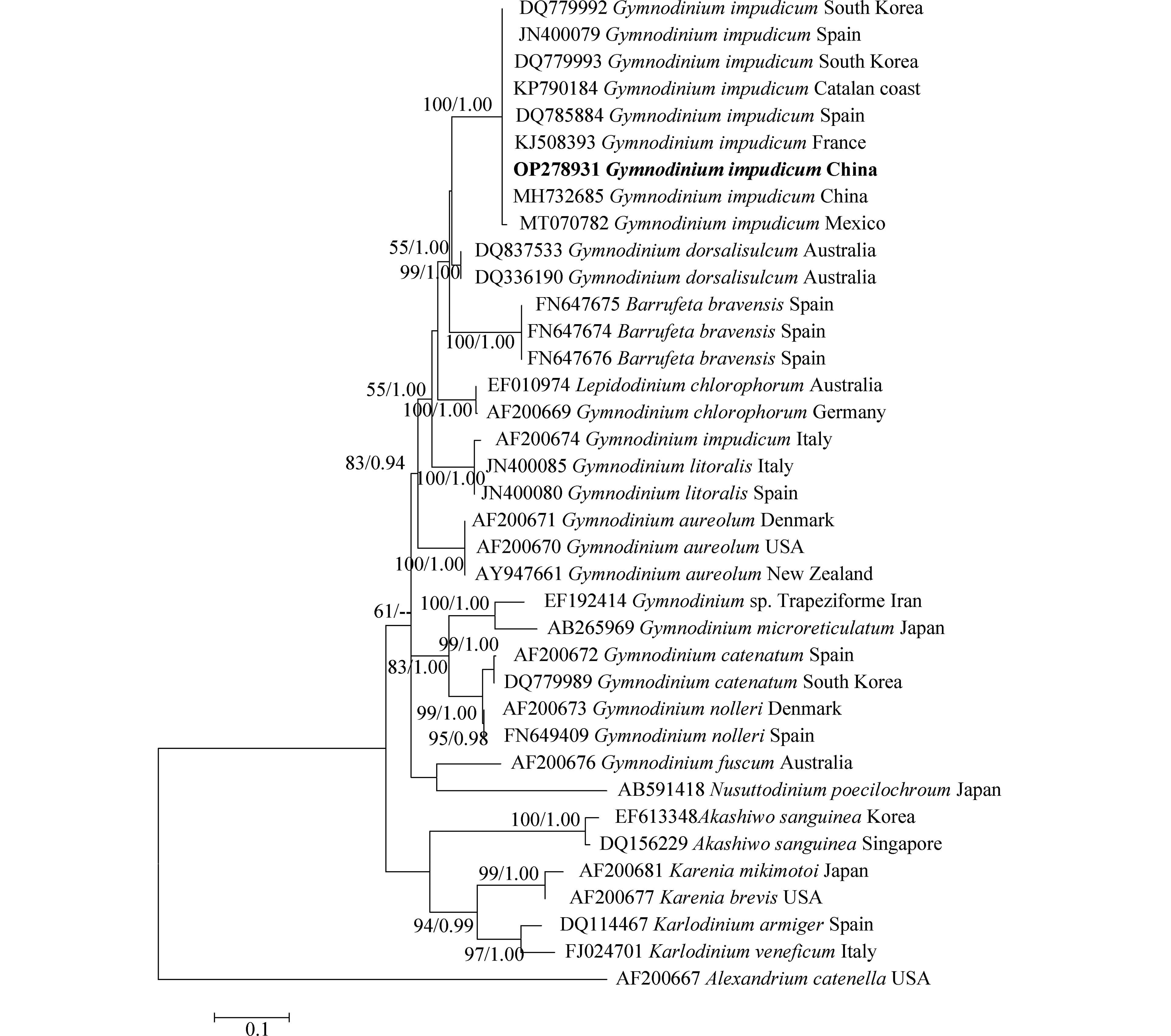
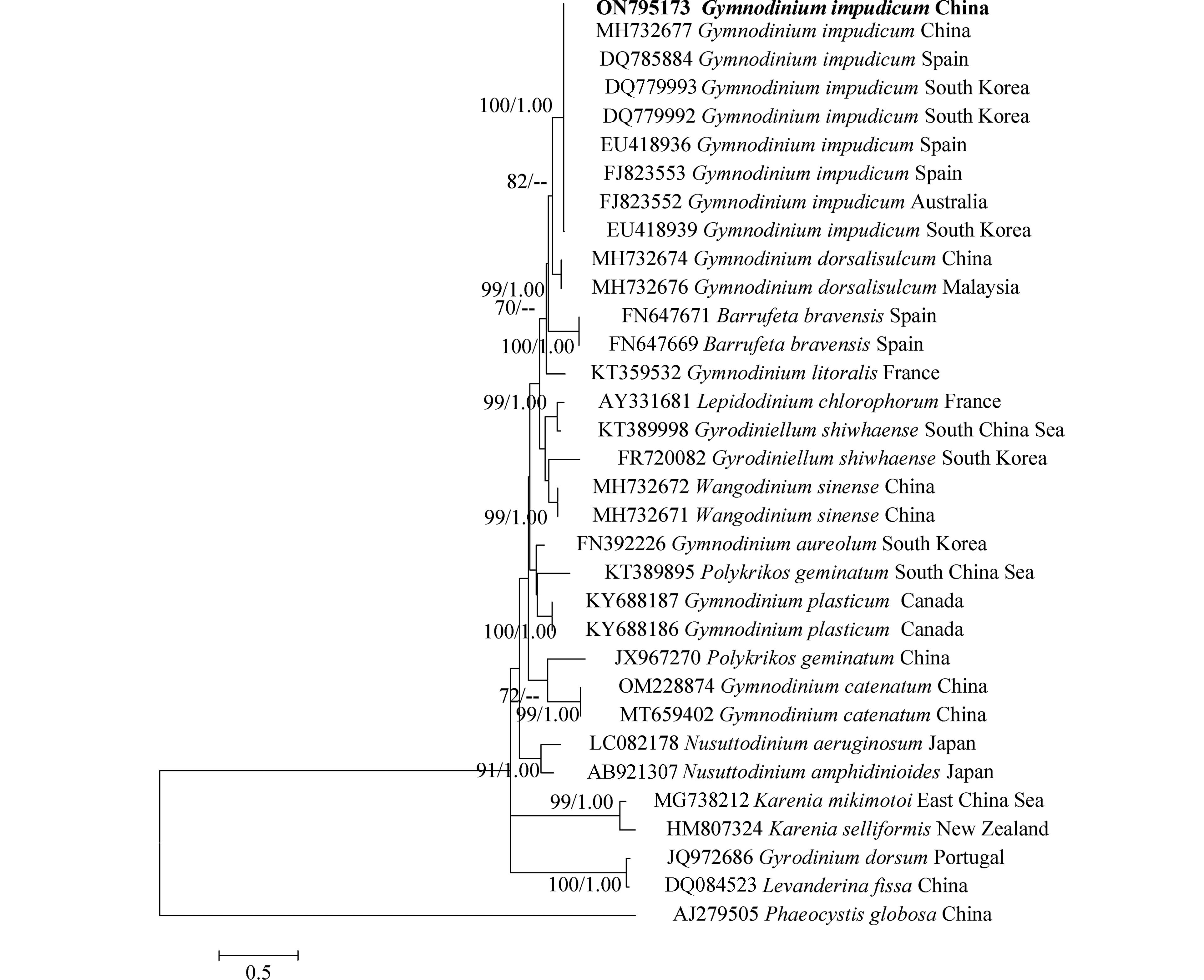
对PCR扩增的LSU rDNA和ITS rDNA产物进行测序,于GenBank中比对并下载其近缘序列37条和33条,以甲藻纲(Dinophycene)的链状亚历山大藻(Alexandrium catenella)和定鞭藻纲(Aptophyceae)的球形棕囊藻(Phaeocystis globosa)为外类群构建系统发育树. ML树与BI树形基本一致,系统发育树显示:本研究分离的伊姆裸甲藻与法国、西班牙、墨西哥等多个国家沿海海域的伊姆裸甲藻聚在一个分支中,置信值为100/1.00. 本株系与分离自我国渤海海域的伊姆裸甲藻(Genbank收录号:MH732685、MH732677)序列一致,位于同一分支,置信值为100/1.00(图3,图4).
综上,经形态学和分子特征序列分析,本次赤潮优势种为伊姆裸甲藻. 伊姆裸甲藻隶属于甲藻纲(Dinophycene),裸甲藻目(Gymnodiniales),裸甲藻科(Gymnodiniaceae),裸甲藻属(Gymnodinium). 该藻分布广泛,在澳大利亚、韩国、葡萄牙、西班牙、新西兰、意大利等全球多个国家沿海海域都有报道[17]. 伊姆裸甲藻是加泰罗尼亚海岸(Catalonia)夏季浮游植物主要优势种之一,在巴塞罗那港口(Barcelona harbor)频繁暴发赤潮[18]. 自1980s以来,韩国沿海水域每年9、10月都会暴发以伊姆裸甲藻为主要优势种的赤潮[6]. 伊姆裸甲藻在我国渤海海域也有发现[19],但南海海域并无该种暴发赤潮的有关记录. 此次报道为伊姆裸甲藻首次在我国南海海域暴发赤潮。
-
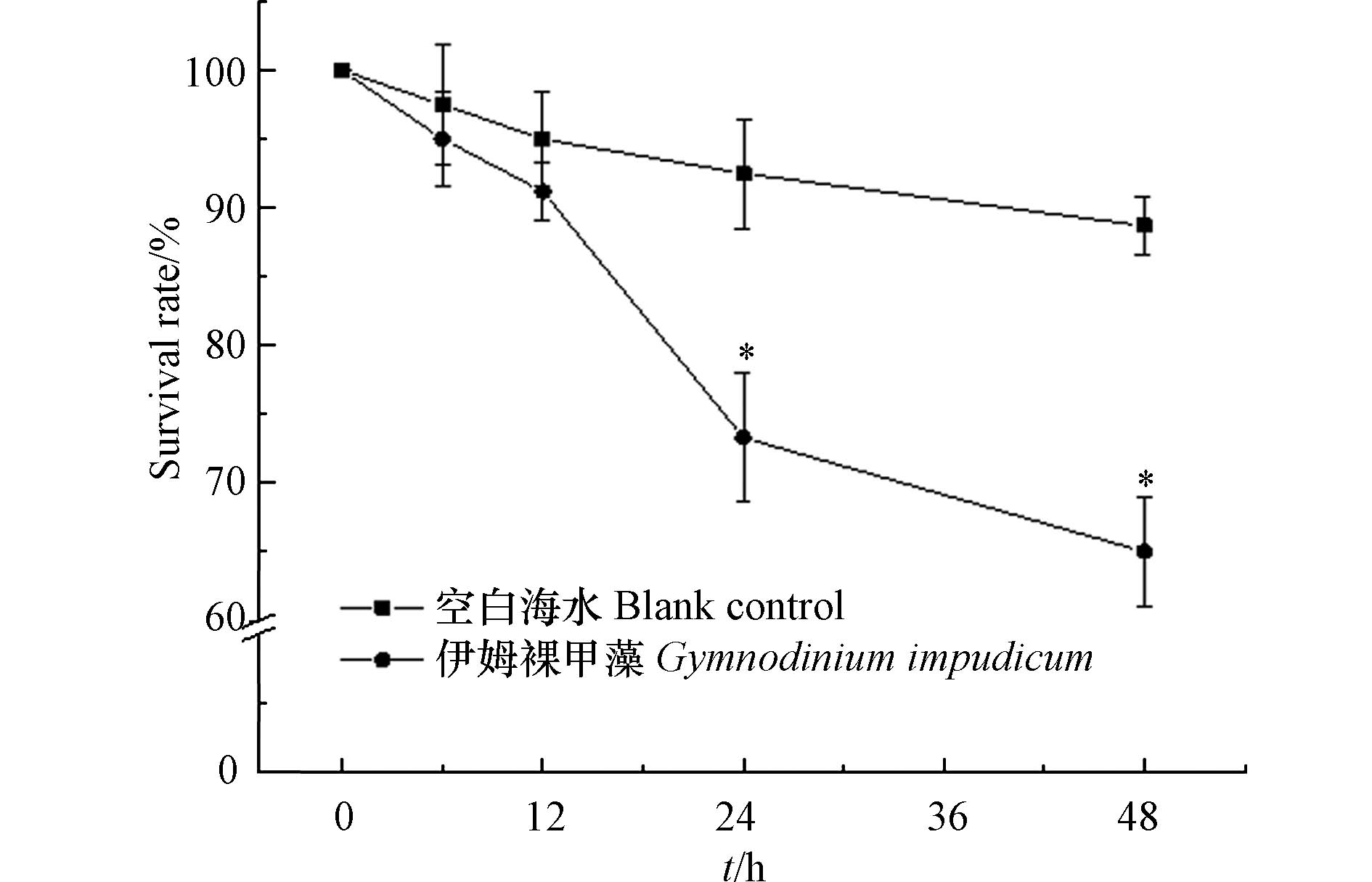
伊姆裸甲藻纯培养藻液对卤虫持续48 h暴露结果显示,该藻纯培养藻液对卤虫具有毒性(藻密度为4.32×103 cells·mL−1),随着暴露时间的延长,实验组卤虫的死亡率升高:24 h时实验组卤虫存活率为73.33%±4.7%,显著低于空白对照组(92.5%±4%) (P < 0.05);48 h时,实验组卤虫存活率降低为65%±4%,显著低于空白组(88.7%±2.1%) (P < 0.05) (图5). Farga等[8]对伊姆裸甲藻纯培养藻细胞的毒性进行研究,结果表明伊姆裸甲藻对小鼠无毒害,高效液相色谱(HPLC)未检测到PSP的存在. 本文对置于伊姆裸甲藻纯培养藻液的卤虫观察发现,部分卤虫被藻细胞分泌的粘液所黏附且无法挣脱,逐渐失去自由运动能力进而死亡(图6). 推测伊姆裸甲藻可能通过分泌某种粘性物质导致海洋生物的死亡,伊姆裸甲藻赤潮暴发对养殖渔业的潜在危害不容忽视. 现场赤潮水样对海洋青鳉鱼幼鱼的急性生物毒性实验显示,海洋青鳉鱼48 h内未出现死亡现象,幼鱼游泳行为正常,表明本次赤潮水样对海洋青鳉鱼无致死效应. 有研究表明伊姆裸甲藻在增殖过程中会产生一种胞外粘性多糖,该物质可能会覆盖在鱼腮表面导致鱼类窒息死亡[20].
-
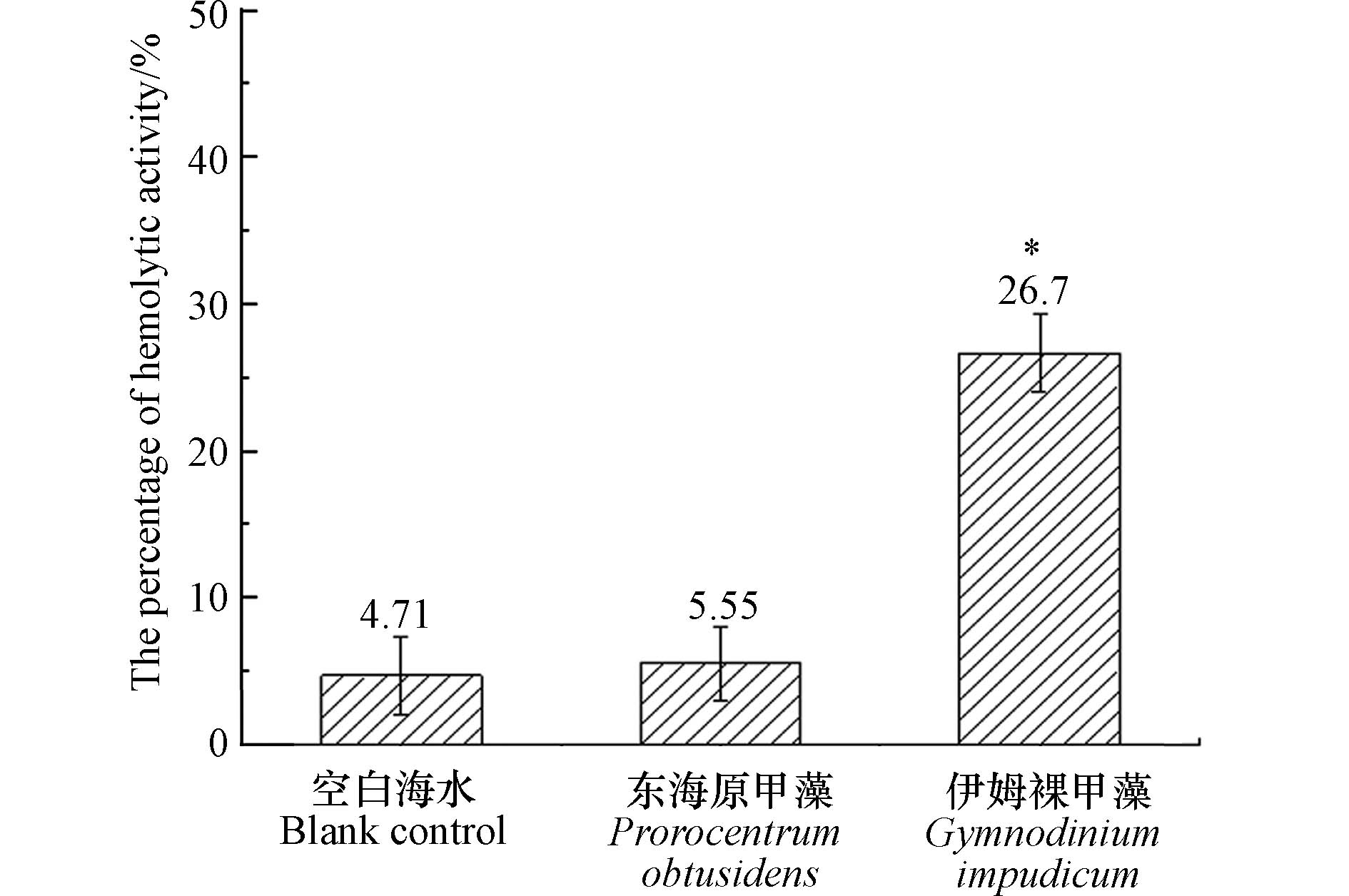
溶血毒素是海洋微藻产生的一类次生代谢产物,可以使血红细胞破损,从而造成鱼类死亡. 目前发现剧毒卡尔藻(Karlodinium veneficum),米氏凯伦藻(Karenia mikmootoi),鞍形凯伦藻(Karenia selliformis)等多种甲藻均具有溶血活性或溶解血红细胞的能力[21]. 以本次分离的伊姆裸甲藻纯培养藻液进行兔血细胞溶血实验,伊姆裸甲藻溶血活性百分数为26.7%±2.6%,显著高于空白对照组(4.71%±2.62%)和阴性对照组(5.55%±2.51%) (P < 0.05)(图7),显示伊姆裸甲藻具有溶血活性. 这一结果也表明伊姆裸甲藻具有潜在毒性效应,伊姆裸甲藻溶血毒素的具体成分仍有待进一步研究.
-
对培养于20 ℃、25 ℃、30 ℃、33 ℃下的伊姆裸甲藻进行为期48天的连续计数,结果表明该藻在此4个温度下均可存活(图8). 其中,20 ℃、25 ℃、30 ℃实验组分别在第36、32和46天到达浓度最高值,依次为(2.54±0.05)×104 cells·mL−1、(2.35±0.02)×104 cells·mL−1和(2.46±0.05)×104 cells·mL−1. 藻细胞最大比生长速率(μmax)出现在25 ℃ (0.371、第2天),其次是30 ℃ (0.360、第4天)、20 ℃ (0.228、第4天)、33 ℃ (0.202、第6天). 值得注意的是,33 ℃实验组藻细胞以5.00×102 cells·mL−1的起始密度缓慢生长至第14天达到密度峰值(3.30±3.08)×103 cells·mL−1,随后藻细胞密度开始降低,至实验结束藻细胞浓度长期维持在(1.40—6.85)×102 cells·mL−1,说明伊姆裸甲藻可以耐受33 ℃的环境,但在此温度下细胞不能大量增殖.
对4个温度下伊姆裸甲藻的最大光化学效率(Fv/Fm)测定表明,伊姆裸甲藻在20 ℃、25 ℃、30 ℃可始终保持较高的光化学活性,Fv/Fm变化范围分别为0.44—0.64、0.46—0.62、0.42—0.61,最大光化学效率值出现时间分别为第18天、第12天和第14天. 在整个生长期,33 ℃实验组伊姆裸甲藻的Fv/Fm明显低于其它3个温度组,除在第1—16天保持了较高的Fv/Fm (0.44—0.57),此后Fv/Fm迅速下降(0.1—0.29).
伊姆裸甲藻对温度的适应范围广,在22—32.9 °C下都曾暴发过赤潮. 1992年发生在加泰罗尼亚海岸的伊姆裸甲藻赤潮水温为22—24 °C,盐度为37.7,发生在瓦伦西亚(西班牙第三大城市)的伊姆裸甲藻赤潮水温为25—28 ℃[8]. 2015年埃及水域9月份伊姆裸甲藻达到细胞峰值7.12×103 cells·mL−1,此时水温为30.4—32.9 ℃,盐度为28.6—29.3 [7]. 在本文的温度实验中,伊姆裸甲藻在20—33 ℃的条件下都可存活,20—30 ℃的培养条件下细胞密度可增长至赤潮水平,但是33 ℃下藻细胞密度较低. 本次伊姆裸甲藻赤潮区现场水温26.1 °C,盐度为32.77,是符合伊姆裸甲藻生长的温度环境.
-
(1)经形态学分析和分子系统发育学分析,2021年8月发生于广东省海门湾的裸甲藻赤潮肇事种为伊姆裸甲藻,这是我国南海海域首次报道该种赤潮.
(2)生物毒性测定结果表明,本次赤潮水样对海洋青鳉鱼无毒害;纯培养的伊姆裸甲藻对兔血具有溶血活性,溶血活性百分数为26.7%;藻密度为4.32×103 cells·mL−1,48小时对卤虫致死率为35%.
(3)伊姆裸甲藻具有较为宽的温度适应幅,25 ℃下比生长速率最高. 20 —30 ℃时,藻细胞可大量繁殖,最高密度达(2.35—2.54)×104 cells·mL−1;33 ℃时,藻细胞无法大量增殖,密度维持在(1.40—6.85)×102 cells·mL−1.
赤潮生物伊姆裸甲藻(Gymnodinium impudicum)毒性和温度适应初步研究
Preliminary study on the toxicity and temperature adaptation of a harmful alga Gymnodinium impudicum
-
摘要: 2021年8月26日,我国广东省海门湾海域暴发了一起裸甲藻赤潮,现场藻细胞密度达3.39×103 cells·mL−1. 本文对该次赤潮肇事种进行了形态学与系统发育学分析,对现场赤潮水样进行了海洋青鳉鱼(Oryzias melastigma) 48 h急性生物毒性分析,对赤潮藻纯培养细胞进行了卤虫(Artemia salina) 48 h急性生物毒性分析、溶血活性测定以及最佳生长温度研究. 结果表明,此次赤潮肇事种为伊姆裸甲藻(Gymnodinium impudicum). 急性生物毒性实验结果表明,赤潮海水对海洋青鳉鱼无明显致死效应,海洋青鳉鱼48 h内游动正常,无异常反应. 该藻纯培养藻种对卤虫具有一定的致死效应,藻密度4.32×103 cells·mL−1时,48 h卤虫死亡率为35%. 溶血活性检测结果表明,该藻溶血活性较低,藻细胞密度为3.66×103 cells·mL−1时,溶血活性百分数为26.7%. 实验室纯培养下,该藻对温度适应性较强,在20 ℃、25 ℃、30 ℃下均可生长,最高密度达(2.35—2.54)×104 cells·mL−1. 25 ℃时藻细胞比生长速率最高(μmax=0.371);33 ℃不适宜该藻增殖,此温度下,藻密度长时间维持在(1.40—6.85)×102 cells·mL−1. 本次赤潮为我国南海海域首次报道伊姆裸甲藻赤潮,该藻的潜在危害及赤潮灾害效应值得进一步关注.Abstract: A Gymnodinium sp.-dominated algae bloom occurred on August 26th, 2021, in Haimen Bay, Guangdong Province. The maximum cell density was 3.39×103 cells·mL−1. We investigated the morphology and phylogeny of the causative species in this study. Acute toxicity study of the bloom samples on marine medaka (Oryzias melastigma) over a 48-hour period was conducted. The hemolytic activity assay, toxicity to Artemia salina, and the optimum growth temperature of the algae were also investigated. The dominant species of this bloom was identified as Gymnodinium impudicum. The bloom sample had no toxic effects on marine medaka, and the O. melastigma survived and swam normally in 48 h. The lethality rate of G. impudicum culture (with a cell density of 4.32×103 cells·mL−1) to Artemia salina in 48 h was 35%. The hemolytic activity of G. impudicum culture (with a cell density of 3.66×103 cells·mL−1) to rabbit’s erythrocyte was 26.7%. The algae grew well at temperature ranged from 20 °C to 30 °C, reaching a peak cell density of (2.35—2.54)×104 cells·mL−1. The maximum growth rate was recorded at 25 °C with a μmax value of 0.371. Gymnodinium impudicum failed to reproduce abundantly at 33 °C, and maintained at a low density of (1.40—6.85)×102 cells·mL−1. This is the first reported of G. impudicum bloom in the South China Sea. More consideration should be given to G. impudicum for its possible risks and disastrous impacts when blooming.
-

-
-
[1] MUHAMMAD B L, KIM T, KI J S. 18S rRNA analysis reveals high diversity of phytoplankton with emphasis on a naked dinoflagellate Gymnodinium sp. at the Han River (Korea) [J]. Diversity, 2021, 13(2): 1-15. doi: 10.3390/d13020073 [2] LI L, CEN J Y, CUI L, et al. Response of size-fractionated phytoplankton to environmental factors near the Changjiang Estuary [J]. Acta Oceanologica Sinica, 2019, 38(1): 151-159. doi: 10.1007/s13131-018-1259-4 [3] 于仁成, 吕颂辉, 齐雨藻, 等. 中国近海有害藻华研究现状与展望 [J]. 海洋与湖沼, 2020, 51(4): 768-788. YU R C, LÜ S H, QI Y Z, et al. Progress and perspectives of harmful algal bloom studies in China [J]. Oceanologia et Limnologia Sinica, 2020, 51(4): 768-788(in Chinese).
[4] HALLEGRAEFF G M, BLACKBURN S I, DOBLIN M A, et al. Global toxicology, ecophysiology and population relationships of the chain-forming PST dinoflagellate Gymnodinium catenatum [J]. Harmful Algae, 2012, 14: 130-143. doi: 10.1016/j.hal.2011.10.018 [5] LIN Z R, GENG H X, ZHANG Q C, et al. Toxin production of dinoflagellate Gymnodinium catenatum isolated from the East China Sea [J]. Harmful Algae, 2022, 113: 102188. doi: 10.1016/j.hal.2022.102188 [6] OH S J, KWON H K, NOH I H, et al. Dissolved organic phosphorus utilization and alkaline phosphatase activity of the dinoflagellate Gymnodinium impudicum isolated from the South Sea of Korea [J]. Ocean Science Journal, 2010, 45(3): 171-178. doi: 10.1007/s12601-010-0015-2 [7] MIKHAIL S, KHALIL N, EL-HADARY M. A new recorded of red tide forming species; Heterocapsa triquetra, Gymnodinium impudicum, Heterosigma akashiwo and Thalassiosira rotula in Alexandria Waters, Egypt [J]. Egyptian Journal of Aquatic Biology and Fisheries, 2020, 24(6): 207-223. doi: 10.21608/ejabf.2020.117258 [8] FRAGA S, BRAVO I, DELGADO M, et al. Gyrodinium impudicum sp. nov. (Dinophyceae), a non-toxic, chain-forming, red tide dinoflagellate [J]. Phycologia, 1995, 34(6): 514-521. doi: 10.2216/i0031-8884-34-6-514.1 [9] 广东省生态环境厅. 广东省入海河流2022年第二季度监测信息[EB/OL]. [2022-10-31]. http://gdee.gd.gov.cn/jhszl/index.html [10] LENAERS G, MAROTEAUX L, MICHOT B, et al. Dinoflagellates in evolution. A molecular phylogenetic analysis of large subunit ribosomal RNA [J]. Journal of Molecular Evolution, 1989, 29(1): 40-51. doi: 10.1007/BF02106180 [11] ADACHI M, SAKO Y, ISHIDA Y. Restriction fragment length polymorphism of ribosomal DNA internal transcribed spacer and 5.8s regions in Japanese Alexandrium species (Dinophyceae) [J]. Journal of Phycology, 1994, 30(5): 857-863. doi: 10.1111/j.0022-3646.1994.00857.x [12] ESCHBACH E, SCHARSACK J P, JOHN U, et al. Improved erythrocyte Lysis assay in microtitre plates for sensitive detection and efficient measurement of haemolytic compounds from ichthyotoxic algae [J]. Journal of Applied Toxicology, 2001, 21(6): 513-519. doi: 10.1002/jat.797 [13] 周成旭, 傅永静, 严小军. 4种典型有害赤潮原因种的溶血特性研究 [J]. 生态毒理学报, 2007, 2(1): 78-82. ZHOU C X, FU Y J, YAN X J. Hemolytic activity studies of several harmful alga strains [J]. Asian Journal of Ecotoxicology, 2007, 2(1): 78-82(in Chinese).
[14] EDLER L, ELBRCHTER M. The Utermöhl method for quantitative phytoplankton analysis[J]Journal of Plankton Research, 2000, 22(12): 2255-2262. [15] 安达六郎. 赤潮生物と赤潮实态 [J]. 水产土木, 1973, 9(1): 31-36. ROKUROU A. Red tide organisms and red tide ecology [J]. Fisheries Engineering (Japan), 1973, 9(1): 31-36.
[16] 自然资源部南海局. 2021年南海区海洋灾害公报 [EB/OL]. [2022-8-19]. http://scs.mnr.gov.cn/scsb/gbytj/202208/7e232de5c3a0430eb16a45be09db34f6.shtml [17] BAND-SCHMIDT C J, ZUMAYA-HIGUERA M G, LÓPEZ-CORTÉS D J, et al. Allelopathic effects of Margalefidinium polykrikoides and Gymnodinium impudicum in the growth of Gymnodinium catenatum [J]. Harmful Algae, 2020, 96: 101846. doi: 10.1016/j.hal.2020.101846 [18] VILA M, CAMP J, GARCÉS E, et al. High resolution spatio-temporal detection of potentially harmful dinoflagellates in confined waters of the NW Mediterranean [J]. Journal of Plankton Research, 2001, 23(5): 497-514. doi: 10.1093/plankt/23.5.497 [19] LUO Z H, HU Z X, TANG Y Z, et al. Morphology, ultrastructure, and molecular phylogeny of Wangodinium sinense gen. et sp. nov. (Gymnodiniales, Dinophyceae) and revisiting of Gymnodinium dorsalisulcum and Gymnodinium impudicum [J]. Journal of Phycology, 2018, 54(5): 744-761. doi: 10.1111/jpy.12780 [20] KIM C S, LEE S G, LEE C K, et al. Reactive oxygen species as causative agents in the ichthyotoxicity of the red tide dinoflagellate Cochlodinium polykrikoides [J]. Journal of Plankton Research, 1999, 21(11): 2105-2115. doi: 10.1093/plankt/21.11.2105 [21] 杨琳, 刘磊, 许道艳, 等. 海洋微藻溶血毒素化学结构研究进展 [J]. 海洋环境科学, 2016, 35(4): 628-634. YANG L, LIU L, XU D Y, et al. Progress of the studies on hemolytic toxin structure in marine algae [J]. Marine Environmental Science, 2016, 35(4): 628-634(in Chinese).
-



 下载:
下载: