-
汞(Hg), 因具有持久性和长距离迁移的特征,被世界公认为全球性的污染物,对生态系统和人类健康造成严重影响,因而备受关注[1 − 2]. 现有研究表明,有色金属开采和冶炼是人为汞排放的最大源头之一[3 − 5]. 尽管黑色金属矿石中汞含量通常较低,但黑色金属矿物开采规模相对较大,其冶炼加工过程中释放量也较大,因此,黑色金属矿物采冶过程中的汞排放对环境的影响不容忽视,而锰作为黑色金属的典型代表,在黑色金属锰的一系列原矿开采和冶炼加工等过程中对环境造成的汞污染状况如何?现有的研究仍显不足. 据估算,韩国全国初级锰冶炼厂汞的排放量可达到每年644.0 kg [6]. 挪威的Si-Mn合金冶炼的工厂中发现锰矿石中汞含量很高,大量的汞通过燃烧废气向大气环境中排放[7]. 锰冶炼生产加工过程中,大约50%的汞被直接释放到大气环境,大量的汞伴随锰矸石、粉煤灰等以固体废物的形式输出[6,8].
前期研究发现,锰矿采矿和电解锰厂等人为工矿活动向环境中释放了大量汞,锰矿中的汞被迁移进入河流环境在沉积物中产生累积[9]. 然而,锰矿开采过程中产生的锰矸石是典型一般固体废物,由于锰矸石产生量大,露天堆放占用大量林地和耕地等土地资源. 在风化、淋溶、自燃等作用下,锰矸石中重金属容易在大气、土壤和水生态环境进行迁移和转化. 对锰矿采矿区的锰矸石堆场采样预实验发现,天然锰矿采矿的原矿和锰矸石堆场的尾矿中汞含量较高,分别为2.5 mg·kg−1、12.9 mg·kg−1,初步认为锰矿开采过程可能产生大量的汞向周围环境排放. 为从源头上摸清锰矿开采过程产生的锰矸石向环境中排放汞状况,以秀山县溶溪镇某大型锰矿开采企业的锰矸石为研究对象,开展锰矸石中汞的静态浸溶和动态淋溶实验研究,考察静态浸泡和动态淋溶对锰矸石中汞的溶出特征,揭示锰矸石中汞在不同温度、pH值、不同粒径、不同降水作用方式下的溶出释放规律,为研究锰矿区环境中汞的地球化学特征具有极其重要意义.
-
研究区域位于重庆市秀山县,秀山县年平均气温均大于17 ℃,平坝、浅丘地带平均气温在16—17 ℃之间. 常年降水量为1341.1 mm,80%以上年份降水量在1100—1700 mm之间. 以秀山县溶溪镇锰矿采矿区某企业的锰矸石堆场为研究对象,研究点位地理位置见图1.
-
2019年9月,某大型锰矿采矿企业的锰矸石堆场面积约13333.3 m2,呈不规则形状堆放,采用“蛇形采样法”,采集该企业锰矸石堆场0—50 cm混合样品,共采集均匀分布的10个点位样品,每个采样点位采集样品2—4 kg,将所有采集点位样品进行均匀混合. 由于一定粒径变化范围内的矸石性质相似,一般按其粒径大小可划分为粗粒矸石(大于25 mm)、中粒矸石(1—25 mm)、细粒矸石(0—1 mm)[10],因而本实验的锰矸石样品经过真空冷冻干燥机(−60 ℃)冻干后,进行破碎、研磨,并选择过6 目、20 目、100 目尼龙筛. 后将样品充分混匀,装入自封袋中密封置于−18 ℃冷冻保存.
-
文献报道,2017年重庆市酸雨的pH范围为3.90—5.59[11]。为考察不同酸雨条件下对锰矸石中汞溶出的影响,本实验浸泡液的pH值设定为4.0、4.8、5.6,将制备好的锰矸石样品(6—20 目、20—100 目、大于100 目)进行静态浸泡实验,每组实验样品均需做平行实验. 采用单因素实验法,分别考察不同粒径、pH值,浸泡时间、固液比、温度对锰矸石中汞溶出特征影响. 考察时间对锰矸石浸出汞的影响,分别投加6—20 目、20—100 目、大于100 目的锰矸石样品各10 g,加入150 mL锥形瓶中,用0.1 mol·L−1 HNO3调节pH值分别为4.0、4.8、5.6,温度为25 ℃,静态浸泡时间为10—180 min. 分别考察固液比为1:16、1:8、1:5.3、1:4、1:3.3、1:2.7对锰矸石浸出汞的影响,pH值分别为4.0、4.8、5.6,温度为25 ℃,浸泡时间120 min. 重庆市夏季最低平均温度为25.74 ℃[12],而最高气温达到了45 ℃,为了考察温度对锰矸石浸出汞的影响,本研究设置温度为25、35、45 ℃,分别投加6—20 目、20—100 目、大于100 目的锰矸石样品各10 g,pH值分别为4.0、4.8、5.6,浸泡时间120 min. 静态浸泡实验中取浸出液25 mL,离心,用HNO3酸化至pH<2,经0.45 μm滤膜过滤后待测.
-
通过模拟大自然降雨过程,对锰矸石样品进行间歇式实验室模拟淋溶,以研究锰矸石中汞的溶解释放特点. 根据参考文献[13]进行锰矸石动态淋溶装置搭建. 为更好模拟锰矿区的实际降水情况,在动态淋溶实验中每天为一个小循环,选取多年平均降雨量作为加入淋溶液量参考,查阅秀山县常年降水量为1341.1 mm,根据文献[14]计算模拟酸雨淋溶液加入量为120 mL. 淋溶柱材质为高硼硅玻璃,淋溶柱底部放置过滤器. 在淋溶柱内分别装入6—20 目、20—100 目,以及大于6 目混合锰矸石样品各300 g,其底部和上部均覆盖5 cm经预处理的石英砂,使淋溶液均匀渗漏.
实验前,先用一级纯水饱和淋溶柱24 h. 在室温为25 ℃条件下,采用每间隔24 h连续加模拟酸雨(配置模拟酸雨pH为4.0)和自然降雨强度(约为1.0 mL·min−1)淋滤方式,采用蠕动泵控制模拟酸雨加入流速,共计反复淋滤38 d.
每次淋滤结束后,测定淋滤液pH、电导率,再分别定量取淋滤液各50 mL,用HNO3酸化至pH<2,经0.45 μm滤膜过滤后测汞和锰浓度.
-
锰矸石静态和动态淋溶液中汞浓度均采用原子荧光光谱法(AFS)测定[15]. 对于静态浸泡和动态淋溶液样品中汞的测定中均需要测定空白样品、标准物质、平行样品及加标回收率实验进行质量控制. 整个实验空白值较低,范围为样品测定值的 1%—4%,可以忽略不计. 按照10%样品量进行实验室平行分析,相对标准差均小于20%,水质样品中汞的加标回收率83%—109%. 固体样品分析测定过程中参考土壤标准物质进行方法验证,测定土壤标准物质(地球物理地球化学勘探研究所,GBW07403/GSS-3,(0.060±0.004)mg·kg−1,GBW07405/GSS-5,(0.29±0.03)mg·kg−1)结果均在误差范围内. 采集样品均需测3个平行样品,测定结果相对标准偏差均小于8.0%.
-
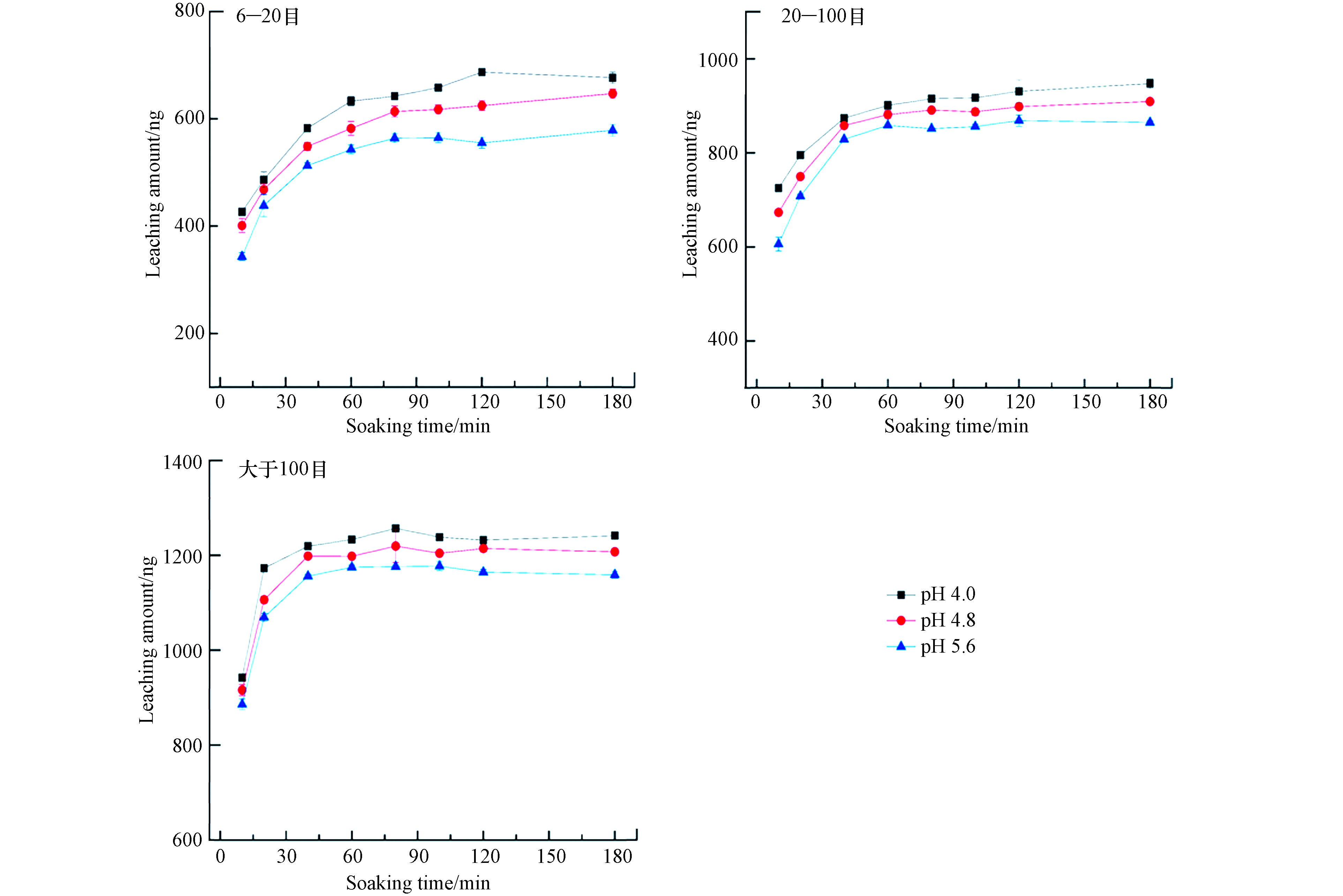
实验考察了静态浸泡时间在10—180 min,浸泡溶液的温度为25 ℃时,锰矸石中汞的浸出量变化情况,实验结果见图2.
由图2可以看出,不同粒径锰矸石尾矿中汞浸出量均随着浸泡时间的增加而升高,在10—90 min内,6—20 目粒径锰矸石中浸出汞量呈快速释放阶段,90—180 min呈慢速释放阶段,在120 min内,锰矸石中浸出汞量的释放基本达到平衡. 在10—60 min内,20—100 目粒径锰矸石中浸出汞量是快速释放阶段,60—180 min呈慢速释放阶段,在90 min内,锰矸石中浸出汞量的释放基本达到平衡. 在0—40 min内,大于100 目粒径锰矸石中浸出汞含量呈快速释放阶段,40—180 min呈慢速释放阶段,在40 min内,锰矸石中浸出汞量的释放基本达到平衡. 当pH=4.0,时间为180 min时,6—20 目、20—100 目、大于100 目锰矸石中汞的浸出量分别为677、947、1421 ng;当pH=4.8,时间为180 min时,6—20 目、20—100 目、大于100 目锰矸石中汞的浸出量分别为647、909、1207 ng;当pH=5.6,时间为180 min时,6—20 目、20—100 目、大于100 目锰矸石中汞的浸出量分别为579、865、1159 ng. 锰矸石的浸泡初始阶段,浸泡液中汞浓度较低,溶解释放的汞浓度梯度较高,锰矸石中汞的溶解释放速率较快. 随着浸泡时间增加,浸泡液中汞浓度越高,锰矸石溶解释放汞总量越多,浓度梯度越来越小,锰矸石中汞的释放速率减慢. 此时锰矸石中汞的溶解释放主要受扩散控制,其研究结果与煤矸石中污染物释放相类似[16]. 也与狄军贞等[17]研究粒径对煤矸石污染物溶解释放规律研究结果相似,煤矸石的粒径为0.18—0.25 mm时,煤矸石中污染物释放量达到较大值,当粒径小于该范围时候,污染物释放的增量较小. 当浸泡溶液的酸度增加时,6—20 目、20—100 目和大于100 目锰矸石中汞的浸出量均增大,且浸出后溶液的pH值均呈增加趋势,主要是由于浸泡溶液酸度增加,有利于铁锰氧化态、碳酸盐结合态的重金属转为水溶态重金属,重金属的迁移性随之增加. 从总体上看,锰矸石的粒径越大,锰矸石中汞的溶出量达平衡时间相对较慢,粒径越小,比表面积越大,与浸泡溶液的接触面积越大,锰矸石中汞易于溶解析出,缩短了锰矸石中汞的溶出释放量达到平衡时间.
-
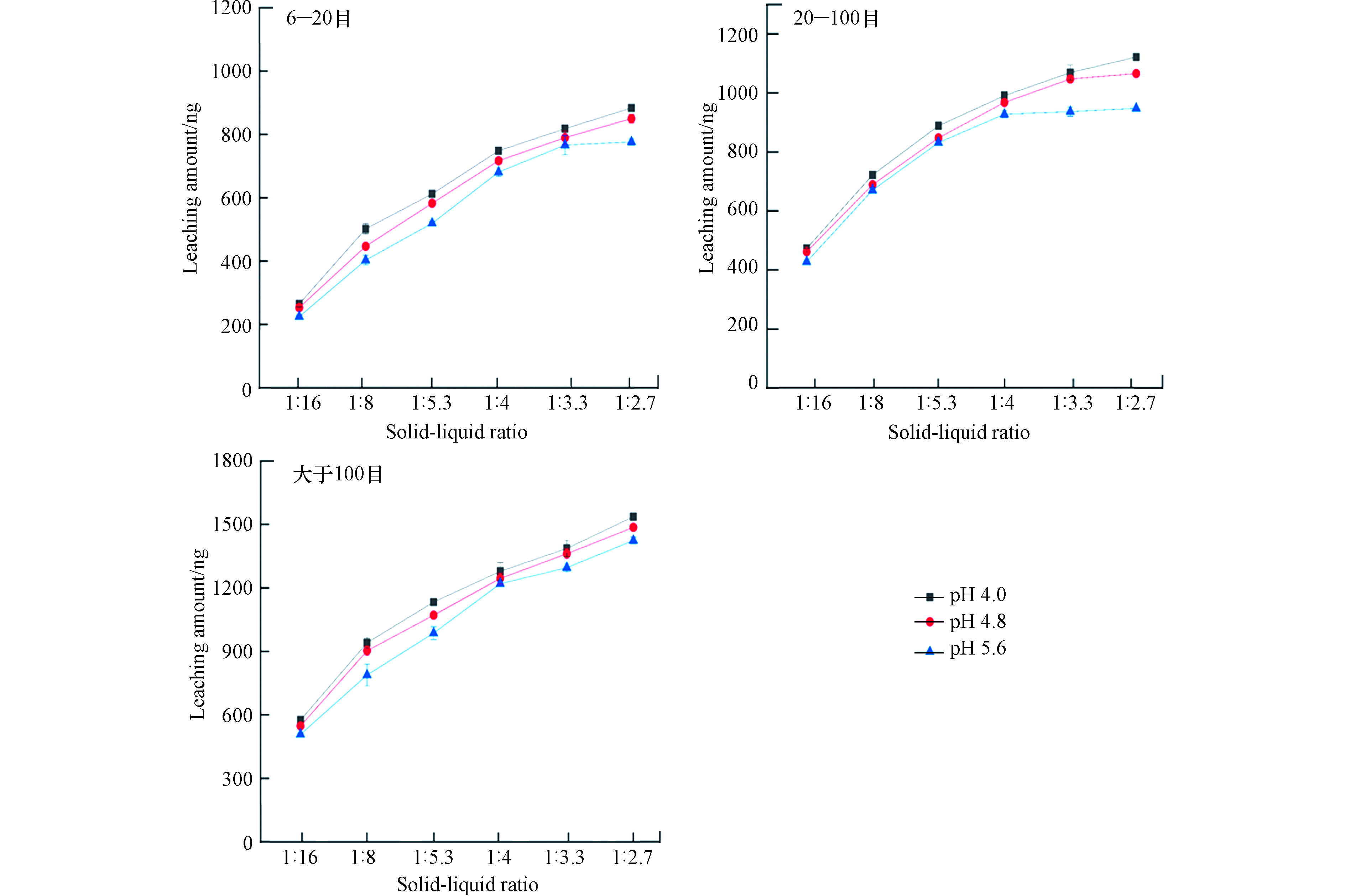
实验考察了固液比为1:16、1:8、1:5.3、1:4、1:3.3、1:2.7对锰矸石中汞的释放规律影响,浸泡时间120 min,浸泡溶液的温度为25 ℃,实验结果见图3. 由图3可以看出,不同固液比对锰矸石中汞的溶出释放规律有着较大影响,随着固液比增加,不同粒径锰矸石中汞的浸出量逐渐增加,均呈现先逐渐增长趋势,随着固液比增大有所减缓,主要是由于锰矸石中汞的溶出释放速率减小,单位质量的锰矸石中汞释放量减小. 当pH=4.0,固液比为1:2.7时,6—20 目、20—100 目、大于100 目锰矸石中汞的浸出量分别为884、1121、1536 ng;当pH=4.8,固液比为1:2.7时,6—20 目、20—100 目、大于100 目锰矸石中汞的浸出量分别为850、1066、1486 ng;当pH=5.6,固液比为1:2.7时,6—20 目、20—100 目、大于100 目锰矸石中汞的浸出量分别为777、948、1424 ng. 固液比为1:16时,锰矸石中汞的溶出释放规律受扩散控制,固液比越小,浸泡液中汞的浓度低,浓度梯度增大,汞的溶出释放速率升高,有利于锰矸石中汞的溶出释放;反之,固液比越大,浓度梯度减小,汞释放速率降低,不利于锰矸石中汞的溶出浸出. 固液比对锰矸石中汞的溶出特征影响与煤矸石中重金属淋溶结果相类似[16,18].
因此,在锰矿采矿中锰矸石尾矿堆场区,当降雨量增大,即固液比越小,锰矸石中汞溶解释放速率会增加,单位质量的锰矸石中汞的溶出释放量就越多. 在不同固液比条件下,浸泡溶液的酸度越大,锰矸石中汞的浸出量增加,但是增加趋势相对较小. 在1:3.3和1:2.7固液比,pH=5.6条件下,对6—20 目和20—100 目锰矸石中汞的浸出量趋于平稳. 在不同固液比、浸泡溶液的不同酸度条件下,锰矸石中汞浸出量呈现大于100 目>20—100 目>6—20 目. 从总体上看,锰矸石的粒径越小,固-液接触面积越大,锰矸石中汞释放量梯度变化明显,释放速率最快,随着固液比增大,浸出液中汞量越多.
-
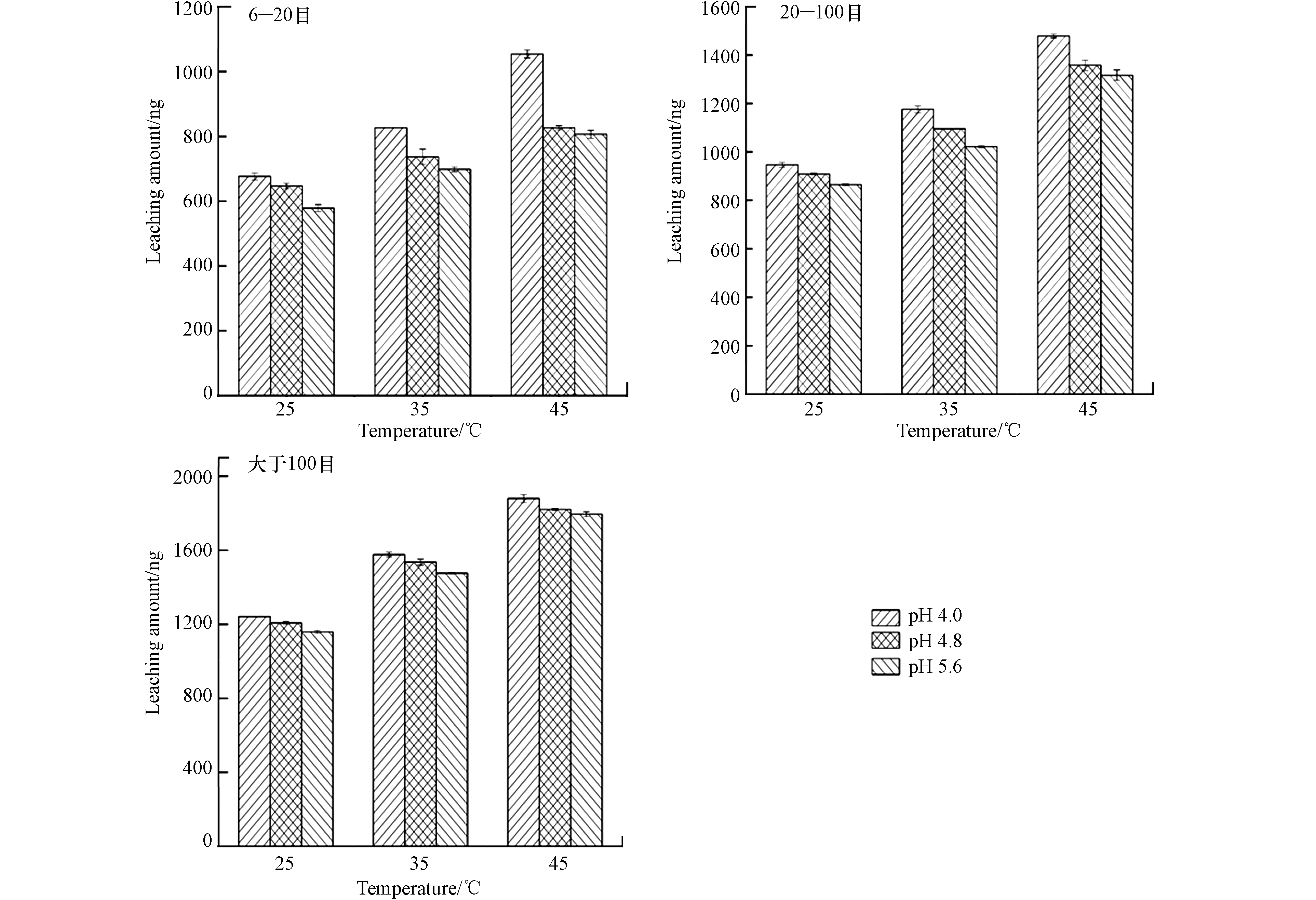
实验考察了浸泡溶液温度为25、35、45 ℃条件下,6—20 目、20—100 目、大于100 目锰矸石样品10 g,浸泡时间120 min,浸泡溶液温度对锰矸石中汞的浸出量影响见图4。由图4可见,6—20 目、20—100 目、大于100 目锰矸石中汞的浸出量随着温度增加,温度越高释放速度越快,锰矸石中汞的浸出量呈明显增大,主要是由于锰矸石中构成物质的分子或离子等结构体的活性受温度影响,温度升高,分子运动加快,活性增强,有利于分子间结构重新组合,使得锰矸石中汞元素游离出来并发生溶解而释放到浸泡液中[11]. 相同粒径,pH=4.0、温度为45 ℃条件下,锰矸石中汞的浸出量最大,pH=5.6时,锰矸石中汞的浸出量最小. 当pH=4.0,温度为45 ℃时,6—20 目、20—100 目、大于100 目锰矸石中汞的浸出量分别为1054、1479、1879 ng;当pH=4.8,温度为45 ℃时,6—20 目、20—100 目、大于100 目锰矸石中汞的浸出量分别为826、1358、1821 ng;当pH=5.6,温度为45 ℃时,6—20 目、20—100 目、大于100 目锰矸石中汞的浸出量分别为807、1317、1795 ng. 从总体可以看出,在不同酸度条件下,温度越高,锰矸石的粒径越小,浸泡溶液的酸度越大,锰矸石中汞的浸出量越大.
-
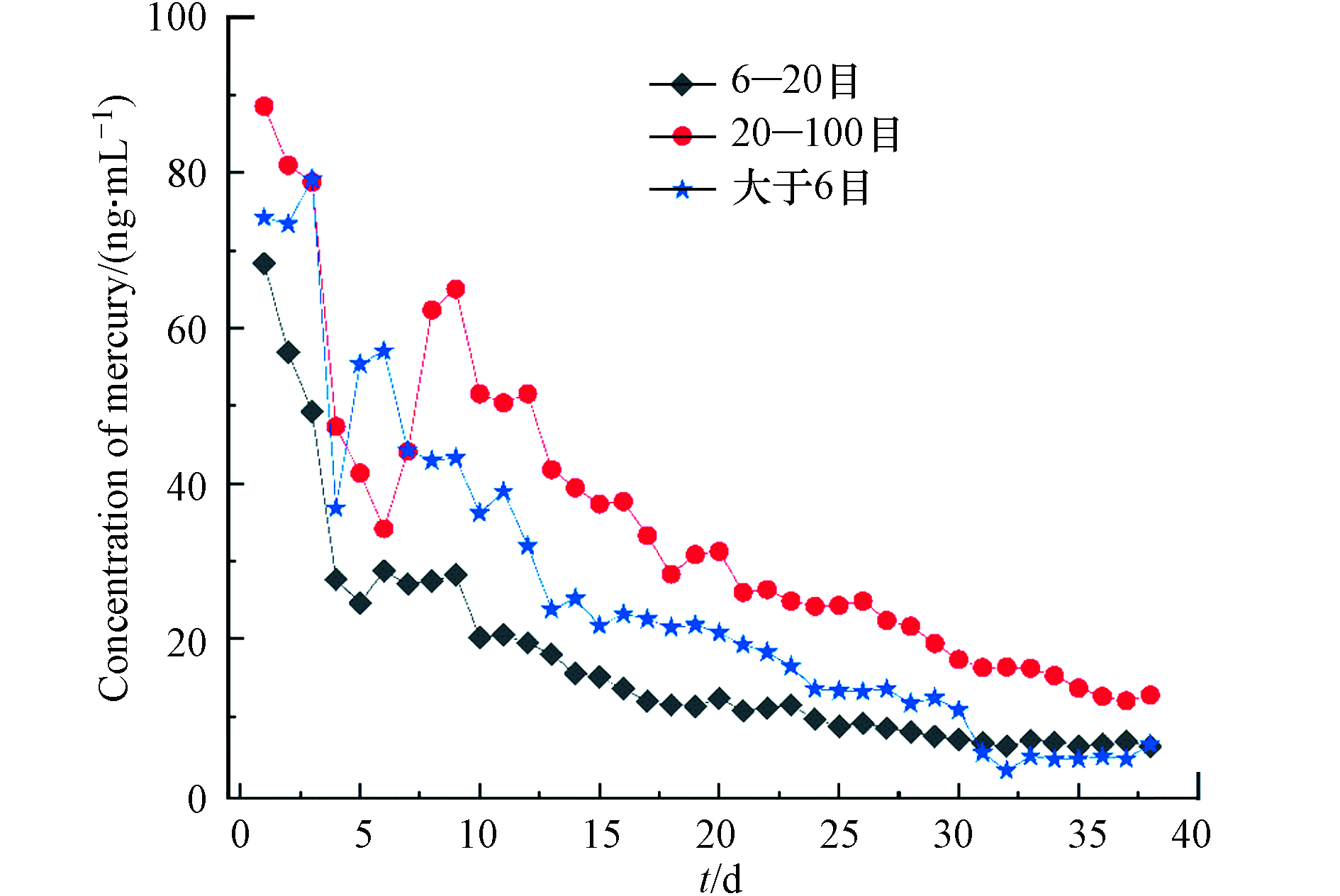
采用模拟酸雨(pH=4.0)对锰矸石中汞进行动态淋溶,以研究连续降雨条件下,锰矸石中水溶性组分的释放规律,实验结果见图5.
由图5可以看出,1—12 d时间,6—20 目、20—100 目和大于6 目混合粒径锰矸石中汞淋溶释放过程各不相同,其中,在1—4 d内,6—20 目锰矸石的动态淋溶液中汞的浓度变化幅度较大且呈逐渐减小,而在12 d以内,20—100 目和大于6 目混合粒径锰矸石动态淋溶液中汞的浓度呈现先减少后增大再减少的释放溶出特征. 在13—38 d时间范围内,3种不同粒径锰矸石的动态淋溶液中汞的浓度变化呈逐渐变小的相似释放规律. 动态淋溶第1 天,6—20 目、20—100 目和大于6 目混合粒径锰矸石中汞的溶出量分别为16114、1107、11878 ng;前8 天时间,3种不同粒径锰矸石的淋溶液中汞的浓度变化规律不相同,从第8 天开始,锰矸石的连续淋溶液中汞的浓度均呈现为20—100 目>大于6 目混合>6—20 目. 由于锰矸石在露天条件下受风化的影响,大于6 目混合更加贴近自然条件下锰矸石的粒度分布情况,因此,本实验选择大于6 目混合的锰矸石淋溶汞量进行估算,每年每吨锰矸石尾矿大约溶出汞量为375.9 mg. 相比于自然条件下,本实验连续降雨过程持续时间较长,但处于地势较低处的锰矸石受到的浸泡时间可能较长,且在湿润矸石层,特别是干燥和湿润阶段连续的情况下,有机物的氧化会导致矸石堆发生自燃现象[19] . 据Zhao等估计[20],自燃过程会导致矸石中超过90%的汞进入空气中,矸石中汞的排放量达到0.4 mg·kg−1,这可能导致本研究锰矸石中汞的溶出估算结果偏低[21].
测定模拟酸雨(pH=4.0)对锰矸石动态淋溶液的pH发现,在动态淋溶38 d期间,模拟酸雨对6—20 目、20—100 目和大于6 目混合粒径锰矸石进行淋溶后,淋溶液的pH均小于4.0,呈现弱酸性,尤其是动态淋溶前10 d,模拟酸雨淋溶后酸度增大较为明显,主要原因是锰矿石中存在黄铁矿(主要成分为FeS2)[21],黄铁矿在水解氧化时会产生硫酸,以黄铁矿为例,其水解氧化反应可以表示为如公式(1)[22]:
在3种不同粒径锰矸石淋溶初始阶段,随着模拟酸雨侵蚀锰矸石,黄铁矿进入溶出液中水解氧化使得溶液呈中强酸,随着锰矸石淋溶进行,锰矸石矿物中硫酸盐水解量减少,动态淋溶液的pH值有所上升. 这与WANG等[23]的研究结果一致,即浸出液中的pH值与废弃矿物中矿物质的水解密切相关. 测定锰矸石动态淋溶液中电导率结果发现,模拟酸雨(pH=4.0)对6—20 目、20—100 目和大于6 目混合粒径锰矸石进行动态淋溶后溶液的电导率总体呈逐渐减小趋势,动态淋溶过程的第2天,6—20 目、20—100 目和大于6 目混合粒径锰矸石的淋溶液电导率值达最大,分别为2.41、2.55、2.67 ms·cm−1,主要是由于锰矸石样品均为锰矿采矿产生的尾矿表层废弃物,长期裸露在地表,由于风化、自燃、降雨淋溶等作用,锰矸石发生了不同程度的矿化,在动态淋溶初始阶段,锰矸石的表面吸附可溶性矿物质和易溶盐分能够快速溶解进入淋滤液,导致了淋滤液电导率值有所升高,随着动态淋溶过程进行,锰矸石表面的可溶性矿物和易溶盐逐渐减少,电导率值呈逐渐减少. 同时,研究发现,在动态淋溶初始阶段,锰矸石中铁锰氧化态和碳酸盐结合态重金属转为水溶态重金属[24],锰矸石自身会淋溶析出一定的汞和Mn等金属离子,在锰矿物表面盐基离子和酸碱根离子也会被快速淋溶,连续淋溶10 d后,3种不同粒径锰矸石淋溶液电导率值逐渐趋于稳定,主要是随着动态淋溶过程进行,锰矸石表面受到淋溶液侵蚀,锰矿物中金属离子进行稳定交换反应,吸附在锰矸石表面活性较强离子都被进入到淋溶溶液中.
-
(1)锰矸石粒径越小,静态淋溶液酸度越大,锰矸石中汞的静态浸出量越大,浸出达平衡时间越快. 静态淋溶液温度越高,锰矸石中汞的浸出量增大. 在固液比为1:2.7时,不同粒径锰矸石中汞的浸出量达最大. 静态淋溶实验的固液比越小,淋溶液中汞的浓度越低,浓度梯度增大,汞溶出释放速率升高,有利于锰矸石中汞的溶出释放. 通过估算,每年每吨锰矸石尾矿大约溶出汞量为375.9 mg.
(2)不同粒径锰矸石中汞的动态淋溶变化规律相似,前4 d,淋溶液中汞的浓度变化显著,38 d动态淋溶过程,锰矸石的淋溶液中汞浓度和电导率均呈逐渐减小,林溶液的pH值均小于4.0,动态淋溶后的溶液均呈现酸度增大.
(3)锰矿原矿开采人为活动过程中会向环境中排放大量的汞.
锰矿区典型汞排放源——锰矸石中汞溶出排放特征
Characteristics of mercury dissolution and discharge in manganese gangue, a typical mercury emission source in manganese mining areas
-
摘要:
为掌握锰矿开采产生的锰矸石向环境中排放汞状况,以某大型锰矿开采企业的锰矸石为研究对象, 开展锰矸石中汞的静态浸泡和动态淋溶特征研究. 静态浸泡实验分别考察不同粒径(6—20 目、20—100目、大于100 目)、pH值(4.0、4.8、5.6),浸泡时间(10—180 min)、固液比(1∶16、1∶8、1∶5.3、1∶4、1∶3.3、1∶2.7)、温度(25、35、45 ℃)对锰矸石中汞溶出特征影响. 动态淋溶实验采取在淋溶柱内分别装入6—20 目、20—100 目,以及大于6 目混合锰矸石样品各300 g,温度为25 ℃,以1.0 mL·min−1淋溶速度,每间隔24 h连续加模拟酸雨(pH为4.0)进行淋溶实验,共计反复淋滤38 d. 实验结果表明:在静态浸泡实验中,锰矸石中汞的浸出量随浸泡时间增加而增加,固液比越小,浸出量越大;温度升高,浸出量增大. 酸性条件有利于增加锰矸石中汞的迁移性,粒径较小的锰矸石拥有更大的比表面积,与浸泡溶液的接触面积越大,锰矸石中汞更易于溶解析出. 固液比为1∶2.7时,不同粒径锰矸石中汞浸出量均为最大,表明较大的降雨量和积水量可能增加锰矸石中汞的溶出释放风险. 在动态淋溶实验中,不同粒径锰矸石中淋溶汞浓度变化显著,且均在13—38 d时间范围内,呈逐渐变小的相似释放规律;淋溶后的溶液均呈现酸度增大. 通过估算,每年每吨锰矸石尾矿大约溶出汞量为375.9 mg,锰矿原矿开采人为活动过程均会向环境中排放大量的汞. Abstract: To investigate the mercury emission of manganese gangue produced by manganese ore mining to the environment, this thesis was based on the research on the static immersion and dynamic leaching characteristics of manganese gangue from a large manganese mining enterprise. In static immersion experiments, the effects of different particle sizes (6—20 mesh, 20—100 mesh, greater than 100 mesh), pH value (4.0, 4.8, 5.6), immersion time (10—180 min), solid-liquid ratio (1:16, 1:8, 1:5.3, 1:4, 1:3.3, 1:2.7) and temperature (25, 35, 45 °C) on the dissolution characteristics of mercury in manganite were investigated respectively. The dynamic leaching experiment was performed by loading 300 g of manganese gangue samples with 6—20 mesh, 20—100 mesh and the mixed sample with more than 6 mesh in the leaching column at a temperature of 25 °C under a leaching rate of 1.0 mL·min−1, and continuously adding simulated acid rain (pH 4.0) every 24 h, for a total of 38 days of repeated leaching. The results showed that in the static immersion experiment, the leaching amount of mercury in manganese gangue increased with the increasing immersion time, and the leaching amount increased with smaller solid-liquid ratio and higher temperature. Acidic conditions were conducive to increasing the mobility of mercury in manganese. Manganese gangue with smaller particle size had a larger specific surface area, and the larger the contact area with the immersion solution, the easier it was for the mercury in the manganese gangue to dissolve and desorb. At a solid-liquid ratio of 1:2.7, the amount of mercury leached from manganese gangue with different particle sizes was the largest, indicating that heavy rainfall and water accumulation may increase the risk of mercury dissolution and release from manganese gangue. In the dynamic leaching experiment, the concentration of leached mercury in manganese gangue of different particle sizes changed significantly, showing a similar gradually decreasing release within 13—38 d. After leaching, the solution showed increased acidity. It is estimated that the amount of mercury dissolved per ton of manganese gangue tailings per year is about 375.9 mg, and large amounts of mercury will be released into the environment during manganese raw ore mining.-
Key words:
- manganese gangue /
- mercury /
- static leaching /
- dynamic leaching
-

-
-
[1] SELIN H, KEANE S E, WANG S X, et al. Linking science and policy to support the implementation of the Minamata Convention on Mercury[J]. Ambio, 2018, 47(2): 198-215. doi: 10.1007/s13280-017-1003-x [2] BANK M S. The mercury science-policy interface: History, evolution and progress of the Minamata Convention[J]. Science of The Total Environment, 2020, 722: 137832. doi: 10.1016/j.scitotenv.2020.137832 [3] ORIHEL D M. Temporal changes in the distribution, methylation, and bioaccumulation of newly deposited mercury in an aquatic ecosystem[J]. Environmental Pollution, 2008, 154(1): 77-88. doi: 10.1016/j.envpol.2007.12.030 [4] LIU S J, WANG X D, GUO G L, et al. Status and environmental management of soil mercury pollution in China: A review[J]. Journal of Environmental Management, 2021, 277: 111442. doi: 10.1016/j.jenvman.2020.111442 [5] 孙阳昭, 陈扬, 蓝虹, 等. 中国汞污染的来源、成因及控制技术路径分析[J]. 环境化学, 2013, 32(6): 937-942. doi: 10.7524/j.issn.0254-6108.2013.06.003 SUN Y Z, CHEN Y, LAN H, et al. Study on pollution sources, cause of mercury pollution and its control technical roadmap in China[J]. Environmental Chemistry, 2013, 32(6): 937-942 (in Chinese). doi: 10.7524/j.issn.0254-6108.2013.06.003
[6] BACK S K, SUNG J H, MOOM Y H, et al. Mercury distribution characteristics in primary Manganese smelting plants[J]. Environmental Pollution, 2017, 227: 357-363. doi: 10.1016/j.envpol.2017.04.097 [7] KERO I T, EIDEM P A, MA Y, et al. Airborne emissions from Mn ferroalloy production[J]. JoM, 2019, 71(1): 349-365. doi: 10.1007/s11837-018-3165-9 [8] FUKUDA N. Mercury emission and behavior in primary ferrous metal production[J]. Atmospheric Environment, 2011, 45(22): 3685-3691. doi: 10.1016/j.atmosenv.2011.04.038 [9] ZHANG Y J, SUN T, MA M, et al. Distribution of mercury and methylmercury in river water and sediment of typical Manganese mining area[J]. Journal of Environmental Sciences, 2022, 119: 11-22. doi: 10.1016/j.jes.2021.12.011 [10] 粟俊江. 南桐煤矿矸石山的稳定性分析及防治措施研究[D]. 重庆: 重庆大学, 2008. SU J J. Stability analysis and research of prevention and cure measure of waste dump in Nantong coal mine[D]. Chongqing: Chongqing University, 2008(in Chinese).
[11] 张灿, 孟小星, 张关丽. 重庆地区酸雨污染现状[J]. 绿色科技, 2018(16): 11-14. ZHANG C, MENG X X, ZHANG G L. Acid rain pollution in Chongqing area[J]. Journal of Green Science and Technology, 2018(16): 11-14(in Chinese).
[12] 刘兴钰. 近20年重庆气候变化及NDVI的响应研究[D]. 重庆: 重庆师范大学, 2019. LIU X Y. Study on climate change and NDVI response of Chongqing in recent 20 years[D]. Chongqing: Chongqing Normal University, 2019(in Chinese).
[13] 周辰昕, 李小倩, 周建伟. 广西合山煤矸石重金属的淋溶实验及环境效应[J]. 水文地质工程地质, 2014, 41(3): 135-141. ZHOU C X, LI X Q, ZHOU J W. Leaching experiment and environmental effect of heavy metals of coal gangue in Heshan mining area, Guangxi Province[J]. Hydrogeology & Engineering Geology, 2014, 41(3): 135-141(in Chinese).
[14] 马宏璞. 锑矿堆放区重金属锑淋溶释放规律及其在土—水界面环境下迁移转化模型的研究[D]. 湘潭: 湖南科技大学, 2015. MA H P. Study of leaching law and transformation model under soil-water interfaces of Sb in antimony ore stack area[D]. Xiangtan: Hunan University of Science and Technology, 2015(in Chinese).
[15] 中华人民共和国环境保护部. 水质 汞、砷、硒、铋和锑的测定 原子荧光法: HJ 694—2014[S]. 北京: 中国环境科学出版社, 2014. Ministry of Environmental Protection of the People's Republic of China. Water quality-determination of mercury, arsenic, selenium, bismuth and antimony-atomic fluorescence spectrometry: HJ 694—2014[S]. Beijing: China Environment Science Press, 2014(in Chinese).
[16] 肖利萍, 梁冰, 陆海军, 等. 煤矸石浸泡污染物溶解释放规律研究: 阜新市新邱露天煤矿不同风化煤矸石在不同固液比条件下浸泡实验[J]. 中国地质灾害与防治学报, 2006, 17(2): 151-155, 163. XIAO L P, LIANG B, LU H J, et al. Releasement of contaminants within coal gangue based on soaking experiment—a case study of coal gangue in Xinqiu Coal Mine, Fuxin[J]. The Chinese Journal of Geological Hazard and Control, 2006, 17(2): 151-155, 163(in Chinese).
[17] 狄军贞, 鲍斯航, 杨逾, 等. 粒径对煤矸石污染物溶解释放规律影响研究[J]. 煤炭科学技术, 2020, 48(4): 178-184. DI J Z, BAO S H, YANG Y, et al. Study on effects of particle size on dissolution and release law of pollutants in gangue[J]. Coal Science and Technology, 2020, 48(4): 178-184(in Chinese).
[18] 张燕青, 黄满红, 戚芳方, 等. 煤矸石中金属和酸根离子的淋溶特性[J]. 环境化学, 2014, 33(3): 452-458. doi: 10.7524/j.issn.0254-6108.2014.03.008 ZHANG Y Q, HUANG M H, QI F F, et al. The leaching characteristics of metals and acid radical ions in gangue[J]. Environmental Chemistry, 2014, 33(3): 452-458(in Chinese). doi: 10.7524/j.issn.0254-6108.2014.03.008
[19] QUEROL X, IZQUIERDO M, MONFORT E, et al. Environmental characterization of burnt coal gangue banks at Yangquan, Shanxi Province, China[J]. International Journal of Coal Geology, 2008, 75(2): 93-104. doi: 10.1016/j.coal.2008.04.003 [20] ZHAO Y, ZHANG J, CHOU C L, et al. Trace element emissions from spontaneous combustion of gob piles in coal mines, Shanxi, China[J]. International Journal of Coal Geology, 2008, 73(1): 52-62. doi: 10.1016/j.coal.2007.07.007 [21] 陈红亮. 新鲜电解锰渣和长期堆存渣的矿物成分和毒性特征的差异分析[J]. 贵州师范大学学报(自然科学版), 2016, 34(2): 32-36. CHEN H L. Differences analysis of minerals compositions and toxicity characteristics between the fresh electrolytic Manganese residue and the stockpiling residue[J]. Journal of Guizhou Normal University (Natural Sciences), 2016, 34(2): 32-36(in Chinese).
[22] AKCIL A. Acid Mine Drainage (AMD): Causes, treatment and case studies[J]. Journal of Cleaner Production, 2006, 14(12/13): 1139-1145. [23] WANG X, REN B Z, ZHOU Y Y, et al. Study on the mechanism and kinetics of Manganese release from waste Manganese ore waste rock under rainfall leaching[J]. Environmental Science and Pollution Research, 2022, 29(4): 5541-5551. doi: 10.1007/s11356-021-16081-w [24] 李颖, 顾雪元. 土壤中锰氧化物的形态及其化学提取方法综述[J]. 环境化学, 2022, 41(1): 9-21. doi: 10.7524/j.issn.0254-6108.2021061603 LI Y, GU X Y. Soil Manganese oxides and its extraction methods: A review[J]. Environmental Chemistry, 2022, 41(1): 9-21(in Chinese). doi: 10.7524/j.issn.0254-6108.2021061603
-




 下载:
下载: