-
近年来,高碘酸盐(IO4−,PI)作为一种氧化、消毒过程的新型水处理试剂,因其强氧化特性和氧化过程产生无毒、稳定的氧化产物(碘酸盐)[1 − 3],受到环境领域研究者关注[4 − 7]. 随着高级氧化技术(AOPs)的不断发展,活化高碘酸盐产生活性自由基降解有机污染物的研究逐渐成为环境领域研究热点[8 − 10]. 但是,高浓度的高碘酸盐是一类潜在的有毒物质,例如,高碘酸盐引起的碘含量增加可能导致甲状腺毒症,对小鼠腹腔内的半数致死量(LD50)为58 mg·kg−1[11]. 因此,在利用高碘酸盐的氧化特性合成有机物、分析物质浓度及降解污染物的过程中,需要准确量化反应体系中PI的消耗量,以研究高碘酸盐的氧化效能和机理,并防止过量的PI释放到水体中造成污染. 因此,建立经济、简便、高灵敏度、准确的分析方法测定水中微量的高碘酸盐尤为必要.
目前PI的测定方法主要有脉冲极谱法[12]、直接电位法[13]、循环伏安法[14]、碘量法[15]、色谱法[16]、荧光探针法[17]等,但这些分析方法均具有其局限性,无法满足实际应用要求. 例如,经典的碘量法测定PI,滴定步骤过于繁琐和耗时,不适于常规快速分析. 电化学法、色谱法和荧光法灵敏度高,但需要昂贵、操作复杂的仪器,亦不适用于常规分析. 分光光度法由于其分析速度快、操作方便、成本低等优点而被广泛应用[18]. 其中,2, 2-联氮-二(3-乙基-苯并噻唑-6-磺酸)(ABTS)和N, N-二乙基对苯二胺(DPD)因能被氧化剂氧化生成稳定带色自由基,而被普遍用于测定水处理中各种氧化剂(如过氧化氢[19]、过硫酸盐[20]、一氯胺[21]等)的浓度. 尽管目前已有相关的研究使用ABTS和DPD检测水中是否存在PI[22],但基于PI与ABTS或DPD反应,系统建立测定水中微量PI浓度的分光光度法尚未被报道.
本研究基于DPD、ABTS与PI的显色反应,分别建立了两种测定实际水样中微量高碘酸盐浓度的分光光度法,优化了两种方法的最佳反应pH、反应时间、显色剂浓度,并考察了共存离子、腐殖酸、不同水质背景对两种方法的影响,为建立快速,准确、低成本测定水中微量PI浓度的方法提供技术参考.
-
UV-2100紫外可见分光光度计(北京瑞利)、SX-20MV停留光谱仪(英国光物理公司).
ABTS和DPD均购于美国Sigma-Aldrich公司;其他所用分析纯试剂,如高碘酸钾、磷酸钠、氢氧化钠和盐酸等购于上海国药集团化学试剂;实验用水均为Millipore超纯水.
-
PI溶液:称取2.3012 g KIO4溶于超纯水中,定容至1000 mL,得到浓度约0.01 mol·L−1KIO4储备标液,使用前按碘量法标定[15],标定浓度为0.0109 mol·L−1;DPD溶液:称取1.3117 g DPD,加超纯水定容至500 mL,获得所需10 mmol·L−1 DPD储备液;ABTS溶液:称0.2743 g ABTS,加超纯水定容至500 mL,获得所需1 mmol·L−1 ABTS储备液. 所有溶液均在4 ℃条件下避光保存.
-
ABTS法测定PI:25 oC下,将5.0 mL醋酸盐缓冲液(pH=3.0,0.2 mmol·L−1)和3.0 mL ABTS(1 mmol·L−1)原液混合在10 mL比色管中;随后加入2 mL浓度未知的PI样品,通过连续振荡引发氧化显色反应;当反应进行到30 s时,将显色溶液转移到1 cm比色皿中并定容至10 mL,在415 nm波长下进行测定.
DPD法测定PI:25 oC下,将2.0 mL磷酸盐缓冲液(pH=6.5,0.5 mmol·L−1)和2.0 mL DPD(10 mmol·L−1)原液混合在10 mL比色管中;随后,加入2 mL未知浓度的PI样品并定容至10 mL. 由于该反应十分迅速,充分混合后可立即将显色溶液转移到1 cm比色皿中,在551 nm波长下进行测定. 当进行空白校正时,使用超纯水代替未知浓度的PI样品. 此外,为了确保数据的准确性和可靠性,所有测定至少进行3次,结果以平均值呈现. 参比液为超纯水. PI浓度通过比尔-郎伯定律计算得出:
其中,ΔAl为吸光度响应值;γ为所生成的ABTS·+或DPD·+的化学计量系数;l为比色皿光程(cm);ε为显色剂的标准摩尔吸收系数(L·mol−1·cm−1);Vfinal为定容后的体积(mL);Vsample为加入PI 的体积(mL). 上述所有测定均在室温下进行.
此外,采用4种不同来源的实际水样评价ABTS或DPD法在实际水样中测定PI浓度的可行性,所用实际水样均经过孔径为0.45 μm的醋酸纤维膜过滤后在4 ℃条件下冷藏. 表1列出了不同水样的主要参数.
-
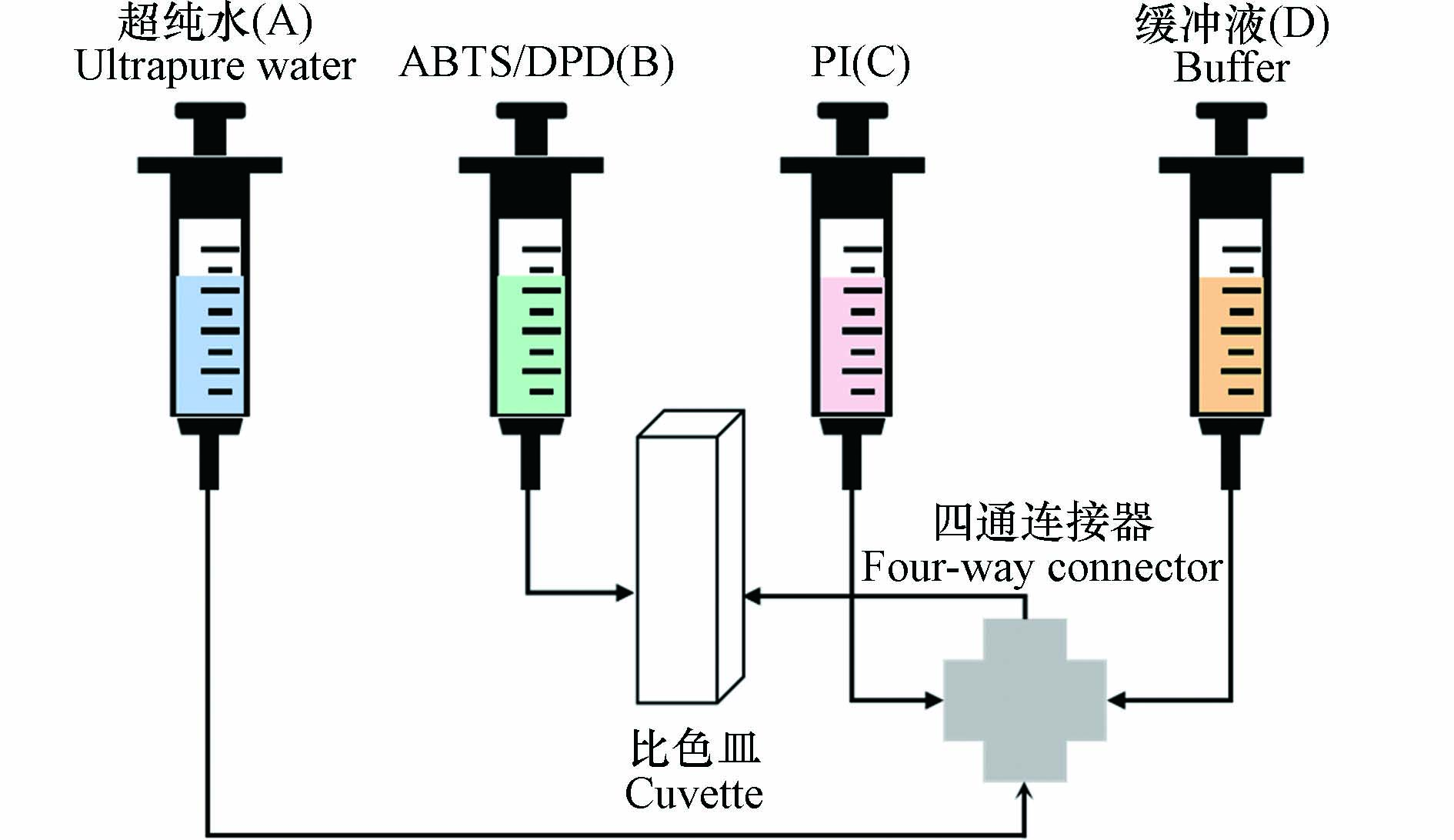
本研究应用停留光谱仪在连续混合模式下研究PI与ABTS/DPD的反应动力学. 将试剂通过4个自动驱动注射器混合并转移到比色皿中(如图1所示). 注射器A含有超纯水作为推进剂,用于将混合后的反应物推入比色皿. 第一次驱动(预混合)将注射器C中的PI和注射器D中的缓冲液注入混合室中,使反应体系达到最佳反应pH;第二次驱动将注射器B中的ABTS/DPD溶液和预混合液混合到比色皿中. 在比色皿中,ABTS/DPD与PI发生反应,通过实时测定反应体系在415 nm或551 nm处吸光度变化进行动力学研究.
-
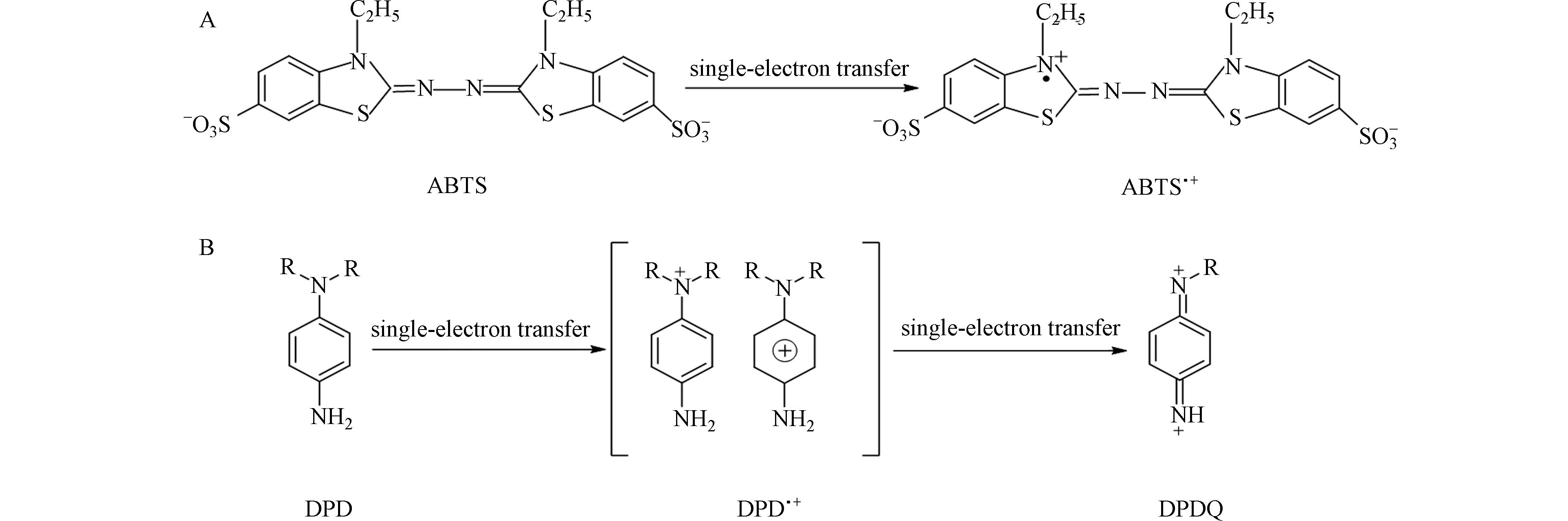
ABTS作为一种商业化学试剂,最初用于检测自由基的存在,目前也常作为介体使得漆酶通过介体电子转移过程生成具有较高氧化还原电位的活性物种[23 − 24]. 如图2A所示,稳定且无色的ABTS通过单电子转移与自由基或其他氧化剂反应,生成稳定、绿色的ABTS·+自由基. 对于DPD而言,其通过单电子转移形成稳定的粉红色共轭结构自由基(DPD·+,图2B). ABTS/ABTS·+、DPD/DPD·+及IO4−/IO3−的氧化还原电位分别为0.68 V [25]、0.33 — 0.76 V [26]和1.61 V[27]. 因此,从热力学的角度可判断PI氧化ABTS或DPD发生显色反应是可行的.
-
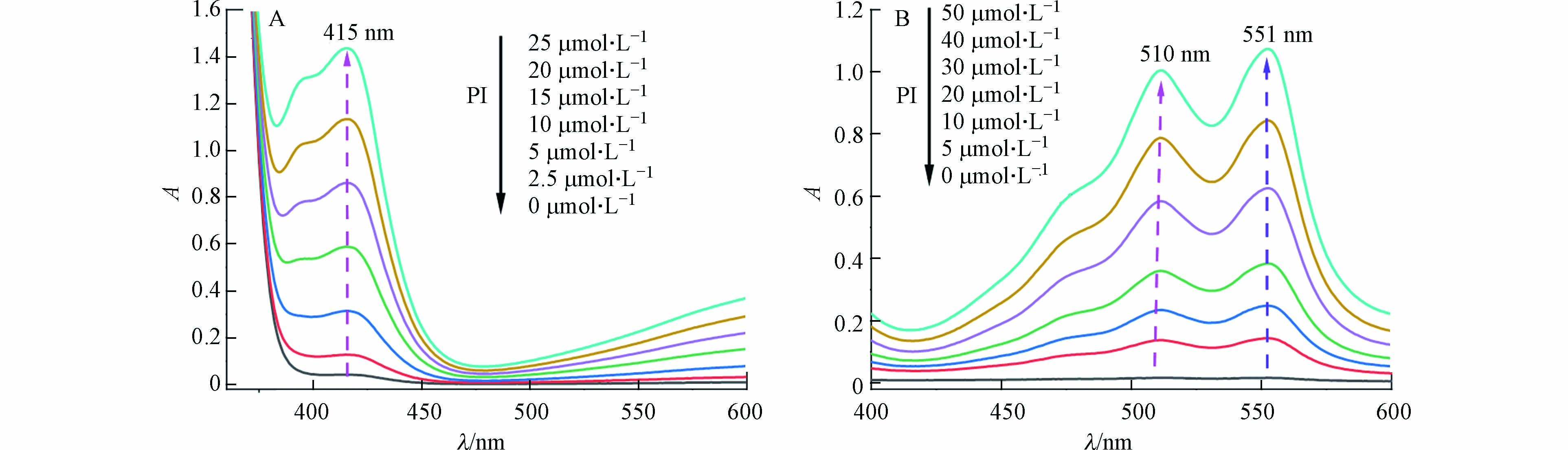
图3A和图3B分别为ABTS、DPD与不同剂量PI反应后的吸收光谱. 由图可知,两种方法所产生的ABTS·+、DPD·+自由基分别在415 nm、551 nm波长处有最大吸收峰,与文献结果一致[28 − 29]. 因此分别采用415 nm和551 nm作为两种方法的检测波长. 此外,两种方法的吸收曲线的形状和最大吸收波长λmax不随PI剂量变化而改变.
-
本研究进一步对两种分光光度法测定PI的条件,如反应时间、溶液pH、显色剂浓度等进行优化.
-
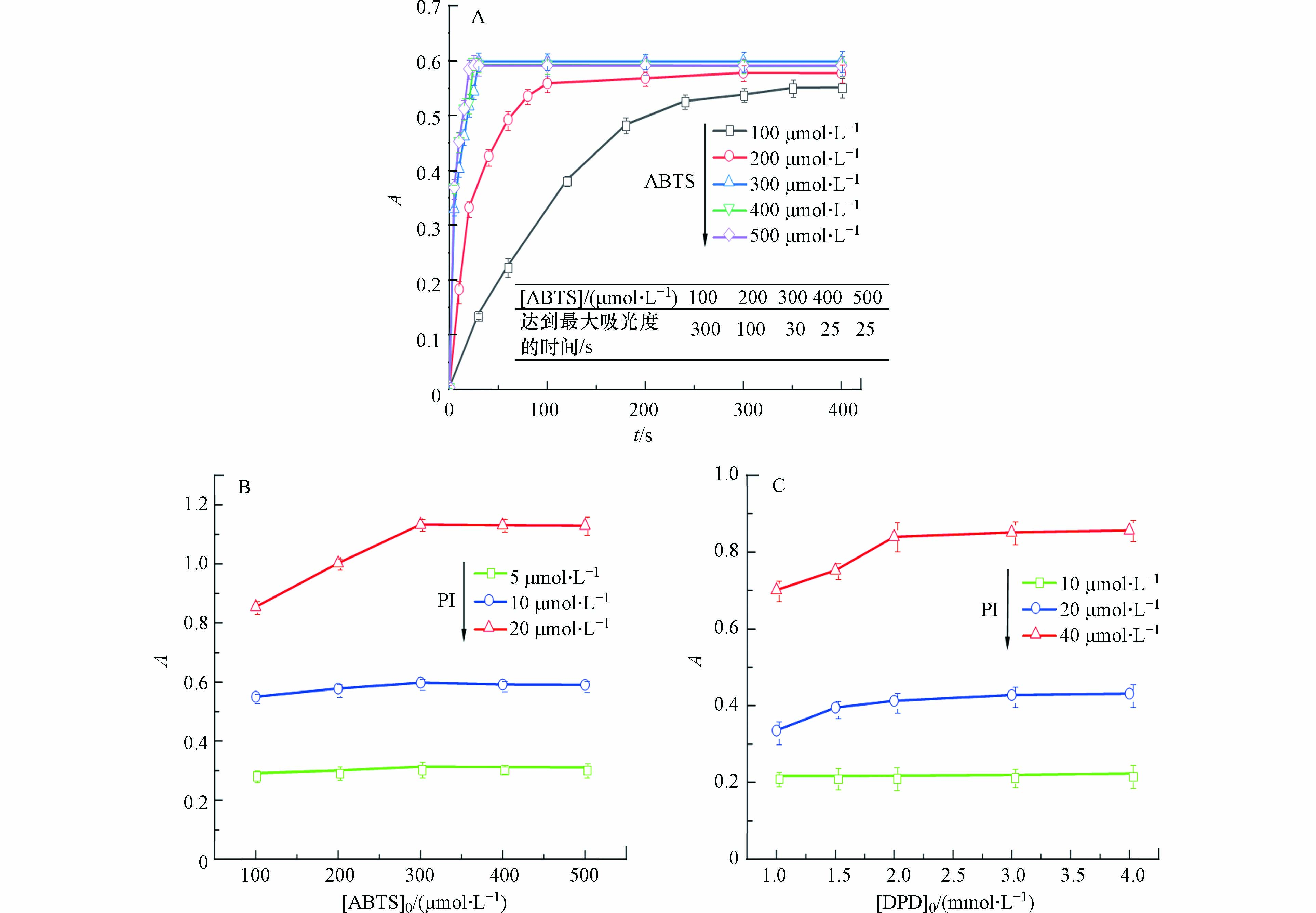
鉴于ABTS和DPD与PI反应较快,常规光谱仪难以准确追踪相关的反应动力学. 本研究采用停留光谱仪对其最佳反应时间及相应的动力学进行研究. 如图4A所示,在给定反应条件下,30 s后,ABTS·+在415 nm处的吸光度值达到最大值并基本保持不变. 在ABTS过量的条件下,ABTS与PI的反应符合准一级动力学模型,一级反应速率常数(kobs)为0.18 s−1,表观二级反应速率常数(kapp)为6.1 × 102 L·mol−1·s−1. 如图4B所示,在给定反应条件下,10 μmol·L−1的PI在0.48 s内基本完全衰减. 因此,当DPD与PI混合均匀后,可立即进行测定. 此外,该反应的kobs为16.44 s−1,对应的kapp为8.22 × 103 L·mol−1·s−1. 因此,DPD法更适用于PI的快速反应动力学研究.
-
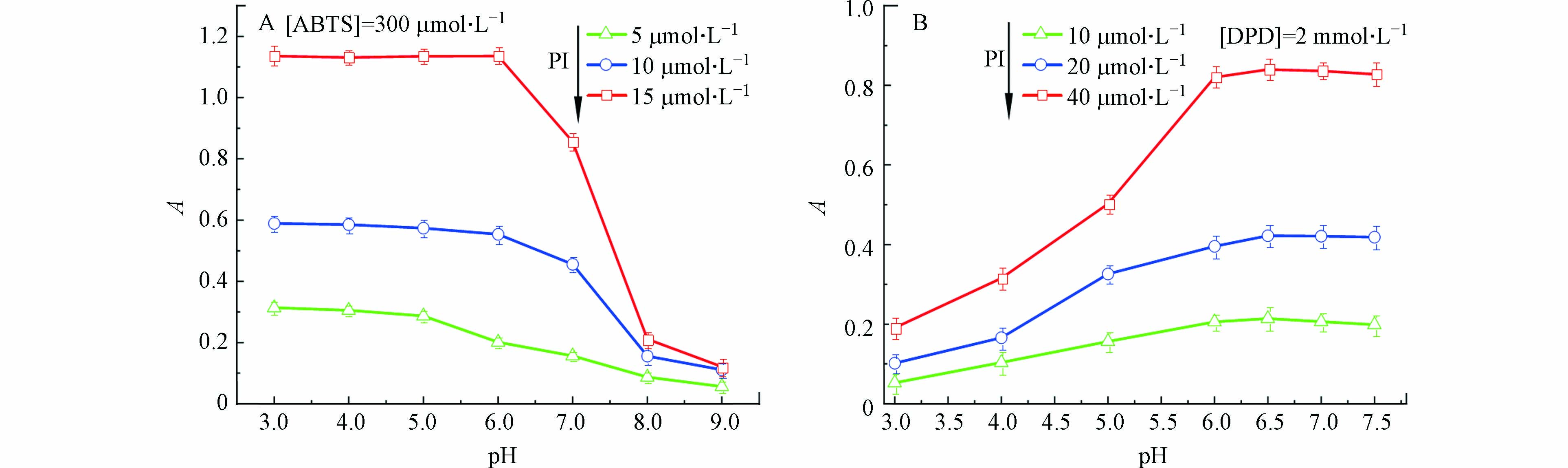
如图5A所示,当溶液pH在3.0 — 4.0时,ABTS溶液在415 nm处的吸光值随pH的升高而基本保持不变;而当pH为4.0 — 9.0时,吸光值随着pH的升高而逐渐降低. 其原因是不同pH下PI的存在形式不同,其氧化能力随pH升高而降低[26],从而影响ABTS·+的生成量. 当pH越低时,ABTS·+显色越稳定[30],因此选择pH=3.0作为最佳测定pH. 如图5B所示,pH在6.0 — 7.5时,DPD溶液在551 nm处的吸光度值随pH的升高而基本保持不变;当pH=6.5时,吸光度值达到最高. 然而,在酸性条件下,吸光度响应值较低,原因是强酸条件下,溶液中粉红色的DPD·+容易被进一步氧化形成无色的苯醌二亚胺衍生物(DPDQ)[31](图2B). 因此选择pH=6.5作为测定pH. 与ABTS法相比,DPD法的pH条件更温和,更适用于实际水体的分析.
-
如图6A所示,pH=3.0醋酸缓冲液条件下,随着ABTS浓度从100 μmol·L−1增加到300 μmol·L−1,反应体系达到最大吸光度的时间从300 s缩短到30 s. 图6B为ABTS浓度对ABTS·+显色范围的影响. 在给定PI浓度下,ABTS的浓度低于300 μmol·L−1时,吸光度值随ABTS浓度的增加而增加. 但当ABTS浓度超过300 μmol·L−1后,吸光度值几乎保持不变. 由于过量的ABTS会抑制ABTS·+在酸性条件下产生无色的ABTS和偶氮盐[30]. 因而,选择300 μmol·L−1作为ABTS的初始浓度.
图6C为pH=6.5条件下,PI与DPD氧化显色后,随着DPD浓度从1.0 mmol·L−1升高到2.0 mmol·L−1,DPD·+的吸光度明显增加. 但当进一步将DPD的浓度增加到4.0 mmol·L−1时,吸光度值轻微提高. 因此,选择2.0 mmol·L−1作为DPD的最佳显色浓度.
-
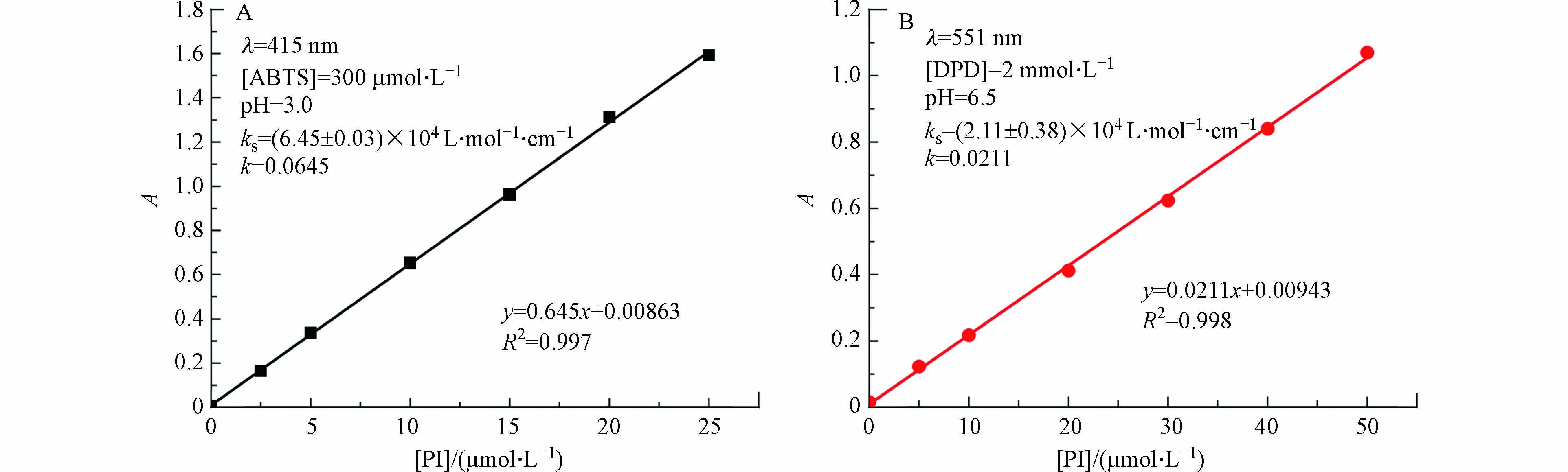
在给定条件下,对系列PI溶液进行测定,得到ABTS法测定PI的标准曲线,图7中k为标准曲线的斜率,将斜率k进行单位物质量浓度、单位比色皿长度的换算可以得到方法的灵敏度ks. 如图7A所示,吸光度值与PI浓度在0 — 20 μmol·L−1(R2>0.997)范围内具有良好线性关系. 对10 μmol·L−1的PI溶液连续测定6次,测定结果的相对偏差为1.22%. 该方法的灵敏度为(6.45±0.03)×104 L·mol−1·cm−1. 图7B为DPD法测定PI的标准曲线,吸光度值与PI浓度在0 — 40 μmol·L−1(R2>0.998)范围内具有良好线性关系. 对20 μmol·L−1的PI溶液连续测定6次,测定结果的相对偏差为1.68%. 该方法的灵敏度为(2.11±0.08)×104 L·mol−1·cm−1. 显然,ABTS法的灵敏度要优于DPD法.
-
ABTS法和DPD法中自由基产生的化学计量系数可由式(2)得到:
式中,γ为化学计量系数,ks为ABTS法、DPD法的测定灵敏度(L·mol−1·cm−1),ε为显色剂生成的显色自由基的标准摩尔吸收系数(L·mol−1·cm−1). 由图7A可知,ABTS法的灵敏度(ks)为(6.45 ± 0.03)×104 L·mol−1·cm−1,而根据文献[32]ABTS·+在415 nm处的ε = (3.34 ± 0.04) × 104 L·mol−1·cm−1,由公式2可得γ为1.93,接近2.0. 同理,由图7B中的ks值(2.11 ± 0.08) × 104 L·mol−1·cm−1以及DPD·+在551 nm处的ε = (1.05 ± 0.04) × 104 L·mol−1·cm−1(文献[33]),可算出DPD法的γ为2.01.
-
(1) 常见共存离子及天然有机质的影响
通过考察水中常见共存离子和天然有机质的干扰效应,可评估两种分析方法在实际水质中的适用性. 在优化的测定条件下,PI的浓度为10 μmol·L−1(1.9 mg·L−1),通过添加不同峰值剂量的干扰离子,分别进行ABTS法和DPD法的回收率试验,如表2所示. 当与过渡金属离子共存时,ABTS方法产生较大的偏差,原因是强酸条件下,过渡金属离子自身氧化能力增强,会使ABTS分子被氧化[34];此外酸性条件下,过渡金属也可能活化高碘酸盐产生各种氧化自由基[8],从而进一步氧化ABTS显色. 与ABTS法相比,DPD法在不同共存离子存在时显示出更良好的抗干扰性能,测定的相对误差不超过5%,故该该法选择性良好. 当腐殖酸的浓度为10 mg·L−1或20 mg·L−1时,两种方法的回收率误差不超过5%,初步说明两种方法适用于天然水体.
(2) 显色稳定性
为了评估自由基的显色稳定性,本研究进一步验证了不同水质背景(超纯水、自来水、水库水、地下水、污水)下,两种反应产生的自由基在0 — 30 min内吸光度值的变化. 如图8A所示,ABTS法产生的自由基在5种水样中保持稳定,在30 min内几乎保持不变. 由图8B可知,DPD自由基的吸光度值呈现先下降后升高的趋势,该趋势与DPD法测定H2O2浓度时类似[33]. 其主要原因是反应开始有部分DPD自由基进一步被氧化为无色的DPDQ,随着反应的进行DPD被水体中的溶解氧等氧化性杂质缓慢氧化生成DPD自由基. 此外,在不同的水质背景下,显色反应5 min内,DPD自由基的变色率小于5%,随后才会逐渐上升超过5%. 因此,当使用DPD法测定天然水体、污水和超纯水中PI的浓度时,应在5 min内完成测定.
-
本研究对20个空白样品进行测定,并计算标准偏差(σ),分别为σABTS = 0.00023,σDPD = 0.0026. 根据地表水自动监测技术规范HJ915-2017和HJ377-2019,以3倍σ计算检出限(LOD)和10倍σ计算定量下限(LOQ). 分别计算得到ABTS和DPD监测方法的LODABTS 为1.1 × 10−8 mol·L−1;LODDPD为3.7 × 10−7 mol·L−1. LOQABTS为3.3 × 10−8 mol·L−1,LOQDPD = 1.23 × 10−6 mol·L−1. 如表3所示,本研究提出的ABTS法和DPD法的检出限明显优于大部分传统PI分析方法的检出限,仅低于GC-MS法. 由于水体中的微量污染物的浓度通常较低,故水处理高级氧化过程中,氧化剂的用量通常在0.5 — 500 μmol·L−1[35]. 因此,两种的方法检出限和定量下限满足水处理的实际需求.
-
为了进一步评价两种方法的可靠性,在超纯水以及四种实际水样中分别加入5.0 μmol·L−1、10 μmol·L−1、20 μmol·L−1的高碘酸盐准溶液进行加标回收率试验. 结果如表4所示,不同水质背景下,ABTS法的回收率在95%—105%之间,而DPD法在污水水质背景下的回收率略高,这可能是DPD会与污水中的氧化性杂质反应,导致吸光度值的偏高.
-
本研究基于PI与ABTS和DPD反应在415 nm和551 nm处产生稳定的自由基建立了2种新的测定水中PI的方法,其特点如下:
(1)相比于传统检测PI浓度的方法,这两种方法均具有灵敏度高、检出限低、测定速度快、操作简单、测定结果准确、线性范围宽及成本低等优点.
(2)当PI浓度在0 — 20 μmol·L−1时,ABTS法的最佳测定条件为:λ = 415 nm,pH = 3.0,[ABTS] = 0.3 mmol·L−1,反应时间30 s. 当PI浓度在0 — 40 μmol·L−1时DPD法的最佳测定条件为:λ = 551 nm,pH = 6.5,[DPD] = 2.0 mmol·L−1,反应时间1 s. PI与DPD的反应非常快. 因此,DPD法在动力学实验中可以选择性地测量PI或快速猝灭PI.
(3)DPD法在抗过渡金属离子等共存物质干扰性方面优于ABTS法,但两种方法对其他水体中常见离子和腐殖酸均具有较好的抗干扰性. 加标回收率试验结果表明两种方法在测定天然水样中微量PI浓度的应用方面具有很好的潜力,但DPD法在污水中的应用潜力要小于ABTS法.
2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)(ABTS)和N,N-二乙基对苯二胺(DPD)显色分光光度法测定水中微量高碘酸盐的对比
Comparison of the spectrophotometric determination for trace periodate in water with 2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonate) (ABTS) and N,N-diethyl phenylene-1,4-diamine (DPD)
-
摘要: 高碘酸盐(IO4−,PI)因具有强氧化性和化学稳定性,被广泛应用于环境污染物的氧化降解,然而传统的PI分析方法具有操作复杂、费用高和检出限高等缺点,不适用于常规分析. 因此如何快速、准确、低成本测定水中微量PI备受环境领域研究者的关注. 本研究基于2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)(ABTS)和N,N-二乙基对苯二胺(DPD)与PI氧化显色的原理,建立了两种利用分光光度法测定水中低浓度PI的方法. 结果表明,当pH = 3.0时,ABTS与PI的反应化学计量系数接近1: 2,最大吸光值在415 nm处,标准曲线线性范围为0 — 20 μmol·L−1(R2>0.997),灵敏度为(6.45±0.03)× 104 L·mol−1·cm−1,检出限和定量下限分别为1.1 × 10−8 mol·L−1和3.3 × 10−8 mol·L−1;当pH = 6.5时,DPD与PI的反应化学计量系数为1: 2,最大吸光值在551 nm处,标准曲线线性范围为0 — 40 μmol·L−1(R2>0.998),灵敏度为(2.11±0.08)× 104 L·mol−1·cm−1,检出限和定量下限分别为3.7 × 10−7 mol·L−1和1.23 × 10−6 mol·L−1. 最后,研究了水中常见共存离子、腐殖酸、实际水质背景对PI测定的影响以及加标回收率,发现两种方法均具有良好的抗干扰性、稳定性和检测精度. 本研究结果表明两种方法可准确、快速、低成本测定水中微量PI浓度并具有较好的应用前景.
-
关键词:
- 高碘酸盐 /
- 分光光度法 /
- 2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)(ABTS) /
- N,N-二乙基对苯二胺(DPD) /
- 水处理.
Abstract: Periodate (IO4−, PI) is widely used in the oxidative degradation of environmental pollutants due to its strong oxidation and chemical stability. However, traditional methods for PI analysis have the disadvantages of complicated operation, high cost and high detection limit, which are not suitable for routine analysis. Therefore, detecting trace PI in water quickly, accurately and cheaply has attracted much attention from environmental researchers. Two new spectrophotometric methods for the determination of trace PI in water were proposed based on the oxidative coloration of 2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonate) (ABTS) or N,N-diethyl-p-phenylenediamine (DPD) and PI in this study. Results show that the stoichiometric coefficient of ABTS and PI is close to 1:2, and the maximum absorption value is 415 nm at pH = 3.0. The linear range of the standard curve was 0—20 µmol·L−1 (R2>0.997), and the sensitivity was (6.45±0.03) × 104 L·mol−1·cm−1. The limit of detection and lower limit of quantitation were 1.1 × 10−8 mol·L−1 and 3.3 × 10−8 mol·L−1, respectively. The stoichiometric coefficient of DPD and PI reaction was 1:2, the maximum absorption value was 551 nm in pH = 6.5. The linear range of the standard curve was 0 — 40 µmol·L−1 (R2>0.998), and the sensitivity was (2.11±0.08) × 104 L·mol−1·cm−1. The limit of detection and lower limit of quantitation were 3.7 × 10−7 mol·L−1 and 1.23 × 10−6 mol·L−1, respectively. Finally, the influence of common coexisting ions, the actual water quality background and the recovery rate were studied. It was found that two methods have good anti-interference performance, stability and detection accuracy. The results of this study indicate that the two methods can accurately, rapidly and cheaply determine the concentration of trace PI in water, and have a good application prospect. -

-
图 6 (A)ABTS浓度对ABTS·+在415 nm处生成速率的影响;(B)ABTS浓度对ABTS溶液在415 nm处吸光度值的影响;(C) DPD浓度对DPD溶液在551 nm处吸光度值的影响
Figure 6. (A) Effect of ABTS concentration on the rate of ABTS·+ formation at 415 nm; (B) Effect of ABTS concentration on the absorbance at 415 nm; (C) Effect of DPD concentration on the absorbance at 551 nm
表 1 不同实际水样的主要水质参数
Table 1. Major water parameters of different real water samples
水质背景
Water matrixespH DOC/
(mg·L−1)碱度/(mg·L−1)*
Alkalinity自来水 7.36 0.83 49.82 水库水 7.69 10.63 117.43 地下水 7.26 6.35 68.75 污水 6.72 53.62 42.53 注:* 以CaCO3计算. Note:* Calculated as CaCO3 . 表 2 不同峰值剂量干扰离子条件下两种PI浓度测定方法的回收试验
Table 2. Recovery test of two methods for PI determination with different spiking dosages of interference ions
共存离子
Interference ion[PI]/[干扰离子]
Interference ion回收率/%
Recovery rateABTS DPD PI — 100.1±0.87 101.1±0.95 Fe3+ 1:500 104.6±1.23 99.7±0.0.89 1:1000 117.6±1.14 103.4±0.76 Co2+ 1:200 108.7±1.33 101.2±0.84 1:500 130.3±1.28 104.4±0.79 Cu2+ 1:50 240.3±1.68 103.4±0.54 1:100 251.2±1.55 106.7±1.22 Ca2+ 1:500 102.5±0.98 101.3±0.56 1:1000 105.7±1.24 104.6±0.85 Mg2+ 1:200 103.3±1.54 101.9±1.25 1:500 107.5±1.03 105.6±1.11 Na+ 1:500 102.3±1.26 101.9±1.63 1:1000 106.6±0.93 105.6±1.45 NO3− 1:500 102.7±1.59 102.6±1.68 1:1000 104.6±1.66 105.8±1.57 SO42− 1:500 102.3±1.74 101.7±1.25 1:1000 104.2±1.57 106.4±1.23 CO32− 1: 200 100.8±2.05 101.5±1.36 1:500 104.7±2.37 106.4±1.49 Cl− 1:500 102.5±1.84 103.4±1.39 1:1000 105.4±1.69 106.3±1.35 Br− 1:500 109.6±1.79 102.4±1.84 1:1000 120.9±1.94 105.5±1.58 腐殖酸(HA) 1:5 101.5±1.64 102.7±1.42 1:10 103.3±1.38 104.8±1.86 表 3 不同高碘酸根分析方法的检出限对比
Table 3. Comparison of detection limits of different analysis methods for periodate
表 4 回收试验结果(n=5)
Table 4. Results of recovery experiment (n=5)
水质
Water matrixes加标量/(μmol·L−1)
Spiked测量值/(μmol·L−1)
MeasuredRSD/% 回收率/%
RecoveryABTS DPD ABTS DPD ABTS DPD 超纯水 5.0 4.82±0.07 4.89±0.12 1.45 2.45 96.4 97.6 10.0 10.12±0.12 9.98±0.08 1.18 1.82 101.2 99.3 20.0 19.76±0.18 20.16±0.42 0.91 2.01 98.8 100.8 自来水 5.0 4.92±0.05 5.08±0.13 1.01 2.61 98.5 101.6 10.0 9.96±0.12 9.93±0.34 1.20 3.42 99.6 99.3 20.0 19.48±0.19 20.78±0.45 0.97 2.16 97.4 103.9 水库水 5.0 5.07±0.07 5.23±0.16 1.38 3.06 101.4 104.6 10.0 9.93±0.16 10.25±0.24 1.61 2.34 99.3 102.5 20.0 19.58±0.21 20.56±0.36 1.07 1.75 97.9 102.8 地下水 5.0 4.93±0.06 4.98±0.14 1.21 2.81 98.6 99.7 10.0 9.67±0.12 10.06±0.19 1.24 1.89 96.7 100.6 20.0 19.86±0.21 19.36±0.37 1.05 1.91 99.3 96.8 污水 5.0 5.21±0.11 7.03±0.19 2.11 2.71 104.2 140.6 10.0 10.39±0.16 11.51±0.21 1.54 1.82 103.9 115.1 20.0 19.88±0.29 22.08±0.48 1.56 2.17 99.4 110.4 -
[1] MOZAFARI H, HOJJATOLESLAMY M, MOHAMMADIZADEH M. Optimizing the properties of Zodo gum and examining its potential for amino acid binding by periodate oxidation[J]. International Journal of Biological Macromolecules, 2021, 167: 1517-1526. doi: 10.1016/j.ijbiomac.2020.11.106 [2] PANDEIRADA C O, ACHTERWEUST M, JANSSEN H G, et al. Periodate oxidation of plant polysaccharides provides polysaccharide-specific oligosaccharides[J]. Carbohydrate Polymers, 2022, 291: 119540. doi: 10.1016/j.carbpol.2022.119540 [3] LI J J, ZHANG J, XU M M, et al. Advances in glycopeptide enrichment methods for the analysis of protein glycosylation over the past decade[J]. Journal of Separation Science, 2022, 45(16): 3169-3186. doi: 10.1002/jssc.202200292 [4] ALI SHAH S N, KHAN M, REHMAN Z U. A prolegomena of periodate and peroxide chemiluminescence[J]. TrAC Trends in Analytical Chemistry, 2020, 122: 115722. doi: 10.1016/j.trac.2019.115722 [5] LIU F Y, LI Z M, DONG Q Q, et al. Catalyst-free periodate activation by solar irradiation for bacterial disinfection: Performance and mechanisms[J]. Environmental Science & Technology, 2022, 56(7): 4413-4424. [6] ZHANG K T, ZHANG S Q, YE C S, et al. Sunlight-activated periodate oxidation: A novel and versatile strategy for highly efficient water decontamination[J]. Chemical Engineering Journal, 2023, 451: 138642. doi: 10.1016/j.cej.2022.138642 [7] SUN H W, HE F, CHOI W. Production of reactive oxygen species by the reaction of periodate and hydroxylamine for rapid removal of organic pollutants and waterborne bacteria[J]. Environmental Science & Technology, 2020, 54(10): 6427-6437. [8] LI R X, WANG J Q, WU H, et al. Periodate activation for degradation of organic contaminants: Processes, performance and mechanism[J]. Separation and Purification Technology, 2022, 292: 120928. doi: 10.1016/j.seppur.2022.120928 [9] FANG G G, LI J L, ZHANG C, et al. Periodate activated by manganese oxide/biochar composites for antibiotic degradation in aqueous system: Combined effects of active manganese species and biochar[J]. Environmental Pollution, 2022, 300: 118939. doi: 10.1016/j.envpol.2022.118939 [10] LONG Y K, DAI J A, ZHAO S Y, et al. Atomically dispersed cobalt sites on graphene as efficient periodate activators for selective organic pollutant degradation[J]. Environmental Science & Technology, 2021, 55(8): 5357-5370. [11] LENT E M, CROUSE L C B, ECK W S. Acute and subacute oral toxicity of periodate salts in rats[J]. Regulatory Toxicology and Pharmacology, 2017, 83: 23-37. doi: 10.1016/j.yrtph.2016.11.014 [12] ELMOSALAMY M A F, MOODY G J, THOMAS J D R, et al. Poly (vinyl chloride) matrix membrane electrodes responsive to thiocyanate, perchlorate and periodate[J]. Analytical Letters, 1987, 20(10): 1541-1555. doi: 10.1080/00032718708078025 [13] OTHMAN A M. PVC membrane sensor based on periodate—Cetylpyridinium ion pair for the potentiometric determination of periodate[J]. Journal of Analytical Chemistry, 2010, 65(11): 1191-1197. doi: 10.1134/S106193481011016X [14] GÖKÇEL H İ, NIŞLI G. Static and flow-injection voltammetric determination of periodate by reduction at a rotating platinum wire electrode[J]. Analytica Chimica Acta, 1994, 292(1/2): 99-105. [15] VEELAERT S, de WIT D, TOURNOIS H. An improved kinetic model for the periodate oxidation of starch[J]. Polymer, 1994, 35(23): 5091-5097. doi: 10.1016/0032-3861(94)90670-X [16] GUPTA M, JAIN A, VERMA K K. Optimization of experimental parameters in single-drop microextraction-gas chromatography-mass spectrometry for the determination of periodate by the Malaprade reaction, and its application to ethylene glycol[J]. Talanta, 2007, 71(3): 1039-1046. doi: 10.1016/j.talanta.2006.05.083 [17] HONG K I, CHOI W H, JANG W D. Hydroxythiophene-bearing benzothiazole: Selective and sensitive detection of periodate and its application as security ink[J]. Dyes and Pigments, 2019, 162: 984-989. doi: 10.1016/j.dyepig.2018.11.026 [18] SHI Z N, CHOW C W K, FABRIS R, et al. Applications of online UV-vis spectrophotometer for drinking water quality monitoring and process control: A review[J]. Sensors, 2022, 22(8): 2987. doi: 10.3390/s22082987 [19] ZOU J, CAI H H, WANG D Y, et al. Spectrophotometric determination of trace hydrogen peroxide via the oxidative coloration of DPD using a Fenton system[J]. Chemosphere, 2019, 224: 646-652. doi: 10.1016/j.chemosphere.2019.03.005 [20] ZOU J, HUANG Y X, ZHU L R, et al. Multi-wavelength spectrophotometric measurement of persulfates using 2, 2’-azino-bis(3-ethylbenzothiazoline-6-sulfonate) (ABTS) as indicator[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2019, 216: 214-220. doi: 10.1016/j.saa.2019.03.019 [21] 陶辉, 王玲, 李星, 等. 饮用水氯胺法消毒过程中一氯胺的水杨酸分光光度法测定[J]. 环境化学, 2009, 28(1): 126-131. doi: 10.3321/j.issn:0254-6108.2009.01.027 TAO H, WANG L, LI X, et al. Monochloramine testing method in chloramination process—Salicylate spectrophotometric method[J]. Environmental Chemistry, 2009, 28(1): 126-131 (in Chinese). doi: 10.3321/j.issn:0254-6108.2009.01.027
[22] LIIMATAINEN H, SIRVIÖ J, PAJARI H, et al. Regeneration and recycling of aqueous periodate solution in dialdehyde cellulose production[J]. Journal of Wood Chemistry and Technology, 2013, 33(4): 258-266. doi: 10.1080/02773813.2013.783076 [23] 黄丽萍, 马华, 潘雨, 等. 石墨烯对漆酶/介体系统降解碱木素的影响[J]. 环境化学, 2018, 37(4): 704-712. doi: 10.7524/j.issn.0254-6108.2017082305 HUANG L P, MA H, PAN Y, et al. Effects of graphene on the degradation of alkali lignin by laccase-mediator system[J]. Environmental Chemistry, 2018, 37(4): 704-712 (in Chinese). doi: 10.7524/j.issn.0254-6108.2017082305
[24] 张司雨, 董仕鹏, 高士祥, 等. 漆酶/ABTS介体系统催化氧化羟基化多溴联苯醚[J]. 环境化学, 2022, 41(12): 3855-3865. doi: 10.7524/j.issn.0254-6108.2022062702 ZHANG S Y, DONG S P, GAO S X, et al. Transformation of hydroxylation polybrominateddiphenyl ethers in laccase-ABTS system[J]. Environmental Chemistry, 2022, 41(12): 3855-3865 (in Chinese). doi: 10.7524/j.issn.0254-6108.2022062702
[25] GRAMSS G. Reappraising a controversy: Formation and role of the azodication (ABTS2+) in the laccase-ABTS catalyzed breakdown of lignin[J]. Fermentation, 2017, 3(2): 27. doi: 10.3390/fermentation3020027 [26] ALBERTI A, BOLOGNINI L, MACCIANTELLI D, et al. The radical cation of N, N-diethyl-para-phenylendiamine: A possible indicator of oxidative stress in biological samples[J]. Research on Chemical Intermediates, 2000, 26(3): 253-267. doi: 10.1163/156856700X00769 [27] CODOLÀ Z, M S CARDOSO J, ROYO B, et al. Highly effective water oxidation catalysis with iridium complexes through the use of NaIO4[J]. Chemistry - A European Journal, 2013, 19(22): 7203-7213. doi: 10.1002/chem.201204568 [28] CAI H H, LIU X, ZOU J, et al. Multi-wavelength spectrophotometric determination of hydrogen peroxide in water with peroxidase-catalyzed oxidation of ABTS[J]. Chemosphere, 2018, 193: 833-839. doi: 10.1016/j.chemosphere.2017.11.091 [29] FAN W J, QIAO J L, GUAN X H. Multi-wavelength spectrophotometric determination of Cr(VI) in water with ABTS[J]. Chemosphere, 2017, 171: 460-467. doi: 10.1016/j.chemosphere.2016.11.153 [30] LABRINEA E P, GEORGIOU C A. Stopped-flow method for assessment of pH and timing effect on the ABTS total antioxidant capacity assay[J]. Analytica Chimica Acta, 2004, 526(1): 63-68. doi: 10.1016/j.aca.2004.09.040 [31] GOKULAKRISHNAN S, MOHAMMED A, PRAKASH H. Determination of persulphates using N, N-diethyl-p-phenylenediamine as colorimetric reagent: Oxidative coloration and degradation of the reagent without bactericidal effect in water[J]. Chemical Engineering Journal, 2016, 286: 223-231. doi: 10.1016/j.cej.2015.10.058 [32] PINKERNELL U, NOWACK B, GALLARD H, et al. Methods for the photometric determination of reactive bromine and chlorine species with ABTS[J]. Water Research, 2000, 34(18): 4343-4350. doi: 10.1016/S0043-1354(00)00216-5 [33] BADER H, STURZENEGGER V, HOIGNÉ J. Photometric method for the determination of low concentrations of hydrogen peroxide by the peroxidase catalyzed oxidation of N, N-diethyl-p-phenylenediamine (DPD)[J]. Water Research, 1988, 22(9): 1109-1115. doi: 10.1016/0043-1354(88)90005-X [34] LI T, DAI L, HUANG Y X, et al. Spectrophotometric determination of Cr(VI) in water using N, N-diethyl-p-phenylenediamine (DPD) as the indicator[J]. Journal of Environmental Chemical Engineering, 2021, 9(5): 105517. doi: 10.1016/j.jece.2021.105517 [35] LIU X, FU Q, XU P, et al. Rapid determination of monopersulfate with bromide ion-catalyzed oxidation of 2, 2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid (ABTS)[J]. Chemical Engineering Journal, 2022, 433: 133551. doi: 10.1016/j.cej.2021.133551 -



 下载:
下载: