-
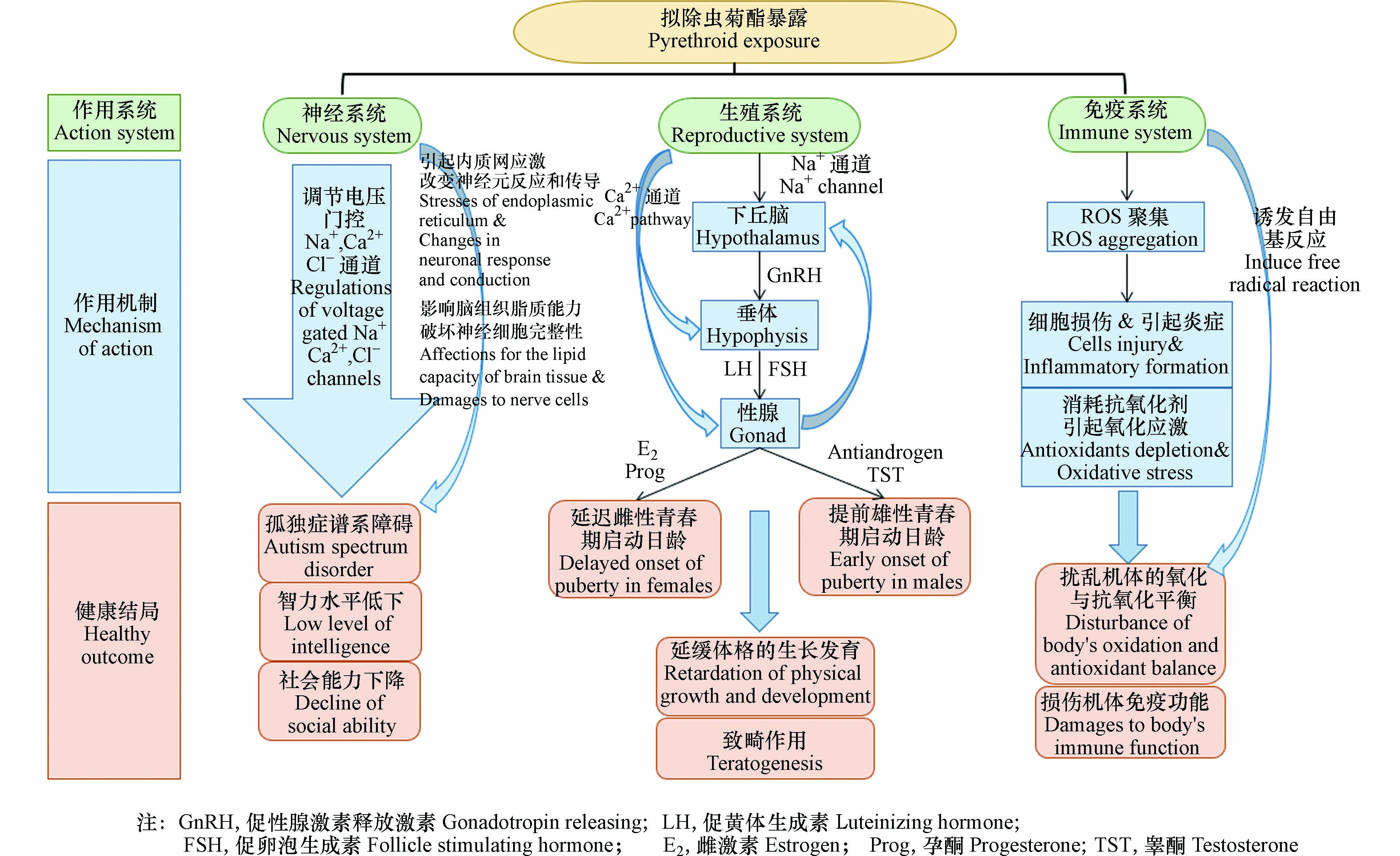
拟除虫菊酯类杀虫剂作为新一代仿生合成的杀虫剂,正广泛地应用于农业杀虫和家庭害虫防治,近年来已占到全球杀虫剂总使用量25%,在全球杀虫剂市场中排名第二[1]. 按其化学结构可分为两种:Ⅰ型不含氰基,如氯菊酯(permethrin, PM)、联苯菊酯(bifenthein, BF)、胺菊酯(tetramethrin, Tet)等;Ⅱ型含氰基,包括溴氰菊酯(deltamethrin, DM)、氯氰菊酯(cypermethrin, CYP)、氰戊菊酯(fenvalerate, FVT)、甲氰菊酯(fenpropathrin, Fen)等. 随着拟除虫菊酯类杀虫剂使用量、频率的增加,其在居住环境和生物体内普遍检出[2]. 同时越来越多研究表明,母亲孕期或儿童生长初期长期暴露于该农药对处于生长发育关键阶段的儿童尤其具有免疫毒性、神经毒性、生长发育毒性和代谢毒性等[3].
儿童体内各组织器官尚未发育完全,接触环境污染物的途径多样,对环境污染物更易感[4]. Lu等[5]将儿童的饮食从传统食品改为有机食品(不含杀虫剂)的研究,通过对尿液样本的收集,比较发现儿童对拟除虫菊酯的暴露水平差异是主要是饮食摄入不同的结果. 与此同时,Tulve等[6]还在室内外空气、地毯灰尘、衣物等中检测到PM、CYP、BF等,这进一步提示儿童还可能通过摸爬滚打、接触成人衣物上的附着农残等途径接触拟除虫菊酯类杀虫剂,接触方式较成人更为多样[7]. 长期暴露于拟除虫菊酯类农药的儿童神经认知、神经运动或神经行为表现出现困难的风险较高,同时也可能通过内分泌干扰等方式影响儿童的生殖系统和生长发育,因此了解该类农药对儿童健康的影响是十分有必要的.
-
拟除虫菊酯类杀虫剂主要通过改变昆虫Na+通道活性使昆虫神经细胞发生异常兴奋,因此儿童也可因长期低剂量暴露于该农药而产生神经中毒症状[8]. Hicks等[9]通过调查其所在医疗中心周边区域的孤独症谱系障碍(autism spectrum disorder, ASD)和发育障碍(developmental disorders, DD)的诊断率发现,空中喷洒拟除虫菊酯杀虫剂暴露量较大的地区儿童ASD和DD患病率较高,证实了农药接触途径与神经发育迟缓率之间的显著关系. 拟除虫菊酯在体内代谢产物主要有3-苯氧基苯甲酸(3-phenoxy benzoic, 3-PBA)、4-氟-3-苯氧基苯甲酸(4-fluoro-3-phenoxy benzoic acid, 4-F-3-PBA)、顺式-3-(2,2二溴乙烯基)-2,2-二甲基环丙烷-甲酸[cis-3-(2,2dibromovinyl)-2,2-dimethyl cyclopropane carboxylic acid, cis-DBCA]、顺式-3-(2,2二氯乙烯基)-2,2-二甲基环丙烷-甲酸[cis-3-(2,2dichlorovinyl)-2,2-dimethyl cyclopropane carboxylic acid, cis-DCCA]和反式-3-(2,2二氯乙烯基)-2,2-二甲基环丙烷-甲酸[trans-3-(2,2dichlorovinyl)-2,2-dimethyl cyclopropane carboxylic acid, trans-DCCA]等5种[10]. 本文收集到10项孕妇或儿童拟除虫菊酯暴露对儿童神经发育影响有关的人群流行病学研究,总结了这些文献的研究方法及其与儿童神经系统的相关性,结果见表1. 这些文献通过队列研究或病例对照研究证实了母亲孕期或儿童时期环境剂量拟除虫菊酯的暴露是儿童患自闭症、认知能力和智力水平低下的关键因素,均体现了生命早期拟除虫菊酯杀虫剂的暴露情况与个体认知与神经发育的密切联系.
拟除虫菊酯类杀虫剂不仅对儿童早期神经与心理发育产生影响,还在行为与情绪症状方面产生一定的影响. Melissa等[21]发现孕妇妊娠期尿中含3-PBA、cis-DCCA水平与儿童行为评估系统得分呈负相关,这表明母亲产前该农药代谢物的水平与儿童不良行为调节、情绪控制、内在行为有关. 然而,另有Wagner等[22]在NHANES的一项横断面研究报告了3-PBA与注意力缺陷多动障碍(attention deficit and hyperactivity disorder, ADHD)和多动症之间的关联,而Quirós-Alcalá等[23]在NHANES的另一项研究表明横断面调查不能确定暴露和结果的时间顺序,也不能确定因果关系,从而报告了与ADHD之间的无效关联,这可能与行为评估研究系统自身的缺陷以及低暴露检测频率和生物标记物的局限性有关. 此外,有5项关于孕妇或儿童接触拟除虫菊酯后,影响儿童行为情绪的人群流行病学研究,结果见表2. 这一系列研究表明拟除虫菊酯类杀虫剂与儿童罹患多动症和注意力缺陷疾病的潜在相关性,对儿童的语言表达、社会能力和社交情绪可能存在负面作用. 因此,建议孕妇在怀孕期间尽量避免接触此种农药,婴儿在生长发育初期应减少此种农药的暴露水平,以此降低其对儿童神经系统的伤害.
-
已有研究通过给8周龄雌性C57BL/6J怀孕小鼠口服0.3、1、3 mg·kg−1的DM,在整个妊娠期和哺乳期持续给药,到产后22 d幼崽断奶时结束. 在产前或发育过程中暴露于DM的小鼠表现出一些让人联想到ADHD的特征,包括多巴胺转运蛋白(dopamine transporter, DAT)水平升高、多动、工作记忆和注意力缺陷和冲动等行为,表明孕期和哺乳期长期低剂量的拟除虫菊酯暴露是子代ADHD的危险因素[29]. Curtis等[30]同样在怀孕和哺乳期给小鼠口服3 mg·kg−1的DM(远低于EPA推荐的参考剂量10.1 mg·kg−1),与对照组相比,实验组小鼠发声减少,重复行为增加,恐惧条件反射和操作性条件反射有一定损害. 这进一步提示了DM是导致多巴胺功能障碍和DD的重要可能原因. Kim等[31]选取10、21、40日龄的Sprague-Dawley雄性大鼠,以灌胃方式给予0.4、2、10 mg·kg−1的DM. 其中10 mg·kg−1组,10、21日龄大鼠在最初一段时间表现出明显的唾液分泌,并在6—8 h和12—16 h内死亡;2 mg·kg−1组中,10、21日龄大鼠出现严重的流涎和震颤,其中32只10日龄的幼崽中有3只死亡,而40日龄大鼠仅在10 mg·kg−1组出现轻微流涎症状. 此项研究表明不同生长发育的动物对DM的敏感性不同,所产生神经毒性具有年龄依赖性,其严重程度与年龄存在负相关,同时也证实了拟除虫菊酯毒性作用的强度与暴露剂量成正相关.
另有Hu等[32]利用斑马鱼胚胎的研究发现,个体暴露于DM明显增加了斑马鱼胚胎的死亡率和畸形率,推测DM暴露主要通过改变甘油磷脂和氨基酸的代谢,从而削弱斑马鱼幼体适应能力,损害学习记忆功能,导致神经行为改变. Ranjani等[33]将斑马鱼胚胎受精在24 h和48 h两个时间点暴露于低浓度的CYP,出现了孵化过程延迟、心跳加快和脊柱弯曲变形等表型异常,进一步证明了拟除虫菊酯杀虫剂的神经发育毒性.
一系列的动物实验已表明拟除虫菊酯类杀虫剂对于胚胎和幼年哺乳动物的神经发育毒性,因此孕妇在怀孕期间和儿童在生长发育初期接触此种农药,可能对儿童运动活动、听觉惊吓、学习和记忆有持久影响. 为降低其对儿童神经系统的伤害,减少拟除虫菊酯类神经毒物的暴露和探究具体的毒性机制对于保护儿童的神经发育至关重要.
-
研究显示,拟除虫菊酯类杀虫剂主要通过改变神经动作电位产生的基础——电压门控通道影响儿童神经系统,即减缓Na+通道的激活与失活使通道持续开放,允许大量Na+通过中枢神经膜,从而造成神经兴奋性的传导障碍[8],出现神经中毒症状;与此同时,神经元持续兴奋,导致神经功能紊乱,中毒症状进一步加重. Soderlund等[34]关于Xenopus laevis卵母细胞拟除虫菊酯暴露对克隆昆虫和哺乳动物Na+通道异构体作用的研究也表明,拟除虫菊酯对昆虫和哺乳动物Na+通道存在依赖效应,且依赖性因拟除虫菊酯化合物种类的不同而不同.
同时,神经营养素也可对儿童大脑中的神经元产生一定影响,其中的神经生长因子已被发现是一种调节神经元存活的蛋白质. Hossain等[35]研究小鼠原代海马神经元发现,细胞暴露于DM(1—5 μmol·L−1)可引起内质网应激,降低神经生长因子水平,最终通过Akt信号通路诱导海马细胞凋亡,从而损伤小鼠的记忆能力,造成学习障碍. 此外,FVT还可以影响小鼠脑组织脂质的过氧化及抗过氧化能力破坏神经细胞细胞膜的完整性[36]. 同时含α-氰基的拟除虫菊酯还能够介导烟碱(胆碱)神经传导的调节、Ca2+或Cl-通道的直接相互作用而实现对神经系统的影响[37].
上述研究表明,拟除虫菊酯类杀虫剂可通过调控电压门控Na+通道或Ca2+、Cl-通道、改变神经元的反应和传导、破坏组织细胞完整性等方式发挥其对于神经系统的毒性作用. 其中电压门控Na+通道是拟除虫菊酯神经毒性作用的主要靶点,但对于急性毒性可能涉及的其他靶点及毒理学意义仍存在未知性,拟除虫菊酯中毒的二级靶点也仍有待进一步确定.
-
拟除虫菊酯类杀虫剂可通过调节促性腺激素的分泌状况影响儿童的青春期发育时间. 有研究发现尿液中3-PBA浓度与女孩乳房Tanner分级、生殖器毛发Tanner分级的OR值呈负相关具有统计学意义,同时3-PBA浓度与月经初潮所指示的青春期开始之间也存在负相关[38]. 而另有对463名9—16岁男孩的研究发现,3-PBA与促性腺激素呈正相关(P<0.001),这表明该农药可使男孩青春期提前[39]. 针对上述不同的结论,首先可能是男女孩自身的代谢差异导致到达靶标的终浓度不同,因而出现不同性别产生相反效应的现象;其次,拟除虫菊酯类杀虫剂在人体内代谢迅速,半衰期短,因此3-PBA水平的测定不能准确反映该农药在人体的暴露水平. 针对以上局限性,拟除虫菊酯类杀虫剂对儿童生长发育的影响亟待进一步研究.
关于拟除虫菊酯类杀虫剂对儿童体格发育的影响,Xu、Zhang等[40 − 41]发现拟除虫菊酯类杀虫剂代谢物的增加与出生体重、头围的增加成正相关;Ding、Eric等[42 − 43]发现母体尿中拟除虫菊酯类杀虫剂代谢物浓度与幼儿的体重呈负相关;而Ding、Jonathan、Berkowitz等[42,44 − 45]所针对的出生队列研究显示个体总代谢物水平与出生长度、头围或妊娠期之间不存在相关性. 其实,人们每天都会接触到多种环境毒物,不同性质化合物可能共同作用叠加产生不同的影响,而上述对于拟除虫菊酯类杀虫剂对儿童出生体型影响的研究集中在探索暴露于单一化合物对生长发育的影响. 针对这一局限性,可通过研究杀虫剂混合物的生物标志物产前尿液浓度与出生体重、身长和头围之间的关系,并结合动物实验开展进一步的研究.
-
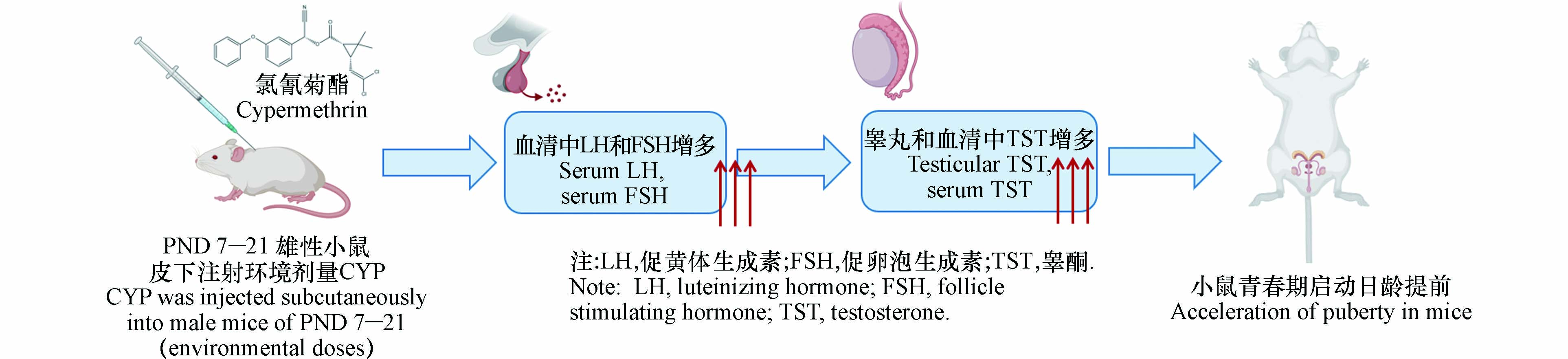
大量动物实验表明,拟除虫菊酯类杀虫剂可对生物体青春期发育造成影响. Pine等[46]将出生22 d的未成年雌性大鼠经S-FVT(0、0.5、1.0、5.0 mg·kg−1)灌胃处理后,发现其通过抑制下丘脑控制的促性腺激素的分泌显著延迟了雌性青春期的开始. Moniz等[47]利用类似的实验也得出了相同的结论. 本课题组前期研究将出生后7—21 d雄性小鼠通过皮下注射的方式暴露于CYP(0、0.5、5、50 μg·kg−1),发现其可诱导雄性小鼠垂体分泌促黄体生成素(luteinizing hormone, LH)和促卵泡素(follicle stimulating hormone, FSH),表达促性腺激素亚单位基因[绒毛膜促性腺激素α(chorionic gonadotropinα, CGα)、LHβ和FSHβ],同时刺激睾丸间质细胞产生睾酮和类固醇生成相关基因[类固醇生成急性调节(steroidogenic acute regulatory protein, StAR)和细胞色素P450,家族11,亚家族A,多肽1(recombinant cytochrome P450 11A1, CYP11A1)],从而刺激促性腺激素释放激素(gonadotrophin releasing hormone, GnRH)脉冲分泌频率,提前了雄性小鼠青春期启动日龄,且表现出剂量效应关系(见图1)[48]. 青春期发育依赖于性类固醇的产生,根据上述研究推测拟除虫菊酯作为具有雌激素和抗雄激素作用的农药,可能通过下丘脑GnRH脉冲频率的增加激活下丘脑-垂体-性腺轴来调节儿童青春期的发育. 同时,拟除虫菊酯杀虫剂对青春期性成熟的影响存在性别差异,其可能由于PYRs在生物体内的代谢存在性别差异,导致其到达靶器官的最终浓度的存在差异,从而产生了性别双相效应. 同时上述毒理学实验中暴露剂量的较大差异也可能导致不同小鼠青春期启动日龄的性别差异,有待进一步的动物实验探究环境剂量拟除虫菊酯的暴露对儿童青春期发育的潜在机制.
拟除虫菊酯对动物体格的生长发育有延缓抑制作用,甚至还会通过改变基因表达和诱发染色体畸变,影响子代的生长发育,具有一定的致畸作用. Latif等[49]采用10 mg·kg−1的FVT灌胃成年雄性小鼠,并与未经处理的雌性小鼠交配产生后代. 研究发现,F0雄性小鼠精子基因组DNA中的血管紧张素转换酶以及与其他生殖相关基因Foxo3a、Hap1、Nr3c2、Pml和Ptgfrn出现甲基化. 而F1代雄性小鼠精子畸形率、血清T和雌二醇(estradiol, E2)水平均明显增高;F1代雌性小鼠动情周期延长、子宫湿重增加、E2水平降低而孕酮水平升高. 另有Park等[50]用0、15、30 μmol·L−1的BF处理斑马鱼胚胎,48 h后观察到其显著诱导了眼睛畸形并导致心包水肿和肝脏水肿. 此外还发现BF通过降低胚胎血管内皮生长因子(vascular endothelial growth factor, VEGF)受体的调节来破坏血管生成,这些都意味着BF可能诱导正常斑马鱼胚胎的异常器官形成. 陈楚楚等[51]将斑马鱼胚胎暴露于Fen外消旋体及其对映体(0、0.2、0.5、0.8、1 mg·L−1)、Tet外消旋体及其反式对映体(0、0.2、0.4、0.8、1 mg·L−1)溶液中96 h,发现斑马鱼胚胎出现许多畸形现象,如心包囊肿、脊柱弯曲等,其中心包囊肿最为明显,且其随暴露浓度增加而增加. 此外,谭丽超等[52]通过给出生14 d的鹌鹑的饲料中添加CYP(5 mg·kg−1、10 mg·kg−1和20 mg·kg−1),持续喂食10周后鹌鹑进入到产蛋高峰期,收集其鹌鹑蛋进行检测分析. 研究发现CYP的暴露使受精率、孵化率及子代雏鹌鹑14 d的成活率有所下降,且剂量越高,下降越显著. 由此可见,暴露于拟除虫菊酯杀虫剂的斑马鱼胚胎和子代鹌鹑表现出与小鼠模型中所见相似的毒性迹象,也存在一定的剂量依赖性,发育中的胎儿和儿童暴露于可测量水平的拟除虫菊酯杀虫剂对发育的毒性潜力更需要进一步的研究和关注.
-
拟除虫菊酯类农药作为一种环境内分泌干扰物,可通过拟雌激素或抗激素作用,影响下丘脑-垂体-性腺轴等方式,干扰生殖激素合成、运输、代谢、消除等过程,从而引起内分泌紊乱,对儿童的生殖系统产生毒性作用[53 − 54]. Chen等[55]通过人乳腺癌细胞增殖法(E-Screen)检测、雌激素受体竞争性结合检测和雌激素调节蛋白(PS2)表达检测等3种体外试验,发现拟除虫菊酯类农药均可通过诱导人乳腺癌MCF-7细胞增殖来释放雌激素潜力. 同时CYP、PM、DM还能被雌激素拮抗药ICI 182.780完全阻断,以上实验表明拟除虫菊酯具有拟雌激素活性. 在此基础上,Li等[54]将小鼠垂体性腺激素LβT2细胞暴露于CYP(1、10、100 nmol·L−1),证实了其可通过破坏Ca2+促进C/c-Raf/ERK1/2/早期基因通路的激活以及促性腺激素亚单位基因转录的增加,从而对垂体促性腺激素合成起干扰作用. 然而,关于拟除虫菊酯暴露对子代健康影响的细胞实验仍较少,上述机制有待进一步体外试验加以证实.
-
儿童作为免疫力较弱的人群,长期低剂量农药暴露过程中,机体的免疫监测功能可能受到损伤[56],进而使得肿瘤细胞能够逃脱免疫系统的监测和清除,导致肿瘤发生. Ding等[57]在2010—2011年期间进行了儿童急性淋巴白血病(acute lymphoblastic leukemia, ALL)的病例对照研究,研究发现ALL患者中3-PBA、cis-DCCA、trans-DCCA检出量明显高于对照组且代谢产物水平与儿童ALL的发生率呈正相关. Skolarczyk等[58]的最新研究也表明,拟除虫菊酯类化合物会抑制白细胞的增殖,并降低IgG免疫球蛋白的浓度,从而导致儿童免疫障碍,降低机体免疫力. 然而目前拟除虫菊酯类杀虫剂对于与儿童免疫相关疾病的流行病学研究还是相对缺乏,因此进一步深入开展此类农药与儿童免疫疾病关联性的流行病学研究是十分有必要和有意义的.
-
Santoni等[59]将50 mg·kg−1的CYP口服送入Wistar孕鼠体内,研究人员在小鼠出生后不同时间(30、60、90、120 d)对母鼠及其后代的外周血和脾脏细胞毒性活动进行评估. 研究发现,幼崽的外周血自然杀伤和抗体依赖细胞毒性活性显著增加,表明子鼠细胞毒性活性的免疫调节与孕鼠产前暴露于CYP存在潜在联系. 此外,Rehman等[60]发现小鼠连续口服DM(18 mg·kg−1)10 d后白念珠菌的感染率较对照组更高,这提示DM可能具有免疫抑制作用. 同时,Jin等[61]用20 mg·kg−1的BF处理青春期雄性小鼠,口服3周后小鼠脾脏和胸腺重量均显著下降,脾脏中肿瘤坏死因子和白细胞介素2(interleukin2, IL2)以及胸腺中IL2和IL4基因的转录水平增加,同时血清中谷胱甘肽过氧化物酶活性显著降低,还原型谷胱甘肽含量显著升高. 柴晓静等[36]将50只8周龄雄性昆明系小鼠连续1个月经口灌胃DM(1.8、3.6 mg·kg−1)或CYP(4、8 mg·kg−1)后,发现染毒后的小鼠脑内丙二醛均有所升高,羟自由基(-OH)在高剂量组的脑中也升高,与此同时,研究者还发现小鼠脑组织总抗氧化能力(T-AOC)降低. 综上研究,拟除虫菊酯类农药能诱发自由基反应,扰乱机体的氧化与抗氧化平衡状态,产生相应链式反应,最终使小鼠机体产生氧化损伤,影响机体免疫功能.
-
农药的代谢会导致儿童体内产生有害代谢物,并引发活性氧簇(reactive oxygen species, ROS)[56]. ROS若不断富集至儿童不可耐受范围,则将通过阻断抗原交叉提呈、降低白细胞向损伤或感染部位的趋化性等方式引起细胞损伤和炎症反应,影响机体免疫机能. 与此同时,ROS不断消耗抗氧化剂同时介导氧化还原信号通路,干扰机体稳态,进而引起氧化应激效应,可能导致细胞死亡与凋亡,最终影响儿童的机体免疫功能[62 − 63]. Parent等[64]发现,经PM处理后(1.23、3.7、11.1、33.3、100 μg·L−1),96 h后幼鱼红鲷和成年木乃伊脾细胞数量有所下降,这进一步揭示了拟除虫菊酯类杀虫剂暴露与免疫抑制之间存在潜在联系. 而Lee等[65]认为,BF和CYP等拟除虫菊酯农药和纳米颗粒会诱导巨噬细胞周期停止和凋亡或吞噬活性,还可能影响抗病毒和炎症活性细胞因子的产生,来抑制免疫细胞的生存和生长. 然而,其具体剂量效应需要通过进一步的毒性测试来探究,以限制高免疫毒性拟除虫菊酯杀虫剂的使用并寻找其替代品.
-
作为全球十大农药之一,拟除虫菊酯类杀虫剂的应用越来越广泛,其在环境及农产品中的残留问题日趋严重,使人群普遍受到暴露,对人类的健康尤其是孕妇、儿童等易感人群造成严重危害. 大量研究已表明其可对儿童的神经、发育系统造成一定的不良影响,对于免疫系统可能也有潜在影响(见图2). 因此,在国家鼓励二胎、三孩生育的政策背景下,关于环境浓度下拟除虫菊酯杀虫剂的暴露对儿童健康影响的安全评估至关重要.
目前,关于该农药对儿童神经行为影响的具体分子机制尚不明确,相关动物实验的暴露剂量与实际人群的环境暴露之间也存在一定差异,应采取多种拟除虫菊酯杀虫剂的联合作用来接近真实暴露. 同时,该农药是否使儿童青春期发育提前仍存在争议,其性别双相效应值得深入研究. 此外该农药对儿童免疫系统的影响多处于动物试验阶段,对人群流行病学研究相对缺乏. 因此,在后续的工作中,有必要加强以上研究,从而为准确、全面评估拟除虫菊酯杀虫剂对儿童的健康风险提供更为合理的依据,为有效处理拟除虫菊酯类杀虫剂在环境中的迁移、降解及更好地了解其毒作用特点提供科学的理论基础,从而指导母亲孕期及儿童生长期正确使用含有拟除虫菊酯杀虫剂的产品. 相关部门应加强拟除虫菊酯类杀虫剂的管理,农业生产者也应正确使用该农药,不应过度使用,以降低残留,同时对孕妇和儿童等易感人群做好早期预防工作,以此保障环境安全和儿童健康.
拟除虫菊酯杀虫剂暴露对儿童健康的影响
Effects of pyrethroid insecticide exposure on children's health
-
摘要: 拟除虫菊酯类杀虫剂(pyrethroid insecticides,PYR)作为一种高效、低毒且易降解的广谱杀虫剂,自20世纪70年代以来广泛地应用于农林畜牧和家庭害虫防治. 然而随着研究的深入,其对儿童的潜在危害也逐渐暴露. 本文总结了国内外儿童因该农药暴露产生相关疾病的流行病学调查,发现其可能降低儿童的智力水平和行为能力,改变儿童的生长发育,及损伤机体的免疫功能;又通过分析相关动物实验及细胞实验,归纳了其对儿童神经、发育、免疫系统的影响及作用机制,为实验室深入研究提供科学依据,为临床治疗给予合理的指导,也为研发无害化杀虫剂给予参考思路.Abstract: Pyrethroid insecticides (PYR), as a commonly used insecticide with high efficiency, low toxicity and biodegradation, has been widely used in agriculture, forestry, livestock and household pest control since 1970s. However, with further research, more attention has been paid to its potential harm to children. This article summarized domestic and foreign environmentally epidemiological investigation on pyrethroids associated with children’s health, and found that it may reduce the intelligence level and behavioral ability, change the growth and development of children, and damage the immune function of the body. This article also reviewed the effects and mechanism of its action on children's nervous system, reproductive system and immune system. The study provided scientific basis for further laboratory research, reasonable guidance for clinical treatment and reference idea for the invention of harmless insecticides.
-
Key words:
- pyrethroid /
- exposure level /
- immunotoxicity /
- neurotoxicity /
- reproductive toxicity.
-

-
表 1 拟除虫菊酯暴露对儿童神经发育影响有关的人群流行病学研究
Table 1. Population-based epidemiological studies of the effects of pyrethroid exposure on neurodevelopment in children
样本(量)
Sample
(size)检测物质及暴露关键期
Test chemicals and critical exposure period研究人群
Study population研究方法
Study design对儿童神经发育的影响
Effects on neurodevelopment in children主要结果
Results参考文献
Reference尿(482) 3-PBA、4-F-3-PBA、cis-DBCA/孕期 孕8—18周、20—29周和32—41周的妇女/2岁儿童 队列研究(产前孕妇的状况),通过贝利婴儿发育量表评估儿童神经发育水平 孕早期尿中4-F-3-PBA浓度的升高可降低2岁儿童运动得分(β=−5.02, 95%CI −9.08—−0.97)和适应性行为(β=−4.12,95%CI −7.92—−0.32),可增加2岁儿童适应性行为发育迟缓的风险(OR=2.07, 95%CI 1.13—3.82) 农村妇女孕早期日常生活PYRs暴露可能会影响2岁儿童神经发育,孕早期可能是其关键窗口期,但孕中、晚期同等水平PYRs暴露对2岁儿童神经发育不存在影响 [11] 尿(201) 3-PBA/孕期 有ASD家族史的孕妇/3岁儿童 队列研究(孕妇怀孕每三个月尿液样本),根据自闭症诊断观察量表评估孩子3岁的神经发育情况,将其分为ASD或TD与非TD(既不是TD也不是ASD)三类 所有样本的中位比重校正
3-PBA浓度为
1.46 ng·mL−1. 第二个季度
3-PBA浓度较高与ASD的RRR:1.50(95%CI 0.89—2.51),P=0.12. 非TD和TD之间没有区别相对于患TD的风险,妊娠中期尿液样本中的较高的3-PBA浓度可使孩子3年后患ASD的风险增加50%. 没有发现3-PBA与非TD与TD进行比较的差异 [12] 尿(187) 3-PBA/孕期 妊娠早期、中期、晚期孕妇/24个月和36个月婴儿 队列研究(妊娠早中晚期母体尿液样本),利用贝利婴儿发育量表在评估24个月和36个月儿童MDI和PDI 在调整协变量后
(P-trend=0.07),中高3-PBA类别的参与者在24个月时的MDI分数低于低3-PBA类别的参与者(P-trend=0.07),女生当中相关性稍强. 孕晚期
3-PBA的3级分类变量与36个月时的MDI评分或任一时间点的PDI评分无关孕妇妊娠晚期的拟除虫菊酯暴露与婴儿的神经发育可能有关,需要在更大的研究人群中进行额外研究 [13] 尿(634) cis-Cl2CA、trans-Cl2CA、
3-PBA/孕期产前中段孕妇/1岁幼儿 队列研究(产前中段孕妇的状况),采用0—6岁儿童发育筛查测验对幼儿神经智力发育状况进行评估,得出MI及DQ 随着孕妇暴露水平的增高,幼儿MI和DQ存在逐渐降低的趋势,多元线性回归分析
(β=−0.1453 , P<0.05)宫内拟除虫菊酯农药高暴露与幼儿神经智力发育低水平间存在联系 [14] 住宅接近度(970) 母亲妊娠期住宅地半径为1.25、1.5、1.75 km的缓冲区内暴露的拟除虫菊酯杀虫剂暴露量/孕期 诊断为全综合症DD或ASD的2—5岁儿童/母亲孕期暴露情况 病例对照研究,依据自闭症诊断观察量表选取神经发育障碍的儿童,追溯其母亲孕期暴露情况 儿童ASD与母亲妊娠前3个月和妊娠晚期的拟除虫菊酯暴露量存在正相关,与DD无明显关系 在妊娠期间暴露于拟除虫菊酯杀虫剂的母亲,其子女患精神发育障碍的风险可能会增加 [15] 尿(241) 3-PBA、cis-DCCA、λ-氯氰菊酯酸(λ-CYP特异性代谢产物)/儿童时期 约7岁儿童 横断面研究,依据Woodcock-Muñoz一般认知能力测试和CANTAB剑桥认知测试评估儿童的认知能力 使用拟除虫菊酯杀虫剂的地区,儿童完成规则习得和认知灵活性任务逆转试验的次数较少,且3-PBA的浓度与儿童认知能力存在一定负相关 儿童发育中的大脑容易受到杀虫剂的影响,接触拟除虫菊酯可能对儿童的认知和执行功能存在负面影响 [16] 尿(40) 3-PBA/儿童时期 ASD和CTR儿童 病例对照研究,对5—12岁的ASD(利用儿童孤独症评定量表进行评估)和CTR儿童进行比较 两组儿童尿中3-PBA水平的差异没有达到统计学意义(P=0.054),CARS总分和尿液中的3-PBA之间没有相关性(R2= 0.0539 , P>0.05),但在正常儿童中,3-PBA随年龄增长而增加具有统计学意义(R2=0.2196 , P=0.043)在同一年龄范围内的对照组中,3-PBA和年龄之间存在正相关 [17] 尿(287对) 3-PBA、cis-DBCA、4-F-3-PBA、trans-DCCA、cis-DCCA/孕期 妊娠6周至19周的孕妇/6岁儿童 队列研究(收集妊娠期孕妇的尿液样本),6年后利用Wechsler儿童智力量表评估了儿童语言理解和工作记忆 儿童3-PBA和cis-DBCA浓度都与语言理解分数(分别为
P-trend=0.04和P-trend<0.01)和工作记忆评分(分别为
P-trend=0.05和P-trend<0.01)呈负相关孕产妇产前拟除虫菊酯代谢物浓度与儿童的认知评分间没有达到统计学意义,儿童期低水平暴露于拟除虫菊酯类杀虫剂,可能会对6岁儿童的神经认知发育产生负面影响 [18] 血浆(分娩时母体和脐带中)/
空气(272/342)PM/PM和胡椒基丁醚(拟除虫菊酯协同作用剂)/孕期 分娩时的母亲/
36个月儿童队列研究(收集分娩时母体和脐带血浆样本和怀孕期间个人空气样本),并在儿童36个月时利用贝利婴儿发育量表第二版评估其认知和运动发育 产前暴露于空气或血浆中的PM与儿童发育无关,但在个人空气样本中接触更高浓度胡椒基丁醚的儿童(>4.34 ng·m−3)智力发育指数比接触率较低的儿童低3.9分(95%CI
−0.25—7.49)产前暴露于胡椒基丁醚与3岁时婴儿发育的BSID得分降低相关 [19] 农药暴露量( 2961 )距离产妇居住地2000 m内每英亩每月施用的农药磅数/孕期和儿童时期 诊断为自闭症谱系障碍的婴儿/
母亲产前和婴儿的农药接触情况病例对照研究,选取诊断为自闭症谱系障碍的婴儿,追溯产妇居住地2000 m内农药施用磅数来估计产前和婴儿对农药的接触情况 自闭症谱系障碍的风险与产前接触PM有关(aOR=1.10,95%CI 1.01—1.20). 患有智力障碍、自闭症谱系障碍的儿童,产前接触PM的几率更高(OR=1.46,95%CI 1.20—1.78);在1岁时接触某些拟除虫菊酯农药可使婴儿患伴随性智力残疾的几率增加50% 母亲在怀孕期间接触环境农药后,后代患自闭症谱系障碍的风险会增加,婴儿接触可能会进一步增加自闭症谱系障碍和合并智力残疾的风险 [20] 表 2 拟除虫菊酯暴露对儿童行为情绪影响有关的人群流行病学研究
Table 2. Population-based epidemiological study of the effects of pyrethroid exposure on children’s behavior and emotion
样本(量)
Sample
(size)检测物质及
暴露关键期
Test chemicals and critical exposure period研究人群
Study
population研究方法
Study design对儿童行为情绪的影响
Effects on children’s behavior and emotion主要结果
Results参考文献
Reference尿(524) 3-PBA/孕期和儿童时期 孕妇产前、2、4、6、8岁的儿童/6岁和8岁的儿童 队列研究(统计各个时间段孕妇和儿童尿液),并要求父母填写ADHD评定量表IV来评估儿童ADHD症状 孕妇产前和儿童2岁时3-PBA浓度加倍与儿童6岁时ADHD症状相关(分别增加2.7%, 95%CI 0.3—5.2; 增加5.2%, 95%CI 0.5—10.2). 儿童4岁和6岁时的3-PBA浓度加倍与8岁时的ADHD症状相关(分别增加2.7%, 95%CI 0.3—5.3; 增加3.3%, 95%CI 0.2—6.4),没有明确性别特异性关联 产前和儿童早期接触3-PBA与ADHD症状有关,怀孕期间和2至6岁的暴露是6岁和8岁拟除虫菊酯神经毒性的易感期 [24] 尿( 1081 )3-PBA、cis-DBCA、4-F-3-PBA、cis-DCCA、trans-DCCA/儿童时期 6—11岁儿童 横向研究(收集儿童尿液样本),使用父母版优势和困难问卷来评估儿童行为问题 拟除虫菊酯代谢物cis-DCCA与父母版的儿童优势和困难问卷分数相关有统计学意义(OR增加10倍=2.0, 95%CI 1.1—3.6),与trans-DCCA的关联无统计学意义(OR=1.6, 95%CI 0.9—3.0) 儿童拟除虫菊酯暴露与父母报告的儿童行为问题有关,应该对其的潜在风险进行进一步纵向
研究[25] 尿( 1207 )3-PBA、trans-DCCA/孕期 妊娠第28周母亲/2—4岁儿童 队列研究(收集妊娠28周母体尿液),并在儿童2—4岁时利用儿童行为检查表评估ADHD得分 母体拟除虫菊酯类代谢物3-PBA浓度每增加1倍ADHD评分增加3%(OR=1.03, 95%CI 1.00—1.07),ADHD评分≥90的几率增加13%(OR=1.13, 95%CI 1.04—1.38),母体trans-DCCA浓度高于检出限增加了ADHD症状的几率(OR=1.76, 95%CI 1.08—2.86) 产前暴露于拟除虫菊酯与2—4岁时的ADHD相关特征
相关[26] 尿(752) cis-DCCA、trans-DCCA、3-PBA、cis-DBCA/孕期 分娩前后的孕妇/1岁和2岁儿童 队列研究(收集母亲尿液)并利用贝利婴儿发育量表评估1岁和2岁儿童的神经
发育母体cis-DCCA、trans-DCCA和3-PBA每增加10倍,儿童在1岁时的社交情绪得分分别下降-0.63(95%CI −1.14—−0.12)、−0.48(95%CI −0.92—−0.05)和−0.58(−1.11, −0.06),母亲产前cis-DBCA代谢物含量每增加10倍与儿童2岁时语言综合得分和表达交流得分下降之间具有统计学意义[β1=1.74, β2=0.40,增加10倍] 产前暴露于拟除虫菊酯可能与1岁时较差的社会情绪发展有关;母亲产前拟除虫菊酯暴露水平较高可能导致儿童2岁时语言发育较差 [27] 尿(287) 3-PBA、cis-DBCA、4-F-3-PBA、cis-DCCA、trans-DCCA/孕期 妊娠6周至19周的孕妇/
6岁儿童队列研究(收集妊娠期孕妇的尿液样本),6年后收集婴儿尿液并利用使用优势和困难问卷评估儿童行为(亲社会行为、内化障碍和外化障碍) 产前cis-DCCA浓度增加与内化困难有关(Cox P=0.05);对于儿童3-PBA浓度,观察到与外化困难呈正相关(Cox P=0.04),异常或边缘社会行为的ORs较高(中代谢物类别分别为OR 2.93, 95%CI 1.27—6.78和OR 1.91, 95%CI 0.80—4.57);儿童trans-DCCA浓度高与外化障碍减少有关(Cox P=0.03) 在环境层面接触某些拟除虫菊酯可能会在6岁时对神经行为发育产生负面
影响[28] 注:OR,优势比;TD,典型发育;RRR,相对风险比;MDI,心理发展指数;PDI,精神运动发展指数;cis-Cl2CA,顺式-3-(2,2-二氯乙烯基)-2,2-二甲基环丙烷-1-羧酸;trans-Cl2CA,反式-3-(2,2-二氯乙烯基)-2,2-二甲基环丙烷-1-羧酸;MI,智力发育指数;DQ,发育商;RR,相对危险度;CTR,健康对照;aOR,调整优势比.
Note: PYRs, pyrethroid pesticide; OR, odds ratio; TD, typical development; RRR, relative risk ratio; MDI, Mental Development Index; PDI, psychomotor Development Index; cis-Cl2CA, cis-3-(2,2-dichloroyl)-2,2-dimethylcyclopropane-1-carboxylic acid; trans-Cl2CA, trans-3-(2,2-dichloroyl)-2, 2-dimethylcyclopropane-1-carboxylic acid; MI, intelligence development Index; DQ, developmental quotient; RR, relative risk; CTR, healthy control; AOR, adjusting the odds ratio. -
[1] CHEN S, XIAO X, QI Z, et al. Effects of prenatal and infant daily exposure to pyrethroid pesticides on the language development of 2-year-old toddlers: A prospective cohort study in rural Yunnan, China[J]. Neurotoxicology, 2022, 92: 180-190. doi: 10.1016/j.neuro.2022.08.002 [2] 陈小宇, 孙树洲, 周国英, 等. 山东省农田土壤中拟除虫菊酯类农药污染特征与风险评价[J]. 环境化学, 2020, 39(7): 1851-1859. doi: 10.7524/j.issn.0254-6108.2019041901 CHEN X Y, SUN S Z, ZHOU G Y, et al. Pollution characteristics and risk assessment of pyrethroid pesticides in agricultural soil in Shandong Province[J]. Environmental Chemistry, 2020, 39(7): 1851-1859 (in Chinese). doi: 10.7524/j.issn.0254-6108.2019041901
[3] LUCERO B, MUÑOZ-QUEZADA M T. Neurobehavioral, neuromotor, and neurocognitive effects in agricultural workers and their children exposed to pyrethroid pesticides: A review[J]. Frontiers in Human Neuroscience, 2021, 15: 648171. doi: 10.3389/fnhum.2021.648171 [4] OLIVEIRA M, SLEZAKOVA K, DELERUE-MATOS C, et al. Children environmental exposure to particulate matter and polycyclic aromatic hydrocarbons and biomonitoring in school environments: A review on indoor and outdoor exposure levels, major sources and health impacts[J]. Environment International, 2019, 124: 180-204. doi: 10.1016/j.envint.2018.12.052 [5] LU C S, BARR D B, PEARSON M A, et al. The attribution of urban and suburban children's exposure to synthetic pyrethroid insecticides: A longitudinal assessment[J]. Journal of Exposure Science & Environmental Epidemiology, 2009, 19(1): 69-78. [6] TULVE N S, EGEGHY P P, FORTMANN R C, et al. Methodologies for estimating cumulative human exposures to current-use pyrethroid pesticides[J]. Journal of Exposure Science & Environmental Epidemiology, 2011, 21(3): 317-327. [7] QUIRÓS-ALCALÁ L, BRADMAN A, NISHIOKA M, et al. Pesticides in house dust from urban and farmworker households in California: An observational measurement study[J]. Environmental Health, 2011, 10: 19. doi: 10.1186/1476-069X-10-19 [8] ELSER B A, HING B, STEVENS H E. A narrative review of converging evidence addressing developmental toxicity of pyrethroid insecticides[J]. Critical Reviews in Toxicology, 2022, 52(5): 371-388. doi: 10.1080/10408444.2022.2122769 [9] HICKS S D, WANG M, FRY K, et al. Neurodevelopmental delay diagnosis rates are increased in a region with aerial pesticide application[J]. Frontiers in Pediatrics, 2017, 5: 116. doi: 10.3389/fped.2017.00116 [10] DEREUMEAUX C, SAOUDI A, GORIA S, et al. Urinary levels of pyrethroid pesticides and determinants in pregnant French women from the Elfe cohort[J]. Environment International, 2018, 119: 89-99. doi: 10.1016/j.envint.2018.04.042 [11] 齐志业, 宋肖肖, 肖霞, 等. 农村妇女孕全程拟除虫菊酯类农药暴露对2岁儿童神经发育影响的队列研究[J]. 中华预防医学杂志, 2022, 56(3): 270-279. QI Z Y, SONG X X, XIAO X, et al. Prenatal pyrethroid pesticides exposure and neurodevelopment of 2-year-old children: A birth cohort study[J]. Chinese Journal of Preventive Medicine, 2022, 56(3): 270-279 (in Chinese).
[12] BARKOSKI J M, PHILIPPAT C, TANCREDI D, et al. In utero pyrethroid pesticide exposure in relation to autism spectrum disorder (ASD) and other neurodevelopmental outcomes at 3 years in the MARBLES longitudinal cohort[J]. Environmental Research, 2021, 194: 110495. doi: 10.1016/j.envres.2020.110495 [13] WATKINS D J, FORTENBERRY G Z, SÁNCHEZ B N, et al. Urinary 3-phenoxybenzoic acid (3-PBA) levels among pregnant women in Mexico City: Distribution and relationships with child neurodevelopment[J]. Environmental Research, 2016, 147: 307-313. doi: 10.1016/j.envres.2016.02.025 [14] 齐小娟, 郑明岚, 邬春华, 等. 宫内拟除虫菊酯类农药暴露对1岁幼儿神经发育的影响[J]. 卫生研究, 2011, 40(6): 693-697. doi: 10.19813/j.cnki.weishengyanjiu.2011.06.004 QI X J, ZHENG M L, WU C H, et al. Impact of prenatal pyrethroid exposure on neurodevelopment of one-year old infants[J]. Journal of Hygiene Research, 2011, 40(6): 693-697 (in Chines). doi: 10.19813/j.cnki.weishengyanjiu.2011.06.004
[15] SHELTON J F, GERAGHTY E M, TANCREDI D J, et al. Neurodevelopmental disorders and prenatal residential proximity to agricultural pesticides: The CHARGE study[J]. Environmental Health Perspectives, 2014, 122(10): 1103-1109. doi: 10.1289/ehp.1307044 [16] RODRÍGUEZ D, BARG G, QUEIROLO E I, et al. Pyrethroid and Chlorpyrifos Pesticide Exposure, General Intellectual Abilities, and Executive Functions of School Children from Montevideo, Uruguay[J]. International Journal of Environmental Research and Public Health, 2023, 20(7): 5288. doi: 10.3390/ijerph20075288 [17] DOMINGUES V, NASUTI C, PIANGERELLI M, et al. Pyrethroid pesticide metabolite in urine and microelements in hair of children affected by autism spectrum disorders: A preliminary investigation[J]. International Journal of Environmental Research and Public Health, 2016, 13(4): 388. doi: 10.3390/ijerph13040388 [18] VIEL J F, WAREMBOURG C, Le MANER-IDRISSI G, et al. Pyrethroid insecticide exposure and cognitive developmental disabilities in children: The PELAGIE mother–child cohort[J]. Environment International, 2015, 82: 69-75. doi: 10.1016/j.envint.2015.05.009 [19] HORTON M K, RUNDLE A, CAMANN D E, et al. Impact of prenatal exposure to piperonyl butoxide and permethrin on 36-month neurodevelopment[J]. Pediatrics, 2011, 127(3): e699-e706. doi: 10.1542/peds.2010-0133 [20] VON EHRENSTEIN O S, LING C, CUI X, et al. Prenatal and infant exposure to ambient pesticides and autism spectrum disorder in children: Population based case-control study[J]. BMJ, 2019, 365: l4032. [21] FURLONG M A, BARR D B, WOLFF M S, et al. Prenatal exposure to pyrethroid pesticides and childhood behavior and executive functioning[J]. NeuroToxicology, 2017, 62: 231-238. doi: 10.1016/j.neuro.2017.08.005 [22] WAGNER-SCHUMAN M, RICHARDSON J R, AUINGER P, et al. Association of pyrethroid pesticide exposure with attention-deficit/hyperactivity disorder in a nationally representative sample of U. S. children[J]. Environmental Health:a Global Access Science Source, 2015, 14: 44. [23] QUIRÓS-ALCALÁ L, MEHTA S, ESKENAZI B. Pyrethroid pesticide exposure and parental report of learning disability and attention deficit/hyperactivity disorder in U. S. children: NHANES 1999-2002[J]. Environmental Health Perspectives, 2014, 122(12): 1336-1342. doi: 10.1289/ehp.1308031 [24] LEE K S, LIM Y H, LEE Y A, et al. The association of prenatal and childhood pyrethroid pesticide exposure with school-age ADHD traits[J]. Environment International, 2022, 161: 107124. doi: 10.1016/j.envint.2022.107124 [25] OULHOTE Y, BOUCHARD M F. Urinary metabolites of organophosphate and pyrethroid pesticides and behavioral problems in Canadian children[J]. Environmental Health Perspectives, 2013, 121(11-12): 1378-1384. doi: 10.1289/ehp.1306667 [26] DALSAGER L, FAGE-LARSEN B, BILENBERG N, et al. Maternal urinary concentrations of pyrethroid and chlorpyrifos metabolites and attention deficit hyperactivity disorder (ADHD) symptoms in 2-4-year-old children from the Odense Child Cohort[J]. Environmental Research, 2019, 176: 108533. doi: 10.1016/j.envres.2019.108533 [27] ESKENAZI B, AN S, RAUCH S A, et al. Prenatal exposure to DDT and pyrethroids for malaria control and child neurodevelopment: The VHEMBE cohort, south Africa[J]. Environmental Health Perspectives, 2018, 126(4): 047004. doi: 10.1289/EHP2129 [28] VIEL J F, ROUGET F, WAREMBOURG C, et al. Behavioural disorders in 6-year-old children and pyrethroid insecticide exposure: The PELAGIE mother–child cohort[J]. Occupational and Environmental Medicine, 2017, 74(4): 275-281. doi: 10.1136/oemed-2016-104035 [29] RICHARDSON J R, TAYLOR M M, SHALAT S L, et al. Developmental pesticide exposure reproduces features of attention deficit hyperactivity disorder[J]. FASEB Journal:Official Publication of the Federation of American Societies for Experimental Biology, 2015, 29(5): 1960-1972. doi: 10.1096/fj.14-260901 [30] CURTIS M A, DHAMSANIA R K, BRANCO R C, et al. Developmental pyrethroid exposure causes a neurodevelopmental disorder phenotype in mice[J]. PNAS Nexus, 2023, 2(4): 1-12. [31] KIM K B, ANAND S S, KIM H J, et al. Age, dose, and time-dependency of plasma and tissue distribution of deltamethrin in immature rats[J]. Toxicological Sciences, 2010, 115(2): 354-368. doi: 10.1093/toxsci/kfq074 [32] HU Y, HU J Y, LI W H, et al. Changes of embryonic development, locomotor activity, and metabolomics in zebrafish co-exposed to chlorpyrifos and deltamethrin[J]. Journal of Applied Toxicology, 2021, 41(9): 1345-1356. doi: 10.1002/jat.4124 [33] RANJANI T S, PITCHIKA G K, YEDUKONDALU K, et al. Phenotypic and transcriptomic changes in zebrafish (Danio rerio) embryos/larvae following cypermethrin exposure[J]. Chemosphere, 2020, 249: 126148. doi: 10.1016/j.chemosphere.2020.126148 [34] SODERLUND D M. State-dependent modification of voltage-gated sodium channels by pyrethroids[J]. Pesticide Biochemistry and Physiology, 2010, 97(2): 78-86. doi: 10.1016/j.pestbp.2009.06.010 [35] HOSSAIN M M, RICHARDSON J R. Nerve growth factor protects against pyrethroid-induced endoplasmic reticulum (ER) stress in primary hippocampal neurons[J]. Toxicological Sciences, 2020, 174(1): 147-158. doi: 10.1093/toxsci/kfz239 [36] 柴晓静, 王振全, 邓晓辉, 等. II-型拟除虫菊酯对雄性小鼠中枢神经系统氧化应激的影响[J]. 现代预防医学, 2007, 34(16): 3017-3019. CHAI X J, WANG Z Q, DENG X H, et al. Effects of II-pyrethrins on oxidative stress of central nervous system of mice[J]. Modern Preventive Medicine, 2007, 34(16): 3017-3019 (in Chinese).
[37] YAN Y, YANG Y, YOU J, et al. Permethrin modulates cholinergic mini-synaptic currents by partially blocking the calcium channel[J]. Toxicology Letters, 2011, 201(3): 258-263. doi: 10.1016/j.toxlet.2011.01.009 [38] YE X Q, PAN W Y, ZHAO Y H, et al. Association of pyrethroids exposure with onset of puberty in Chinese girls[J]. Environmental Pollution, 2017, 227: 606-612. doi: 10.1016/j.envpol.2017.04.035 [39] YE X Q, PAN W Y, ZHAO S L, et al. Relationships of pyrethroid exposure with gonadotropin levels and pubertal development in Chinese boys[J]. Environmental Science & Technology, 2017, 51(11): 6379-6386. [40] XU Q H, ZHU B S, DONG X D, et al. Pyrethroid pesticide exposure during early pregnancy and birth outcomes in southwest China: A birth cohort study[J]. The Journal of Toxicological Sciences, 2020, 45(5): 281-291. doi: 10.2131/jts.45.281 [41] ZHANG J, YOSHINAGA J, HISADA A, et al. Prenatal pyrethroid insecticide exposure and thyroid hormone levels and birth sizes of neonates[J]. Science of the Total Environment, 2014, 488/489: 275-279. doi: 10.1016/j.scitotenv.2014.04.104 [42] DING G D, CUI C, CHEN L M, et al. Prenatal exposure to pyrethroid insecticides and birth outcomes in Rural Northern China[J]. Journal of Exposure Science & Environmental Epidemiology, 2015, 25(3): 264-270. [43] COKER E, CHEVRIER J, RAUCH S, et al. Association between prenatal exposure to multiple insecticides and child body weight and body composition in the VHEMBE South African birth cohort[J]. Environment International, 2018, 113: 122-132. doi: 10.1016/j.envint.2018.01.016 [44] JONATHAN C, STEPHEN R, MADELEIN C, et al. Maternal exposure to DDT and pyrethroids and birth outcomes among residents of an area sprayed for malaria control participating in the VHEMBE birth cohort study[J]. American Journal of Epidemiology, 2018, 6(9): 047004. [45] BERKOWITZ G S, WETMUR J G, BIRMAN-DEYCH E, et al. In utero pesticide exposure, maternal paraoxonase activity, and head circumference[J]. Environmental Health Perspectives, 2004, 112(3): 388-391. doi: 10.1289/ehp.6414 [46] PINE M D, HINEY J K, LEE B, et al. The pyrethroid pesticide esfenvalerate suppresses the afternoon rise of luteinizing hormone and delays puberty in female rats[J]. Environmental Health Perspectives, 2008, 116(9): 1243-1247. doi: 10.1289/ehp.11119 [47] MONIZ A C, CRUZ-CASALLAS P E, SALZGEBER S A, et al. Behavioral and endocrine changes induced by perinatal fenvalerate exposure in female rats[J]. Neurotoxicology and Teratology, 2005, 27(4): 609-614. doi: 10.1016/j.ntt.2005.05.005 [48] YE X Q, LI F X, ZHANG J Y, et al. Pyrethroid insecticide cypermethrin accelerates pubertal onset in male mice via disrupting hypothalamic–pituitary–gonadal axis[J]. Environmental Science & Technology, 2017, 51(17): 10212-10221. [49] Ahmad L, Khan A, Khan MZ. Pyrethroid-induced reproductive toxico-pathology in non-target species[J]. Pakistan Veterinary Journal, 2012, 32(1): 1-9. [50] PARK S, LEE J Y, PARK H, et al. Bifenthrin induces developmental immunotoxicity and vascular malformation during zebrafish embryogenesis[J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 2020, 228: 108671. [51] 陈楚楚. 拟除虫菊酯对斑马鱼不同生命阶段的毒性效应及作用机制[D]. 杭州: 浙江工业大学, 2016. CHEN C C. Toxic effects and mechanism of pyrethroids on zebrafish at different life stages[D]. Hangzhou: Zhejiang University of Technology, 2016 (in Chinese).
[52] 谭丽超, 程燕, 田丰, 等. 氯氰菊酯对鸟类繁殖影响的慢性试验方法[J]. 环境化学, 2013, 32(12): 2396-2397. doi: 10.7524/j.issn.0254-6108.2013.12.026 TAN L C, CHENG Y, TIAN F, et al. Chronic test method for the effect of cypermethrin on bird reproduction[J]. Environmental Chemistry, 2013, 32(12): 2396-2397 (in Chinese). doi: 10.7524/j.issn.0254-6108.2013.12.026
[53] 陆可安, 叶小青. 环境内分泌干扰物对女性青春期性成熟的干扰作用研究进展[J]. 环境化学, 2023, 42(2): 358-369. doi: 10.7524/j.issn.0254-6108.2021102802 LU K A, YE X Q. The effects and mechanisms of environmental endocrine disruptors exposure on pubertal development in females[J]. Environmental Chemistry, 2023, 42(2): 358-369 (in Chinese). doi: 10.7524/j.issn.0254-6108.2021102802
[54] LI F X, MA H H, LIU J. Pyrethroid insecticide cypermethrin modulates gonadotropin synthesis via calcium homeostasis and ERK1/2 signaling in LβT2 mouse pituitary cells[J]. Toxicological Sciences, 2018, 162(1): 43-52. doi: 10.1093/toxsci/kfx248 [55] CHEN H, Y XIAO J G, HU G, et al. Estrogenicity of organophosphorus and pyrethroid pesticides[J]. Journal of Toxicology and Environmental Health, Part A, 2002, 65(19): 1419-1435. doi: 10.1080/00984100290071243 [56] 汪霞, 郜兴利, 何炳楠, 等. 拟除虫菊酯类农药的免疫毒性研究进展[J]. 农药学学报, 2017, 19(1): 1-8. doi: 10.16801/j.issn.1008-7303.2017.0002 WANG X, GAO X L, HE B N, et al. Research progress on the immunotoxicity of pyrethroids[J]. Chinese Journal of Pesticide Science, 2017, 19(1): 1-8 (in Chinese). doi: 10.16801/j.issn.1008-7303.2017.0002
[57] DING G D, SHI R, GAO Y, et al. Pyrethroid pesticide exposure and risk of childhood acute lymphocytic leukemia in Shanghai[J]. Environmental Science & Technology, 2012, 46(24): 13480-13487. [58] SKOLARCZYK J, PEKAR J, NIERADKO-IWANICKA B. Immune disorders induced by exposure to pyrethroid insecticides[J]. Postępy Higieny i Medycyny Doświadczalnej, 2017, 71(1): 446-453. [59] SANTONI G, CANTALAMESSA F, MAZZUCCA L, et al. Prenatal exposure to cypermethrin modulates rat NK cell cytotoxic functions[J]. Toxicology, 1997, 120(3): 231-242. doi: 10.1016/S0300-483X(97)03662-7 [60] REHMAN H, MOHAN A, TABASSUM H, et al. Deltamethrin Increases Candida albicans infection susceptibility in mice[J]. Scandinavian Journal of Immunology, 2011, 73(5): 459-464. doi: 10.1111/j.1365-3083.2011.02521.x [61] JIN Y X, PAN X H, FU Z W. Exposure to bifenthrin causes immunotoxicity and oxidative stress in male mice[J]. Environmental Toxicology, 2014, 29(9): 991-999. doi: 10.1002/tox.21829 [62] ISLAM J Y, HOPPIN J, MORA A M, et al. Respiratory and allergic outcomes among 5-year-old children exposed to pesticides[J]. Thorax, 2023, 78(1): 41-49. doi: 10.1136/thoraxjnl-2021-218068 [63] 李旭东, 孙宁, 陶冶, 等. 大气颗粒物中类腐殖质的测定、理化特性及健康影响[J]. 环境化学, 2021, 40(12): 3787-3802. doi: 10.7524/j.issn.0254-6108.2020080503 LI X D, SUN N, TAO Y, et al. Determination, physical and chemical characterization and health risk of HULLS in atmospheric particulate matter[J]. Environmental Chemistry, 2021, 40(12): 3787-3802 (in Chinese). doi: 10.7524/j.issn.0254-6108.2020080503
[64] PARENT L M, DELORENZO M E, FULTON M H. Effects of the synthetic pyrethroid insecticide, permethrin, on two estuarine fish species[J]. Journal of Environmental Science and Health, Part B, 2011, 46(7): 615-622. doi: 10.1080/03601234.2011.589316 [65] LEE G H, CHOI K C. Adverse effects of pesticides on the functions of immune system[J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 2020, 235: 108789. -



 下载:
下载: