-
施氏矿物(Schwertmannite)是1992年被正式确认的新矿物,是一种弱结晶的Fe(Ⅲ)羟基硫酸盐矿物,其化学通式为 Fe8O8(OH)8-2x(SO4)x·n H2O(1≤x≤1.75),普遍存在于高铁高硫酸盐环境的酸性矿山废水及硫化矿矿堆等环境中[1]. 施氏矿物具有以铁为骨架构成的隧道结构,双八面体链式结构中的SO42−离子能够稳定隧道结构,结构中每个晶胞存在的两个硫酸盐分子,在 Fe-O 八面体构成的通道内分别形成外球和内球复合体,孔道内很容易被其他相似半径的离子比如砷酸根、铬酸根离子占据. 矿物表面的硫酸根以单齿或单核/双核双齿状存在,而双齿复合体的形式更多出现在施氏矿物结构通道的内部. 研究发现,施氏矿物中的硫酸根有 1/3 吸附在矿物表面,2/3 存在于通道内[2];SO42−对其稳定性起着重要的作用,当隧道内SO42−大量损失时,施氏矿物会逐渐向针铁矿缓慢转变[3].
近年来,越来越多的研究关注于施氏矿物的实际应用. 研究发现,矿区沉积物中施氏矿物含量越多对水体中Mn、Cu、Pb及Zn等重金属的去除量越大,表明施氏矿物对于重金属的环境迁移行为具有重要的影响[4]. Fe3+水解合成法制备的施氏矿物在 pH=7时对 As(V)和As(Ⅲ)最大吸附量分别为 143.25 mg·g−1和 217.85 mg·g−1[5];施氏矿物对Mn、Cu、Pb 和 Zn 等阳离子的吸附机制主要为Fe3+的取代作用及表面活性羟基的络合作用,而对AsO43−、CrO43−等含氧阴离子的去除机制则以硫酸根的离子交换作用为主[6]. 由于天然施氏矿物常含有各种杂质,人们用化学氧化法、非生物沉淀法以及生物铁氧化法等方法室内合成制备施氏矿物[7 − 8],尤其是化学氧化法简单高效(本文采用化学氧化法中的H2O2氧化法、KMnO4氧化法和基于H2O2氧化法的乙醇改性法),更适用于实验中对施氏矿物的表面形态结构特征等理论研究[5,9 − 10]. 由于不同的合成方法和条件会对施氏矿物的形貌及比表面积有较大影响,导致吸附容量的差异. 如利用氧化亚铁链霉菌合成的Al2(PO4)3的施氏矿物,其形貌由绒毛状球形聚集体转变为光滑球状,结晶度降低,在单一金属体系中,最大吸附容量有限,而改性后其选择性吸附显著增强[11 − 12].
锑(antimony,Sb)是一种有毒金属元素,可与蛋白质中的巯基(—SH)结合,抑制酶活性,破坏细胞离子平衡,干扰体内蛋白质和糖的代谢[13],具有较强的毒性及潜在的致癌性. 自然环境中Sb的含量通常较低[14],但随着锑矿的开采及印染锑废水的排放,部分土壤和水中的锑浓度显著升高[15 − 17]. 例如在我国湖南、广西和贵州等,锑矿的大量开采加速了当地环境的恶化,甚至我国部分矿区附近水体中锑浓度达到
7000 μg·L−1;我国甘肃陇星尾矿泄露导致 300 多公里河段 Sb 污染[18],锡矿山、大宝山和大冶铁矿的矿区周边地表水Sb含量达到263、163、52.7 μg·L−1[16,19];在印染工艺中,锑在聚酯纤维的制造过程中被用作催化剂,残留的锑催化剂在涤纶织物的后续加工过程中溶出进入废水,造成严重的锑污染[20].施氏矿物作为铁氧化物的典型代表,具有结晶度低、比表面积大等特点,对环境中锑的界面行为有显著影响. 且施氏矿物合成方法简单,使用原材料廉价易得,表面具有大量活性基团,是环境友好型功能材料,利用施氏矿物去除Sb(Ⅲ)污染具有一定的实际意义. 纵观前人研究结果,有关施氏矿物对重金属的吸附机制研究主要集中于砷、铬、铜等,对锑的研究甚少,关于不同制备来源的施氏矿物的对比研究尚未涉及,特别是已有研究大多采用 “始末两态式”的表征方法,鲜见全过程的动态监测. 本文制备了3种施氏矿物(过氧化氢氧化法施氏矿物H-SCH、高锰酸钾氧化法施氏矿物M-SCH和乙醇改性法施氏矿物Y-SCH),以3种施氏矿物对Sb(Ⅲ)的吸附性能研究为主线,开展了吸附动力学实验研究,结合动力学全过程动态表征监测,初步揭示了不同化学法合成的施氏矿物对Sb(Ⅲ)吸附的差异性机制,以期为施氏矿物在含锑废水处理领域的实际应用提供理论基础.
-
称取5.56 g FeSO4·7H2O于250 mL血清瓶中,加入248 mL超纯水持续搅拌,待其完全溶解后,缓慢滴加2 mL的30% H2O2,缓慢搅拌静置30 min,置于20 ℃,180 r·min−1的振荡器中反应24 h. 反应后将血清瓶静置4 h,倒掉上清液过0.45 μm膜抽滤取膜上物. 在60 ℃烘箱中干燥12 h,研磨后过150目筛,在保干器中保存[21].
-
称取5.56 g FeSO4·7H2O于250 mL血清瓶中,加入240 mL超纯水持续搅拌,待其完全溶解后,缓慢滴加10 mL质量分数为3% 的KMnO4溶液,缓慢搅拌静置30 min,置于20 ℃,180 r·min−1的振荡器中反应24 h. 反应后将血清瓶静置4 h,倒掉上清液,过0.45 μm膜抽滤,取膜上物. 在60 ℃烘箱中干燥12 h,进行研磨后过150目筛,在保干器中保存[22].
-
称取 5.56 g FeSO4·7H2O于250 mL血清瓶中,加入248 mL 20%乙醇溶液持续搅拌,待其完全溶解后,缓慢滴加2 mL的30% H2O2,缓慢搅拌静置30 min,置于20 ℃,180 r·min−1的振荡器中反应24 h. 反应后将血清瓶静置4 h,倒掉上清液,过0.45 μm膜抽滤取膜上物. 在60 ℃烘箱中干燥12 h,研磨后过150目筛,在保干器中保存[21]. 施氏矿物合成过程中的混匀状态、静置后状态,以及冷冻干燥后的样品如图1所示.
-
按照固液比M/V=1.5 g·L−1的比例,分别称取60 mg矿物样品放入50 mL离心管中,配置浓度为200 mg·L−1的酒石酸锑钾溶液,其中NaCl背景电解质浓度为0.01 mol·L−1,使用氢氧化钠和盐酸溶液调节调节pH为4,于厌氧手套箱中往每个离心管加入40 mL酒石酸锑钾溶液,并于离心管上部吹氮气2 min后封盖拧紧,混匀后将离心管平放于恒温振荡器中,调节转速为180 r·min−1使矿物与锑溶液充分接触,在20 ℃的条件下进行恒温震荡吸附反应. 动力学采用批次实验的方法,以固液刚接触的时间为起点,设置时间点0 min、5 min、15 min、30 min、1 h、2 h、4 h、6 h、8 h、12 h、24 h,实验设置3个平行. 每个时间点均设置1组只有H-SCH、M-SCH、Y-SCH和背景电解质溶液的空白对照组.
在设置时刻点抽取上清液,过0.45 μm滤膜,稀释预处理后使用原子荧光分光光度计,以5%的盐酸溶液为载流,硼氢化钾溶液作为还原剂,测试锑浓度,随后计算对应吸附量;同步测定过0.45 μm滤膜上清液的pH,并用原子吸收分光光度计测定总铁(TFe)的浓度. 固体样品经40 ℃烘干24 h后研磨,再进行FTIR、XRD、XPS及SEM-EDS分析.
-
采用《水质-汞、砷、硒、铋和锑的测定-原子荧光法》(HJ694—2014)测定样品中Sb的含量,仪器为原子荧光光度计(AFS-
3100 双道原子荧灯电流:30 mA,负高压:280 V). 取 1 mL 过 0.45 μm滤膜的上清液置于50 mL 具塞比色管中,加入 10 mL(1+1)盐酸、10 mL 硫脲-抗坏血酸溶液,混匀静置反应 2 h后定容上机测定. 测试环境:10%盐酸作为载流,氢氧化钾-硼氢化钾为还原剂. -
傅里叶红外变化光谱(FTIR)表征使用ATR反射法,样品无需进行复杂分离,可直接进行红外光谱分析. X射线衍射(XRD)表征采用压片方式进行测样,工作条件为管压 40 kV、管流 40 mA、步长为 0.1 s·step−1、波长为
0.1540 nm、扫描范围 5°—80°. XPS表征利用电子谱仪测量 X 射线光子辐照时的样品,可对样品进行定性及定量分析,从 XPS 图谱的峰位和峰形获得样品表面元素成分、价态等信息. 使用透射电镜对样品的形貌进行表征,并通过与电镜联用的能谱(EDS)对样品进行能谱分析,分析样品表面所含的元素及占比. 采用SSA(比表面积分析仪)测定合成矿物的比表面积及孔径分布,实验样品在 100 ℃下脱气 4 h,然后采用 N2吸附静态容量法测定. -
将制备的3种施氏矿物于室温下用盐酸消解,待矿物完全溶解,过0.45 μm滤膜,分析计算得到3种施氏矿物的化学组成(表1). 其中,H-SCH的Fe/S 值最大,即H-SCH在矿物合成过程中结合了更多的Fe,拥有了更稳定的骨架结构,可提高矿物的稳定性;而M-SCH和Y-SCH较之H-SCH拥有更多的SO42−,这可能是由于高锰酸钾氧化和乙醇改性后的矿物结构得到优化,结构内结合了更多的硫酸根基团,可以提供更多的结合位点.
-
结果表明,H-SCH 和M-SCH 的比表面积差异不大,分别为4.17 m2·g−1和5.06 m2·g−1,而Y-SCH 的比表面积达到 16.15 m2·g−1(表2),比H-SCH 和M-SCH 的比表面积大3倍到4倍,较大的比表面积能提供更多的结合位点. 施氏矿物是一种典型的中孔吸附剂,其微孔比例较小(2.21%—3.23%),而中孔比例较大(占总孔容的77.08%—81.54%). 微孔和中孔的存在归因于矿物颗粒表面之间的空洞以及聚集的矿物颗粒之间的间隙[23].
-
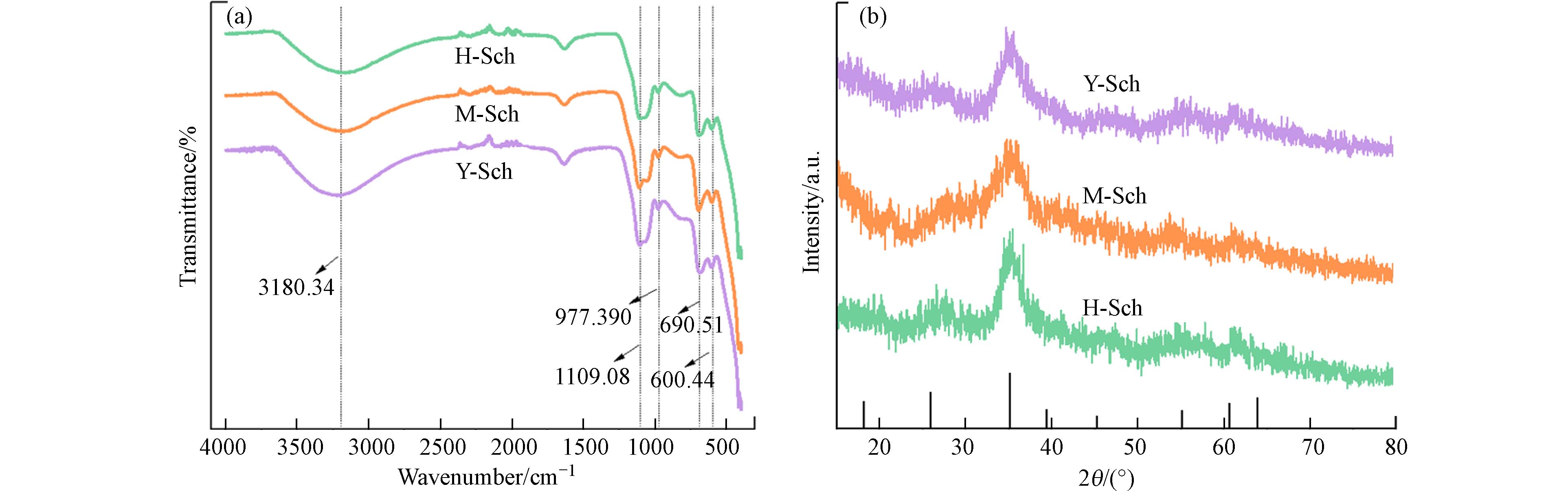
FTIR谱图显示(图2a),位于
3180.34 cm−1的收缩振动峰为矿物外表面羟基(—OH),位于1109.08 cm−1的收缩振动宽峰为施氏矿物硫酸根的三重简并不对称吸收峰ν3(SO42−),位于977.39 cm−1处的内对称收缩峰为ν1(SO42−),ν1(SO42−)和ν3(SO42−)都被认为是施氏矿物外部络合的硫酸根;而位于600.44 cm−1处ν4(SO42−)吸收峰则为施氏矿物隧道内部的硫酸根[24],研究表明位于690.51 cm−1处的收缩振动峰为Fe—O吸收峰. 由此可知3种化学法合成的矿物,均符合施氏矿物FTIR谱图的特征峰. 对比发现,Y-SCH的—OH振动峰波动较大,这表明矿物表面拥有更多外部结合的羟基官能团,Y-SCH、M-SCH的ν3(SO42−)和ν4(SO42−)伸缩振动峰波动较大,说明其拥有更多内外部络合的SO42−,这也进一步说明M-SCH和Y-SCH两种方法使矿物拥有了更多的结合位点,这可以提高其吸附性能. -
3种矿物XRD特征峰对应的2θ值分别为26.14°、35.31°、46.41°、55.38°、61.32°(图2(b)),与施氏矿物标准图谱(JCPDS,00-045-
1775 )[25]相比,可知3种合成的矿物均为施氏矿物. 从图中可以看出,3种类型施氏矿物无尖锐且强烈的尖峰,峰形较宽,且毛刺较多,说明施氏矿物的结晶度较差,而M-SCH和Y-SCH的特征峰强度降低,说明这两种合成方法促进了结晶度的下降. -
形貌分析表明,H-SCH矿物呈圆球状,表面较为粗糙;M-SCH结构同样呈圆球状,但表面沟壑更为明显,这也提示M-SCH表面具有更多可结合位点;Y-SCH呈现出相对离散的绒毛状球体且粒径较小,这可能与Y-SCH结构表面具有更多羟基有关(图3). 结合EDS数据,M-SCH和Y-SCH表面S含量占比较H-SCH更高,可知这两种合成方法让矿物表面结合态硫酸根相对更多.
-
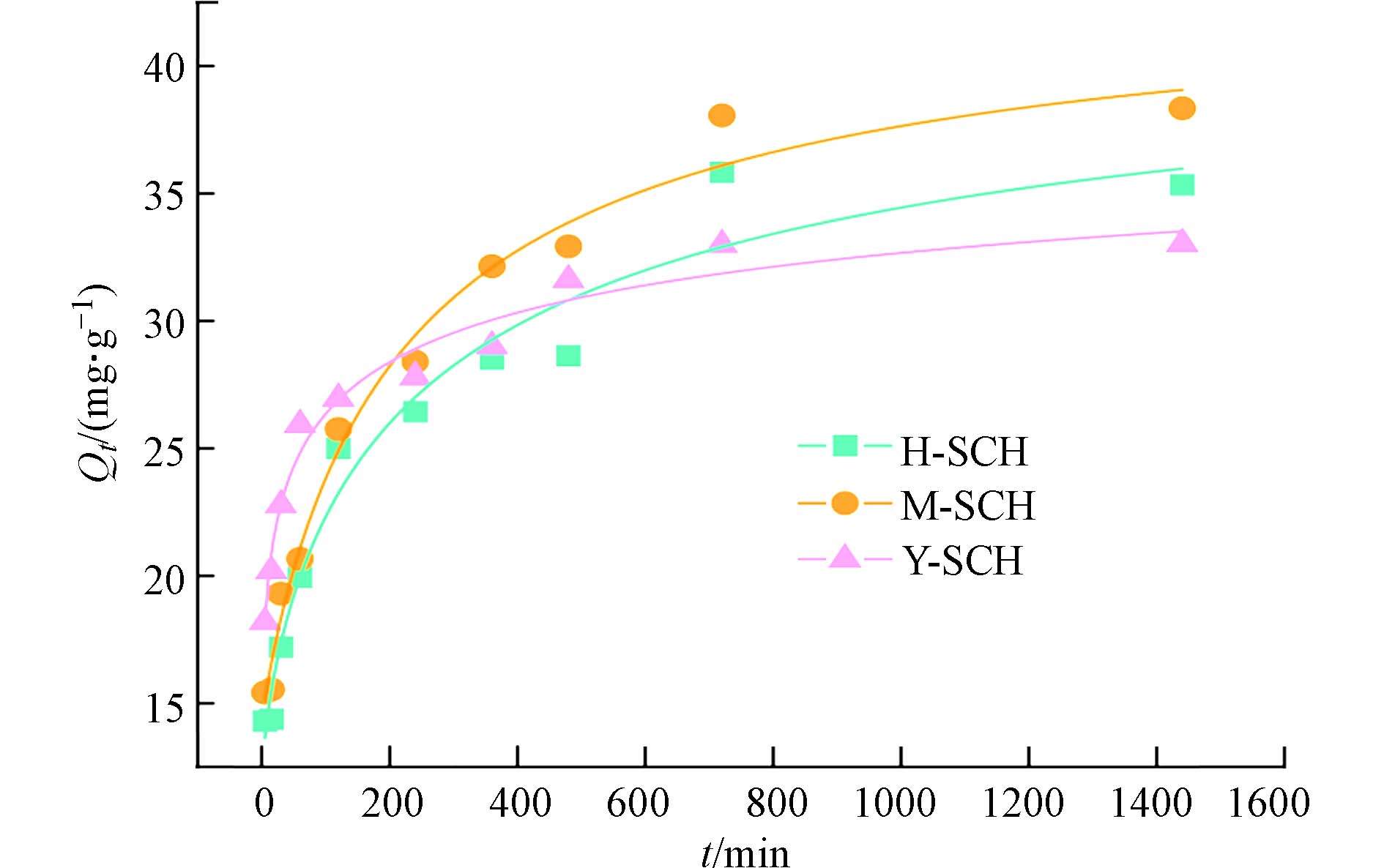
吸附动力学实验表明,3种施氏矿物对Sb(Ⅲ) 的吸附曲线呈现相似的趋势,随着矿吸附时间增加,吸附量逐渐增大,吸附速率逐渐降低(图4). H-SCH、M-SCH、Y-SCH在1 h时分别达到最大吸附量的55.7%、53.9%、78.5%,这主要是由于初始阶段 Sb(Ⅲ) 浓度较大且矿物表面活性吸附基团较多;随着反应时间增加,吸附位点被逐渐占据,3种矿物均在12 h时吸附逐渐趋于平衡,最大吸附容量分别达到 35.83、38.07、32.99 mg·g−1.
准一级动力学和准二级动力学模型常用于描述吸附动力学过程[26 − 27]. 准一级动力学模型假定目标污染物在吸附剂上的吸附过程是基于边界扩散的原理,准二级动力学模型描述化学吸附过程,吸附主要通过化学成键作用进行. 方程式如式(1)和(2)所示:
式中,qe,为吸附平衡后单位质量吸附剂吸附Sb(Ⅲ)的容量,mg·g−1;qt,为吸附时间t时刻单位质量吸附剂吸附Sb(Ⅲ)的容量,mg·g−1;k1,为准一级动力学方程的吸附速率常数,h−1;k2,为准二级动力学方程的吸附速率常数,g·mg−1·h−1.
拟合结果表明, Y-SCH最先达到吸附平衡,其次是M-SCH、 H-SCH(图4和表3). H-SCH、M-SCH、Y-SCH吸附Sb(Ⅲ)的准一级动力学模型的相关系数R2为 0.601、0.573、0.481,准二级动力学模型的相关系数R2为 0.992、0.995、0.999;且准二级动力学拟合数据最大吸附量与实验数据更为接近,因此准二级动力学模型更符合H-SCH、M-SCH、Y-SCH吸附Sb(Ⅲ)的过程(表3). 这也表明在吸附过程中化学吸附发挥主导作用,且吸附过程存在离子交换和络合反应. Sb(Ⅲ)除了在极酸极碱条件下,主要以电中性的Sb(OH)30形式存在,因此推测反应初始阶段Sb(OH)3主要与施氏矿物上的Fe—OH发生脱氢缩合,形成Fe—O—Sb键. 根据准二级动力学方程的吸附速率常数k2的数据可知,Y-SCH、M-SCH、H-SCH的k2分别为0.078、0.031、0.032 mg·g−1·h−1,这一拟合结果与1 h内3种矿物吸附Sb(Ⅲ)的速率一致,这也符合因为Y-SCH表面羟基较多的特性,吸附前期羟基络合的主导作用使得Y-SCH吸附Sb(Ⅲ)的速率最快.
颗粒内扩散模型的拟合结果表明,H-SCH、M-SCH、Y-SCH对Sb(Ⅲ)的吸附过程均具有多段性,拟合曲线均不通过原点(图5和表4),说明存在颗粒内扩散行为,该吸附过程受到表面吸附和颗粒扩散的共同作用.
3种矿物的吸附过程可分为两部分,分别为快速吸附过程以及缓慢吸附过程,由于初始阶段矿物表面存在大量的吸附活性位点以及较高的Sb(Ⅲ) 浓度,H-SCH、Y-SCH 分别在前2 h、1 h内发生快速吸附过程,斜率分别达到1.292 和1.424,分别达到最大吸附量的69.8%和78.5%. 随着表面吸附位点逐渐被占据,斜率减小,吸附速率逐渐降低,进行颗粒内扩散. 而M-SCH的快速吸附阶段持续到8 h,这可能是因为M-SCH矿物颗粒表面沟壑更多,表面活性位点分布不均,使快速吸附过程持续较长时间. 根据两阶段吸附数据的拟合参数可知,只有第一阶段颗粒内扩散才能很好地模拟(R2>0.97),这表明吸附过程主要受边界层扩散的控制,吸附反应还涉及其他吸附机制.
-
为了进一步探究H-SCH,M-SCH,Y-SCH吸附Sb(Ⅲ) 过程中的吸附机理及其差异,对吸附过程中不同时间点样品进行了红外光谱的表征,结果如图6.
可以看出,3种矿物在吸附Sb(Ⅲ)之后,仍保持施氏矿物的主要特征峰;3种矿物的外表面—OH伸缩振动峰强度随时间增加而逐渐降低,这表明羟基在吸附过程中发挥了主要作用,可以推断这是由于Sb(OH)3与Fe—OH发生表面络合吸附作用[28]. H-SCH、M-SCH的外圈络合SO42−,其图谱上位于977 cm−1和
1109 cm−1的伸缩振动峰强度逐渐降低,H-SCH表现更为明显,这表明与外部硫酸根的离子交换作用也参与到吸附过程中;而Y-SCH的外圈络合SO42−,振动峰强度变化不甚明显,可能是因为Y-SCH主要以羟基络合机制吸附锑. 3种矿物的内部结合态硫酸根振动峰都未呈现明显变化,这是因为Sb(Ⅴ)离子半径较大,会形成八面体配位结构[29],因而SO42−的结构位置不足以完全容纳 Sb-O 八面体,无法进入施氏矿物结构隧道内. -
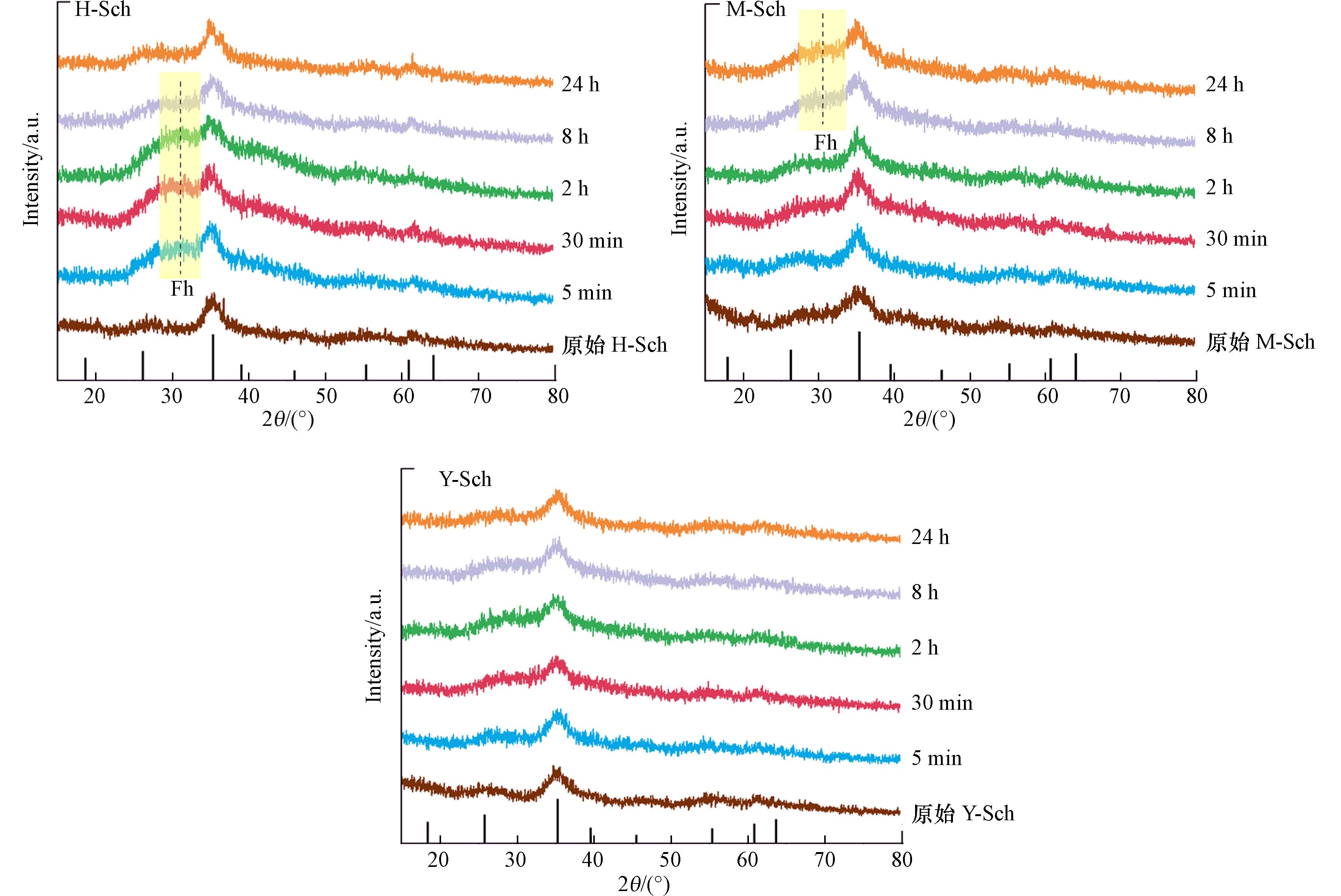
3种矿物吸附Sb(Ⅲ)的过程样品表征XRD图谱如图7所示,可以看到3种矿物仍保持施氏矿物的主要特征峰.
H-SCH在吸附Sb(Ⅲ)的5 min—8 h阶段都在35°附近出现了异于施氏矿物而有水铁矿特征[30]的宽峰,随后24 h时该特征宽峰消失,XRD图谱又呈现为施氏矿物. 一般来说,水铁矿是表生环境中Fe3+水解最先出现的沉淀物[31],常在接近中性及碱性环境中被发现(Dold, 2003). pH值、铁的浓度、有机质、共存离子等都能影响施氏矿物的稳定性[8]. 本吸附动力学实验过程中,同步监测发现吸附前期存在Fe3+的释放现象,且体系pH由7.5降至5.0左右,故该时段释放的Fe3+有水解成水铁矿的可能;由于水铁矿的热力学稳定性较差,随着反应时间的延长,吸附达到平衡阶段后总Fe浓度不再增加,水铁矿逐渐消失,矿相结构又转变为施氏矿物主要矿相[32],这与本实验结果一致.
M-SCH在8 h和24 h的样品图谱出现35°附近的水铁矿特征峰,但并不显著,而吸附前期并没有发生矿相变化,这可能是吸附前期Fe3+大量析出,仍在溶液中保持游离状态,而后部分Fe3+水解为水铁矿. 水铁矿具有比表面积大,等电点位高的特点,已有研究表明水铁矿对Sb具有吸附能力[33],对于H-SCH和M-SCH来说,吸附过程中水铁矿的出现,也提高了这两种矿物对Sb(Ⅲ)的吸附能力. Y-SCH的晶形结构在24 h内都没有发生转变,保持了较好的稳定性,施氏矿物的特征吸收峰仍然明显存在,因此Y-SCH在吸附Sb的过程中矿相没有变化,这可能是因为Y-SCH在吸附Sb的过程中主要以羟基络合的形式进行,因此对矿物结构的影响较小. 这也解释了前文所提到在吸附动力学过程中的总铁释放量,H-SCH和M-SCH因为存在Fe3+水解再沉淀形成水铁矿的现象,总铁释放量先增长后趋于平衡,而Y-SCH未发生矿相变化,因此其总铁释放量未呈现下降平衡的趋势.
-
利用XPS表征可分析矿物吸附Sb(Ⅲ)前后表层元素类别及价态,以便分析锑在矿物表面的结合形式. 图8显示了H-SCH、M-SCH和Y-SCH吸附前后的O1s谱和S2p谱. 结合能在530 eV和531.7 eV峰值分别为Fe—O—Fe和Fe—OH[34],532.2 eV的峰值为施氏矿物的SO42− , 在168.5 eV和169.8 eV处的两个峰分别为表面吸附的SO42−和施氏矿物的结构态SO42-[35].
吸附前的O1s 的图谱中,其中H-SCH的Fe-O-Fe峰面积占比较大,M-SCH和Y-SCH的SO42−峰面积占比以及Y-SCH的Fe-OH峰面积占比相对较高,与我们前述对矿物的表征结果一致,H-SCH矿物结构中结合了更多的铁,M-SCH和Y-SCH具有更多可交换态硫酸根,Y-SCH的表面羟基更多.
3种矿物在吸附24 h后,O1s 的图谱中的Fe—OH均有明显下降,同时 O2−键显著上升. 吸附后矿物表面Fe—OH比例的减少以及 O2−比例的增多说明在吸附过程中施氏矿物的羟基可能与Sb(OH)3络合,这与傅里叶红外光谱分析中3种矿物羟基振动峰缩小相吻合,再次表明 Sb(Ⅲ)与吸附剂表面Fe—OH发生了络合反应从而被吸附至矿物表面. Fe—OH在Sb(Ⅲ)的吸附中起着重要作用. 在吸附过程中,Sb(Ⅲ)可能与Fe—OH络合形成Fe—O—Sb键,符合吸附后XPS结果中O2−键的增加. Cheng等[36]的研究结果表明Fe-MIL-88B吸附Sb(Ⅲ)的吸附机制也是以与Fe-OH络合作用为主,这与本研究的实验结果类似.
吸附后3种矿物的XPS图谱均在结合能为 540.2 eV处产生了一个新的特征峰,该峰代表Sb(Ⅲ),这说明 Sb(Ⅲ)均被吸附在3种矿物表面上,531.3 eV处的特征峰为 Sb(Ⅴ)[37],说明吸附过程中Sb(Ⅲ)被氧化,这可能是矿物在吸附过程中释放的Fe3+氧化了Sb(Ⅲ),已有研究表明介孔分子筛MCM-41负载MnFe2O4吸附Sb(Ⅲ)时,Sb(Ⅲ)被Fe3+氧化[38],M-SCH吸附后图谱Sb(Ⅴ)峰面积较H-SCH和Y-SCH更大,氧化率更高,同时M-SCH的SO42−峰面积的显著降低,由此可知M-SCH在吸附Sb (Ⅲ)过程中由于氧化作用生成的Sb(OH)6−与矿物外部SO42−发生离子交换更为显著,同时进一步促进了吸附Sb(Ⅲ)的效果. 因此施氏矿物对 Sb(Ⅲ)的吸附主要是化学吸附和氧化还原作用的共同结果.
-
矿物吸附Sb(Ⅲ)过程的SEM-EDS数据结果如图9所示,选取了1 h、4 h、8 h和24 h进行观察. 由图可知3种矿物的微观形貌仍为球状结构,保持着施氏矿物的特征微观结构,同时都呈现出更明显的团聚体,矿物表面有更多小的团聚体.
扫描电镜图片显示H-SCH和M-SCH随着吸附时间增加,矿物结构表面沟壑愈发明显,球状结构被破坏的愈加明显,而Y-SCH颗粒团聚体间出现黏连状,但球状结构要比另两种矿物更稳定,这也与前文表征所对应,表明Y-SCH在吸附Sb(Ⅲ)过程中能够保持较好的稳定性.
根据样品EDS数据可以看到,3种矿物表面Sb占比随吸附时间增加而逐渐增加,吸附24 h矿物表面Sb占比分别为1.41%、1.32%、1.18%,这也说明施氏矿物吸附Sb(Ⅲ)的过程主要是表面吸附作用为主,Sb元素多附着在矿物表面;M-SCH表面S元素占比损失量较多,也佐证了M-SCH吸附Sb(Ⅲ)过程中对Sb(Ⅲ)的氧化率更高,外部硫酸根交换作用更明显;H-SCH和Y-SCH外表面O元素占比的明显下降归因于吸附过程中矿物表面Fe-OH发挥作用,与Sb(OH)3发生络合作用,张传巧[39]的实验结果也证明了这一作用.
-
(1)H-SCH在合成过程中结合了更多的Fe,具有更稳定的骨架结构,M-SCH拥有比H-SCH更多的内外部结构态SO42−,Y-SCH拥有更大的比表面积以及丰富的表面活性羟基,对合成矿物进行表征发现,M-SCH和Y-SCH的合成方法较之H-SCH的结晶度均有所下降.
(2)动力学结果表明,3种化学法合成施氏矿物对Sb(Ⅲ)的吸附均符合准二级动力学、颗粒内扩散模型,均以化学吸附为主,属于非均相扩散过程.
(3)在3种化学法合成施氏矿物吸附Sb(Ⅲ)的过程中,Y-SCH未发生矿相转化,具有较好的稳定性;而H-SCH和M-SCH在吸附中后期出现了水铁矿的特征峰,由于水铁矿对Sb(Ⅲ)也具有一定的吸附能力,这在一定程度上促进了矿物对Sb(Ⅲ)的吸附.
(4)实验揭示了3种施氏矿物对锑的吸附机理,包括静电吸附,羟基络合及离子交换. 其中以外表面羟基官能团络合作用为主,在吸附过程中Sb(Ⅲ)会被Fe(Ⅲ)氧化为Sb(Ⅴ),形成的Sb(OH)6−能够与施氏矿物表面可交换态SO42−进行离子交换,进一步促进施氏矿物吸附锑的能力.
3种合成施氏矿物对Sb(Ⅲ)的吸附动力学机制
Kinetics mechanisms of Sb(Ⅲ) adsorbed by three synthesized Schwertmannites
-
摘要: 施氏矿物具有结晶度低、比表面积大等特点,对环境中锑的界面行为有显著影响. 本文合成了3种施氏矿物(过氧化氢氧化法施氏矿物H-SCH、高锰酸钾氧化法施氏矿物M-SCH和乙醇改性法施氏矿物Y-SCH),以3种施氏矿物对Sb(Ⅲ)的吸附性能研究为主线,开展了吸附动力学实验研究,结合动力学全过程动态表征监测,揭示了不同化学法合成的施氏矿物对Sb(Ⅲ)吸附的差异性机制. 结果表明,H-SCH在合成过程中结合了更多的Fe,具有更稳定的骨架结构;M-SCH与Y-SCH拥有比H-SCH更多的结构态SO42−;Y-SCH拥有更大的比表面积以及丰富的表面活性羟基;同时与H-SCH相比,M-SCH和Y-SCH的矿物结晶度均有所下降. 吸附动力学过程揭示,3种施氏矿物对Sb(Ⅲ)的吸附均符合准二级动力学、颗粒内扩散模型,均以化学吸附为主,属于非均相扩散过程. XRD等矿物表征分析表明,在3种施氏矿物吸附Sb(Ⅲ)的过程中,Y-SCH未发生矿相转化,具有较好的稳定性;而H-SCH和M-SCH在吸附中后期出现了水铁矿的特征峰,由于水铁矿对Sb(Ⅲ)也具有一定的吸附能力,这在一定程度上促进了这两种矿物对Sb(Ⅲ)的吸附. 3种施氏矿物主要通过外表面羟基官能团的络合作用对Sb(Ⅲ)进行吸附,在吸附过程中Sb(Ⅲ)会被Fe(Ⅲ)氧化为Sb(Ⅴ),形成的Sb(OH)6−进一步与施氏矿物表面可交换态SO42−进行离子交换,促进了施氏矿物对锑的吸附,为施氏矿物在含锑废水处理领域的实际应用积累了理论和实验数据基础.Abstract: Schwertmannites are characterized by low crystallinity and high specific surface area, which significantly impact the interface process of antimony (Sb) in the environment. In this study, three types of Schwertmannites, namely H-SCH (synthesized by H2O2 oxidation method), M-SCH (synthesized by KMnO4 oxidation method), and Y-SCH (H-SCH modified by ethanol), were prepared. The study investigated the kinetics mechanisms of Sb(Ⅲ) adsorption by the three synthesized Schwertmannites through comprehensive monitoring and characterization. The results revealed that H-SCH combined more Fe during the synthesis process, resulting in a more stable framework structure. M-SCH and Y-SCH exhibited higher structural SO42− compared to H-SCH. Particularly, Y-SCH displayed a larger specific surface area and abundant surface-active hydroxyl groups. Both M-SCH and Y-SCH presented decreased trends in mineral crystallinity compared to H-SCH. The adsorption kinetics indicated that the adsorption of Sb(Ⅲ) by the three Schwertmannites followed the models of pseudo-second-order kinetics and particle diffusion, suggesting dominant chemical adsorption and a non-homogeneous diffusion process. XRD analysis revealed relative stability in Y-SCH during the adsorption process of Sb(Ⅲ), with no observed mineral phase transformation. However, the H-SCH and M-SCH groups exhibited characteristic peaks of ferrihydrite during the late stage of adsorption process, enhancing the adsorption of Sb(Ⅲ) due to the high adsorption abilities of ferrihydrite to Sb(Ⅲ). Chelation of surface hydroxyl functional groups was the main mechanism for Sb(Ⅲ) adsorption by the three synthesized Schwertmannites. During the adsorption process, Sb(Ⅲ) was oxidized to Sb(V) by Fe(Ⅲ), and the formed Sb(OH)6− further exchanged with exchangeable SO42− on the surface of Schwertmannites, inherently enhancing the adsorption of Sb(Ⅲ) by Schwertmannites. This work provides a theoretical basis and a comprehensive dataset for the practical application of Schwertmannites in the treatment of wastewater containing Sb.
-
Key words:
- Schwertmannite /
- Sb(Ⅲ) /
- adsorption /
- kinetics mechanisms /
- characterization.
-

-
表 1 矿物成分分析
Table 1. Mineral composition analysis
矿物种类
MineralsFe/ (mmol·g−1) SO42−/(mmol·g−1) Fe/S 理论分子式
Theoretical molecular formulaH-SCH 10.339 2.313 4.47 Fe8O8(OH)4.42(SO4)1.79 M-SCH 9.861 2.387 4.13 Fe8O8(OH)4.12(SO4)1.94 Y-SCH 9.971 2.456 4.06 Fe8O8(OH)4.06(SO4)1.97 表 2 3种施氏矿物比表面积和平均孔径
Table 2. Specific surface area and average pore volume of three kinds of SCH
矿物种类
Minerals比表面/(m2·g−1)
BET平均孔径/nm
Average pore volumeH-SCH 4.17 54.51 M-SCH 5.06 121.56 Y-SCH 16.15 72.60 表 3 3种施氏矿物吸附Sb(Ⅲ)的动力学拟合结果
Table 3. Kinetic fitting results of adsorption of Sb(Ⅲ) by three kinds of SCH
Pseudo-first-order Pseudo-second-order qe/(mg·g−1) k1/h−1 R2 qe/(mg·g−1) k2/ (g·mg−1·h−1) R2 H-SCH 30.274 1.800 0.601 36.153 0.032 0.992 M-SCH 32.354 1.800 0.572 39.277 0.031 0.995 Y-SCH 28.741 7.380 0.481 33.411 0.078 0.999 表 4 3种施氏矿物吸附Sb(Ⅲ)的颗粒扩散模型拟合参数
Table 4. Particle diffusion model fitting parameters of Sb(Ⅲ) adsorption by three kinds of SCH
时间/h
Time rangeKd/(g·mg−1·h−0.5) R2 H-SCH 0—2 1.292 0.984 2—24 0.435 0.821 M-SCH 0—8 0.954 0.974 8—24 0.285 0.588 Y-SCH 0—1 1.424 0.998 1—24 0.266 0.859 -
[1] BIGHAM J M, CARLSON L, MURAD E. Schwertmannite, a new iron oxyhydroxysulphate from Pyhäsalmi, Finland, and other localities[J]. Mineralogical Magazine, 1994, 58(393): 641-648. doi: 10.1180/minmag.1994.058.393.14 [2] BIGHAM J M, SCHWERTMANN U, PFAB G. Influence of pH on mineral speciation in a bioreactor simulating acid mine drainage[J]. Applied Geochemistry, 1996, 11(6): 845-849. doi: 10.1016/S0883-2927(96)00052-2 [3] PAIKARAY S, PEIFFER S. Abiotic schwertmannite transformation kinetics and the role of sorbed As(Ⅲ)[J]. Applied Geochemistry, 2012, 27(3): 590-597. doi: 10.1016/j.apgeochem.2011.12.013 [4] 谢莹莹. 溶解性有机质介导下酸性矿山废水中施氏矿物的转化机制及对重金属环境行为的影响[D]. 广州: 华南理工大学, 2018. XIE Y Y. Phase transformation of schwertmannite mediated by dissolved organic matter in acid mine drainage and its effects on environmental behaviour of heavy metals[D]. Guangzhou: South China University of Technology, 2018 (in Chinese).
[5] SONG J, JIA S Y, REN H T, et al. Application of a high-surface-area schwertmannite in the removal of arsenate and arsenite[J]. International Journal of Environmental Science and Technology, 2015, 12(5): 1559-1568. doi: 10.1007/s13762-014-0528-9 [6] FAN L J, ZHANG X J. Adsorption and desorption of cadmium on synthetic schwertmannite[J]. Desalination and Water Treatment, 2017, 79: 243-250. doi: 10.5004/dwt.2017.20339 [7] PAIKARAY S, PEIFFER S. Biotic and abiotic schwertmannites as scavengers for As(III): Mechanisms and effects[J]. Water, Air, & Soil Pollution, 2012, 223(6): 2933-2942. [8] 罗灿钰, 张琢, 赵华甫. 施氏矿物的矿物学特征及其除砷研究进展[J]. 环境化学, 2021, 40(11): 3530-3543. doi: 10.7524/j.issn.0254-6108.2020070302 LUO C Y, ZHANG Z, ZHAO H F. The mineralogical characteristics of schwertmannite and its progress in arsenic removal[J]. Environmental Chemistry, 2021, 40(11): 3530-3543 (in Chinese). doi: 10.7524/j.issn.0254-6108.2020070302
[9] LIU F W, ZHOU J, ZHANG S S, et al. Schwertmannite synthesis through ferrous ion chemical oxidation under different H2O2 supply rates and its removal efficiency for arsenic from contaminated groundwater[J]. PLoS One, 2015, 10(9): e0138891. doi: 10.1371/journal.pone.0138891 [10] HAN X, LI Y L, GU J D. Oxidation of As(III) by MnO2 in the absence and presence of Fe(II) under acidic conditions[J]. Geochimica et Cosmochimica Acta, 2011, 75(2): 368-379. doi: 10.1016/j.gca.2010.10.010 [11] GAN M, SUN S J, ZHENG Z H, et al. Adsorption of Cr(Ⅵ) and Cu(Ⅱ) by AlPO4 modified biosynthetic schwertmannite[J]. Applied Surface Science, 2015, 356: 986-997. doi: 10.1016/j.apsusc.2015.08.200 [12] SUN S J, ZHU J Y, ZHENG Z H, et al. Biosynthesis of β-cyclodextrin modified Schwertmannite and the application in heavy metals adsorption[J]. Powder Technology, 2019, 342: 181-192. doi: 10.1016/j.powtec.2018.09.072 [13] LI J Y, ZHENG B H, HE Y Z, et al. Antimony contamination, consequences and removal techniques: A review[J]. Ecotoxicology and Environmental Safety, 2018, 156: 125-134. doi: 10.1016/j.ecoenv.2018.03.024 [14] ETTLER V, TEJNECKÝ V, MIHALJEVIČ M, et al. Antimony mobility in lead smelter-polluted soils[J]. Geoderma, 2010, 155(3/4): 409-418. [15] FU Z Y, WU F C, MO C L, et al. Bioaccumulation of antimony, arsenic, and mercury in the vicinities of a large antimony mine, China[J]. Microchemical Journal, 2011, 97(1): 12-19. doi: 10.1016/j.microc.2010.06.004 [16] HE M C, WANG X Q, WU F C, et al. Antimony pollution in China[J]. Science of the Total Environment, 2012, 421/422: 41-50. doi: 10.1016/j.scitotenv.2011.06.009 [17] ZHENG J, OHATA M, FURUTA N. Studies on the speciation of inorganic and organic antimony compounds in airborne particulate matter by HPLC-ICP-MS[J]. Analyst, 2000, 125(6): 1025-1028. doi: 10.1039/b002201m [18] 张晓健. 甘肃陇星锑污染事件和四川广元应急供水[J]. 给水排水, 2016, 52(10): 9-20. doi: 10.3969/j.issn.1002-8471.2016.10.002 ZHANG X J. Antimony pollution accident of Gansu Longxing enterprise and emergent water supply in Guangyuan City[J]. Water & Wastewater Engineering, 2016, 52(10): 9-20 (in Chinese). doi: 10.3969/j.issn.1002-8471.2016.10.002
[19] 朱静, 吴丰昌, 邓秋静, 等. 湖南锡矿山周边水体的环境特征[J]. 环境科学学报, 2009, 29(3): 655-661. doi: 10.3321/j.issn:0253-2468.2009.03.029 ZHU J, WU F C, DENG Q J, et al. Environmental characteristics of water near the Xikuangshan antimony mine, Hunan Province[J]. Acta Scientiae Circumstantiae, 2009, 29(3): 655-661 (in Chinese). doi: 10.3321/j.issn:0253-2468.2009.03.029
[20] WANG L L, LI H, YU D Y, et al. Hyperbranched polyamide-functionalized sodium alginate microsphere as a novel adsorbent for the removal of antimony(Ⅲ) in wastewater[J]. Environmental Science and Pollution Research, 2019, 26(26): 27372-27384. doi: 10.1007/s11356-019-05914-4 [21] ZHANG D J, WU S Y, WEI Y D, et al. Schwertmannite modified with ethanol: A simple and feasible method for improving As(III) adsorption capacity[J]. Journal of Environmental Chemical Engineering, 2022, 10(3): 107412. doi: 10.1016/j.jece.2022.107412 [22] CAO Q W, CHEN C, LI K, et al. Arsenic(V) removal behavior of schwertmannite synthesized by KMnO4 rapid oxidation with high adsorption capacity and Fe utilization[J]. Chemosphere, 2021, 264: 128398. doi: 10.1016/j.chemosphere.2020.128398 [23] LI X, ZHANG Y K, XIE Y, et al. Ultrasonic-enhanced Fenton-like degradation of bisphenol A using a bio-synthesized schwertmannite catalyst[J]. Journal of Hazardous Materials, 2018, 344: 689-697. doi: 10.1016/j.jhazmat.2017.11.019 [24] BOILY J F, GASSMAN P L, PERETYAZHKO T, et al. FTIR spectral components of schwertmannite[J]. Environmental Science & Technology, 2010, 44(4): 1185-1190. [25] BOWLES J F W. Cornell R. M. and Schwertmann U. The Iron Oxides: Structure, Properties Reactions Occurrence and Uses. [J]. Mineralogical Magazine, 1997, 61(408): 740-741. doi: 10.1180/minmag.1997.061.408.20 [26] JUANG R S, WU F C, TSENG R L. Mechanism of adsorption of dyes and phenols from water using activated carbons prepared from plum kernels[J]. Journal of Colloid and Interface Science, 2000, 227(2): 437-444. doi: 10.1006/jcis.2000.6912 [27] HO Y S, McKAY G. Comparative sorption kinetic studies of dye and aromatic compounds onto fly ash[J]. Journal of Environmental Science and Health, Part A, 1999, 34(5): 1179-1204. doi: 10.1080/10934529909376889 [28] 李双双, 戴友芝, 于磊, 等. 铁改性海泡石除锑的影响因素研究[J]. 环境工程学报, 2009, 3(3): 485-488. LI S S, DAI Y Z, YU L, et al. Study on affecting factors of removing antimony with iron modified sepiolite[J]. Chinese Journal of Environmental Engineering, 2009, 3(3): 485-488 (in Chinese).
[29] LAN B Y, WANG Y X, WANG X, et al. Aqueous arsenic (As) and antimony (Sb) removal by potassium ferrate[J]. Chemical Engineering Journal, 2016, 292: 389-397. doi: 10.1016/j.cej.2016.02.019 [30] 丁秘, 康文晶, 冯程龙, 等. 人工合成水铁矿对水中六价铬的吸附特征研究[J]. 工业水处理, 2017, 37(2): 29-33. doi: 10.11894/1005-829x.2017.37(2).029 DING M, KANG W J, FENG C L, et al. Research on the adsorption characteristics of synthetic ferrihydrite for hexavalent chromiumon in water[J]. Industrial Water Treatment, 2017, 37(2): 29-33 (in Chinese). doi: 10.11894/1005-829x.2017.37(2).029
[31] SCHWERTMANN U, TAYLOR R M. Iron oxides[M]//SSSA Book Series. Madison, WI, USA: Soil Science Society of America, 2018: 379-438. [32] 范聪. 施氏矿物还原-重结晶过程中重金属的再分配机制研究[D]. 广州: 华南理工大学, 2019. FAN C. Redistribution mechanism of previously-bound heavy metals during the Fe(Ⅱ)-induced recrystallization of schwertmannite[D]. Guangzhou: South China University of Technology, 2019 (in Chinese).
[33] 申思月, 黄阳, 王维清, 等. 水铁矿及其腐殖酸复合体对Sb(Ⅴ)的吸附行为研究[J]. 环境科学学报, 2019, 39(12): 4015-4021. SHEN S Y, HUANG Y, WANG W Q, et al. Study on adsorption behavior of Sb(Ⅴ) by ferrihydrite and its humic acid complex[J]. Acta Scientiae Circumstantiae, 2019, 39(12): 4015-4021 (in Chinese).
[34] FAN C, GUO C L, ZHANG J H, et al. Thiocyanate-induced labilization of schwertmannite: Impacts and mechanisms[J]. Journal of Environmental Sciences, 2019, 80: 218-228. doi: 10.1016/j.jes.2018.12.015 [35] SU X Y, LI X F, MA L M, et al. Formation and transformation of schwertmannite in the classic Fenton process[J]. Journal of Environmental Sciences (China), 2019, 82: 145-154. doi: 10.1016/j.jes.2019.03.004 [36] CHENG K, WU Y N, ZHANG B R, et al. New insights into the removal of antimony from water using an iron-based metal-organic framework: Adsorption behaviors and mechanisms[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2020, 602: 125054. doi: 10.1016/j.colsurfa.2020.125054 [37] WU T L, SUN Q, FANG G D, et al. Unraveling the effects of Gallic acid on Sb(Ⅲ) adsorption and oxidation on goethite[J]. Chemical Engineering Journal, 2019, 369: 414-421. doi: 10.1016/j.cej.2019.03.085 [38] LI W B, FU F L. Incorporating MnFe2O4 onto the thiol-functionalized MCM-41 for effective capturing of Sb(III) in aqueous media[J]. Microporous and Mesoporous Materials, 2020, 298: 110060. doi: 10.1016/j.micromeso.2020.110060 [39] 张传巧. 新型镧锰复合氧化物制备及其去除水中锑的研究[D]. 西安: 西安建筑科技大学, 2020. ZHANG C Q. Preparation of A novel lanthanum-manganese binary oxide and its behavior and mechanism for the removal of antimony from aqueous solution[D]. Xi'an: Xi'an University of Architecture and Technology, 2020 (in Chinese).
-




 下载:
下载: