-
碘元素有几种与健康或环境问题有关的同位素,如127I、129I、131I等. 127I是唯一的一种非放射性同位素,也是人体必需的微量元素. 它是甲状腺激素三碘甲状腺原氨酸(C15H12I3NO4)和甲状腺素(C15H11I4NO4)的组成部分,参与人体的新陈代谢,127I摄入量不足或摄入量过多都会对人体的发育和生长产生影响[1 − 2]. 2021年全球碘营养记分卡显示26个国家和地区碘摄取不足,12个国家和地区碘摄取过量[3]. 通过食用碘盐去补充人体所需的碘是大家公认的一种方法. 此外,还可以对食用性植物进行碘生物强化,常见的碘生物强化植物有菠菜、小麦、水稻、番茄、生菜、胡萝卜和马铃薯等[4 − 8]. 植物中碘的来源之一是植物根部从土壤中吸收碘元素.
pH、氧化还原电位、土壤有机质和铁锰铝氧化物等土壤性质会影响碘在土壤中的固定、迁移和形态变化. 土壤中碘的转化方式有氧化还原、有机化、挥发、生物代谢以及植物根部吸收等,其中氧化还原是碘形态转化的主要过程. 目前,国内外对于土壤中碘的迁移转化作用机理仍存在许多未解决的疑点,本文对土壤中碘的含量、形态以及土壤中碘的吸附及迁移转化等环境行为进行总结,并针对未解决的问题提出了今后的研究方向.
-
碘主要通过大气干湿沉降、成土母质和植物释放等方式进入土壤. 土壤中碘含量与土壤理化性质有关,世界各地土壤性质差异较大,导致土壤中碘的含量范围较广. 其中,富含有机质与金属氧化物的土壤中碘的含量比较高,当pH值在3—4时土壤中碘的含量也会相对较高[9]. 除此之外,土壤的地理位置也会影响碘含量,距离海洋近的陆地土壤中碘含量就会较高,这与海洋中碘挥发有关[10].
-
研究者针对不同地区的土壤进行了碘含量的测量分析,得出土壤中碘的含量及变化范围. 世界各地土壤碘的数据库中
2151 种土壤样品里碘的含量范围为0.1—150 mg·kg−1,碘的平均含量为5.1 mg·kg−1,近一半的土壤中碘含量小于2.5 mg·kg−1,土壤中碘的分布并不均匀[11]. 我国表层土壤的碘含量分布也不均匀,不同的土壤类型中碘含量有明显差异,表1总结了中国不同土壤类型中土壤A层的碘含量,在富含有机质和黏土的土壤中,碘含量通常较高,如红壤、黄壤等. 在新疆若羌县表层土壤中的碘含量低于全国表层土壤碘含量背景值[12],这与当地的土壤类型(棕漠土、灌淤土等)有很大关系. -
土壤中碘含量的影响因素有很多,首先是土壤的地理位置. 海水是陆地生物圈中碘的最大来源. 生物反应和光化学反应导致无机碘和有机碘从海水中挥发出来,挥发性碘有机化合物(碘甲烷(CH3I)、二碘甲烷(CH2I2)、氯碘甲烷(ClCH2I)、碘乙烷(C2H5I)和碘丙烷(C3H7I)[10, 14])释放到大气中会发生光解,进而以气溶胶和气体的形式通过风雨就近向内陆沉积进入土壤(图1),所以距离海洋近的土壤中碘浓度比较高. 中国碘的浓度和空间分布发现,碘浓度低的土壤主要分布在远离海洋的地区. 在有机质有效固定的情况下,近海陆地土壤碘的含量高于内陆地区[15].
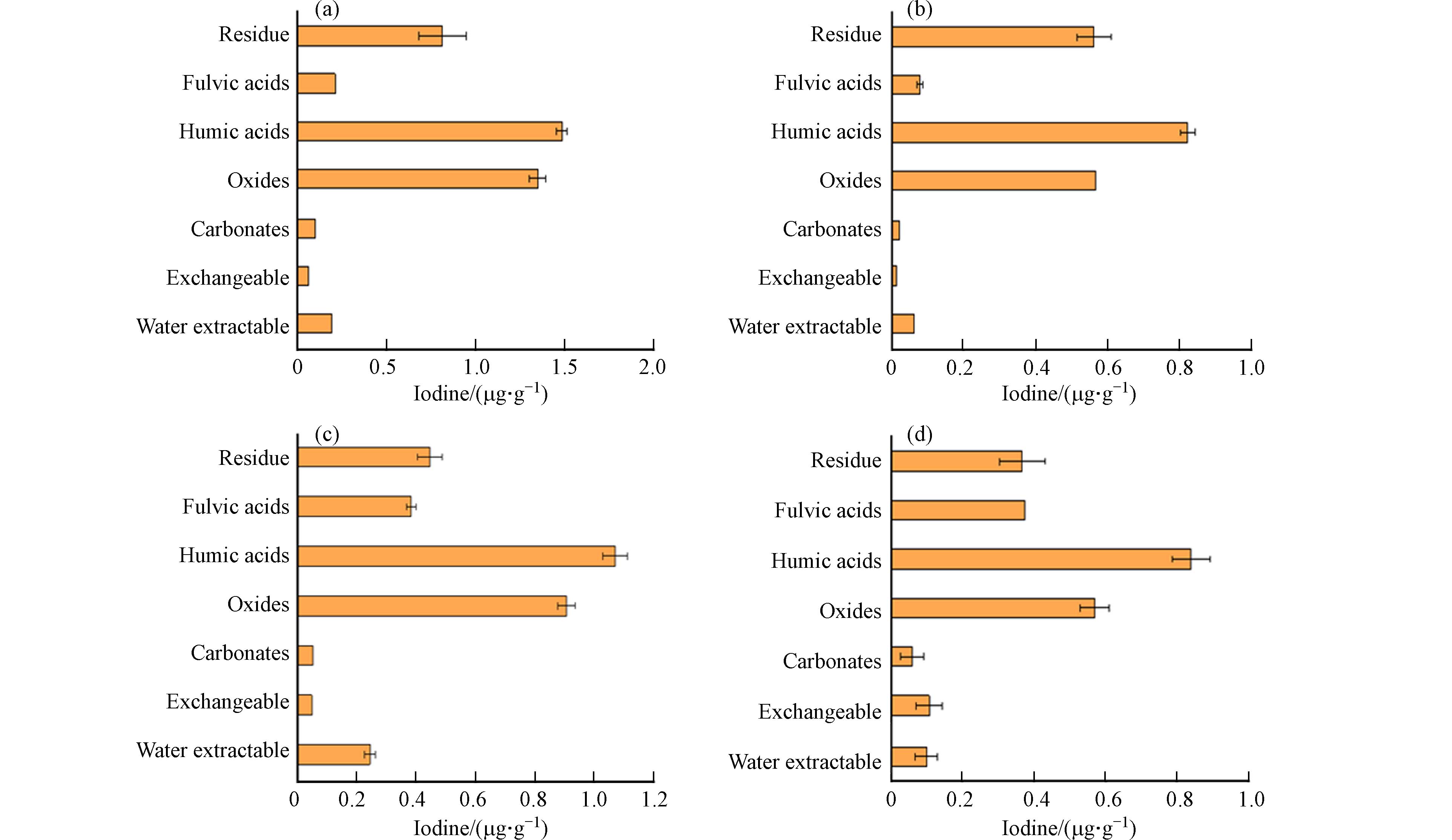
土壤中的有机质和金属氧化物对碘的固定和释放有重要作用. 土壤中碘的主要储存库是腐殖质,腐殖质是土壤有机质腐化的产物[16]. 土壤中的碘含量主要取决于碘进入土壤的量和土壤中有机质、金属氧化物对碘的固定能力. 研究发现当土壤中有机质含量和金属氧化物含量高时,土壤固定碘的能力越强[17]. Duborská等[18]从农业和森林土壤中提取土壤组分并测量了组分中的碘含量和浓度,发现大部分的碘是从土壤腐殖质(主要是胡敏酸部分)和金属氧化物中提取出来的,且富含上述物质的土壤中的碘含量也较为偏高(图2). 由此可以证实,土壤中碘含量与有机质和金属氧化物的含量有明显的正相关关系.
-
在很大程度上,碘在土壤中的迁移主要取决于碘的存在形态. 碘在土壤中的主要化学形态为碘酸根、碘离子和有机碘,有机碘包括可溶性有机碘和难溶性有机碘[19 − 20]. 碘的形态发生变化与碘在土壤中一系列的氧化还原、络合、吸附、沉淀和微生物反应有关.
碘与土壤颗粒结合在一起,根据颗粒的一般化学性质,通过连续提取方式,可以将碘从不同组分中提取出来,提取剂与条件见表2. 主要可识别组分有:水溶态碘、可交换态碘、碳酸盐结合态碘、矿物氧化物结合态碘、土壤有机质结合态碘及残渣碘[21]. 通过分析图2与表2的碘含量及占比发现,土壤中的水溶态碘含量较低(<12.7%),腐殖质和矿物氧化物结合态碘含量较高,这与土壤对元素碘的吸附也有重要联系(具体见小节3.1).
-
目前碘常用的测量分析方法有分光光度法[24]、色谱法[25 − 26]、电感耦合等离子发射光谱法(ICP-AES)[27]、电感耦合等离子质谱法(ICP-MS)[25 − 26, 28 − 30]和X射线荧光光谱法(XRF). 表3总结了近3年碘含量测定的前处理方法与测量仪器. 土壤中碘含量常用的测量分析方法是紫外分光光度计(占比22.2%)和ICP-MS(占比66.7%),常用的提取剂是TMAH溶液(占比62%).
-
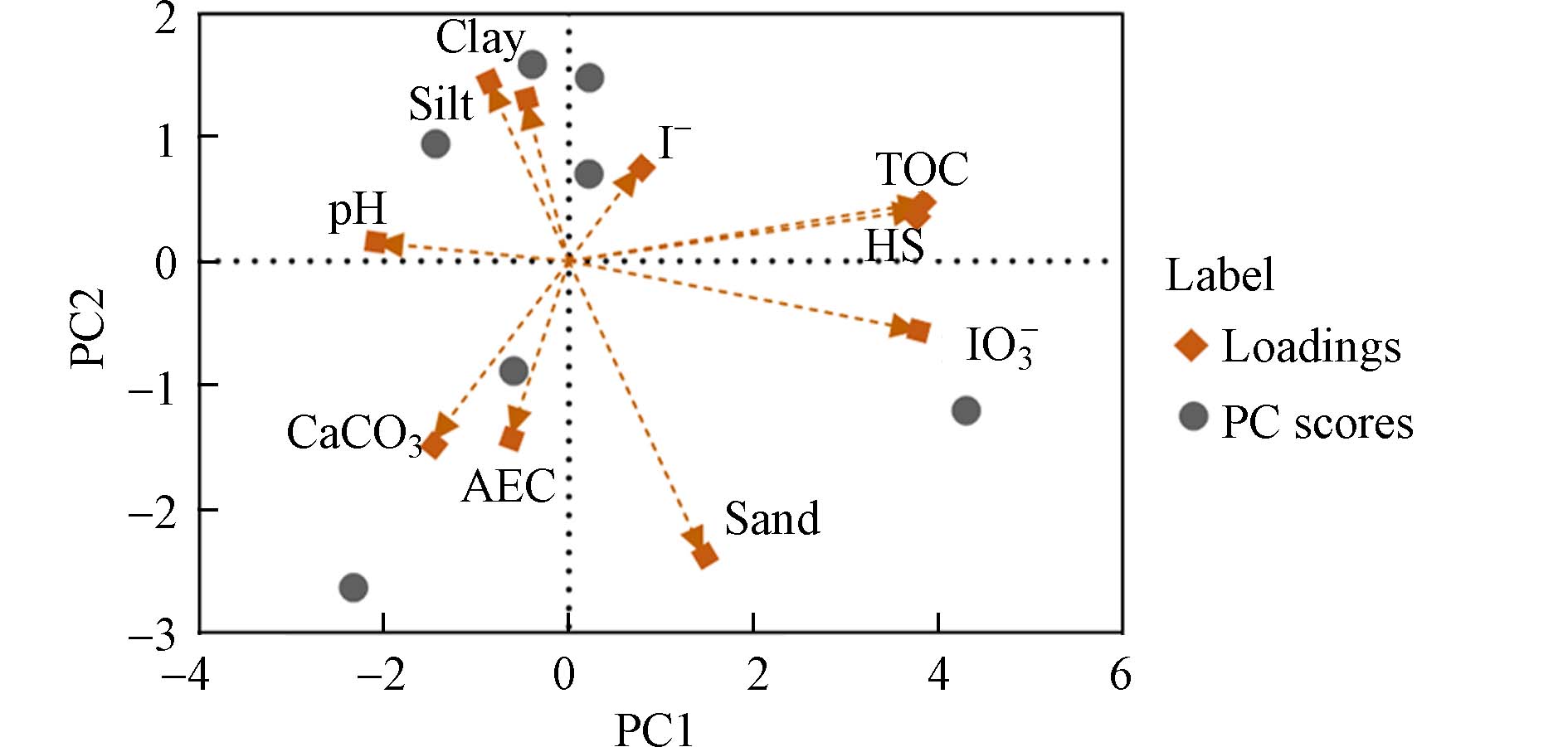
土壤对于无机碘的吸附是碘在土壤中迁移转化的重要前提. 碘与土壤中的有机质、金属氧化物和黏土的络合作用不仅固定了碘,同时降低了植物可利用的水溶性碘的浓度[46]. 根据土壤的理化性质和其对无机碘吸附的数据(总有机碳(TOC%)、腐殖质(HS%)、黏土/沙土/粉砂含量(clay/sand/silt,%)、AEC、CaCO3、pH以及土壤对无机碘吸附含量(mg·kg−1))做PCA分析后得出了双标图(图3),箭头代表变量,灰点代表土壤,箭头之间夹角表示原始变量之间关系的密切程度,通过观察理化性质与碘离子、碘酸根的夹角,可以发现总有机碳(TOC)、腐殖质(HS)和黏土含量与吸附效果呈正相关,且TOC与HS含量与土壤吸附无机碘的效率关系很密切,而pH值与吸附效果呈负相关.
土壤有机质(胡敏酸(HA)、富里酸(FA)和胡敏素(HM))是土壤固相中重要的组成部分,对无机碘具有较强的吸附作用. 在I-氧化或IO3-还原为低碘酸(HIO)和碘分子(I2)时,不稳定的HIO和I2很难在孔隙水中长期存在,会与土壤有机质中的结构位点(如酚、甲酸、羧酸、酰胺和醌类等)共价结合,使碘结合到有机质上,产生新物质—有机碘化合物[47 − 49]. 从土壤提取的HA具有强烈的结合碘的能力,使用尺寸排阻层析(SEC)还证实了碘更易与低分子量的有机质结合,与高分子量有机质结合对时间有很强的依赖性[50]. 有机质的类型不同也会影响对碘的吸附效果. 在环境浓度下,HA的吸收率始终高于FA,这可能是由于HA中芳香碳的数量高于FA.
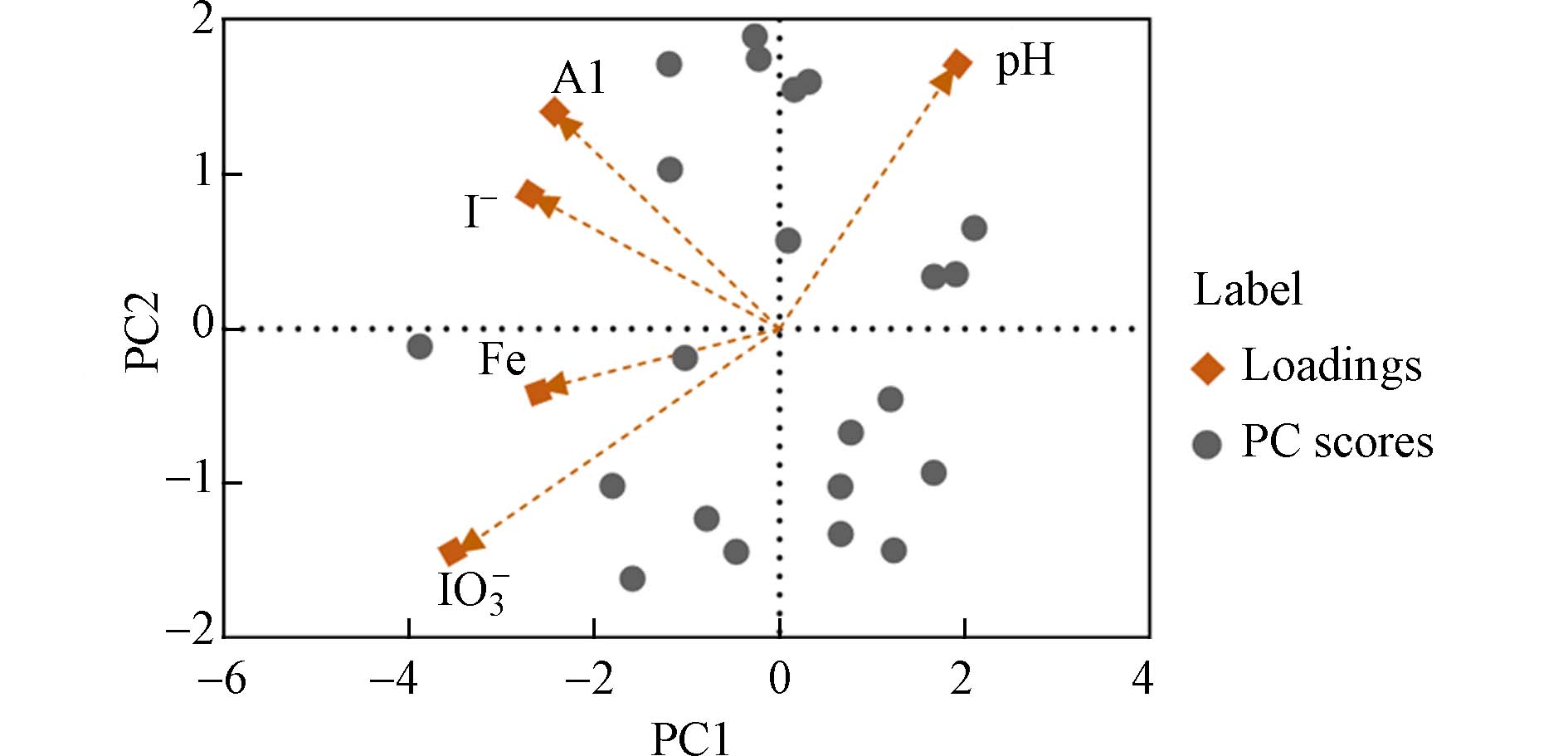
土壤中的铁铝矿物的存在也会促进土壤对无机碘的吸附,通过收集22种土壤的数据绘制的主成分分析图(图4)可以证实碘离子与碘酸根的吸附与铁铝矿物的含量呈正相关. 无机碘与金属氧化物结合的过程是发生了氧化还原反应,土壤中的带有正电荷的铁铝矿物与带负电荷的无机碘会相互吸引. 二价态铁的存在可以介导碘酸根的还原,产生易于与土壤颗粒结合的亲电性HIO和I2,或被直接还原为碘离子,这也导致土壤对碘酸盐的固定更强[51 − 52]. 学者进一步通过建模得出了土壤对碘酸盐吸附能力高于对碘离子的结论[53].
在自然条件下,土壤的pH和Eh(氧化还原电位)也是影响碘在土壤中吸附和转化的重要因素. 不同的pH和Eh时环境中的碘形态存在差异,在较宽的pH值和Eh为0.6 mV以下时,碘化物为主要形态,高度氧化情况下,碘酸盐为主要形态[54 − 56]. 图3和图4主成分分析图中碘离子和碘酸根与pH的夹角大于90°,无机碘吸附与土壤pH密切相关且呈反比. 在酸性溶液中,土壤矿物表面的羟基会发生质子化,铁铝化合物对无机碘的吸附作用增强,促进了土壤对无机碘的吸附. 同时,较低的pH值会增加土壤中电荷的阴离子交换能力,促进土壤对无机碘的吸附[57]. pH值3—4时土壤对于碘的吸附能力最强[58]. 当土壤呈碱性时,土壤矿物进行脱质子化使其表面带有负电荷,与土壤无机碘同性相斥,因此铁铝氧化物吸附能力降低,土壤对于碘的吸附量随之降低.
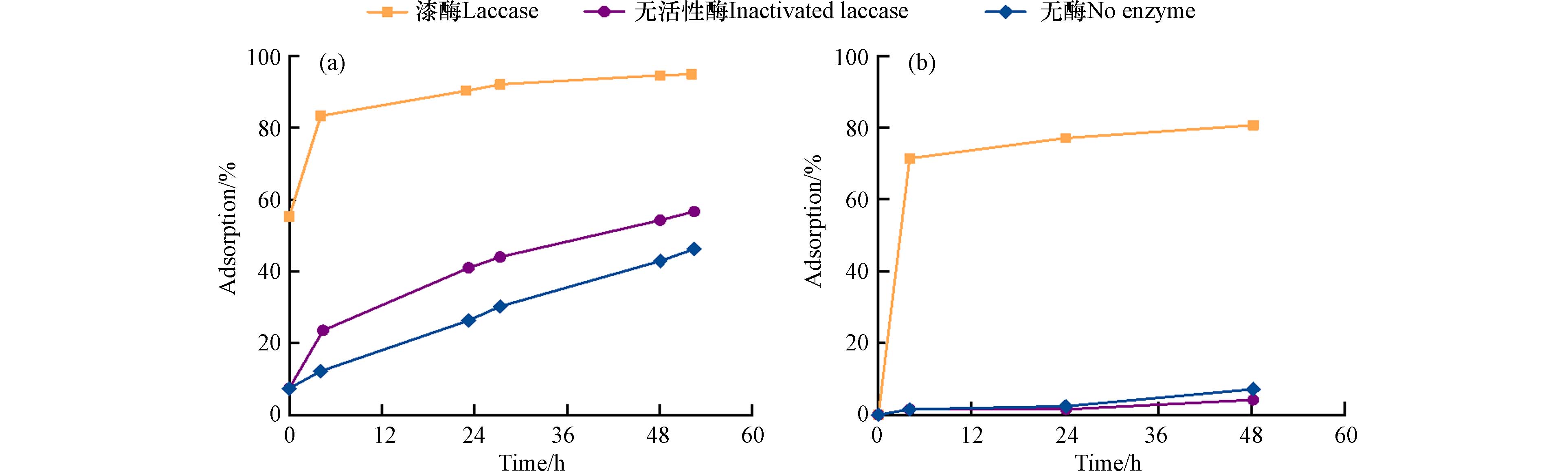
土壤的微生物活性和酶会影响碘的吸附. 为证明漆酶对于土壤吸附碘化物的影响,通过一系列促进和抑制漆酶活性的方式改变系统状态,在无酶、无活性酶和漆酶存在的3种情况下,活性漆酶存在时土壤对于碘离子的吸附最强,无酶时土壤对碘离子的吸附效果最弱[47](图5).
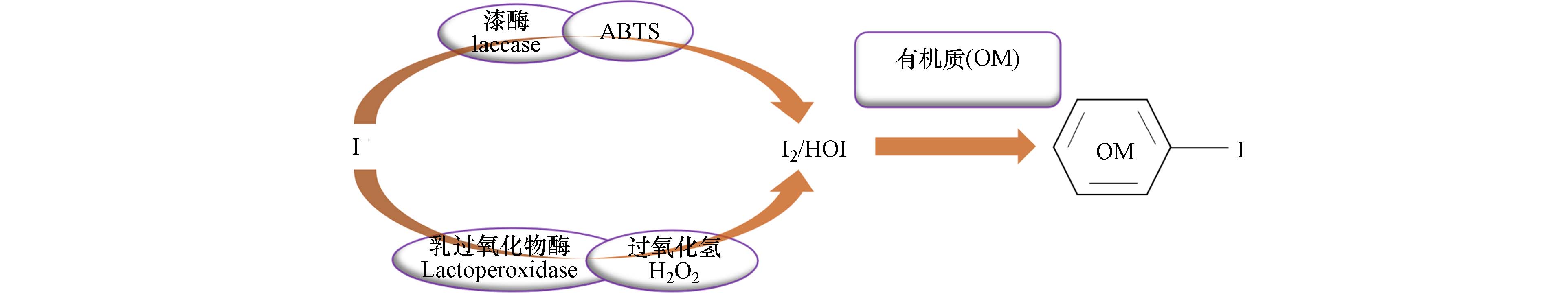
在HA-I的系统中添加漆酶或乳过氧化物酶(LPO),结果发现当介体(ABTS(2,2-联氮-双-3-乙基苯并噻唑啉-6-磺酸)和H2O2)存在时,两个体系均能促进HA对于I-的吸附[59]. 真菌漆酶活性与土壤中的碘氧化酶活性呈正相关,在介体存在时会促进土壤中碘离子氧化,生成易于有机质结合的碘形态[60]. 其他条件相同的情况下,无酶反应时土壤对碘离子的吸附效率低的原因在于乳过氧化物酶和漆酶存在促进碘离子的氧化(具体见小节碘离子的氧化),增强了碘离子的碘化反应.
除上述原因之外,随着碘浓度的增加,吸附系数也会增加,然而,这种线性相关并不一定适用于所有碘浓度范围. 在土壤中强结合位点不变的情况下,高浓度碘离子或碘酸根向反应活性物种(I2和HIO)的转化会受到限制,吸附效率降低[57]. 另外,时间也是影响土壤吸附碘效率的因素,在HA和无机碘的结合研究中发现,4 d时的碘吸收效率仅为10 d的60%,IO3−和富含有机物的沉积物之间的非酶反应具有很强的时间依赖性[61 − 62].
-
碘元素在土壤介质中的迁移行为及生物有效性很大程度取决于其在土壤中的转化过程. 碘元素从土壤到食物链的转运也与其有着千丝万缕的联系,因此,碘在土壤中的转化对其在环境和人体中的行为具有重要影响.
-
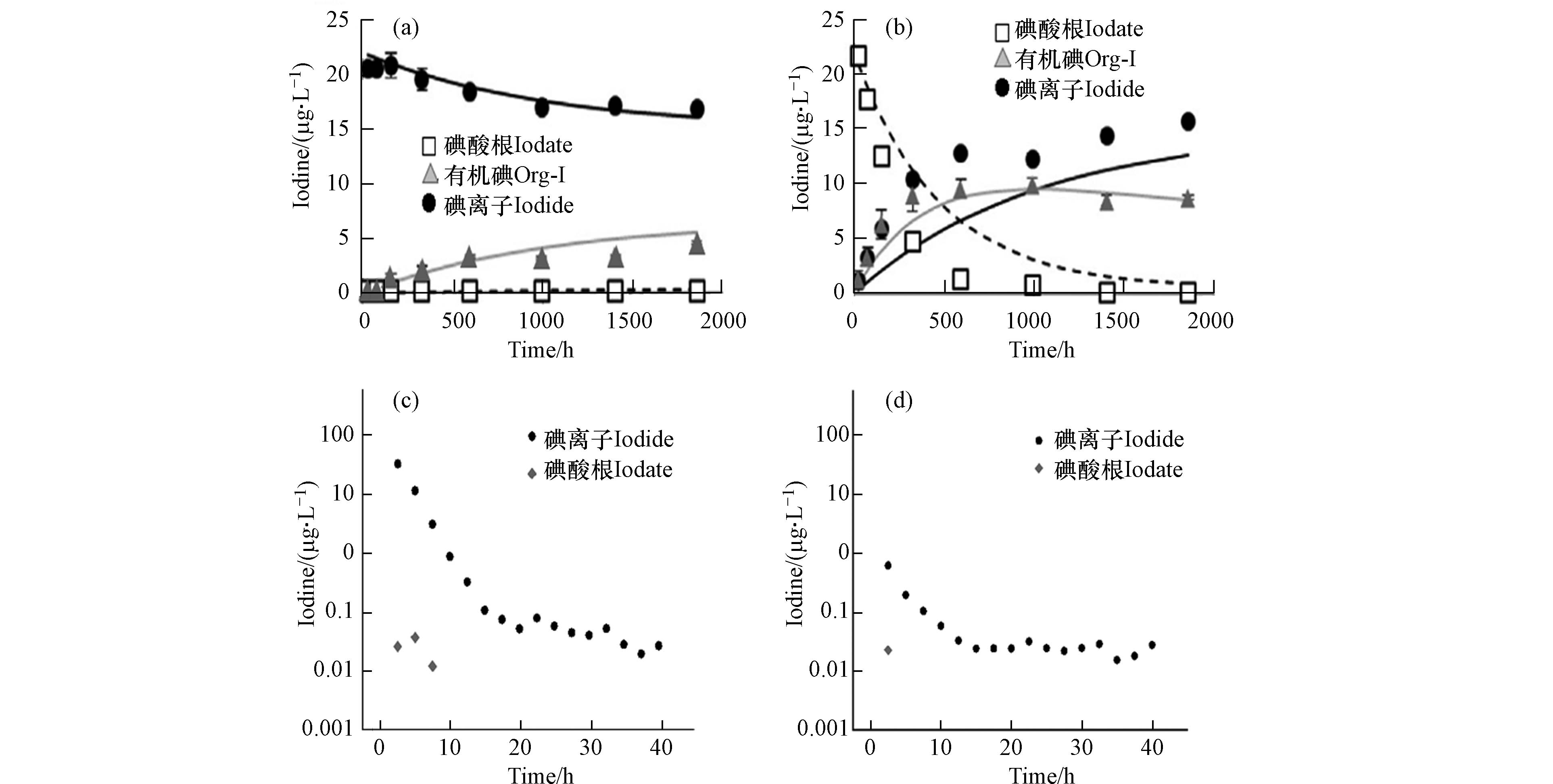
在厌氧条件和酸性条件下,碘酸根会被土壤中的二价铁和对苯二酚(或半醌)基团或自由基非生物还原为碘化物[48],其中间产物就是上文所提及的I2和HIO. 通过向腐殖酸溶液中添加相同浓度的碘离子(图6a)与碘酸根(图6b),研究发现添加碘离子的土壤溶液中碘酸根浓度趋近于无,而添加碘酸根的土壤溶液中观察到碘离子出现,观察短期碘动态实验图(图6d)发现在添加碘酸根的土壤溶液中碘离子存在且碘酸根浓度减少,这也可以证实碘酸根在土壤溶液中发生了还原反应,生成碘离子.
-
土壤中碘离子的氧化会经过两部分,首先是碘离子被氧化成碘分子,之后再被氧化为碘酸根. 在土壤短期碘动态实验图中(图6c,d),添加碘离子的土壤溶液中仅能在10 h之前观察到微量碘酸盐(图6c),与碘酸根还原反应相比,碘离子氧化为碘酸根的反应有限. 在土壤中,碘化物可以通过多种方式被氧化,如土壤溶液中的溶解氧、硝酸盐以及铁锰铝氧化物都可以作为碘化物的氧化剂。由于溶解氧在土壤中的浓度极低,二价锰具有强氧化性,所以二价锰可能是土壤中碘离子的氧化剂[58]. 二氧化锰(δ-MnO2、γ- MnO2、β- MnO2)可以将碘离子氧化为碘酸根,该反应在较低的pH下氧化的速度更快[64].
土壤中的微生物活性酶(漆酶和乳过氧化物酶)可以将碘离子催化氧化形成亲电性碘(I2和HIO),亲电性碘会与土壤有机质结合(图7),进而促进了碘离子在土壤中的吸附. 由微生物和高等植物产生的漆酶和乳过氧化物酶具有较强的氧化能力. 细菌和真菌除了可以通过细胞外过氧化物酶和氧化酶直接促进碘离子氧化,还能通过降低pH值间接促进碘离子氧化[65].
-
土壤中碘转化的生物代谢方式主要是指土壤中的微生物代谢,主要是在需氧条件下,中性至微碱性pH下发生的活性生物过程. 通过在实验室中培养细菌发现,碘化物在多次的富集培养中被氧化成I2,并且分离的细菌菌株中约一半可以显示出低水平的碘化物氧化活性[65]. 在美国萨凡纳河站点(SRS)上,已确定碘化物氧化发生在含水层沉积物中的细菌里,同样,从Hanford Site的129I地下水中分离出了还原碘酸盐的兼性厌氧菌[67].
碘化物可以被微生物直接吸收进入细胞生物质中,如图8所示,碘化物通过转运载体进入细菌参与转化或是被过氧化氢氧化为亲电形态的HIO,HIO通过亲电取代与细胞质外体中的有机配体产生作用,从而促进了有机碘库的形成;另外一种情况,HIO依赖ATP的转运载体被运输到细胞内,在那里它与有机配体反应转化为细胞内的有机碘或还原回碘离子,有机碘会在细胞质中积累或挥发至细胞外,而碘离子会在细胞体内积累[21, 68].
-
土壤中的碘能以气态的形式从土壤挥发至大气中. 生物作用和非生物作用都会产生挥发性碘,生物作用(微生物和植物)会释放气态甲基碘(CH3I),非生物作用通过氧化还原产生气态碘分子和碘化氢.
通过自身产生的酶,真菌和细菌可以将碘化合物转化成具有挥发性的有机碘化合物——甲基碘,这也是土壤中挥发的甲基碘来源之一[39, 69]. 通过添加抑制细菌生长的抗生素会对土壤中碘挥发产生明显的抑制作用,结果证实了生物作用会释放甲基碘[70]. 在Hanford Site的3个不同地点沉积物的碘甲基化和挥发,发现几乎所有添加了碘离子的沉积物中微生物都产生了甲基碘,同时学者发现甲基碘是在生物条件下产生的唯一碘化合物[71].
上文中讲到碘离子和碘酸根的氧化或还原产生的碘分子会与有机质结合形成有机碘化合物,保留在土壤中. 但在实验室培养中观察125I示踪剂在森林腐殖质中的动态研究中发现,土壤中的部分碘以气态的形式挥发到大气中[39]. Thiry等[72]构建了森林生态模型,发现有机质含量高的森林土壤中,碘与溶液和固相中的有机质络合会形成稳定碘,碘的挥发量减少. 碘在土壤中的挥发量与有机质密切相关.
-
水溶性碘(碘离子、碘酸根和可溶性有机碘)是土壤碘形态中最容易被植物根部吸收的部分,其量不超过土壤碘总量的10%,在某些情况下会低于0.6%[23, 73],森林中的植物根部从土壤中吸收的碘含量仅占土壤整个储存的0.2%[31].
植物根部从土壤中吸收碘元素,再从根部迁移到其他部位,迁移中碘的浓度是痕量的. 与碘酸根相比,植物根部对碘离子的吸收能力更强,这与碘离子的吸收途径较多有关,植物根部吸收碘的途径有共质体途径和质外体途径. 2019年,Humphrey等[74]通过在菠菜添加外源碘和代谢抑制剂(CCCP)研究碘在菠菜根部的吸收途径,如图9所示,总碘在质外体的含量高于共质体,可以证明碘在植物根部的吸收途径主要是质外体途径. 从图9a可见,在添加代谢抑制剂后质外体和共质体内的总碘含量均有降低趋势,碘离子在质外体的含量增加,在共质体的含量降低,证实碘离子可以进行主动运输(共质体途径).
土壤中相对较高比例的碘不能被植物根部吸收利用,因为它与HA和FA结合,或被带正电荷的铁铝氧化物吸附后固定在土壤中[75]. 通过向番茄植株根部添加无机碘(KI、KIO3)和小分子有机碘化合物去研究植物根部对于不同形态碘的吸收能力,发现小分子有机碘(5-ISA、2-IBeA、4-IBeA和2,3,5-triIBeA)在植物根部的积累要高于无机碘(图10). 这说明了土壤中可溶性有机碘是可以被植物根部吸收,且吸收效果普遍高于无机碘.
-
(1)受地理位置、土壤组成等因素影响,碘在土壤中的含量变化范围较大. 沿海地区、有机质和铁铝矿物含量高的土壤中碘含量较多. 土壤中测碘含量常用的方法是在添加提取剂TMAH溶液后,使用ICP-MS进行测量. 然而,目前对于土壤中碘的形态及测量的研究通常是指碘离子和碘酸根,其他形态的碘的详细、操作性强的测量方法尚待探讨.
(2)金属氧化物的存在会促进无机碘的吸附,带有正电荷的金属氧化物与带有负电荷的无机碘会相互吸引. 土壤有机质上的芳香环与由氧化还原反应产生的活性碘物种(I2和HIO)结合,生成有机碘.
(3)土壤中微生物数量巨大,成分复杂,土壤中的碘可以被微生物吸收利用,微生物产生的酶可以将无机碘氧化或还原为有机碘释放至大气. 微生物在碘的吸附转化过程中的作用机理较为复杂,有待进一步研究.
土壤中碘的吸附及转化等环境行为研究进展
A review of environmental behavior in the measurement, adsorption, and transformation of iodine in soil
-
摘要: 碘是一种非金属元素,也是人类健康必须的微量元素,缺碘和过量摄入碘都会对人体健康造成危害,了解土壤环境中碘的含量、形态及迁移转化对人体健康和评估碘的生物地球化学行为有重要意义. 本文介绍了土壤中碘的含量及其影响因素,包括地理位置、土壤的理化性质、有机质、铁锰铝氧化物等;总结了近几年土壤中碘的测量方法以及不同的前处理方式;讨论了碘在土壤中的吸附和转化等环境行为. 通过主成分分析双标图分析土壤理化性质与土壤吸附无机碘的相关性. 研究发现碘在土壤中的转化包括氧化还原、有机化、挥发、生物代谢及植物根部吸收,碘分子和低碘酸是氧化还原反应的中间产物,它们与有机质结合生成不同种类的有机碘;微生物和植物根部可以吸收土壤中的碘并在体内将其转化为有机碘.Abstract: Iodine is a non-metallic and necessary micronutrient for humans. Both iodine deficiency and excessive intake may have adverse effects on human health. Investigating the content, form, migration, and transformation of iodine in the soil environment is of great significance for human health and understanding the biogeochemical behavior of iodine. In this review, we introduced the content of iodine in soil and its influencing factors including geographical location, physical and chemical properties of soil, organic matter, iron, manganese and aluminum oxides, vegetation, and so on. The pretreatment and analysis methods of iodine in soil were summarized in recent years. The environmental behaviors such as the adsorption and transformation of iodine in soil were discussed. The correlation between soil's physiochemical properties and the adsorption behavior of inorganic iodine in soil was analyzed through the principal component analysis biplot. The transformation of iodine in soil includes redox reactions, organification, volatilization, biological metabolism, and plant root uptake. I2 and HIO have been identified as the intermediate products of redox reactions, which can combine with organic matter to form various kinds of organic iodine. Microbes and plant roots can take up iodine from the soil and convert it into organic forms.
-
Key words:
- iodine /
- soil /
- adsorption /
- transformation.
-

-
土壤类型
Soil type碘/(mg.kg−1)
Iodine土壤类型
Soil type碘/(mg.kg−1)
Iodine土壤类型
Soil type碘/(mg.kg−1)
Iodine红壤 7.06 暗棕壤 2.35 褐土 1.63 黄壤 5.56 草甸土 2.14 白浆土 1.62 砖红壤 4.78 栗钙土 2.08 水稻土 1.56 黑钙土 3.05 潮土 1.99 绵土 1.33 燥红土 2.64 沼泽土 1.91 棕漠土 1.20 黑土 2.57 灰钙土 1.80 碱土 1.17 盐土 2.46 黑垆土 1.67 灌淤土 1.07 表 2 土壤各部分碘的提取条件及占比[18, 22 − 23]
Table 2. Extraction conditions and proportion of iodine in each part of soil[18, 22 − 23]
碘组分
Iodine component提取剂
ExtractpH 温度/℃
Temperature占比/%
Proportion文献[22] 文献[23] 文献[18] 水溶态 H2O — 25 12.7 5.0—6.0 1.9—7.8 可交换态 1 mol·L−1 NH4Ac-HAc 7 25/20 7.8 4.0—17.0 0.1—4.4 碳酸盐结合态 1 mol·L−1 NH4Ac-HAc 5 25/20 4.3 4.0—5.0 1.1—6.6 矿物氧化物结合态 0.04 mol·L−1 NH2OH·HCl 3 80 37.5 16.0—18.0 23.7—75.9 胡敏酸结合态 5% TMAH 14 25 39.2 38.0—40.0 4.2—38.7 富里酸结合态 5% TMAH 14 25 11.0—17.0 3.4—15.5 残余碘 5% TMAH 14 90 6.8 — 2.2—26.4 注:TMAH:四甲基氢氧化铵溶液;—:未提及. Note: TMAH: Tetramethylammonium hydroxide; —:Not mentioned. 表 3 碘前处理和测量方法总结
Table 3. Summary of iodine pretreatment and measurement methods
样品
Sample分析物
Analyte样品制备
Sample preparation提取工艺
Extraction process测量仪器
Measuring instrument检出限
LOD文献
Reference土壤 植物 127I 烘干 与5% TMAH混合,90 ℃消解3 h ICP-MS 0.04—0.23 µg·L−1 [31] 土壤 127I 风干、筛分 采用Kesari等[32]的方法 紫外分光光度计 — [33] 土壤 127I 风干、均质、研磨 与5% TMAH溶液混合,20 ℃的干浴培养箱90 h ICP-MS 0.01 µg·L−1 [18] 土壤 植物 127I 土壤105 ℃烘干;
根、芽在65 ℃烘箱中干燥后研磨与10 mol·L−1 KOH溶液混合,烘箱干燥0.5 h后放入马弗炉;冷却后
10 mL水与H3PO4溶液(1:2,V/V)转移至容量烧瓶,向上清液中加入10 mL KI(1.0%)、5 mL溴水、
2 mL无色结晶紫,完成颜色反应紫外分光光度计 — [34] 土壤 植物 127I 土壤风干;植物在50 ℃下
干燥粉碎后 4 ℃保存样品与去离子水混合,向上清液中加1 mL 5% EDTA和0.5 mL溴水混合,再加入1 mL 0.1% KI溶液和
1 mL无色紫晶体溶液,进行显色紫外分光光度计 — [35] 土壤 植物 127I 干燥 研磨 样品与5 mL 5% TMAH混合,在消解系统中消解3 h, ICP-MS 0.02—0.08 µg·L−1 [36] 土壤 127I 103 ℃干燥4 h,研磨 在90 ℃下与去离子水、1 mL 25% TMAH混合3 h ICP-MS 0.032 µg·L−1 [37] 植物 127I 冻干、研磨 样品与10 mL 5% TMAH混合,
50 ℃水浴,离心、过滤ICP-MS — [38] 腐殖质 127I — 样品与10 mL 5% TMAH混合,放置在90 ℃沙浴或温控消化系统,之后稀释过滤 ICP-MS 0.07—0.89 µg·L−1 [39] 125I 超纯γ光谱仪 3.0 Bq 植物 127I 冷冻干燥,研磨,-20 ℃储存 用TMAH进行碱性提取碘 ICP-MS联用三重四极杆光谱仪(TQ ICP-MS) — [40] 土壤 127I 干燥,筛分 样品与水混合30 min,上清液中加入1 mL 5% EDTA和0.5 mL溴水混合,然后加入1 mL 0.1% KI和
1 mL无色紫晶体溶液,进行显色紫外分光光度计 — [41] 土壤 127I 风干,筛分,研磨 10% TMAH提取,离心后稀释到1% ICP-MS — [42] 水样 127I 0.22 μm注射过滤器 1% TMAH 单四极ICP-MS — 植物 127I 75 ℃下使用烘箱干燥,研磨后储存在塑料袋 1 mL 25% TMAH和10 mLH2O与样品在90 °C下混合3 h ICP-MS/MS — [43] 土壤 127I 风干,筛分2 mm 用HNO3分解消化 ICP-OES — [44] 125I ICP-MS 0.018 µg·kg−1 [45] 植物 127I −70 ℃、200 Pa冷冻干燥72 h 7 mL 67% HNO3和3 mL 30% H2O2与样品混合,在微波消解仪中消解 ICP-MS NG1 [7] 注:TMAH:四甲基氢氧化铵溶液;EDTA:乙二胺四乙酸;—:未提及.
Note: TMAH: Tetramethylammonium hydroxide; EDTA: Ethylene Diamine Tetraacetic Acid; —:Not mentioned. -
[1] ZIMMERMANN M B, GIZAK M, ABBOTT K, et al. Iodine deficiency in pregnant women in Europe[J]. The Lancet. Diabetes & Endocrinology, 2015, 3(9): 672-674. [2] 于汀汀, 马生凤, 王蕾, 等. 电感耦合等离子质谱同时测定地下水中的溴及碘 [J]. 矿物岩石地球化学通报: 2023, 42: 053. YU T T, MA S F, WANG L, et al. Simultaneous determination of bromine and iodine in underground water by inductively coupling plasma-mass spectrometry[J]. Bulletin of Mineralogy, Petrology and Geochemistry, 2023, 42: 053(in Chinese).
[3] IGN. Global scorecard of iodine nutrition in 2021 in the general population based on school-age children (SAC) [R]. IGN, Ottawa, Canada, 2021. [4] LAWSON P G, DAUM D, CZAUDERNA R, et al. Soil versus foliar iodine fertilization as a biofortification strategy for field-grown vegetables[J]. Frontiers in Plant Science, 2015, 6: 450. [5] SMOLEŃ S, SADY W. Influence of iodine form and application method on the effectiveness of iodine biofortification, nitrogen metabolism as well as the content of mineral nutrients and heavy metals in spinach plants (Spinacia oleracea L )[J]. Scientia Horticulturae, 2012, 143: 176-183. doi: 10.1016/j.scienta.2012.06.006 [6] CAKMAK I, PROM-U-THAI C, GUILHERME L R G, et al. Iodine biofortification of wheat, rice and maize through fertilizer strategy[J]. Plant and Soil, 2017, 418(1): 319-335. [7] DOBOSY P, ENDRÉDI A, SANDIL S, et al. Biofortification of potato and carrot with iodine by applying different soils and irrigation with iodine-containing water[J]. Frontiers in Plant Science, 2020, 11: 593047. doi: 10.3389/fpls.2020.593047 [8] KIFERLE C, ASCRIZZI R, MARTINELLI M, et al. Effect of Iodine treatments on Ocimum basilicum L : Biofortification, phenolics production and essential oil composition[J]. PLoS One, 2019, 14(12): e02266559. [9] HUMPHREY O S, YOUNG S D, BAILEY E H, et al. Iodine soil dynamics and methods of measurement: a review[J]. Environmental Science. Processes & Impacts, 2018, 20(2): 288-310. [10] FUGE R, JOHNSON C C. Iodine and human health, the role of environmental geochemistry and diet, a review[J]. Applied Geochemistry, 2015, 63: 282-302. doi: 10.1016/j.apgeochem.2015.09.013 [11] JOHNSON C C. Database of the iodine content of soils populated with data from published literature[J]. Keyworth, Nottingham British Geological Survey, 2003. [12] 马常莲, 周金龙, 曾妍妍, 等. 新疆若羌县农用地表层土壤硒氟碘地球化学特征[J]. 物探与化探, 2022, 46(6): 1573-1580. MA C L, ZHOU J L, ZENG Y Y, et al. Geochemical characteristics of selenium, fluorine, iodine in surface soil of the agricultural land in Ruoqiang County, Xinjiang[J]. Geophysical and Geochemical Exploration, 2022, 46(6): 1573-1580 (in Chinese).
[13] 中国环境监测总站. 中国土壤元素背景值[M]. 北京: 中国环境科学出版社, 1990. China National Environmental Monitoring Centre. Chinese soil element background value [M]. Beijing: China Environmental Science Press, 1990(in Chinese).
[14] ANDREWS S J, JONES C E, CARPENTER L J. Aircraft measurements of very short-lived halocarbons over the tropical Atlantic Ocean[J]. Geophysical Research Letters, 2013, 40(5): 1005-1010. doi: 10.1002/grl.50141 [15] WANG W, WANG X Q, ZHANG B M, et al. Spatial distribution of iodine in the pedosphere of China and its influencing factors[J]. Journal of Geochemical Exploration, 2023, 248: 107191. doi: 10.1016/j.gexplo.2023.107191 [16] 周红, 何欢, 肖蒙, 等. 云南省森林土壤腐殖质组分特征及影响因素[J]. 土壤学报, 2021, 58(4): 1008-1017. ZHOU H, HE H, XIAO M, et al. Composition of humus in forest soils of Yunnan Province, China and its influencing factors[J]. Acta Pedologica Sinica, 2021, 58(4): 1008-1017 (in Chinese).
[17] ROULIER M, COPPIN F, BUENO M, et al. Iodine budget in forest soils: Influence of environmental conditions and soil physicochemical properties[J]. Chemosphere, 2019, 224: 20-28. doi: 10.1016/j.chemosphere.2019.02.060 [18] DUBORSKÁ E, BUJDOŠ M, URÍK M, et al. Iodine fractionation in agricultural and forest soils using extraction methods[J]. CATENA, 2020, 195: 104749. doi: 10.1016/j.catena.2020.104749 [19] YAMADA H, KIRIYAMA T, ONAGAWA Y, et al. Speciation of iodine in soils[J]. Soil Science and Plant Nutrition, 1999, 45(3): 563-568. doi: 10.1080/00380768.1999.10415819 [20] LI J X, WANG Y X, GUO W, et al. Iodine mobilization in groundwater system at Datong Basin, China: Evidence from hydrochemistry and fluorescence characteristics[J]. Science of the Total Environment, 2014, 468-469: 738-745. doi: 10.1016/j.scitotenv.2013.08.092 [21] DUBORSKÁ E, MATULOVÁ M, VACULOVIČ T, et al. Iodine fractions in soil and their determination[J]. Forests, 2021, 12(11): 1512. doi: 10.3390/f12111512 [22] HOU X L, HANSEN V, ALDAHAN A, et al. A review on speciation of iodine-129 in the environmental and biological samples[J]. Analytica Chimica Acta, 2009, 632(2): 181-196. doi: 10.1016/j.aca.2008.11.013 [23] HANSEN V, ROOS P, ALDAHAN A, et al. Partition of iodine (129I and 127I) isotopes in soils and marine sediments[J]. Journal of Environmental Radioactivity, 2011, 102(12): 1096-1104. doi: 10.1016/j.jenvrad.2011.07.005 [24] 吴祎, 邓冬莉, 胡科, 等. 分光光度法测定食盐中的碘含量[J]. 轻工科技, 2018, 34(9): 18-19. WU Y, DENG D L, HU K, et al. Spectrophotometric determination of iodine content in table salt[J]. Light Industry Science and Technology, 2018, 34(9): 18-19 (in Chinese).
[25] 苏宇亮, 吴杰, 方黎, 等. 离子色谱-电感耦合等离子体质谱联用法同时分析水中碘酸根和碘离子[J]. 给水排水, 2008, 34(7): 29-31. SU Y L, WU J, FANG L, et al. Analysis of iodate and iodine ion in water by ion chromatography(IC) coupled with inductively coupled plasma mass spectrometry(ICP-MS)[J]. Water & Wastewater Engineering, 2008, 34(7): 29-31 (in Chinese).
[26] 刘崴, 曹蔚然, 胡俊栋, 等. 高效液相色谱-电感耦合等离子体质谱法测定紫菜中的碘形态[J]. 分析试验室, 2017, 36(9): 1028-1031. LIU W, CAO W R, HU J D, et al. Determination of iodine species in seaweed samples using high performance liquid chromatography-inductively coupled plasma mass spectrometry[J]. Chinese Journal of Analysis Laboratory, 2017, 36(9): 1028-1031 (in Chinese).
[27] 柴小丽, 高丹丹, 李海军, 等. ICP-AES测定微量碘进样装置的设计及应用[J]. 盐湖研究, 2021, 29(2): 94-101. CHAI X L, GAO D D, LI H J, et al. Design and application of sampling device for determination of trace iodine by ICP-AES[J]. Journal of Salt Lake Research, 2021, 29(2): 94-101 (in Chinese).
[28] TAKEDA A, TSUKADA H, TAKAHASHI M, et al. Changes in the chemical form of exogenous iodine in forest soils and their extracts[J]. Radiation Protection Dosimetry, 2015, 167(1/2/3): 181-186. [29] 赖阳巍. 电感耦合等离子体质谱法测定土壤中的总碘[J]. 土壤, 2018, 50(1): 221-224. LAI Y W. Determination of iodine in soil by inductively coupled plasma mass spectrometry[J]. Soils, 2018, 50(1): 221-224 (in Chinese).
[30] 徐长龙, 赵志飞, 宋娟娥. 电感耦合等离子体质谱法分析碘元素时的有机增敏效应及消除[J]. 环境化学, 2022, 41(1): 405-408. XU C L, ZHAO Z F, SONG J E. Organic sensitization effect and eliminate in determination of iodine by inductively coupled plasma mass spectrometry[J]. Environmental Chemistry, 2022, 41(1): 405-408 (in Chinese).
[31] ROULIER M, BUENO M, THIRY Y, et al. Iodine distribution and cycling in a beech (Fagus sylvatica) temperate forest[J]. Science of the Total Environment, 2018, 645: 431-440. doi: 10.1016/j.scitotenv.2018.07.039 [32] KESARI R, RASTOGI R, GUPTA V. A simple and sensitive spectrophotometric method for the determination of iodine in environmental samples[J]. Chemia Analityczna, 1998, 43: 201-207. [33] MOHIUDDIN M, HUSSAIN Z, ABBASI A, et al. Sawdust amendment in agricultural and pasture soils can reduce iodine losses[J]. Sustainability, 2022, 14(20): 13620. doi: 10.3390/su142013620 [34] FARIDULLAH F, SHABBIR H, IQBAL A, et al. Iodine supplementation through its biofortification in Brassica species depending on the type of soil[J]. Environmental Science and Pollution Research, 2023, 30(13): 37208-37218. [35] YAN T Y, FAROOQ A, MOHIUDDIN M, et al. Role of different organic and inorganic amendments in the biofortification of iodine in Coriandrum sativum crop[J]. Frontiers in Ecology and Evolution, 2023, 11: 1145979. doi: 10.3389/fevo.2023.1145979 [36] PISAREK P, BUENO M, THIRY Y, et al. Influence of tree species on selenium and iodine partitioning in an experimental forest ecosystem[J]. The Science of the Total Environment, 2022, 809: 151174. doi: 10.1016/j.scitotenv.2021.151174 [37] JENSEN H, ORTH B, REISER R, et al. Environmental parameters affecting the concentration of iodine in New Zealand pasture[J]. Journal of Environmental Quality, 2019, 48(5): 1517-1523. doi: 10.2134/jeq2019.03.0128 [38] OJOK J, OMARA P, OPOLOT E, et al. Iodine agronomic biofortification of cabbage (Brassica oleracea var. capitata) and cowpea (Vigna unguiculata L. ) is effective under farmer field conditions[J]. Agronomy, 2019, 9(12): 797. doi: 10.3390/agronomy9120797 [39] ROULIER M, CARASCO L, ORJOLLET D, et al. Iodine distribution and volatilization in contrasting forms of forest humus during a laboratory incubation experiment[J]. Journal of Environmental Radioactivity, 2022, 248: 106872. doi: 10.1016/j.jenvrad.2022.106872 [40] SMOLEŃ S, KOWALSKA I, SKOCZYLAS Ł, et al. Effectiveness of enriching lettuce with iodine using 5-iodosalicylic and 3, 5-diiodosalicylic acids and the chemical composition of plants depending on the type of soil in a pot experiment[J]. Food Chemistry, 2022, 382: 132347. doi: 10.1016/j.foodchem.2022.132347 [41] MOHIUDDIN M, ALI J, LETA M K, et al. Estimation of iodine leaching in soil amended with organic and inorganic materials using HYDRUS 1-D model[J]. Sustainability, 2021, 13(19): 10967. doi: 10.3390/su131910967 [42] AHMAD S, BAILEY E H, ARSHAD M, et al. Multiple geochemical factors may cause iodine and selenium deficiency in Gilgit-Baltistan, Pakistan[J]. Environmental Geochemistry and Health, 2021, 43(11): 4493-4513. doi: 10.1007/s10653-021-00936-9 [43] GRZANKA M, SMOLEŃ S, SKOCZYLAS Ł, et al. Biofortification of sweetcorn with iodine: Interaction of organic and inorganic forms of iodine combined with vanadium[J]. Agronomy, 2021, 11(9): 1720. doi: 10.3390/agronomy11091720 [44] SMOLEŃ S, LEDWOŻYW-SMOLEŃ I, SADY W. The role of exogenous humic and fulvic acids in iodine biofortification in spinach (Spinacia oleracea L. )[J]. Plant and Soil, 2016, 402(1): 129-143. [45] KÖHLER F, RIEBE B, SCHEINOST A C, et al. Sorption of iodine in soils: Insight from selective sequential extractions and X-ray absorption spectroscopy[J]. Environmental Science and Pollution Research, 2019, 26(23): 23850-23860. doi: 10.1007/s11356-019-05623-y [46] DAI J L, ZHANG M, HU Q H, et al. Adsorption and desorption of iodine by various Chinese soils: II. Iodide and iodate[J]. Geoderma, 2009, 153(1/2): 130-135. [47] SEKI M, OIKAWA J I, TAGUCHI T, et al. Laccase-catalyzed oxidation of iodide and formation of organically bound iodine in soils[J]. Environmental Science & Technology, 2013, 47(1): 390-397. [48] STEINBERG S M, KIMBLE G M, SCHMETT G T, et al. Abiotic reaction of iodate with sphagnum peat and other natural organic matter[J]. Journal of Radioanalytical and Nuclear Chemistry, 2008, 277(1): 185-191. doi: 10.1007/s10967-008-0728-1 [49] YEAGER C M, AMACHI S, GRANDBOIS R, et al. Microbial transformation of iodine: From radioisotopes to iodine deficiency[J]. Advances in Applied Microbiology, 2017, 101: 83-136. [50] BOWLEY H E, YOUNG S D, ANDER E L, et al. Iodine binding to humic acid[J]. Chemosphere, 2016, 157: 208-214. doi: 10.1016/j.chemosphere.2016.05.028 [51] DUBORSKÁ E, URÍK M, BUJDOŠ M, et al. Influence of physicochemical properties of various soil types on iodide and iodate sorption[J]. Chemosphere, 2019, 214: 168-175. doi: 10.1016/j.chemosphere.2018.09.041 [52] SZLAMKOWICZ I B, FENTRESS A J, LONGEN L F, et al. Transformations and speciation of iodine in the environment as a result of oxidation by manganese minerals[J]. ACS Earth and Space Chemistry, 2022, 6(8): 1948-1956. doi: 10.1021/acsearthspacechem.1c00372 [53] HONG C L, WENG H X, JILANI G, et al. Evaluation of iodide and iodate for adsorption-desorption characteristics and bioavailability in three types of soil[J]. Biological Trace Element Research, 2012, 146(2): 262-271. doi: 10.1007/s12011-011-9231-6 [54] JUNIOR E C D, WADT L H O, Da SILVA K E, et al. Geochemistry of selenium, Barium, and iodine in representative soils of the Brazilian Amazon rainforest[J]. The Science of the Total Environment, 2022, 828: 154426. doi: 10.1016/j.scitotenv.2022.154426 [55] 闫志雲, 曾妍妍, 周金龙, 等. 新疆喀什地区地下水碘的分布特征及成因分析[J]. 环境化学, 2022, 41(12): 4077-4086. doi: 10.7524/j.issn.0254-6108.2021081401 YAN Z Y, ZENG Y Y, ZHOU J L, et al. Distribution characteristics and cause analysis of iodine in groundwater in Kashi Prefecture, Xinjiang[J]. Environmental Chemistry, 2022, 41(12): 4077-4086 (in Chinese). doi: 10.7524/j.issn.0254-6108.2021081401
[56] 周殷竹, 孙英, 周金龙, 等. 新疆石河子地区地下水砷、碘分布规律及共富集因素分析[J]. 环境化学, 2021, 40(11): 3464-3473. doi: 10.7524/j.issn.0254-6108.2020070601 ZHOU Y Z, SUN Y, ZHOU J L, et al. Distribution and co-enrichment factors of arsenic and iodine in groundwater in the Shihezi area, Xinjiang[J]. Environmental Chemistry, 2021, 40(11): 3464-3473 (in Chinese). doi: 10.7524/j.issn.0254-6108.2020070601
[57] XU C, ZHANG S J, SUGIYAMA Y, et al. Role of natural organic matter on iodine and 239, 240Pu distribution and mobility in environmental samples from the northwestern Fukushima Prefecture, Japan[J]. Journal of Environmental Radioactivity, 2016, 153: 156-166. doi: 10.1016/j.jenvrad.2015.12.022 [58] COX E M, ARAI Y. Environmental chemistry and toxicology of iodine[J]. Advances in Agronomy. 2014, 128: 47-96. [59] LI D E, XU C, YEAGER C M, et al. Molecular interaction of aqueous iodine species with humic acid studied by I and C K-edge X-ray absorption spectroscopy[J]. Environmental Science & Technology, 2019, 53(21): 12416-12424. [60] NIHEI R, USAMI M, TAGUCHI T, et al. Role of fungal laccase in iodide oxidation in soils[J]. Journal of Environmental Radioactivity, 2018, 189: 127-134. doi: 10.1016/j.jenvrad.2018.03.016 [61] CHANG H S, XU C, SCHWEHR K A, et al. Model of radioiodine speciation and partitioning in organic-rich and organic-poor soils from the Savannah River Site[J]. Journal of Environmental Chemical Engineering, 2014, 2(3): 1321-1330. doi: 10.1016/j.jece.2014.03.009 [62] XU C, LIN P, GARIMELLA R, et al. 1H-13C heteronuclear single quantum coherence NMR evidence for iodination of natural organic matter influencing organo-iodine mobility in the environment[J]. The Science of the Total Environment, 2022, 814: 152546. doi: 10.1016/j.scitotenv.2021.152546 [63] HUMPHREY O S, YOUNG S D, CROUT N M J, et al. Short-term iodine dynamics in soil solution[J]. Environmental Science & Technology, 2020, 54(3): 1443-1450. [64] DU J S, KIM K, SON S, et al. MnO2-induced oxidation of iodide in frozen solution[J]. Environmental Science & Technology, 2023, 57(13): 5317-5326. [65] LI H P, YEAGER C M, BRINKMEYER R, et al. Bacterial production of organic acids enhances H2O2-dependent iodide oxidation[J]. Environmental Science & Technology, 2012, 46(9): 4837-4844. [66] LEE B D, ELLIS J T, DODWELL A, et al. Iodate and nitrate transformation by Agrobacterium/Rhizobium related strain DVZ35 isolated from contaminated Hanford groundwater[J]. Journal of Hazardous Materials, 2018, 350: 19-26. doi: 10.1016/j.jhazmat.2018.02.006 [67] NEEWAY J J, KAPLAN D I, BAGWELL C E, et al. A review of the behavior of radioiodine in the subsurface at two DOE sites[J]. The Science of the Total Environment, 2019, 691: 466-475. doi: 10.1016/j.scitotenv.2019.07.146 [68] JIANG Z, HUANG M H, JIANG Y G, et al. Microbial contributions to iodide enrichment in deep groundwater in the North China plain[J]. Environmental Science & Technology, 2023, 57(6): 2625-2635. [69] DUBORSKÁ E, URÍK M, BUJDOŠ M. Comparison of iodide and iodate accumulation and volatilization by filamentous fungi during static cultivation[J]. Water, Air, & Soil Pollution, 2017, 228(6): 225. [70] DUBORSKÁ E, BALÍKOVÁ K, MATULOVÁ M, et al. Production of methyl-iodide in the environment[J]. Frontiers in Microbiology, 2021, 12: 804081. doi: 10.3389/fmicb.2021.804081 [71] BAGWELL C E, ZHONG L R, WELLS J R, et al. Microbial methylation of iodide in unconfined aquifer sediments at the Hanford site, USA[J]. Frontiers in Microbiology, 2019, 10: 2460. doi: 10.3389/fmicb.2019.02460 [72] THIRY Y, TANAKA T, BUENO M, et al. Recycling and persistence of iodine 127 and 129 in forested environments: A modelling approach[J]. The Science of the Total Environment, 2022, 831: 154901. doi: 10.1016/j.scitotenv.2022.154901 [73] OTA M, TERADA H, HASEGAWA H, et al. Processes affecting land-surface dynamics of 129I impacted by atmospheric 129I releases from a spent nuclear fuel reprocessing plant[J]. The Science of the Total Environment, 2020, 704: 135319. doi: 10.1016/j.scitotenv.2019.135319 [74] HUMPHREY O S, YOUNG S D, BAILEY E H, et al. Iodine uptake, storage and translocation mechanisms in spinach (Spinacia oleracea L. )[J]. Environmental Geochemistry and Health, 2019, 41(5): 2145-2156. doi: 10.1007/s10653-019-00272-z [75] DOBOSY P, VETÉSI V, SANDIL S, et al. Effect of irrigation water containing iodine on plant physiological processes and elemental concentrations of cabbage (Brassica oleracea L. var.capitata L. ) and tomato (Solanum lycopersicum L. ) cultivated in different soils[J]. Agronomy, 2020, 10(5): 720. doi: 10.3390/agronomy10050720 [76] HALKA M, SMOLEŃ S, CZERNICKA M, et al. Iodine biofortification through expression of HMT, SAMT and S3H genes in Solanum lycopersicum L[J]. Plant Physiology and Biochemistry:PPB, 2019, 144: 35-48. doi: 10.1016/j.plaphy.2019.09.028 [77] HALKA M, KLIMEK-CHODACKA M, SMOLEŃ S, et al. Organic iodine supply affects tomato plants differently than inorganic iodine[J]. Physiologia Plantarum, 2018, 164(3): 290-306. doi: 10.1111/ppl.12733 -




 下载:
下载: