-
目前,含氮废水的主要处理工艺是生物硝化反硝化,这种传统生物脱氮技术需要大量的氧气和碳源,能耗高,同时还产生大量的CO2和NOx,加剧了温室效应. 随着“碳达峰、碳中和”战略目标的实施,该技术与新形势下的环保政策不相适应,需要研究和开发可持续发展的脱氮工艺,其中氨氮回收是一种最可取的方法,在废水处理的同时可实现废弃物资源化.
水凝胶是由亲水性聚合物交联形成的三维网络结构[1]. 由于其交联网络和亲水性聚合物组分之间有很大的自由空间,水凝胶的吸水能力很强,可以吸收比其自身质量高出数百到数千倍的水,同时水凝胶本身不溶于水[2,3]. 在吸水过程中,水凝胶可以通过络合、共价键、静电相互作用甚至物理黏附来吸附污染物(主要是阳离子污染物). 因此,其再生容易,不需要大量的化学再生剂[4].
丙烯酸由于其丰富的乙烯基、羧基和羟基等官能团,具有快速聚合的特点被广泛用于合成水凝胶吸附剂. 海藻酸钠(SA)是由β-D-甘露糖醛酸(β-D-mannuronic,M)和α-L-古洛糖醛酸(α-L-guluronic,G)以不同比例通过 1—4个链接组成的一种阴离子、天然可生物降解和可再生的聚合物. 现已广泛在各种商业和工业中应用,例如化妆品、食品和重金属吸附剂. Huang等[5]制备了海藻酸钠-g-丙烯酸钠/凹凸棒土(NaAlg-g-PNaA/APT)复合水凝胶用作吸附剂,吸附废水溶液中的Cu2+和Zn2+,其最大吸附容量分别为343.64 mg·g−1和307.46 mg·g−1. Sabaa等[6]合成了海藻酸盐和聚甲基丙烯酸2-羟乙酯物理水凝胶对碱性染料和重金属离子表现出优异的去除能力.
无机纳米粒子具有制孔效果,能增加水凝胶的比表面积和孔隙,从而增加吸附容量. 纳米二氧化钛(TiO2NPs)因其成本低、毒性低、长期热力学稳定性和较好的制孔性能被广泛应用于有机废水处理[7 − 8]. 然而,TiO2纳米粒子在水中容易团聚且难以回收,从而极大地限制了其实际应用[9 − 10]. 因此,有学者开始研究将 TiO2NPs固定在不同的载体上,例如活化碳、石墨烯、玻璃、聚合物和碳纳米管等[11 − 13]. 现阶段研究主要存在一些局限性,如TiO2与载体的结合力差、相容性低、缺乏柔韧性等,且载体容易破损. 为此,将水凝胶作为纳米粒子的载体开始受到关注[14 − 16].
纳米粒子复合水凝胶目前主要用于重金属离子的吸附. 通过调节pH、盐度和温度等操作条件,可以增强水凝胶与金属离子之间的相互作用强度[17 − 20]. Wu等[21]制备的海藻酸盐/聚丙烯酰胺/二氧化钛复合水凝胶对甲基橙、亚甲基蓝均有一定吸附效果. Moon等[22]采用自由基聚合和缩合反应制备了聚乙烯醇/丙烯酸/TiO2/氧化石墨烯纳米复合水凝胶,利用其TiO2 NPs制孔效果提高了处理碱性废水的处理效果.
目前关于纳米二氧化钛复合水凝胶对废水中铵的吸附研究较少,本研究通过丙烯酸接枝海藻酸钠,以过硫酸钾和二氧化钛作为引发剂合成PAA/SA@TiO2水凝胶并应用于含氮废水中氨氮的回收. 通过对PAA/SA@TiO2水凝胶的结构、官能团、化学键等特性分析,研究其对氨氮的吸附性能和吸附机理,在探索氨氮回收和资源化利用的基础上,为含氮废水处理提供新的方法和思路.
-
纳米二氧化钛(TiO2,20 nm)购自Aldrich默克公司、丙烯酸(AA,99%)、N,N'-亚甲基双丙烯酰胺(MBA,≥99%)、海藻酸钠(SA,≥99%)、过硫酸钾(KPS、GR,≥99.0%)、盐酸(HCl、AR、 37%)、氢氧化钠(NaOH、AR、颗粒、≥98.5%)、氯化铵(NH4Cl、AR,≥99%)、氯化钠(NaCl、AR、≥99%),所有化学品均为分析纯,均购置于国药集团化学试剂有限公司(沪试).
-
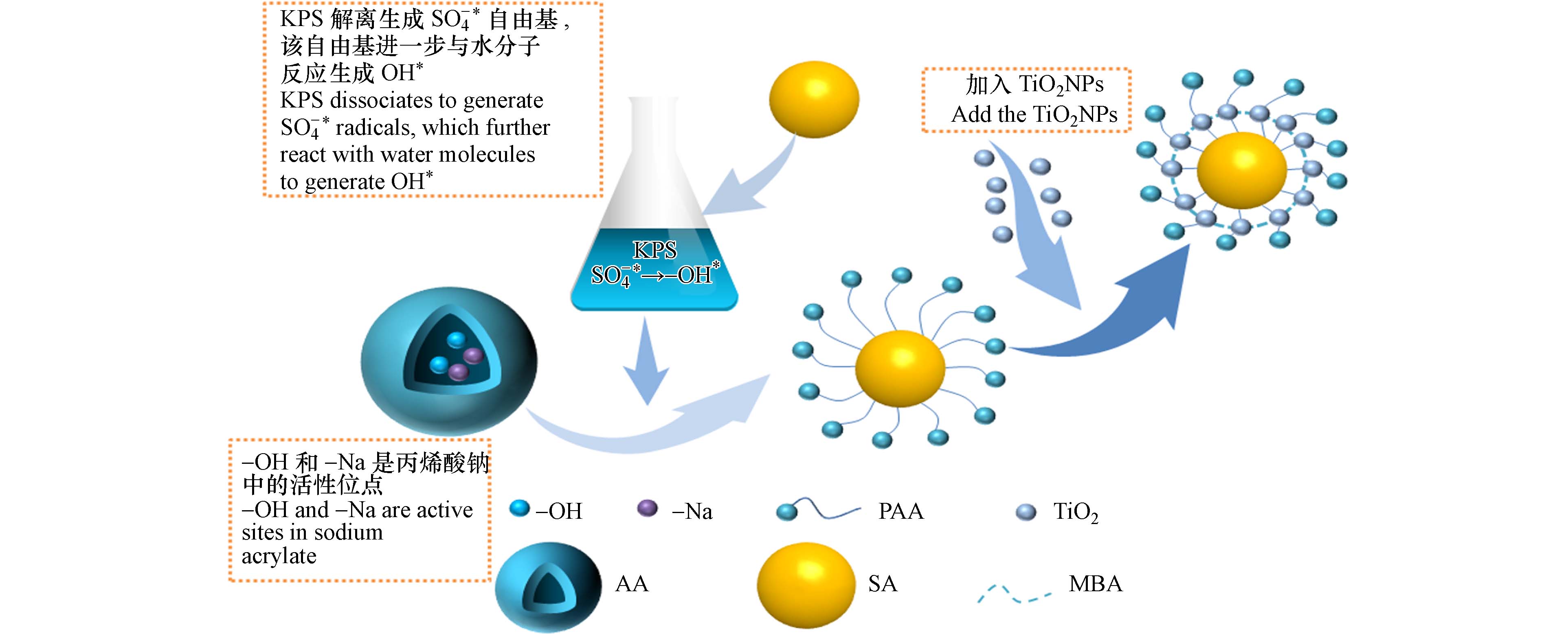
聚丙烯酸/海藻酸钠基纳米二氧化钛(PAA/SA@TiO2)复合水凝胶采用共聚法,在超声恒温70 ℃振荡下均匀聚合形成复合水凝胶. 具体制备过程如图1. 过硫酸钾产生的羟基自由基存在条件下加入丙烯酸(AA),形成丙烯酸长链,再加入N'-N亚甲基双丙烯酰胺待完全溶解后加入TiO2分散体. TiO2分散体是将TiO2粉末分散到一定量蒸馏水中,超声处理2 h得到. 在70 ℃恒温水浴锅中加热4 h,使混合物聚合完成形成凝胶. 将得到的水凝胶在 1 mol·L−1 NaOH 中浸泡2 h后用蒸馏水洗涤凝胶表面杂质. 最后,在105 ℃恒温干燥箱中烘干至达到恒定重量,并储存起来备用(图2a). 同时还制备了丙烯酸/海藻酸钠水凝胶PAA/SA(图2b)作为对照. 图2形貌对比可知,PAA/SA表面光滑、结构紧密,而PAA/SA@TiO2表面含有大量的孔洞,且更加疏松,其原因是TiO2 NPs具有制孔效果增大了水凝胶表面和内部空间的孔隙.
-
吸附容量(q,mg·g−1)和吸附效率(R,%)反映了吸附性能. 其计算方法如下:
式中,C0为吸附前NH4+的浓度, mg·L−1;Ct为吸附后溶液中剩余NH4+离子浓度, mg·L−1; V 为NH4+离子溶液体积,L;m为水凝胶样品干重质量,g.
-
配制初始氨氮浓度分别为100、200、300 mg·L−1的氨氮溶液100 mL,用0.1 mol·L−1稀盐酸或稀氢氧化钠溶液逐滴加入氨氮溶液,将其pH调节至7. 称取一定量的PAA/SA@TiO2样品投入上述溶液中. 在恒温振荡箱中以200 r·min−1振荡一定时间. 根据吸附前后氨氮浓度计算吸附容量和吸附速率.
-
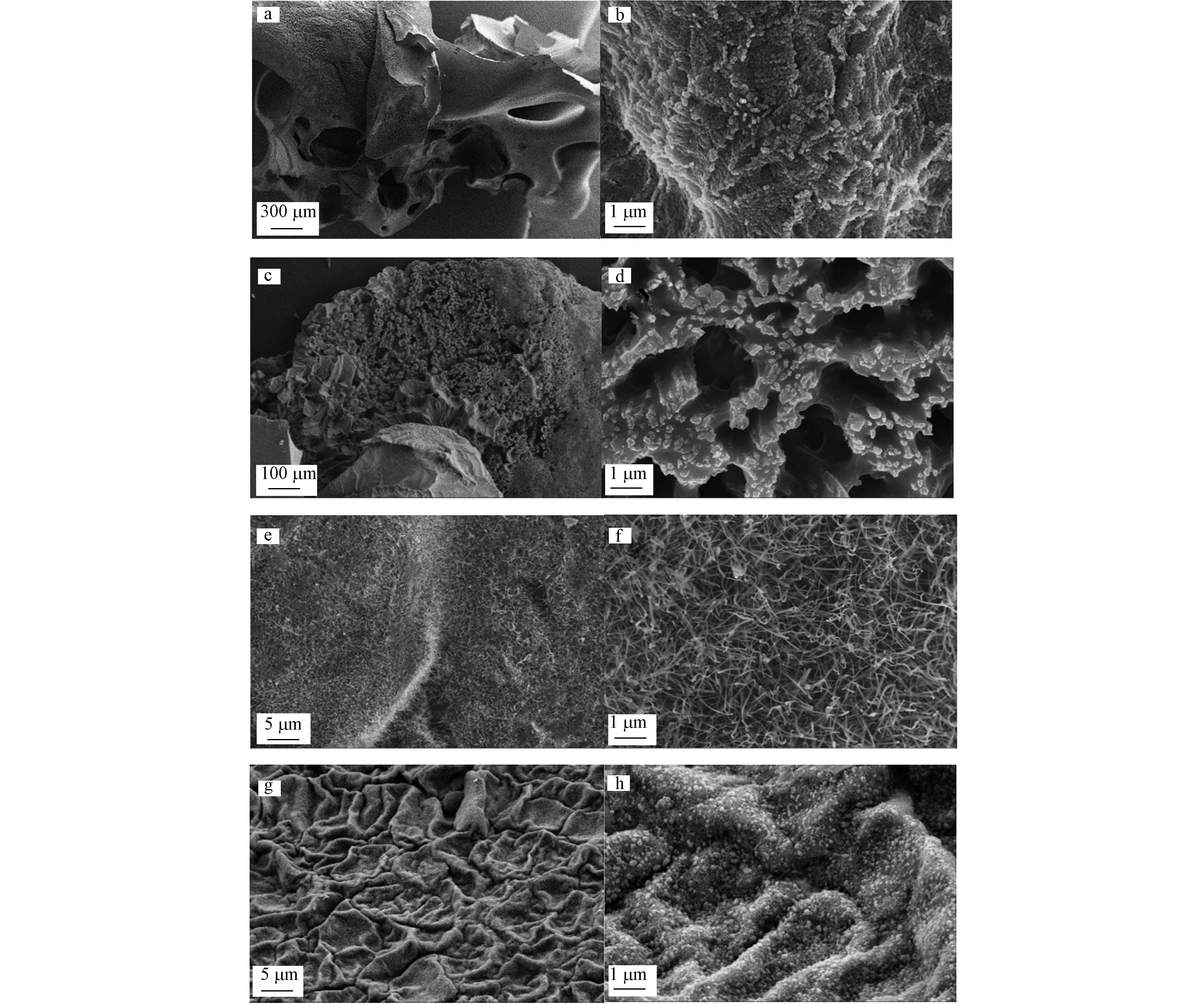
从PAA/SA水凝胶吸附前SEM形貌图3(a)(b)可见,吸附前制备的水凝胶表面含有多孔结构且放大倍数后看到含有大量颗粒和孔隙,增大了其接触面积,存在大量的吸附点位,可以增强NH4+的吸附. 吸附氨氮后图3(c)发现,PAA/SA水凝胶表面出现疏松多孔状,推测是由于吸水膨胀后增大了其体积,而放大后图3(d)发现,PAA/SA水凝胶内部出现大量白色颗粒,证明氨氮被吸附进PAA/SA内部. 图3(e)(f)发现,添加TiO2后复合水凝胶出现大量絮状物,其表面变得更粗糙,表明吸附点位增加. 但氨氮吸附后图3(g)(h)显示,絮状物消失且表面出现大量的白色颗粒,证明氨氮被成功吸附.
-
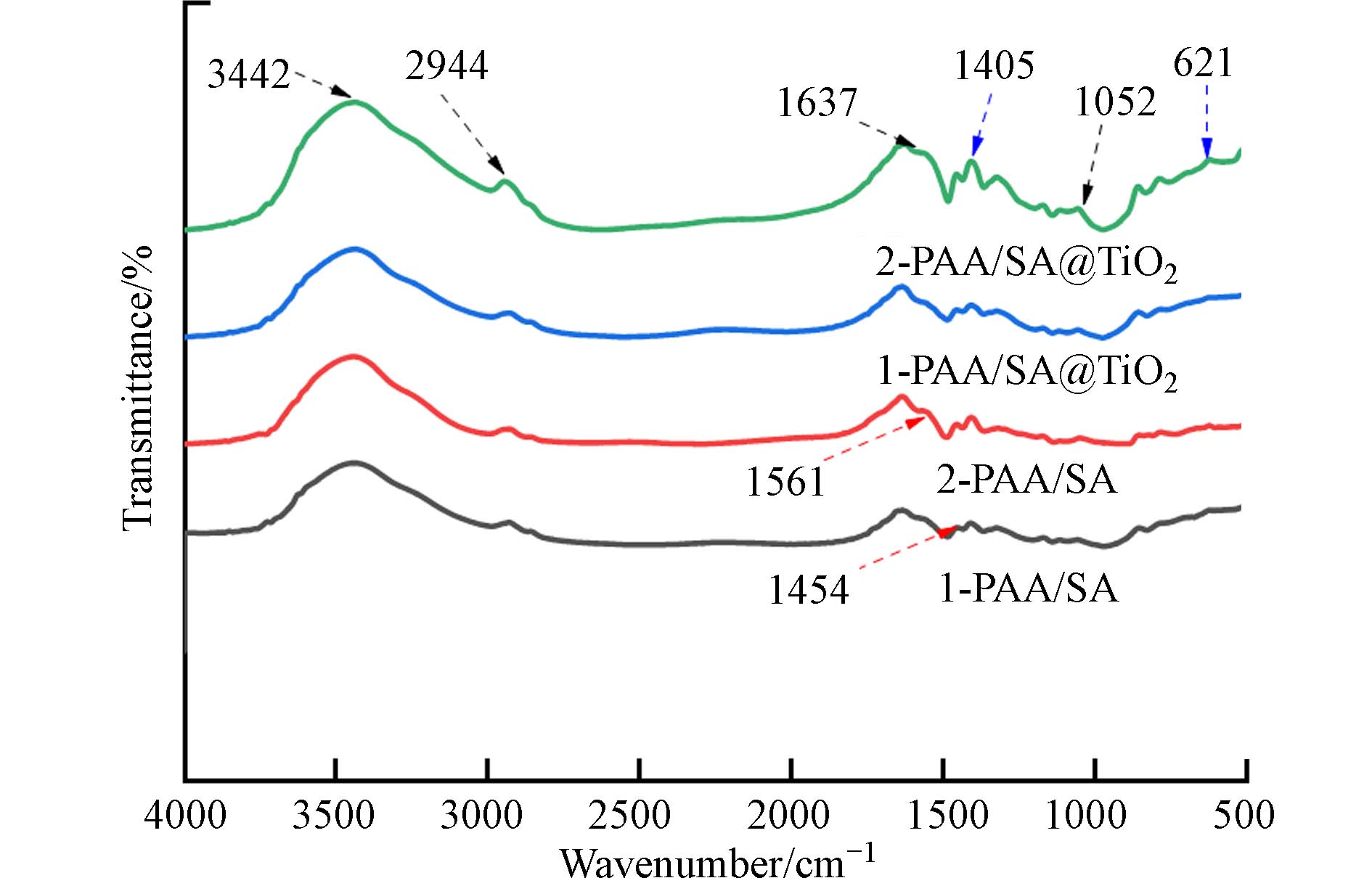
吸附前后PAA/SA和PAA/SA@TiO2复合水凝胶FTIR表征分析结果如图4所示. 波长3442 cm−1表示—OH基团的伸缩, 2944 cm−1处的峰表示CH2基团的C—H伸缩. 1561 cm−1分别属于反对称伸缩缝,1637 cm−1伸缩振动证明存在C=O,1052 cm−1属于C—O伸缩缝归因于SA的糖结构. 621 cm−1和1405 cm−1分别是Ti—O和Ti—O—Ti的特征峰. 吸附后的光谱图在1452 cm−1处振动峰增大,其对应—NH2的弯曲振动,这说明 NH4+被成功吸附.
-
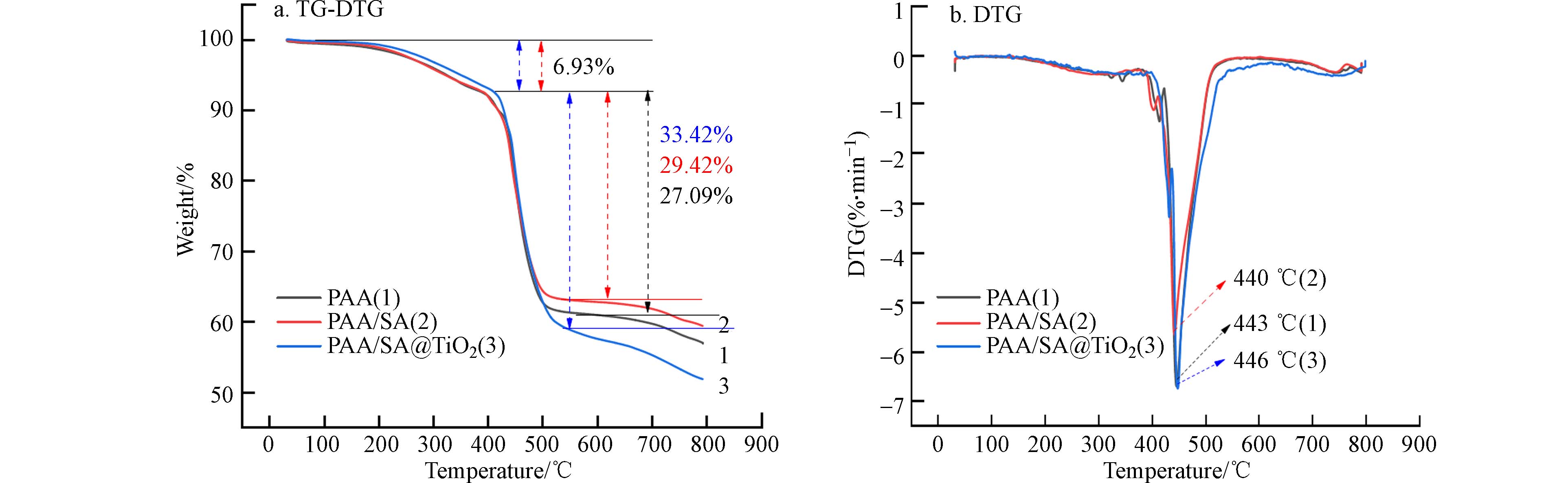
利用TG-DTG曲线分析PAA/SA/TiO2复合水凝胶的热稳定性,如图5a所示,在常温到150 ℃条件下,PAA、PAA/SA和PAA/SA/TiO2水凝胶热重发生小幅度下降,归因于三者水凝胶均易吸潮,样品中残留水分子的蒸发. PAA/SA/TiO2复合水凝胶热损失主要分为3个阶段. 第一阶段在150—410 ℃,PAA/SA和PAA/SA/TiO2热损失量为6.93%,这可归因于复合水凝胶中N’N-亚甲基双丙烯酰胺的分解和基质中少量的过硫酸钾引发剂蒸发. 第二阶段在410—540 ℃,此阶段PAA、PAA/SA和PAA/SA/TiO2三者均发生快速下降,热损失为27.09%、29.42%和33.42%,其原因为3种水凝胶主链在此温度下均发生断裂降解,羟基和羧基发生热分解,而SA和TiO2纳米粒子均发生热分解,导致复合的PAA/SA/TiO2热损失量更大. 第三阶段540 ℃以后,热损失仍在持续进行,推测主要为残留的支链发生热解. 当热解温度为800 ℃时,PAA/SA/TiO2热损失率为48%. 通过DTG曲线(图5b)可发现,PAA、PAA/SA和PAA/SA/TiO2在440—450 ℃时热降解最快,其中PAA/SA/TiO2复合水凝胶在446 ℃热解最快,其原因为主链发生断裂降解,羟基和羧基发生热分解,验证了上述第二阶段的结论. 通过热重分析可看出复合后的PAA/SA和PAA/SA/TiO2水凝胶热损失量增加但其失重率仍在50%以内,同样具有良好的热稳定性.
-
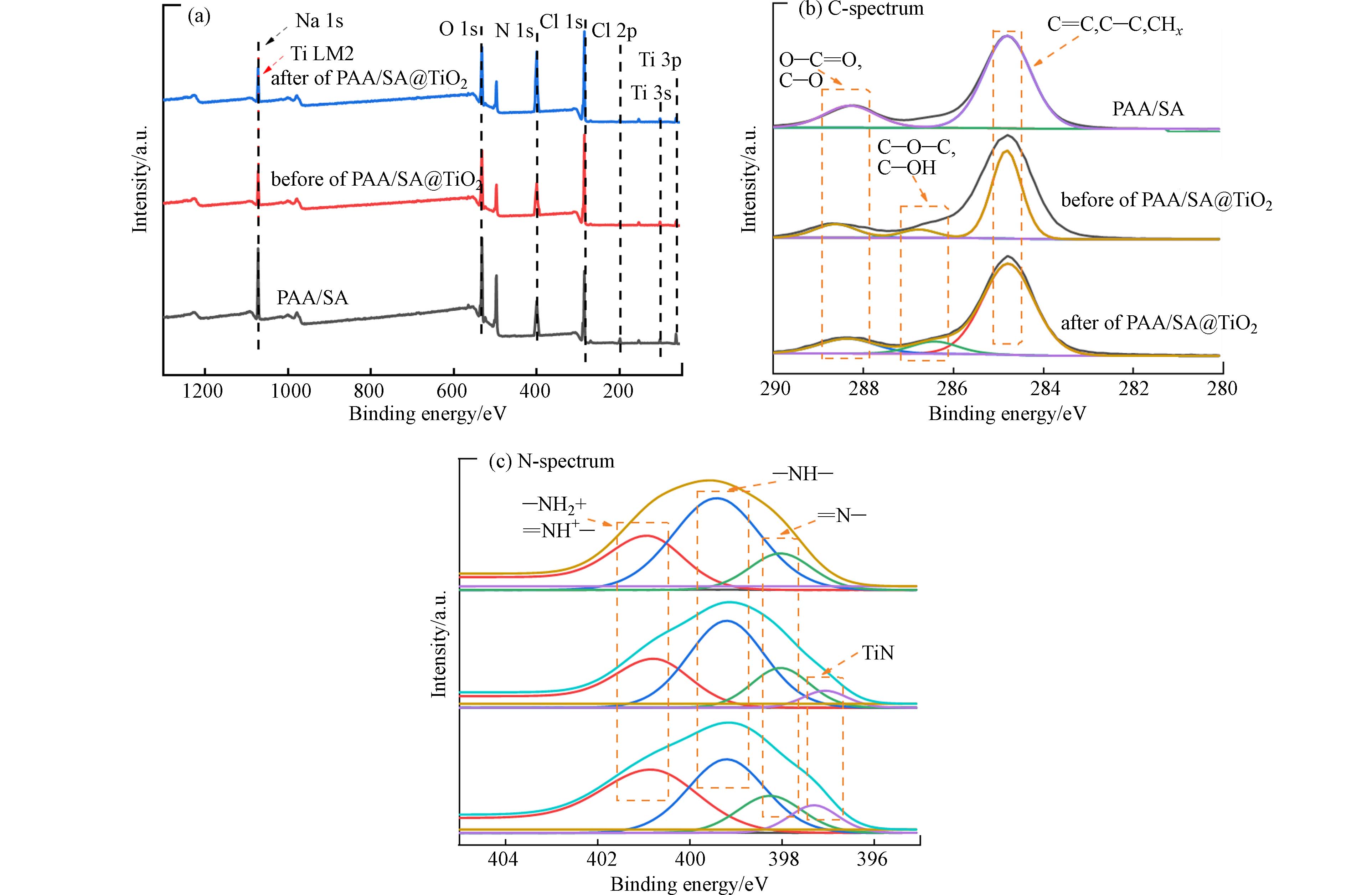
通过XPS研究了复合水凝胶吸附NH4+前后的元素化合状态,结果如图6a所示. PAA/SA和PAA/SA@TiO2都呈现出5个结合能峰:Cl2p(198.08 eV)、C1s (284.36 eV)、N1s (399.83 eV) 、O1s (531.13 eV)、Na1s(1071.11 eV). PAA/SA@TiO2光谱出现了Ti 3s(100.08 eV)和Ti 3p(62.08 eV)证明TiO2被成功复合进PAA/SA@TiO2水凝胶. 当吸附NH4+离子后,N1s处的峰出现上升,N含量增加,表明NH4+被成功吸附进复合水凝胶内. 通过对C、N、O分峰拟合得到结合能信息如图6b、c所示,图6b中在284.8 eV处出现结合能峰,归因于C=C和C—C,在285.63 eV处出现的特征峰是归因于AA和SA羧基中的C—OH,而288.85 eV的结合能峰是MBA中的C=O和AA羧基官能团的O—C=O. 图6c中, N1s的分峰在401、399、398 eV处出现了—NH2+、仲氨基(—NH—)和亚胺(=N—),在397.08 eV处出现的结合峰归因于TiN,在吸附完成后—NH2+出现上升,表明NH4+被吸附到PAA/SA@TiO2中. 以上数据表明PAA/SA@TiO2制备成功且对NH4+具有一定吸附效果.
-
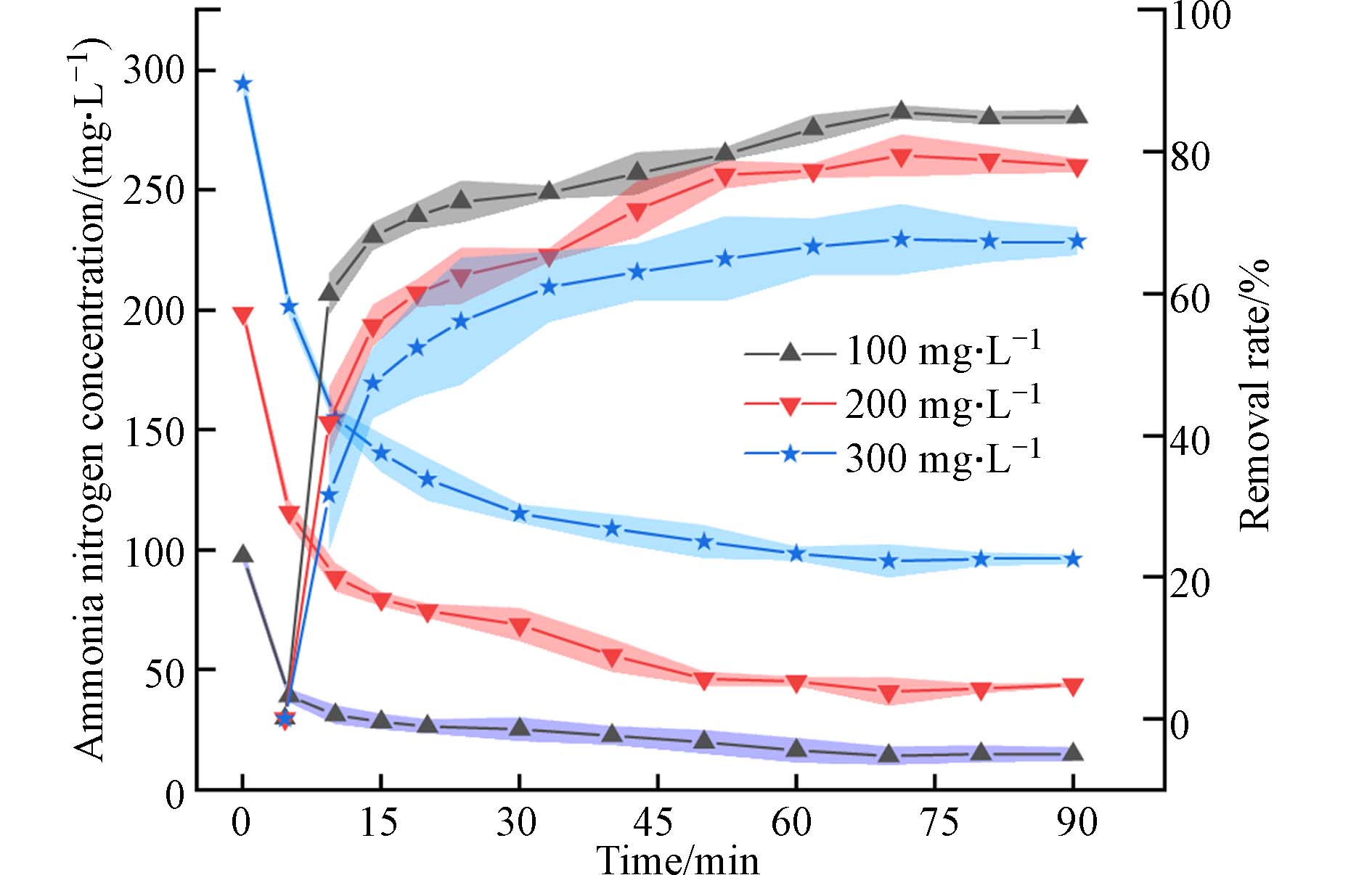
为探究该PAA/SA@TiO2吸附氨氮的最佳时间,模拟进水氨氮浓度为100、200、300 mg·L−1,用稀HCl和NaOH调节pH为7,在0、5、10、20、30、45、60、70、80、90 min分别取样检测剩余氨氮浓度,计算水凝胶吸附氨氮效率. 如图7所示,在前30 min水凝胶吸附速率很快,在50 min接近吸附峰值,70 min后达到吸附饱和状态. 最终初始浓度为100、200、300 mg·L−1的氨氮溶液去除率稳定在85.56%、79.46%、67.63%,确定PAA/SA@TiO2最佳吸附时间为70 min.
-
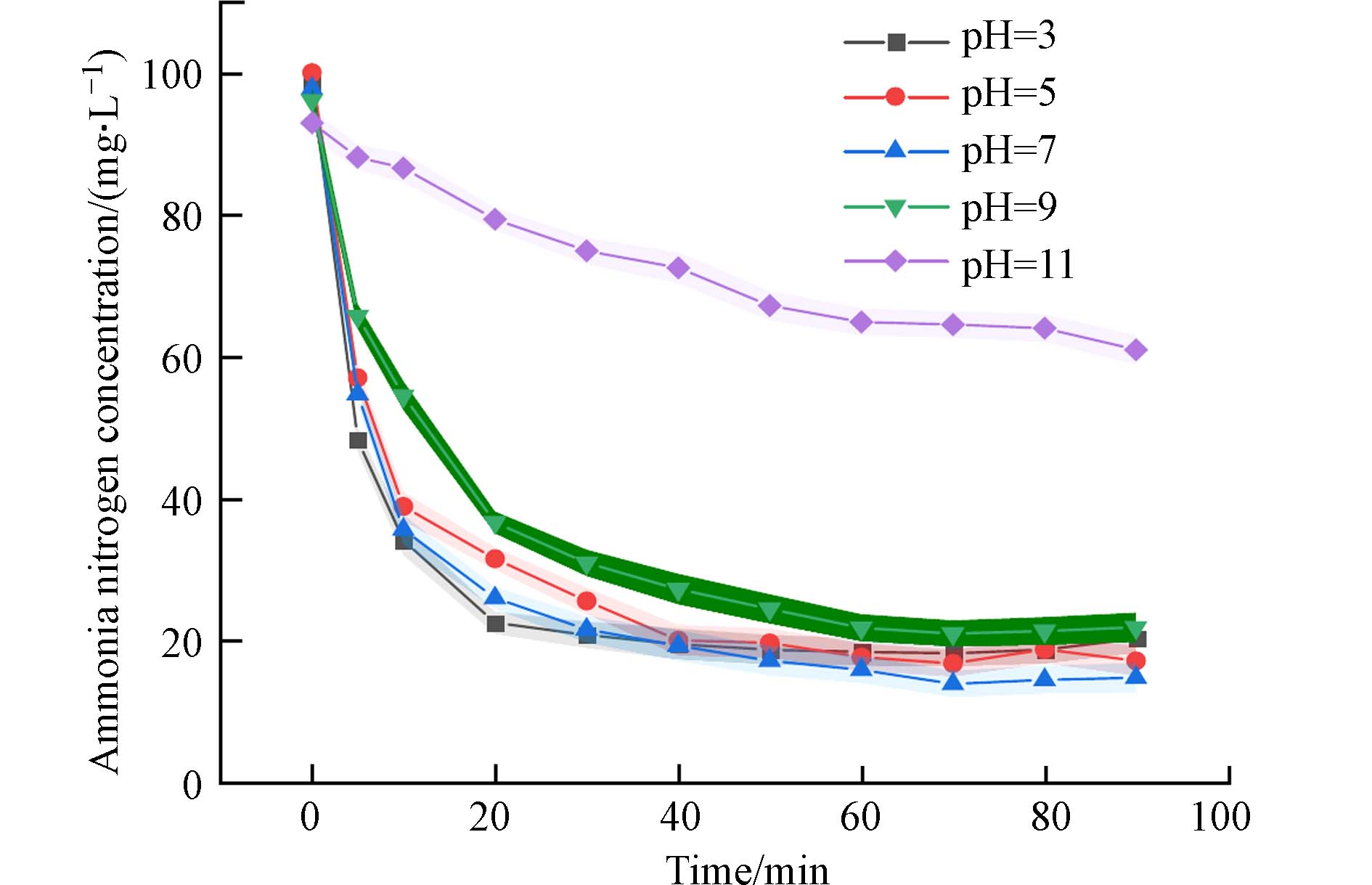
图8为NH4+浓度为100 mg·L−1,不同pH,吸附时间为90 min时的氨氮浓度变化情况. 实验发现,当 pH=7时,剩余氨氮浓度最低. pH<7时剩余氨氮浓度变化不大. 在pH>7时,氨氮浓度升高,推测是在碱性介质中,产生的 ·OH 自由基与底物自由基反应,影响链式反应,破坏水凝胶内部结构. pH=11时剩余氨氮浓度仅下降40%,氨氮去除效率降至最低,说明PAA/SA@TiO2复合水凝胶适合应用于酸性和中性条件下.
-
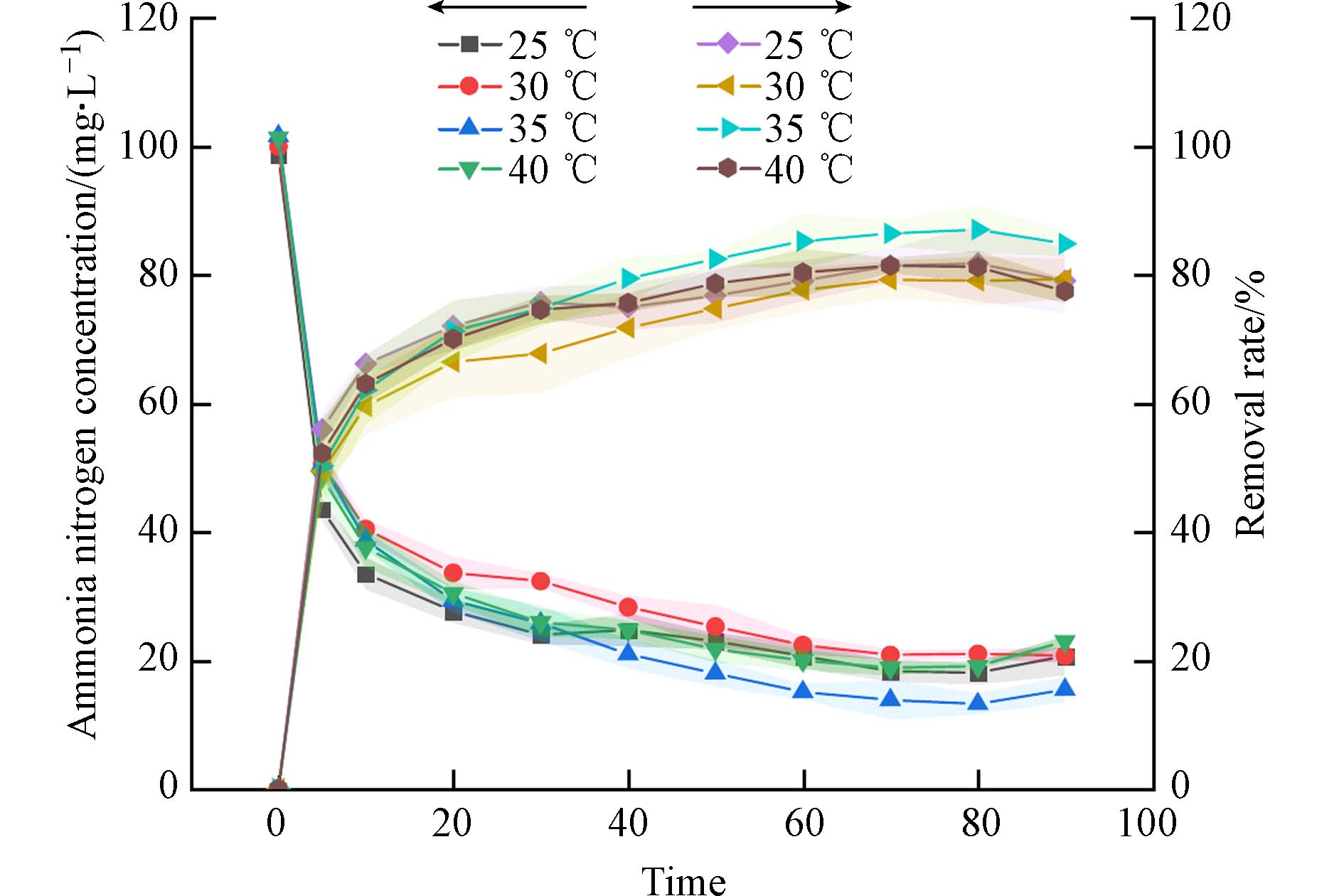
取适量PAA/SA@TiO2置于 50 mL 100 mg·L−1 NH4+溶液中,温度选择室温25 ℃开始. 在25、30、35、40 ℃温度下进行吸附实验,探究温度对水凝胶吸附NH4+的影响,结果见图9. 从图9可见,35 ℃时吸附效果越好,说明PAA/SA@TiO2复合水凝胶在常温状态下吸附是一个吸热的过程. 当温度升高到40 ℃,PAA/SA@TiO2吸附效率降低,可能是因为吸附剂内部的孔体积在高温下发生溶胀作用,破坏部分氢键,导致部分吸附的NH4+在高温下解吸进入溶液中.
-
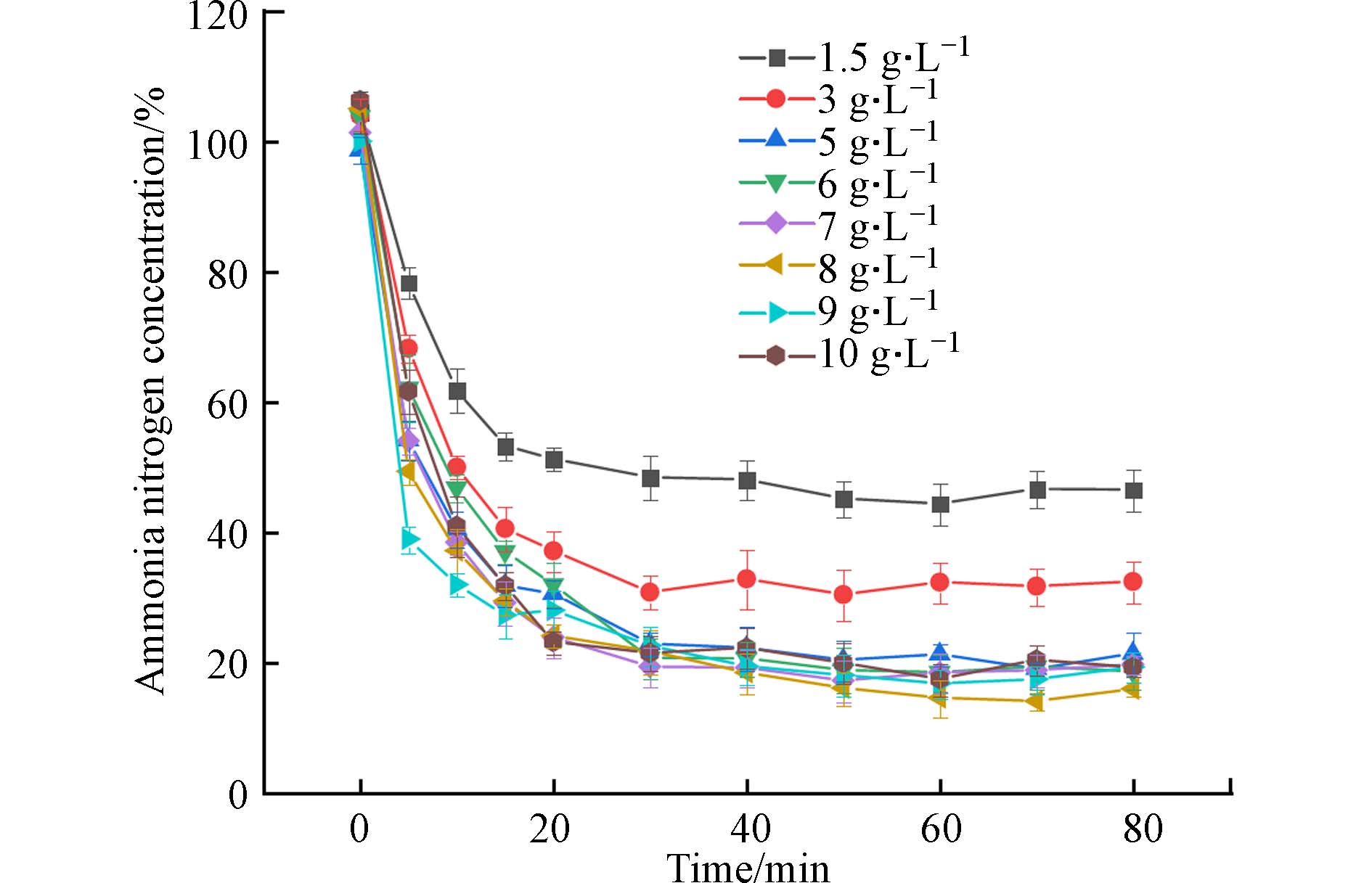
图10所示,在 100 mL NH4+溶液中,随着吸附剂剂量从1.5 g·L−1增加到10 g·L−1,NH4+的吸收从53.5% 增加到81.8%,之后,去除率没有显著变化. 随着剂量的增加,氨氮去除率的增加是由于吸附表面积增加导致PAA/SA@TiO2水凝胶上产生更多可用的吸附位点. 投加量从6 g·L−1增加到10 g·L−1氨氮去除率没有发现明显变化,考虑到资源节约的环保理念,确定最佳投加量为6 g·L−1.
-
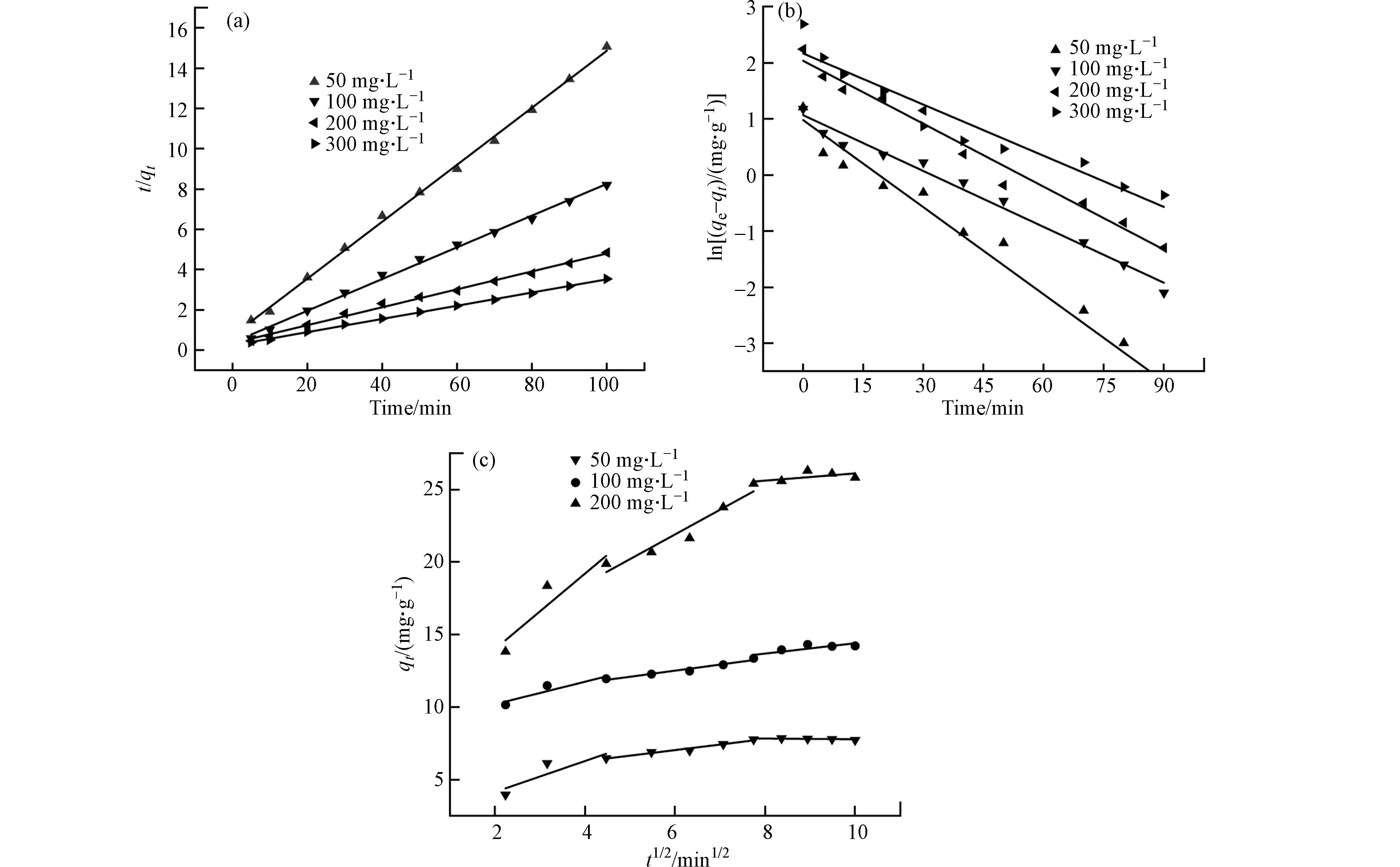
为研究吸附速率,进行动力学研究并减小实验误差,确定初始浓度为50、100、200、300 mg·L−1, pH=7条件下进行动力学实验,得到拟一级和拟二级动力学模型曲线和参数. 图11表示了不同NH4+初始浓度下PAA/SA@TiO2复合水凝胶对NH4+吸附的拟一级动力学方程和拟二级动力学方程,拟合的相关结果参数如表1和表2所示.
从表1、2和图11可以看到,拟一级和拟二级动力学方程对吸附曲线实验数据拟合良好. 在NH4+初始浓度为50、100、200、300 mg·L−1的吸附实验组中,拟二级动力学线性相关系数(R2)大于拟一级动力学方程,且拟二级动力学方程所拟合得到的理论平衡吸附量更加接近PAA/SA@TiO2复合水凝胶对NH4+的实际平衡吸附量,这说明PAA水凝胶吸附NH4+过程更加符合拟二级动力学模型,即吸附控制步骤是一个化学过程.
另一方面,动力学模型方程的吸附速率常数K和NH4+初始浓度没有线性相关性,这说明离子交换和物理吸附参与了吸附过程. K值的意义是指整个吸附平衡达到特殊百分比吸附阶段的速率,即 K值越大意味着能越快达到吸附平衡. 由表1可知, NH4+初始浓度为50 mg·L−1时,吸附速率常数 K最大,即水凝胶对NH4+的吸附能最快的达到吸附平衡.
此外,为了进一步阐明PAA/SA@TiO2水凝胶在吸附NH4+过程吸附机理,对实验数据进行了颗粒内扩散模型的拟合. 如图11(c)和表3所示,第一阶段的吸附反应速率很快,主要在边界层扩散作用下,NH4+通过液膜迁移到PAA/SA@TiO2水凝胶外表面,表现为吸附剂的外表面吸附. 第二阶段反映吸附质扩散到颗粒内部或吸附剂内表面. 第三阶段为吸附平衡阶段. 随着吸附时间的延长,液相主体中的氨氮浓度越来越小,最终吸附达到平衡. 在不同浓度条件下的内扩散图由多段直线构成,均未经过零点,说明该吸附过程膜扩散和孔隙扩散共同参与.
-
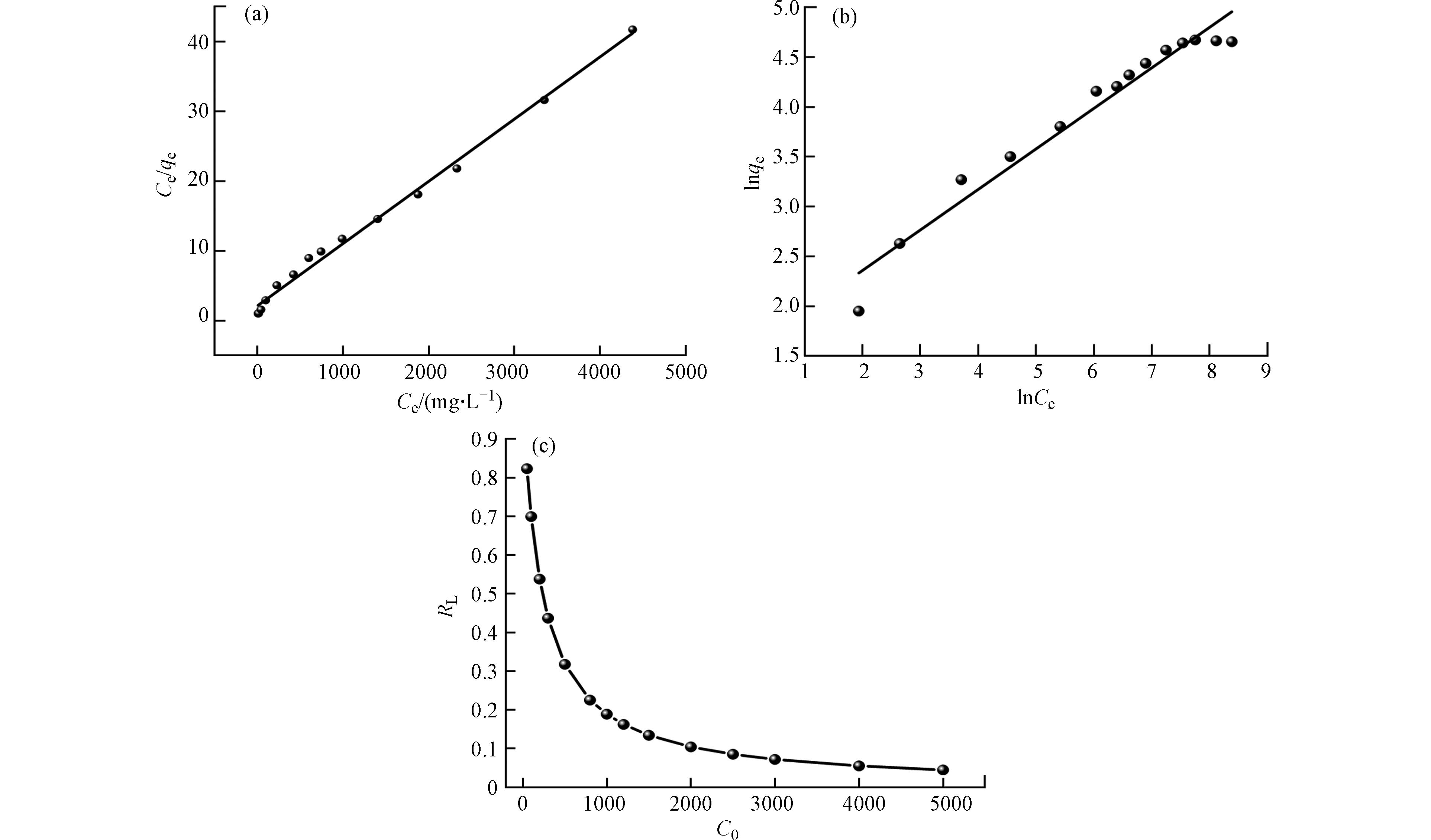
为了清楚了解吸附容量与平衡浓度的关系,采用 Langmuir 和 Freundlich 等温线模型对实验数据进行拟合. 水凝胶对NH4+吸附等温线模型和相关参数分别如图12所示. 通过对比分析可知 Langmuir 模型的相关系数(R2=0.994)高于 Freundlich(R2=0.956),且 Langmuir 模型拟合得到的NH4+的理论最大吸附量(112.11 mg·g−1)与实验得到的最大吸附量(112.92 mg·g−1)接近. 结果表明水凝胶对NH4+的吸附过程更符合 Langmuir 等温线模型,吸附过程符合单分子层吸附且表面活性位点均匀.
不同浓度下得到的1/n值均小于1,表明吸附剂对金属离子的吸附过程良好有利. 分离因子(RL)反应吸附NH4+的容易程度. 实验考察了在 25 ℃时初始浓度(50—5000 mg·L−1)对分离因子的影响,从图12(c)可知,RL的范围从0.823到0.044(0<RL<1),表明NH4+与PAA/SA@TiO2复合水凝胶的亲和力较大.
-
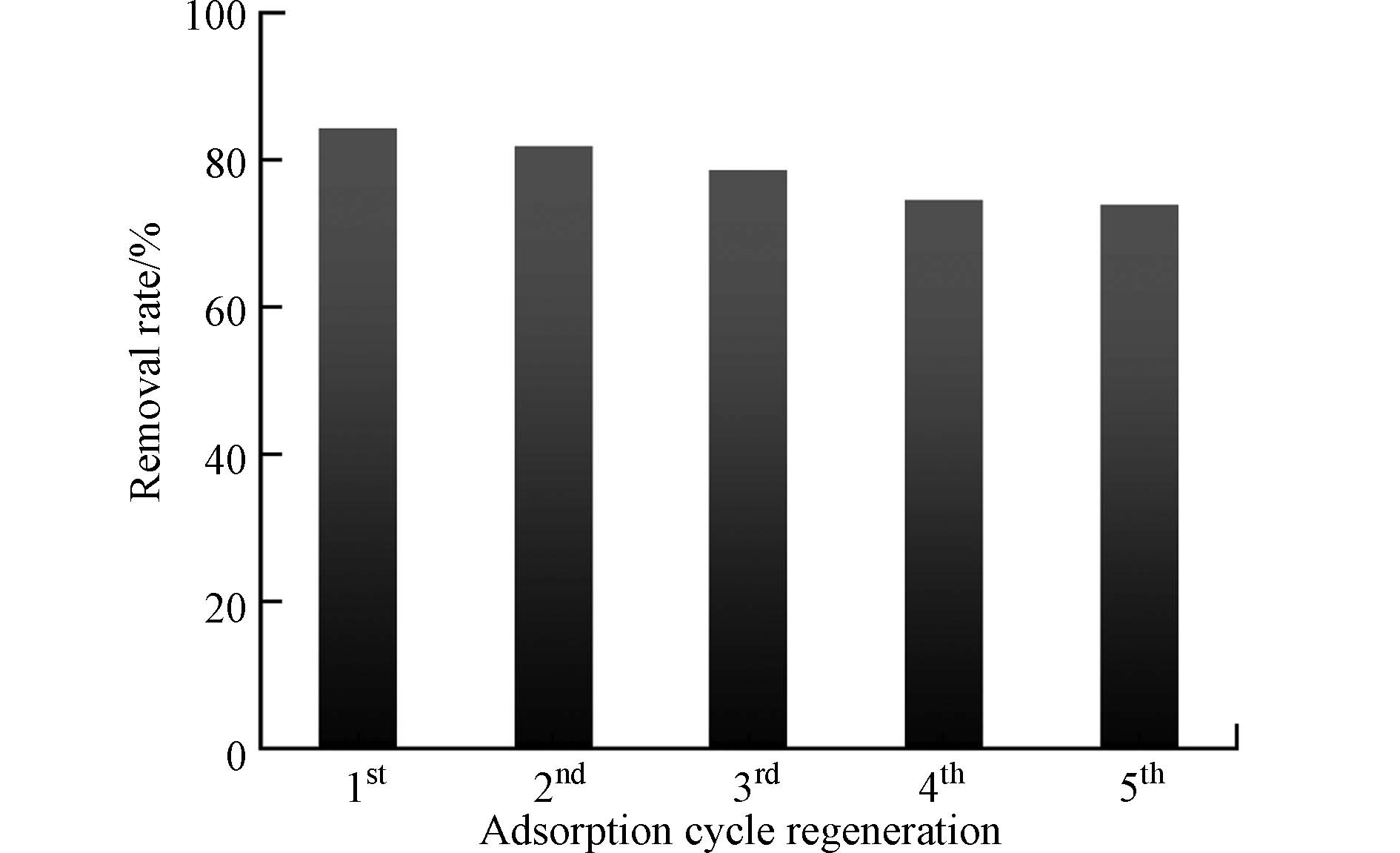
从经济和资源型的角度出发,吸附剂的可回收性和重复使用性至关重要. 将吸附后的水凝胶在0.5 mol·L−1的稀盐酸溶液中进行酸洗脱附1 h,再投入进0.5 mol·L−1的氢氧化钠溶液中2 h进行再生,用蒸馏水多次洗净表面的酸碱溶液,最后放入105 ℃烘箱烘干备用.
再生实验结果如图13所示,经过 5 次循环重复使用实验,PAA/SA@TiO2复合水凝胶吸附效率从首次84.5%下降到74%左右,吸附效率仅下降约10%. 出现略微下降是因为在脱附剂中,NH4+不能被完全解吸,占据了一定的吸附位点. 但整体的下降趋势不显著,说明该水凝胶具有较高的稳定性. 吸附剂经过解吸和干燥后,能够可循环使用,因此其在处理废水方面具有潜在的应用前景.
-
(1)采用自由基聚合法成功合成了应用于含氮废水处理的聚丙烯酸/海藻酸钠基纳米二氧化钛(PAA/SA@TiO2)复合水凝胶. 在pH=7,温度为35 ℃,吸附剂用量为6 g·L−1,吸附平衡时间为70 min的最佳吸附条件下,初始氨氮浓度分别为100、200、300 mg·L−1时,氨氮的去除率分别稳定在85.56 %、79.46 %、67.63 %. PAA/SA@TiO2复合水凝胶的最大吸附容量为112.92 mg·g−1.
(2)SEM表明PAA/SA@TiO2复合水凝胶表面均匀稳定,含有大量孔隙且孔径较大,吸附点位多,吸附容量大. 热重分析表明PAA/SA/TiO2复合水凝胶在446 ℃时开始热解,在800 ℃时热损失率为48%,证明该复合水凝胶具有良好的热稳定性.
(3)PAA/SA@TiO2复合水凝胶对氨氮的吸附类型属于单层吸附. 吸附动力学模型为拟二级动力学模型的化学吸附. 颗粒内扩散模型表明,该吸附主要是膜扩散和孔扩散. 复合水凝胶经过5次循环吸附再生后,吸附效率仅下降了约10 %,运行稳定性良好.
聚丙烯酸/海藻酸钠基纳米二氧化钛(PAA/SA@TiO2)复合水凝胶对氨氮的吸附性能
Study on the adsorbing performance of ammonia nitrogen by polyacrylic acid-grafted sodium alginate-based titanium dioxide (PAA/SA@TiO2)composite hydrogel
-
摘要: 聚丙烯酸/海藻酸钠基纳米二氧化钛(PAA/SA@TiO2)复合水凝胶对氨氮具有良好的吸附效果,其最佳吸附条件为:pH=7,温度35 ℃,吸附剂用量6 g·L−1,吸附平衡时间70 min,当初始氨氮浓度分别为100、200、300 mg·L−1时,吸附效率分别为85.56%、79.46%、67.63%. 该吸附过程符合Langmuir模型的单层吸附,吸附动力学模型属于拟二级动力学模型的化学吸附. 热重分析(TG)表明,PAA/SA@TiO2复合水凝胶在446 ℃主链断裂降解,羟基和羧基发生热分解,在800 ℃时热损失率为48%. PAA/SA@TiO2复合水凝胶结构稳定,经过5次循环吸附再生后,吸附效率仅下降约10%. 研究结果表明PAA/SA@TiO2复合水凝胶在含氮废水处理领域具有较好的应用前景,本研究为水凝胶应用于含氮废水处理提供理论依据和运行参数.Abstract: The polyacrylic acid-grafted sodium alginate-based titanium dioxide (PAA/SA@TiO2)composite hydrogel showed excellent adsorption performance for ammonia nitrogen. The optimal adsorption conditions is pH=7, T=35°C, adsorbent dosage 6 g·L−1 and adsorption equilibrium time of 70 minutes. At that time, the adsorption efficiencies were 85.56%, 79.46% and 67.63% for initial ammonia nitrogen concentrations of 100, 200 and 300 mg·L−1, respectively. The adsorption process is the Langmuir model of monolayer adsorption, and the adsorption kinetics belongs to the pseudo-second-order kinetics model of chemical adsorption. Thermal gravimetric analysis (TGA) showed that the main chain, hydroxyl and carboxyl groups, of PAA/SA@TiO2 composite hydrogel began disrupting and degrading at 446 ℃ with thermal loss rate of 48% at 800 ℃. The PAA/SA@TiO2 composite hydrogel possessed a stable structure, and the adsorption efficiency only decreased by approximately 10% after 5 cycles of adsorption and regeneration. The research indicated that the PAA/SA@TiO2 composite hydrogel had great potential in the nitrogen-containing wastewater treatment. The results provided theoretical basis and operational parameters for the application of hydrogels.
-
Key words:
- composite hydrogel /
- ammonia nitrogen /
- adsorption mechanism /
- performance characterization /
- recycling.
-

-
表 1 不同初始浓度下PAA/SA@TiO2水凝胶吸附的拟一级动力学参数
Table 1. PAA/ SA@TiO2 at different initial concentrations pseudo first order kinetic parameters of hydrogel adsorption
C0/(mg·L−1) qe1,exp/(mg·g−1) qe1,cal/(mg·g−1) K1/min−1 R2 50 7.04 6.66 0.12 0.961 100 13.87 12.90 0.08 0.982 200 26.30 25.65 0.09 0.975 300 33.17 29.72 0.07 0.919 表 2 不同初始浓度下PAA/SA@TiO2水凝胶吸附的拟二级动力学参数
Table 2. PAA/ SA@TiO2 at different initial concentrations pseudo second order kinetic parameters of hydrogel adsorption
C0/(mg·L−1) Qe2,cal/(mg·g−1) K2/min−1 R2 50 7.042 0.028 0.998 100 13.658 0.017 0.996 200 26.222 0.006 0.995 300 33.103 0.005 0.999 表 3 不同初始浓度下颗粒内扩散模型
Table 3. Intraparticle diffusion models under different initial concentrations
C0 C1 Kid1/(mg·g−1·min−1/2) R12 C2 Kid2/(mg·g−1·min−1/2) R22 C3 Kid3/(mg·g−1·min−1/2) R32 50 2.016 1.067 0.544 4.741 0.383 0.955 8.011 −0.024 −0.049 100 8.653 0.775 0.746 9.998 0.419 0.946 10.829 0.357 0.569 200 8.792 2.602 0.728 11.689 1.703 0.911 23.639 0.247 0.156 -
[1] LIAO W Q, ZHAO M H, RONG H W, et al. Photocatalyst immobilized by hydrogel, efficient degradation and self regeneration: A review[J]. Materials Science in Semiconductor Processing, 2022, 150: 106929. doi: 10.1016/j.mssp.2022.106929 [2] KANAKARAJU D, ANAK KUTIANG F D, LIM Y C, et al. Recent progress of Ag/TiO2 photocatalyst for wastewater treatment: Doping, co-doping, and green materials functionalization[J]. Applied Materials Today, 2022, 27: 101500. doi: 10.1016/j.apmt.2022.101500 [3] BARANOWSKA-WÓJCIK E, SZWAJGIER D, OLESZCZUK P, et al. Effects of titanium dioxide nanoparticles exposure on human health—A review[J]. Biological Trace Element Research, 2020, 193(1): 118-129. doi: 10.1007/s12011-019-01706-6 [4] KUMAR N, CHAUHAN N S, MITTAL A, et al. TiO2 and its composites as promising biomaterials: A review[J]. BioMetals, 2018, 31(2): 147-159. doi: 10.1007/s10534-018-0078-6 [5] HUANG D J, WANG W B, WANG A Q. Removal of Cu2+ and Zn2+ ions from aqueous solution using sodium alginate and attapulgite composite hydrogels[J]. Adsorption Science & Technology, 2013, 31(7): 611-623. [6] SABAA M W, ALI A M, SOLIMAN S M A. Physical hydrogel based on alginate and poly(2-hydroxyethyl methacrylate) for water treatment[J]. Desalination and Water Treatment, 2020, 174: 152-160. doi: 10.5004/dwt.2020.24841 [7] NUR A S M, SULTANA M, MONDAL A, et al. A review on the development of elemental and codoped TiO2 photocatalysts for enhanced dye degradation under UV-vis irradiation[J]. Journal of Water Process Engineering, 2022, 47: 102728. doi: 10.1016/j.jwpe.2022.102728 [8] ZHAO Y, LINGHU X Y, SHU Y, et al. Classification and catalytic mechanisms of heterojunction photocatalysts and the application of titanium dioxide (TiO2)-based heterojunctions in environmental remediation[J]. Journal of Environmental Chemical Engineering, 2022, 10(3): 108077. doi: 10.1016/j.jece.2022.108077 [9] RACOVITA A D. Titanium dioxide: Structure, impact, and toxicity[J]. International Journal of Environmental Research and Public Health, 2022, 19(9): 5681. doi: 10.3390/ijerph19095681 [10] WANG J Q, WANG Z H, WANG W, et al. Synthesis, modification and application of titanium dioxide nanoparticles: A review[J]. Nanoscale, 2022, 14(18): 6709-6734. doi: 10.1039/D1NR08349J [11] ALHAJI M H, SANAULLAH K, KHAN A, et al. Recent developments in immobilizing titanium dioxide on supports for degradation of organic pollutants in wastewater- A review[J]. International Journal of Environmental Science and Technology, 2017, 14(9): 2039-2052. doi: 10.1007/s13762-017-1349-4 [12] KUVAREGA A T, MAMBA B B. TiO2-based photocatalysis: toward visible light-responsive photocatalysts through doping and fabrication of carbon-based nanocomposites[J]. Critical Reviews in Solid State and Materials Sciences, 2017, 42(4): 295-346. doi: 10.1080/10408436.2016.1211507 [13] LI PUMA G, BONO A, KRISHNAIAH D, et al. Preparation of titanium dioxide photocatalyst loaded onto activated carbon support using chemical vapor deposition: A review paper[J]. Journal of Hazardous Materials, 2008, 157(2/3): 209-219. [14] ZHU H J, LI Z K, YANG J H. A novel composite hydrogel for adsorption and photocatalytic degradation of bisphenol A by visible light irradiation[J]. Chemical Engineering Journal, 2018, 334: 1679-1690. doi: 10.1016/j.cej.2017.11.148 [15] ZHAO S, HOU C X, SHAO L R, et al. Adsorption and in situ photocatalytic synergy degradation of 2, 4-dichlorophenol by three-dimensional graphene hydrogel modified with highly dispersed TiO2 nanoparticles[J]. Applied Surface Science, 2022, 590: 153088. doi: 10.1016/j.apsusc.2022.153088 [16] RATSHIEDANA R, KUVAREGA A T, MISHRA A K. Titanium dioxide and graphitic carbon nitride-based nanocomposites and nanofibres for the degradation of organic pollutants in water: A review[J]. Environmental Science and Pollution Research International, 2021, 28(9): 10357-10374. doi: 10.1007/s11356-020-11987-3 [17] DRAGAN E S. Design and applications of interpenetrating polymer network hydrogels. A review[J]. Chemical Engineering Journal, 2014, 243: 572-590. doi: 10.1016/j.cej.2014.01.065 [18] BUWALDA S J, BOERE K W M, DIJKSTRA P J, et al. Hydrogels in a historical perspective: From simple networks to smart materials[J]. Journal of Controlled Release, 2014, 190: 254-273. doi: 10.1016/j.jconrel.2014.03.052 [19] ZHAO Y, SHI C, YANG X D, et al. pH- and temperature-sensitive hydrogel nanoparticles with dual photoluminescence for bioprobes[J]. ACS Nano, 2016, 10(6): 5856-5863. doi: 10.1021/acsnano.6b00770 [20] JU X J, ZHANG S B, ZHOU M Y, et al. Novel heavy-metal adsorption material: Ion-recognition P(NIPAM-co-BCAm) hydrogels for removal of lead(II) ions[J]. Journal of Hazardous Materials, 2009, 167(1/2/3): 114-118. [21] WU T M, SAWUT A, SIMAYI R, et al. Green synthesis and environmental applications of alginate/polyacrylamide/titanium dioxide composite hydrogel[J]. Journal of Applied Polymer Science, 2023, 140(37): e54394. doi: 10.1002/app.54394 [22] MOON Y E, JUNG G, YUN J M, et al. Poly(vinyl alcohol)/poly(acrylic acid)/TiO2/graphene oxide nanocomposite hydrogels for pH-sensitive photocatalytic degradation of organic pollutants[J]. Materials Science and Engineering:B, 2013, 178(17): 1097-1103. doi: 10.1016/j.mseb.2013.07.002 -



 下载:
下载: