-
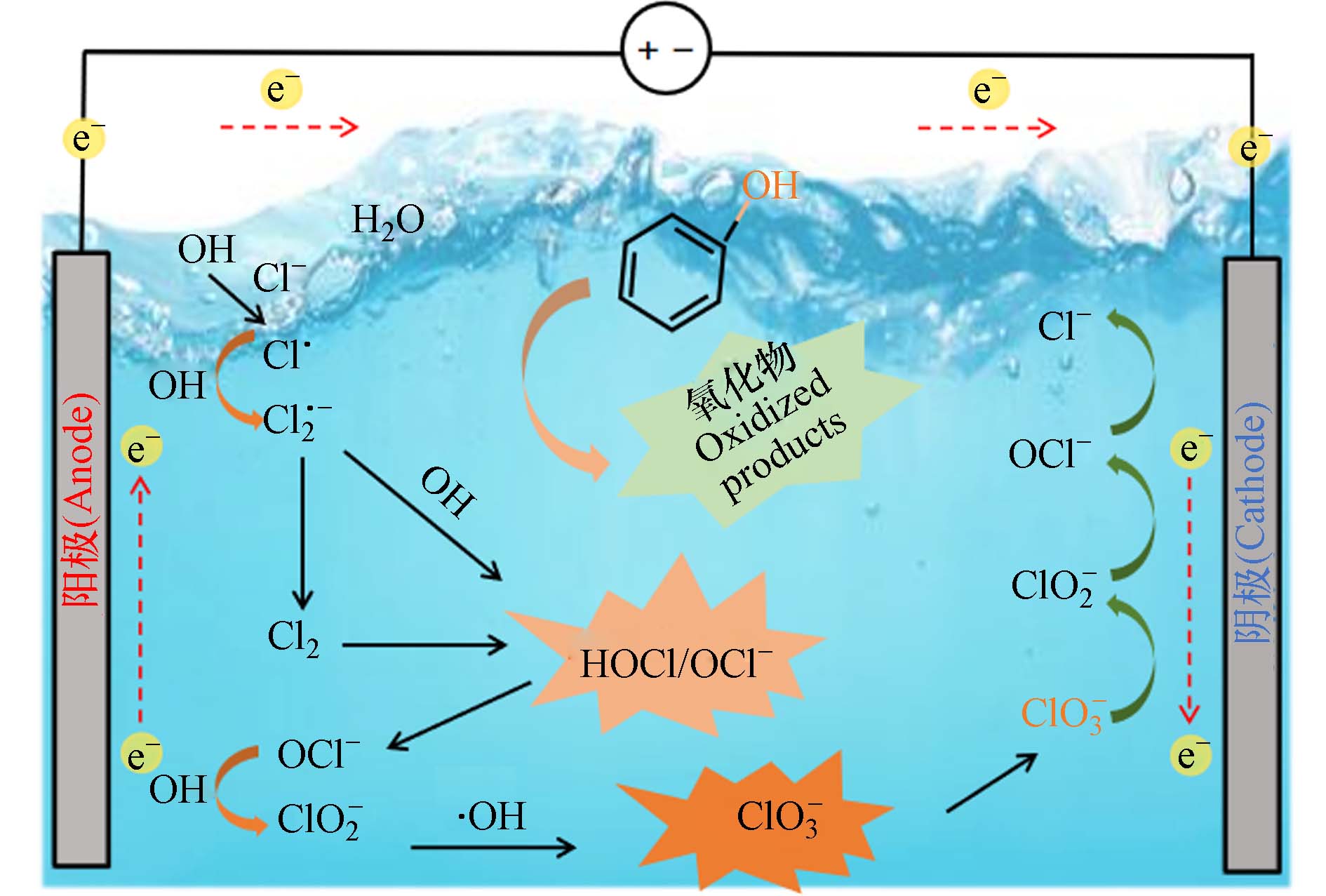
电化学氧化工艺(EO)为电化学高级氧化(EAOPs)工艺中用于去除废水中有机污染物的主要方法[1 − 2]. 阳极材料类型对去除效率有显著影响,如掺硼金刚石(BDD)、PbO2和Sb-SnO2电极,能高效产生物理吸附态的羟基自由基(·OH)[3 − 4];尺寸稳定阳极(DSA)具有较高稳定性,能优先产生化学吸附态的·OH,进而转化Cl−为高度氧化的活性物种,如Cl· (
$E^0_{{\mathrm{Cl}}^{\cdot}/{\mathrm{Cl}}^-} $ = 2.4 VNHE),Cl2·− ($E^0_{{\mathrm{Cl}}_2^{\cdot-}/{\mathrm{Cl}}^-} $ = 2.0 VNHE),和 ClO· ($E^0_{{\mathrm{ClO}}^{\cdot}/{\mathrm{Cl}}^-} $ = 1.5—1.8 VNHE),增强了水中污染物的氧化降解能力,有助于实现COD的电氧化去除[5 − 6].尽管氯离子对COD的电氧化去除有积极作用,但很少有研究考虑电氧化过程中所产生的氯氧离子(ClOx−)对性能评价的影响. 这些ClOx−不仅在COD测定中存在掩蔽效应,使得COD测定值偏低,导致对电氧化去除COD性能的过高评价[7-8]. 这种过高评价会使得真实的电催化效果无法达到预期目标. 这样的错误评价在预处理过程中会增大后续生化处理的压力,在深度处理阶段产生处理后的废水COD看似达标的假象[9]. 此外,电氧化产生的无机氯化副产物如ClO3−和ClO4−具有生物毒性. 排放这些含氯氧离子(ClOx−)的水不仅影响后续的生化处理过程,甚至会严重威胁到人类健康和生态系统安全[10 − 12]. 在电化学氧化过程中,有机物和氯(氧)离子除了在阳极处发生氧化反应外,已有研究证明在阴极处同样会发生直接还原和原子H*介导的间接还原[11]. 不同的阴极材料还原能力不同,同样会影响氯氧离子的生成. 然而,对于常见阴极材料对氯氧离子产生的具体影响仍未明确.
本研究旨在探究DSA电极体系处理含Cl−废水时,不同阴极材料对氯氧离子生成水平及其影响因素. 采用钛板、不锈钢和Cu/Zn等不同阴极材料构建DSA电化学氧化体系,模拟苯酚废水进行电催化氧化,并评估氯氧离子对COD的干扰水平. 通过考察不同电流密度对ClOx−产生、COD和TOC去除的影响;同时利用亚硫酸盐去除氯氧离子,测定电化学氧化体系内真实的COD去除性能. 最后,通过电化学分析和自由基清除实验,探究不同阴极材料在ClO3−和ClO−产生机理方面的差异. 这些研究结果有望为今后COD性能测定的干扰及氯氧离子的控制提供新的方法.
-
集热式恒温加热磁力搅拌器,巩义市英峪高科仪器厂.PTFE微滤膜(0.45 μm),长沙斯普林公司. 氯化钠(NaCl),次氯酸钠(NaClO),氢氧化钠(NaOH),苯酚(C6H5OH),无水硫酸钠(Na2SO4),亚硫酸氢钠(NaHSO3)等均购自国药集团化学试剂有限公司. 所有试剂均为分析纯,使用时均未作进一步纯化. 研究过程中所用模拟废水由苯酚和实验室自制去离子水配制,苯酚的初始浓度为2 mmol·L−1,硫酸根和氯离子通过添加硫酸钠和氯化钠引入.
-
如图1所示,电催化氧化实验在250 mL的反应槽中进行,配制200 mL含2 mmol·L−1苯酚以及50 mmol·L−1 NaCl的电解液,室温下调控磁力搅拌的速率至800 r·min−1进行搅拌,本实验中所用的阳极(自制Ti/EBNTA/RuO2–IrO2–SnO2–Sb2O5)和阴极(Ti、不锈钢或Cu/Zn)间隔控制为2 cm,所有电化学反应均在恒流条件下进行. 每组实验进行3次,结果取平均值.
-
Agilent A1100液相色谱分析仪,安捷伦科技有限公司;ICS-5000离子色谱仪,美国戴安公司;PCII 58700-00余氯分析仪,北京精诚华泰仪表有限公司;CHI660E电化学工作站、饱和甘汞电极(CHI150),上海辰华有限公司.
本实验COD 的检测采用国标法中的重铬酸钾法进行测定(HJ/T 399-2007)[13]. 通过快速消解后进行分光光度测定,检测范围为0—250 mg·L−1.TOC采用总有机碳分析仪进行测定. 苯酚样品经0.22 µm滤膜过滤后,采用高效液相色谱检测浓度,进样水量为5 µL,检测波长为270 nm. Cl−和ClO3−均采用离子色谱仪测定,色谱条件为流量1.33 mL·min−1、抑制电流100 mA、分析时间为9 min.游离氯采用便携式余氯分析仪测定,其检测方法为DPD分光光度法,测定范围0.01—8.8 mg·L−1.
-
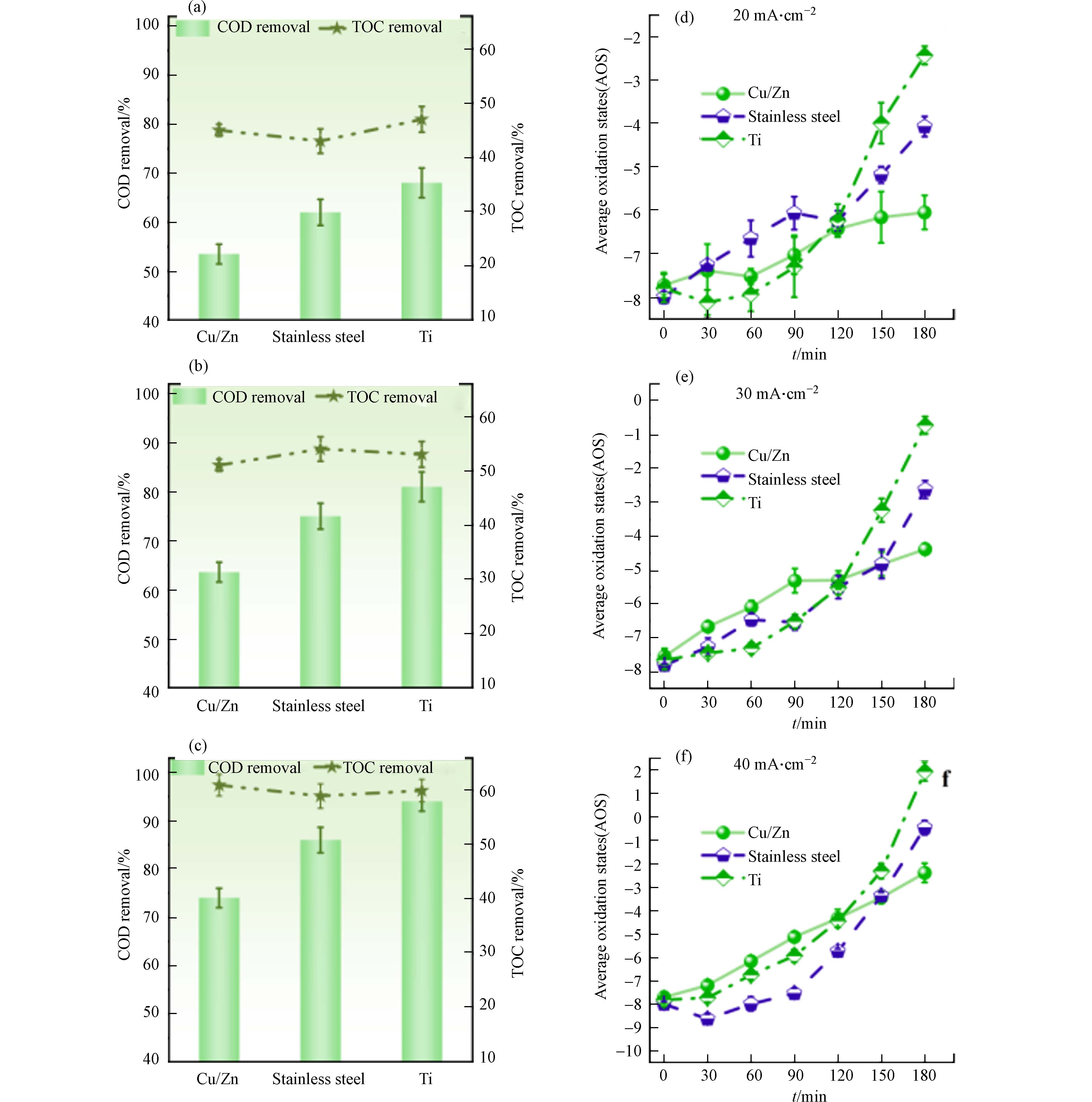
为考察不同阴极的DSA电氧化体系对污染物的去除效果,分别在不同电流密度下进行实验. 如图2 (a-c)所示,随着电流密度从20 mA·cm−2增加到40 mA·cm−2,使用Ti、不锈钢和Cu/Zn不同阴极反应180 min后的COD去除率分别从68%增加到94%、62%增加到86%和53%增加到74%,从高到低排列分别为Ti、不锈钢、Cu/Zn阴极. 而不同阴极对TOC去除率的影响微乎其微(P > 0.05),电流密度从20 mA·cm−2增加到40 mA·cm−2的过程中,TOC去除率均从45%提高到60%左右.
在废水可降解性评估中最为广泛使用的参数之一是平均氧化态(AOS),它是根据TOC和COD的值计算而来,计算公式如下:
AOS反映了溶液中存在的有机化合物的碳原子的氧化程度. 有机分子氧化程度越高,计算所得值就越高[14]. 图2 (d-f)显示,在Ti、不锈钢和Cu/Zn阴极下,电流密度从20 mA·cm−2增加到40 mA·cm−2时,AOS值分别从−2.4上升至1.9、−4.0上升至−0.4和−6.0上升至-2.3. 特别是在Ti阴极下,AOS值在120 min后急剧增加. 图2 (d)显示,20 mA·cm−2条件下,反应时间从120 min延长到180 min时,Ti阴极下的AOS值从−6.2增至−2.4,而不锈钢和Cu/Zn阴极下仅分别从−6.2增至−4.0和从−6.4增至−6.0. 理论上说,电化学氧化体系中COD和TOC的去除率与阴极材料无关. 然而,AOS值在EO开始时增长缓慢,但在120 min后显著增加,这与常见趋势相矛盾,因为随着反应进行,AOS的增量通常逐渐减少,可氧化产物对氧化性物种的抵抗力增加[15-16]. 结果表明,在处理含氯废水时,使用Ti阴极具有较高的表象COD去除率,但TOC的去除率没有显著差异,可能是因为COD测定受到不同氯氧离子浓度的影响.
-
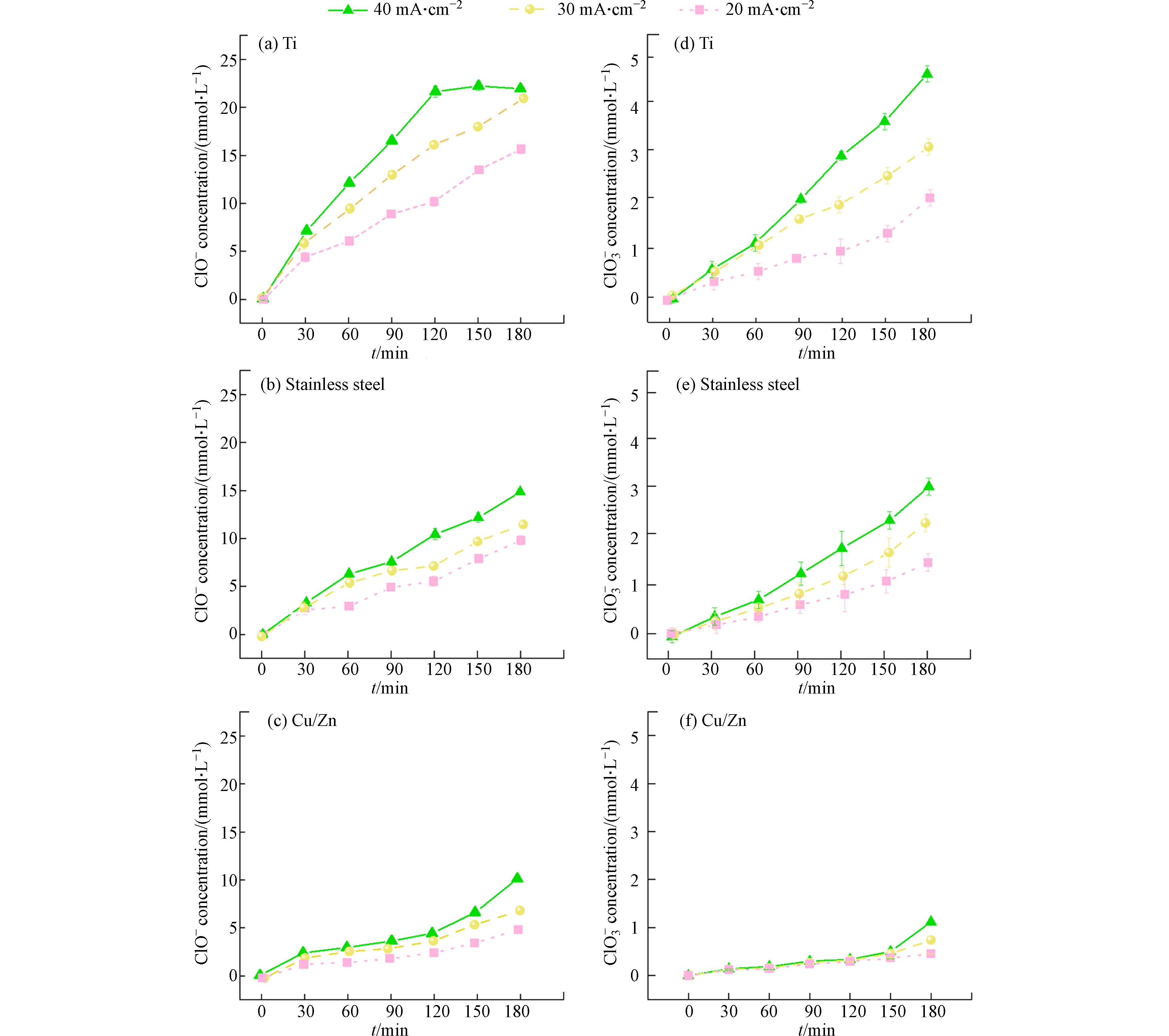
为探究氯氧离子的生成规律以及其对COD/TOC的影响,本文使用不含苯酚的50 mmol·L−1 NaCl作为电解质,对3种不同阴极材料进行电解试验. 反应结束后系统中只检测到次氯酸根(ClO−)和氯酸根(ClO3−)两种氯氧离子. 如图3所示,当电流密度从20 mA·cm−2提高到40 mA·cm−2反应3 h后,在使用Ti、不锈钢和Cu/Zn阴极的体系中,ClO−的浓度分别从15.9 mmol·L−1增加到21.9 mmol·L−1、从9.9 mmol·L−1增加到14.9 mmol·L−1以及从5.9 mmol·L−1增加到9.8 mmol·L−1;反应3 h后ClO3−的浓度也分别从2.2 mmol·L−1增加到5.1 mmol·L−1,从1.6 mmol·L−1增加到3.2 mmol·L−1,从0.4 mmol·L−1增加到1.2 mmol·L−1. 表明增大电流密度有利于Cl−氧化成氯氧离子[17 − 18],不同阴极材料的电化学氧化体系所产生的氯氧离子浓度趋势为Ti(图3 (a, d))>不锈钢(图3 (b, e))>Cu/Zn(图3 (c, f)). 从图3 (a, d)中可以看出Ti阴极体系内氯氧离子生成量最多,而使用Cu/Zn阴极(图3 (c, f))可以有效抑制体系内氯氧离子的生成.
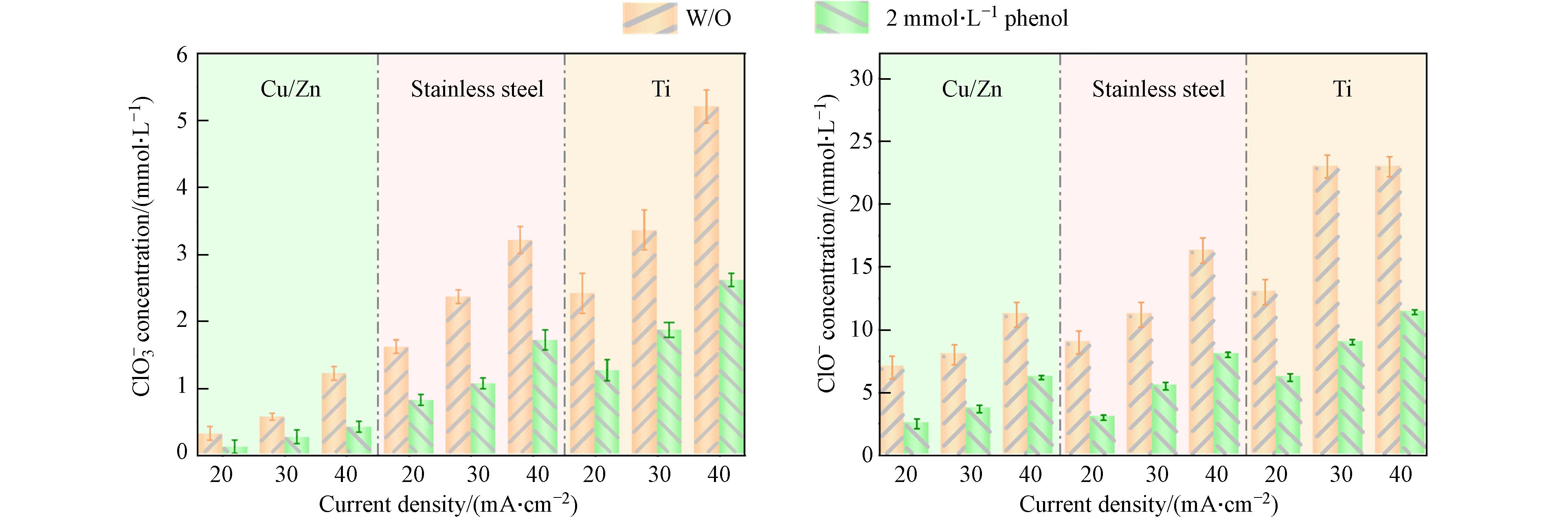
与不含苯酚的电解氯化钠溶液相比,在含2 mmol·L−1苯酚的氯化钠溶液反应180 min后ClO−和ClO3−的产生浓度有所降低. 如图4所示,电流密度为20 mA·cm−2时,使用Cu/Zn阴极、不锈钢阴极和Ti阴极的电催化体系中分别加入2 mmol·L−1苯酚后,ClO−的浓度分别从5.9 mmol·L−1降低到1.8 mmol·L−1,9.9 mmol·L−1降低到4.1 mmol·L−1,15.9 mmol·L−1降低到6.7 mmol·L−1 (图4). 相应地,ClO3−的浓度也分别从2.2 mmol·L−1下降到1.2 mmol·L−1,1.6 mmol·L−1下降到0.7 mmol·L−1,0.4 mmol·L−1下降到0.2 mmol·L−1 (图4). 在电化学氧化体系中,Cl−氧化为ClO−是通过直接氧化或在阳极表面与DSA(·OH)反应进行的(见方程式2—9)[19].ClO−能够在DSA阳极上通过直接电子转移或与DSA(·OH)反应生成ClO2−和ClO3− (方程式10—11). 因此,当存在苯酚时,不同阴极的DSA电氧化体系产生的ClO−和ClO3−浓度都比较低,可能是因为有机物和Cl−以及ClO−之间存在DSA电极产生的氧化物种的竞争[20-21]. 从图3和图4中不同阴极材料对应COD去除率与TOC去除率的变化趋势及所产生的氯氧离子浓度分布可以推断,生成的氯氧离子(即ClO−和ClO3−)浓度越高,COD去除率越高. 电氧化体系产生的ClO−和ClO3−可能存在对COD去除性能评价过高的情况.
-
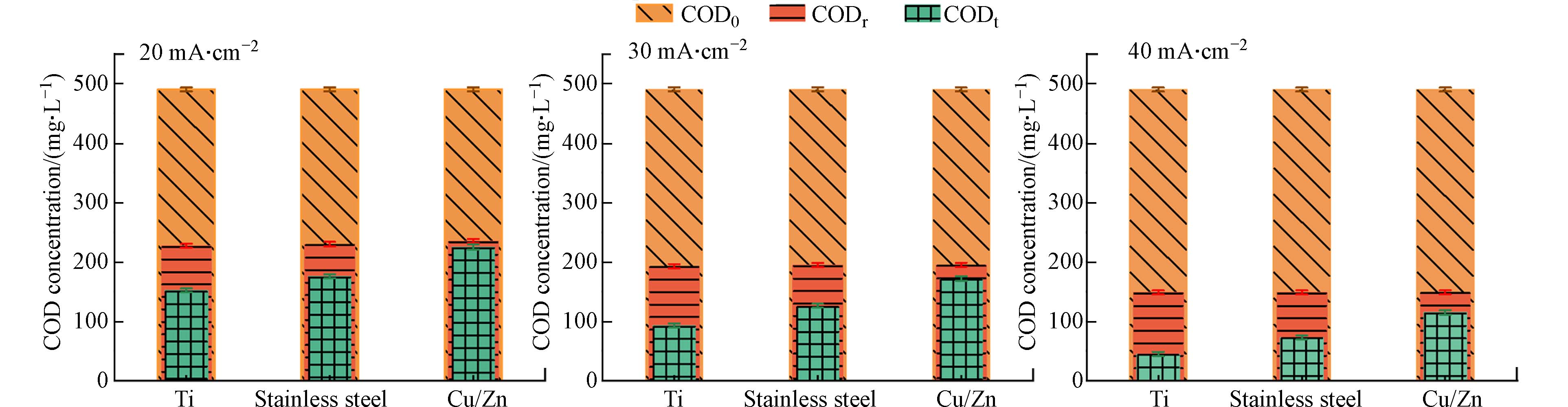
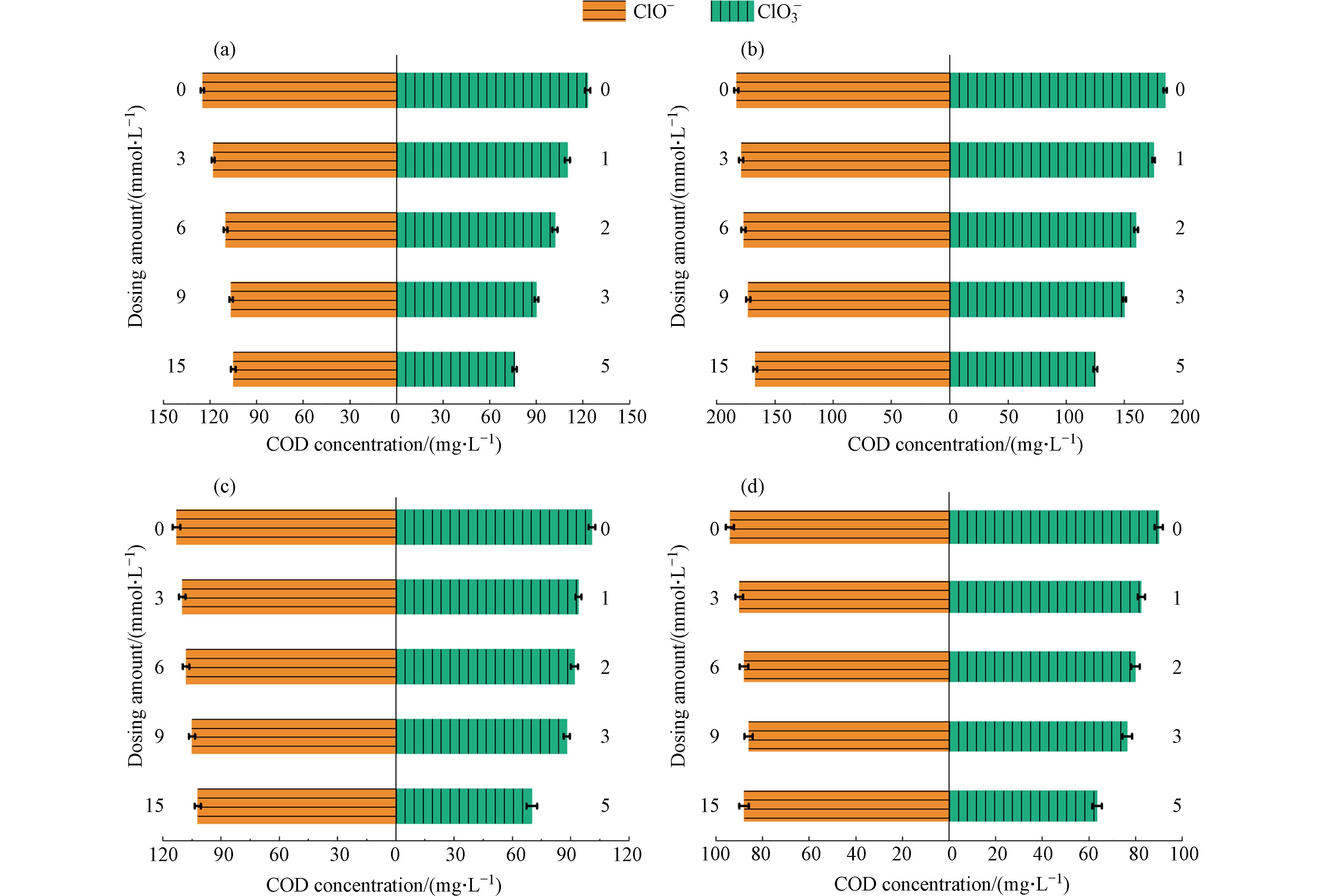
为准确评估体系真实的COD去除性能,在进行COD测试前,采用亚硫酸盐还原法去除经电化学氧化处理后废水中的氯氧离子. 在COD测试前使用亚硫酸盐还原法去除电化学氧化处理废水中的氯氧离子,在进行二次检测. 具体而言,在测定完ClO3−浓度后,在氧气氛围下向待测溶液内加入亚硫酸盐基,反应时间为60 min,初始pH为4—6,以[亚硫酸盐]:[ClO3−]摩尔比为1:5投加试剂,从而消除处理后废水中ClO3−对COD测定的干扰[22]. 此外,最近的研究表明,亚硫酸盐同样也可以用来消除ClO−,其[亚硫酸盐]:[ClO−]摩尔比为1:1. 为了加速亚硫酸盐还原氯氧离子的速率,并使这些反应物同时耗尽,反应温度保持在60 °C. 为了确保亚硫酸盐消耗殆尽避免造成COD检测的二次干扰,在反应结束后对亚硫酸盐进行二次检测[22]. 如图5所示,氯氧离子被完全处理后,COD去除率均有降低. 去除氯氧离子前后COD值的变化最大的是Ti阴极的体系. 以电流密度为30 mA·cm−2时为例,使用Ti、不锈钢和Cu/Zn阴极这3种不同的体系,在完全去除氯氧离子后COD值分别从88 mg·L−1提高到192 mg·L−1,从124 mg·L−1提高到198 mg·L−1和从180 mg·L−1提高到205 mg·L−1,表明在去除氯氧离子后,获得COD的真实去除效率约为60%.
以上结果表明,上述结论中去除性能的提升只是受到了不同浓度氯氧离子的干扰. 且随着电流密度的提升氯氧离子浓度升高,促使COD测定的误差进一步增大. 综上,Cu/Zn阴极的氧化体系生成的氯氧离子相对较少,能够有效减少氯氧离子对COD测定的干扰,从而体现真实的电催化体系的COD去除性能.
-
以上实验结果验证了以DSA为阳极的电化学氧化过程中会产生大量的ClO−和ClO3−,两者都会在一定程度上干扰电化学反应结束后COD的测定. 本文以苯醌、儿茶酚和2,4-二氯苯酚作为模型中间体,评估ClO−和ClO3−对COD测定的干扰. 由图6可知,在含有苯酚、苯醌、儿茶酚和2,4-二氯苯酚的水样中,随着氯氧离子浓度的增加,COD逐渐降低.
在投加相同浓度的情况下,ClO3−对COD的掩蔽效应更为显著. 如图6 (a)所示,当ClO3−和ClO−的用量分别为5 mmol·L−1和15 mmol·L−1时,0.5 mmol·L−1苯酚溶液的COD检测值分别从127 mg·L−1降至78 mg·L−1和105 mg·L−1. 而加入不同浓度的ClO−后,所有苯酚降解中间体的COD变化不大(< 15 mg·L−1),这可能是由于ClO−对苯酚降解中间体的氧化能力较差所致(图6 (b-d)). 随后分别向含有2,4-二氯苯酚、儿茶酚和苯醌的溶液中加入5 mmol·L−1 ClO3−,监测到溶液中COD值急剧下降. 这是由于ClO3−被迅速还原并转化为ClO2(方程式12),这是一种在高温消解时ClO3−与处理后废水中的有机污染物在酸性条件下反应所产生的一种氧化性气体. 大多数有机物质,包括持久性化合物,都能够被ClO2−迅速氧化(方程式13). 而如方程式14、15所示[23],在中性条件和酸性条件ClO3−的氧化还原电势不同,其氧化性能也不同,这也就说明在酸性条件下ClO3−具有更强的氧化性能,从而实现在实际的中性水体中不会影响到COD的变化. 而ClO3−和ClO2在测试条件下则会引起的有机物氧化减少了处理后废水中重铬酸盐的总消耗,从而导致基于标准重铬酸盐方法测定的COD值较低. 由此可见,电化学氧化过程生成的ClO3−是导致电化学氧化去除COD性能被高估的主要“罪魁祸首”.
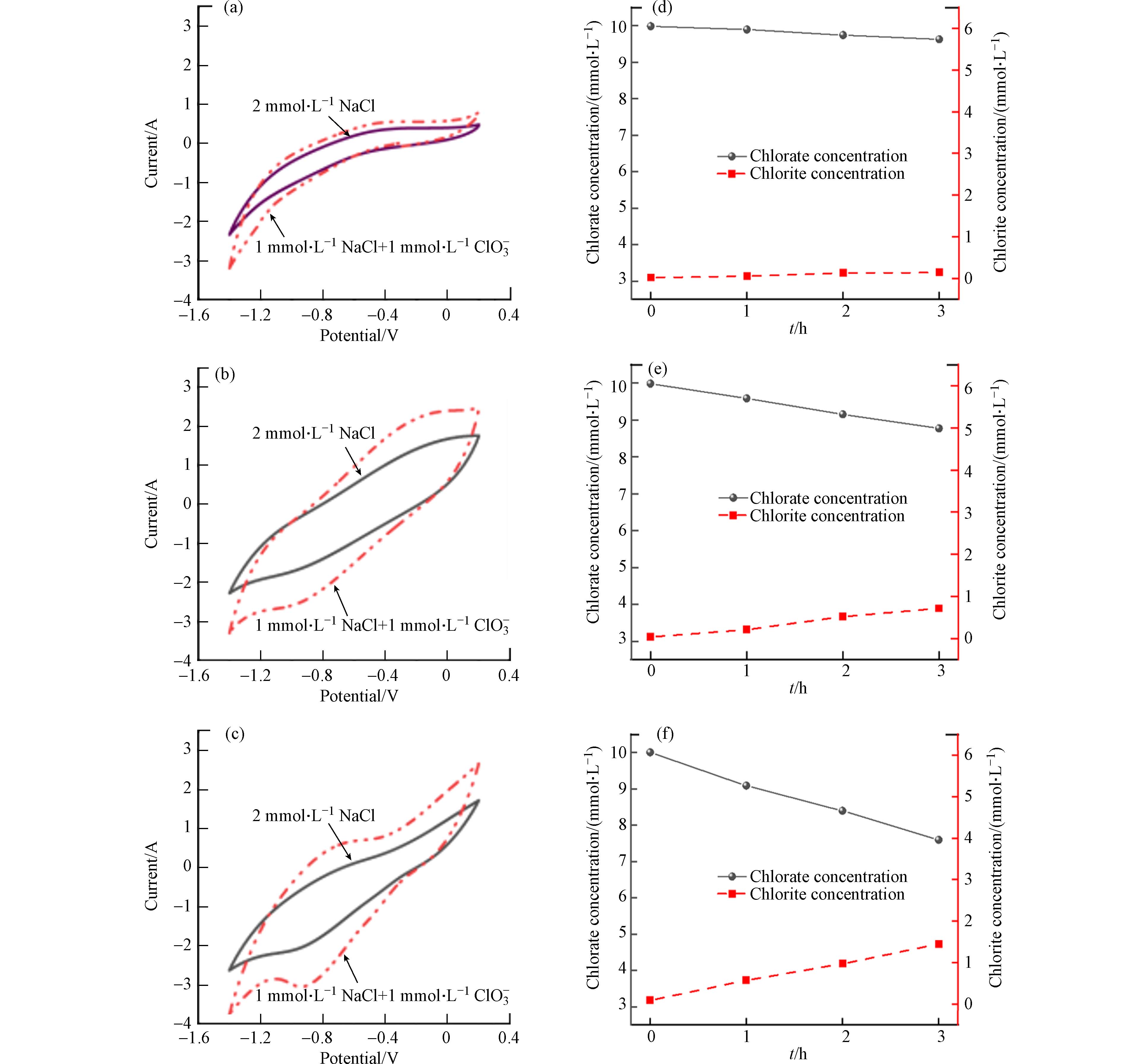
以上实验验证了DSA为阳极的电化学氧化过程会产生大量的ClO−和ClO3−,两者都会影响COD的测定,其中ClO3−的干扰更为显著. 在此过程中,使用不同阴极的电化学氧化体系所体现的电化学氧化COD去除性能的差异,主要是由于它们在电催化过程中对ClO−和ClO3−的抑制作用不同. 本实验通过循环伏安法分析比较了3种阴极材料对ClO−和ClO3−的还原性能. 如图7 (a-c)所示,当电解液中存在ClO3−时,3种阴极体系在−1.4—0.2 V范围内均有还原峰出现,其中Cu/Zn电极的响应电流最强. Cu/Zn阴极在电位为−0.9 V时出现了一个大小为−3.2 A的还原峰远大于不锈钢阴极的−2.6 A和Ti阴极的−1.4 A. 扫描过程中,3种电极响应电流出现增大表明ClO3−的存在促进了阴极表面水分子的分裂产生氢离子,从而促进了阴极表面氢的形成. 根据之前的研究结果[24],ClO3−能够与阴极表面的带电氢离子发生反应,转化为Cl−(方程式16,17),从而促进反应平衡的转变.
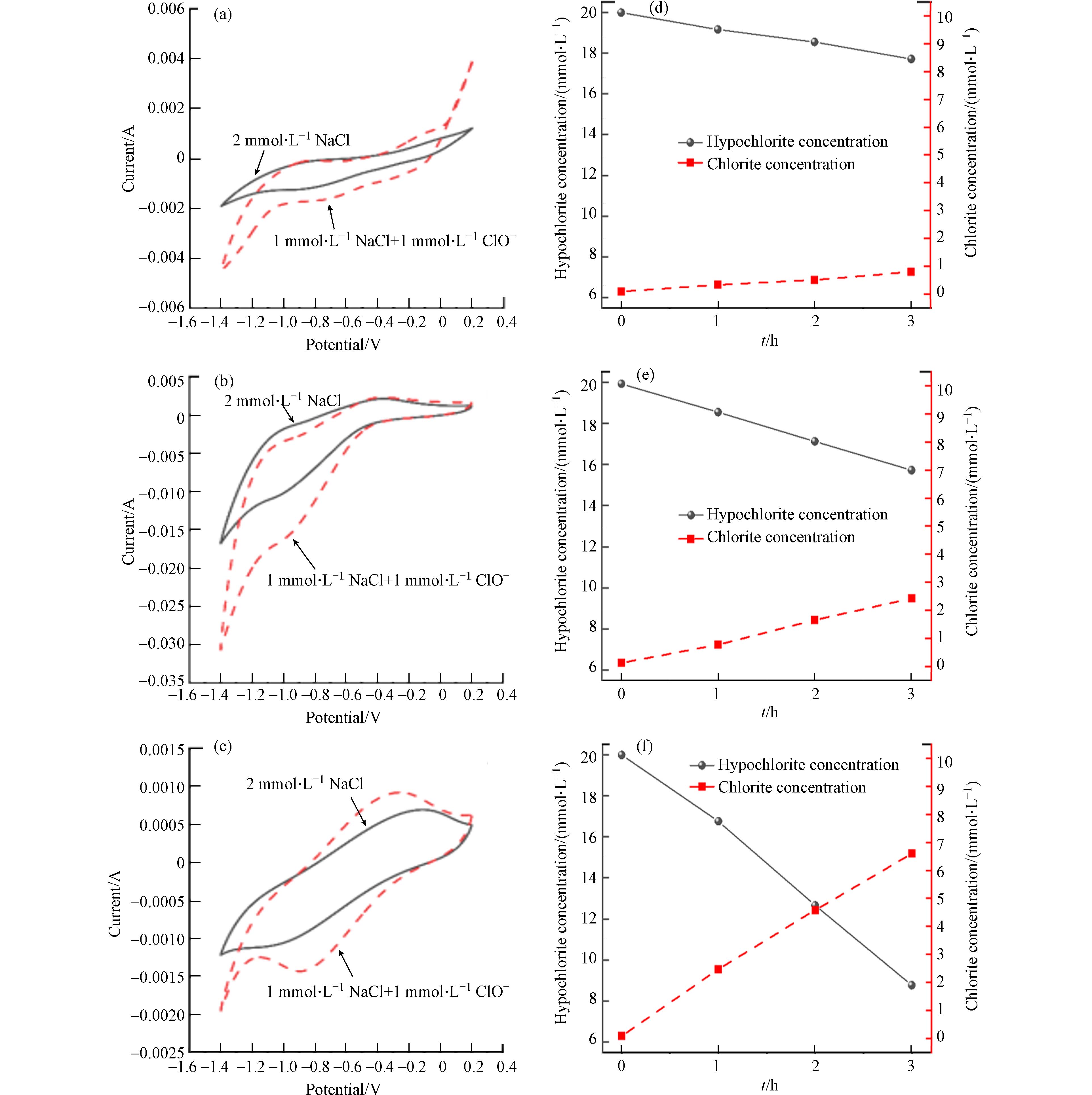
同样,当反应溶液是1 mmol·L−1的ClO−时,从图8 (a-c)可以看出仍然是在Cu/Zn阴极处出现了明显的还原峰和更强的响应电流. 总的来说,在含ClO−和ClO3−的电解液中使用Cu/Zn阴极和不锈钢阴极进行扫描时,其电位窗口(析氧电位和析氢电位之差)是明显大于Ti阴极的. 这说明Cu/Zn电极和不锈钢电极具有更好的催化还原性能,这也是Cu/Zn电极抑制氯氧离子生成能力远大于Ti阴极的主要原因. 在相同的实验条件下,对三种阴极进行电化学还原实验. 随着反应的进行,溶液中ClO−和ClO3−逐渐减少并伴随着Cl−浓度的增加.
从图8 (d-f)可以看出,反应180 min,Cu/Zn阴极还原了2.4 mmol·L−1 ClO3−,同步产生了1.3 mmol·L−1 Cl−,而同时刻下不锈钢还原了1.2 mmol·L−1 ClO3−和Ti阴极还原了0.4 mmol·L−1 ClO3−. 使用Ti、不锈钢和Cu/Zn阴极还原ClO−溶液,反应180 min后,ClO−的浓度分别从20 mmol·L−1降到17.8 mmol·L−1、15.8 mmol·L−1和8.8 mmol·L−1. 在Ti、不锈钢和Cu/Zn阴极上,Cl−的浓度分别增加了0.7 mmol·L−1、2.4 mmol·L−1和6.7 mmol·L−1. 这一结果表明,ClO−和ClO3−使用三种阴极都能最终还原为Cl−,其中Cu/Zn阴极的还原能力最强.
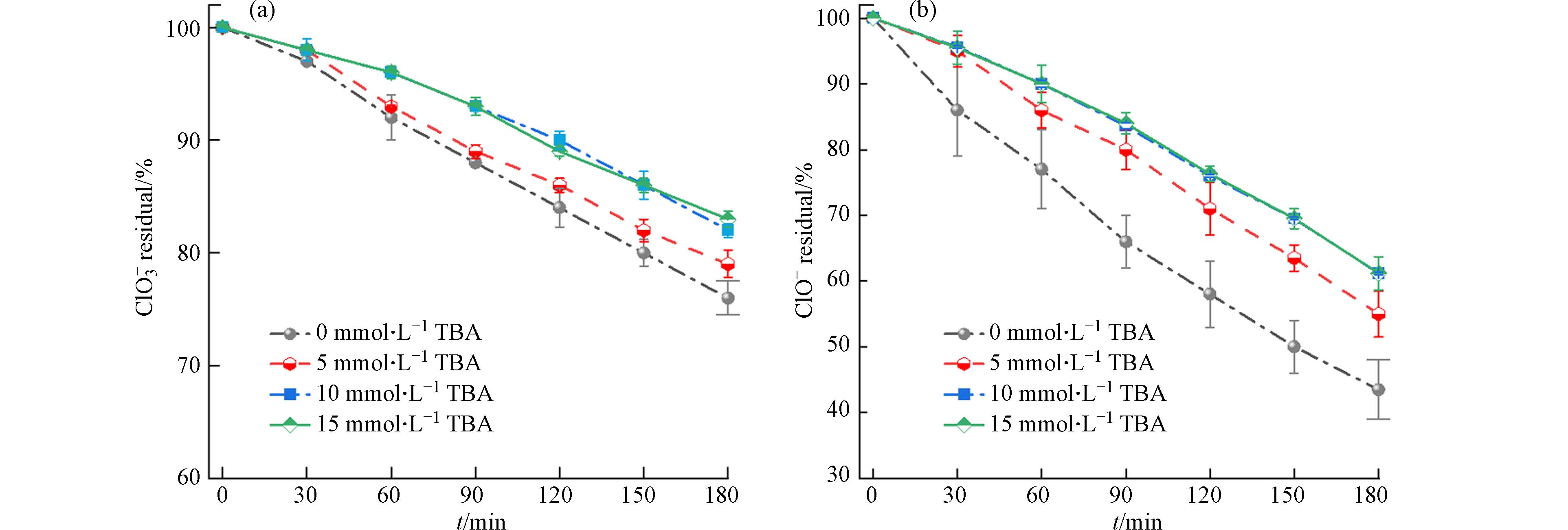
氯氧离子的电化学还原主要是通过直接还原和间接还原两种方式进行. 直接还原是主要是由电子转移起作用,间接还原则是通过阴极产生的H*起作用. 为了定性探究H*在Cu/Zn阴极电化学还原ClO−和ClO3−的贡献,本文将叔丁醇(TBA)作为H*清除剂添加到溶液中. 如图9所示,TBA浓度的增加会对ClO3−的还原去除起抑制作用,当TBA浓度为5 mmol·L−1时,ClO3−去除率由24%下降至21%,当TBA浓度增加到10 mmol·L−1时,去除率下降至17%. 但当TBA浓度超过10 mmol·L−1后,ClO3−的还原效率再无更大的影响. 此外,TBA的添加对ClO−还原的影响更为明显,在TBA浓度为5 mmol·L−1和10 mmol·L−1时,ClO−的去除效率分别下降了近11%(从56%到45%)和17%(从56%到39%). 但当TBA浓度进一步达到10 mmol·L−1和15 mmol·L−1时,ClO−的还原效率无明显差异. 综上所示,Cu/Zn阴极体系由原子H*介导的间接还原仅占ClO−和ClO3−电化学还原过程的30%左右.
上述结果证实了Cu/Zn阴极对电化学反应生成的ClO−和ClO3−具有良好的还原能力,主要依赖于电极表面的直接电子转移反应. 证明以Cu/Zn为阴极的电化学氧化体系中,对COD测定的干扰会远小于以Ti和不锈钢为阴极的电化学系统.
-
1)在使用相同阳极处理相同废水的情况下更换不同阴极材料对TOC的去除率基本没有影响,而COD的去除率出现明显差别,从高到低依次为Ti、不锈钢、Cu/Zn阴极.
2)通过离子色谱检测发现,与使用Ti阴极和不锈钢阴极的氧化体系相比,使用Cu/Zn阴极处理含2 mmol·L−1的模拟苯酚废水时产生的氯氧离子最少. 通过亚硫酸盐还原法消除处理后溶液中氯氧离子后,3种不同阴极体系处理的废水COD去除率均有所下降且都恢复到了相近水平. 从而证实氯氧离子对COD测定具有掩蔽作用,Cu/Zn阴极对COD的干扰程度更低,更能够体现电催化体系的真实COD去除性能.
3)ClO3−对COD测定的干扰比ClO−更明显. 利用电化学分析和电化学还原实验进一步说明了,使用Cu/Zn阴极的电催化氧化体系处理含氯废水生成氯氧离子更少的原因是Cu/Zn阴极对ClO−和ClO3−的还原能力更强.
阴极材料对钛基金属氧化物阳极体系氯氧离子生成规律及COD去除性能影响评价
Effects of cathode materials on the oxychlorides generation laws in the DSA electrooxidation system and performance assessment of COD removal
-
摘要: 金属氧化物阳极(DSA)体系对含氯废水进行电化学氧化会产生氯氧离子副产物,导致COD去除性能评价过高及污水达标的假象. 本文旨在探究不同阴极的DSA电氧化体系中氯氧离子的产生情况对COD、TOC测定的干扰. 在40 mA·cm−2电流密度下,经过180 min处理后,不同阴极对TOC的去除率基本相似,但对COD的表观去除率则依次为Ti(94%)、不锈钢(86%)、Cu/Zn阴极(74%),这与氯氧离子的产生量对应一致,即Ti阴极的氯氧离子副产物产出更多. 采用还原性能更强的Cu/Zn阴极或通过增加有机物苯酚的浓度均可显著抑制氯氧离子的生成. 使用亚硫酸盐还原去除氯氧离子(ClO−和ClO3−)后,COD去除效率均下降到相近水平,表明氯氧离子对COD的测定具有掩蔽效应. 对照实验中发现,ClO3−对COD测定的干扰比ClO−更明显. 通过研究氯氧离子在不同阴极的DSA电氧化体系下的产生情况及其对COD去除性能测定的干扰,引入了一种方便、绿色、有效的控制策略,为正确评价电氧化体系的COD去除性能提供新方法.Abstract: The Direct Solar Airflow (DSA) electrooxidation system, employed for the electrochemical oxidation of chlorine-rich wastewater, yields oxychlorides as byproducts. This can lead to an overestimation of Chemical Oxygen Demand (COD) removal efficiency and a misleading impression of compliant effluent. This study investigates the influence of oxychloride formation in the DSA electrooxidation system on COD and Total Organic Carbon (TOC) determination when utilizing various cathodes. After 180 minutes of treatment at a current density of 40 mA·cm−2, TOC removal was largely consistent across different cathodes. However, the apparent COD removal followed the order Ti (94%), stainless steel (86%), and Cu/Zn cathode (74%), corresponding to the production of oxychlorides; notably, the Ti cathode produced more Chlorine Dioxide (ClOx−) as byproducts. Oxychloride oxide production can be significantly mitigated using a Cu/Zn cathode with robust reducing capabilities and increasing the content of organic phenol. The removal of oxychlorides (ClO− and ClO3−) via sulfite reduction resulted in a decrease in COD removal efficiency to similar levels, suggesting a masking effect of chloroxylate ions on COD determination. In control experiments, it was observed that ClO3− interfered more significantly with COD determination than ClO−. By examining the generation of oxychlorides under DSA electrooxidation systems with different cathodes and their interference with COD removal performance determination, a convenient, green, and effective control strategy was introduced, providing a novel method for accurately evaluating COD removal performance of electrooxidation systems.
-
Key words:
- electrochemical /
- oxychloride ions /
- cathode material /
- COD determination
-

-
图 7 Ti (a); 不锈钢 (b)和Cu/Zn (c) 阴极分别在2 mmol·L−1 NaCl和1 mmol·L−1 NaCl + 1 mmol·L−1 ClO3−溶液中分别进行的CV扫描实验. 当电流密度为30 mA cm−2时, 在10 mmol·L−1 NaClO3和30 mmol·L−1 Na2SO4中用Ti (d); 不锈钢 (e) 和Cu/Zn (f) 阴极进行电化学还原ClO3−(Ti作为阳极)
Figure 7. CV scanning experiments of Ti (a); stainless steel (b) and Cu/Zn (c) cathodes in 2 mmol·L−1 NaCl and 1 mmol·L−1 NaCl + 1 mmol·L−1 ClO3− solution, respectively. Electrochemical reduction of ClO3− (Ti as anode) was carried out with Ti (d); stainless steel (e) and Cu/Zn (f) cathodes in 10 mmol·L−1 NaClO3 and 30 mmol·L−1 Na2SO4 when the current density was 30 mA cm−2
图 8 分别在2 mmol·L−1 NaCl和1 mmol·L−1 NaCl+1 mmol·L−1 ClO−溶液中对Ti (a); 不锈钢 (b) 和Cu/Zn (c) 阴极进行CV扫描实验. 当电流密度为30 mA cm−2时, 在20 mmol·L−1的NaClO中将ClO−还原成Cl−, 阴极为Ti (d); 不锈钢 (e) 和Cu/Zn (f) (Ti作为阳极)
Figure 8. CV scanning experiments were performed on Ti (a); stainless steel (b) and Cu/Zn (c) cathodes in 2 mmol·L−1 NaCl and 1 mmol·L−1 NaCl+1 mmol·L−1 ClO− solutions, respectively. Reduction of ClO− to Cl− in 20 mmol·L−1 NaClO at a current density of 30 mA cm−2 , cathodes of Ti (d); stainless steel (e) and Cu/Zn (f) (Ti as anode)
-
[1] MARTÍNEZ-HUITLE C A, FERRO S. Electrochemical oxidation of organic pollutants for the wastewater treatment: Direct and indirect processes[J]. Chemical Society Reviews , 2006, 35(12): 1324-1340. doi: 10.1039/B517632H [2] PANIZZA M, CERISOLA G. Direct and mediated anodic oxidation of organic pollutants[J]. Chemical Reviews, 2009, 109(12): 6541-6569. doi: 10.1021/cr9001319 [3] LIU Y J, MENG X Z, LI C, et al. Electrochemical degradation of pharmaceuticals using Ti/SnO2-Sb2O5-IrO2-RuO2 anode: Electrode properties, performance and contributions of diverse reactive species[J]. Journal of the Electrochemical Society, 2020, 167(14): 143503. doi: 10.1149/1945-7111/abc30b [4] SUN T, WANG J R, LIU Y J, et al. A comprehensive study on nano-diamond doped β-PbO2 electrode: Preparation, properties and electrocatalytic performance[J]. Journal of the Electrochemical Society, 2019, 166(14): E473-E480. doi: 10.1149/2.0591914jes [5] CHO K, QU Y, KWON D, et al. Effects of anodic potential and chloride ion on overall reactivity in electrochemical reactors designed for solar-powered wastewater treatment[J]. Environmental Science & Technology, 2014, 48(4): 2377-2384. [6] PARK H, VECITIS C D, HOFFMANN M R. Electrochemical water splitting coupled with organic compound oxidation: the role of active chlorine species[J]. The Journal of Physical Chemistry C, 2009, 113(18): 7935-7945. doi: 10.1021/jp810331w [7] FERETTI D, ZERBINI I, CERETTI E, et al. Evaluation of chlorite and chlorate genotoxicity using plant bioassays and in vitro DNA damage tests[J]. Water Research, 2008, 42(15): 4075-4082. doi: 10.1016/j.watres.2008.06.018 [8] 颜薇, 余伟, 肖慧吉, 等. 氯酸盐屏蔽废水COD测定的消除策略及反应机制[J]. 环境化学, 2023, 42(8): 2813-2822. doi: 10.7524/j.issn.0254-6108.2022032202 YAN W, YU W, XIAO H J, et al. Elimination strategy and reaction mechanism for the interference of chlorate on COD[J]. Environmental Chemistry, 2023, 42(8): 2813-2822 (in Chinese). doi: 10.7524/j.issn.0254-6108.2022032202
[9] MENG X S, KHOSO S A, LYU F, et al. Study on the influence and mechanism of sodium chlorate on COD reduction of minerals processing wastewater[J]. Minerals Engineering, 2019, 134: 1-6. doi: 10.1016/j.mineng.2019.01.009 [10] 柏平. Mg-Al类水滑石同步去除亚氯酸盐、氯酸盐的试验研究[D]. 杭州: 浙江工业大学, 2016. BAI P. Removal of chlorite and chlorate by Mg-Al layered double hydroxides[D]. Hangzhou: Zhejiang University of Technology, 2016.
[11] YAN Z, XU L M, ZHANG W M, et al. Comparative toxic effects of microplastics and nanoplastics on Chlamydomonas reinhardtii: Growth inhibition, oxidative stress, and cell morphology[J]. Journal of Water Process Engineering, 2021, 43: 102291. doi: 10.1016/j.jwpe.2021.102291 [12] 张小磊, 苍岩, 宋伟, 等. 二氧化氯预氧化含藻水过程中副产物的生成规律[J]. 环境化学 , 2019, 38(2): 306-316. doi: 10.7524/j.issn.0254-6108.2018040203 ZHANG X L, CANG Y, SONG W, et al. By-product formation in algae-containing water pre-oxidized by chlorine dioxide[J]. Environmental Chemistry, 2019,38(2): 306-316 (in Chinese). doi: 10.7524/j.issn.0254-6108.2018040203
[13] 中华人民共和国环境保护部. 水质 化学需氧量的测定 快速消解分光光度法: HJ/T 399—2007[S]. 北京: 中国环境科学出版社, 2008. Ministry of Environmental Protection of the People’s Republic of China. Water quality-Determination of the chemical oxygen demand-Fast digestion-Spectrophotometric method: HJ/T 399—2007[S]. Beijing: China Environmental Science Press, 2008.
[14] AL MOMANI F, SANS C, ESPLUGAS S. A comparative study of the advanced oxidation of 2, 4-dichlorophenol[J]. Journal of Hazardous Materials, 2004, 107(3): 123-129. doi: 10.1016/j.jhazmat.2003.11.015 [15] WOJNÁROVITS L, WANG J L, CHU L B, et al. Matrix effect in the hydroxyl radical induced degradation of β-lactam and tetracycline type antibiotics[J]. Radiation Physics and Chemistry, 2022, 193: 109980. doi: 10.1016/j.radphyschem.2022.109980 [16] GIANNAKIS S, GAMARRA VIVES F A, GRANDJEAN D, et al. Effect of advanced oxidation processes on the micropollutants and the effluent organic matter contained in municipal wastewater previously treated by three different secondary methods[J]. Water Research, 2015, 84: 295-306. doi: 10.1016/j.watres.2015.07.030 [17] YANG Y, SHIN J, JASPER J T, et al. Multilayer heterojunction anodes for saline wastewater treatment: Design strategies and reactive species generation mechanisms[J]. Environmental Science & Technology, 2016, 50(16): 8780-8787. [18] JUNG Y J, BAEK K W, OH B S, et al. An investigation of the formation of chlorate and perchlorate during electrolysis using Pt/Ti electrodes: The effects of pH and reactive oxygen species and the results of kinetic studies[J]. Water Research, 2010, 44(18): 5345-5355. doi: 10.1016/j.watres.2010.06.029 [19] YANG C H, LEE C C, WEN T C. Hypochlorite generation on Ru–Pt binary oxide for treatment of dye wastewater[J]. Journal of Applied Electrochemistry, 2000, 30(9): 1043-1051. doi: 10.1023/A:1004038503410 [20] CLARK J A, YANG Y H, RAMOS N C, et al. Selective oxidation of pharmaceuticals and suppression of perchlorate formation during electrolysis of fresh human urine[J]. Water Research, 2021, 198: 117106. doi: 10.1016/j.watres.2021.117106 [21] HENRY BERGMANN M E, ROLLIN J. Product and by-product formation in laboratory studies on disinfection electrolysis of water using boron-doped diamond anodes[J]. Catalysis Today, 2007, 124(3/4): 198-203. [22] XIAO H J, YAN W, ZHAO Z K, et al. Chlorate induced false reduction in chemical oxygen demand (COD) based on standard dichromate method: Countermeasure and mechanism[J]. Water Research, 2022, 221: 118732. doi: 10.1016/j.watres.2022.118732 [23] WEAST, ROBERT C. CRC handbook of chemistry and physics [M]. Crc Press, Inc, 1988, 1223-1224. [24] BROWN G M. The reduction of chlorate and perchlorate ions at an active titanium electrode[J]. Journal of Electroanalytical Chemistry and Interfacial Electrochemistry, 1986, 198(2): 319-330. doi: 10.1016/0022-0728(86)90008-2 -



 下载:
下载: