-
微塑料一般是指粒径小于5 mm的塑料颗粒[1 − 2],由于其良好性能被广泛使用于日常生活之中,因此,微塑料分布也十分广泛. 微塑料会在环境中不断积累,土壤是微塑料重要储存库[3]. 微塑料在环境中可被动物误食 [4 − 5],影响它们生长、发育、行为甚至导致死亡. 微塑料在动物体内积累,进而会影响人类健康. 微塑料还是其他污染的载体,对污染物的迁移转化有着重要影响[6].
近些年来,由于人类和动物使用后的排放,土壤环境中经常检测到高浓度抗生素[7]. 抗生素对土壤的污染已被认为是一种潜在的威胁,可导致土壤微生物中抗生素耐药性的发展和传播、土壤生态系统功能的损害、农产品的污染[8]. 因此,研究抗生素在环境中的迁移特性,对于更好地了解抗生素的最终归宿具有重要意义.
土霉素(oxytetracycline,OTC)属于四环素的一类[9],被人类大量使用于传统畜牧业,但因其自身的特殊性质而无法被动物完全吸收[2,10],而是随粪便进入土壤环境中,进而影响环境[11 − 12]. OTC在不同pH条件下具有不同离子形态[13],且具有羧基、氢基、氨基多种官能团,可与土壤发生多种相互作用,影响其在环境中的迁移转化,进而干扰自然界的物质循环;OTC具有一定毒性对人类健康构成相应威胁[14]. 2004年,Kulshrestha等[15]研究发现,低浓度的有机物促进抗生素在土壤上的吸附,而高浓度的有机物促进抗生素在土壤上的解吸. 同时也证实了有机质可以进入四环素的层间扩散[15],进而抑制土壤吸附OTC. 溶解性有机质(dissolved organic matter,DOM)可以覆盖在微塑料表面改变其性质[16];微塑料的载体效应可以与DOM竞争吸附位点,影响抗生素暴露风险,进而影响对土壤生物有效性与毒性效应.
寒地黑土是“土壤中的大熊猫”,有机质含量 3%—10%,约是黄土的10倍,土壤肥力高[17]. 研究表明,土壤组成如有机质含量[18]、矿物质[13]等,会影响抗生素的吸附行为. 本研究拟从寒地黑土不同组分着手,选择高密度聚乙烯(HDPE)微塑料作为模型微塑料,抗生素OTC作为吸附质,研究新型污染物微塑料、寒地黑土和抗生素之间的作用. 探究寒地黑土不同组分对抗生素的吸附作用,考察pH变化对寒地黑土的不同组分吸附抗生素的影响,探究HDPE微塑料对OTC的吸附作用,分析微塑料对寒地黑土不同组分吸附抗生素的影响. 以期揭示抗生素与寒地黑土的相互作用机理,为抗生素在环境中的迁移转化研究提供数据支持,为进一步了解土壤微塑料污染做出贡献.
-
双光束紫外可见分光光度计(T9,北京普析通用仪器有限责任公司);电子天平(FA2004N,上海菁海仪器有限公司);笔式酸度计(pH-103,常州爱德克斯仪器仪表有限公司);振荡器(WH-962B,太仓市华利达实验设备有限公司);超纯水器(GWA-UN4-F20,北京海富达科技有限公司).
实验选择的寒地黑土来自于黑龙江省庆安县的农田中,供试土壤基本理化性质如表1所示. 实验用的试剂主要有土霉素(UPS级,源叶生物);叠氮钠(分析纯,天津市环宇化工厂);无水乙醇(99.7%,天津市大茂化学试剂厂);盐酸(36%—38%,天津市凯信化学工业有限公司)氯化钠、氯化钙、氢氧化钠(均为分析纯,天津市永大化学试剂有限公司);过氧化氢(分析纯,南京化学试剂股份有限公司);高密度聚乙烯购于陶氏化学公司.
-
用少量水润湿风干的土壤样品,再加入10 mL的10%过氧化氢溶液,用玻璃棒搅拌土液,盖上表面皿,加热促进作用. 在过氧化氢的发泡作用消失后,再加入一定量的过氧化氢,反复处理,直至不再产生气泡,多余过氧化氢可以加热去除. 最后反复用去离子水漂洗酸洗后的去有机质土壤,以除尽游离电解质[19 − 20].
-
取5 g风干的土壤样品与30 mL超纯水混合(土水比例为1∶6),放置于50 mL离心管中,室温下振荡24 h,取出样品,以
4000 r·min−1离心20 min,过0.45 μm滤膜,滤液为土壤DOM,置于冰箱,−20 ℃保存,使用总有机碳分析仪测定其溶解性有机碳(DOC)浓度,此法提取水溶性DOM效率为43.98%;滤渣记为去DOM土,低温烘干,研磨,备用[21 − 22]. -
配制浓度为100 mg·L−1 OTC储备液,用电解质溶液(0.1 mol·L−1的NaCl和CaCl2以及200 mg·L−1的NaN3)配制初始浓度分别设为1、4、8、16、32、64 mg·L−1的OTC使用液,调节使用液pH值约6.5. 分别称取(0.05±
0.0010 )g的土壤、去有机质土壤、去DOM土壤置于40 mL棕色EPA瓶中,加入不同浓度的OTC使用液至满,拧紧瓶盖,放入振荡器中,室温下以10 r·min−1的转速振荡5 d,然后静止24 h,将上清液过0.22 μm滤膜,滤液用紫外分光光度计测OTC浓度[23]. 每个浓度试验设置2组平行,1组空白. -
配制初始浓度分别设为1、4、8、16、32 mg·L−1的OTC使用液,控制使用液pH值分别为2、5、10,进行不同pH下单一吸附剂对OTC的吸附实验. 其他操作同“1.2.3”节.
-
称取HDPE(0.05±
0.0010 )g置于40 mL棕色EPA瓶中;再分别加入1、4、8、16、32、64 mg·L−1浓度的OTC使用液,调节使用液pH值约为6.5,其他操作同“1.2.3”节. -
分别称取土壤、去有机质土壤、去DOM土壤与HDPE混合物(0.05±
0.0010 )g(混合比9∶1),置于40 mL棕色EPA瓶中;再分别加入1、4、8、16、32 mg·L−1浓度的OTC使用液,调节使用液pH值约为6.5,其他操作同“1.2.3”节. -
根据质量平衡计算吸附相的浓度OTC在土壤上的吸附量计算公式如式(1):
其中,C0为开始时液相中吸附质浓度,CW为平衡时液相中吸附质浓度,q为吸附量,是平衡态时固相吸附剂上吸附质浓度.
将吸附平衡的液相浓度(CW)和固相浓度(q)利用Linear模型(式2)、Freundlich模型(式3)和Langmuir模型(式4)进行拟合.
式中,KD为吸附分配系数是吸附质在吸附剂固相中的浓度与吸附质在液相中的平衡浓度之间的比率. Kf为Freundlich 等温线方程拟合参数,与亲和能力和吸附强度有关;n 为线性指数,无单位,n大于 1 或小于 1 均为非线性吸附,n越接近于 1 吸附线性程度越高[24]. Qm为饱和吸附量,KL为Langmuir 等温线方程的常数.
采用公式(1)计算土霉素的固相浓度,采用Linear模型(式2)、Freundlich等温线方程公式(3)和Langmuir等温线方程公式(4)对土霉素在土壤上吸附的数据进行拟合. 所有实验数据采用Origin 2023b软件进行分析与处理.
-
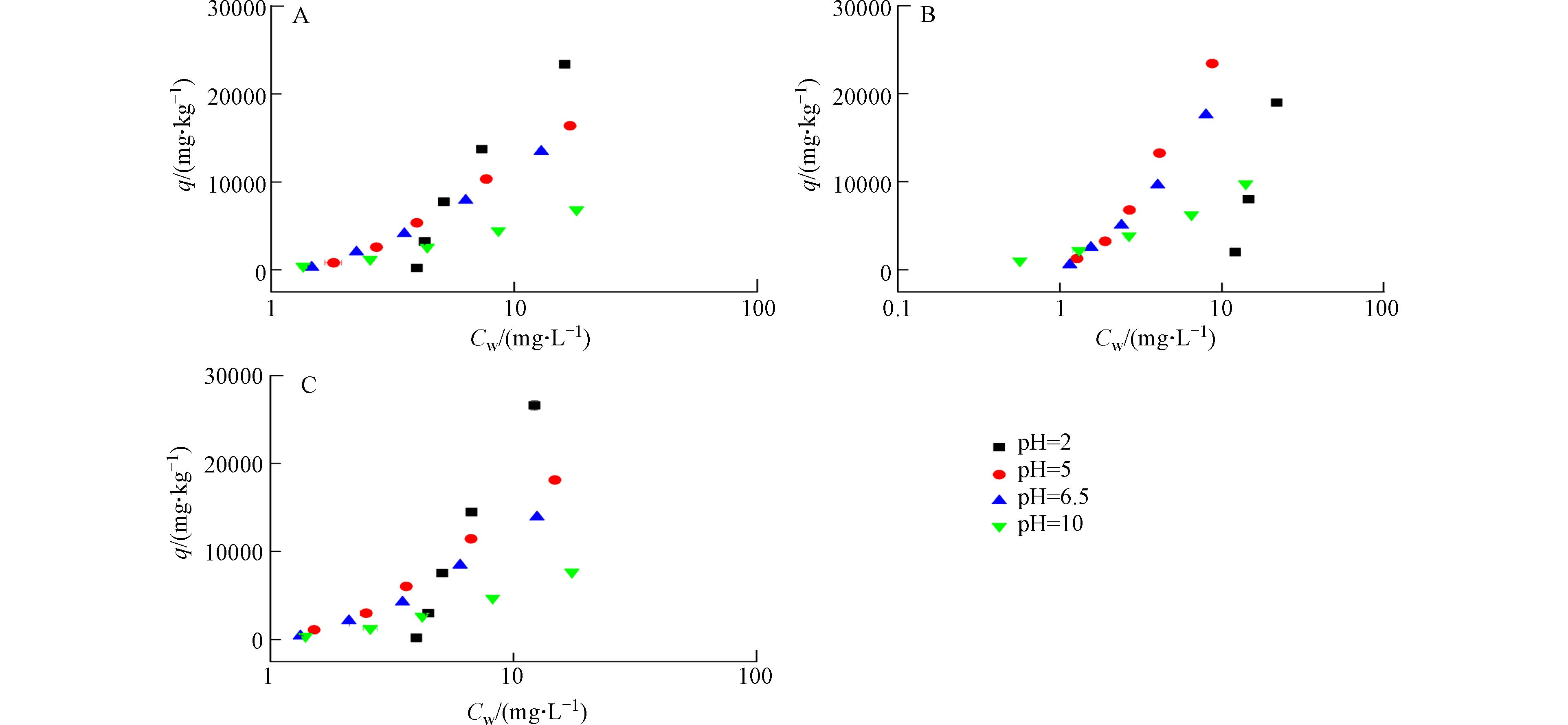
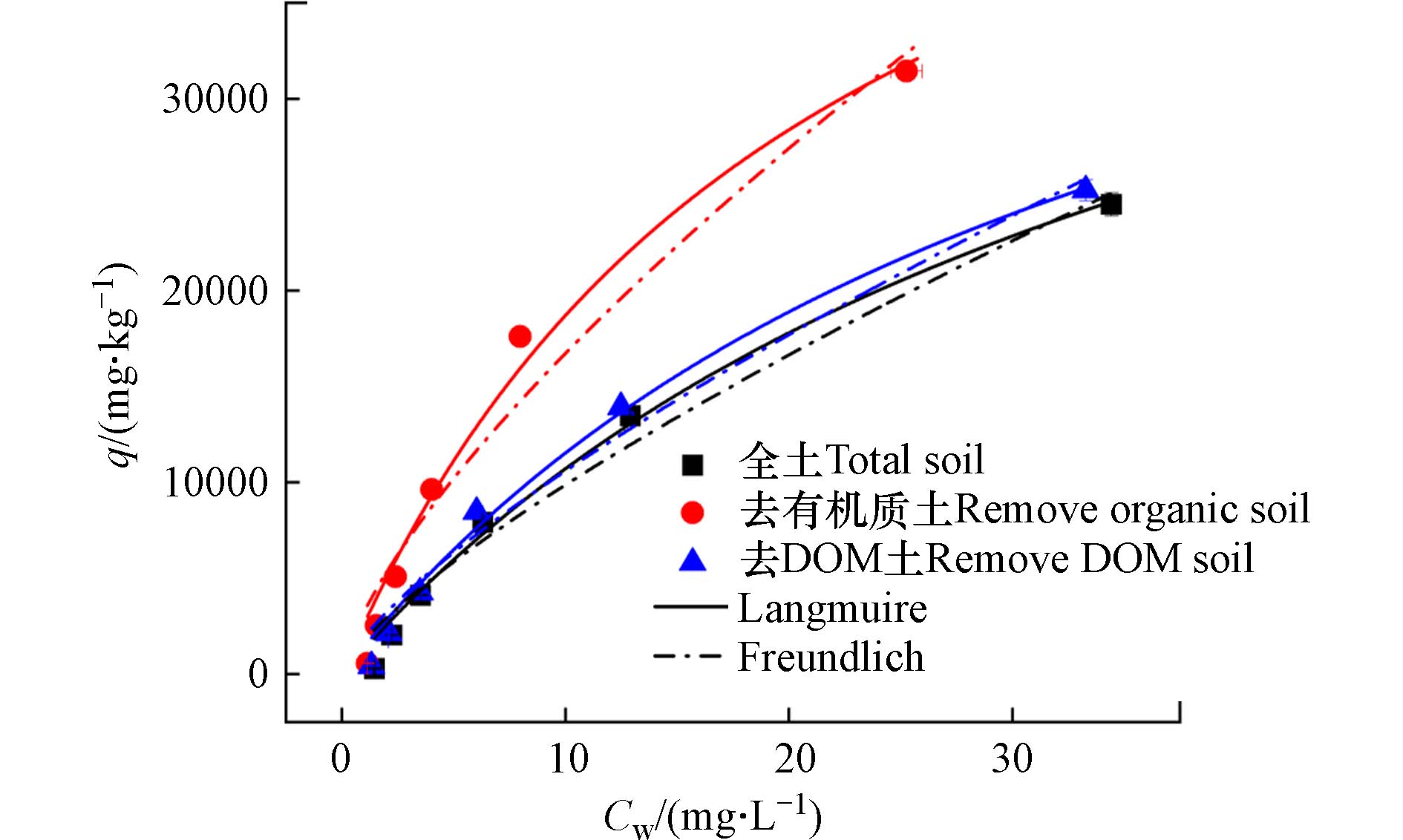
图1是OTC在土壤不同组分上的吸附. 随着OTC初始浓度的增加,OTC在土壤不同组分上的吸附量增加,并且去有机质土对OTC吸附高于全土和去DOM土. 吸附数据用Langmuir等温线方程和Freundlich等温线方程拟合,拟合参数见表2,因此OTC在土壤上既有单层吸附又有多层吸附. Zhang等[21]关于沉积土的不同有机质组分对OTC的研究表明,土壤对OTC的等温吸附可以用Langmuir方程和Freundlich等温线方程拟合. Freundlich等温线方程拟合参数n < 1,土壤不同组分对OTC的吸附为非线性,从Kf看去有机质土对OTC吸附最高. Langmuir等温线方程拟合参数Qm为饱和吸附量,土壤不同组分饱和吸附量差异不大. 土壤不同组分对OTC的吸附的实验数据显示的最大吸附量均未达到Qm.
从图1可知,去有机质土对OTC吸附高于全土对OTC吸附. 与之类似,PILS等[25]对土壤黏土、有机质、黏土-有机质吸附抗生素的研究结果表明,四环素类的季铵官能团带正电荷可以通过阳离子交换与土壤和有机质的负电荷位点相互作用,并且四环素类带负电荷的三羰基甲烷酮-烯醇部分通过阳离子桥接与土壤和有机质的负电荷位点相互作用. 有机质存在会掩蔽四环素的吸附位点或抑制四环素的层间扩散,有机质存在抑制黏土对OTC吸附[25].
-
表3是在不同pH值对土壤不同组分吸附OTC的等温方程参数. 从表3可以看出,全土和去DOM土的KD值随着pH的升高而降低;去有机质土的KD值随着pH的升高,先增加再减少;随着pH增加土壤不同组分对OTC吸附的Kf 值都是先增加后降低,pH为10的时候最低. OTC在吸附级分上的pH依赖性吸附特征可能与OTC的形态和吸附量跟表面电荷有关[21]. 从图2得出,随着OTC初始浓度的增加,土壤不同组分在不同pH影响下对OTC的吸附量增加,并且全土和去DOM土随着pH升高而降低,去有机质土随着pH升高,先增加后再减少.
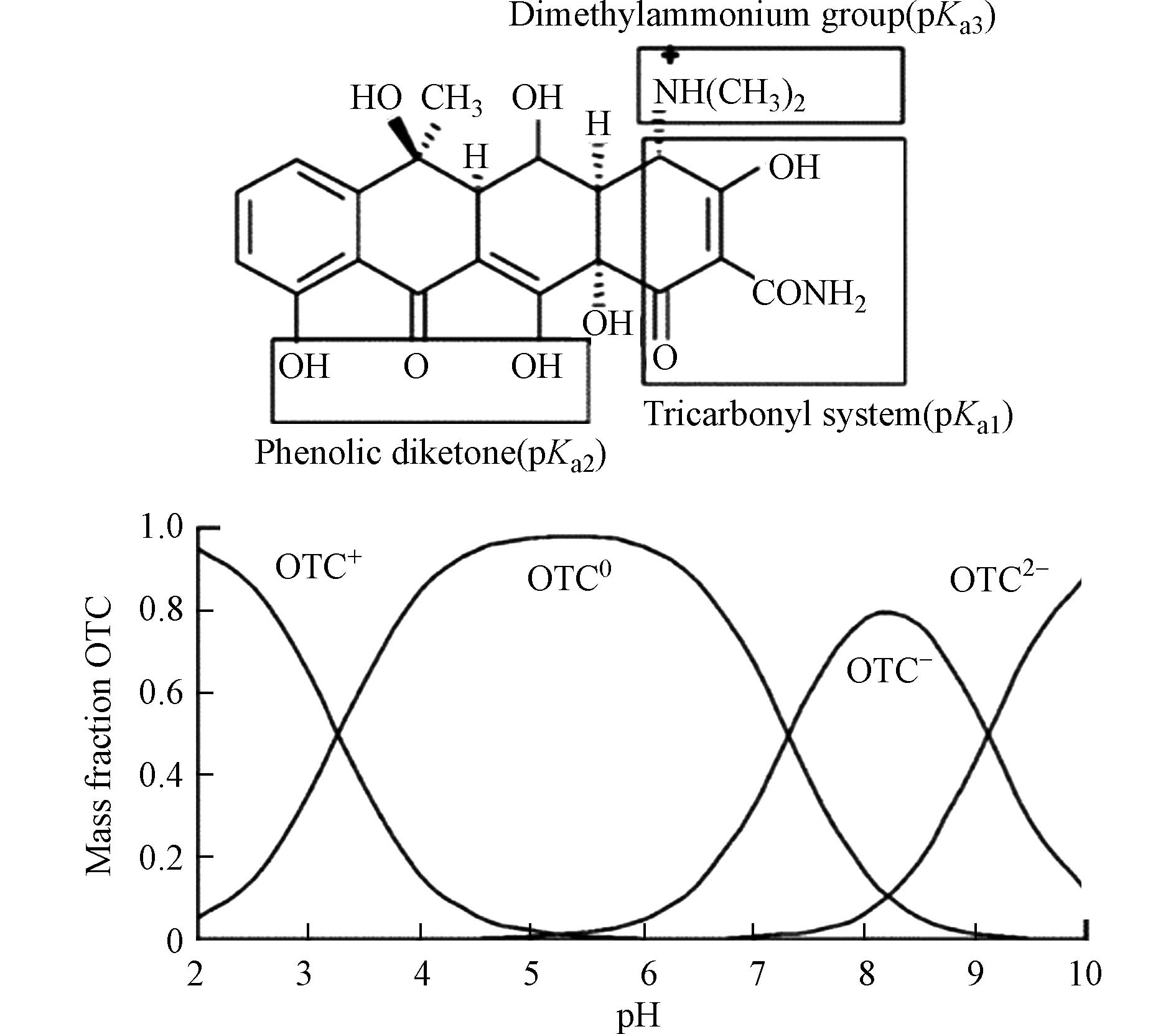
一般而言,OTC的离子形式受溶液pH值影响(图2)[15]. 从图2可知,当pH 2时,全土和去DOM土对OTC的吸附最强,而此时OTC主要以OTC+的形式存在(图3),可能是全土和去DOM土中有机质的羧基与其发生阳离子交换[26]. Kulshrestha等[15]对OTC在黏土和有机质中的分子相互作用的研究表明,低pH值时黏土与OTC的主要作用机制为阳离子交换. pH 2时去DOM土的KD值高于全土的KD值,可能是DOM存在而抑制土壤对OTC吸附,由于DOM覆盖在OTC表面,改变OTC表面性质,进而影响了吸附[16]. 研究表明高含量DOM存在,可以抑制黏土对OTC吸附[15].
从表2可知,在pH为5和6.5的时候,去有机质土吸附OTC的能力高于全土和去DOM土,可能是土壤中的无机矿物质与OTC发生了络合作用,也可能是土壤矿物中金属离子与四环素分子中的羟基、羰基和氨基等官能团螯合. pH为5和6.5时OTC主要以OTC0和OTC-的形式存在(图3),此时土壤与OTC之间是以疏水作用为主. Kulshrestha等[15]对OTC在黏土和有机质中的分子相互作用的研究,也指出pH为5时主要为疏水作用. Du等[13]研究发现,pH为4.5时四环素分子A环(pKa1=3.3)的羰基和氨基与黏土表面可以发生强烈的络合作用.
在pH为10的时候土壤不同组分对OTC的吸附都是最低(图2),此时OTC主要以OTC2-的形式存在,OTC与土壤表面带着相同的负电荷,发生静电斥力,因此吸附量下降. Liu等[27]研究OTC在有机质上的吸附,说明了pH大于pKa3(9.44)时,主要机制为静电斥力.
-
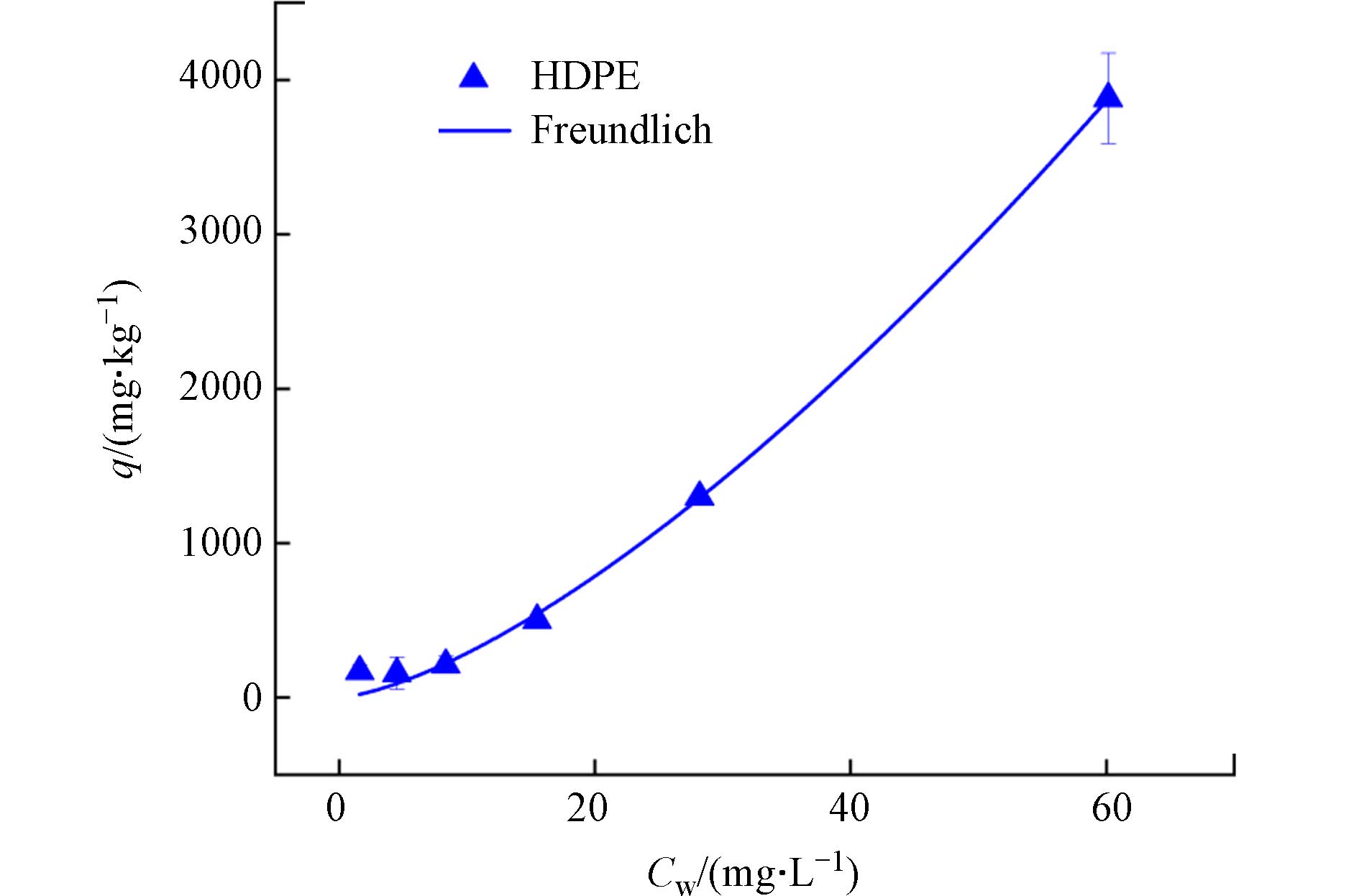
图4是HDPE对OTC的吸附曲线. HDPE对OTC的吸附量随着OTC初始浓度的增加而增加. OTC在HDPE微塑料的Freundlich等温线方程的参数见表4. 从表4可以看出,微塑料对OTC的吸附不强. 郭梦函[29]的研究表明四环素的阴离子会与带负电的微塑料产生静电斥力,从而抑制微塑料对四环素的吸附.
研究表明,在pH值为5时,微塑料表明带负电,且随pH值增加而电负性增加[28]. 本研究实验体系pH为6.5,说明HDPE表面带负电[30], OTC主要为中性,少部分为负电,且存在少量的H+离子,主要与带负电荷的微塑料发生静电作用为主,但是OTC中的阴离子与带负电HDPE相互竞争在溶液中少量H+的吸附. 由于H+为少数,故HDPE对OTC吸附量较低. 且HDPE非极性与OTC疏水性相斥[31],也造成吸附不强的原因之一.
在图5是HDPE吸附OTC前后对比的红外光谱图,2000—
3000 cm−1之间峰都没有发生变化,说明主要C=C没有变化. 而1467.44 、1376.62 、717.66 cm−1,与吸附后HDPE之间变化,移动到了1468.08 、1377.42 、717.62 cm−1,属于HDPE的C—H弯曲振动,表明了存在氢键作用. 故推测HDPE微塑料对OTC吸附机理主要为静电作用、氢键作用和疏水作用. -
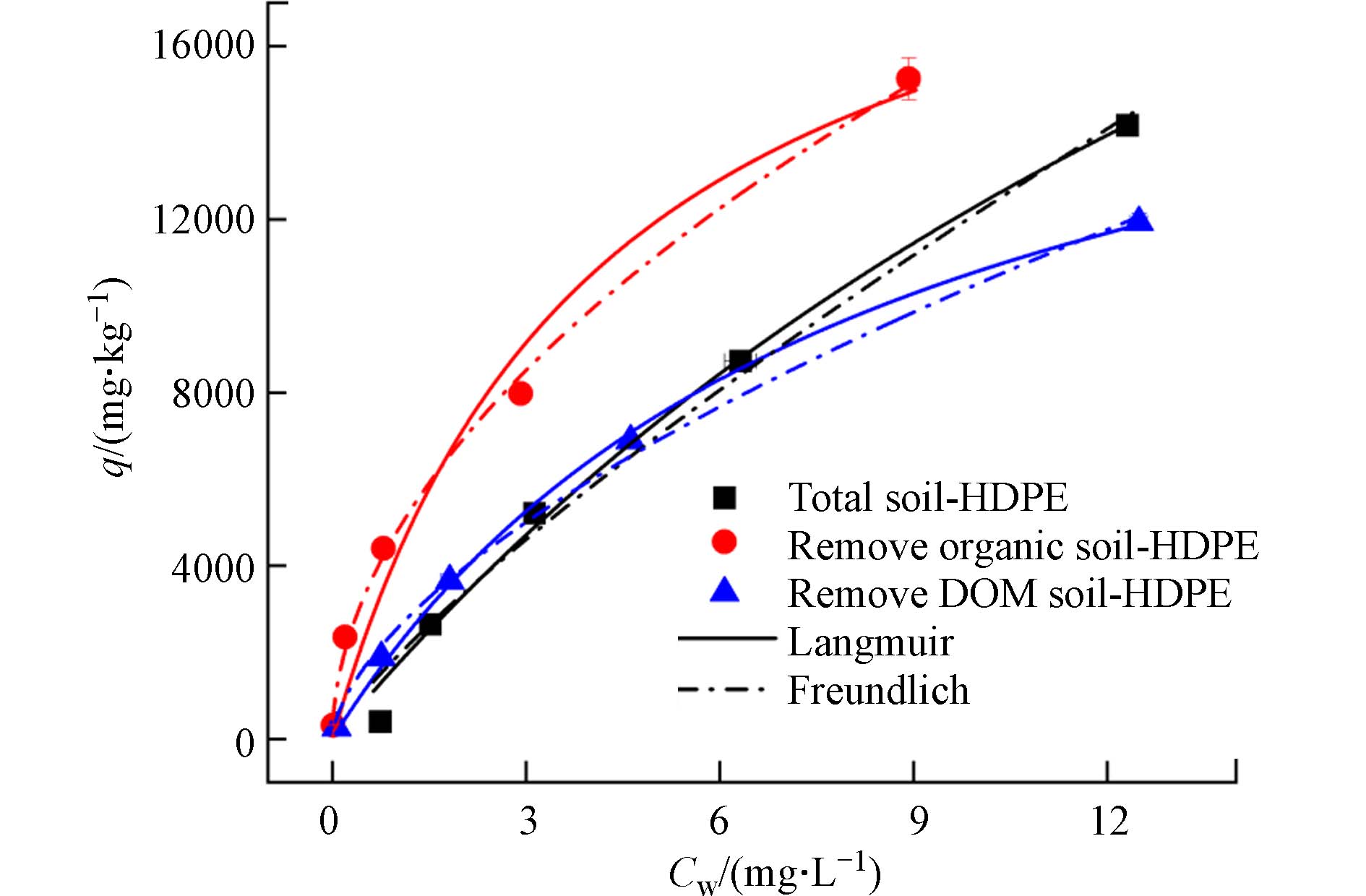
图6是HDPE影响下土壤不同组分对OTC吸附. 从图6可以看出,土壤对OTC的吸附随着OTC浓度增加而增加. 对实验数据使用Freundlich和 Langmuir拟合,参数见表4. HDPE和土壤共存时,对OTC的吸附既存在单层吸附,也存在多层吸附. 其中,与单一全土吸附OTC相比,可知HDPE使全土对OTC的吸附增加,而饱和吸附量却下降了;HDPE使去有机质土和去DOM土对高浓度OTC的吸附能力降低,饱和吸附量降低. 因此HDPE抑制去有机质土和去DOM土对OTC的吸附.
Li等[32]研究了微塑料对OTC在桑迪土壤中迁移性影响,认为当OTC浓度低时,因为溶液体积是固定的,OTC都可以被土壤吸附,且没有达到土壤对OTC饱和吸附量. 也就是说在达到土壤饱和量之前,土壤对OTC吸附大于土壤和微塑料的混合,而达到饱和量之后,增加微塑料比例会降低对OTC的吸附量. 这与实验结果不同,图1与图6对比,发现全土-HDPE对OTC的吸附量大于全土对OTC吸附量. 说明全土与HDPE对OTC吸附发生“叠加效应”. 与之相似的,Hu等[33]研究表明,随着微塑料添加量的增加土壤对17β-雌二醇的吸附能力显著升高. 有研究表明微塑料-土壤对污染物的吸附受到微塑料与污染物的亲和性[16]、污染物初始度等因素影响.
Li等[32]研究还表明,土霉素的扩散速度快,但其吸附量小,PA微塑料的存在使土壤颗粒内部孔隙数量减少,即微塑料占据了内部孔隙,抑制了OTC的吸附. 有研究表明,微塑料可以被土壤吸附[32 − 34],聚苯乙烯微塑料可以吸附到土壤上,并且吸附机制主要包括静电和疏水相互作用[34],土霉素也可以通过这两种吸附机制被土壤吸附[35]. 因此推测HDPE存在对OTC在全土吸附的饱和吸附量比没有微塑料影响的时候低,是由于微塑料的存在减少土壤含量,同时还微塑料占据土壤内部孔隙,进而抑制土壤对OTC吸附. 故HDPE影响下土壤对OTC吸附主要机理是疏水作用、静电作用.
图6中在OTC初始浓度为32 mg·L−1,与单一存在去有机质土和去DOM土相比,HDPE存在下去有机质土和去DOM土对OTC的吸附降低. 说明了在土壤吸附位点接近饱和情况下,微塑料的存在,降低了土壤对OTC的吸附量. 其原因可能是土壤在吸附高浓度OTC时,土壤达到饱和吸附量,此时OTC与微塑料共同竞争土壤有限吸附位点,有研究显示微塑料可以被土壤吸附[32 − 34],微塑料占据了内部孔隙,减少了土壤对OTC吸附点位. 李嘉等[2]研究微塑料对土壤吸附土霉素,表明了向土壤中添加微塑料(质量分数10%)可抑制土壤对OTC的吸附. 前文“2.2”表明去有机质土对OTC吸附机理为络合作用、疏水作用、静电作用;且HDPE对OTC吸附是很低的. 由此可推测HDPE影响去有机质土对OTC被抑制原因是HDPE存在降低去有机质土含量,使得与OTC产生络合物减少. 而HDPE影响去DOM土对OTC被抑制原因是HDPE存在降低去DOM土含量,减少对OTC吸附.
-
从“2.2”的分析可知,pH为2,土壤对OTC的吸附机理主要为阳离子交换,pH为5、6.5、10,吸附主要机理为疏水作用、静电作用. HDPE对OTC主要机理为静电作用、氢键作用.
在微塑料、土壤不同组分和OTC的三元体系中,土壤可以直接与微塑料竞争吸附OTC,土壤的吸附位点又可以被微塑料与OTC竞争占据;微塑料既可以占据土壤表面改变表面性质,又可以进入土壤内部孔隙减少土壤吸附位点[32];且OTC多官能团的性质,导致OTC可以与吸附剂发生多种反应. 故两两之间存在一定竞争关系,导致HDPE影响下土壤对OTC的饱和吸附量下降. 对比图1与图6可以看出,HDPE促进不同土壤组分对低浓度OTC的吸附. 分析可能有以下两点:一是在三元体系中,疏水的HDPE覆盖到土壤表面改变土壤性质,促进了土壤对OTC的吸附;二是HDPE与OTC的氢键作用,使得微塑料与土壤发生“叠加效应”. HDPE抑制土壤不同组分对高浓度OTC的吸附. 主要原因是土壤的“稀释效应”和微塑料可以进入土壤内部与OTC竞争吸附位点.
从图6中可以得到HDPE影响下,土壤对OTC吸附量大小为:去有机质土>全土>去DOM土. 图1中土壤对OTC吸附量大小为,去有机质土>去DOM土>全土,有机质存在抑制了土壤对OTC吸附,HDPE影响下DOM促进土壤对OTC吸附. 有研究表明,DOM可以与重金属竞争微塑料上的吸附位点;DOM可以覆盖在微塑料表面改变其表面电荷和疏水性;DOM存在多种官能团可以与金属发生络合反应进而影响重金属在微塑料的吸附[16]. 可能是DOM覆盖在HDPE表面,改变HDPE表面性质和疏水性,促进HDPE对OTC的吸附[36]. DOM具有亲水基团与疏水基团,使得DOM 对 TC 具有良好亲和力,形成稳定的 TC-亲水性 DOM 或 TC-疏水性 DOM 复合物,促进土壤对OTC的吸附[37]. 故HDPE存在的时候,去DOM土对OTC吸附量低于全土. 而 HDPE的存在的时候,全土对OTC吸附量低于去有机质土的主要原因是有机质会掩蔽四环素的吸附位点或抑制四环素的层间扩散[24]. HDPE的存在,有机质的掩蔽或抑制作用依旧存在.
-
1) OTC在土壤不同组分上的吸附和在土壤-HDPE上的吸附都可以用Freundlich和Langmuir拟合,因此既有单层吸附又有多层吸附. 吸附趋势都是随着OTC浓度增加而吸附量增加. 土壤中有机质可以抑制土壤对OTC吸附.
2) pH值对土壤吸附OTC影响大,在pH为2时吸附机理是阳离子交换作用,pH为5和6.5时吸附机理是络合作用和疏水作用,pH为10时吸附机理是静电作用.
3) OTC为低浓度时,HDPE促进土壤不同组分吸附OTC;而OTC为高浓度时,HDPE抑制去有机质土、去DOM土吸附OTC. 微塑料存在,会影响土壤纯度,进而降低土壤对高浓度的OTC吸附.
微塑料影响土壤不同组分吸附土霉素,并且此过程受环境的综合因素影响. 环境中还存在多种微塑料和多种抗生素,因此还需要大量实验了解微塑料、土壤与抗生素之间的交互作用,为抗生素在环境中的迁移转化提供理论支持,同时也为改善土壤环境做出贡献.
微塑料对寒地黑土不同组分吸附土霉素的影响
Research on the effect of microplastics on the adsorption of oxytetracycline in cold black soil
-
摘要: 微塑料污染问题近年来受到广泛关注. 土壤中的微塑料可以吸附环境中的污染物,与土壤的不同组分共存,进而影响污染物在土壤环境中的迁移转化. 本研究选取高密度聚乙烯(HDPE)为模型微塑料,研究寒地黑土不同组分对土霉素(oxytetracycline,OTC)的吸附,探讨不同pH对寒地黑土不同组分吸附OTC的影响,探究HDPE微塑料对土霉素的吸附,以及HDPE存在时寒地黑土对OTC的吸附,以期为研究微塑料对污染物在土壤环境中迁移转化的影响提供基础数据. 结果表明, 土霉素在土壤不同组分上的吸附可以用Freundlich和Langmuir拟合;土壤对土霉素的吸附机理受pH影响较大;HDPE微塑料对OTC吸附机理主要有静电作用、疏水作用;当微塑料存在时,去有机质土、去DOM土对高浓度的土霉素吸附降低.Abstract: The problem of microplastic pollution has attracted widespread attention in recent years. Microplastics in soil can adsorb pollutants in the environment and coexist with different components of soil, which in turn affects the migration and transformation of pollutants in the soil environment. In this investigation, high-density polyethylene (HDPE)was selected as model microplastics to study the adsorption of oxytetracycline (OTC) by different components of the cold black soil, the effects of different pH on the adsorption of OTC by different components in cold black soil, the adsorption of oxytetracycline by HDPE microplastics, and the adsorption effect of cold black soil on OTC in the presence of HDPE, with a view to provide basic data to study the effect of microplastics on the migration and transformation of pollutants in the soil environment. The results showed that: the adsorption of oxytetracycline on different fractions of soil can be fitted by Freundlich and Langmuir; the adsorption mechanism of oxytetracycline on soil is greatly affected by pH; the adsorption mechanism of HDPE microplastics on OTC is mainly electrostatic and hydrophobic; the adsorption of oxytetracycline at high concentration by de-organicized and de-DOM soils decreases when microplastics are present.
-
Key words:
- high-density polyethylene /
- oxytetracycline /
- adsorption /
- cold black soil.
-

-
表 1 供试土壤理化性质
Table 1. Physicochemical properties of the tested soil
pH 有机质/(mg·g−1)
Organic matter碱解氮/(mg·kg−1)
Alkaline hydrolyzable nitrogen速效钾/(mg·kg−1)
Available potassium有效磷/(mg·kg−1)
Available phosphorus6.87 51.20 175.1 324.2 83.58 表 2 OTC在不同土壤组分上吸附的等温线方程拟合参数
Table 2. Parameters for fitting isotherm equations for OTC adsorption on different soil fractions
土壤
SoilLangmuir Freundlich Qm /(μg·g−1) KL/ (mL·μg−1) R2 Kf /(mg1–n·Ln·kg−1) n R2 全土 51594 ±4661 0.026±0.004 0.993 1732 ±2740.76±0.05 0.977 去有机质土 57705 ±5713 0.048±0.009 0.985 3227 ±5570.71±0.06 0.96 去DOM土 51450 ±4475 0.029±0.004 0.992 2012±286 0.73±0.04 0.98 表 3 pH值对土壤吸附OTC的Liner方程和Freundlich方程模拟
Table 3. Liner equation and Freundlich equation simulation of pH for soil adsorption of OTC
土壤类型 Freundlich Linear Kf /(mg1–n·Ln·kg−1) n R2 KD R2 全土 pH=2 918±444 1.2±0.2 0.873 1418 ±1200.939 pH=5 1489 ±3260.86±0.09 0.954 1036 ±540.976 pH=6.5 1108 ±2160.99±0.08 0.970 1075 ±410.987 pH=10 740±119 0.78±0.06 0.972 431±22 0.975 去有机质土 pH=2 4±4 2.7±0.4 0.960 662±119 0.86 pH=5 2327 ±4391.08±0.09 0.963 2694 ±1170.983 pH=6.5 1819±277 1.1±0.08 0.976 2191 ±820.987 pH=10 1958±101 0.61±0.02 0.994 769±65 0.951 去DOM土 pH=2 554±281 1.56±0.21 0.917 1914±196 0.922 pH=5 2004±393 0.83±0.08 0.958 1316 ±670.977 pH=6.5 1380 ±2450.93±0.08 0.971 1165 ±440.989 pH=10 723±117 0.84±0.06 0.975 472±21 0.961 表 4 OTC在HDPE、土壤不同组分-HDPE混合的吸附等温线方程拟合参数
Table 4. Parameters of adsorption isotherm equation fitting of OTC on HDPE、soil different components-HDPE mixture
类型 Langmuir Freundlich Qm /(μg·g−1) KL/ (mL·μg−1) R2 Kf /(mg1–n·Ln·kg−1) n R2 HDPE — — — 10±3 1.45±0.07 0.991 全土-HDPE 40304 ±6957 0.044±0.01 0.991 1897±208 0.81±0.05 0.985 去有机质土-HDPE 21932 ±2753 0.239±0.069 0.966 4776 ±1810.53±0.02 0.996 去DOM土-HDPE 19736 ±8260.121±0.010 0.997 2540 ±1220.62±0.02 0.996 注,—, 拟合失败. fitting failed -
[1] 陈永平, 姜璐, 许春阳, 等. 东中国海表层海水微塑料分布特征及其来源综述[J]. 海洋环境科学, 2023, 42(2): 315-325. CHEN Y P, JIANG L, XU C Y, et al. Distribution characteristics and sources of microplastics in surface seawater of the East China Sea[J]. Marine Environmental Science, 2023, 42(2): 315-325(in Chinese).
[2] 李嘉, 余松国, 沈林恩, 等. 微塑料对土壤吸附土霉素的影响初探[J]. 环境化学, 2021, 40(10): 3133-3143. doi: 10.7524/j.issn.0254-6108.2020101504 LI J, YU S G, SHEN L E, et al. Influence of microplastics on sorption behaviors of oxytetracycline onto soils: A preliminary study[J]. Environmental Chemistry, 2021, 40(10): 3133-3143(in Chinese). doi: 10.7524/j.issn.0254-6108.2020101504
[3] 鄢紫薇. 微塑料和秸秆输入对黄棕壤和潮土中温室气体排放及氮淋溶比较研究[D]. 武汉: 华中农业大学, 2022. YAN Z W. Comparative stduy on greenhouse gas emission and nitrogen leaching in yellow brown soil and fluvo-aquic soil by microplastics and straw input[D]. Wuhan: Huazhong Agricultural University, 2022(in Chinese).
[4] CAO Y X, MA X Y, CHEN N, et al. Polypropylene microplastics affect the distribution and bioavailability of cadmium by changing soil components during soil aging[J]. Journal of Hazardous Materials, 2023, 443: 130079. doi: 10.1016/j.jhazmat.2022.130079 [5] KOLANDHASAMY P, SU L, LI J N, et al. Adherence of microplastics to soft tissue of mussels: A novel way to uptake microplastics beyond ingestion[J]. Science of the Total Environment, 2018, 610/611: 635-640. doi: 10.1016/j.scitotenv.2017.08.053 [6] ANASTOPOULOS I, PASHALIDIS I, KAYAN B, et al. Microplastics as carriers of hydrophilic pollutants in an aqueous environment[J]. Journal of Molecular Liquids, 2022, 350: 118182. doi: 10.1016/j.molliq.2021.118182 [7] JONES A D, BRULAND G L, AGRAWAL S G, et al. Factors influencing the sorption of oxytetracycline to soils[J]. Environmental Toxicology and Chemistry, 2005, 24(4): 761-770. doi: 10.1897/04-037R.1 [8] LUO Y, XU L, RYSZ M, et al. Occurrence and transport of tetracycline, sulfonamide, quinolone, and macrolide antibiotics in the Haihe River Basin, China[J]. Environmental Science & Technology, 2011, 45(5): 1827-1833. [9] 徐惟馨, 夏静静, 韦芸, 等. 红外光谱对牛预混料中违禁添加盐酸土霉素的快速定量[J]. 光谱学与光谱分析, 2023, 43(3): 842-847. XU W X, XIA J J, WEI Y, et al. Rapid determination of oxytetracycline hydrochloride illegally added in cattle premix by ATR-FTIR[J]. Spectroscopy and Spectral Analysis, 2023, 43(3): 842-847(in Chinese).
[10] 黄慧婷, 李艳花, 汤贺尧, 等. 氮氧双掺杂多孔碳对四环素的电吸附及其机制[J]. 环境化学, 2024, 43(3): 1035-1046. doi: 10.7524/j.issn.0254-6108.2023080707 HUANG H T, LI Y H, TANG H Y, et al. The electro-adsorption of nitrogen and oxygen co-doped porous carbon for tetracyline and its mechanism[J]. Environmental Chemistry, 2024, 43(3): 1035-1046(in Chinese). doi: 10.7524/j.issn.0254-6108.2023080707
[11] 沈箭飞, 陈冬, 陈天虎, 等. 天然黑钨矿应用于光催化降解土霉素[J]. 过程工程学报, 2023, 23(4): 580-589. SHEN J F, CHEN D, CHEN T H, et al. Wolframite was applied to photocatalytic degradation of oxytetracycline[J]. The Chinese Journal of Process Engineering, 2023, 23(4): 580-589(in Chinese).
[12] 司静宜, 洪亚军, 夏鹏, 等. 我国土霉素的淡水生物水质基准与标准及生态风险评估研究[J]. 环境科学研究, 2023, 36(2): 403-413. SI J Y, HONG Y J, XIA P, et al. Water quality criteria/standards and ecological risk assessment of oxytetracycline for freshwater organisms in China[J]. Research of Environmental Sciences, 2023, 36(2): 403-413(in Chinese).
[13] DU H H, DU J W, LIU F Y, et al. Binding of tetracycline on soil phyllosilicates with Cd(II) as affected by pH and mineral type[J]. Journal of Soils and Sediments, 2021, 21(2): 775-783. doi: 10.1007/s11368-020-02867-x [14] LI Z J, QI W N, FENG Y, et al. Degradation mechanisms of oxytetracycline in the environment[J]. Journal of Integrative Agriculture, 2019, 18(9): 1953-1960. doi: 10.1016/S2095-3119(18)62121-5 [15] KULSHRESTHA P, GIESE R F J, AGA D S. Investigating the molecular interactions of oxytetracycline in clay and organic matter: Insights on factors affecting its mobility in soil[J]. Environmental Science & Technology, 2004, 38(15): 4097-4105. [16] 侯宇晴, 李冰, 王金花, 等. 微塑料与农田土壤中典型污染物的复合污染研究进展[J]. 环境科学,2024,45(2):1196-1209. 2023-10-20]. HOU Y Q, LI B, WANG J H, et al. Research progress on the combined pollution of microplastics and typical pollutants in agricultural soil[J]. Environmental Science,2024,45(2):1196-1209 (in Chinese).
[17] 于久茹, 王雪, 刘辉, 等. 温室大棚寒地黑土质量综合评价及安全性分析[J]. 吉林化工学院学报, 2022, 39(1): 29-34. YU J R, WANG X, LIU H, et al. Quality comprehensive evaluation and safety analysis of black soilin the cold area greenhouse[J]. Journal of Jilin Institute of Chemical Technology, 2022, 39(1): 29-34(in Chinese).
[18] 章明奎, 王丽平, 郑顺安. 两种外源抗生素在农业土壤中的吸附与迁移特性[J]. 生态学报, 2008, 28(2): 761-766. ZHANG M K, WANG L P, ZHENG S A. Adsorption and transport characteristics of two exterior-source antibiotics in some agricultural soils[J]. Acta Ecologica Sinica, 2008, 28(2): 761-766(in Chinese).
[19] 全国农业技术推广中心. 土壤分析技术规范[M]. 二版. 北京: 中国农业出版社, 2006. NATESC(Nation Agro-Tech Extension and Service Center). Soil analysis and technical specifications[M]. 2nd edition. Beijing: China Agriculture Press, 2006(in Chinese).
[20] 王令祥, 王玉军, 周东美, 等. 用Wien效应研究土壤有机质对阳离子与黄棕壤型水稻土黏粒相互作用的影响[J]. 土壤学报, 2012, 49(4): 716-724. WANG L X, WANG Y J, ZHOU D M, et al. Effects of organic matter on interactions between cations and clay particles in paddy soil of yellow-brown soil based on Wien effect[J]. Acta Pedologica Sinica, 2012, 49(4): 716-724(in Chinese).
[21] ZHANG D, YANG S K, WANG Y N, et al. Adsorption characteristics of oxytetracycline by different fractions of organic matter in sedimentary soil[J]. Environmental Science and Pollution Research, 2019, 26(6): 5668-5679. doi: 10.1007/s11356-018-4028-1 [22] CURTIN D, BEARE H M, CHANGTIGNY H M, et al. Controls on the extractability of soil organic matter in water over the 20 to 80°C temperature range[J]. Soil Science Society of America Journal, 2011, 75(4): 1423-1430. doi: 10.2136/sssaj2010.0401 [23] 邹继颖, 刘辉, 吕逸寒, 等. 微塑料对抗生素的吸附研究[J]. 吉林化工学院学报, 2021, 38(1): 90-94. ZOU J Y, LIU H, LU Y H, et al. Adsorption of antibiotics by microplastics[J]. Journal of Jilin Institute of Chemical Technology, 2021, 38(1): 90-94(in Chinese).
[24] 邹继颖. 微塑料对典型有机污染物和重金属离子的吸附及机理研究[D]. 长春: 东北师范大学, 2021. ZOU J Y. Research on sorption and mechanism of typical organic pollutants and heavy metal ions by microplastics[D]. Changchun: Northeast Normal University, 2021(in Chinese).
[25] PILS J R V, LAIRD D A. Sorption of tetracycline and chlortetracycline on K- and Ca-saturated soil clays, humic substances, and clay−humic complexes[J]. Environmental Science & Technology, 2007, 41(6): 1928-1933. [26] GU C, KARTHIKEYAN K G. Sorption of the antibiotic tetracycline to humic-mineral complexes[J]. Journal of Environmental Quality, 2008, 37(2): 704-711. doi: 10.2134/jeq2007.0030 [27] LIU X H, ZHANG H B, LOU Y M, et al. Sorption of oxytetracycline in particulate organic matter in soils and sediments: Roles of pH, ionic strength and temperature[J]. Science of the Total Environment, 2020, 714: 136628. doi: 10.1016/j.scitotenv.2020.136628 [28] KONG W D, LI C G, DOLHI J M, et al. Characteristics of oxytetracycline sorption and potential bioavailability in soils with various physical–chemical properties[J]. Chemosphere, 2012, 87(5): 542-548. doi: 10.1016/j.chemosphere.2011.12.062 [29] 郭梦函. 抗生素在微塑料上的吸附行为及其相关毒性研究[D]. 西安: 西安理工大学, 2020. GUO M H. Study on the adsorption behavior and related toxicity of antibiotics on microplastics[D]. Xi’an: Xi’an University of Technology, 2020(in Chinese).
[30] ZOU J Y, LIU X P, ZHANG D M, et al. Adsorption of three bivalent metals by four chemical distinct microplastics[J]. Chemosphere, 2020, 248: 126064. doi: 10.1016/j.chemosphere.2020.126064 [31] ZHUANG S T, WANG J L. Interaction between antibiotics and microplastics: Recent advances and perspective[J]. Science of the Total Environment, 2023, 897: 165414. doi: 10.1016/j.scitotenv.2023.165414 [32] LI J, GUO K, CAO Y S, et al. Enhance in mobility of oxytetracycline in a sandy loamy soil caused by the presence of microplastics[J]. Environmental Pollution, 2021, 269: 116151. doi: 10.1016/j.envpol.2020.116151 [33] HU B Y, LI Y X, JIANG L S, et al. Influence of microplastics occurrence on the adsorption of 17β-estradiol in soil[J]. Journal of Hazardous Materials, 2020, 400: 123325. doi: 10.1016/j.jhazmat.2020.123325 [34] LUO Y Y, ZHANG Y Y, XU Y B, et al. Distribution characteristics and mechanism of microplastics mediated by soil physicochemical properties[J]. Science of the Total Environment, 2020, 726: 138389. doi: 10.1016/j.scitotenv.2020.138389 [35] LI J, ZHANG H. Adsorption-desorption of oxytetracycline on marine sediments: Kinetics and influencing factors[J]. Chemosphere, 2016, 164: 156-163. doi: 10.1016/j.chemosphere.2016.08.100 [36] ATUGODA T, WIJESEKARA H, WERELLAGAMA D R I B, et al. Adsorptive interaction of antibiotic ciprofloxacin on polyethylene microplastics: Implications for vector transport in water[J]. Environmental Technology & Innovation, 2020, 19: 100971. [37] WANG C Q, XU H, CHENG T F, et al. Affinity-based alleviation of dissolved organic matter (DOM) on tetracycline toxicity to photosynthesis of green algae Chlorella vulgaris: Roles of hydrophilic and hydrophobic DOM[J]. Environmental Science and Pollution Research, 2023, 30(14): 42165-42175. doi: 10.1007/s11356-023-25201-7 -



 下载:
下载: