-
环境DNA(environmental deoxyribonucleic acid,eDNA)是指由活细胞分泌的或已经死亡的生物释放出的DNA[1],可在环境中较为持续地存在. 环境中的微生物可以利用DNA降解酶将eDNA分解成游离态[2],作为C、P、O等元素的营养来源[3],维持自身的新陈代谢. 同时,eDNA作为胞外遗传物质,能够参与基因传递和水平转移过程[4]. 更重要的是,eDNA是抗生素抗性基因(Antibiotic resistance genes,ARGs)的重要载体[5],编码ARGs的eDNA在环境中的广泛存在和迁移会增强致病菌的耐药性[6],对环境和人体造成严重威胁.
生物炭是一种优良的碳基吸附剂材料,Hale等[7 − 8]用生物炭对土壤环境中的eDNA进行提取. 有学者研究了生物炭与eDNA之间的相互作用,Fang等[9]研究表明,eDNA与生物炭之间的静电作用和π-π作用[10]是主要的吸附作用机制. Lian等[11]发现,纳米生物炭与ARGs之间不仅存在吸附,还会造成eDNA的损伤,从而对ARGs的复制产生影响. 石墨、碳纳米管也是碳基材料的重要组成部分. 由于碳基材料的施用日益增加,其不可避免地释放到生态系统中,势必会介入eDNA的环境行为. 碳管具有高疏水性,进入水体环境后很容易聚集并且沉降. 而经历环境老化的碳管能够较为稳定地悬浮,使其携带的污染物更加容易地在环境中迁移转化[12],因而环境风险大大提高. 此前对eDNA在土壤胶体[13]和天然矿物[14]上的吸附研究已较为完善,但关于石墨、碳管等碳基材料吸附eDNA的研究有所欠缺,碳基纳米材料悬浮状态如何影响eDNA的吸附也尚不清楚.
本研究采用不同尺寸的石墨、不同功能化碳管为吸附剂,hsDNA为吸附质,探究了上述碳基材料对eDNA的吸附行为. 主要关注pH对碳基材料吸附hsDNA的影响,进一步解释了主要吸附机理;利用超声手段模拟实际环境中碳管的悬浮,描述了hsDNA在碳管悬浮及吸附中的作用.
-
hsDNA购买于Sigma-Aldrich公司(<50 bp);用于维持DNA构型的Tris(C4H11NO3)购买于德国BioFroxx公司,实验时需配制成0.01 mol·L−1的Tris-HCl背景液,本研究中的hsDNA溶液均溶解或稀释于此背景液中. 石墨化碳管(graphitized multiwall carbon tube,G-CNT)、羧基化碳管(carboxylated multiwall carbon tube,C-CNT)、羟基化碳管(hydroxylated multiwall carbon tube,H-CNT)购买于成都中科时代纳米有限公司;200目石墨(G200)、2000目石墨(G2000)购买于南京嘉慧碳素有限公司. 实验中的溶液均由超纯去离子水配制.
-
通过元素分析仪(vario MICRO cube,德国艾力蒙塔公司)测定碳材料的元素组成和含量;利用Zeta电位分析仪(Naobrook 90plus-PALS-ZETA,美国Bruker海文仪器有限公司)获取材料表面的带电情况;通过微孔材料分析仪测定(Autosorbiq-MP,美国康塔公司)材料的比表面积和孔径.
-
分别取100 mg的石墨或10 mg的碳管和40 mL浓度为40 mg·L−1,pH=7.0±0.2的DNA溶液于不同的40 mL棕色玻璃瓶中,在25 ℃、150 r·min−1的避光条件下振荡. 各实验组中hsDNA溶液体积均为40 mL;石墨吸附实验组中石墨用量均为100 mg;碳管吸附实验组中碳管用量均为10 mg. 在0.167、0.333、0.5、0.67、0.83、1.17、1.33、2、4、6、8、10、12、25.5、36、48 h时刻取样,过0.45 µm滤膜后在最大吸收波长259 nm[15]处用紫外-分光光度计测定上清液中hsDNA的浓度,计算吸附量,从而得到吸附动力学曲线.
配制pH=7.0±0.2浓度为120 mg·L−1的hsDNA母液,用Tris-HCl背景液稀释成20 mL的5、10、15、20、30、40、50、60 mg·L−1的目标hsDNA溶液. 将目标溶液分别与50 mg的石墨或5 mg的碳管进行混合,在25 ℃、150 r·min−1避光的条件下振荡48 h. 过0.45 µm滤膜后在最大吸收波长259 nm处用紫外-分光光度计测定上清液中hsDNA的浓度,计算吸附量,从而得到吸附等温线曲线.
-
分别取50 mg石墨或5 mg碳管于20 mL浓度为60 mg·L−1的hsDNA溶液中,调整pH分别为1.5、2、2.5、3、4、5、6、7、8. 在25 ℃、150 r·min−1避光的条件下振荡48 h. 取样过0.45 µm滤膜后在最大吸收波长259 nm处用紫外-分光光度计测定上清液中hsDNA的浓度,计算吸附量.
-
分别取50 mg的石墨或5 mg的碳管于20 mL棕色玻璃瓶中,加入pH=7.0±0.2浓度范围为5—60 mg·L−1的hsDNA溶液,利用细胞破碎仪以127.5 W的功率超声30 s. 将超声后的样品在25 ℃、150 r·min−1避光的条件下振荡48 h. 取样在800 nm[16]处用紫外-分光光度计测定吸光度,用于评估碳管的悬浮情况;样品过0.45 µm滤膜后在最大吸收波长259 nm处用紫外-分光光度计测定上清液中hsDNA的浓度,计算吸附量.
-
通过公式(1)、(2)计算hsDNA的平衡吸附量Qe(mg·g−1)和瞬时吸附量Qt(mg·g−1)
式中,Ce和Ct分别为溶液中hsDNA的平衡浓度(mg·L−1)和瞬时平衡浓度(mg·L−1),V为溶液的体积(L),m为碳基材料的用量(g),Qt为不同碳基材料对hsDNA在t时刻的瞬时吸附量.
利用伪一阶动力学模型和伪二阶动力学模型对hsDNA在5种不同碳基材料上的吸附动力学曲线进行拟合,动力学方程如下:
1)伪一阶反应速率方程:
2)伪二阶反应速率方程:
其中,Qe为不同碳基材料对hsDNA的平衡吸附量(mg·g−1);k1和k2分别为伪一阶动力学的速率常数(min−1)和伪二阶动力学的速率常数(g·(mg·min−1)).
利用Langmuir和Freundlich模型对吸附等温线数据进行拟合
1)Langmuir模型:
2)Freundlich模型:
其中,KL为与吸附能有关的Langmuir常数(L·mg−1);KF为Freundlich模型吸附系数(mg1-n·Ln·g−1);n为非线性指数;Qm为hsDNA的饱和吸附量(mg·g−1).
-
实验中所用的5种碳基材料的理化性质如表1所示. G200和G2000只含有C元素和极少量的O元素,G2000的含碳量和含氧量均高于G200. 对于不同的碳管,C-CNT和H-CNT在改性过程中引入了羧基和羟基,两种碳纳米材料的O含量和H含量均高于G-CNT. 在这3种碳管中,N元素和H元素最高的材料是H-CNT,C-CNT的O元素含量最高.
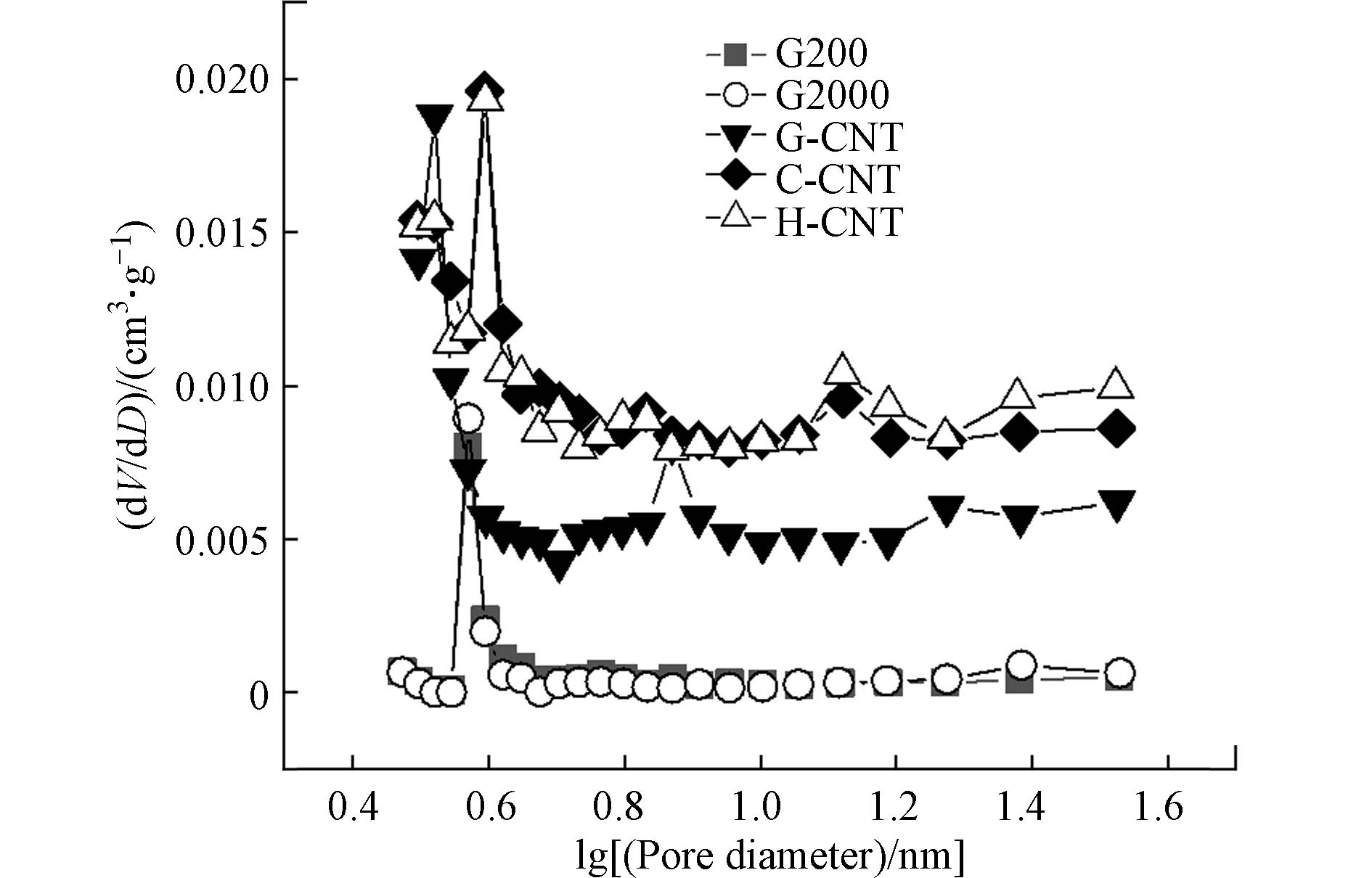
根据图1和表1可以看出,5种碳基材料的平均孔径相差不大,比表面积和总孔容均呈H-CNT>C-CNT>G-CNT>G2000>G200的顺序. 在pH=7.0±0.2的条件下,5种材料的表面都带有负电,带负电量从小到大的顺序为:G-CNT<H-CNT<G2000<C-CNT<G200. 由于G-CNT的表面几乎没有可电离的含氧官能团,电离能力差[17],其带负电量最小. C-CNT和H-CNT的表面分别带有羧基和羟基,这两种官能团的电离能力强[18],表面所带的负电荷均大于G-CNTs.
-
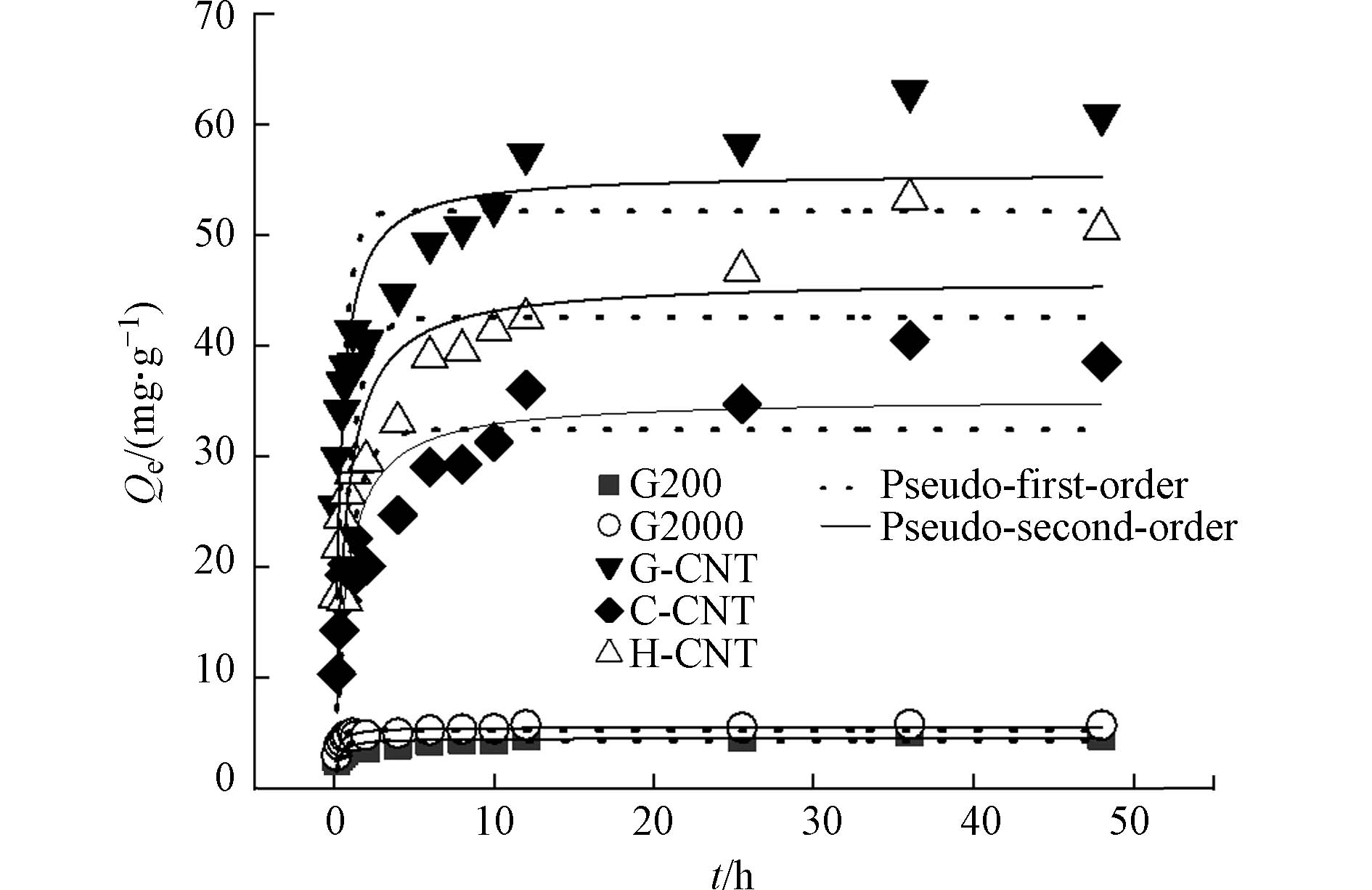
从图2可以看出,前1 h吸附量增加速度很快,而后吸附量增加速度减缓,在48 h达到吸附平衡. 吸附量从大到小的顺序为:G-CNT>H-CNT>C-CNT>G2000>G200. 吸附过程刚开始发生时,材料表面上的hsDNA浓度和液相环境中hsDNA的浓度差异大,因此hsDNA吸附的速度极快. 随着吸附过程的不断进行,材料表面的hsDNA浓度与液相环境中的hsDNA浓度差异不断变小,吸附速度也随之降低,最终在48 h达到吸附平衡.
通过伪一级模型和伪二级模型对吸附动力学数据进行拟合,拟合得到的参数如表2所示. 伪二级模型拟合出的R2高于伪一级模型,说明伪二级模型的可靠性更高,更适用于碳基材料对hsDNA的吸附,碳基材料对hsDNA的吸附主要是化学吸附. 石墨材料的k2高于碳管,说明吸附速率更快. 其原因在于石墨材料的比表面积小,吸附位点远远少于碳管,吸附会更快地达到吸附平衡. Roman等[19]研究甘氨酸在石墨和碳管上的吸附时发现石墨对甘氨酸的吸附作用明显弱于碳纳米管,与本实验一致.
-
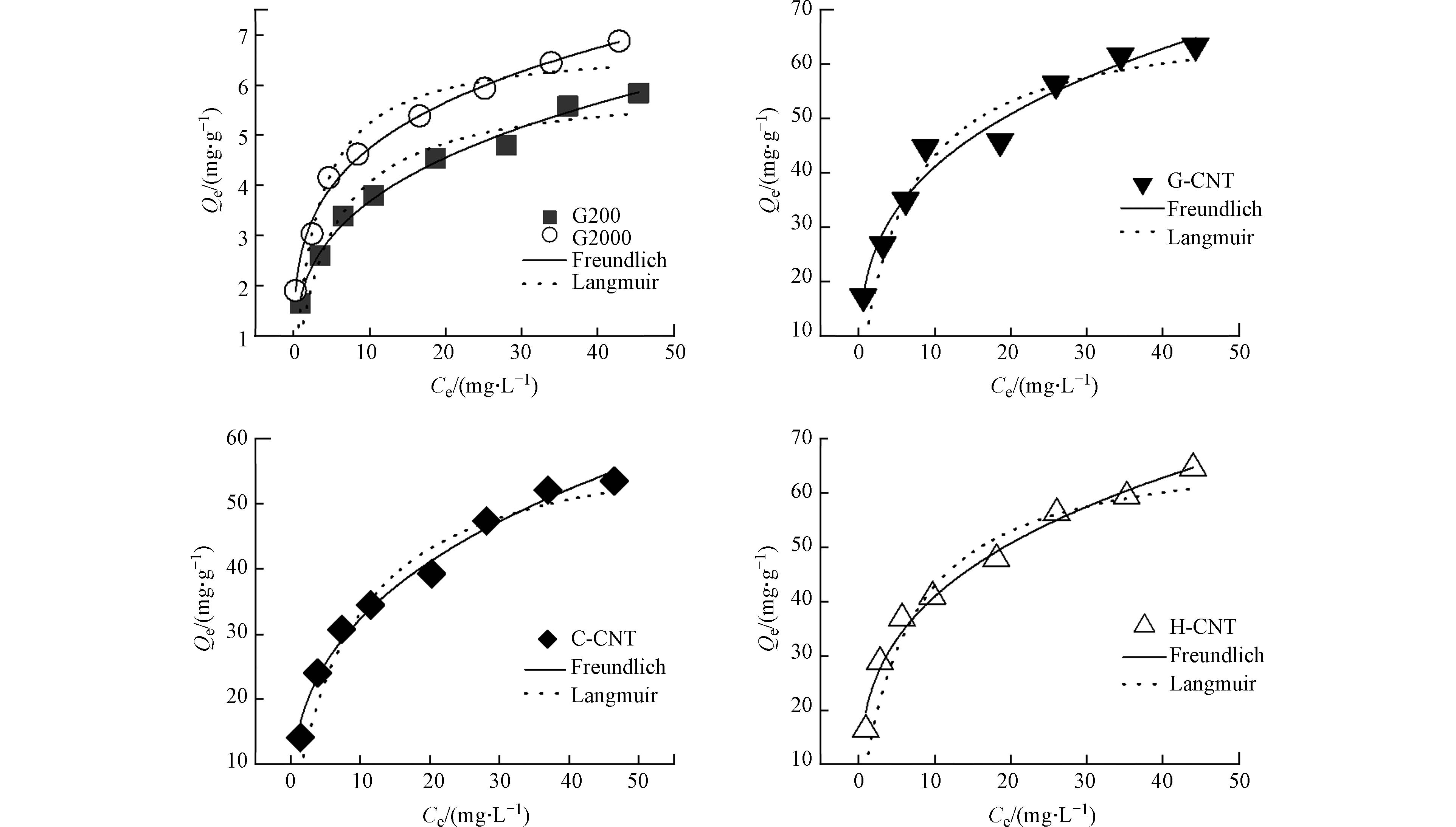
从图3可以看出,5种碳基材料对hsDNA的吸附量从高到低的顺序为:G-CNT> H-CNT> C-CNT>G2000>G200. 采用Freundlich模型和Langmuir模型对不同碳基材料吸附hsDNA数据进行拟合,结果如图3和表3所示. 从总体上看,碳管对hsDNA的吸附量比石墨高近1个数量级. 3种碳管中,G-CNT对hsDNA的最大吸附量(66.75 mg·g−1)高于C-CNT(58.31 mg·g−1)和H-CNT(65.34 mg·g−1). 2种石墨中,G2000对hsDNA的最大吸附量(6.80 mg·g−1)高于G200(6.01 mg·g−1). Freundlich模型拟合出的可决系数大于Langmuir模型,更适用于碳基材料对hsDNA的吸附体系,说明碳材料与hsDNA之间的吸附主要是非均质吸附过程. 一般来说,Freundlich吸附模型中的0<n<1时对吸附有利[20]. 根据拟合结果来看,不同碳基材料采用Freundlich吸附模型拟合出的n值均在0.1—0.5之间,这表示碳基材料对hsDNA之间的吸附作用是容易发生和进行的.
在pH=7.0±0.2时,材料的带负电量顺序从小到大的排序为:G-CNT、H-CNT、G2000、C-CNT、G200. 由于该pH条件下hsDNA带负电,材料也带负电,会产生静电斥力. 静电斥力越小,吸附量越大,除G2000外,其他4种材料的带负电量与吸附量从顺序相匹配. G2000表面所带负电荷比C-CNT少,但吸附量低于C-CNT,说明静电作用不是决定吸附的唯一因素,表面积[21]和孔径[22]也能对吸附过程产生影响. 5种碳基材料的比表面积和孔径大小顺序均为:H-CNT>C-CNT>G-CNT>G2000>G200. 除G-CNT外,其他4种材料的比表面积和孔径大小顺序与吸附量大小顺序相匹配. 比表面积和孔径越大,可用的吸附位点越多,吸附量越大. H-CNT的比表面积和孔径均大于G-CNT,对hsDNA的吸附量却低于G-CNT,说明静电作用对碳基材料吸附hsDNA的影响强于比表面积和孔径的影响. 疏水作用[23]也是影响吸附的重要原因,材料的含氧量顺序为C-CNT> H-CNT> G-CNT> G2000> G200. C-CNT和 H-CNT材料表面具有丰富含氧官能团,与水中的氢键作用强于与有机分子与含氧官能团之间的相互作用,吸附的水分子占据了部分吸附位点[24],因此降低了材料对hsDNA的吸附.
-
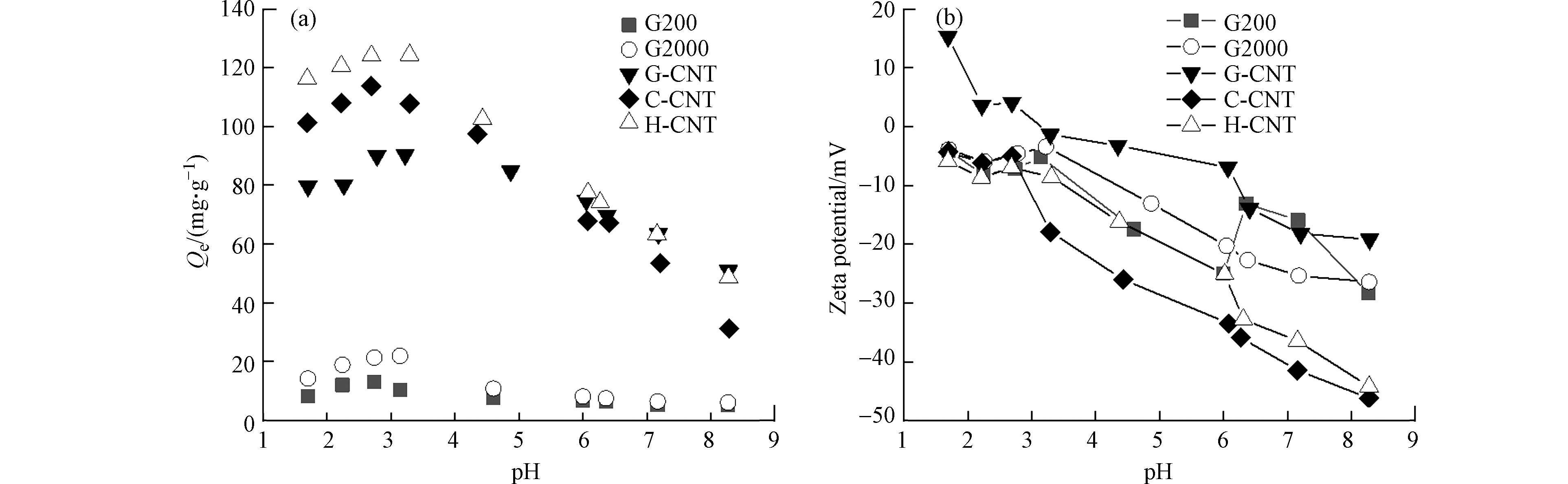
从图4(a)可以看出,在pH为1.5—8.5范围内,5种碳基材料对hsDNA的吸附量均呈现先升高后降低的现象,pH为3时吸附量达到最大值,与Sheng[25]和王慎阳[26]等的研究类似. 如图4(b)所示,随着pH的升高增加,碳基材料的电位均呈现下降趋势. 胞嘧啶(pKa=4.2)及腺嘌呤(pKa=3.5)在pH=3—4时能够被有效质子化[27],与带负电的碳基材料间的静电吸引最强,因此hsDNA吸附量最高. 与此同时,H-CNT带负电荷最多,因此吸附量最大,C-CNT次之,G-CNT负电荷含量最少,吸附量最低. 虽然G-CNT的负电荷含量比G200和G2000少,但比表面积和孔径均大于石墨材料,因此其对hsDNA的吸附量高于G200和G2000. 当pH高于等电点时,hsDNA的磷酸基团脱去质子[28],表面带负电,与5种碳基材料间的静电斥力增强,吸附量降低.
-
预实验结果表明,超声对于石墨材料的悬浮作用并不明显,因此只探究3种碳管的悬浮行为及其对吸附的影响. 整体上看(图5),G-CNT的悬浮性能远低于H-CNT和C-CNT.
C-CNT的悬浮能力最强,是因为含氧官能团能够赋予碳基纳米材料更强的亲水性,有助于其在水中的悬浮. 几种碳管的含氧量从大到小的顺序为:C-CNT>H-CNT>G-CNT,悬浮能力也遵循此顺序. Ma等[29]在研究中发现,碳管的悬浮性与碳管表面的含氧量呈正相关关系,与本研究中的现象一致.
在无超声条件下,随hsDNA浓度的升高,G-CNT的悬浮量略有增加,在800 nm处的吸光度均小于0.04;C-CNT和H-CNT的悬浮量随hsDNA浓度的升高呈现先升高后稳定的趋势,但吸光度均仍不超过0.05. 上述现象表明hsDNA作为悬浮剂单独使用的能力有限,原因可能是hsDNA拥有较大分子体积,难以有效地插入碳纳米管束并将单根碳纳米管分隔开,导致“拉拉链”机制[30]无法发挥作用.
在超声条件辅助下,3种碳管的悬浮情况均有大幅度提升,且悬浮量随hsDNA浓度的升高显著增加. 这是因为超声过程中,纳米碳管间距离增加[31],为hsDNA进入管间提供了条件. 一旦hsDNA进入纳米碳管之间,空间位阻效应能够保持纳米碳管相互分隔的状态,从而实现悬浮[32]. 但G-CNT的悬浮量仍十分低,是因为其表面含氧官能团极少,即使在超声辅助下也无法达到C-CNT和H-CNT的悬浮效果. 当hsDNA浓度在5—50 mg·L−1时,随着hsDNA浓度的升高,几种碳管对hsDNA的吸附量均有小幅度提升;hsDNA浓度为60 mg·L−1时,G-CNT和C-CNT对hsDNA的吸附量降低,但H-CNT对hsDNA的吸附量依然呈现上升趋势. 尽管超声显著增加了纳米碳管的悬浮,但对hsDNA吸附提升不明显. 现象表明,未经超声处理时,hsDNA吸附在碳纳米管束的外围,无法实现单管悬浮;超声处理后,仅有少部分hsDNA进入了碳纳米管之间,但依然表现出了极强的悬浮能力. 上述结果说明,eDNA具有作为碳纳米管分散剂的巨大潜能,在碳纳米管经历环境老化等过程后,能够显著提升碳纳米管的悬浮效果,进一步增强ARGs迁移和随纳米材料进入细胞的能力,从而造成ARGs和纳米材料的协同污染.
-
(1)碳管对hsDNA的吸附量优于石墨,在pH=7.0±0.2的条件下,碳基材料吸附DNA从高到低遵循G-CNT、H-CNT、C-CNT、G2000、G200的顺序.
(2)伪二级动力学模型和Freundlich模型更适用于碳材料对hsDNA的吸附体系,碳基材料与hsDNA之间的吸附主要是非均质吸附过程.
(3)静电作用、比表面积、孔径及疏水作用是影响碳基材料吸附hsDNA的主要因素;pH及碳管悬浮均会改变碳基材料与hsDNA之间的相互作用.
碳基材料对鲱鱼精子DNA的吸附及其影响因素
Study on herring sperm DNA adsorption by carbon-based materials and the influencing factors
-
摘要: 环境DNA作为抗生素抗性基因的载体,其环境行为受到了愈加广泛的关注,但其与碳基材料间吸附行为的研究仍不系统. 选取有代表性的鲱鱼精子DNA(hsDNA),通过批量吸附动力学、等温线实验及不同pH值下的吸附实验,探讨不同碳基材料(石墨化碳管G-CNT、羧基化碳管C-CNT、羟基化碳管H-CNT、200目石墨G200、2000目石墨G2000)对于环境DNA的吸附机制. 实验表明,碳管对hsDNA的最高吸附量比石墨高近1个数量级,且吸附量从大到小的顺序为:G-CNT(66.75 mg·g−1)>H-CNT(65.34 mg·g−1)>C-CNT(58.31 mg·g−1)>G2000(6.80 mg·g−1)>G200(6.01 mg·g−1). 静电作用、比表面积、孔径及疏水作用都会影响碳基材料对hsDNA的吸附. Freundlich模型比Langmuir模型更适用于描述碳基材料对hsDNA的吸附,吸附主要是非均质化学吸附过程. pH在3—8时,hsDNA的吸附量随pH的升高显著降低;pH<3时,规律则相反. 利用超声手段模拟实际环境中碳管的悬浮,描述了hsDNA对碳管悬浮的作用及超声条件对碳管吸附hsDNA的影响. 超声显著增加了纳米碳管的悬浮,但对hsDNA吸附提升不明显. 由于缺少含氧官能团,G-CNT的悬浮量低于C-CNT和H-CNT. 超声辅助下,3种碳管的悬浮量随hsDNA浓度的升高显著增加. 探究不同碳基材料与环境DNA的吸附机制及悬浮碳管对环境DNA吸附行为的影响,可为评价碳基材料和被其吸附的环境DNA进入环境后的风险提供理论基础.Abstract: The environmental behavior and risk of environmental DNA as a carrier of antibiotic resistance genes has received increasing attention. To investigate the adsorption mechanism of various carbon-based materials (G-CNT, C-CNT, H-CNT, G200, G2000) for environmental DNA, representative herring sperm DNA (hsDNA) was used. This was done using batch adsorption kinetics, isotherm tests, and adsorption experiments at varied pH values. The results show that the highest adsorption capacity of carbon tube on hsDNA is nearly 1 order of magnitude higher than that of graphite, and the order of adsorption capacity from large to small is G-CNT(66.75 mg·g−1)>H-CNT(65.34 mg·g−1)>C-CNT(58.31 mg·g−1)>G2000(6.80 mg·g−1)>G200(6.01 mg·g−1). The adsorption of carbon-based materials to hsDNA is influenced by electrostatic interactions, surface area, pore size, and hydrophobic effects. Electrostatic and hydrophobic effects are the main adsorption mechanisms of hsDNA by carbon-based materials. When describing the adsorption of hsDNA by carbon-based materials, which was primarily a heterogeneous chemisorption process, the Freundlich model proved more appropriate than the Langmuir model. The adsorption of hsDNA decreases significantly with the increase in pH from 3 to 8; the trend is reversed when pH is below 3. The phenomenon was inverted at pH values below 3. Using ultrasonic means to simulate the suspension of carbon nanotubes in actual environment, the study describes the effect of hsDNA on the suspension of carbon nanotubes and the influence of ultrasonic conditions on the adsorption of hsDNA on carbon nanotube materials. Ultrasonic significantly increases the suspension of nanotubes, but the enhancement of hsDNA adsorption is not significant. Due to the lack of oxygen-containing functional groups, the suspension of G-CNT is lower than that of C-CNT and H-CNT. Under ultrasonic assistance, the suspension of the three carbon nanotubes significantly increases with the concentration of hsDNA. Exploring the adsorption mechanism of different carbon-based materials on environmental DNA and the effect of suspended carbon nanotubes on the adsorption behavior of environmental DNA can provide a theoretical basis for evaluating the risk of carbon-based materials and the absorbed environmental DNA entering the environment.
-
Key words:
- carbon-based materials /
- herring sperm DNA /
- suspension /
- adsorption.
-

-
表 1 5种碳基材料的理化性质
Table 1. The characteristic of five carbon-based materials
碳基材料
MaterialsC/%wt O/%wt N/%wt H/%wt 灰分/%wt SBET/
(m2·g−1)平均孔径/nm
Average pore size总孔容/(cm3·g−1)
Total pore sizeZeta电位/mV
Zeta potentialG200 84.86 0.20 0 0 14.94 8.637 3.716 0.108 -36.86 G2000 89.02 0.37 0 0 10.61 16.095 3.720 0.433 -24.36 G-CNT 98.23 0.05 0 0 1.72 89.246 3.321 0.872 -9.57 C-CNT 92.33 3.99 0.21 0.21 3.26 125.932 3.928 1.176 -26.84 H-CNT 91.36 3.38 0.32 0.23 4.71 135.166 3.940 1.328 -16.20 表 2 动力学拟合结果
Table 2. Kinetic fitting results
碳基材料
Materials伪一阶动力学
Pseudo-first-order伪二阶动力学
Pseudo-second-orderk1/h−1 Qe/(mg·g−1) R2 k2/(g·(mg·min)−1) Qe/(mg·g−1) R2 G200 2.85 4.33 0.71 1.04 4.56 0.88 G2000 3.91 5.26 0.78 1.23 5.51 0.93 G-CNT 1.87 51.66 0.60 0.05 55.65 0.83 C-CNT 1.10 32.43 0.68 0.04 35.26 0.84 H-CNT 1.10 45.37 0.64 0.03 45.96 0.82 表 3 hsDNA吸附等温线Freundlich拟合和Langmuir拟合
Table 3. Freundlich fitting and Langmuir fitting of hsDNA adsorption isotherm
碳基材料
MaterialsLangmuir吸附等温线
Langmuir fittingFreundlich吸附等温线
Freundlich fittingKL/(L·mg−1) Qm/(mg·g−1) R2 KF/(mg1-n·Ln·g−1) n R2 G200 0.21 6.01 0.93 1.81 0.31 0.99 G2000 0.34 6.80 0.88 2.64 0.25 0.99 G-CNT 0.21 66.75 0.91 20.24 0.31 0.97 C-CNT 0.15 58.31 0.95 14.57 0.35 0.99 H-CNT 0.24 65.34 0.95 20.10 0.31 0.99 -
[1] YANG M Y, SHI L, ZHANG D, et al. Adsorption of herring sperm DNA onto pine sawdust biochar: Thermodynamics and site energy distribution[J]. Frontiers of Environmental Science & Engineering, 2022, 16(11): 144. [2] SUTHERLAND I W. The biofilm matrix - an immobilized but dynamic microbial environment[J]. Trends in Microbiology, 2001, 9(5): 222-227 doi: 10.1016/S0966-842X(01)02012-1 [3] MORRISSEY E M, MCHUGH T A, PRETESKA L, et al. Dynamics of extracellular DNA decomposition and bacterial community composition in soil[J]. Soil Biology and Biochemistry, 2015, 86: 42-49. doi: 10.1016/j.soilbio.2015.03.020 [4] SHI B Y, ZHENG M, TAO W, et al. Challenges in DNA delivery and recent advances in multifunctional polymeric DNA delivery systems[J]. Biomacromolecules, 2017, 18(8): 2231-2246. doi: 10.1021/acs.biomac.7b00803 [5] 赵方园, 杨新瑶, 陈芳敏, 等. 抗性DNA在水土环境中的迁移归趋与水平转移[J]. 环境化学, 2018, 37(8): 1804-1819. doi: 10.7524/j.issn.0254-6108.2018022701 ZHAO F Y, YANG X Y, CHEN F M, et al. Transport, fate and horizontal transfer of antibiotic resistance DNA in soil and water environment[J]. Environmental Chemistry, 2018, 37(8): 1804-1819 (in Chinese). doi: 10.7524/j.issn.0254-6108.2018022701
[6] ZAREI-BAYGI A, SMITH A L. Intracellular versus extracellular antibiotic resistance genes in the environment: Prevalence, horizontal transfer, and mitigation strategies[J]. Bioresource Technology, 2021, 319: 124181. doi: 10.1016/j.biortech.2020.124181 [7] HALE L, CROWLEY D. DNA extraction methodology for biochar-amended sand and clay[J]. Biology and Fertility of Soils, 2015, 51(6): 733-738. doi: 10.1007/s00374-015-1020-5 [8] FERREIRA P, RISCADO M, BERNARDO S, et al. Pristine Multi-walled carbon nanotubes for a rapid and efficient plasmid DNA clarification[J]. Separation and Purification Technology, 2023, 320: 124224. doi: 10.1016/j.seppur.2023.124224 [9] FANG J, JIN L, MENG Q K, et al. Interactions of extracellular DNA with aromatized biochar and protection against degradation by DNase I[J]. Journal of Environmental Sciences, 2021, 101: 205-216. doi: 10.1016/j.jes.2020.08.017 [10] SUN J X, LI Y, LIN J P. Studying the adsorption of DNA nanostructures on graphene in the aqueous phase using molecular dynamic simulations[J]. Journal of Molecular Graphics and Modelling, 2017, 74: 16-23. doi: 10.1016/j.jmgm.2017.03.003 [11] LIAN F, YU W C, ZHOU Q X, et al. Size matters: Nano-biochar triggers decomposition and transformation inhibition of antibiotic resistance genes in aqueous environments[J]. Environmental Science & Technology, 2020, 54(14): 8821-8829. [12] LIU S Y, LI X X, CHEN L, et al. Understanding physicochemical properties changes from multi-scale structures of starch/CNT nanocomposite films[J]. International Journal of Biological Macromolecules, 2017, 104: 1330-1337. doi: 10.1016/j.ijbiomac.2017.05.174 [13] 王志刚, 陈文晶, 胡影, 等. DNA在黑土胶体微界面的吸附与解吸特性[J]. 农业环境科学学报, 2017, 36(10): 2058-2062. doi: 10.11654/jaes.2017-0619 WANG Z G, CHEN W J, HU Y, et al. Characteristics of DNA adsorption and desorption on micro-interfaces of black soil colloids[J]. Journal of Agro-Environment Science, 2017, 36(10): 2058-2062 (in Chinese). doi: 10.11654/jaes.2017-0619
[14] CAI P, HUANG Q, ZHANG X, et al. Adsorption of DNA on clay minerals and various colloidal particles from an Alfisol[J]. Soil Biology and Biochemistry, 2006, 38(3): 471-476. doi: 10.1016/j.soilbio.2005.05.019 [15] LI L, LIM S F, PURETZKY A, et al. DNA methylation detection using resonance and nanobowtie-antenna-enhanced Raman spectroscopy[J]. Biophysical Journal, 2018, 114(11): 2498-2506. doi: 10.1016/j.bpj.2018.04.021 [16] HYUNG H, FORTNER J D, HUGHES J B, et al. Natural organic matter stabilizes carbon nanotubes in the aqueous phase[J]. Environmental Science & Technology, 2007, 41(1): 179-184. [17] HENRY P A, RAUT A S, UBNOSKE S M, et al. Enhanced electron transfer kinetics through hybrid graphene-carbon nanotube films[J]. Electrochemistry Communications, 2014, 48: 103-106. doi: 10.1016/j.elecom.2014.08.024 [18] DELINE A R, FRANK B P, SMITH C L, et al. Influence of oxygen-containing functional groups on the environmental properties, transformations, and toxicity of carbon nanotubes[J]. Chemical Reviews, 2020, 120(20): 11651-11697. doi: 10.1021/acs.chemrev.0c00351 [19] ROMAN T, DIÑO W A, NAKANISHI H, et al. Glycine adsorption on single-walled carbon nanotubes[J]. Thin Solid Films, 2006, 509(1/2): 218-222. [20] AL-GHOUTI M A, DA’ANA D A. Guidelines for the use and interpretation of adsorption isotherm models: A review[J]. Journal of Hazardous Materials, 2020, 393: 122383. doi: 10.1016/j.jhazmat.2020.122383 [21] VAN ALIN A, CORBETT M K, FATHOLLAHZADEH H, et al. Klebsiella aerogenes adhesion behaviour during biofilm formation on monazite[J]. Microorganisms, 2023, 11(5): 1331. doi: 10.3390/microorganisms11051331 [22] BRANDÃO-DIAS P F P, TANK J L, SNYDER E D, et al. Suspended materials affect particle size distribution and removal of environmental DNA in flowing waters[J]. Environmental Science & Technology, 2023, 57(35): 13161-13171. [23] ZHU J H, YU J Y, ZHANG B J, et al. Hydrophobic-action-driven removal of six organophosphorus pesticides from tea infusion by modified carbonized bacterial cellulose[J]. Food Chemistry, 2023, 412: 135546. doi: 10.1016/j.foodchem.2023.135546 [24] WANG Z Y, YU X D, PAN B, et al. Norfloxacin sorption and its thermodynamics on surface-modified carbon nanotubes[J]. Environmental Science & Technology, 2010, 44(3): 978-984. [25] SHENG X, QIN C, YANG B, et al. Metal cation saturation on montmorillonites facilitates the adsorption of DNA via cation bridging[J]. Chemosphere, 2019, 235: 670-678. doi: 10.1016/j.chemosphere.2019.06.159 [26] 王慎阳, 饶伟, 王代长, 等. 蒙脱土、高岭土和针铁矿对DNA吸附与解吸特征[J]. 环境科学, 2012, 33(5): 1736-1743. WANG S Y, RAO W, WANG D C, et al. Characteristics of DNA adsorption and desorption in montmorillonite, kaoline and goethite[J]. Environmental Science, 2012, 33(5): 1736-1743 (in Chinese).
[27] APUL O G, WANG Q L, ZHOU Y, et al. Adsorption of aromatic organic contaminants by graphene nanosheets: comparison with carbon nanotubes and activated carbon[J]. Water Research, 2013, 47(4): 1648-1654. doi: 10.1016/j.watres.2012.12.031 [28] KAGZI K, HECHLER R M, FUSSMANN G F, et al. Environmental RNA degrades more rapidly than environmental DNA across a broad range of pH conditions[J]. Molecular Ecology Resources, 2022, 22(7): 2640-2650. doi: 10.1111/1755-0998.13655 [29] MA P C, SIDDIQUI N A, MÄDER E, et al. Correlation between electrokinetic potential, dispersibility, surface chemistry and energy of carbon nanotubes[J]. Composites Science and Technology, 2011, 71(14): 1644-1651. doi: 10.1016/j.compscitech.2011.07.014 [30] SHI L, ZHANG D, ZHAO J F, et al. Small organic molecules act as a trigger in an “unzippering” mechanism to facilitate carbon nanotube dispersion[J]. Science of the Total Environment, 2021, 758: 143620. doi: 10.1016/j.scitotenv.2020.143620 [31] LING H X, YU X X, WANG S F, et al. Study on ultrasonic assisted mechanism of ring opening polymerization of octamethylcyclotetrasiloxane (D4)[C]//AIP Conference Proceedings. Hangzhou, China, 2018. [32] YIN M N, SHI L, ZHANG D, et al. New insights into the “unzippering” mechanism of carbon nanotube dispersion via the “trigger” effect of small charged molecules[J]. Colloid and Interface Science Communications, 2021, 43: 100456. doi: 10.1016/j.colcom.2021.100456 -



 下载:
下载: