-
近年来,过氧乙酸(peracetic acid,PAA)因具有消毒高效、经济价廉和绿色环保等特性,被广泛用于环保、医疗、食品、水产养殖等领域[1 − 2]. PAA具有较强的氧化能力(E0PAA = 1.76 V[3]),可直接用于氧化降解水环境中氨比西林等药物类有机污染物[4 − 5]. 同时,PAA含有非对称的O—O键,其键能为159 kJ·mol−1[6],远小于过氧化氢(H2O2)(213 kJ·mol−1)[7],易于被过渡金属离子等诱导生成高氧化活性物种降解双氯芬酸等难降解有机污染物[6,8 − 12]. 利用PAA作为氧化剂和消毒剂时,其浓度是影响氧化消毒效能的关键因素. 同时,PAA自身稳定性较差,在常温常压下1 h内可以分解20%—30%[13],在使用时需要频繁地进行浓度标定. 商用的PAA溶液是通过醋酸和H2O2反应制备的,有大量与PAA物化性质相近的H2O2共存[14],这大大增加了PAA浓度测定的难度. 因此,非常有必要建立快速、简便、准确的PAA测定方法,为推动PAA的应用提供技术支撑.
目前,PAA的测定方法主要包括电化学法、色谱法、滴定法和分光光度法等[15 − 18]. 虽然滴定法是PAA测定校准中常用的方法,但存在检测限高和耗时长的缺点. 同时,昂贵的检测设备和复杂的分析过程也阻碍了电化学方法和色谱法的广泛应用. 相比之下,分光光度法具有分析操作简便、无需昂贵的设备、测定成本低廉等优势,被广泛运用于PAA浓度的测定[14,18 − 22]. Xiao等[22]基于PAA氧化碘化钾(KI)的显色反应,在碘量滴定法基础上建立了测定PAA浓度的碘量分光光度法. 然而,碘量分光光度法检测波长为350 nm,接近紫外吸收光谱区,易受水环境中背景物质的干扰. Zhang等[20]和Laura等[18]利用KI催化PAA 氧化N,N-二乙基对苯二胺(DPD)的显色反应,以DPD为指示剂建立了测定PAA浓度的DPD分光光度法. Lin等[14]和Pinkernell等[21]基于KI催化PAA氧化2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)显色,以ABTS为指示剂建立了ABTS分光光度法. DPD和ABTS分光光度法检测波长均在可见光吸收光谱区,避免了水中天然有机物等背景物质对PAA检测结果的影响. 需要注意的是,KI会与PAA溶液中共存的H2O2反应,在以KI作为指示剂/催化剂的分光光度法时需要严格控制检测时间. Yuan等[19]基于Co(Ⅱ)选择性催化PAA的特性,以Co(Ⅱ)替代KI作为催化剂改进了ABTS分光光度法,避免了共存H2O2对PAA测定的干扰. 然而,ABTS价格昂贵,且易与水环境中普遍存在的Fe(Ⅲ)反应显色[19].
酸性橙7(acid orange 7,AO7)含有偶氮基团,在484 nm处有特征吸收峰. AO7化学稳定性高,几乎不与Fe(Ⅲ)和PAA反应,但也能够被Co(Ⅱ)/PAA催化氧化体系快速氧化褪色[23]. 因此,本研究采用AO7和Co(Ⅱ)分别作为指示剂和催化剂,开发了一种快速、简便、准确测定水中过氧乙酸浓度的分光光度法.
-
七水合硫酸钴、30%含量的过氧化氢、无水硫酸钠和碳酸氢钠购自阿拉丁生物化学科技有限公司. 酸性橙7(AO7)、乙酸钠、冰乙酸、ABTS、DPD、氟化钠、双氯芬酸、硫酸亚铁七水合物、腐殖酸、三氯化铁、氯化钠、碘化钾和氢氧化钠购自国药化学试剂有限公司. 硝酸钾购自广东汕头西陇化工厂. 硫代硫酸钠五水合物购自上海麦克林生化科技有限公司. 实验用水均为超纯水(18.2 MΩ·cm).
-
吸收光度值采用紫外-可见分光光度计(Persee TU-1901,中国)进行测量. 溶液pH值用pH计(Sartorius PB-10,德国)测量. 双氯芬酸(Diclofenac,DCF)的浓度采用高效液相色谱仪(Agilent HPLC
1220 ,美国)进行测定,配有Agilent TC-C18 (2)色谱柱(5 μm,150 mm×4.6 mm). 流动相由0.1%乙酸溶液和乙腈组成,两者体积比45:55,流速为1 mL·min−1,检测波长为232 nm. -
AO7分光光光度法测定水中PAA浓度主要是通过Co(Ⅱ)与PAA的反应,产生CH3C(O)O·与CH3C(O)OO·自由基,CH3C(O)O·与CH3C(O)OO·再氧化AO7脱色,借助紫外-可见分光光度计测定AO7在484 nm处吸光度值变化,进而通过实验标曲换算即可得出PAA浓度. 主要反应方程式(1—6)如下[9]:
采用碘量滴定法(GBT
19104 —2021)对制备的PAA储备液浓度进行标定. 采用AO7分光光度法测定水中PAA浓度的步骤描述如下:1)空白校零:往1 cm石英比色皿中加入2.5 mL超纯水在484 nm波长处进行空白校零;2)初始吸光度值(A0)测定:往1 cm石英比色皿中依次加入1.00 mL的pH为5.00的醋酸缓冲母液(60 mmol·L−1)、0.05 mL的Co(Ⅱ)母液(87.5 mmol·L−1)、0.20 mL的AO7母液(1 mmol·L−1)以及1.25 mL超纯水,盖紧比色皿盖板并手动搅拌均匀,在484 nm处测定初始吸光度值,记为A0;3)反应褪色后吸光度值(At)测定:往1 cm石英比色皿中依次加入1.00 mL的pH为5.00的醋酸缓冲母液(60 mmol·L−1)、0.05 mL的Co(Ⅱ)母液(87.5 mmol·L−1)、0.20 mL的AO7母液(1 mmol·L−1)以及1.25 mL的PAA待测液,盖紧比色皿盖板并手动搅拌均匀,反应1 min后在484 nm处测定吸光度值,记为At;4)待测液中PAA浓度的计算:先计算获得褪色反应前后吸光度值的差值ΔA= A0-At,进而根据公式(7)计算待测液中的PAA浓度,记为[PAA]sample.其中,ΔA为1 cm石英比色皿在484 nm处记录的吸光度值变化值;Vfinal为1 cm石英比色皿中所有试剂溶液的最终总体积,记为2.50 mL;k为在1 cm石英比色皿以及484 nm测定波长下,测定PAA浓度的校准曲线斜率;Vsample是加入到1 cm石英比色皿中的水样体,即为1.25 mL.
-
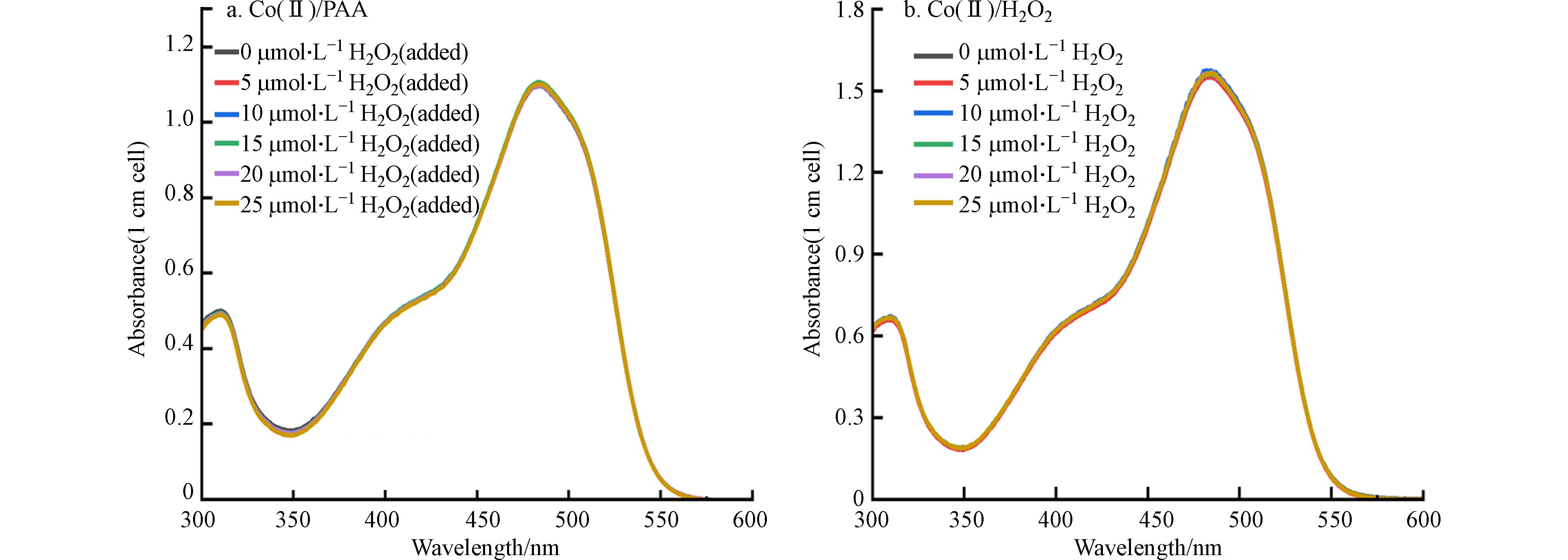
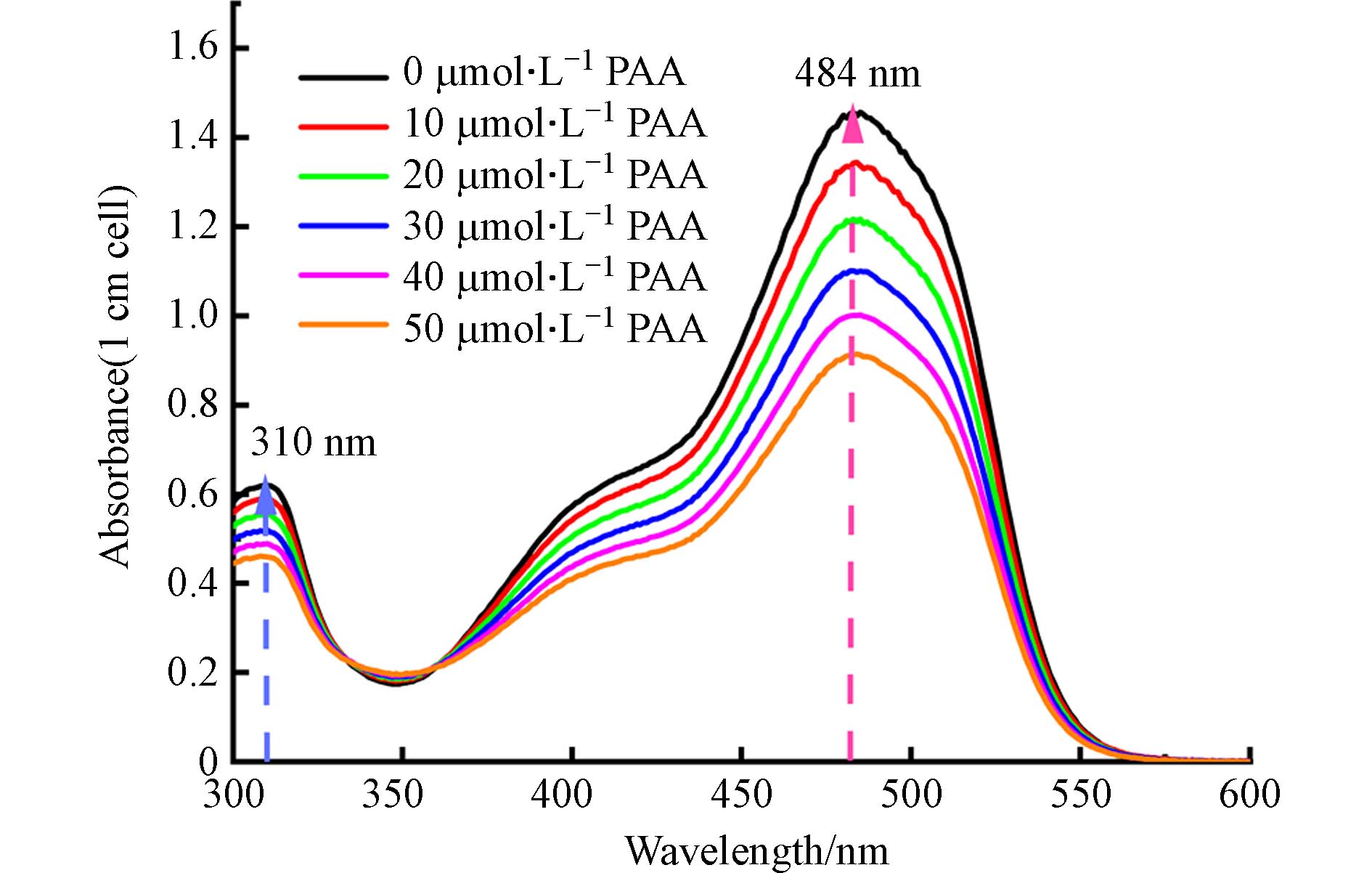
Co(Ⅱ)/PAA体系会生成乙酰氧自由基和Co(Ⅲ)等高氧化活性物种,进而氧化AO7褪色[23]. 采用单因素变量法考察了PAA浓度对Co(Ⅱ)/PAA体系中AO7紫外-可见光吸收光谱图的影响,结果如图1所示. 由吸收光谱图可知,AO7在310 nm和484 nm处有特征吸收峰,对应着AO7的两个发色基团,即萘环结构和偶氮键. 在Co(Ⅱ)/PAA体系中,AO7在这两个特征吸收峰处的吸收度值随着PAA浓度的增加而呈线性比例减小. 这表明,采用Co(Ⅱ)和AO7分别作为催化剂和指示剂来建立测定PAA浓度的分光光度法是可行的. 考虑到484 nm为可见光吸收波长且AO7在484 nm处的比摩尔吸收系数远高于310 nm处,本研究选择484 nm作为AO7分光光度法的检测波长.
为了考察Co(Ⅱ)对PAA的选择性催化作用,分别研究了H2O2浓度对Co(Ⅱ)/PAA体系以及Co(Ⅱ)/H2O2体系中AO7吸收光谱的影响,结果如图2所示. 在Co(Ⅱ)/PAA体系中,额外加入的H2O2对AO7吸收光谱没有影响(图2a). 这表明,PAA溶液中共存的H2O2并不会影响Co(Ⅱ)/PAA体系氧化褪色AO7的效能. 同时,从图2b中也可以看到,Co(Ⅱ)/H2O2体系对AO7没有明显的氧化褪色作用,这进一步表明PAA溶液中共存的H2O2不会影响Co(Ⅱ)/PAA体系AO7的氧化褪色效能. 也就是说,Co(Ⅱ)对PAA具有选择性催化作用. 因此,采用Co(Ⅱ)和AO7分别作为催化剂和指示剂建立的测定PAA浓度的分光光度法,不会受到PAA溶液中共存H2O2的干扰.
-
反应时间、溶液pH、Co(Ⅱ)浓度和AO7浓度是影响Co(Ⅱ)/PAA体系氧化AO7褪色的重要因素[14,19]. 因此,为了建立快速、简便、准确测定PAA浓度的AO7分光光度法,需要对上述反应条件进行优化.
-
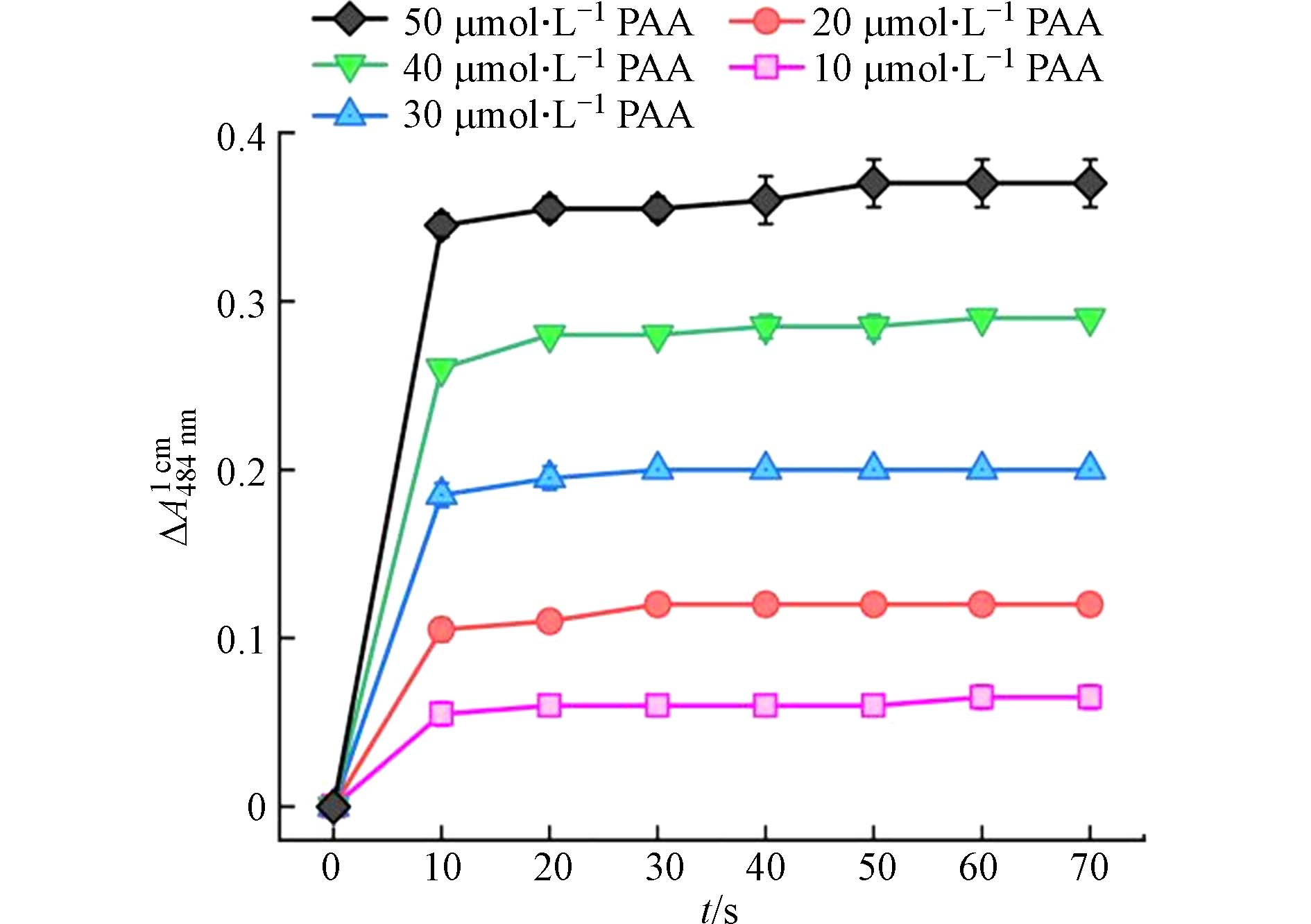
图3为在不同PAA浓度条件下,反应时间对Co(Ⅱ)/PAA体系中AO7在特征吸收波长484 nm处吸收度变化值的影响规律. AO7在484 nm处的吸收度变化值用∆A表示(∆A = A0 - At,其中A0和At为反应前后AO7溶液在484 nm处的吸光度值). 从图3可知,在特定PAA浓度下,∆A随着反应时间的延长不断增加,但在50 s后维持在一个恒定值保持不变. 这表明,溶液中的PAA在50 s内被Co(Ⅱ)催化分解完毕. 为了保险起见,在后面的实验中,选择t = 1 min作为AO7分光光度法测定PAA的操作时间.
-
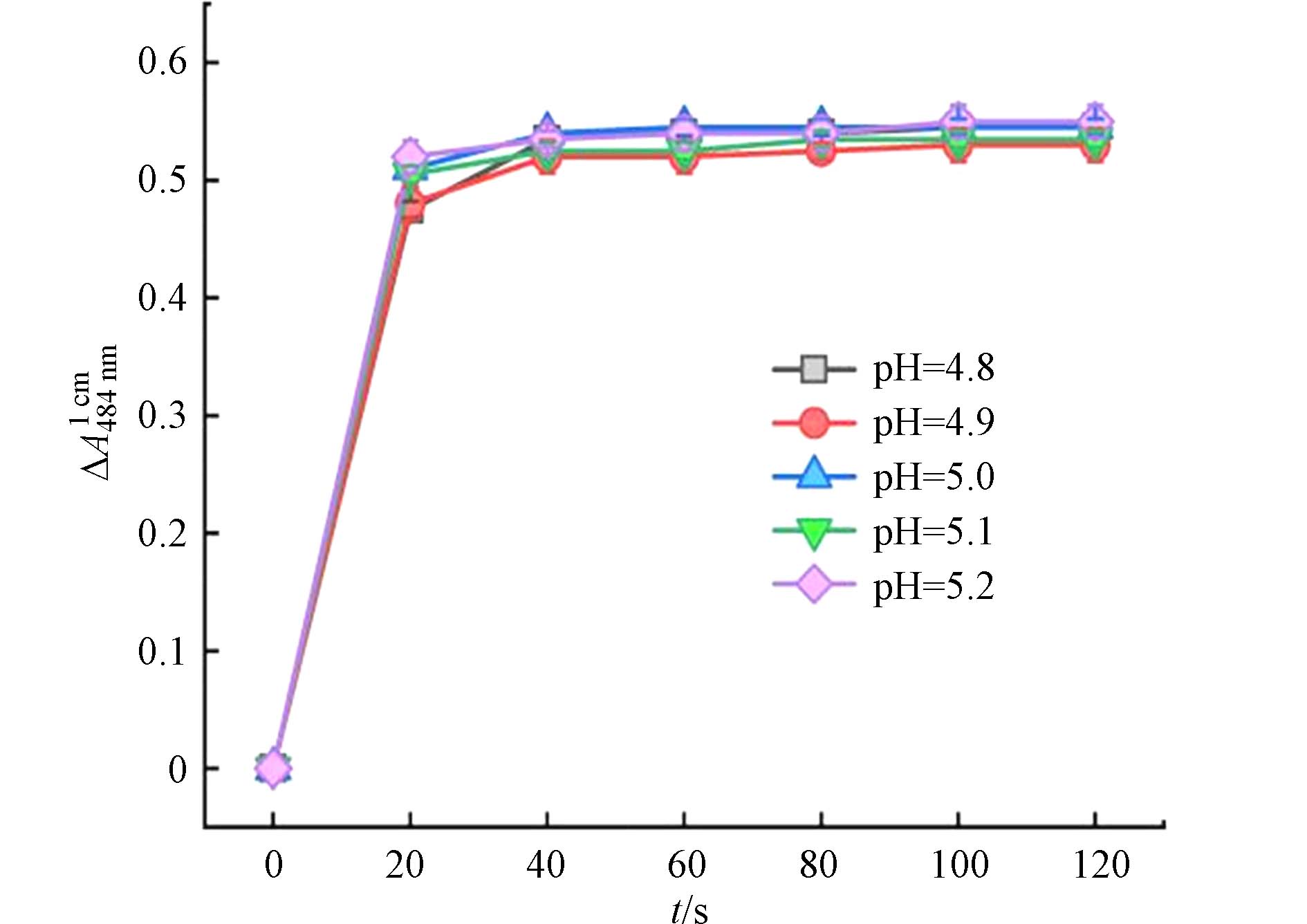
溶液pH是影响Co(Ⅱ)/PAA体系氧化AO7褪色的另一个重要因素. Co(Ⅱ)/PAA体系在pH = 5.0附近对水中有机污染物具有良好的去除效能[9],且醋酸缓冲液中醋酸的pKa1 = 4.8[24]. 因此,本文主要研究了溶液pH在4.8—5.2范围内对AO7褪色程度的影响. 图4显示了反应溶液pH对Co(Ⅱ)/PAA体系中AO7在484 nm处吸收度变化值的影响规律. 从图4可知,反应溶液pH在4.8—5.2范围内时,Co(Ⅱ)/PAA体系中AO7在484 nm处的∆A随反应时间的变化趋势几乎不受影响,均能在1 min内达到峰值并保持不变. 因此,在后面的实验中,选择pH = 5.0作为AO7分光光度法测定PAA的反应溶液pH.
-
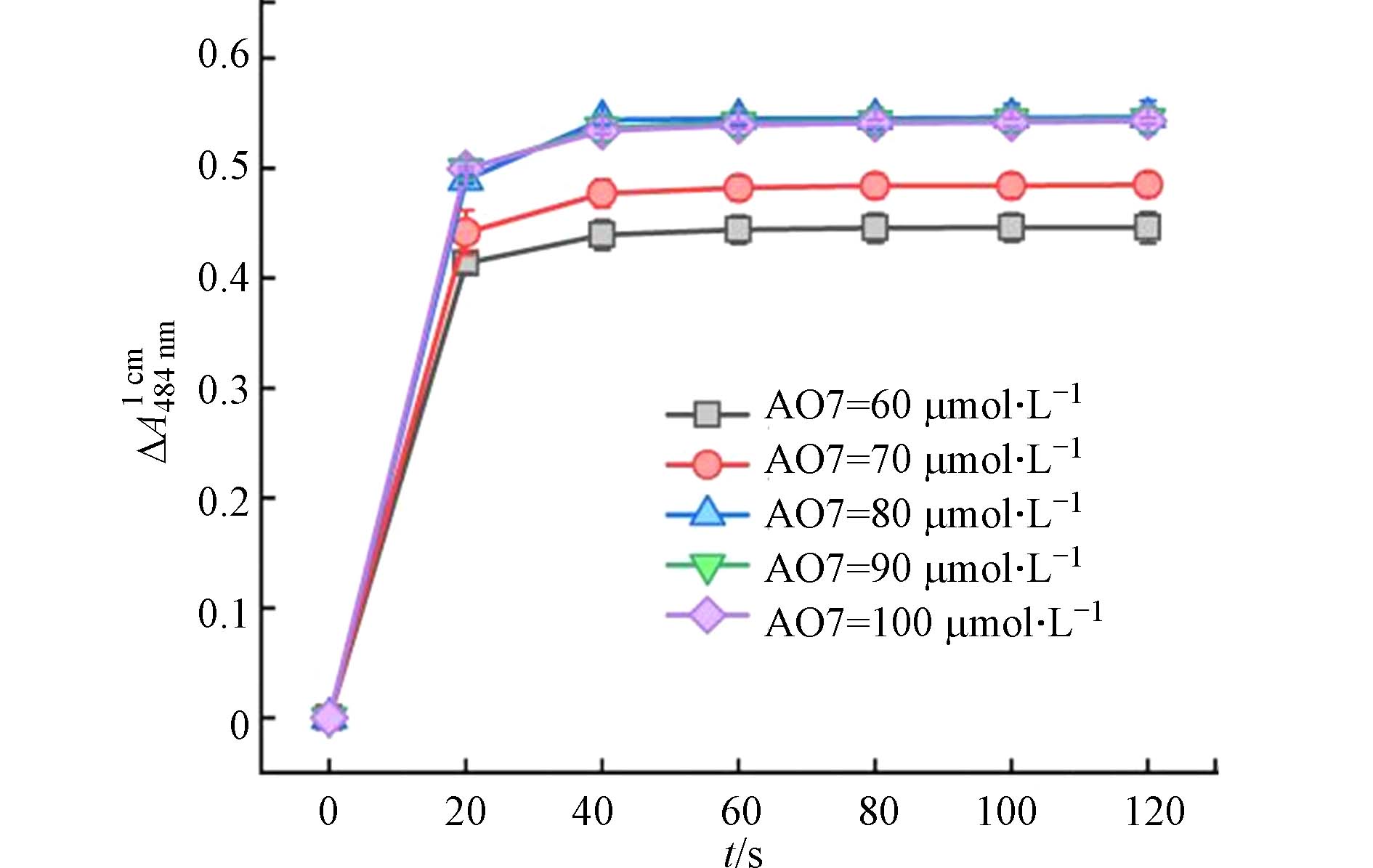
图5显示了AO7浓度对Co(Ⅱ)/PAA体系中AO7在484 nm处吸收度变化值的影响规律. 在特定AO7浓度下,∆A均随着反应时间的延长不断增加,但在1 min后维持在峰值保持不变. 需要特别注意的是,反应时间为1 min时对应的∆A值随着AO7浓度的增加而增加,直至AO7浓度达到80 μmol·L−1为止. 考虑到分光光度计的线性吸光度值范围,在后面的实验中,选择初始AO7浓度80 μmol·L−1作为AO7分光光度法测定PAA的AO7浓度.
-
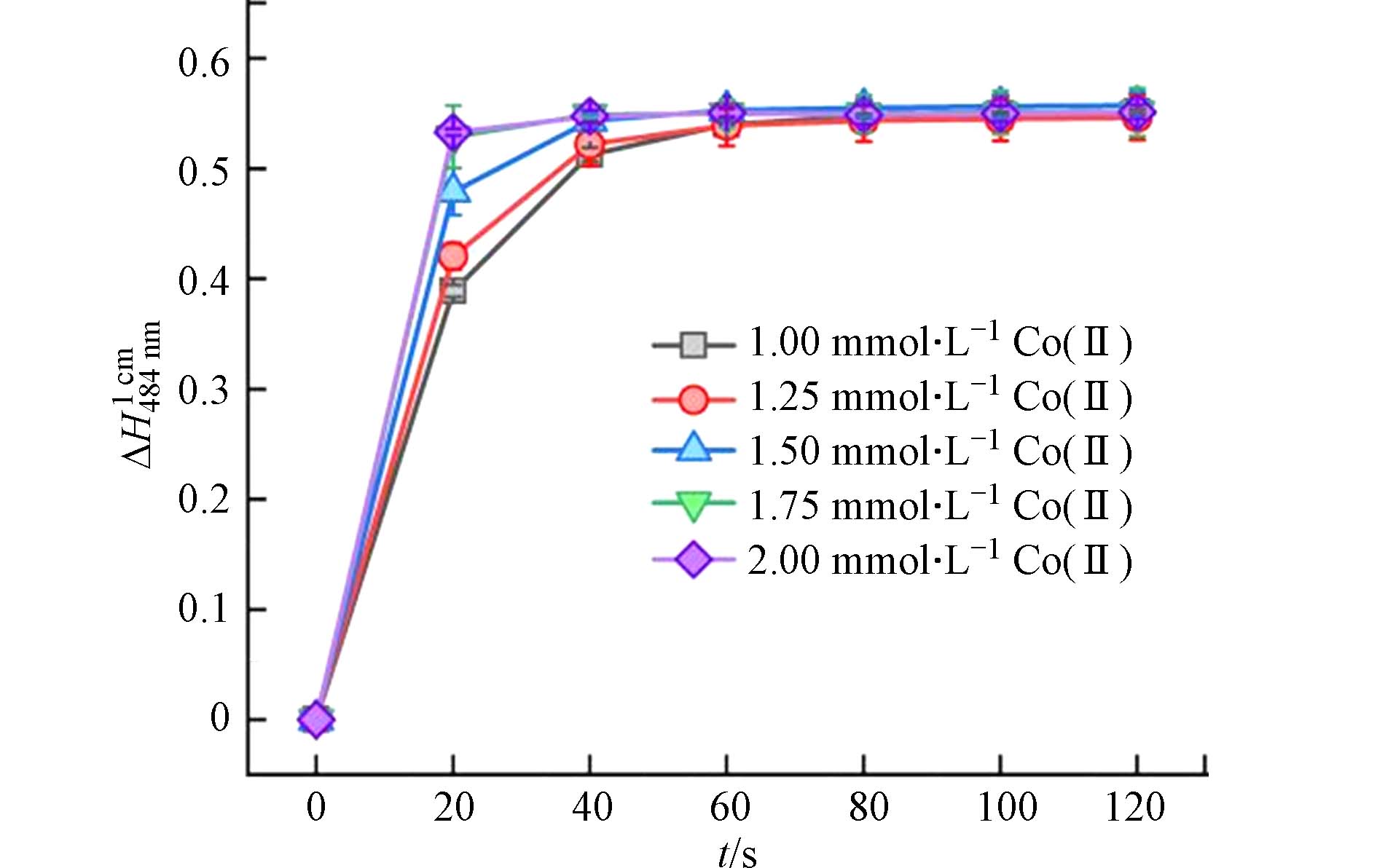
Co(Ⅱ)浓度与Co(Ⅱ)/PAA体系中高活性氧化物种的生成速度密切相关,也是影响Co(Ⅱ)/PAA体系氧化AO7褪色的重要因素. 图6显示了Co(Ⅱ)浓度对Co(Ⅱ)/PAA体系中AO7在484 nm处吸收度变化值随反应时间的影响规律. 从图6可知,随着Co(Ⅱ)浓度从1.00 mmol·L−1增加到1.75 mmol·L−1, AO7的脱色速率不断增加. 同时,反应时间为1 min时对应的∆A值也是随着Co(Ⅱ)浓度的增加而增加,直至Co(Ⅱ)浓度达到1.75 mmol·L−1为止. 因此,在后面的实验中,选择Co(Ⅱ)浓度1.75 mmol·L−1作为AO7分光光度法测定PAA的Co(Ⅱ)浓度.
-
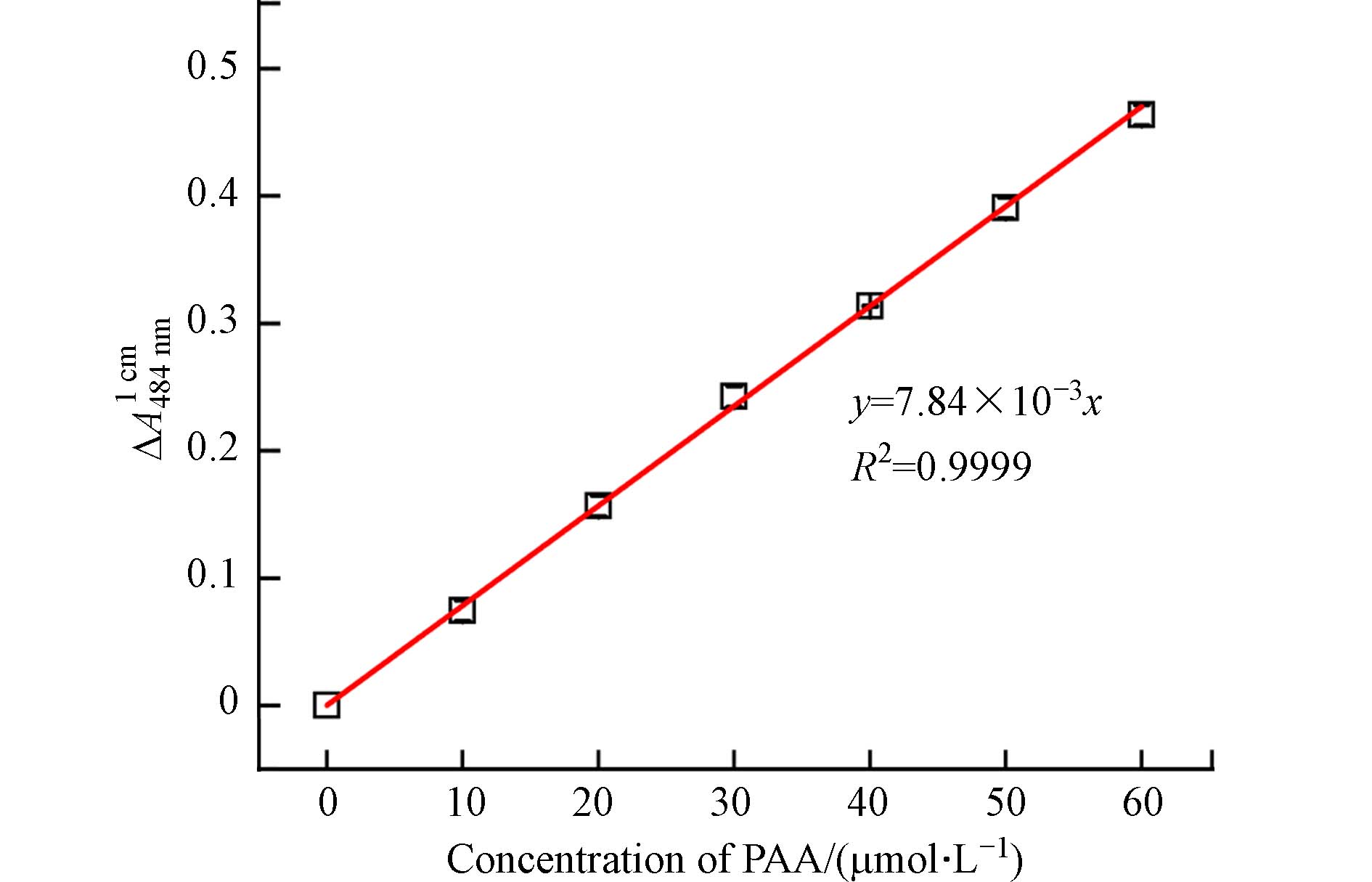
根据3.2部分优化后的反应测定条件,即AO7浓度为80 μmol·L−1、Co(Ⅱ)浓度为1.75 mmol·L−1、pH为5.0以及反应时间为1 min,建立了AO7分光光度法测定水中PAA浓度的标准曲线,如图7所示.
从图7可知,AO7在484 nm处的吸光度变化值∆A与PAA浓度(0—60 μmol·L−1)之间具有良好的线性关系(R2 =
0.9999 ),这表明以Co(Ⅱ)和AO7 分别作为催化剂和指示剂建立的AO7分光光度法,用来测定水中PAA浓度是可行的. 图7中PAA浓度测定标准曲线的斜率(k),经拟合计算为7.84×10−3 μmol·L−1·cm−1. 结合空白样品的标准偏差σ(σ = 1.27×10−3,平行测定次数n=7),计算得出AO7分光光度法测定PAA浓度的最低检出限LOD(LOD = 3σ/k)和最低定量限LOQ(LOD = 10σ/k)分别为0.48 μmol·L−1和1.62 μmol·L−1. 上述计算结果表明,本研究建立的AO7分光光度法具有很高的灵敏度,可用于测定水溶液中低浓度的PAA. -
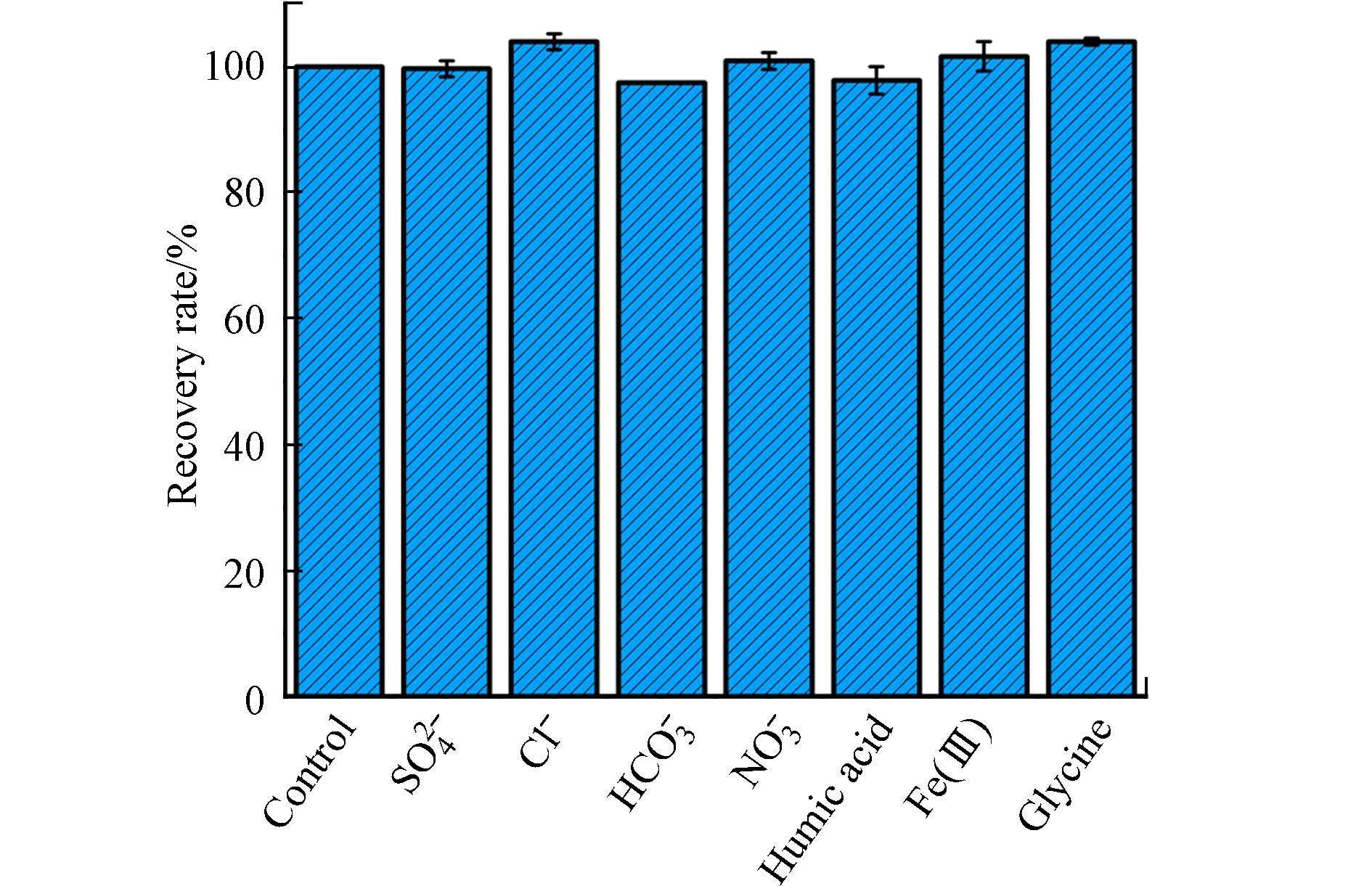
为了评估AO7分光光度法的抗干扰能力,探究了水中常见物质,包括碳酸氢根离子、氯离子、硫酸根离子、硝酸根离子等无机离子、腐殖酸为代表的天然有机物、甘氨酸为代表的生物单分子蛋白类物质以及Fe(Ⅲ)为代表的过渡金属离子对PAA测定的影响. 如图8所示,在碳酸氢根离子、氯离子、硫酸根离子和硝酸根离子浓度为1 mmol·L−1、腐殖酸浓度为1 mg·L−1、甘氨酸浓度为1 mmol·L−1以及Fe(Ⅲ)浓度为20 μmol·L−1时,AO7分光光度法测定水中PAA浓度的回收率均在97.5%—104.4%的范围内. 这表明,AO7分光光度法测定PAA浓度时,几乎不受实际水体中共存物质的干扰. 前期报道的以ABTS为指示剂的测定方法受Fe(Ⅲ)干扰很大,需要加入高浓度氟离子来抑制Fe(Ⅲ)对PAA浓度测定结果的影响[19]. 这表明,AO7分光光度法在测定含Fe(Ⅲ)水样中PAA浓度时具有明显的优势. 值得注意的是,Fe(Ⅲ)也是最常用的PAA催化剂之一. 因此,本研究所建立的AO7分光光度法有助于进一步推动Fe(Ⅲ)/PAA体系的研究与应用.
为了进一步评估AO7分光光度法的抗干扰能力,在不同实际水体中进行了PAA浓度测定的回收率试验,如表1所示. 从表1可以看出,在超纯水、地表水以及地下水等三种不同水体中,采用AO7分光光度法测定PAA浓度的回收率均近似为100%,这表明AO7分光光度法几乎不受实际水体水质背景的干扰.
-
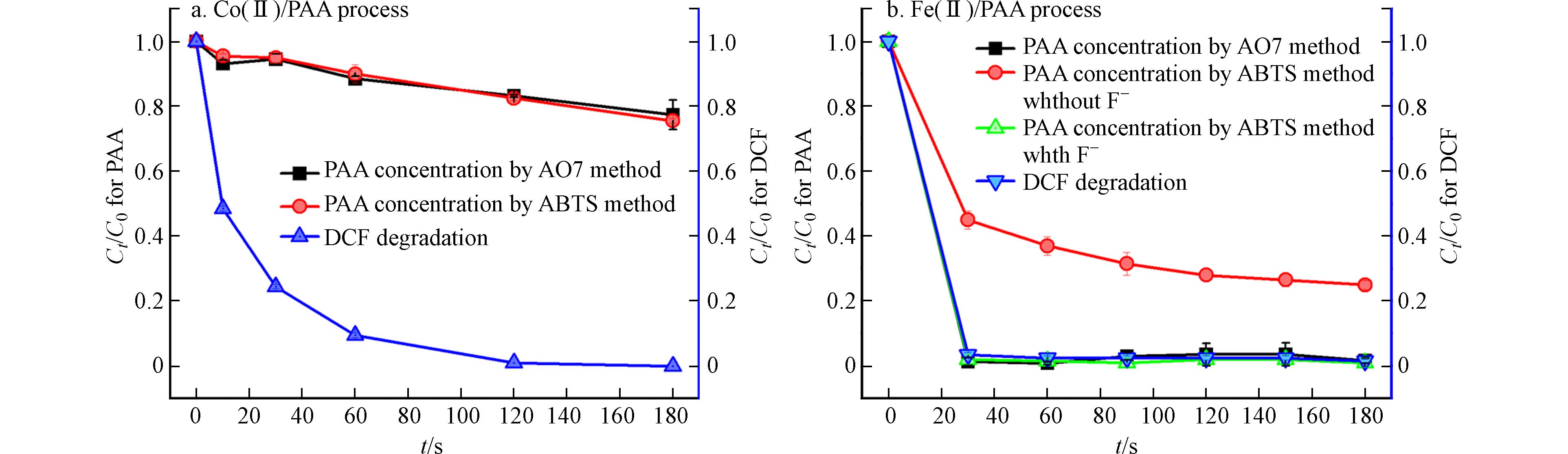
在基于PAA的高级氧化工艺中,快速而准确地监测体系中PAA浓度的变化,对于这些工艺的反应机理研究以及推广运用具有重要意义. 采用本研究建立的AO7分光光度法,对Co(Ⅱ)/PAA体系和Fe(Ⅱ)/PAA体系降解双氯芬酸(DCF)过程中PAA浓度的变化规律进行了监测,并与前期报道的ABTS分光光度法[19]的监测结果进行了对比,如图9所示. 值得注意的是,在体系中,PAA浓度超过了AO7以及ABTS法测定PAA浓度的实验标准曲线线性范围,实验时,通过取不同量的水样进行稀释,从而测定高浓度的PAA. 从图9a中可知,Co(Ⅱ)/PAA体系在3 min内可以将DCF几乎完全降解,而PAA只分解约20%. 采用ABTS分光光度法和AO7分光光度法两种检测方法,监测得到的Co(Ⅱ)/PAA体系降解DCF过程中PAA的分解规律几乎一致,这表明本研究建立的AO7分光光度法可应用于Co(Ⅱ)/PAA体系中PAA浓度的准确测定. 此外,从图9b中可知,Fe(Ⅱ)/PAA体系可迅速将DCF降解完全,而体系中PAA经历了快速分解和慢速分解两个阶段. 值得注意的是,前期报道的ABTS分光光度法会受到PAA水样中Fe(ⅡI)的干扰,使得检测得到的PAA残余浓度偏高. 为了解决水样中Fe(ⅡI)的干扰,需要额外加入大量氟离子(F−)来屏蔽Fe(Ⅲ)的干扰[19]. 从图9b中可以看到,AO7分光光度法监测所得PAA浓度变化规律与加入F−作为掩蔽剂的ABTS分光光度法的监测结果相一致. 这表明本研究建立的AO7分光光度法,特别适合于测定含Fe(Ⅲ)水样中的PAA浓度.
-
本研究基于Co(Ⅱ)选择性催化PAA氧化AO7的褪色反应,以Co(Ⅱ)和AO7分别作为催化剂和指示剂,建立了快速、简便、准确测定水中PAA浓度的AO7分光光度法. 该方法的主要特性如下:
(1) 优化后的反应测定条件为:AO7浓度为80 μmol·L−1、Co(Ⅱ)浓度为1.75 mmol·L−1、pH为5.0以及反应时间为1 min.
(2) 该方法具有测定快速和操作简便的特点,测定反应时间仅为1 min且仅需实验室常规配置的可见光分光光度计即可完成PAA浓度的测定.
(3) 该方法具有很高的灵敏度,可准确测定水样中低浓度的PAA,标准曲线线性范围为0—60 μmol·L−1,LOD为0.48 μmol·L−1.
(4) 该方法抗干扰能力强,不受PAA溶液中共存H2O2以及Fe(Ⅲ)、腐殖酸、碳酸氢根离子等实际水体水质背景物质的干扰.
(5) 该方法可用于地下水和地表水等实际水体中PAA浓度的准确测定,并成功应用于Co(Ⅱ)/PAA体系和Fe(Ⅱ)/PAA体系降解DCF过程中PAA浓度变化规律的准确监测.
基于二价钴催化氧化脱色酸性橙7的分光光度法快速测定水中过氧乙酸浓度
Rapid spectrophotometric determination of peracetic acid in water with cobalt-mediated oxidation decolorization of acid orange 7
-
摘要: 文章开发建立了一种快速、简便、准确测定水中过氧乙酸浓度的分光光度方法. 该方法基于催化氧化脱色原理,利用Co(Ⅱ)选择性催化过氧乙酸氧化脱色酸性橙7. 研究结果表明,酸性橙7脱色程度随过氧乙酸浓度的提高而增加,且酸性橙7在其特征吸收波长484 nm处的吸光度变化值与过氧乙酸浓度具有良好的线性关系. 该方法的检测时间仅为1 min、最低检测限为0.48 μmol·L−1且线性范围为0—60 μmol·L−1. 共存的过氧化氢以及实际水体水质背景中存在的硫酸根离子、氯离子、碳酸氢根离子、硝酸根离子、腐殖酸和三价铁离子对该方法的测定结果均没有显著影响. 该方法还成功运用于监测过氧乙酸活化体系降解双氯芬酸过程中过氧乙酸的浓度变化.Abstract: This work developed a rapid, simple and accurate spectrophotometric method for determining the concentration of peracetic acid. The developed method was based on the oxidation decolorization of acidic orange 7 by PAA using Co(Ⅱ) as the catalyst. The results showed that the decolorization degree of acidic orange 7 increased with the concentration of peracetic acid, and there was a well linear relationship between the concentration of peracetic acid below 60 μmol·L−1 and the absorbance change at 484 nm (the characteristic absorption wavelength of acidic orange 7). Determination time of the AO7 method was as short as 1 minute and limit of detection was calculated as low as 0.48 μmol·L−1. The determination of peracetic acid with the AO7 method were not affected by the coexistent hydrogen peroxide and the substances in actual water samples including sulfate ion, chloride ion, bicarbonate ion, nitrate ion, humic acid, and ferric iron ion. The developed AO7 method was successfully used to monitor the variation of peracetic acid concentration during the degradation of diclofenac in Co(Ⅱ)/PAA and Fe(Ⅱ)/PAA processes.
-
Key words:
- peracetic acid /
- determination method /
- hydrogen peroxide /
- acid orange 7 /
- Co (Ⅱ).
-

-
表 1 AO7分光光度法测定不同水体中PAA浓度的回收率
Table 1. Recovery rate of PAA determined by AO7 spectrophotometric method in different water bodies
水样
Water sample水样中PAA浓度/(μmol·L−1)
PAA concentration in the water sample测得的PAA浓度/(μmol·L−1)
Measured PAA concentrationPAA测定的回收率/%
Recovery rates as determined by PAA超纯水 20.00 20.03±0.13 100.00±0.64 地表水 20.00 20.02±0.13 100.00±0.64 地下水 20.00 20.06±0.15 100.00±0.74 -
[1] MALCHESKY P S. Peracetic acid and its application to medical instrument sterilization[J]. Artificial Organs, 1993, 17(3): 147-152. doi: 10.1111/j.1525-1594.1993.tb00423.x [2] KOIVUNEN J, HEINONEN-TANSKI H. Inactivation of enteric microorganisms with chemical disinfectants, UV irradiation and combined chemical/UV treatments[J]. Water Research, 2005, 39(8): 1519-1526. doi: 10.1016/j.watres.2005.01.021 [3] AO X W, ELORANTA J, HUANG C H, et al. Peracetic acid-based advanced oxidation processes for decontamination and disinfection of water: A review[J]. Water Research, 2021, 188: 116479. doi: 10.1016/j.watres.2020.116479 [4] ZHANG K J, ZHOU X Y, DU P H, et al. Oxidation of β-lactam antibiotics by peracetic acid: Reaction kinetics, product and pathway evaluation[J]. Water Research, 2017, 123: 153-161. doi: 10.1016/j.watres.2017.06.057 [5] CAI M Q, SUN P Z, ZHANG L Q, et al. UV/peracetic acid for degradation of pharmaceuticals and reactive species evaluation[J]. Environmental Science & Technology, 2017, 51(24): 14217-14224. [6] WANG Z P, WANG J W, XIONG B, et al. Application of cobalt/peracetic acid to degrade sulfamethoxazole at neutral condition: Efficiency and mechanisms[J]. Environmental Science & Technology, 2020, 54(1): 464-475. [7] WACŁAWEK S, LUTZE H V, GRÜBEL K, et al. Chemistry of persulfates in water and wastewater treatment: A review[J]. Chemical Engineering Journal, 2017, 330: 44-62. doi: 10.1016/j.cej.2017.07.132 [8] KIM J, ZHANG T Q, LIU W, et al. Advanced oxidation process with peracetic acid and Fe(Ⅱ) for contaminant degradation[J]. Environmental Science & Technology, 2019, 53(22): 13312-13322. [9] KIM J, DU P H, LIU W, et al. Cobalt/peracetic acid: Advanced oxidation of aromatic organic compounds by acetylperoxyl radicals[J]. Environmental Science & Technology, 2020, 54(8): 5268-5278. [10] 邓杰文, 张琳悦, 付永胜, 等. Cu(Ⅱ)协同热活化过氧乙酸降解水中双氯芬酸[J]. 环境化学, 2023, 42(4): 1222-1229. doi: 10.7524/j.issn.0254-6108.2021111602 DENG J W, ZHANG L Y, FU Y S, et al. Degradation of diclofenac in water by Cu(Ⅱ)-combined with heat activation of peracetic acid[J]. Environmental Chemistry, 2023, 42(4): 1222-1229 (in Chinese). doi: 10.7524/j.issn.0254-6108.2021111602
[11] 戴寅豪, 杨绍贵, 祁承都, 等. 活化过氧乙酸技术去除水体有机污染物研究进展[J]. 环境化学, 2021, 40(2): 497-508. doi: 10.7524/j.issn.0254-6108.2020083001 DAI Y H, YANG S G, QI C D, et al. Activation of peracetic acid process for aquatic organic pollutants degradation: A review[J]. Environmental Chemistry, 2021, 40(2): 497-508 (in Chinese). doi: 10.7524/j.issn.0254-6108.2020083001
[12] 汪诗翔, 陈卓, 王真然, 等. 亚铁联合过氧乙酸降解水中的三氯生[J]. 环境化学, 2022, 41(9): 3033-3041. doi: 10.7524/j.issn.0254-6108.2021051402 WANG S X, CHEN Z, WANG Z R, et al. Degradation of triclosan by Fe2+-peracetic acid system in water[J]. Environmental Chemistry, 2022, 41(9): 3033-3041 (in Chinese). doi: 10.7524/j.issn.0254-6108.2021051402
[13] RAGAZZO P, CHIUCCHINI N, PICCOLO V, et al. Wastewater disinfection: Long-term laboratory and full-scale studies on performic acid in comparison with peracetic acid and chlorine[J]. Water Research, 2020, 184: 116169. doi: 10.1016/j.watres.2020.116169 [14] LIN J B, XIAO J Y, CAI H Y, et al. Multi-wavelength spectrophotometric determination of peracetic acid and the coexistent hydrogen peroxide via oxidative coloration of ABTS with the assistance of Fe2+ and KI[J]. Chemosphere, 2022, 287: 132242. doi: 10.1016/j.chemosphere.2021.132242 [15] SODE F. Simultaneous determination of peracetic acid and acetic acid by titration with NaOH[J]. Analytical Methods, 2014, 6(7): 2406-2409. doi: 10.1039/C3AY41836G [16] ZHANG T Q, HUANG C H. Simultaneous quantification of peracetic acid and hydrogen peroxide in different water matrices using HPLC-UV[J]. Chemosphere, 2020, 257: 127229. doi: 10.1016/j.chemosphere.2020.127229 [17] LI J, TU W W, LEI J P, et al. Porphyrin-functionalized gold nanoparticles for selective electrochemical detection of peroxyacetic acid[J]. Electrochimica Acta, 2011, 56(9): 3159-3163. doi: 10.1016/j.electacta.2011.01.060 [18] DOMÍNGUEZ-HENAO L, TUROLLA A, MONTICELLI D, et al. Assessment of a colorimetric method for the measurement of low concentrations of peracetic acid and hydrogen peroxide in water[J]. Talanta, 2018, 183: 209-215. doi: 10.1016/j.talanta.2018.02.078 [19] YUAN N, LI H C, QIAN J S. Determination of peracetic acid in the presence of hydrogen peroxide based on the catalytic oxidation of ABTS[J]. Chemical Engineering Journal Advances, 2022, 10: 100247. doi: 10.1016/j.ceja.2022.100247 [20] ZHANG K J, SAN Y L, CAO C, et al. Optimising the measurement of peracetic acid to assess its degradation during drinking water disinfection[J]. Environmental Science and Pollution Research International, 2020, 27(27): 34135-34146. doi: 10.1007/s11356-020-09505-6 [21] PINKERNELL U, LÜKE H J, KARST U. Selective photometric determination of peroxycarboxylic acids inthe presence of hydrogen peroxide[J]. Analyst, 1997, 122(6): 567-571. doi: 10.1039/a700509a [22] XIAO J Y, WANG M Y, PANG Z J, et al. Simultaneous spectrophotometric determination of peracetic acid and the coexistent hydrogen peroxide using potassium iodide as the indicator[J]. Analytical Methods, 2019, 11(14): 1930-1938. doi: 10.1039/C8AY02772B [23] 田丹, 吴玮, 沈芷璇, 等. Co(Ⅱ)活化过氧乙酸降解有机染料研究[J]. 环境科学学报, 2018, 38(10): 4023-4031. TIAN D, WU W, SHEN Z X, et al. Degradation of organic dyes with peracetic acid activated by Co(Ⅱ)[J]. Acta Scientiae Circumstantiae, 2018, 38(10): 4023-4031 (in Chinese).
[24] KIM Y, LOGAN B E. Simultaneous removal of organic matter and salt ions from saline wastewater in bioelectrochemical systems[J]. Desalination, 2013, 308: 115-121. doi: 10.1016/j.desal.2012.07.031 -



 下载:
下载: