-
在空气传播途径中,大气细颗粒物(PM2.5)成分复杂、粒径小、数量多、表面积大,可承载大量的重金属(heavy metals, HMs),是重金属扩散的“理想载体”[1]. 作为大气颗粒物中重金属污染的重要来源,有色金属冶炼厂区及其周边区域PM2.5载带重金属的污染形势严峻[2 − 3]. 其中,砷(arsenic, As)是有色金属冶炼区域中最常见的重金属之一,其存在形式复杂多样,包括无机砷和有机砷[4]. 三价砷[As(Ⅲ)]和五价砷[As(Ⅴ)]被认为是毒性最强的化学形态,而无机形态甲基化形成的有机化合物如二甲基砷(DMA)、一甲基砷(MMA)、砷甜菜碱(AsB)等毒性相对较小[5]. 长期暴露于高As环境中会导致各种健康问题,例如肺癌、心脑血管疾病和肠道疾病等[6 − 8]. 云南省某有色冶炼工业园区道路PM2.5中重金属的平均含量高于PM10,其中As的平均含量最高,对成人和儿童具有显著的非致癌风险[9]. 株洲市是我国主要的有色金属冶炼基地之一,城市大气污染受周边有色金属冶炼工业的影响比较大. 针对大气颗粒物中痕量元素的研究发现As是细颗粒物中积累量最高的元素之一,是城市居民潜在的健康威胁[10]. 相比于城市区域,有色金属冶炼场地PM2.5载带As(PM2.5-As)具有种类多样、含量丰富、传播范围广以及机体吸收率高等特点,能够造成更大程度的健康风险[3].
肠道菌群作为人体内最大的微生物生态系统,是整合多种环境因素与遗传因素的中心枢纽. 肠道微生物参与分解食物中的纤维素、淀粉等难以消化的碳水化合物,产生有益的短链脂肪酸等代谢产物,帮助人体吸收营养物质,调节胰岛素敏感性,影响脂质代谢等[11]. 近年来,肠道菌群的紊乱与多种疾病的发生密切相关,包括肠道疾病、肥胖症和自身免疫性疾病等[12 − 13]. 越来越多的证据表明,肠道微生物与砷之间存在复杂的相互作用,砷暴露可能会影响肠道微生物组和代谢组[14]. 砷的长期经口暴露(10 mg·kg−1)可显著影响 C57BL/6小鼠的肠道微生物组组成,包括门水平上的蓝藻、厚壁菌门、软壁菌门和疣微菌门的比例[15 − 16]. 48 h的砷经口暴露(0.05 mg·kg−1)显著增加了出生21 d小鼠的脱铁杆菌丰度[17]. 此外,肠道细菌丰度和多样性的改变也会导致其代谢功能的紊乱. 研究发现,经口暴露亚砷酸钠(50 mg·kg−1)显著改变了小鼠从门到种的肠道微生物群的组成和代谢物的组成,特别是与氨基酸相关的代谢物[18 − 19]. 值得注意的是,现有关于砷和肠道微生物的研究主要是基于食物和饮用水中的砷的浓度和化学形态开展的经口暴露. 大气中PM2.5-As主要以呼吸道吸入方式进入人体. 虽然PM2.5-As吸入暴露途径与肠道菌直接作用的几率小于经口暴露,但能够通过吞咽-肠道、肺-肠轴、诱发机体炎症以及免疫系统等方式直接或间接地影响肠道菌群的多样性. 现有研究表明PM2.5-As暴露相关的肠道菌群改变可能进一步导致甲状腺功能异常、肠道紊乱、早衰和不良生殖结局[20 − 22]. 然而,通过呼吸道吸入的PM2.5-As对肠道菌群结构和代谢的影响仍鲜有研究.
本研究以有色金属冶炼场地PM2.5-As的浓度和化学形态为暴露依据,采用气管滴注暴露方式,探究长期吸入PM2.5-As对小鼠肠道菌群结构及代谢的影响,以期为了解砷暴露的毒性作用及其致病机制提供重要线索.
-
C57BL/6 雄性小鼠(6周龄,体重18—20 g)购自广东省医学实验动物中心. 所用试剂包括三价砷[As(Ⅲ)]、五价砷[As(V)]、一甲基砷(MMA)、配制PM2.5-As暴露溶液过程中,As(V)(CAS:
7778 -39-4)和As(Ⅲ)(CAS:1327 -53-3)标准溶液购自O2Si(查尔斯顿,美国),MMA(CAS:124-58-3)标准溶液从中国计量科学研究院购入. 微生物组学研究中,E.Z.N.A.DNA试剂盒购自美国 Omega Bio-Tek 公司,AxyPrep DNA凝胶提取试剂盒购自美国Axygen Biosciences 公司. 非靶向代谢组学分析中,甲醇和二氯甲烷购自广州化学试剂厂,乙腈和甲酸购自Merck公司,并从广州捷威斯生物公司购入4-氯苯丙氨酸作为内标. -
本研究以真实大气PM2.5环境中As的成分和浓度为根据,对小鼠进行颗粒物气管滴注暴露. 金属冶炼场地中PM2.5中As的主要形态有As(V)、As(Ⅲ)和MMA,比重分别为82.7%、17.2%和0.17%[8]. 根据此比例,使用As(V)、As(Ⅲ)和MMA标准溶液配制暴露液. 16只6周龄健康雄性C57BL/6小鼠,随机分为两组,每组8只小鼠:一组为暴露组(T),PM2.5-As暴露剂量为42.5 μg·kg−1·b.w.,代表PM2.5-As的全年最高浓度的5倍;一组为对照组(C),暴露液为0.9%的生理盐水.
对小鼠采用自由饮食和自饮水的饲养方式,室温保持恒定,光照符合自然日夜条件. 小鼠采用隔天滴注的暴露方式,对照组单次使用20 μL 0.9%生理盐水,暴露组单次使用20 μL 63.8 mg·mL−1的滴注液,每周3次,共暴露8周. 之后,将两组小鼠分别放进铺有无菌滤纸的铁笼里,当小鼠排便后立即收集粪便样品于灭菌离心管中,加入适当液氮进行冷冻,并放入-80 ℃冰箱进行保存. 该动物研究已获得广东工业大学动物伦理委员会(GDUTXS2022103)的批准,所有操作均遵循《实验动物护理和使用指南》.
-
动物暴露8周后,收集暴露组和对照组小鼠的粪便样品,使用E.Z.N.A. DNA试剂盒提取其中微生物群落基因组的DNA. 通过PCR热循环仪,使用引物对16SrRNA基因中的V3—V4可变区域的338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)进行扩增. 扩增完成后,对扩增产物进行纯化并在Illumina MiSeq平台上富集. 根据美吉生物制药科技有限公司开发的标准方法对混合扩增片段进行配对端的高通量测序. 使用usparse(版本7.1),在相似度为97%的情况下,对操作分类单元(OTUs)进行截断和分类,以便识别和清除嵌合序列. 采用RDP分类器(版本2.2)对16S rRNA数据进行分类,研究每个基因序列的系统发生关系,确保置信阈值为0.7.
-
精确称量50 mg已冻干的小鼠粪便样品,加入1 mL含内标 4-氯苯丙氨酸的萃取剂(甲醇:乙腈:水=2:2:1,V/V/V)混合. 将匀浆后的粪便进行超声,此步骤重复3次. 以
13000 r·min−1的转速保持4 ℃离心15 min. 收集上清液,在氮气流下吹干,后加入180 μL甲醇-水(V/V=1:1)进行定容,等待上机.采用超高效液相色谱-四极杆-静电场轨道阱高分辨质谱法(UPLC-Q-Orbitrap-HRMS)分析非靶向代谢组学数据,仪器为超高效液相色谱仪(ThermoScienticTMDionex U3000,美国)和四极杆-静电场轨道阱高分辨串联质谱(ThermoScientic Q Exactiver,美国). 采用赛默飞公司的Hypersi1 GOLD C18色谱柱(100 mm×2.1 mm,19 μm,美国)对代谢物进行分离,然后在电喷雾电离源(electron spray ionization,ESI)条件下,分别采集正、负离子模式的数据. 对于色谱端,流动相A使用0.1%甲酸水溶液,流动相B为100%乙腈;流动相梯度详见表1,其中流量保持在0.25 mL·min−1,柱温维持在40 ℃,每次进样量为5 μL. 质谱端使用H-ESI离子源,喷射电压正负极分别设置为4.0 IKV1(+)和3.0 IKV1(-).
-
使用XCMS Online (https://xcmsonline.scripps.edu/)数据库进行数据预处理,以此改变目标分子的分子量、质荷比(m/z)、保留时间和丰度等特征. 之后,进一步筛选差异代谢物,将筛选出的差异特征离子进行MS/MS分析,并将其与人类代谢组数据库(HMDB)和METLIN数据库中已有的代谢产物的二级谱图进行比对. 结合KEGG数据库,使用MetaboAnalyst 5.0进行代谢通路分析.
-
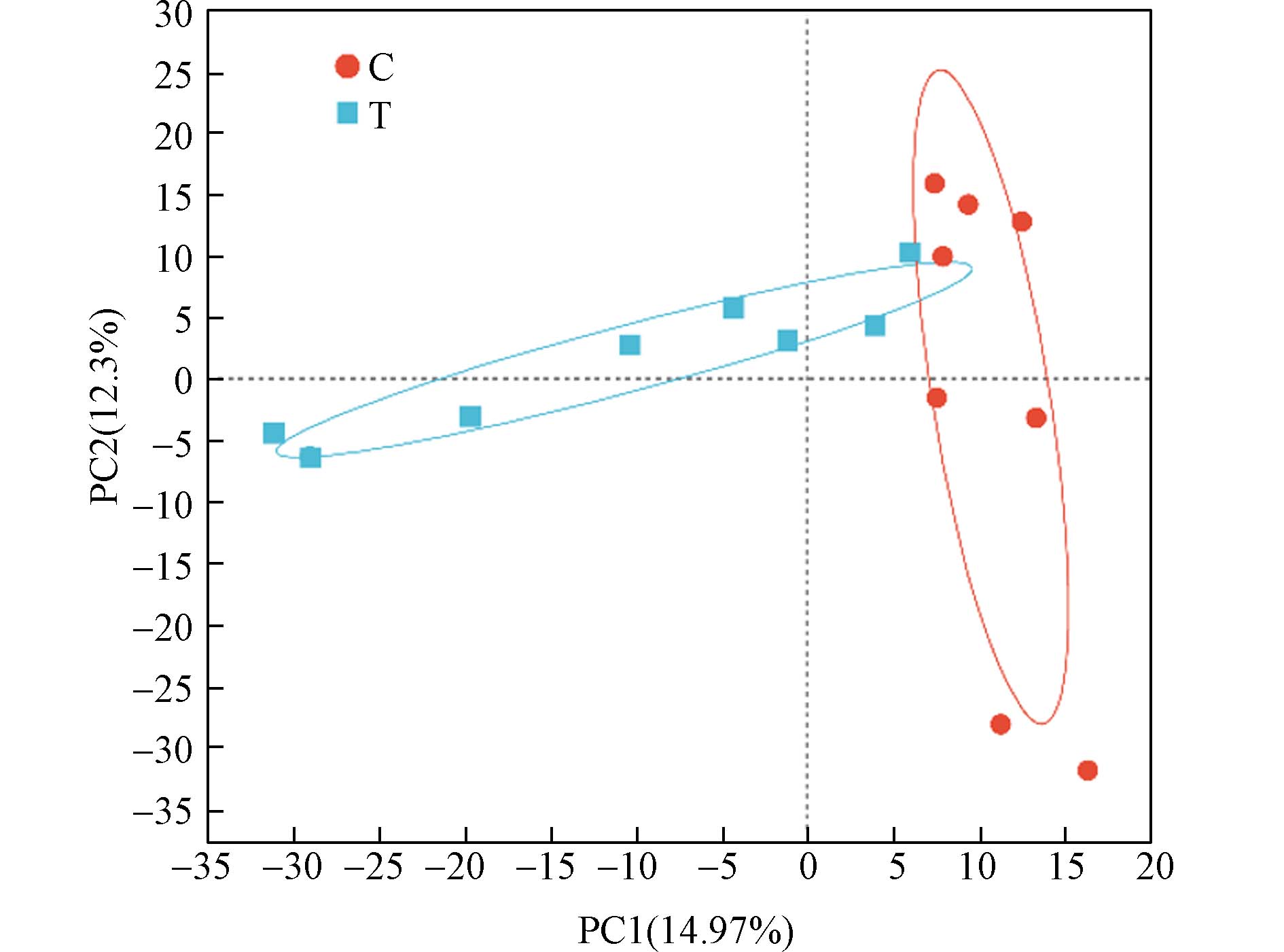
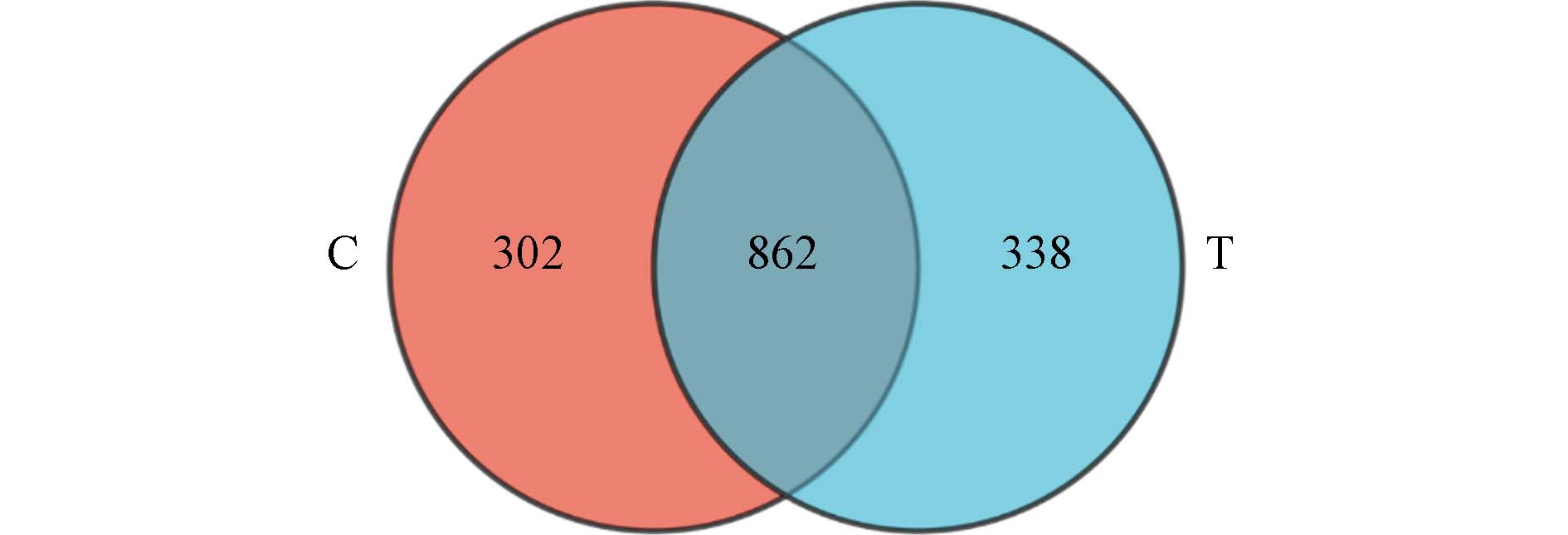
为了探究PM2.5-As暴露对肠道微生物的影响,本研究使用16S rRNA基因测序技术对暴露组和对照组的粪便样品进行分析. 操作分类单元(OTU)是为了方便系统发生学或群体遗传学研究而设置的分类单元标志. Venn图能够可视化不同集合之间的重叠关系,在肠道微生物组学的研究中常用于表现OTU的组成以及不同样品之间的差异性,直观展示了物种之间的相似性和差异程度. 如图1的Venn图显示,对照组(C)和暴露组(T)之间相同的OTU有862个,重叠率为57.39%,独有菌种分别为302个和338个. 由图2可见,主成分分析(PCA)结果显示对照组和暴露组的肠道微生物菌群组成具有显著的差异性,主成分贡献率PC1和PC2分别为14.97%和12.3%,表明PM2.5-As暴露显著改变了肠道菌群的结构和组成.
已有研究报道PM2.5实时吸入暴露能够导致小鼠肠道微生物组紊乱并引发机体损伤[23 − 24]. 空气中的颗粒物可以通过口腔和呼吸道黏膜纤毛等各种途径进入肠道[25]. PM2.5 到达肺部后被巨噬细胞吞噬,并通过黏液纤毛运输到口咽,随后被摄入胃肠道[26]. 考虑到PM2.5的复杂组分以及空气污染与肠道疾病之间的密切关系[27],本文进一步证实了有色金属冶炼场地PM2.5-As暴露能够诱发肠道微生物组的紊乱,为探究PM2.5中砷的毒理学机制提供了新的线索.
-
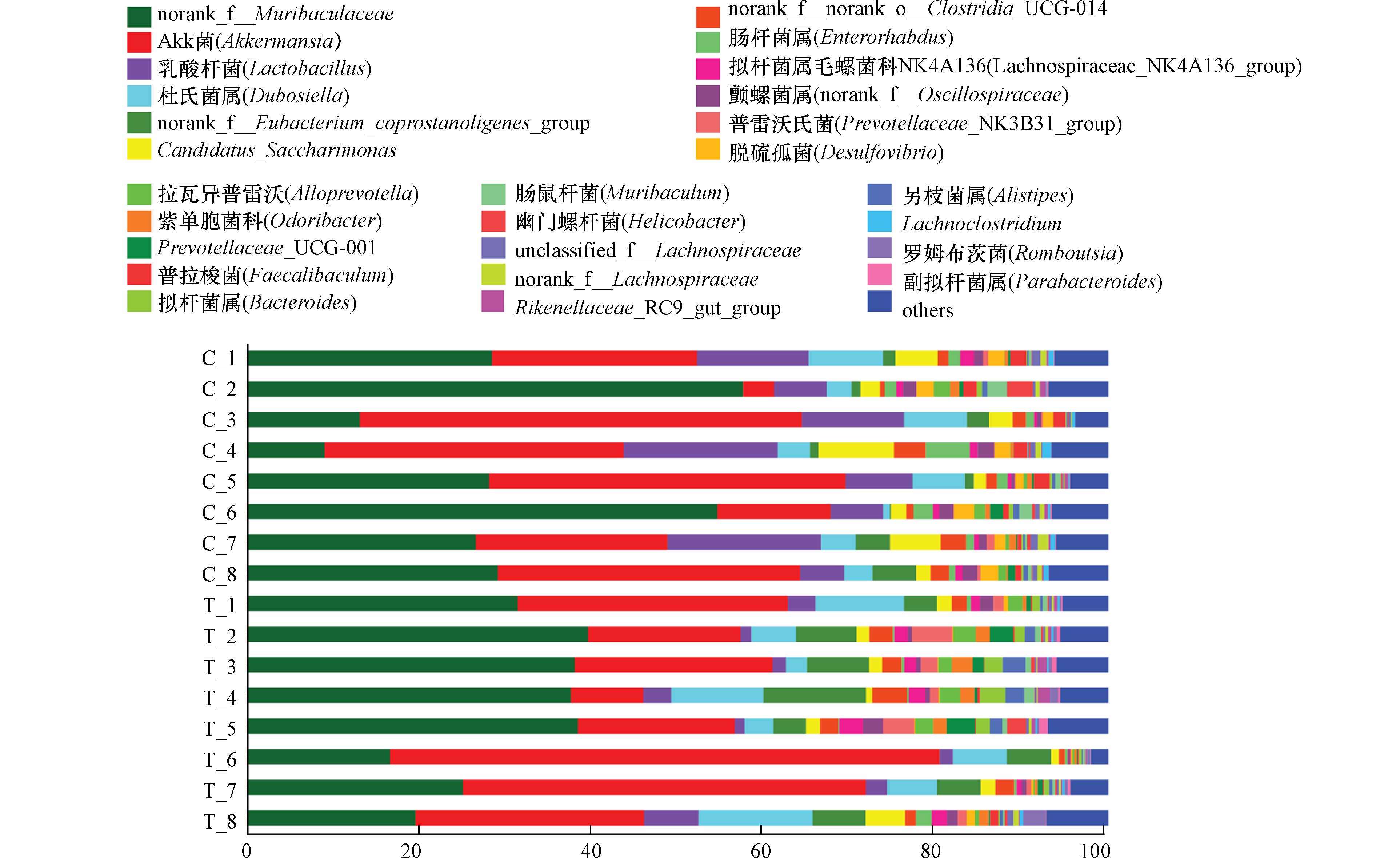
在Venn图和OTU物种组成分析的基础上,进一步对微生物群落组成进行分析,并使用群落柱状图对结果进行表示. 如图3显示,PM2.5-As暴露共影响了27个菌属水平,其中丰度改变较大的包括乳酸杆菌(Lactobacillus)、Akk菌(Akkermansia)和拟杆菌(Muribaculaceae)等. 同时,PM2.5-As暴露后肠道菌群主要改变的优势菌大多属于厚壁菌门(Firmicutes). 与对照组相比,暴露组的乳酸杆菌丰度有所减少,而Akk菌的丰度明显增加.
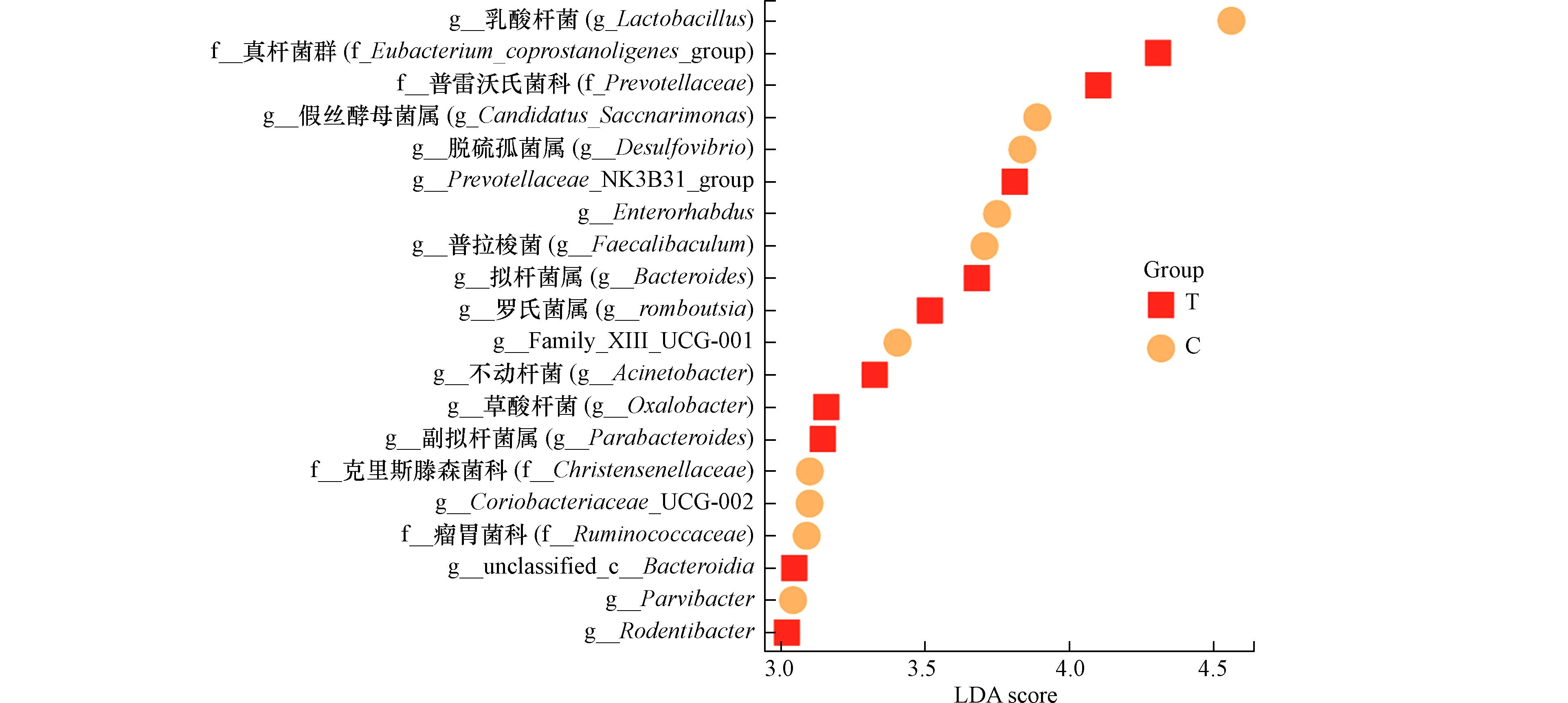
采用随机森林线性判别分析(LDA)评分来确定对照组和暴露组中受影响最大的菌群,旨在揭示该物种可能在环境胁迫中起到的关键作用. 设置阈值LDA>3,P<0.05对肠道菌群进行筛选,两种不同颜色分别代表对照组和暴露组. 如图4所示,两组之间显著富集的微生物有20组,其中对照组中LDA得分较高的3组分别为,乳酸杆菌(Lactobacillus)、糖杆菌(Saccharimonas)和脱硫弧菌(Desulfovibrio);而暴露组LDA得分较高的主要为真细菌(Eubacterium)和普雷沃特菌(Prevotellaceae). 显而易见,PM2.5-As暴露明显改变了肠道内的乳酸杆菌数量及其占比,这与图3中PM2.5-As暴露抑制乳酸杆菌丰度结果一致. 已有研究表明重金属砷As暴露可能通过直接毒性作用、影响菌群平衡、干扰代谢途径、调节免疫反应以及改变菌群微环境等多种途径和机制,协同影响肠道乳酸杆菌在肠道中的数量和功能[28].
乳酸杆菌在人体中发挥着重要作用,可将己糖转化为乳酸,从而抑制多种有害细菌的生长[29]. 乳酸杆菌显著参与短链脂肪酸(丁酸盐、丙酸盐和乙酸盐)的产生,有助于局部上皮屏障的完整性和免疫激活[30],其水平变化可能与帕金森疾病有关[31]. 同时,乳酸杆菌能够在调节肠道微生态平衡和减轻肠道炎症方面发挥积极作用[32];此外,肠道内乳酸杆菌具有影响机体神经系统发育和系统功能的潜在作用,并涉及情绪调节系统[33 − 34]. 由此可以推断PM2.5-As暴露可能通过降低乳酸杆菌丰度来影响人体的炎症因子水平、免疫功能、神经调节等,从而对人体的健康造成危害.
-
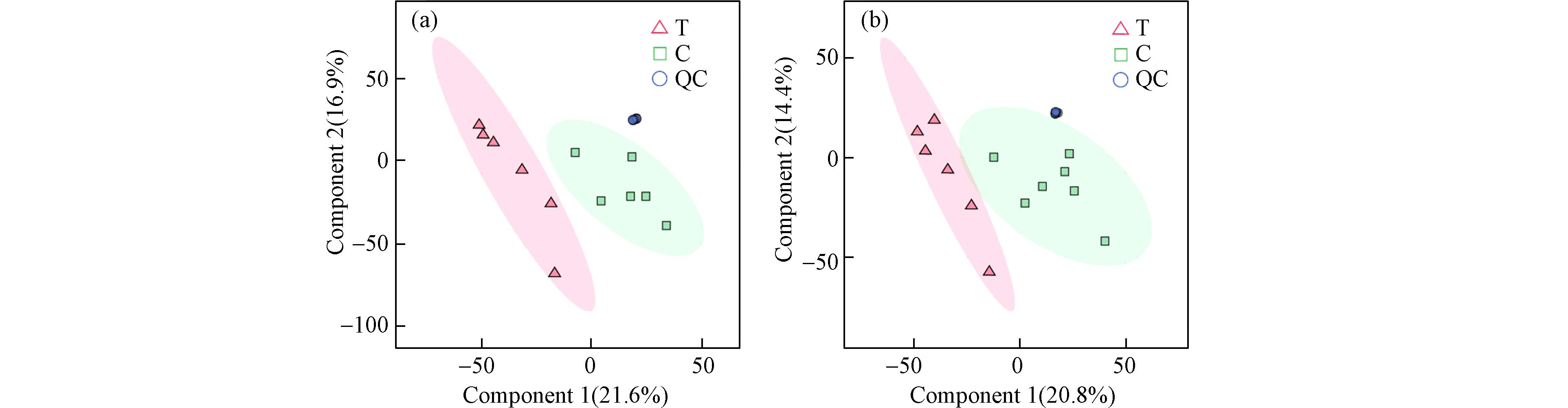
为了探究PM2.5-As暴露对小鼠体内肠道微生物代谢过程产生的影响,本研究通过非靶向代谢组学方法对暴露后的小鼠粪便样品进行研究. 非靶向代谢组学中常用的统计模型为偏最小二乘判别分析(PLS-DA),由正负离子扫描后采集的一级代谢物谱图进行分析,构建PLS-DA模型. 如图5所示,POS中对照组C与暴露组T间存在明显距离,NEG中对照组和暴露组整体呈分离趋势,说明PM2.5-As的暴露已经对小鼠的代谢产生严重影响. 同时质控组QC高度集中,样品点聚集紧密,表明该仪器具有良好的稳定性,数据可信度高. 因此,可初步推断PM2.5-As暴露扰乱了肠道菌的丰度以及结构的稳定性,继而使其代谢谱图发生改变.
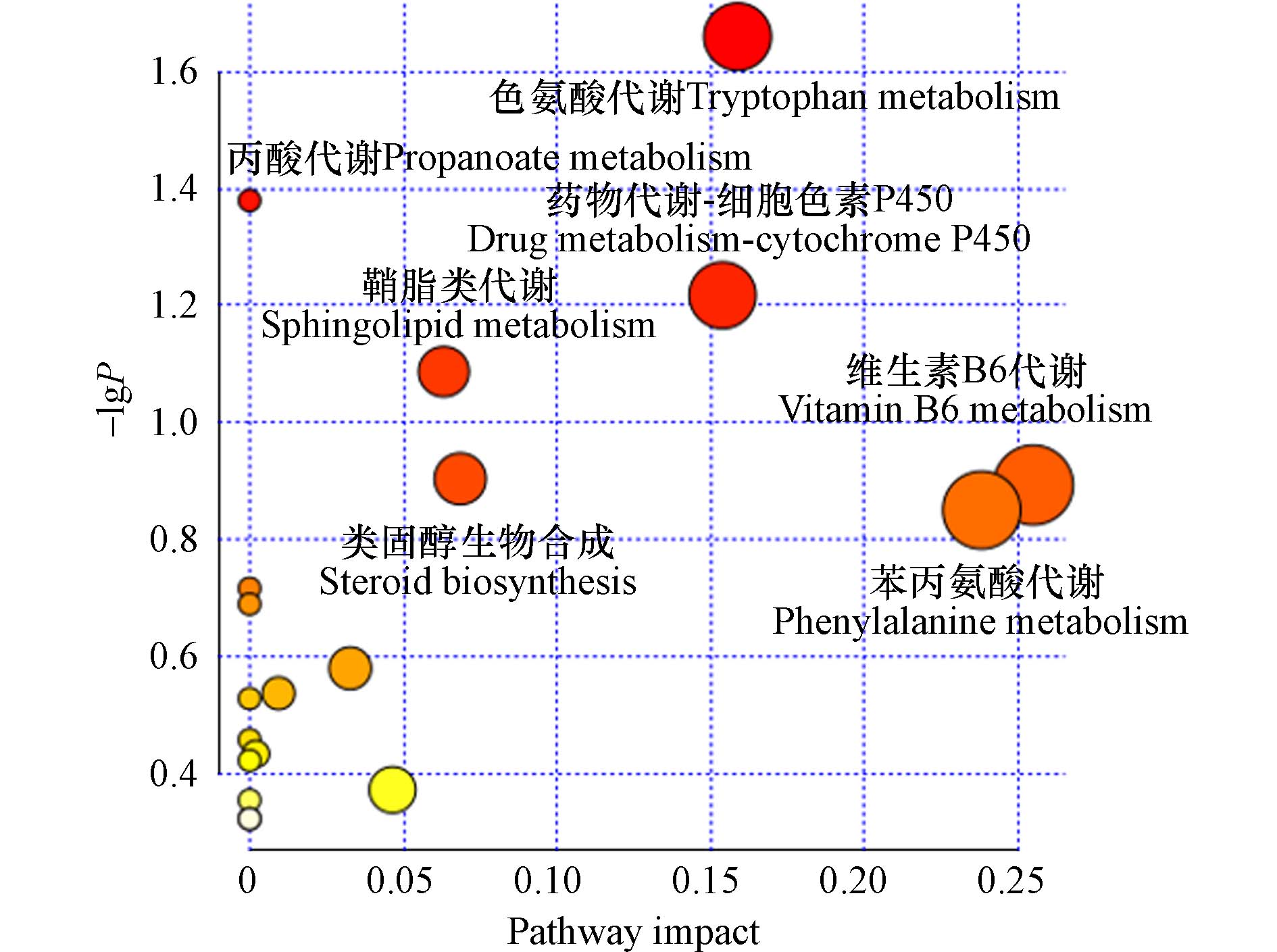
基于肠道菌群代谢数据,使用差异倍数分析、T检验和PLS-DA分析进行差异代谢物的筛选,进而开展通路富集分析. 差异性代谢产物筛选参数标准设置为VIP值>1、FC>1.2或<0.8、P<0.05. 本文共筛选出317种差异代谢物,主要差异代谢物包括色胺(tryptamine)、5-羟色胺(serotonin)、5-羟基吲哚-3-乙酸(5-hydroxyindole-3-acetic acid)和琥珀酸(succinic acid)等,其中POS端有228种差异代谢物,NEG端有99种差异代谢物,重复值为10. 如二级通路图6所示,在正、负离子模式中,PM2.5-As参与调控的生物代谢途径有19条,包括色氨酸代谢(tryptophan metabolism)、丙酸代谢(propanoate metabolism)、药物代谢-细胞色素P450(drug metabolism-cytochrome P450)、类固醇生物合成(steroid biosynthesis)、鞘脂代谢(sphingolipid metabolism)、维生素B6代谢(vitamin B6 metabolism)、苯丙氨酸代谢(phenylalanine metabolism)等. PM2.5-As暴露显著改变了色氨酸代谢和丙酸代谢,其中色氨酸代谢为最主要差异通路.
色氨酸是哺乳动物的一种必需氨基酸,在宿主细胞内代谢为犬尿氨酸、5-HT及其衍生物,可参与神经元功能、机体免疫和肠道稳态等多种生理过程[35]. 色氨酸在动物体内可通过多条途径进行代谢,产生不同代谢产物来调控和保证动物肠道屏障功能的稳定,改善机体的健康[36]. 当色氨酸代谢被PM2.5-As暴露干扰之后,主要使犬尿氨酸和5-HT信号通路发生改变,可能对神经炎症因子水平、大脑代谢水平等产生影响. 同时,色氨酸水平过高或过低都会使生物体发生疾病,如腹泻患者与其血液高水平色氨酸呈正相关. 重度抑郁症发作的患者血液中色氨酸和5-HT水平却显著低于正常人体[37]. 因此,PM2.5-As暴露可能引起生物体氧化应激,影响肠道菌群的色氨酸代谢等代谢通路水平,从而使机体产生健康风险.
-
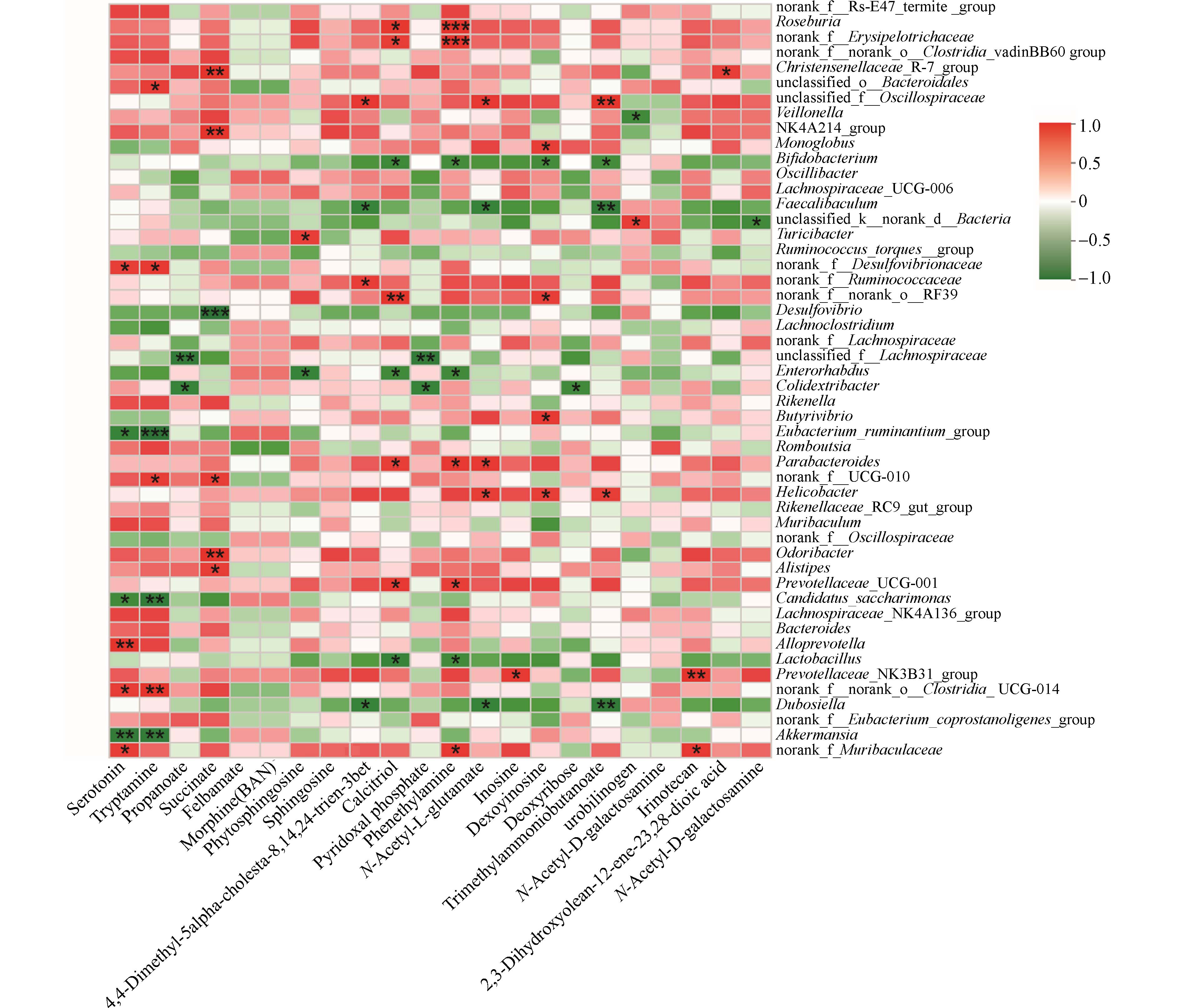
为了深入探究肠道菌群分布与肠道内代谢物之间的相互关系,本研究对不同组别的小鼠粪便样品进行进一步分析. 通过Spearman相关性分析,本研究评估了50种关键菌属与23种显著差异的代谢物之间的关联. 结果如图7所示,罗斯菌属(Roseburia)和丹毒丝菌科(Erysipelotrichaceae)与钙三醇(calcitriol)和苯乙胺(phenethylamine)表现出显著的正相关性. 而乳酸杆菌属(Lactobacillus)与上述代谢物则显示出负相关性. 此外,真杆菌(Eubacterium_ruminantium_group)与色胺(tryptamine)之间存在显著的负相关关系,脱硫弧菌属(Desulfovrio)与琥珀酸(succinate)同样显示出类似的负相关性. 这些相关性的变化进一步影响了色氨酸代谢(tryptophan metabolism)和丙酸代谢(propanoate metabolism). 综上所述,PM2.5-As暴露所引起的肠道菌群多样性及相关代谢通路的变化,可能与特定肠道微生物及其代谢产物的相互作用有关.
-
(1)PM2.5-As呼吸暴露显著影响了27个肠道微生物菌群的丰度和结构特征,其中乳酸杆菌是受影响最大的菌群.
(2)PM2.5-As呼吸暴露在扰乱肠道菌结构稳定性的同时,也随之改变了肠道菌群的代谢特征和通路,涉及到的潜在代谢途径共有19条,主要包括色氨酸代谢和丙酸代谢等代谢通路.
(3)PM2.5-As呼吸暴露引发的肠道菌群紊乱与其代谢功能异常具有相关性,罗斯菌属和丹毒丝菌科与钙三醇和苯乙胺呈显著正相关,而与乳酸杆菌属则呈负相关. 另外,真杆菌与色胺以及脱硫弧菌属与琥珀酸之间存在显著的负相关性,这些关系可能影响了色氨酸代谢和丙酸代谢通路.
PM2.5中重金属砷呼吸暴露对肠道菌群结构及代谢的影响
The effects of long-term respiratory exposure to heavy metal arsenic in PM2.5 on the structure and metabolism of gut microbiota
-
摘要: 重金属砷(As)不仅具有致癌性,还能诱发和加剧心血管、呼吸以及生殖等多种系统疾病. 有色金属冶炼区域大气细颗粒物(PM2.5)载带的重金属As(PM2.5-As)具有浓度高、传播广、危害大以及生物吸收效率高等特点,因此,能够对机体造成更大程度的损伤和危害. 现有的研究表明肠道微生物是环境污染物暴露诱发机体损伤的重要“枢纽”. 然而,关于有色金属冶炼场地PM2.5-As吸入暴露对肠道菌微生物群落多样性及其代谢功能影响的研究仍存在不足. 本研究依据有色金属冶炼场地PM2.5-As的环境浓度及组成开展动物暴露研究,探究PM2.5-As暴露对肠道菌群组成及代谢的影响. 结果显示,PM2.5-As暴露显著影响了微生物菌群的丰度和特征结构,其中乳酸杆菌是受影响最大的肠道菌属. 在此基础上,使用非靶向代谢组学方法,共筛选出317种差异代谢物,而色氨酸代谢是受PM2.5-As暴露影响最为显著的代谢通路. 本研究不仅为PM2.5-As的健康危害提供了新的证据,还为相关疾病的预防和治疗提供了科学依据.Abstract: Heavy metal arsenic (As) not only has carcinogenicity, but also can induce and aggravate cardiovascular, respiratory, reproductive and other systemic diseases. The heavy metal As carried by atmospheric fine particles (PM2.5-As) in non-ferrous metal smelting areas has the characteristics of high concentration, widespread, great harm and high biological absorption efficiency. Therefore, it can cause greater damage and harm to the body. Previous studies have shown that gut microbiota was an important “hub” for body damage induced by environmental pollutant exposure. However, the effects of PM2.5-As inhalation exposure on intestinal microbial community diversity and metabolism in non-ferrous metal smelting sites remain to be explored. In this study, animal exposure studies were carried out based on the environmental concentration and composition of PM2.5-As in non-ferrous metal smelting sites to explore the effects of PM2.5-As exposure on the composition and metabolism of gut microbiota. The results showed that PM2.5-As exposure significantly affected the abundance and characteristic structure of gut microbiota, among which Lactobacillus was the most affected gut microbiota. On this basis, a total of 317 metabolites were screened by non-targeted metabolomics, and tryptophan metabolism was the most significant metabolic pathway affected by PM2.5-As exposure. The results of this paper not only provide new evidence for the health hazards of PM2.5-As, but also provide the scientific basis for the prevention and treatment of related diseases.
-
Key words:
- PM2.5-As /
- inhalation exposure /
- gut microbiota /
- metabolic pathway.
-

-
表 1 UPLC-Q-Orbitrap HRMS 流动相梯度
Table 1. UPLC-Q-Orbitrap HRMS mobile phase gradient
时间
Time/min流动相A%
Mobile phase A流动相B%
Mobile phase B0 95 5 2 95 5 6 20 80 12 5 95 16 5 95 16.1 95 5 22 95 5 -
[1] LIU F, WANG Z J, WEI Y Y, et al. The leading role of adsorbed lead in PM2.5-induced hippocampal neuronal apoptosis and synaptic damage[J]. Journal of Hazardous Materials, 2021, 416: 125867. doi: 10.1016/j.jhazmat.2021.125867 [2] ZHANG J W, SUN X H, DENG J G, et al. Emission characteristics of heavy metals from a typical copper smelting plant[J]. Journal of Hazardous Materials, 2022, 424: 127311. doi: 10.1016/j.jhazmat.2021.127311 [3] HE X C, ZHAO Q T, CHAI X Y, et al. Contribution and effects of PM2.5-bound lead to the cardiovascular risk of workers in a non-ferrous metal smelting area considering chemical speciation and bioavailability[J]. Environmental Science & Technology, 2023, 57(4): 1743-1754. [4] 冉茂霞, 吴迪, 史永富, 等. 砷在水生生物中的生物累积、转化及在其他生物体内的代谢毒理学研究进展[J]. 环境化学, 2024, 43(4): 1069-1084. doi: 10.7524/j.issn.0254-6108.2022100401 RAN M X, WU D, SHI Y F, et al. Research progress on arsenic’s bioaccumulation and biotransformation in aquatic organisms, and its metabolism and toxicology in other organisms[J]. Environmental Chemistry, 2024, 43(4): 1069-1084 (in Chinese). doi: 10.7524/j.issn.0254-6108.2022100401
[5] SHARMA V K, SOHN M. Aquatic arsenic: Toxicity, speciation, transformations, and remediation[J]. Environment International, 2009, 35(4): 743-759. doi: 10.1016/j.envint.2009.01.005 [6] 马婉琪, 张娜, 刘思金, 等. 重金属砷、镉和铅对树突状细胞的差异化功能损伤[J]. 环境化学, 2024, 43(5): 1474-1483. doi: 10.7524/j.issn.0254-6108.2023050404 MA W Q, ZHANG N, LIU S J, et al. Diverse effects of heavy metals on the functions of dendritic cells[J]. Environmental Chemistry, 2024, 43(5): 1474-1483 (in Chinese). doi: 10.7524/j.issn.0254-6108.2023050404
[7] RAHAMAN M S, RAHMAN M M, MISE N, et al. Environmental arsenic exposure and its contribution to human diseases, toxicity mechanism and management[J]. Environmental Pollution, 2021, 289: 117940. doi: 10.1016/j.envpol.2021.117940 [8] QI Z H, ZHAO Q T, YU Z X, et al. Assessing the impact of PM2.5-bound arsenic on cardiovascular risk among workers in a non-ferrous metal smelting area: Insights from chemical speciation and bioavailability[J]. Environmental Science & Technology, 2024, 58(19): 8228-8238. [9] 冯于耀, 史建武, 钟曜谦, 等. 有色冶炼园区道路扬尘中重金属污染特征及健康风险评价[J]. 环境科学, 2020, 41(8): 3547-3555. FENG Y Y, SHI J W, ZHONG Y Q, et al. Pollution characteristics and health risk assessment of heavy metals in road dust from non-ferrous smelting parks[J]. Environmental Science, 2020, 41(8): 3547-3555 (in Chinese).
[10] LYU Y, ZHANG K, CHAI F H, et al. Atmospheric size-resolved trace elements in a city affected by non-ferrous metal smelting: Indications of respiratory deposition and health risk[J]. Environmental Pollution, 2017, 224: 559-571. doi: 10.1016/j.envpol.2017.02.039 [11] FAN Y, PEDERSEN O. Gut microbiota in human metabolic health and disease[J]. Nature Reviews. Microbiology, 2021, 19(1): 55-71. doi: 10.1038/s41579-020-0433-9 [12] 刘昌孝. 肠道菌群与健康、疾病和药物作用的影响[J]. 中国抗生素杂志, 2018, 43(1): 1-14. doi: 10.3969/j.issn.1001-8689.2018.01.001 LIU C X. Gut microbiota: The effects of health, illness and medicines[J]. Chinese Journal of Antibiotics, 2018, 43(1): 1-14 (in Chinese). doi: 10.3969/j.issn.1001-8689.2018.01.001
[13] HSU C L, SCHNABL B. The gut-liver axis and gut microbiota in health and liver disease[J]. Nature Reviews. Microbiology, 2023, 21(11): 719-733. doi: 10.1038/s41579-023-00904-3 [14] 高艳侠, 卫子扬, 张珩琳, 等. 环境化学品暴露与宿主肠道微生态健康的研究进展与展望[J]. 环境化学, 2023, 42(9): 2893-2912. doi: 10.7524/j.issn.0254-6108.2022110205 GAO Y X, WEI Z Y, ZHANG H L, et al. Environmental chemicals exposure and host intestinal microecology: Research progress and prospective[J]. Environmental Chemistry, 2023, 42(9): 2893-2912 (in Chinese). doi: 10.7524/j.issn.0254-6108.2022110205
[15] LU K, ABO R P, SCHLIEPER K A, et al. Arsenic exposure perturbs the gut microbiome and its metabolic profile in mice: An integrated metagenomics and metabolomics analysis[J]. Environmental Health Perspectives, 2014, 122(3): 284-291. doi: 10.1289/ehp.1307429 [16] CHI L, BIAN X M, GAO B, et al. The effects of an environmentally relevant level of arsenic on the gut microbiome and its functional metagenome[J]. Toxicological Sciences, 2017, 160(2): 193-204. doi: 10.1093/toxsci/kfx174 [17] GOKULAN K, ARNOLD M G, JENSEN J, et al. Exposure to arsenite in CD-1 mice during juvenile and adult stages: Effects on intestinal microbiota and gut-associated immune status[J]. mBio, 2018, 9(4): e01418-18. [18] LI D, YANG Y, LI Y X, et al. Changes induced by chronic exposure to high arsenic concentrations in the intestine and its microenvironment[J]. Toxicology, 2021, 456: 152767. doi: 10.1016/j.tox.2021.152767 [19] CHEN L K, LI C J, ZHONG X T, et al. The gut microbiome promotes arsenic metabolism and alleviates the metabolic disorder for their mammal host under arsenic exposure[J]. Environment International, 2023, 171: 107660. doi: 10.1016/j.envint.2022.107660 [20] XIE S S, ZHANG C H, ZHAO J Z, et al. Exposure to concentrated ambient PM2.5 (CAPM) induces intestinal disturbance via inflammation and alternation of gut microbiome[J]. Environment International, 2022, 161: 107138. doi: 10.1016/j.envint.2022.107138 [21] PAN R B, WANG J N, CHANG W W, et al. Association of PM2.5 components with acceleration of aging: Moderating role of sex hormones[J]. Environmental Science & Technology, 2023, 57(9): 3772-3782. [22] DONG X W, YAO S Q, DENG L F, et al. Alterations in the gut microbiota and its metabolic profile of PM2.5 exposure-induced thyroid dysfunction rats[J]. Science of the Total Environment, 2022, 838: 156402. doi: 10.1016/j.scitotenv.2022.156402 [23] LIU J H, SU X H, LU J J, et al. PM2.5 induces intestinal damage by affecting gut microbiota and metabolites of rats fed a high-carbohydrate diet[J]. Environmental Pollution, 2021, 279: 116849. doi: 10.1016/j.envpol.2021.116849 [24] WANG J X, YAN Y W, SI H L, et al. The effect of real-ambient PM2.5 exposure on the lung and gut microbiomes and the regulation of Nrf2[J]. Ecotoxicology and Environmental Safety, 2023, 254: 114702. doi: 10.1016/j.ecoenv.2023.114702 [25] BAILEY M J, HOLZHAUSEN E A, MORGAN Z E M, et al. Postnatal exposure to ambient air pollutants is associated with the composition of the infant gut microbiota at 6-months of age[J]. Gut Microbes, 2022, 14(1): 2105096. doi: 10.1080/19490976.2022.2105096 [26] MÖLLER W, HÄUSSINGER K, ZIEGLER-HEITBROCK L, et al. Mucociliary and long-term particle clearance in airways of patients with immotile Cilia[J]. Respiratory Research, 2006, 7(1): 10. doi: 10.1186/1465-9921-7-10 [27] FENG J, CAVALLERO S, HSIAI T, et al. Impact of air pollution on intestinal redox lipidome and microbiome[J]. Free Radical Biology and Medicine, 2020, 151: 99-110. doi: 10.1016/j.freeradbiomed.2019.12.044 [28] WANG P F, DU H L, FU Y Q, et al. Role of human gut bacteria in arsenic biosorption and biotransformation[J]. Environment International, 2022, 165: 107314. doi: 10.1016/j.envint.2022.107314 [29] MAKAROVA K, SLESAREV A, WOLF Y, et al. Comparative genomics of the lactic acid bacteria[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(42): 15611-15616. [30] BARICHELLA M, SEVERGNINI M, CILIA R, et al. Unraveling gut microbiota in Parkinson’s disease and atypical Parkinsonism[J]. Movement Disorders, 2019, 34(3): 396-405. doi: 10.1002/mds.27581 [31] HASEGAWA S, GOTO S, TSUJI H, et al. Intestinal dysbiosis and lowered serum lipopolysaccharide-binding protein in Parkinson’s disease[J]. PLoS One, 2015, 10(11): e0142164. doi: 10.1371/journal.pone.0142164 [32] PLAZA-DÍAZ J, RUIZ-OJEDA F J, VILCHEZ-PADIAL L M, et al. Evidence of the anti-inflammatory effects of probiotics and synbiotics in intestinal chronic diseases[J]. Nutrients, 2017, 9(6): 555. doi: 10.3390/nu9060555 [33] KIM S, KIM H, YIM Y S, et al. Maternal gut bacteria promote neurodevelopmental abnormalities in mouse offspring[J]. Nature, 2017, 549(7673): 528-532. doi: 10.1038/nature23910 [34] FIJAN S. Microorganisms with claimed probiotic properties: An overview of recent literature[J]. International Journal of Environmental Research and Public Health, 2014, 11(5): 4745-4767. doi: 10.3390/ijerph110504745 [35] MIURA H, OZAKI N, SAWADA M, et al. A link between stress and depression: Shifts in the balance between the kynurenine and serotonin pathways of tryptophan metabolism and the etiology and pathophysiology of depression[J]. Stress, 2008, 11(3): 198-209. doi: 10.1080/10253890701754068 [36] LIANG H W, DAI Z L, LIU N, et al. Dietary L-tryptophan modulates the structural and functional composition of the intestinal microbiome in weaned piglets[J]. Frontiers in Microbiology, 2018, 9: 1736. doi: 10.3389/fmicb.2018.01736 [37] 陈菁青, 郑建华, 董巧燕, 等. 色氨酸代谢调控肠道应激损伤作用的研究进展[J]. 中国实验动物学报, 2024, 32(4): 539-546. doi: 10.3969/j.issn.1005-4847.2024.04.015 CHEN J Q, ZHENG J H, DONG Q Y, et al. Regulation of tryptophan metabolism in stress-related gastrointestinal disorders[J]. Acta Laboratorium Animalis Scientia Sinica, 2024, 32(4): 539-546 (in Chinese). doi: 10.3969/j.issn.1005-4847.2024.04.015
-



 下载:
下载: