-
类固醇激素包括雌激素、雄激素、孕激素和肾上腺皮质激素,由于对生物体具有强烈的内分泌干扰作用,被广泛用于疾病治疗、避孕和养殖业等. 这类物质极低的剂量(<1 ng·L−1)就可能引发哺乳动物生殖障碍、性早熟、以及免疫力低下等问题[1],而且与人类乳腺癌、子宫内膜癌、前列腺癌、肺癌等多种癌症有相关性[2]. 我国研究人员对无锡、北京、上海、南京、沈阳、昆明、武汉、伊宁、河北省、辽东湾等地的地表水、海水及污水处理厂进出水[3 − 13]的调查发现,类固醇激素在不同环境水体中普遍存在. 此类物质性质较为稳定,且目前的污水处理工艺对这部分污染物的去除效果并不理想[3,14]. 养殖业尾水排放是环境中此类激素重要污染源[14 − 16],但现有文献对水产养殖区的调查较少. 资料[17 − 20]显示,在水产养殖方面,激素能促进鱼类生长,提高饵料转化率,控制鱼类性别,对提高产量有重要作用. 近年来闽江上游新建的鳗鱼、牛蛙等水产养殖项目数量增长很快,由此带来的类固醇激素污染风险应引起重视. 2022年国家出台了新污染物治理方案,开展水产养殖区类固醇激素这类新污染物的调查监测工作具有现实意义.
类固醇激素检测方法主要有高效液相色谱法[21]、气相色谱-串联质谱法[8 − 9,22]、液相色谱-串联质谱法,以及传感器检测和免疫检测法[23 − 24]. 其中高效液相色谱法费用低,但检出限较高,分辨率不强;气相色谱-串联质谱法具有耗费较低,灵敏度高,选择性强,能同时分析多种成分等优点,但样品需要衍生化,操作较繁琐;传感器检测和免疫检测法设备简单,费用低,检测时间短,适用于现场快速检测,但大多只能测定单一组分,还有可能出现假阳性;而超高液相色谱-串联质谱法具有样品前处理简单无需衍生,高通量,分辨率高,灵敏快速准确等优势,已成为痕量有机物污染物分析的有力手段. 目前已有不少研究者应用固相萃取-超高液相色谱-串联质谱法建立了水中的类固醇激素的检测方法[3 − 7,11],但还存在一些问题,例如,环境水体中往往多种类固醇激素共存,有些研究未涵盖四大类激素;雌激素和孕激素、雄激素、糖皮质激素采用不同流动相分别测定,工作量较大;雌激素和糖皮质激素测定方法灵敏度低,不利于痕量激素的检出.
目前水中类固醇激素检测标准方法尚未出台,可同时测定四大类激素且检出限小于1 ng·L−1的分析方法相对较少. 为更全面地了解水产养殖污水中类固醇激素的存在状况,亟待建立灵敏度高、准确可靠的分析方法. 本课题选取使用量大、环境中检出率高的四大类12种类固醇激素为研究对象,通过加大取样体积,优化全自动固相萃取浓缩富集及超高效液相色谱串联质谱检测条件降低检测限,建立了水环境中多种类固醇激素同时测定的方法,并应用于福州地区有代表性的水产养殖区水环境样品的采样监测,为进一步开展污染风险评估研究奠定基础.
-
LC30超高效液相色谱仪(日本岛津); AB SCIEX Triple Quad
4500 三重四极杆质谱仪(美国Sciex公司);EXPEC 570六通道全自动固相萃取仪(杭州谱育科技); Sara-01全自动溶液配制仪(上海兰博);固相萃取小柱( 500 mg,6 mL)Oasis HLB(美国Waters)、Cleanert C18(天津Bonna-Agela)、Cleanert PEP(天津Bonna-Agela).12种激素标准品包括5种雌激素(雌酮、17α-雌二醇、17β-雌二醇、雌三醇、乙炔雌二醇),3种孕激素(孕酮、炔诺孕酮、醋酸甲羟孕酮),3种雄激素(诺龙、雄烯二酮、甲基睾酮)和1种糖皮质激素(泼尼松);4种同位素内标17β-雌二醇D3、甲羟孕酮D3、甲睾酮D3、氢化可的松D3,均购自上海安谱公司,纯度大于98.0%.
甲醇、乙腈、乙酸乙酯、甲酸为色谱纯(德国Merck公司);氟化铵99.99%(上海麦克林);纯净水(屈臣氏).
-
取适量单标用30%乙腈配制成500 μg·L−1的12种目标物的混合标准中间溶液和500 μg·L−1的4种同位素内标混合标准工作溶液,4 ℃避光储存.
以30%乙腈作溶剂,用全自动配标仪配制成0.0、1.0、2.5、5.0、10.0、25.0、50.0、100.0、250.0、500.0 µg·L−1的混合标准系列工作溶液,并分别添加内标浓度为20.0 µg·L−1,现配现用.
-
水样采集后储存于
1000 mL棕色玻璃样品瓶,为防止微生物的降解,每个瓶内预先加入1.0 mL甲醛[7,13,25],瓶内无气泡,立即置于4 ℃冷藏箱内,带回实验室冷藏存放并尽快检测.取1 L水样,准确加入40.0 μL混合内标工作溶液,混匀,调节pH值为中性. 若水样悬浮物较多,用0.45 μm水系微孔滤膜过滤,同时去除大部分色素. C18固相萃取小柱依次用6 mL甲醇,6 mL超纯水活化;水样以10 mL·min−1的流速过柱;上样完毕,用5.0 mL超纯水淋洗固相萃取柱;将萃取柱于氮气下吹干20 min;再用10 mL乙酸乙酯洗脱固相萃取柱,洗脱速度为3 mL·min−1;洗脱液常温下氮吹至干;转换溶剂为乙腈,混匀后氮吹至体积小于0.5 mL,用30%乙腈准确定容至1.0 mL,过0.22 μm针式微孔滤膜,待UPLC-MS/MS分析.
-
采用内标法定量,各物质内标见表1.
-
Waters ACQUITY UPLC BEH C18色谱柱(100 mm×2.1 mm,粒径1.7 µm);柱温40 ℃;流速0.4 mL·min−1;进样量10 μL. 流动相A:0.2 mmol·L−1氟化铵水溶液,流动相B:乙腈;梯度洗脱:0 min,30% B;5.0 min,60% B;5.5 min,90%B;6.0 min,90%B;6.5 min,30% B;8.0 min,30% B.
-
质谱采用多反应监测扫描模式(MRM).
孕激素、雄激素:电喷雾正离子模式(ESI+),毛细管电压+
5500 V;糖皮质激素:电喷雾负离子模式(ESI-),毛细管电压-4500 V;气帘气压力20 psi;离子源温度600 ℃;离子源雾化气压力50 psi;离子源脱溶剂气压力30 psi.雌激素:电喷雾负离子模式(ESI-),毛细管电压−
4500 V;气帘气压力15 psi;离子源温度600 ℃;离子源雾化气压力40 psi;离子源脱溶剂气压力40 psi. 质谱参数见表1. -
雌激素含有酚羟基,在ESI-离子源电离方式下易失去H+,可获得较高丰度的[M-H]−准分子离子峰. 孕激素和雄激素含有酮基,在ESI+电离方式下易得到H+,可获得较高丰度的[M+H]+准分子离子峰. 由于糖皮质激素的 [M+H]+(m/z359.2)响应值低,选择响应高的 [M+HCOO]−(m/z403.2)作为母离子.
-
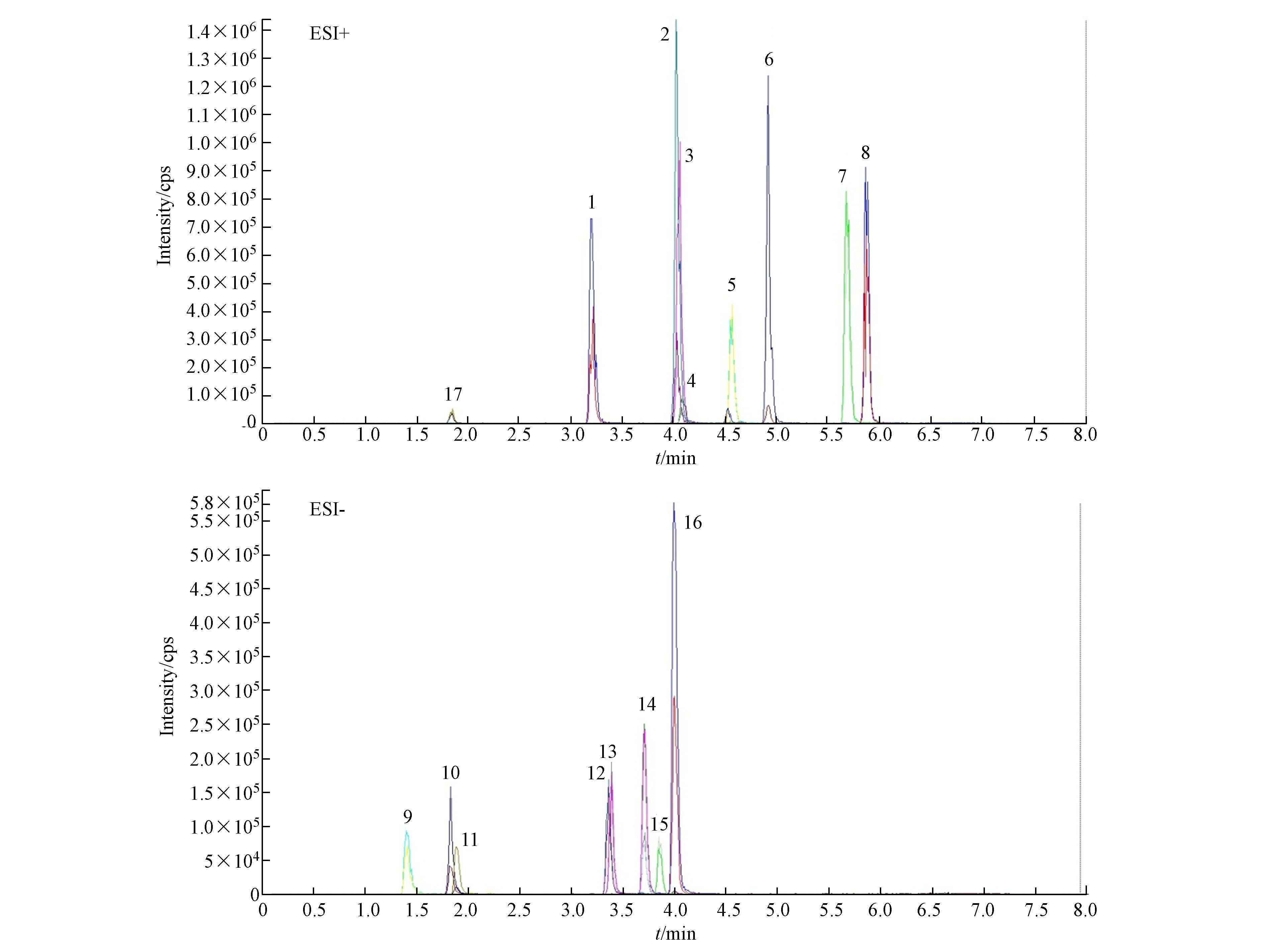
主要从色谱柱、流动相、流速和梯度洗脱几个方面进行优化,优化后的液相色谱条件详见1.4.1节,分离效果见图1,出峰序号详见表1,10号和17号峰分别为泼尼松[M+HCOO]−和[M+H]+.
类固醇激素是弱极性物质,宜选用反向非极性柱. 实验比较了4个不同品牌型号的C18柱,分别是Waters ACQUITY UPLC BEH C18(100 mm×2.1 mm,粒径1.7 µm)[3 − 5, 7]、Waters ACQUITY UPLC HSS T3(100 mm×2.1 mm,粒径1.8 µm)、Phenomenex Lura Omega(100 mm×2.1 mm,粒径1.7 µm)和Phenomenex Kinetex(100 mm×2.1 mm,粒径1.7 µm). 对于本实验的12种目标物,BEH C18柱分离效果最好,分离度高,峰型流畅对称,响应值高,适用pH范围宽.
流动相对化合物色谱峰峰高及峰型的影响很大. 根据实验结果,水-乙腈体系比水-甲醇体系响应值更高. 理论上ESI+模式下流动相中加入适当比例的甲酸,ESI-模式加氨水可增强激素类化合物的离子化效率. 但实验发现雌激素在0.1%氨水体系中响应值仍然很低,因为这类物质较难电离. 为了提高测定灵敏度,有研究者采用丹磺酰氯[10,13]或吡啶-3-磺酰氯[26]等酰化试剂进行衍生化,得到满意的结果. 由于衍生化反应过程较复杂,本研究采用流动相或工作液中添加0.2 mmol·L−1氟化铵[6,27,28]的方法,与添加0.1%氨水对比,雌激素的响应值显著提高为后者的4倍,而且操作简单. 反应机理可能是氟离子的孤对电子容易和雌激素酚羟基的H结合,形成[M+F]−配合物,通过ESI-模式碰撞诱导电离后,[M+F]−失去HF产生[M-H]−,使响应值显著提高. 而甲酸的加入能改善正离子峰形和灵敏度,并且提供HCOO−,有助于形成响应值比[M+H]+高10倍的糖皮质激素[M+HCOO]−准分子离子. 有些研究[29]得出不一样的实验结果,认为泼尼松[M+HCOO]−比[M+H]+响应低,可能原因是研究者使用的流动相是乙酸,形成的[M+HCOO]−母离子量少. 为了简化测定流程,本实验采用氟化铵流动相体系,一次进样同时测定正负离子. 虽然泼尼松[M+HCOO]−信号值降为甲酸流动相体系时的一半,但灵敏度仍较高,能满足测定要求. 图1中10号峰为泼尼松[M+HCOO]−,17号峰为泼尼松[M+H]+,两者信号强度有显著差异. 并且与甲酸流动相体系相比,氟化铵体系并没有使正离子的响应值降低. 值得探讨的是,在不存在甲酸介质的情况下,泼尼松[M+HCOO]−浓度依然较高的原因.
选择合适的流速,0.4 mL·min−1时柱压适中,出峰时间较短,峰形尖锐,分离度满足要求. 对梯度洗脱程序进行优化,确定分离度大,保留时间较短,峰形对称尖锐流畅的最佳流动相比例和梯度条件,6.0 min实现所有的峰的分离. 其中17α-雌二醇和17β-雌二醇互为顺反异构体,分子量相同,结构仅有细微差别,若选择的定量子离子也相同,质谱仪则难以分辨,这时利用液相色谱柱吸附性能的差异,通过梯度调整使二者得到完全分离,达到准确定量的目的.
-
养殖排放水成分较复杂,可能导致基质效应,影响分析结果的准确性. 选取不含目标物的闽江水,经前处理后加入混合标准溶液,计算基质效应值=(待测物在基质中的响应值/待测物在纯溶剂中的响应值)×100%. 结果表明,基质效应在90.5%—117.7%范围内,可认为基质效应不显著. 为进一步消除基质干扰,本实验采用同类目标组分的三氘代物作为同位素内标进行定量,消除前处理过程、进样体积、流动相以及检测器波动的引起的误差.
-
样品富集和除杂采用全自动固相萃取,对回收率影响较大的因素是小柱填料型号、水样pH、洗脱液、洗脱体积、洗脱流速等. 12种激素的酸度系数pKa均大于10,见表1,因此认为中性条件下在水中电离度小,绝大部分以分子形式存在,对萃取效率影响不大,故实验前样品pH值调为中性6—8. 考虑类固醇激素是弱极性化合物,酸碱性不强,通常选用C18、亲水亲油平衡柱. 实验选用文献报道使用效果最好的Waters OASIS HLB(500 mg×6 mL)小柱[3, 5,7 − 9, 13],以及使用较多的C18[4,6]和PEP[5]作为正交试验因素. 洗脱液考虑3种常用的弱极性洗脱溶剂乙腈[4]、甲醇[6]和乙酸乙酯[5,7 − 8]. 研究进行4因素3水平的L9(34)正交试验,每个试验做3个平行,共27次实验. 以空白加标50 ng·L−1水样作为试样,经全自动固相萃取后,将12种目标化合物和4种内标的峰面积与对照组50 μg·L−1标准溶液峰面积进行对比,计算回收率. 正交试验结果见表2.
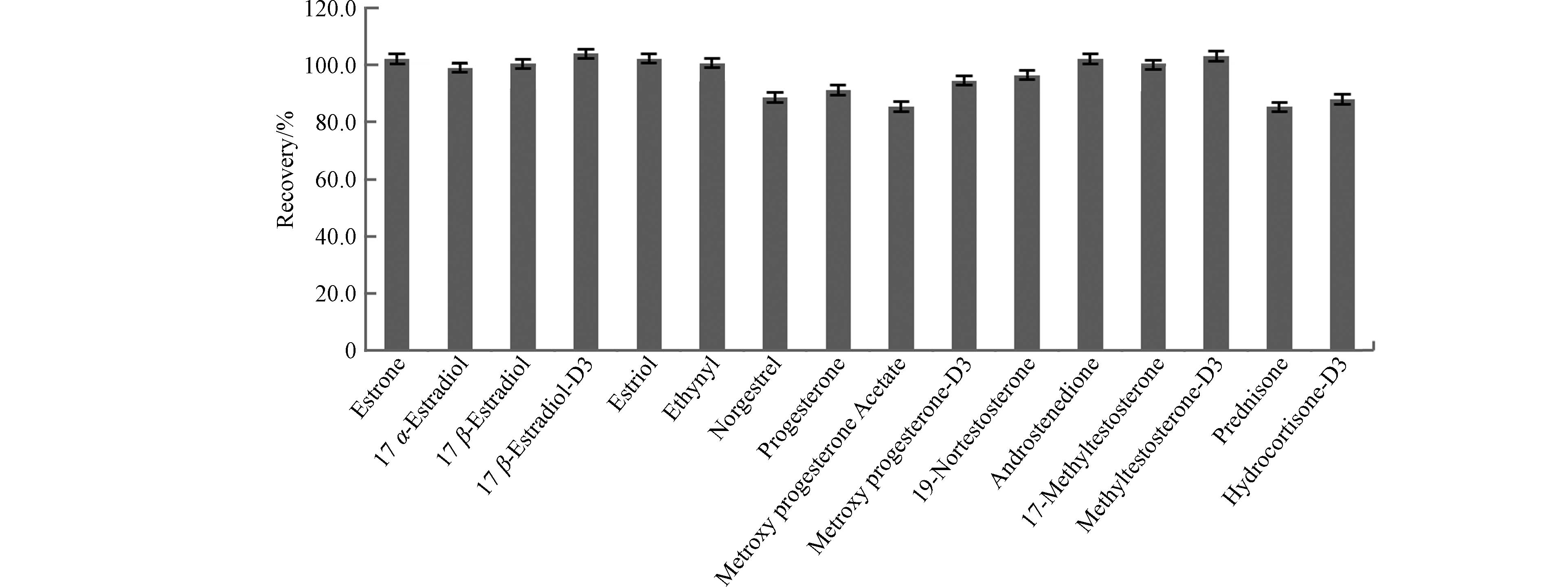
正交试验直观分析显示,最佳条件为C18固相萃取小柱,洗脱剂为甲醇,洗脱剂用量10 mL,流速为3 mL·min−1. 后续研究表明,养殖排放水色度等杂质多,甲醇提取物色度相对较高,检测背景值升高,因此洗脱剂改用乙酸乙酯. 因为A2B3C3D3组合不是正交表内列出的试验,需要对该组合进行3个平行实验验证. 实验结果,该组合平均回收率96.5%,各组分回收率见图2,接受该条件为最优组合.
-
取低浓度混合标准系列0、1.0、2.5、5.0、10.0、25.0、50.0 µg·L−1,UPLC-MS/MS测定,在选定的色谱和质谱条件下平行测定2次,以浓度为横坐标、以被测组分峰面积和内标物的峰面积比值为纵坐标绘制工作曲线. 所有曲线相关系数r>0.999. 依据《合格评定化学分析方法确认和验证指南》GB∕T
27417 —2017,以空白加标2.5 ng·L−1样品10个进行全流程平行实验,标准偏差法计算方法检出限(MDL),以方法检出限的3倍作为定量限(MQL). 结果见表3. 本研究通过采取1 L大体积取样,氟化铵流动相提高雌激素响应,[M+HCOO]−母离子提高糖皮质激素响应,内标法消除干扰等措施提高灵敏度,降低检出限. 12种类固醇激素检出限范围0.32—0.85 ng·L−1,均小于1.0 ng·L−1,定量限为0.97—2.56 ng·L−1. 与以往研究报道中同类仪器相同化合物的方法检出限范围0.3—1.5 ng·L−1 [5]、1.11—1.95 ng·L−1[6]、1.54—8.98 ng·L−1[7]对比,处于较优水平,满足水中痕量有机物污染物检测要求. 个别文献方法检出限低至0.05—0.5 ng·L−1[11],有待探讨. -
依据《合格评定化学分析方法确认和验证指南》GB∕T
27417 —2017,采用样品加标测定方法的正确度. 取闽江中不含目标物的江水水样,添加10、20、50 ng·L−1 的3个浓度水平的目标物,做7次平行试验,计算各物质的回收率和相对标准偏差. 结果见表4,加标回收率均值85.2%—107.8%,相对标准偏差(RSD)3.67%—12.20%. 与文献报道的回收率72.6%—111.9%[4]、71.2%—121%[5]、78.5%—94.6[6]、67%—109%[7]、77%—97%[10]、68.8%—108%[11]、53.6%—90.4%[12]、83.5%—91.7%[13]对比,本方法的回收率相对较高,满足水环境中痕量有机污染物检测要求. -
选取福州地区两个有代表性的水产养殖区—闽江开放式网箱养殖区和某封闭式鳗鱼养殖场,每个养殖区2个月内进行3次采样监测,同时监测闽江下游水体,并用先前建立的方法对实际样品进行检测. 样品检测结果见表5和表6. 养殖区除了表中列出的组分,其余组分均未检出;闽江下游水体所有组分均未检出.
检测结果表明,在养鳗场等流动性较差的养殖水体中,检出雌酮0.86—4.11 ng·L−1,17β-雌二醇ND—1.30 ng·L−1,雄烯二酮1.15—10.95 ng·L−1,个别样品检出微量孕酮,除了进水口,采样检出率为100%,其中雄烯二酮浓度相对较高. 流动性好的水体如闽江网箱养殖区类固醇激素的检出浓度较低,除了微量雌酮和孕酮,部分点位检出雄烯二酮,最高浓度为3.05 ng·L−1,采样检出率为30%. 而闽江下游及两处养殖区背景值低. 本次监测的浓度水平与以往文献的研究结果比较一致,如上海市[6]两个地表水样品中检出雌酮1.88 ng·L−1和雄烯二酮1.48 ng·L−1;南京市[7]地表水雄烯二酮检出率在80%以上;太湖[30]表层水体雄烯二酮检出频率高,为41%,最高检出浓度为16.5 ng·L−1;滇池[9]中雌二醇含量为4.8 ng·L−1,翠湖中雌酮和雌二醇的含量分别为11.7 ng·L−1和7.2 ng·L−1,昆明市第五污水处理厂出水中雌酮和雌二醇的含量分别为14.8 ng·L−1和8.7 ng·L−1;河北省[11]8个地级市48个地下水样品,雌二醇检出率最高为11.43%,最大浓度17.19 ng·L−1;辽东湾[13]32个海水样品中几乎都检出了雌酮和17β-雌二醇,雌酮浓度水平远高于其他雌激素,为(0.714±0.407)ng·L−1,17β-雌二醇的浓度水平次之,为(0.089±0.077 )ng·L−1. 本次研究检测到的几种类固醇激素都属于生物体产生的天然激素,未检测到人工合成激素,但天然激素也可能作为添加剂[17 − 20],无法判断是否存在人工添加的情况. 而在国内其他省份地表水中检测出合成激素,主要有甲基睾酮、孕烯二酮、左炔诺孕酮、炔诺酮、六甲强龙、泼尼松、醋酸泼尼松龙、诺龙、倍他米松和地塞米松等.
-
本文建立了水环境中包含四大类12种类固醇激素残留量的全自动固相萃取-超高效液相色谱-三重四极杆串联质谱同时测定的方法,检出限低于1 ng·L−1,加标回收率高,过程简单. 应用该方法对福州地区部分水产养殖区尾水排放进行监测,检测到雌酮、17β-雌二醇和雄烯二酮和孕酮等类固醇激素,最高浓度为10.95 ng·L−1,明显高于背景值,表明该方法在环境水体样品类固醇激素测定方面实用性较强,也提示水产养殖排放水存在一定的类固醇污染风险.
该方法的检出限、正确度和精密度等参数均能够满足地表水、洁净水、养殖排放废水等不同类型实际水样的测试要求,可以为水体中类固醇激素污染的监测和污染风险因子的筛选提供技术手段. 福建作为海洋大省,建议进一步开展海水养殖排放类固醇激素污染监测研究.
超高液相色谱-串联质谱法测定水产养殖排放水中类固醇激素残留
Determination of steroid hormones in aquaculture effluent by ultra- high performance liquid chromatography tandem mass spectrometry
-
摘要: 建立了全自动固相萃取-超高液相色谱-串联质谱法同时测定水中12种类固醇激素(包括四大类雌激素、孕激素、雄激素和糖皮质激素)的分析方法. 水样经C18固相萃取小柱富集净化,超高效液相色谱法分离,特征离子和保留时间定性,内标法定量,在电喷雾正离子(ESI+)模式下测定雄激素和孕激素,负离子(ESI-)模式下测定雌激素和糖皮质激素. 工作曲线在1—500 ng·L−1范围内线性关系良好,相关系数r>0.999,方法检出限(MDL)0.32—0.85 ng·L−1,定量限(MQL)0.97—2.56 ng·L−1,加标回收率85.2%—107.8%,相对标准偏差(RSD)3.67%—12.20%. 采用该方法对福州地区2个水产养殖区的养殖废水进行监测,雌酮、17β-雌二醇、雄烯二酮等被检出,含量最高10.95 ng·L−1. 该方法检出限低,加标回收率高,过程简便,满足水环境中痕量有机污染物检测要求,适用于地表水、洁净水、养殖废水等水体中多种类固醇激素的检测.
-
关键词:
- 类固醇激素 /
- 超高液相色谱-串联质谱 /
- 全自动固相萃取 /
- 水产养殖废水.
Abstract: An analytical method based on automatic solid-phase extraction (SPE) coupled with UPLC-MS/MS was developed for the extraction and evaluation of 12 hormones (that include estrogen, progestin, androgen, glucocorticoid) at trace levels in water bodies. After being mixed with internal standards, the water samples were enriched and purified by C18 solid phase extraction column. Using the characteristic ions and retention time for qualitative and the internal standard method for quantitative, all the hormones were separated and simultaneously analyzed in multiple reaction monitoring mode (MRM) by UPLC-MS/MS, which greatly improved the sensitivity and efficiency. Androgen and progesterone were analyzed in the positive electrospray ionization (ESI+) mode, while estrogen and glucocorticoid in the negative mode (ESI-). Good linearity was observed within the range of 1—500 ng·L−1, with a correlation coefficient r greater than 0.999. The method detection limits (MDLs) were 0.32—0.85 ng·L−1, and the quantification limit (MQL) were 0.97—2.56 ng·L−1. The average recoveries ranged from 85.2%—107.8%, while the relative standard deviations (RSDs) were between 3.67%—12.20%. The method was successfully applied to the determination of effluent water samples from two aquaculture farms in Fuzhou area. Estrone, 17 β-estradiol, and androstenedione were detected, with the highest content of 10.95 ng·L−1. In conclusion, the method is simple and exhibited good performance in terms of MDLs and recoveries, can be used for the rapid screening of multiple types of steroid hormones in water bodies such as surface water, clean water, and aquaculture wastewater. There is a great need for the analysis and monitoring of hormones residues in groundwater because steroid hormones have been found regularly in aquaculture water. -

-
表 1 类固醇激素的性质和质谱参数
Table 1. Properties and MS parameters for the 12 hormones
模式
Mode序号No. 化合物
Compound化学式
FormulaCAS 保留时间
Retention time/min母离子
Precursor ion(m/z)子离子
Product ion(m/z)去簇电压/V
Declustering potential碰撞能量/eV
Collision energypKa 内标
Internal standardESI+ 1 19-Nortestosterone C18H26O2 434-22-0 3.20 275.3 109.2* 118 38 15.06 Methyl-testosterone-D3 (诺龙 ) 145.1 113 31 2 Methyl-testosterone-D3 C20H27D3O2 96425 -03-54.02 306.2 109.1* 105 44 15.13 (甲基睾酮D3) 270.3 105 27 ESI+ 3 17-Methyl-testosterone C20H30O2 58-18-4 4.05 303.2 109.2* 123 35 15.13 Methyl-testosterone-D3 (甲基睾酮) 97.0 123 37 4 Androstenedione C19H26O2 63-05-8 4.08 287.2 97.1* 120 27 NA Methyl-testosterone-D3 (雄烯二酮) 109.2 120 29 5 Norgestrel C21H28O2 6533 -00-24.57 313.3 109.1* 126 35 13.09 Metroxy progesterone-D3 (炔诺孕酮) 245.2 126 27 6 Metroxy-progesterone-D3 C22H29D3O3 162462 -69-34.92 348.4 126.2* 105 45 13.03 (甲羟孕酮D3) 140.2 105 35 7 Progesterone C21H30O2 57-83-0 5.69 315.2 97.2* 118 38 14.91 Metroxy progesterone-D3 (孕酮) 109.1 118 43 8 Metroxy-progesterone acetate C24H34O4 71-58-9 5.86 387.3 123.1* 105 46 12.62 Metroxy progesterone-D3 (醋酸甲羟孕酮) 285.3 105 25 ESI- 9 Estriol C18H24O3 50-27-1 1.40 287.1 171.0* −165 −48 10.25 17 β-Estradiol-D3 (雌三醇) 145.0 −165 −50 10 Prednisone C21H26O5 53-03-2 1.83 403.2 327.2* −64 −19 12.26 Hydrocortisone-D3 (泼尼松) 357.2 −64 −12 11 Hydrocortisone-D3 C21H27D3O5 115699 -92-81.89 410.2 344.1* −70 −24 12.43 (氢化可的松D3) 300.1 −70 −46 12 17 β-Estradiol-D3 C18H21D3O2 79037 -37-93.36 274 145.0* −170 −54 10.71 (17 β-雌二醇D3) 185.2 −170 −54 13 17 β-Estradiol C18H24O2 50-28-2 3.39 271.1 145.0* −160 −52 10.71 17 β-Estradiol-D3 (17 β-雌二醇) 183.0 −160 −54 14 17 α-Estradiol C18H24O2 57-91-0 3.71 271.1 145.0* −160 −52 10.27 17 β-Estradiol-D3 (17 α-雌二醇) 143.0 −160 −72 15 Ethynylesrtradiol C20H24O2 57-63-6 3.85 295.1 145.2* −165 −55 10.32 17 β-Estradiol-D3 (乙炔雌二醇 ) 159.0 −165 −43 16 Estrone C18H22O2 53-16-7 4.00 269.1 145.0* −150 −48 10.77 17 β-Estradiol-D3 (雌酮 ) 143.0 −150 −73 *定量离子. * Quantitation ion. 表 2 固相萃取正交试验结果表L9(34)
Table 2. Results of orthogonal test for solid phase extraction
序号
No.A:固相萃取小柱
SPEB:淋洗液
EluentC:淋洗用量/mL
Eluent volumeD:淋洗流速/(mL·min−1)
Flow rate回收率/%
Recovery1 HLB 乙腈 3 1 34.84 2 HLB 甲醇 5 2 83.57 3 HLB 乙酸乙酯 10 3 95.13 4 C18 乙腈 5 3 93.82 5 C18 甲醇 10 1 94.63 6 C18 乙酸乙酯 3 2 83.88 7 PEP 乙腈 10 2 75.55 8 PEP 甲醇 3 3 82.59 9 PEP 乙酸乙酯 5 1 78.03 k1 71.18 68.07 67.11 69.17 k2 90.78 86.93 85.14 81.00 k3 78.72 85.68 88.44 90.51 R 19.60 18.86 21.33 21.34 表 3 目标化合物的线性方程、相关系数及方法检测限定量限
Table 3. Linear equation,correlation coefficient and method detection limit and quantitative of 12 target compounds
化合物
Compound线性方程
Linear equation相关系数
r检测限/(ng·L−1)
MDL定量限/(ng·L−1)
MQLEstrone Y=0.108X- 0.0627 0.9999 0.33 0.99 17 α-Estradiol Y= 0.0329 X-0.0182 0.9999 0.62 1.86 17 β-Estradiol Y= 0.0211 X-0.0108 0.9998 0.42 1.26 Estriol Y= 0.0199 X-0.0181 0.9996 0.70 2.11 Ethynyl Y= 0.0117 X-0.00797 0.9997 0.32 0.97 Progesterone Y= 0.0391 X+0.00205 0.9994 0.46 1.38 Norgestrel Y= 0.0438 X+0.0165 0.9996 0.48 1.93 Metroxy progesterone acetate Y= 0.0222 X+0.00833 0.9993 0.50 1.51 19-Nortestosterone Y=0.024X+ 0.00724 0.9997 0.66 1.97 Androstenedione Y= 0.00505 X+0.000141 0.9995 0.85 2.56 17-Methyltestosterone Y= 0.0419 X+0.0038 0.9998 0.43 1.30 Prednisone Y= 0.0685 X-0.00128 0.9997 0.51 1.54 Y:分析物与内标峰面积比值;X:分析物浓度,µg·L−1.
Y: ratio of the peak area of the analyte to the peak area of the internal standard; X: mass concentration of the analyte, µg·L−1.表 4 基质空白加标样品正确度和精密度实验(n=7)
Table 4. The accuracy and precision of analyte in matrix blank labeled samples (n=7)
化合物
Compound添加10 ng·L−1 添加20 ng·L−1 添加50 ng·L−1 回收率/%
RecoveryRSD/% 回收率/%
RecoveryRSD/% 回收率/%
RecoveryRSD/% Estrone 98.9 4.38 99.1 4.06 102.1 4.88 17 α-Estradiol 89.0 6.69 87.7 4.45 90.3 4.02 17 β-Estradiol 94.6 7.06 94.0 6.52 90.6 7.04 Estriol 99.9 8.09 101.9 5.14 103.0 5.31 Ethynyl 97.1 4.47 92.7 5.00 95.1 4.23 Progesterone 93.1 6.92 102.4 5.36 94.6 4.26 Norgestrel 105.7 5.46 102.5 4.82 98.8 4.04 Metroxy progesterone Acetate 85.2 8.19 95.2 5.74 89.8 6.45 19-Nortestosterone 107.8 8.27 99.3 6.18 103.8 5.34 Androstenedione 103.1 12.20 96.2 8.55 100.8 5.53 17-Methyltestosterone 97.0 4.64 92.7 5.86 95.0 3.67 Prednisone 95.2 5.61 103.5 7.19 98.9 3.92 表 5 闽江某网箱养殖区实际样品检测结果(ng·L−1)
Table 5. Concentrations of hormones in water samples collected from a cage culture area in Min River(ng·L−1)
批次
Batch化合物
Compound点位1
Site 1点位2
Site 2点位3
Site 3点位4
Site 4点位5
Site 5点位6
Site 6点位7
Site 7点位8
Site 8点位9
Site 9上游对照
Upstream1 Estrone — 0.33 0.34 — — — — — — — Androstenedione — — — — — — — 1.94 2.44 — 2 Progesterone — — 0.51 — — — — — — — Androstenedione — — 2.70 — — 1.28 — 3.05 2.96 — 3 Androstenedione — 1.57 — — — — — 2.36 2.13 — —:未检出. —:not detected. 表 6 福州市某养鳗场实际样品检测结果(ng·L−1)
Table 6. Concentrations of hormones in water samples collected from an eel farm in Fuzhou(ng·L−1)
批次
Batch化合物
Compound进水
Inlet池1
Pond 1池2
Pond 2池3
Pond 3出水
Outlet总排放口
Total outlet1 Estrone — 2.78 3.05 2.49 2.74 2.97 17 β—Estradiol — — 1.14 1.22 — — Androstenedione — 1.15 1.64 1.38 10.95 8.58 2 Estrone — 0.57 2.53 1.29 4.11 2.93 17 β-Estradiol — — 1.08 1.13 1.30 0.72 Progesterone — 0.51 — 0.61 — — Androstenedione — 3.94 1.93 8.69 2.84 2.09 3 Estrone — 0.86 3.1 2.25 3.53 2.87 17 β-Estradiol — — 1.16 1.29 1.04 0.64 Androstenedione — 3.08 2.47 6.33 4.24 3.76 —:未检出. —:not detected. -
[1] GUEDES-ALONSO R, SOSA-FERRERA Z, SANTANA-RODRÍGUEZ J J. Determination of steroid hormones in fish tissues by microwave-assisted extraction coupled to ultra-high performance liquid chromatography tandem mass spectrometry[J]. Food Chemistry, 2017, 237: 1012-1020. doi: 10.1016/j.foodchem.2017.06.065 [2] AL-SHAMI K, AWADI S, KHAMEES A, et al. Estrogens and the risk of breast cancer: A narrative review of literature[J]. Heliyon, 2023, 9(9): e20224. doi: 10.1016/j.heliyon.2023.e20224 [3] 刘媛媛, 冯慧, 张云, 等. 甾体激素在污水处理厂中的赋存特征和行为归趋[J]. 环境科学, 2023, 44(8): 4364-4373. LIU Y Y, FENG H, ZHANG Y, et al. Occurrence and fate of steroid hormones in sewage treatment plants[J]. Environmental Science, 2023, 44(8): 4364-4373 (in Chinese).
[4] 马帅, 冯晓元, 王纪华, 等. 固相萃取-超高效液相色谱-串联质谱法同时测定环境水体中的12种类固醇激素[J]. 分析试验室, 2016, 35(9): 1046-1051. MA S, FENG X Y, WANG J H, et al. Simultaneous determination of twelve steroid estrogens in environmental water by solid phase extraction and ultra performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Analysis Laboratory, 2016, 35(9): 1046-1051 (in Chinese).
[5] 孙娟, 何青青, 徐荣, 等. 水环境中26种类固醇激素的分析方法研究[J]. 环境监控与预警, 2019, 11(6): 18-23. SUN J, HE Q Q, XU R, et al. Research on the analysis method of 26 steroid hormones in water environment[J]. Environmental Monitoring and Forewarning, 2019, 11(6): 18-23 (in Chinese).
[6] 孙㑇琳. 固相萃取-高效液相色谱-质谱联用法用于地表水中类固醇激素测定[J]. 环境监控与预警, 2018, 10(5): 26-29. SUN Z L. Determination of steroid hormones in surface water by LC-MS/MS[J]. Environmental Monitoring and Forewarning, 2018, 10(5): 26-29 (in Chinese).
[7] 谭丽超, 葛峰, 孔德洋, 等. 南京市地表水中18种类固醇激素的检测分析[J]. 环境化学, 2014, 33(2): 298-305. doi: 10.7524/j.issn.0254-6108.2014.02.012 TAN L C, GE F, KONG D Y, et al. Detection method and occurrence of 18 steriod hormone compounds in surface water of Nanjing[J]. Environmental Chemistry, 2014, 33(2): 298-305 (in Chinese). doi: 10.7524/j.issn.0254-6108.2014.02.012
[8] 王园园, 宋晓明, 温玉娟, 等. 固相萃取-衍生化-气相色谱-质谱联用测定不同水体中类固醇雌激素方法研究[J]. 岩矿测试, 2017, 36(5): 519-528. WANG Y Y, SONG X M, WEN Y J, et al. Determination of steroid estrogens in different water samples using SPE-derivatization coupled with GC-MS[J]. Rock and Mineral Analysis, 2017, 36(5): 519-528 (in Chinese).
[9] 黄斌, 潘学军, 万幸, 等. 固相萃取-衍生化-气相色谱/质谱测定水中类固醇类环境内分泌干扰物[J]. 分析化学, 2011, 39(4): 449-454. doi: 10.1016/S1872-2040(10)60431-8 HUANG B, PAN X J, WAN X, et al. Simultaneous determination of steroid endocrine disrupting chemicals in water by solid phase extraction-derivatization gas chromatography-mass spectrometry[J]. Chinese Journal of Analytical Chemistry, 2011, 39(4): 449-454 (in Chinese). doi: 10.1016/S1872-2040(10)60431-8
[10] 王坤, 方敏, 吴辰熙, 等. 液相色谱质谱法测定水体及土壤中的类固醇激素[J]. 地球与环境, 2015, 43(3): 369-374. WANG K, FANG M, WU C X, et al. Analysis of steroid hormones in water and soil using liquid chromatography mass spectrometry[J]. Earth and Environment, 2015, 43(3): 369-374 (in Chinese).
[11] 邹小南, 罗丹, 李贵洪, 等. 超高效液相色谱-串联质谱法同时分析地下水中24种内分泌干扰物[J]. 中国环境监测, 2022, 38(4): 31-40. ZOU X N, LUO D, LI G H, et al. Simultaneous analysis of 24 endocrine disruptors in groundwater by ultra-high performance liquid chromatography tandem mass spectrometry[J]. Environmental Monitoring in China, 2022, 38(4): 31-40 (in Chinese).
[12] 粟有志, 李艳美, 周均, 等. 分散微固相萃取-高效液相色谱-串联质谱法测定水样中3种氯霉素类和11种激素类药物残留[J]. 分析科学学报, 2020, 36(1): 69-74. SU Y Z, LI Y M, ZHOU J, et al. Dispersive micro-solid phase extraction combined with high performance liquid chromatography-tandem mass spectrometry for determination of 3 chloramphenicols and 11 hormones residue in water samples[J]. Journal of Analytical Science, 2020, 36(1): 69-74 (in Chinese).
[13] 吴世闽, 贾瑷, 彭辉, 等. 辽东湾海水中甾体雌激素的检测及生态风险评价[J]. 中国环境科学, 2011, 31(11): 1904-1909. WU S M, JIA A, PENG H, et al. Determination and risk assessment of steroidal estrogens in Liaodong Bay, China[J]. China Environmental Science, 2011, 31(11): 1904-1909 (in Chinese).
[14] 杨雷, 张晋娜, 史文俊, 等. 类固醇激素在环境中的污染现状及归趋[J]. 生态毒理学报, 2019, 14(5): 1-21. YANG L, ZHANG J N, SHI W J, et al. Occurrence and fate of steroid hormones in the environment[J]. Asian Journal of Ecotoxicology, 2019, 14(5): 1-21 (in Chinese).
[15] 刘姝芳, 李艳霞, 张雪莲, 等. 东北三省畜禽养殖类固醇激素排放及其潜在污染风险[J]. 环境科学, 2013, 34(8): 3180-3187. LIU S F, LI Y X, ZHANG X L, et al. Excretion of manure-borne steroid hormones and their potential risk in the three northeast provinces of China[J]. Environmental Science, 2013, 34(8): 3180-3187 (in Chinese).
[16] 金尔光, 崔华威, 陈洁, 等. 畜禽养殖场粪污中天然雌激素现状及其消减技术研究进展[J]. 家畜生态学报, 2022, 43(8): 1-7. doi: 10.3969/j.issn.1673-1182.2022.08.001 JIN E G, CUI H W, CHEN J, et al. Research progress on the status and abatement techniques of natural estrogen in manure and sewage from livestock farm[J]. Journal of Domestic Animal Ecology, 2022, 43(8): 1-7 (in Chinese). doi: 10.3969/j.issn.1673-1182.2022.08.001
[17] 邓岳松. 甲基睾酮与雄烯二酮诱导日本鳗鲡精子发生: 离体研究[J]. 浙江农业学报, 2002, 14(2): 76-81. doi: 10.3969/j.issn.1004-1524.2002.02.003 DENG Y S. In vitro induction of spermatogenesis in male Japanese eel, Anguilla japonica, by methyl testosterone and androstenedione[J]. Acta Agriculturae Zhejiangensis, 2002, 14(2): 76-81 (in Chinese). doi: 10.3969/j.issn.1004-1524.2002.02.003
[18] 沈旭芳, 王连顺, 闫红伟. 环境因子对鱼类性别决定及分化的影响研究进展[J]. 安徽农学通报, 2020, 26(1): 71-76. doi: 10.3969/j.issn.1007-7731.2020.01.030 SHEN X F, WANG L S, YAN H W. Research progress on the effects of environmental factors on sex determination and differentiation in fish[J]. Anhui Agricultural Science Bulletin, 2020, 26(1): 71-76 (in Chinese). doi: 10.3969/j.issn.1007-7731.2020.01.030
[19] 陶彬彬, 胡炜. 鱼类性别控制育种研究进展[J]. 中国农业科技导报, 2022, 24(2): 1-10. TAO B B, HU W. Research progress on sex control breeding of fish[J]. Journal of Agricultural Science and Technology, 2022, 24(2): 1-10 (in Chinese).
[20] 张森, 谢仰杰, 黄良敏. 日本鳗鲡人工繁殖研究现状及存在问题[J]. 水产科学, 2011, 30(6): 362-368. ZHANG S, XIE Y J, HUANG L M. Advances and challenges in artificial propagation and fry rearing in Japanese Eel Anguilla japonica[J]. Fisheries Science, 2011, 30(6): 362-368 (in Chinese).
[21] 刘建林, 张琛, 王夏娇, 等. 基于碳纳米管的固相萃取-分散液液微萃取测定水中多种痕量环境雌激素[J]. 高等学校化学学报, 2012, 33(1): 37-43. doi: 10.3969/j.issn.0251-0790.2012.01.006 LIU J L, ZHANG C, WANG X J, et al. Carbon nanotubes assisted solid-phase extraction combined with dispersive liquid-liquid microextraction based on solidification of floating organic droplet method for the determination of trace level environmental estrogens in aqueous solutions[J]. Chemical Journal of Chinese Universities, 2012, 33(1): 37-43 (in Chinese). doi: 10.3969/j.issn.0251-0790.2012.01.006
[22] TEMERDASHEV A, NESTERENKO P, DMITRIEVA E, et al. GC-MS/MS determination of steroid hormones in urine using solid-phase derivatization as an alternative to conventional methods[J]. Molecules, 2022, 27(18): 5796. doi: 10.3390/molecules27185796 [23] 于开宁, 王润忠, 刘丹丹. 水环境中新污染物快速检测技术研究进展[J]. 岩矿测试, 2023, 42(6): 1063-1077. YU K N, WANG R Z, LIU D D. A review of rapid detections for emerging contaminants in groundwater[J]. Rock and Mineral Analysis, 2023, 42(6): 1063-1077 (in Chinese).
[24] SWART N, POOL E. Rapid detection of selected steroid hormones from sewage effluents using an ELISA in the Kuils River water catchment area, South Africa[J]. Journal of Immunoassay & Immunochemistry, 2007, 28(4): 395-408. [25] BARONTI C, CURINI R, D’ASCENZO G, et al. Monitoring natural and synthetic estrogens at activated sludge sewage treatment plants and in a receiving river water[J]. Environmental Science & Technology, 2000, 34(24): 5059-5066. [26] WANG Q Q, RANGIAH K, MESAROS C, et al. Ultrasensitive quantification of serum estrogens in postmenopausal women and older men by liquid chromatography-tandem mass spectrometry[J]. Steroids, 2015, 96: 140-152. doi: 10.1016/j.steroids.2015.01.014 [27] RANNULU N S, COLE R B. Novel fragmentation pathways of anionic adducts of steroids formed by electrospray anion attachment involving regioselective attachment, regiospecific decompositions, charge-induced pathways, and ion-dipole complex intermediates[J]. Journal of the American Society for Mass Spectrometry, 2012, 23(9): 1558-1568. doi: 10.1007/s13361-012-0422-y [28] DUMONT Q, BÁRCENAS M, DOSSMANN H, et al. Improved steroids detection and evidence for their regiospecific decompositions using anion attachment mass spectrometry[J]. Analytical Chemistry, 2016, 88(7): 3585-3591. doi: 10.1021/acs.analchem.5b04097 [29] 周永顺, 龚剑, 杨可欣, 等. 超声波提取-固相萃取-液相色谱-串联质谱法同时测定沉积物中24种皮质类固醇激素[J]. 色谱, 2022, 40(2): 165-174. doi: 10.3724/SP.J.1123.2021.03025 ZHOU Y S, GONG J, YANG K X, et al. Simultaneous determination of 24 corticosteroids in sediments based on ultrasonic extraction, solid- phase extraction, liquid chromatography, and tandem mass spectrometry[J]. Chinese Journal of Chromatography, 2022, 40(2): 165-174 (in Chinese). doi: 10.3724/SP.J.1123.2021.03025
[30] 罗鑫. 太湖中甾体激素污染特征及生态风险研究[D]. 无锡: 江南大学, 2021. LUO X. Study on pollution characteristics and ecological risks of steroid hormones in Taihu Lake[D]. Wuxi: Jiangnan University, 2021 (in Chinese).
-



 下载:
下载: