-
丙酮酸在制药工业、日化工业、化工工业等场景中广泛使用[1],其分子结构中既有酮基又有羧基,是众多高附加值化学品的前驱体. 在生物代谢途径中,丙酮酸是糖酵解的最终产物,连接着糖酵解与三羧酸循环. 是蛋白质、脂肪和碳水化合物降解等代谢过程的重要中间分子,无论是好氧呼吸、厌氧发酵等生物产能代谢方式,均要历经形成丙酮酸而后进入相应代谢途径,细胞内的各种代谢途径通过丙酮酸相互连接,其在生物体内的地位不言而喻[2]. 以生物技术法进行丙酮酸资源生产,或以其为纽带进行废物资源化回用,是值得研究的方向.
目前生产丙酮酸的主流工艺是化学合成[3],存在环境污染严重,底物利用率低等问题. 生物技术法生产丙酮酸具有成本低廉、环境友好等特点,是一种潜在的高效工艺. 本文通过概述生物体内丙酮酸代谢途径、生物自身调控机制,综述以代谢工程、生物育种、抑制剂手段人为干预生物体内丙酮酸代谢途径取得的进展,以期构建丙酮酸生物代谢途径框架,为生物技术法高效生产丙酮酸提供借鉴,展望以丙酮酸或以其为纽带进行废物资源化回用的愿景.
-
丙酮酸的生物合成代谢途径具有多样性,包括EMP途径[4]、ED途径[5]、HMP途径[6]、葡萄糖的直接氧化[7]等.
最常见的己糖转化为丙酮酸的途径是EMP途径,即为糖酵解[8] [如式(1)、图1(a)]. 葡萄糖在许多生物的代谢途径中占据核心地位,其分解代谢是生物体共同经历的前期途径,葡萄糖分解净生成2分子丙酮酸和2分子ATP. EMP途径中葡萄糖形成丙酮酸分为10步、两个阶段:第一阶段(前5步)为准备阶段,第二阶段(后5步)是产生ATP的储能阶段.
ED途径即KDPG途径[如式(2)、图1(b)],该途径生成的2分子丙酮酸,分别由2-酮-3-脱氧-6-磷酸葡萄糖(KDPG)裂解、磷酸甘油醛经EMP途径获得[9].
HMP途径即戊糖磷酸途径[如式(3)、图1(c)],可分为氧化和非氧化阶段. 在氧化阶段中,五碳糖由六碳糖脱羧形成,NADP+还原形成NADPH(还原型). 5-磷酸木酮糖在非氧化阶段中形成,而后经过转酮基、转醛基反应,将HMP途径与EMP途径相连接,甘油醛-3-磷酸在一些EMP途径酶的催化下转化为丙酮酸[10].
葡萄糖的直接氧化[图1(d)],即生物利用氧气,葡萄糖转化为葡萄糖酸(葡萄糖氧化酶催化),再磷酸化为6-磷酸葡萄糖酸,后经ED或HMP途径进行后续代谢[7].
-
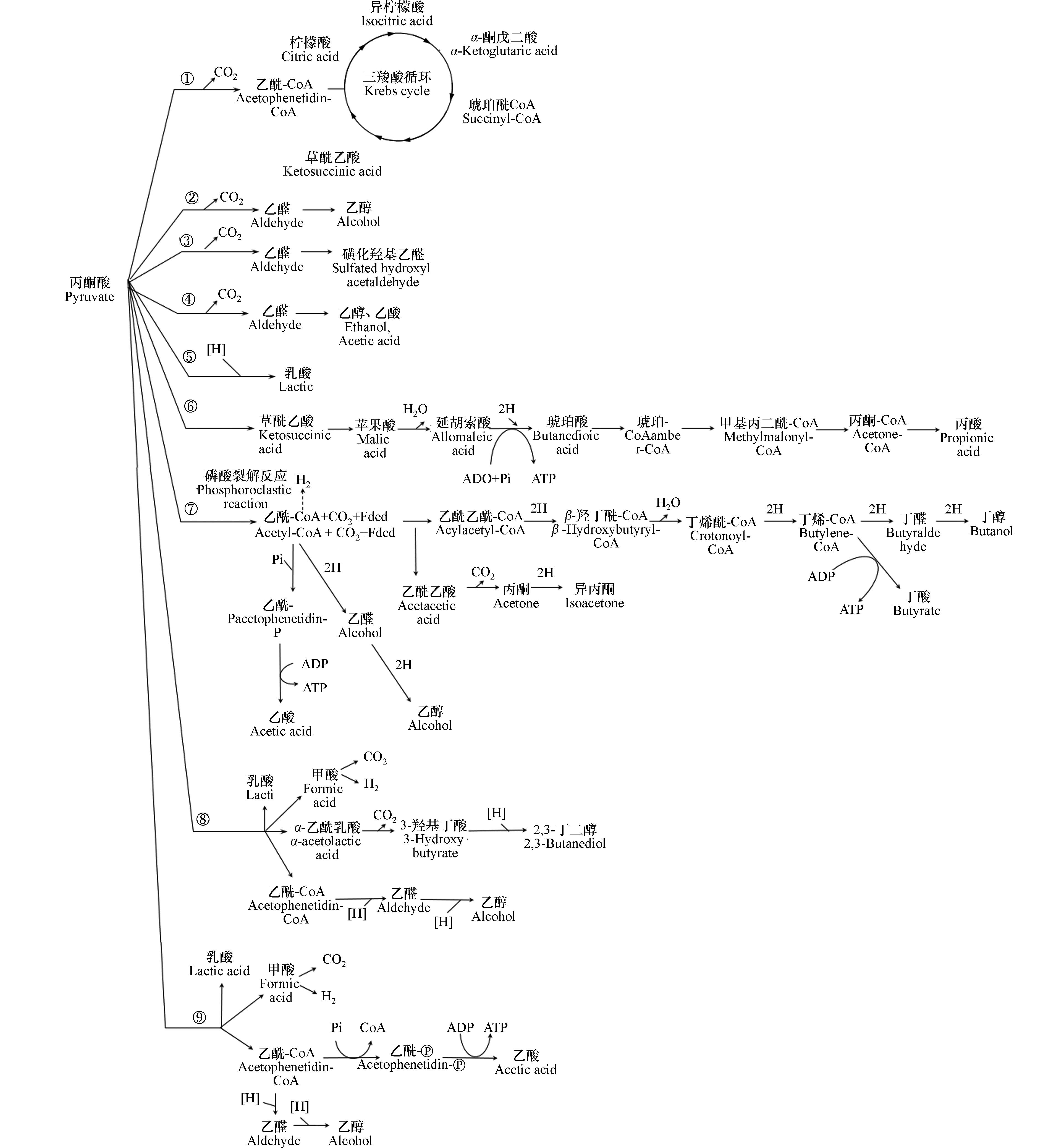
丙酮酸以后的分解代谢途径及产物,因生物种类和所处条件不同而各不相同[11]. 有氧呼吸三阶段理论中,有机物首先转化成丙酮酸,继而转化为乙酰-CoA经历三羧酸循环继续氧化[12],见式(4)、图2.
在无氧条件下,异养厌氧菌和兼性厌氧菌,由于缺乏部分关键酶,而不能形成完整的三羧酸循环. 丙酮酸后续的分解代谢途径,随发酵类型和生物种类的不同而不同,相应的代谢条件、产物、反应过程也各不相同[13],见图2 、表1.
-
生物合成代谢途径受体内复杂调控网络严谨调控,丙酮酸处在糖酵解与三羧酸循环的关键节点,受到关键酶以及代谢产物的反馈调节.
葡萄糖经转运系统进入细胞后,进行糖酵解途径的第一步(葡萄糖的磷酸化),己糖激酶催化D-葡萄糖分子在第6位磷酸化,形成6-磷酸葡糖[见图1(a)],该过程必须有Mg2+的存在. 己糖激酶是糖酵解途径中的关键调节酶,其反应产物6-磷酸葡糖和ADP可以变构抑制该酶[21]. Al-Ziaydi等[22]使用D-甘露庚酮糖抑制己糖激酶,发现丙酮酸、ATP等含量降低,抑制了糖酵解途径,诱导细胞凋亡.
第二个磷酸化反应,即6-磷酸果糖形成1,6-二磷酸果糖[见图1(a)],是糖酵解的关键节点. 该过程磷酸果糖激酶(糖酵解途径最重要的调控关键酶)催化反应,需要有2价金属离子(Mg2+为主)参与反应,磷酸果糖激酶的活力水平直接影响糖酵解的速率[23].
糖酵解的最后一步,即在丙酮酸激酶催化下,磷酸烯醇式丙酮酸不可逆地转变为丙酮酸和一分子ATP[见图1(a)],丙酮酸激酶在控制丙酮酸外流量和ATP产生起关键作用[24]. 有学者通过过表达这些酶的活性,研究对糖酵解进程的影响,Ren等[25]以有抑制丙酮酸激酶效果的MOF,限制了细胞的糖酵解速率及生长. Hauf等[26]同时对酵母糖酵解过程的关键酶过表达,并没有提高糖酵解过程的通量. Emmerling等[27] 分别对静息大肠杆菌的丙酮酸激酶和磷酸果糖激酶过表达,相比对照组,从乙醇到乳酸的转变量分别提高了三倍和两倍,而乙醇的形成减少了很多,但学者认为代谢通量的变化非完全由丙酮酸激酶和磷酸果糖激酶过表达而引起,仅人为过表达糖酵解途径的关键酶,并不能提高合成途径的通量,也可能由于酶过表达而导致的细胞组成发生改变,从而导致糖酵解通量发生改变.
ED途径中的醛缩酶,是该途径的关键酶,催化KDPG形成丙酮酸和3-磷酸甘油醛[28] [见图1(b)]. Morita等[29]在酿酒酵母中异源表达ED途径,当过表达醛缩酶活性时,可提高酿酒酵母的生长速率,ED通路的代谢流量也有所增加.
HMP途径中氧化阶段的第一步(6-磷酸葡糖脱氢),是不可逆的限速反应,由6-磷酸葡糖脱氢酶催化进行[见图1(c)]. 该酶的活性与NADP+/NADPH的比例有关,NADP+是重要的调控因子,NADP+浓度升高/降低时,该酶可被激活/抑制[30].
综上,丙酮酸合成代谢途径受到各代谢途径关键酶(己糖激酶、磷酸果糖激酶、丙酮酸激酶、6-磷酸葡糖脱氢酶、醛缩酶等)、ATP水平及关键代谢产物浓度间的复杂作用调控.
-
在有氧条件下,糖酵解所产生的丙酮酸会继续转化为乙酰辅酶A,丙酮酸脱氢酶系不可逆的调节这个过程,连接着糖酵解与三羧酸循环,控制着丙酮酸到乙酰辅酶A的通路[31],是生物体内分解代谢途径的重要限速酶. 丙酮酸脱氢酶系有三种酶组成,五种辅助因子(焦磷酸硫胺素(TPP)、辅酶A、硫辛酸、NAD+、FAD)参与,这些酶之间非共价结合,依次催化发生三种反应,见表2[32].
E1亚基的磷酸化和去磷酸化,可以使丙酮酸脱氢酶系的活性被抑制或激活. 也可以通过改变丙酮酸脱氢酶激酶(抑制)和丙酮酸脱氢酶磷酸酶(激活)的活性,而使丙酮酸脱氢酶系活性增强[33]. Kwak等[34]从海葵属的几种植物中分离出一种新型丙酮酸脱氢酶激酶抑制剂,增强了丙酮酸脱氢酶的活性. 而经乙酰辅酶A往后的三羧酸循环,主要是受柠檬酸复合酶、异柠檬酸脱氢酶、α-酮戊二酸脱氢酶调控,这些酶所催化的过程是生物代谢的限速因素.
在无氧条件下,生物进行乳酸发酵时,在乳酸脱氢酶的催化下,葡萄糖经丙酮酸转化为成乳酸. Mazzoli等[35]通过过表达乳酸脱氢酶的启动因子,与天然菌株相比乳酸脱氢酶活性提高了10倍,乳酸产量增加了2倍. 酵母菌在无氧条件下进行乙醇发酵生成乙醇,该过程发生两个反应:丙酮酸脱羧生成乙醛(丙酮酸脱羧酶催化)、乙醛还原生成乙醇并产生氧化型NAD+(乙醇脱氢酶催化). Tian等[36]通过在巴氏杆菌中表达异源丙酮酸脱羧酶,以纤维素为底物,实现了21.3 g·L−1的乙醇产量.
故而,丙酮酸分解代谢途径受到控制丙酮酸外流的关键酶(丙酮酸脱氢酶、乳酸脱氢酶、丙酮酸脱羧酶等)以及后置代谢过程产物浓度水平的调节,当后置产物积累时,相对应的酶活性就会受到抑制,从而保证代谢的正常进行.
-
由于生物自身拥有完整的代谢调控系统,葡萄糖代谢和丙酮酸生成受到相应关键酶以及产物的反馈调节,丙酮酸难以在拥有正常代谢途径的生物体内积累. 有学者利用基因工程手段,有目标的对生物原有代谢途径进行修饰改造,从而减弱甚至阻断目标产物的代谢通路流量[37].
丙酮酸的积累量与糖酵解通量直接相关,Yokota等[38]将F1-atp酶基因引入硫辛酸营养缺陷的大肠杆菌W1485lip2中,试图过表达糖酵解过程的关键酶,该菌株以葡萄糖为底物,在32 h内产生约31 g·L−1的丙酮酸.
有学者利用基因工程手段切断或减弱丙酮酸的分解代谢进程,从而达到丙酮酸积累的目的. Tomar等[39]敲除了大肠杆菌丙酮酸脱氢酶复合体的aceE、aceF、lpd基因,表现最好的菌株35h内以葡萄糖和醋酸为底物,可产生35 g·L−1的丙酮酸. Bruno等[40] 敲除大肠杆菌的aceEF、pflB、poxB、pps、ldhA基因,并对乙酸和葡萄糖的比例进行调控,在30 h内实现了62 g·L−1的丙酮酸产量. Moxley等[41]在大肠杆菌中构建了ace基因变体,并且敲除了ldhA和poxB基因,以葡萄糖为底物,丙酮酸最大得率为0.66 g·g−1. 沈冬钱等[42]敲除大肠杆菌的lpdA基因,以葡萄糖、果糖、木糖、甘露糖为碳源,丙酮酸的得率分别达到了0.884 g·g−1、0.802 g·g−1、0.817 g·g−1、0.808 g·g−1.
Nakashima等[43] 沉默大肠杆菌的aceE基因或同时沉默并敲除相关基因,以葡萄糖为底物,可在72 h内产生26 g·L−1的丙酮酸. 与基因敲除相比,基因沉默保留了部分丙酮酸脱氢酶的活性,不需要额外添加碳源维持生物体的基本生长代谢.
在酵母菌中,丙酮酸脱羧酶是丙酮酸分解代谢途径的关键酶,Wang等[44] 敲除酿酒酵母丙酮酸脱羧酶的pdc5和pdc1编码基因,在20 g·L−1蛋白胨、10 g·L−1酵母膏、2.5 g·L−1醋酸钠环境下培养96 h,丙酮酸的产量可达25 g·L−1. 李亿等[45]通过敲除丙酮酸脱羧酶的pdc1、pdc5、pdc6三个结构基因,在2L发酵罐内批次补料进行76 h发酵实验,丙酮酸产量可达105 g·L−1. Wang等[46]通过过表达解脂耶氏酵母的POS5和GPD2基因,修饰其甘油代谢途径,该菌株的丙酮酸产量可达8.55 g·L−1.
Benson等[47]通过敲除细长聚球藻PCC7942的GlgC基因阻止糖原合成,在缺氮以及氮限制条件下,丙酮酸的浓度可达0.24 mmol·L−1,实现了长聚球藻PCC7942的碳通量重新定向,但相较于其他工程菌株,丙酮酸积累量较少.
Suo等[48]敲除乳酸乳球菌中LDH、PTA、ADHE基因,在分批补料发酵下实现54.6 g·L−1的丙酮酸产量. 该菌株除丙酮酸外的大部分代谢途径被阻断,超过80%的碳通量直接流向丙酮酸,从而实现了丙酮酸的高效生产,可见丙酮酸的积累量与流经丙酮酸的碳流量成正相关.
Xu [49]等敲除酿酒酵母中硫胺素生物合成调控基因THI2和THI3,以葡萄糖为碳源,丙酮酸的产量可达8.21 g·L−1. 通过调节丙酮酸代谢过程辅助因子的基因表达,限制相关辅助因子的合成,也可达到代谢控制的目的.
综上,通过基因工程手段,人为干预控制丙酮酸合成或分解关键酶、代谢途径辅助因子的基因表达,可以减少丙酮酸后续代谢过程通量及副产物的产生,见表3. 但经基因敲除后的工程菌,其丙酮酸的分解代谢途径被阻断,无法在以葡萄糖为唯一碳源的环境中正常生长,需要添加乙醇或醋酸盐等碳源才能保持一定的生物活性.
-
丙酮酸分解代谢途径中的关键酶,必须要在相关辅助因子参与下,才能发挥正常的催化作用. 有学者变通过随机诱变,选育出不能正常合成这些辅助因子的营养缺陷型菌株,探究能否达到丙酮酸积累的目的.
Yokota等[50]选育出一株硫辛酸营养缺陷型大肠杆菌(W1485lip2),在缺乏硫辛酸的培养基中以50 g·L−1葡萄糖为底物,丙酮酸产量为25.5 g·L−1. 硫辛酸营养缺陷型菌株在硫辛酸缺乏条件下,丙酮酸脱氢酶活性降低,从而减弱了丙酮酸向乙酰辅酶A的代谢碳通量.
Kamzolova等[51]构建了硫胺素营养缺陷型的VKM Y-
2677 酵母菌株,在发酵罐培养过程中,以葡萄糖为碳源产生43.2 g·L−1丙酮酸. 在硫胺素的限制下,丙酮酸脱氢酶活性降低,丙酮酸从酵母菌体内向外排泄.刘立明等[52]经多次选育改良出一株四重维生素(硫胺素、吡哆醇、生物素、烟酸)的营养缺陷型光滑球拟酵母菌,在300 L发酵罐中68 h丙酮酸积累水平达到55.8 g·L−1. 其中硫胺素是丙酮酸脱羧酶和丙酮酸脱氢酶系的辅基,吡哆醇是转氨酶的辅基,生物素是丙酮酸羧化酶的辅基,烟酸是丙酮酸脱酶系的辅基.
营养缺陷型菌株因自身不能合成所缺陷的辅助因子,在培养基中适量添加这些辅基,可以选择性地开关丙酮酸的代谢通路,从而达到积累丙酮酸的目的,见表3. 营养缺陷型菌株保留了部分丙酮酸后续的代谢通量,可以在细胞正常生长下达到丙酮酸积累的目的.
-
除上述对丙酮酸代谢途径的改造外,一些研究人员根据丙酮酸脱氢酶系的特点,设计出可以降低该酶活性的抑制剂,并应用于不同领域的研究.
Chan等[53] 设计了一种与硫胺素(TPP)结构相似的物质—A derivative of 16, ester 19,是一种有效的PDH E1选择性抑制剂. 王涛[54]以丙酮酸脱氢酶系为作用靶标,研究出α氧代磷酸酯(盐)类衍生物杀菌剂. Song等[55]研究发现,在Bacillus sp. FS2011发酵和预处理堆肥过程中添加丙酮酸脱氢酶复合物抑制剂,可降低代谢副产物的产量.
综上,以丙酮酸脱氢酶系为靶标的抑制剂,可以降低丙酮酸脱氢酶系的活性,抑制丙酮酸后续的分解代谢过程,改变正常的生物代谢途径,从而达到代谢控制的目的.
-
以丙酮酸为前驱体的高附加值化学品众多,用途极其广泛. 相较于传统方法,生物技术法生产丙酮酸,具有价格低廉、环境友好等特点,以该方法生产丙酮酸无疑是最优选择. 本文分析了生物体内丙酮酸合成及分解代谢途径,介绍了研究人员人为干预糖酵解及丙酮酸代谢等过程关键酶活性的系列工作,综述了通过生物代谢途径改造生产丙酮酸取得的进展. 国内外学者在过去一段时间内,通过对生物代谢控制,实现了在单一碳源的理想条件下进行丙酮酸生产.
从丙酮酸出发的代谢途径具有多样性,不同生物体代谢丙酮酸可生成乙醇、乳酸、丙酸、乙酸、丁醇等高经济价值产物[13]. 随着代谢工程、生物育种、新型抑制剂开发等技术的不断发展,以环境领域内的废弃物为底物,对生物丙酮酸脱氢酶系为代表的关键酶进行调控,人为干预生物代谢过程的各部分通量,或选育出具有特殊代谢途径的菌种,以丙酮酸为产物导向进行资源化回收,或利用丙酮酸在各生物代谢途径中占据枢纽地位这一特点,以不同类型生物为工具,以丙酮酸为纽带,将不同生物代谢产能途径相连接,进行以丙酮酸为中间产物的定向废物资源化生产,有着广阔的研究前景.
丙酮酸生物代谢途径及代谢控制的研究进展
Advances in the pathway and metabolic control of pyruvate metabolism
-
摘要: 丙酮酸作为生物代谢途径的重要中间产物,在代谢过程中起着枢纽作用,其又作为一种可再生资源,是众多大宗化学品的前驱体. 与传统化学方法相比,生物技术法生产丙酮酸具有环境友好、过程高效、可持续发展等优势. 本文总结了丙酮酸生物代谢的主要途径及原理;从生物合成、分解、关键酶调控方面总结了生物自身代谢丙酮酸的调控机制;综述了通过基因敲除、选育营养缺陷型菌株、设计及应用丙酮酸脱氢酶系抑制剂等手段阻断丙酮酸代谢途径等系列工作;介绍以丙酮酸脱氢酶系等关键酶为切入点进行代谢过程控制的方法可行性;构建了以丙酮酸或以其为纽带进行废物资源化回收利用的愿景. 以期为生物技术法高效生产丙酮酸提供理论借鉴,推动以丙酮酸或以其为纽带进行废物资源化的研究进程.Abstract: Pyruvic acid, as an important intermediate product in biological metabolic pathways, plays a pivotal role in the metabolic process. As a renewable resource, it is a precursor of many bulk chemicals. Compared with traditional chemical methods, the production of pyruvic acid using biotechnology has advantages such as environmental friendliness, process efficiency, and sustainable development. The main pathways and principles of pyruvate metabolism are summarized in this study; The regulatory mechanisms of pyruvate metabolism in organisms from the perspectives of biosynthesis, decomposition, and key enzyme regulation are summarized; A series of works on blocking pyruvate metabolism pathways through gene knockout, breeding of nutrient deficient strains, design and application of pyruvate dehydrogenase inhibitors, and other means are reviewed in this review. Introducing the feasibility of using key enzymes such as pyruvate dehydrogenase as entry points for metabolic process control methods; We have constructed a vision of utilizing pyruvate or its link for waste resource recycling. In order to provide theoretical reference for the efficient production of pyruvic acid through biotechnology, and promote the laboratory research process of waste recycling using pyruvic acid or its link.
-
Key words:
- Pyruvate /
- metabolic pathways /
- process control /
- resource recycling and utilization.
-

-
图 2 生物分解代谢途径. ①三羧酸循环,②酵母菌的第一型发酵,③酵母菌的第二型发酵,④酵母菌的第三型发酵,⑤乳酸发酵,⑥丙酸发酵,⑦丁酸发酵,⑧丁二醇发酵,⑨混合酸发酵
Figure 2. Biodegradation metabolic pathways. ①Tricarboxylic acid cycle, ②First type fermentation of yeast, ③Second type fermentation of yeast, ④Third type fermentation of yeast, ⑤Lactic acid fermentation, ⑥Propionic acid fermentation, ⑦Butyric acid fermentation, ⑧Butanediol fermentation, ⑨Mixed acid fermentatio
表 1 不同微生物发酵类型
Table 1. Different types of microbial fermentation
微生物
Microorganism发酵类型
Fermentation type条件
Condition产物
Product反应过程
Reaction process参考文献
References酵母菌 第一型发酵 厌氧pH=3.5—4.5 乙醇 图2② [14] 第二型发酵 厌氧硫酸氢钠(3%) 甘油 图2③ [15] 第三型发酵 厌氧 pH=7.6 甘油、乙醇、乙酸、CO2 图2④ [16] 乳酸菌 乳酸发酵 厌氧 乳酸 图2⑤ [17] 丙酸杆菌 丙酸发酵 丙酸、乙酸、CO2 图2⑥ [18] 丁酸杆菌 丁酸型发酵 厌氧 丁酸 图2⑦ [19] 肠杆菌 丁二醇发酵、混合酸发酵 乳酸、乙酸、甲酸、乙醇、CO2、H2 图2⑧⑨ [20] 表 2 丙酮酸脱氢酶系组成
Table 2. Composition of pyruvate dehydrogenase system
组分
Component缩写
Abbreviation辅基
Prosthetic group催化反应
Catalytic reaction丙酮酸脱氢酶组分 E1 TPP 丙酮酸氧化脱羧 二氢硫辛酰转乙酰基酶 E2 硫辛酸 将乙酰基转移到 CoA 二氢硫辛酸脱氢酶 E3 FAD 将还原型硫辛酰胺转变为氧化型 表 3 丙酮酸生物代谢途径改造及产量
Table 3. Modification of pyruvate biometabolic pathways and production
生物种类
Biological species改造策略
Transformation strategy底物
Substrate培养方式
Culture method丙酮酸/( g·L−1)
Pyruvate产率/(g·g−1)
Yield参考文献
ReferencesE.coli K-12 Introduced F1- ATPase 葡萄糖 摇瓶 31 0.62 [38] E.coli CGSC6162 △aceE,△aceF,△lpd 葡萄糖,醋酸 发酵罐 35 0.72 [39] E.coli YYC202 ldhA::Kan △ldhA,△poxB 乙酸,葡萄糖 发酵罐 62 0.83 [40] E.coli H106V ↑aceE,△ldhA, △poxB 葡萄糖 摇瓶 ns 0.66 [41] E. coli MG1655 Silence aceE 葡萄糖 摇瓶 26 ns [43] S. cerevisiae Y2-1 △pdc5,△pdc1 葡萄糖 序批式摇瓶 25 ns [44] S. cerevisiae XY-49 △pdc1,△pdc5, △pdc6 葡萄糖 连续式发酵罐 105 0.5 [45] S. cerevisiae FMME-002 △THI2,△THI3 葡萄糖 摇瓶 8.21 ns [49] Y. lipolytica ZSGP ↑POS5, ↑GPD2 甘油 发酵罐 8.5 0.175 [46] S.elongatus PCC 7942 △GlgC 葡萄糖 摇瓶 0.2 ns [47] L.lactis FS1076 △ldh,△pta,△adhe,△als 葡萄糖 摇瓶 54.6 0.73 [48] E. coli W1485 硫辛酸营养缺陷型 葡萄糖 摇瓶 25.5 0.51 [50] B.adeninivorans VKM Y- 2677 硫胺素营养缺陷型 葡萄糖 摇瓶 43.2 0.77 [51] T.glabrata CCTCCM202019 硫胺素、吡哆醇、生物素、
烟酸营养缺陷型葡萄糖 发酵罐 55.8 0.64 [52] ns,无数据. ns,no data. -
[1] LUO Q, DING N N, LIU Y F, et al. Metabolic engineering of microorganisms to produce pyruvate and derived compounds[J]. Molecules, 2023, 28(3): 1418-1440. doi: 10.3390/molecules28031418 [2] MCCOMMIS K S, FINCK B N. Mitochondrial pyruvate transport: A historical perspective and future research directions[J]. The Biochemical Journal, 2015, 466(3): 443-454. doi: 10.1042/BJ20141171 [3] 李述文, 韩广甸, 赵树讳. 有机制备化学手册[M]. 北京: 石油工业出版社, 1997. LI S W, HAN G D, ZHAO S H. Handbook of organic preparation chemistry [M]. Beijing: Petroleum Industry Press, 1997(in Chinese).
[4] BOLAÑOS J P, ALMEIDA A, MONCADA S. Glycolysis: A bioenergetic or a survival pathway?[J]. Trends in Biochemical Sciences, 2010, 35(3): 145-149. doi: 10.1016/j.tibs.2009.10.006 [5] MENDZ G L, HAZELL S L, BURNS B P. The Entner-Doudoroff pathway in Helicobacter pylori[J]. Archives of Biochemistry and Biophysics, 1994, 312(2): 349-356. doi: 10.1006/abbi.1994.1319 [6] YUAN L, QIN Y L, ZOU Z C, et al. Enhancing intracellular NADPH bioavailability through improving pentose phosphate pathway flux and its application in biocatalysis asymmetric reduction reaction[J]. Journal of Bioscience and Bioengineering, 2022, 134(6): 528-533. doi: 10.1016/j.jbiosc.2022.08.010 [7] LEY J D, CORNUT S. Direct oxidation of glucose by aerobacter sp[J]. Nature, 1951, 168: 515-516. doi: 10.1038/168515a0 [8] CHANDEL N S. Glycolysis[J]. Cold Spring Harbor Perspectives in Biology, 2021, 13(5): a040535. doi: 10.1101/cshperspect.a040535 [9] SUTTER J M, TÄSTENSEN J B, JOHNSEN U, et al. Key enzymes of the semiphosphorylative entner-doudoroff pathway in the haloarchaeon Haloferax volcanii: Characterization of glucose dehydrogenase, gluconate dehydratase, and 2-keto-3-deoxy-6-phosphogluconate aldolase[J]. Journal of Bacteriology, 2016, 198(16): 2251-2262. doi: 10.1128/JB.00286-16 [10] REY G, VALEKUNJA U K, FEENEY K A, et al. The pentose phosphate pathway regulates the circadian clock[J]. Cell Metabolism, 2016, 24(3): 462-473. doi: 10.1016/j.cmet.2016.07.024 [11] VANDER HEIDEN M G, CANTLEY L C, THOMPSON C B. Understanding the Warburg effect: The metabolic requirements of cell proliferation[J]. Science, 2009, 324(5930): 1029-1033. doi: 10.1126/science.1160809 [12] ZHOU S H, DING N N, HAN R H, et al. Metabolic engineering and fermentation optimization strategies for producing organic acids of the tricarboxylic acid cycle by microbial cell factories[J]. Bioresource Technology, 2023, 379: 128986-129004. doi: 10.1016/j.biortech.2023.128986 [13] 李颖, 关国华. 微生物生理学[M]. 北京: 科学出版社, 2013. LI Y, GUAN G H. Microbial physiology[M]. Beijing: Science Press, 2013(in Chinese).
[14] HASHEM M, ALAMRI S A, ASSERI T A Y, et al. On the optimization of fermentation conditions for enhanced bioethanol yields from starchy biowaste via yeast co-cultures[J]. Sustainability, 2021, 13(4): 1890-1903. doi: 10.3390/su13041890 [15] de VUYST L, van KERREBROECK S, LEROY F. Microbial ecology and process technology of sourdough fermentation[J]. Advances in Applied Microbiology, 2017, 100: 49-160. [16] CHIDI B S, BAUER F F, ROSSOUW D. The impact of changes in environmental conditions on organic acid production by commercial wine yeast strains[J]. South African Journal of Enology and Viticulture, 2018, 39(2): 297-304. [17] 王晓娜, 田开仁, 吴昊, 等. 微生物合成乳酸的细胞工厂构建研究进展[J]. 食品与发酵工业, 2023: 1-9. WANG X N, TIAN K R, WU H, et al. Research progress on the construction of cell factories for microbial synthesis of lactic acid [J] Food and Fermentation Industry, 2023: 1-9(in Chinese).
[18] 张克男. 丙酸发酵工艺优化研究[D]. 保定: 河北大学, 2020. ZHANG K N. Study on the optimization of propionic acid fermentation process [D]. Baoding: Hebei University, 2020(in Chinese).
[19] 艾斌凌. 基于混合菌群的水稻秸秆丁酸发酵过程优化与机制研究[D]. 哈尔滨: 哈尔滨工业大学, 2014. AI B L. Fermentative process optimization and mechanisms of butyric acid production from rice straw with undefined mixed culture[D]. Harbin: Harbin Institute of Technology, 2014 (in Chinese).
[20] 张耀, 邱晓曼, 陈程鹏, 等. 生物法制造丁二酸研究进展[J]. 化工学报, 2020, 71(5): 1964-1975. ZHANG Y, QIU X M, CHEN C P, et al. Recent progress in microbial production of succinic acid[J]. CIESC Journal, 2020, 71(5): 1964-1975 (in Chinese).
[21] MAI V Q, MEERE M. Modelling the phosphorylation of glucose by human hexokinase I[J]. Mathematics, 2021, 9(18): 2315-2339. doi: 10.3390/math9182315 [22] AL-ZIAYDI A G, AL-SHAMMARI A M, HAMZAH M I, et al. Hexokinase inhibition using D-Mannoheptulose enhances oncolytic Newcastle disease virus-mediated killing of breast cancer cells[J]. Cancer Cell International, 2020, 20(1): 420-430. doi: 10.1186/s12935-020-01514-2 [23] WANG H Y, ZHAO P J, SHEN X, et al. Genome-wide survey of the phosphofructokinase family in cassava and functional characterization in response to oxygen-deficient stress[J]. BMC Plant Biology, 2021, 21(1): 376-391. doi: 10.1186/s12870-021-03139-7 [24] SCHORMANN N, HAYDEN K L, LEE P, et al. An overview of structure, function, and regulation of pyruvate kinases[J]. Protein Science: a Publication of the Protein Society, 2019, 28(10): 1771-1784. doi: 10.1002/pro.3691 [25] REN X L, HUANG X Y, WU Q, et al. Nanoscale metal organic frameworks inhibition of pyruvate kinase of M2[J]. Chinese Chemical Letters, 2021, 32(10): 3087-3089. doi: 10.1016/j.cclet.2021.03.081 [26] HAUF J, ZIMMERMANN F K, MÜLLER S. Simultaneous genomic overexpression of seven glycolytic enzymes in the yeast saccharomyces cerevisiae[J]. Enzyme and Microbial Technology, 2000, 26(9/10): 688-698. [27] EMMERLING M, BAILEY J E, SAUER U. Glucose catabolism of Escherichia coli strains with increased activity and altered regulation of key glycolytic enzymes[J]. Metabolic Engineering, 1999, 1(2): 117-127. doi: 10.1006/mben.1998.0109 [28] BRAGA R, HECQUET L, BLONSKI C. Slow-binding inhibition of 2-keto-3-deoxy-6-phosphogluconate (KDPG) aldolase[J]. Bioorganic & Medicinal Chemistry, 2004, 12(11): 2965-2972. [29] MORITA K, NOMURA Y, ISHII J, et al. Heterologous expression of bacterial phosphoenol pyruvate carboxylase and Entner-Doudoroff pathway in Saccharomyces cerevisiae for improvement of isobutanol production[J]. Journal of Bioscience and Bioengineering, 2017, 124(3): 263-270. doi: 10.1016/j.jbiosc.2017.04.005 [30] BUI C V, BOSWELL C W, CIRUNA B, et al. Apollo-NADP+ reveals in vivo adaptation of NADPH/NADP+ metabolism in electrically activated pancreatic β cells[J]. Science Advances, 2023, 9(40): eadi8317-8328. doi: 10.1126/sciadv.adi8317 [31] YANG M H, ZHANG X. Construction of pyruvate producing strain with intact pyruvate dehydrogenase and genome-wide transcription analysis[J]. World Journal of Microbiology and Biotechnology, 2017, 33(3): 59-68. doi: 10.1007/s11274-016-2202-5 [32] ŠKERLOVÁ J, BERNDTSSON J, NOLTE H, et al. Structure of the native pyruvate dehydrogenase complex reveals the mechanism of substrate insertion[J]. Nature Communications, 2021, 12(1): 5277-5287. doi: 10.1038/s41467-021-25570-y [33] SGRIGNANI J, CHEN J J, ALIMONTI A, et al. How phosphorylation influences E1 subunit pyruvate dehydrogenase: A computational study[J]. Scientific Reports, 2018, 8(1): 14683-14694. doi: 10.1038/s41598-018-33048-z [34] KWAK C H, LEE J H, KIM E Y, et al. Huzhangoside A suppresses tumor growth through inhibition of pyruvate dehydrogenase kinase activity[J]. Cancers, 2019, 11(5): 712-725. doi: 10.3390/cancers11050712 [35] MAZZOLI R, OLSON D G, LYND L R. Construction of lactic acid overproducing Clostridium thermocellum through enhancement of lactate dehydrogenase expression[J]. Enzyme and Microbial Technology, 2020, 141: 109645-109686. doi: 10.1016/j.enzmictec.2020.109645 [36] TIAN L, PEROT S J, HON S, et al. Enhanced ethanol formation by Clostridium thermocellum via pyruvate decarboxylase[J]. Microbial Cell Factories, 2017, 16(1): 171-181. doi: 10.1186/s12934-017-0783-9 [37] 于慧敏, 马玉超. 工业微生物代谢途径调控的基因敲除策略[J]. 生物工程学报, 2010, 26(9): 1199-1208. YU H M, MA Y C. Gene knockout strategies for metabolic pathway regulation in industrial microbes[J]. Chinese Journal of Biotechnology, 2010, 26(9): 1199-1208(in Chinese).
[38] YOKOTA A, HENMI M, TAKAOKA N, et al. Enhancement of glucose metabolism in a pyruvic acid-hyperproducing Escherichia coli mutant defective in F1-ATPase activity[J]. Journal of Fermentation and Bioengineering, 1997, 83(2): 132-138. doi: 10.1016/S0922-338X(97)83571-4 [39] TOMAR A, EITEMAN M A, ALTMAN E. The effect of acetate pathway mutations on the production of pyruvate in Escherichia coli[J]. Applied Microbiology and Biotechnology, 2003, 62(1): 76-82. doi: 10.1007/s00253-003-1234-6 [40] ZELIĆ B, GOSTOVIĆ S, VUORILEHTO K, et al. Process strategies to enhance pyruvate production with recombinant Escherichia coli: From repetitive fed-batch to in situ product recovery with fully integrated electrodialysis[J]. Biotechnology and Bioengineering, 2004, 85(6): 638-646. doi: 10.1002/bit.10820 [41] MOXLEY W C, EITEMAN M A. Pyruvate production by Escherichia coli by use of pyruvate dehydrogenase variants[J]. Applied and Environmental Microbiology, 2021, 87(13): e0048721. doi: 10.1128/AEM.00487-21 [42] 沈冬钱, 冯晓雨, 林东强, 等. 不同碳源对大肠杆菌lpdA突变菌累积丙酮酸的影响[J]. 生物工程学报, 2009, 25(9): 1345-1351. SHEN D Q, FENG X Y, LIN D Q, et al. Effect of different carbon sources on pyruvic acid production by using lpdA gene knockout Escherichia coli [J] Chinese Journal of Biotechnology, 2009, 25(9): 1345-1351(in Chinese).
[43] NAKASHIMA N, OHNO S, YOSHIKAWA K, et al. A vector library for silencing central carbon metabolism genes with antisense Rnas in Escherichia coli[J]. Applied and Environmental Microbiology, 2014, 80(2): 564-573. doi: 10.1128/AEM.02376-13 [44] WANG D P, WANG L, HOU L, et al. Metabolic engineering of Saccharomyces cerevisiae for accumulating pyruvic acid[J]. Annals of Microbiology, 2015, 65(4): 2323-2331. doi: 10.1007/s13213-015-1074-5 [45] 李亿, 秦艳, 申乃坤, 等. 酿酒酵母pdc基因缺陷菌株的构建及其丙酮酸发酵特性[J]. 食品与发酵工业, 2020, 46(8): 7-13. LI Y, QIN Y, SHEN N K, et al. Construction of pdc-deficient Saccharomyces cerevisiae and its pyruvic acid fermentation characteristics[J]. Food and Fermentation Industries, 2020, 46(8): 7-13(in Chinese).
[46] WANG S M, YANG Y Y, YU K C, et al. Engineering of Yarrowia lipolytica for producing pyruvate from glycerol[J]. Biotech, 2022, 12(4): 98-107. doi: 10.1007/s13205-022-03158-7 [47] BENSON P J, PURCELL-MEYERINK D, HOCART C H, et al. Factors altering pyruvate excretion in a glycogen storage mutant of the cyanobacterium, Synechococcus PCC7942[J]. Frontiers in Microbiology, 2016, 7(5): 475-486. [48] SUO F, LIU J M, CHEN J, et al. Efficient production of pyruvate using metabolically engineered Lactococcus lactis[J]. Frontiers in Bioengineering and Biotechnology, 2021, 8: 611701-611713. doi: 10.3389/fbioe.2020.611701 [49] XU G Q, HUA Q, DUAN N J, et al. Regulation of thiamine synthesis in Saccharomyces cerevisiae for improved pyruvate production[J]. Yeast, 2012, 29(6): 209-217. doi: 10.1002/yea.2902 [50] YOKOTA A, SHIMIZU H, TERASAWA Y, et al. Pyruvic acid production by a lipoic acid auxotroph of Escherichia coliW1485[J]. Applied Microbiology and Biotechnology, 1994, 41(6): 638-643. doi: 10.1007/BF00167278 [51] KAMZOLOVA S V, MORGUNOV I G. Biosynthesis of pyruvic acid from glucose by Blastobotrys adeninivorans[J]. Applied Microbiology and Biotechnology, 2016, 100(17): 7689-7697. doi: 10.1007/s00253-016-7618-1 [52] 刘立明. Torulopsis glabrata过量合成丙酮酸: 丙酮酸流向和代谢流的调控[D]. 无锡: 江南大学, 2003. LIU L M. Excessive synthesis of pyruvate by Torulopsis glabrata: regulation of pyruvate flow and metabolic flux [D]. Wuxi: Jiangnan University, 2003(in Chinese).
[53] CHAN A H Y, HO T C S, AGYEI-OWUSU K, et al. Synthesis of pyrrothiamine, a novel thiamine analogue, and evaluation of derivatives as potent and selective inhibitors of pyruvate dehydrogenase[J]. Organic & Biomolecular Chemistry, 2022, 20(45): 8855-8858. [54] 王涛. 靶标酶抑制剂的设计、合成与性质研究[D]. 武汉: 华中师范大学, 2004. WANG T. Design, synthesis, and properties of target enzyme inhibitors [D]. Wuhan: Central China Normal University, 2004(in Chinese).
[55] SONG Z X, HE H W, FAN Y T, et al. Effects of the inhibitor of pyruvate dehydrogenase multi-enzyme complex on hydrogen production by fermentative microbes[J]. International Journal of Green Energy, 2017, 14(3): 330-335. doi: 10.1080/15435075.2016.1255635 -




 下载:
下载: