-
随着我国污水处理能力和处理率的迅速增长,作为污水衍生品的污泥产量也逐年增加,预计到2020年,我国污泥年产量将达到6×107~9×107t[1]。污泥在经过浓缩、消化、脱水过程时会产生大量污泥水,其水质特点为氮磷浓度高、C/N比较低,且其中的大部分碳较难降解。目前,污泥水通过回流到污水处理厂的前端,与市政污水混合处理,增加了系统的氮磷负荷,容易导致出水氮磷不达标排放[2-4]。因此,将污泥水进行单独处理,可保障主工艺流程的稳定性和达标率,对污水处理厂的运行管理具有重要意义。
然而,污泥水单独处理工艺在目前的污水处理厂中应用较少,主要因为采用单独处理工艺在保证处理效率的前提下,其运行操作较为复杂或其能耗较高[5]。污泥水中的磷一般可通过沉淀或结晶去除,研究相对成熟[6],而污泥水中氮的低耗高效脱除一直是单独处理工艺研究开发的重点。污泥水中的氮主要为氨氮,从节能角度考虑,短程硝化-厌氧氨氧化(PN/A)工艺在污泥水处理中的研究应用较多。目前,大多研究通过分段式实现PN/A工艺对高氨氮废水的处理,即在2个独立的反应器中先经过短程硝化、后经厌氧氨氧化过程去除废水中的氮,但分段式存在操作复杂且短程硝化系统不易于长期稳定控制等问题[7-8]。因此,一体式PN/A对高氨氮废水的处理工艺受到了广泛的关注,相较于分段式,其具有工艺流程简单、占地面积小的优点[9-10]。然而,近年来采用一体式PN/A处理污泥水的研究中大多采用模拟废水[11-12],其对一体式短程硝化-厌氧氨氧化处理实际污泥水的工程应用借鉴性不高。
鉴于此,本研究以实际污泥水为对象,采用移动床生物膜反应器(moving bed biofilm reactor,MBBR)一体式耦合短程硝化与厌氧氨氧化来实现污泥水的生物脱氮,探究了生物脱氮效果并通过微生物鉴定了解其脱氮机制,为实际污泥水中氮的去除提供参考。
全文HTML
-
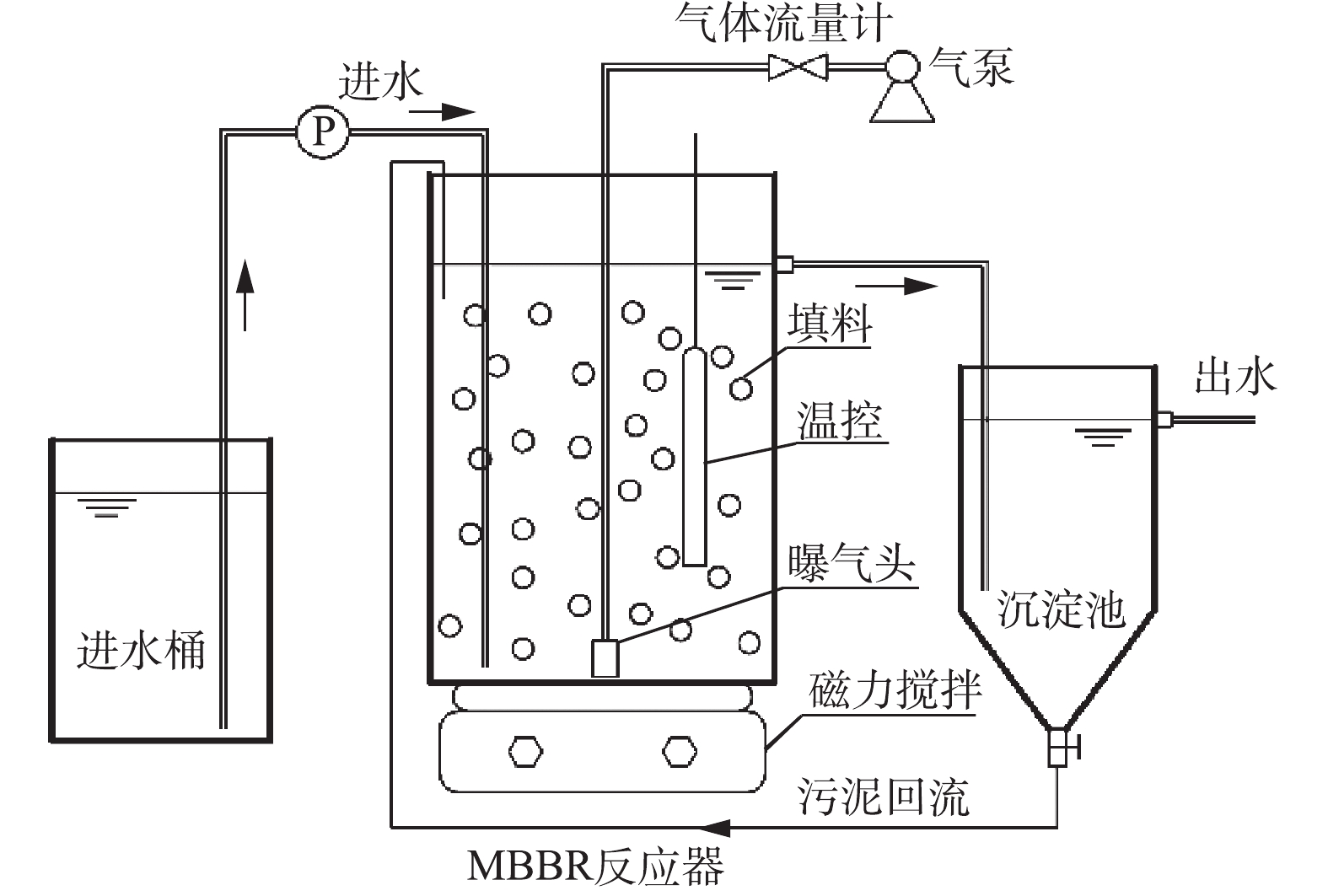
实验系统流程如图1所示。主体部分为MBBR,总高为50 cm,有效体积为10 L。MBBR内部填充K1填料,其密度为0.95 g·cm−3,填充率为50%,规格为直径10 mm×高10 mm。MBBR底部设石英砂曝气头,通过气泵曝气;底部同时设磁力搅拌器,系统完全混合器。MBBR前期接种污泥来自西安市第五污水处理厂二沉池,在开始实验前,MBBR已完成挂膜。沉淀池总有效体积为2.3 L,上部为圆柱形,底部为锥形。
实验在室温(24~26 ℃)下连续运行135 d,进水流量为0.45 L·h−1,DO保持在0.5 mg·L−1。
-
实验采用西安市第五污水处理厂的污泥水,污泥水进入MBBR前已经过磷回收,进入MBBR的污泥水水质如下:
$ {\rm{NH}}_{\rm{4}}^{\rm{ + }}$ -N为155~180 mg·L−1、TN为173~205 mg·L−1、$ {\rm{PO}}_{\rm{4}}^{{\rm{3 - }}}$ -P为8.5~12.5 mg·L−1、COD为109~172 mg·L−1、SS为65~184 mg·L−1。实验期间pH维持在8.45~8.59。 -
进出水水样每4 d采集1次,其中pH采用雷磁pH计(PHS-3C)测量,温度采用温度计测量,DO采用HACH便携式多功能水质测定仪(HQ-30d)测定;
$ {\rm{NH}}_{\rm{4}}^{\rm{ + }}$ -N、$ {\rm{NO}}_{\rm{3}}^{\rm{ - }}$ -N、$ {\rm{NO}}_{\rm{2}}^{\rm{ - }}$ -N、SRP均采用XINMAO752N分光光度计测量;SCOD采用重铬酸钾法测定;采用重量法测定悬浮固体(SS)和挥发性悬浮固体(VSS)。在第2天和第67天时,分别采集活性污泥和生物膜样本,测定其氨氧化活性(AUR)、亚硝酸盐氧化活性(NUR)并观察其宏观形态;在第101天时,采集活性污泥和生物膜样本测定其厌氧氨氧化活性(SAA)并观察其宏观形态。活性污泥和生物膜AUR、NUR、SAA测定时依据文献中的方法[13-14]测定
$ {\rm{NH}}_{\rm{4}}^{\rm{ + }}$ -N、$ {\rm{NO}}_{\rm{2}}^{\rm{ - }}$ -N和$ {\rm{NO}}_{\rm{3}}^{\rm{ - }}$ -N的浓度和MLVSS浓度,并据此计算对应的AOB、NOB及Anammox菌活性。活性污泥和生物膜的宏观形态采用尼康相机采集。在进行微生物的荧光原位杂交(FISH)及高通量测序分析时,在第128天,分别采集活性污泥和生物膜样本。通过FISH观察污泥和生物膜中AAOB菌的空间分布,用激光扫描共聚焦显微镜(Leica TCS SP8)来观察成像,本实验所用探针:总细菌采用Eub338mix (为Eub338, Eub338Ⅱ及Eub338Ⅲ三者等体积混合),总厌氧氨氧化菌采用Amx368,最常见的厌氧氨氧化菌种Candidatus Kuenenia和Candidatus Brocadia采用Amx820。
利用Illumina MiSeq平台对MBBR内的活性污泥和生物膜进行高通量分析测定,具体测定步骤如下。利用OMEGA试剂盒(Life,USA)提取土壤中的总DNA,利用琼脂糖凝胶电泳检验DNA的完整性。利用Qubit 2.0 DNA检测试剂盒(Life,USA)对基因组DNA精确定量,以确定PCR反应过程中应加入的DNA量。利用341F/805R引物进行PCR扩增,341F引物:5′-CCCTACACGACGCTCTTCCGATCTG-3′;805R引物:5′-GACTGGAGTTCCTTGGCACCCGAGAATTCCA-3′。
1.1. 实验装置及运行条件
1.2. 实验用水
1.3. 采样与分析
-
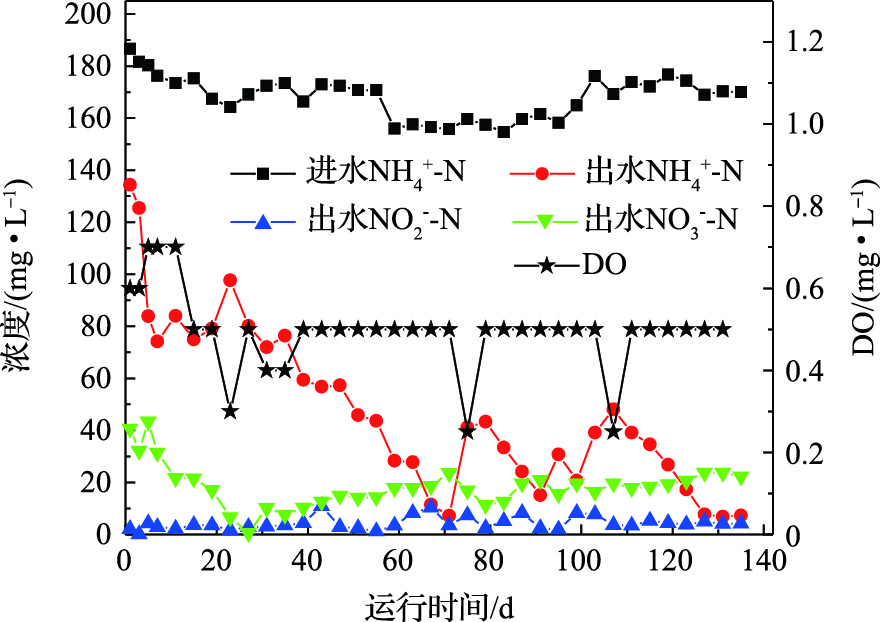
实验考察了MBBR中氮的去除及DO的影响。MBBR的运行性能如图2所示。由图2可知,在整个运行过程中,
$ {\rm{NH}}_{\rm{4}}^{\rm{ + }}$ -N的平均进水浓度为167.51 mg·L−1。在第0~71天,出水$ {\rm{NH}}_{\rm{4}}^{\rm{ + }}$ -N浓度随时间的延长逐渐降低,在第71天,降低至7.13 mg·L−1。由于曝气泵故障,之后的几天反应器内的DO浓度有所降低,出水$ {\rm{NH}}_{\rm{4}}^{\rm{ + }}$ -N浓度在第75天时升高至41.12 mg·L−1。在曝气泵故障排除后,出水$ {\rm{NH}}_{\rm{4}}^{\rm{ + }}$ -N浓度逐步降低,在第91天,降低至15.09 mg·L−1,恢复期为16 d。类似的情况又造成MBBR内DO浓度降低,出水$ {\rm{NH}}_{\rm{4}}^{\rm{ + }}$ -N浓度升高至48.07 mg·L−1,排除故障后,经过20 d的恢复,出水$ {\rm{NH}}_{\rm{4}}^{\rm{ + }}$ -N浓度降低至7.66 mg·L−1并保持稳定运行状态。此外,MBBR运行40 d后,出水$ {\rm{NO}}_{\rm{2}}^{\rm{ - }}$ -N浓度有一定的波动,这可能归因于DO的波动。40 d后,出水中$ {\rm{NO}}_{\rm{3}}^{\rm{ - }}$ -N浓度有所增加,这可能归因于反应器中发生的厌氧氨氧化或硝化,而整个过程未出现$ {\rm{NO}}_{\rm{2}}^{\rm{ - }}$ -N的大量积累。由图2亦可知,MBBR对氨氮和总无机氮的最大去除率可分别达到96%和79.7%。DO的降低可直接导致氮去除率的锐减,而DO的恢复并不能立即恢复氮的去除。因此,一体式反应器受DO浓度的影响较大,维持稳定的DO浓度对于系统的氮去除非常重要。
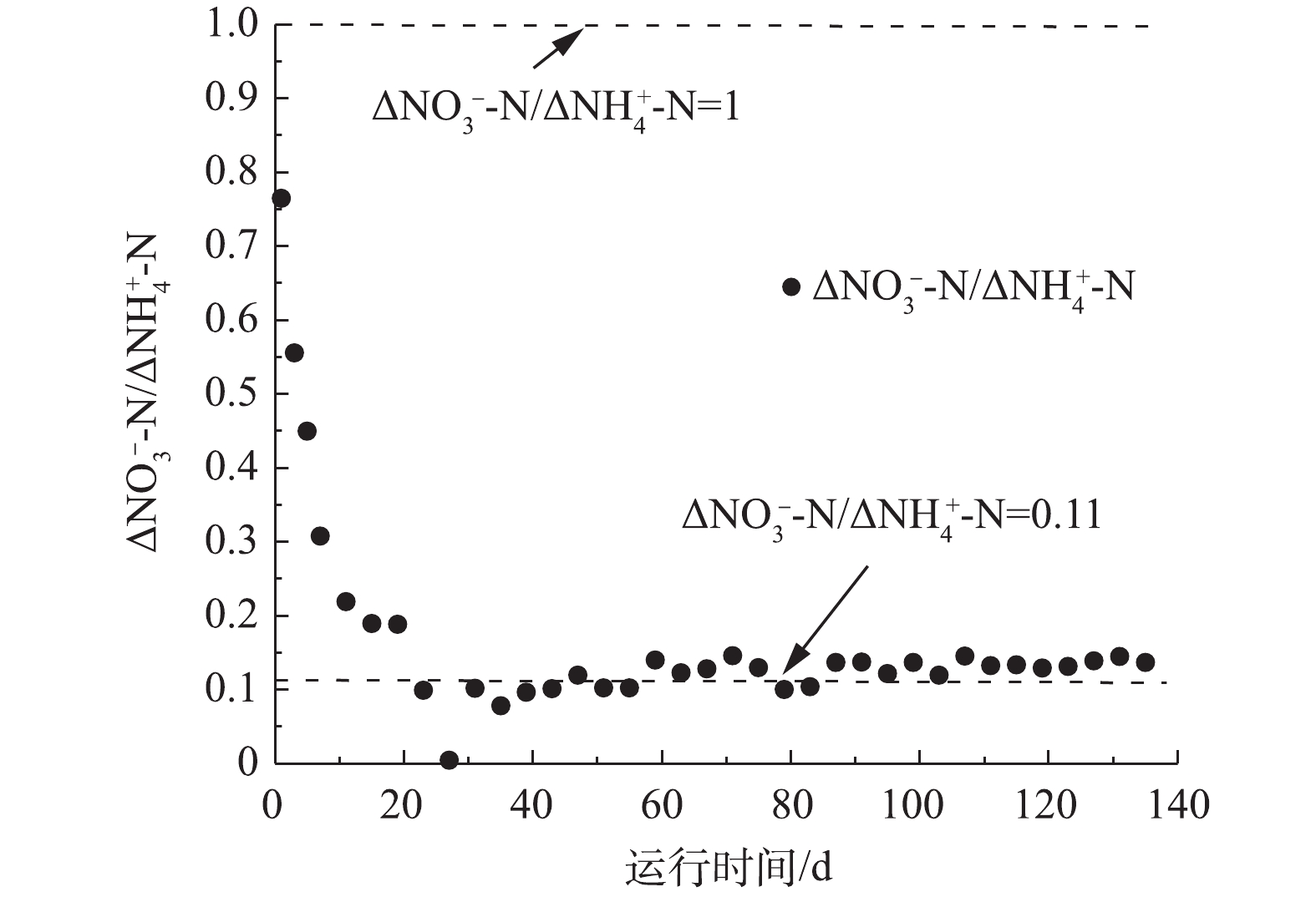
图3反映了整个实验过程中生成
$ {\rm{NO}}_{\rm{3}}^{\rm{ - }}$ -N与去除$ {\rm{NH}}_{\rm{4}}^{\rm{ + }}$ -N的比率(Δ$ {\rm{NO}}_{\rm{3}}^{\rm{ - }}$ -N/Δ$ {\rm{NH}}_{\rm{4}}^{\rm{ + }}$ -N)的变化情况。由图3可知,反应器从开始运行至第40天,Δ$ {\rm{NO}}_{\rm{3}}^{\rm{ - }}$ -N/Δ$ {\rm{NH}}_{\rm{4}}^{\rm{ + }}$ -N从0.77逐步降低到0.1附近,之后,Δ$ {\rm{NO}}_{\rm{3}}^{\rm{ - }}$ -N/Δ$ {\rm{NH}}_{\rm{4}}^{\rm{ + }}$ -N一直稳定在0.11附近。已有研究[15]表明,进水氨氮中约65%在部分硝化-厌氧氨氧化工艺中首先被AOB氧化成亚硝氮,然后剩余的氨氮和生成的亚硝氮通过厌氧氨氧化转化成N2,如果进水$ {\rm{NH}}_{\rm{4}}^{\rm{ + }}$ -N仅通过部分硝化-厌氧氨氧化过程进行生物转化,则$ {\rm{NO}}_{\rm{3}}^{\rm{ - }}$ -N与$ {\rm{NH}}_{\rm{4}}^{\rm{ + }}$ -N之比趋于0.11;如果发生$ {\rm{NH}}_{\rm{4}}^{\rm{ + }}$ -N的完全氧化,则该比率为1.00。因此,本研究表明,MBBR中维持了典型的部分硝化-厌氧氨氧化过程。 -
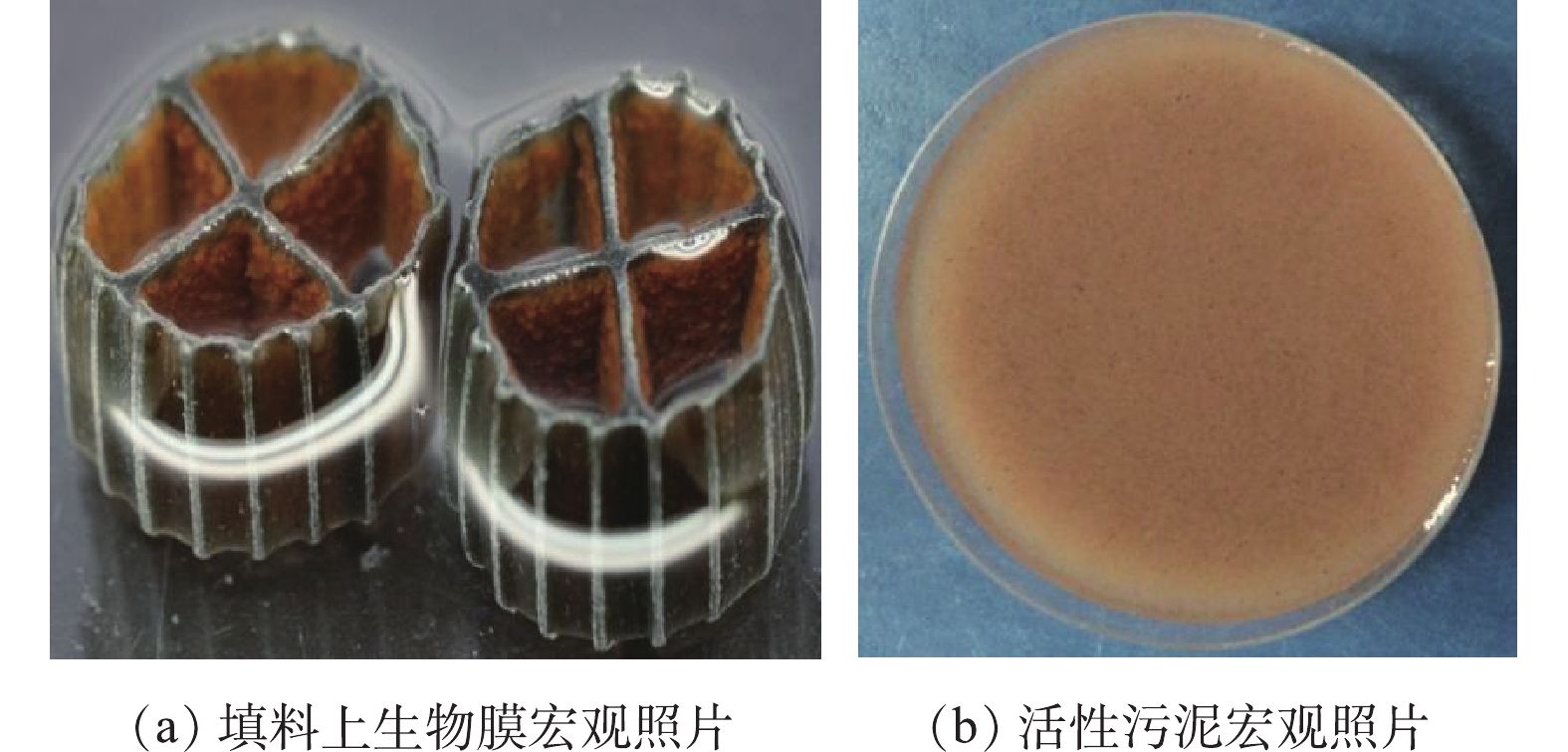
MBBR内活性污泥和填料上生物膜的宏观照片如图4所示。图4(a)为MBBR运行第101天的填料照片,此时填料内表面附着了棕褐色、凹凸不平的生物膜。图4(b)为MBBR运行第101天的活性污泥照片,此时的活性污泥呈现絮状,颜色为淡褐色。因此,MBBR中生物膜和活性污泥呈现出不同的宏观特征。
在MBBR运行2、67和101 d时,分别测定MBBR内活性污泥和生物膜的AUR、NUR和SAA,结果如表1所示。由表1可知,在运行过程中,活性污泥中的AOB菌活性强且增加较快,而NOB菌在活性污泥中活性较低,且在生物膜中的NOB菌活性有一定程度的下降,这有利于在MBBR中较好地完成部分硝化,为后续厌氧氨氧化提供合适的基质。此外,厌氧氨氧化菌存在于活性污泥和生物膜中,且在生物膜中的活性更高。总之,在整个运行过程中,微生物活性的变化有利于在MBBR中较好地完成部分硝化-厌氧氨氧化。
-
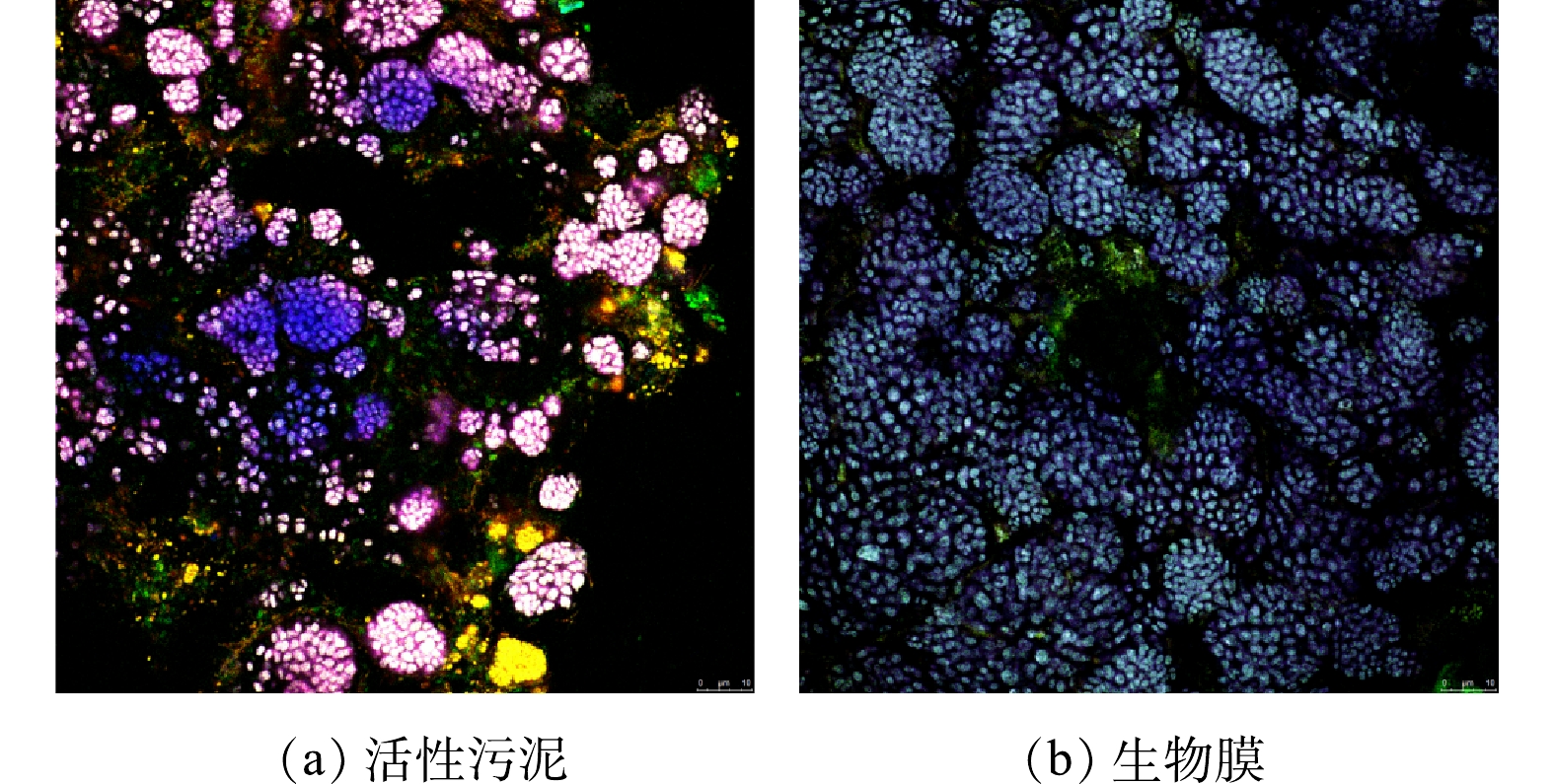
通过FISH观察污泥和生物膜中AAOB菌的空间分布,结果如图5所示。实验分别对样品中的总细菌、总厌氧氨氧化菌及最常见的厌氧氨氧化菌种(Candidatus Kuenenia和Candidatus Brocadia)进行了荧光染色,其荧光标识色分别为红、绿、蓝。3种颜色的叠加色为白色,白色即为总菌中最常见的厌氧氨氧化菌种(Candidatus Kuenenia和Candidatus Brocadia)。图5(a)为活性污泥中的菌种分布。由图5(a)可知,活性污泥中存在厌氧氨氧化菌,大部分菌体成团聚集,也有少部分分散在活性污泥中,图5(a)中显示的粉白色即为厌氧氨氧化菌种(Candidatus Kuenenia或Candidatus Brocadia)。图5(b)为生物膜中的菌种分布。由图5(b)可知,白色团状菌体在生物膜上大量聚集,图5(a)中显示的青白色即为厌氧氨氧化菌种(Candidatus Kuenenia或Candidatus Brocadia)。
-
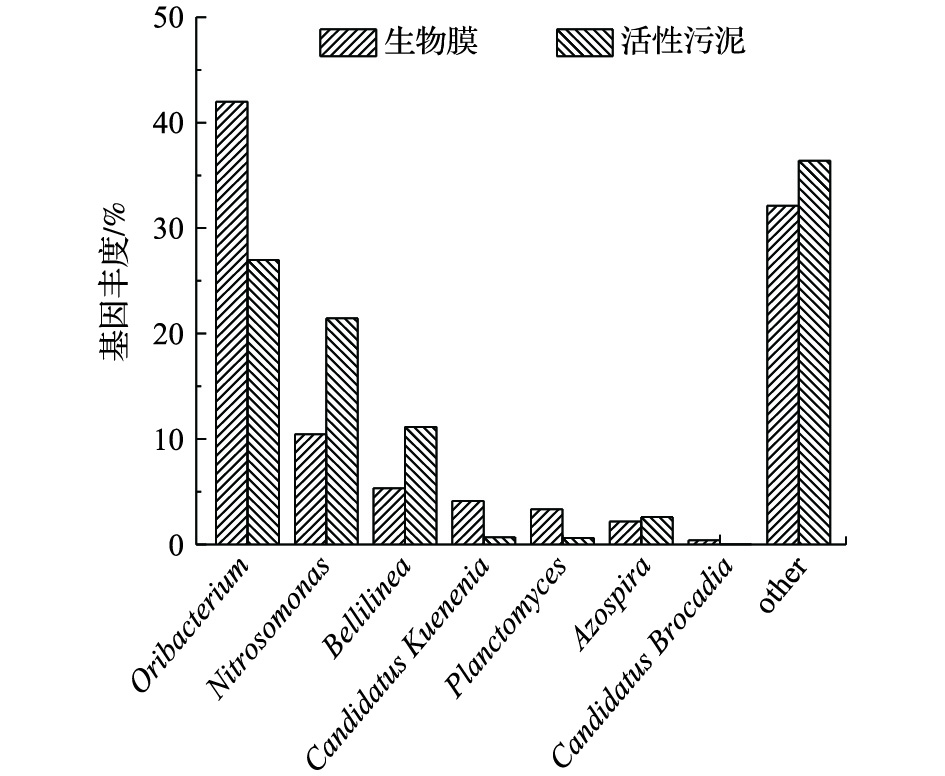
图6给出了MBBR中活性污泥及生物膜的高通量测序分析结果。由图6可知,各菌种在活性污泥和生物膜中所占的比例各不相同,但其菌种的类型较为相似。测定结果显示,本实验的功能菌之一的氨氧化菌Nitrosomonas,在活性污泥中占比达到了21.46%,而在生物膜中占比只有10.46%,这与CHAO等[16]的研究结果相似。因此,氨氧化菌Nitrosomonas在活性污泥中明显富集,其功能主要为部分硝化,这可能归因于氧气在活性污泥中的传质阻力小于生物膜[17]。此外,MBBR中的主要厌氧氨氧化菌为Candidatus Kuenenia和Candidatus Brocadia,两者分别占生物膜中总菌的4.13%和0.4%,占活性污泥中总菌的0.71%和0.04%,这与GILBERT等[18]发现生物膜上的厌氧氨氧化菌的丰度高于活性污泥的结果相一致。由此可见,生物膜具有较强的富集厌氧氨氧化菌的作用。此外,样品中还检测出亚硝酸盐氧化菌Nitroapira,其含量在生物膜及活性污泥微生物中仅分别占0.05%和0.15%。
综上所述,MBBR中活性污泥和生物膜中虽然均存在亚硝化菌和厌氧氨氧化菌,但2类菌在其中的富集程度并不相同,活性污泥主要发挥着亚硝化作用,生物膜主要发挥着厌氧氨氧化作用,这也与前述的活性测定结果一致。
2.1. MBBR的运行性能
2.2. MBBR内活性污泥及生物膜的研究
2.3. MBBR内活性污泥和生物膜的FISH分析
2.4. MBBR内活性污泥和生物膜的高通量测序分析
-
1)以实际污泥水为研究对象,24~26 ℃下在MBBR中实现了短程硝化-厌氧氨氧化一体式耦合,在氮负荷为0.22 kg·(m3·d)−1时,对TN的去除率达到79.7%,但其受反应器中DO浓度影响较大。因此,实现稳定的短程硝化-厌氧氨氧化过程的耦合,关键是要保持稳定的DO浓度。
2)微生物的活性测定及菌种鉴定结果表明,氨氧化菌Nitrosomonas在活性污泥中富集,厌氧氨氧化菌Candidatus Kuenenia在生物膜上富集。相应地,MBBR中的活性污泥主要完成短程硝化,而生物膜主要完成厌氧氨氧化。因此,为控制短程硝化-厌氧氨氧化合理匹配,可以通过控制活性污泥的生物量来实现。
3) MBBR在常温条件下通过短程硝化-厌氧氨氧化过程的耦合实现了对污泥水中氮的有效脱除,这表明MBBR在短程硝化-厌氧氨氧化耦合方面具有巨大的潜力。





 下载:
下载: