-
多氯联苯(PCBs)是联苯经金属催化反应,苯环上的氢原子被1—10个氯原子不同程度取代而形成的氯代芳香族化合物,其分子式为C12H10-XClX[1-2]。209 种PCBs同系物中有78种因分子存在手性轴而具有手性,其中19种可在室温下稳定存在,称其为手性PCBs[3]。手性PCBs在自然环境条件下极难降解,能长时间存留于环境中。手性PCBs占工业PCB制造总量的6%,并且在野外动植物、大气、实验动物和人体内可选择性富集[4]。在2011—2014年期间,中国长城站在南极西部的大气检测到手性PCBs的残留,PCB95、PCB136、PCB149、PCB174和PCB 176的EF值分别是0.438—0.541、0.425—0.654、0.422— 0.606、0.193—0.830和0.288—0.724[5]。2018年,He等研究了手性PCB 95和PCB149在无脊椎动物蚯蚓体内的富集,发现(+)-PCB95和(+)-PCB149在蚯蚓体内优先富集[6]。Bordajandi等对西班牙母乳样品中10种手性PCBs进行测定,结果发现PCB 91、95和149在所有母乳样品中均以外消旋体存在[7]。研究表明,普遍存在于动物、植物、昆虫和微生物体内的细胞色素单加氧酶P-450(CYP450)参与PCBs各异构体的生物富集与代谢过程,并具有明显的对映体选择性,这与酶的独特手性活性位点有关[8-9]。并且在细胞色素单加氧酶P-450(CYP450)的作用下,手性PCBs会转化成羟基化PCB代谢产物(OH-PCBs),代谢产物同样具有手性特征[10]。被称为大自然的"绿色肝脏"的植物可将吸收的污染物在体内降解代谢或转化成其他低毒物质来净化环境,手性化合物经由根部和叶片进入植物体内后在植物体内迁移转化、代谢和累积等的过程均可能存在对映体选择性。因此,研究植物体内手性PCBs的分布和对映体选择性富集特征具有重要的意义,然而当前对植物体内PCBs分布和累积特征的研究主要集中于非手性PCBs [11-12],手性PCBs的选择性累积和富集作用研究较少。
研究证实电子拆解活动会导致电子设备中的PCBs释放到周围的土壤、大气、水体等环境中[13- 14],环境中的PCBs可通过植物吸收进入食物链,威胁人体健康效应[15],因此,研究手性PCBs在农产品中的分布和迁移转化对农产品安全及生态风险预警具有非常重要的意义。
本研究选取与当地群众膳食密切相关的玉米为研究对象,通过对苗期、穗期和花粒期等3个生长周期的玉米植株的根、茎、叶和果实中手性PCBs的分布规律和对映选择性累积特征进行研究,初步揭示植物体内手性PCBs的选择性迁移及富集规律,为准确评价其对人类健康和生态环境风险提供基础数据。
全文HTML
-
Agilent 7890B-5975N 型气相色谱-质谱联用仪(美国Agilent公司),Cyclosil-B(30 m×0.25 mm×0.25 μm)气相色谱手性柱(美国Agilent公司)。加速溶剂萃取仪(Dionex ASE 350,USA),氮吹浓缩仪(Organomation Associates,USA),旋转蒸发仪(Heidolph,Germany)。
-
PCB45、PCB91、PCB95、PCB136、PCB149、PCB132和PCB174等7种手性PCBs标准品购自美国AccuStandard公司(纯度>97%);甲醇、二氯甲烷、丙酮、正己烷及甲苯等购自美国J.T.Baker公司或Dikma公司(农残级);碱性氧化铝,无水硫酸钠和浓硫酸购自北京精细化工厂(分析纯,其中硫酸为优级纯);硅藻土购自戴安公司;柱层析硅胶购自山东青岛海洋化工厂分厂(100—200目)。
-
本研究以清远市龙塘镇电子垃圾拆解区某耕地玉米为研究对象,在该区域内以对角线取样法,远离田埂,地边一定距离布设9个采样点。据文献报道重金属Cu会影响植物体中手性PCBs吸收和代谢的对映体选择性,因此该采样点附近不能有重金属Cu堆放[4]。本研究的采样期为2019年4月至7月,分别采集了苗期、穗期和花粒期的玉米样品,其中苗期采集根、茎和叶,穗期和花粒期分别采集根、茎、叶和果实,同时在该耕地采集土壤和大气样品。
采集的玉米样品带回实验室后,分别用自来水、矿泉水、超纯水冲洗数次,纱布包裹处于通风处阴干。玉米样品按根、茎、叶和果进行分离,经粉碎机粉碎后,过60目筛后,称取约8.0 g粉碎后的样品与硅藻土充分混合转移至提取筒中,用加速溶剂萃取仪提取。将提取后的样品浓缩液经过凝胶渗透色谱去除脂及大分子物质后,依次通过酸性硅胶柱和复合硅胶柱净化,利用碱性氧化铝柱分离得到PCBs组分,将所得样品浓缩直1 mL后,转入进样瓶,用GC-MS测定,土壤样品和大气样品提取净化与测定方法与玉米样品相似。
手性PCBs 在环境样品中的手性组成一般用对映体分数(EF) 表示,其计算公式为: EF = A1 /(A1+A2),当手性PCBs 在色谱柱上的出峰顺序不确定时,A1表示手性化合物第1 个出峰的对映体浓度,A2表示第2 个出峰的对映体浓度;当手性PCBs 的出峰顺序确定时,A1表示(+)对映体浓度,A2表示(–)对映体浓度;当EF 为0.5 时,表明手性单体为外消旋体。详细的手性PCBs的前处理方法、含量测定和对映体分数(EFs)的计算可参考前期发表的文章[16]。
1.1. 仪器
1.2. 标准品与有机溶剂
1.3. 样品的采集、预处理及手性PCBs的测定
-
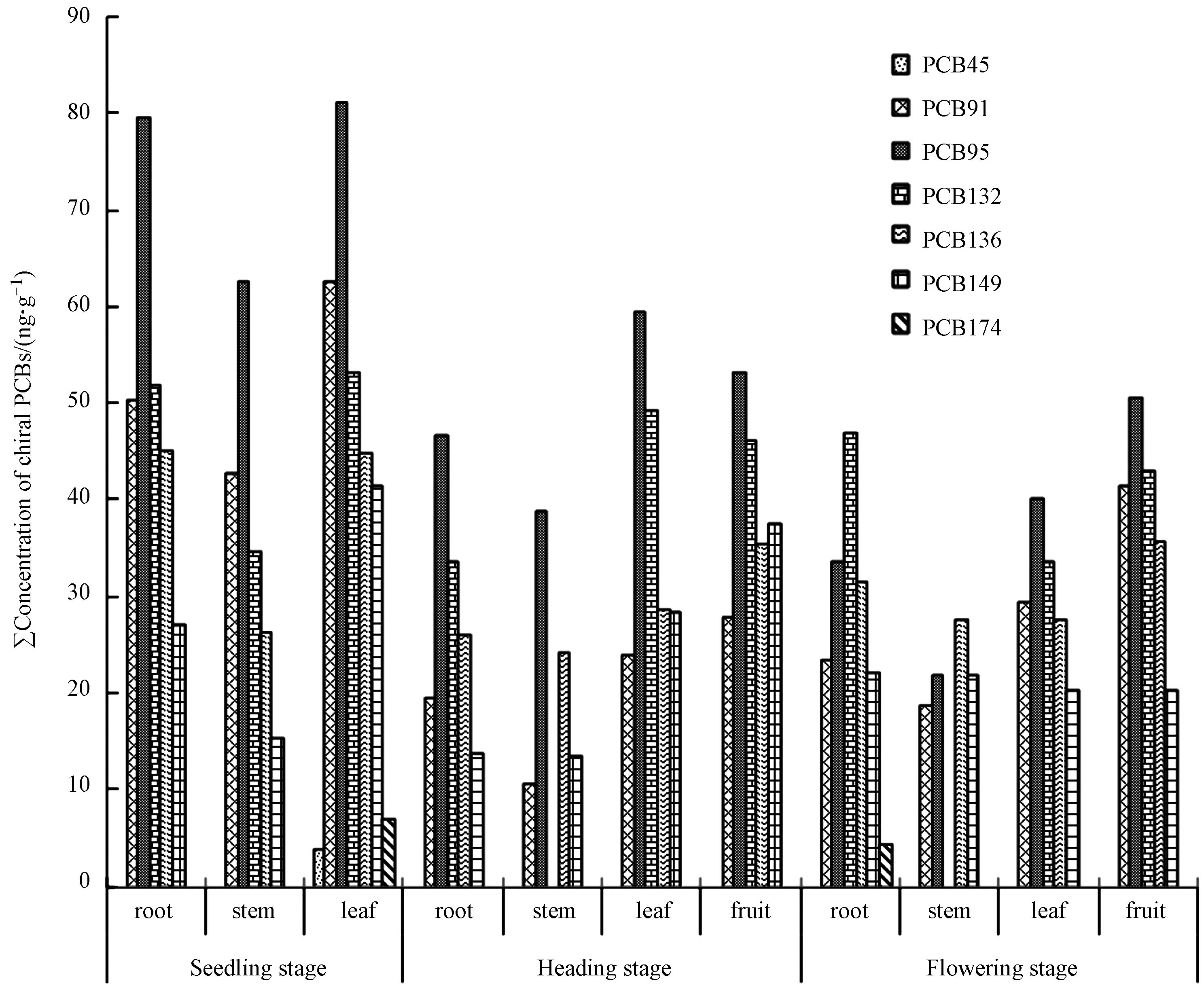
通过分析测定获得了玉米不同生长期各组织器官中7种目标手性PCBs同系物,详细数据列于表1。本研究所采样的玉米不同组织均受到手性PCBs的污染,手性PCBs在不同生长周期的玉米植株的根、茎、叶和果中的总含量为87.6—294.3 ng·g−1,此结果低于桉树叶中di-CBs到deca-CBs总PCBs的含量(88.0—635 ng·g−1)[17],远远高于济南玉米样品中手性PCBs总量为91.4—323 ng·kg−1[18],可见电子垃圾拆解活动是造成玉米植物手性PCBs污染的主要原因。手性PCBs在玉米组织中分布规律大致为:叶>根>茎,这可能是因为叶中手性PCBs的累积一方面来自于根系中PCBs的转移,一方面来自于大气中PCBs向叶片的传输,空气中手性PCBs的浓度比较低,PCB91、PCB95、PCB132、PCB136和PCB149的浓度分别为59.3、68.7、22.4、34.6、48.2 pg·m3,叶片从空气中吸收的手性PCBs的能力有限,故叶片中手性PCBs的累积大部分自于根系中PCBs的转移。而茎中手性PCBs的累积主要从根系转移获得,故而手性PCBs在叶片中的累积最高,茎中的累积最低。PCB91、PCB95、PCB136和PCB149在玉米中均全部检出,PCB132部分检出,检出率为81.8%。PCB45和PCB174的检出率极低,PCB45仅在苗期的叶中有检出,PCB174仅在苗期的叶和花粒期的根中有检出。
玉米不同生长期各组织中PCB91、PCB95、PCB132、PCB136和PCB149含量分别为10.8—62.6、21.8—81.3、ND—53.2、24.4—45.2、13.5—41.6 ng·g−1。其中玉米中PCB95、PCB136和PCB149的含量略高于文献中报道的电子垃圾拆解地桉树叶子和松针中3种手性PCBs的含量[17],这可能是不同的植物富集手性PCBs的能力不同。除了穗期和花粒期茎中手性PCBs,5种手性PCBs在玉米不同生长时期不同部位的浓度水平均为PCB95>PCB132>PCB136> PCB91>PCB149,与该采样区耕地土壤中手性PCBs(PCB91、PCB95、PCB132、PCB136和PCB149的浓度分别为:10.2、22.7、17.6、16.7、7.8 ng·g−1)的浓度规律基本一致。
玉米根部对土壤中手性PCBs的吸收富集能力用RCF(enrichment factor)来表示(RCF = Croot /Csoil,ng·g−1root /ng·g−1soil),PCB91、PCB95、PCB132、PCB136和PCB149的根富集因子分别为1.91—4.94、1.48—3.51、1.91—2.59、1.56—2.71和1.76—3.49。手性PCBs的RCF值均大于1,可见玉米根对土壤中的手性PCBs有明显的富集效应,不同手性PCBs的RCF值差别不大,表明玉米根系从土壤吸收富集不同手性PCBs的能力相当,与碳链长度和氯原子取代数无关。玉米花粒期果实中手性PCBs的含量为206.3 ng·g−1,低于浙江省台州某电子垃圾拆解区大米中15种PCBs含量(425.1 ng·g−1)[19],远远高于北京东南郊灌区夏玉米籽粒中58 种非手性PCBs含量(0.17—0.47 ng·g−1)[20],可见电子拆解活动造成了当地农作物的污染。
将表1玉米中手性PCBs浓度随不同生长周期的变化的趋势绘制成图1。
从图1可以看出,单体和总量手性PCBs在植物中的浓度均随着生长周期的延长而逐渐降低最终趋于平稳,即苗期>穗期≈花粒期,该时间变化规律主要与作物的生长速度及生长稀释作用有关。玉米苗期是指播种至拔节的一段时间,在此期间玉米生长缓慢,土壤中的手性PCBs伴随营养物质一起被玉米根系吸收并转移传输至茎和叶片中,使手性PCBs含量处于较高水平。玉米穗期是指拔节至抽雄吐丝期间,是玉米生长发育最旺盛的阶段,该阶段对水分的吸取量最大,手性PCBs伴随水分和营养成分转移到各组织器官,导致手性PCBs浓度降低。花粒期是指玉米从抽雄开花至果穗灌浆成熟的时期。这个阶段的生育特点:花粒期茎叶生长量达到最大值,并停止生长,而进入以生殖生长为中心的阶段,因此这个阶段手性PCBs在各组织器官中的浓度基本趋于稳定,与穗期手性PCBs在各组织器官中的浓度基本相等。
为了研究手性PCBs在玉米体内的转移能力,本研究计算了PCBs 从玉米根到茎的传输因子TFr-s (TFr-s = Cstraw /Croot,ng·g−1straw/ng·g−1root)和茎到叶的传输因子TFs-l (TFs-l= Cleaf /Cstraw,ng·g−1leaf /ng·g−1straw)。PCB91、PCB95、PCB132、PCB136和PCB149的TFr-s值分别为0.55—0.85、0.65—0.83、0.67、0.58—0.93和0.57—0.99,TFs-l值分别为1.46—2.21、1.29—1.84、1.54、1.00—1.70和0.93—2.70。可见,TFr-s值<1,表明手性PCBs不易从玉米根部向茎中转移,TFs-l值>1,表明手性PCBs易从玉米茎部向叶中转移,这可能是因为叶片中脂质含量大于茎中,导致手性PCBs易于在叶片中富集,而不易在茎中富集。
-
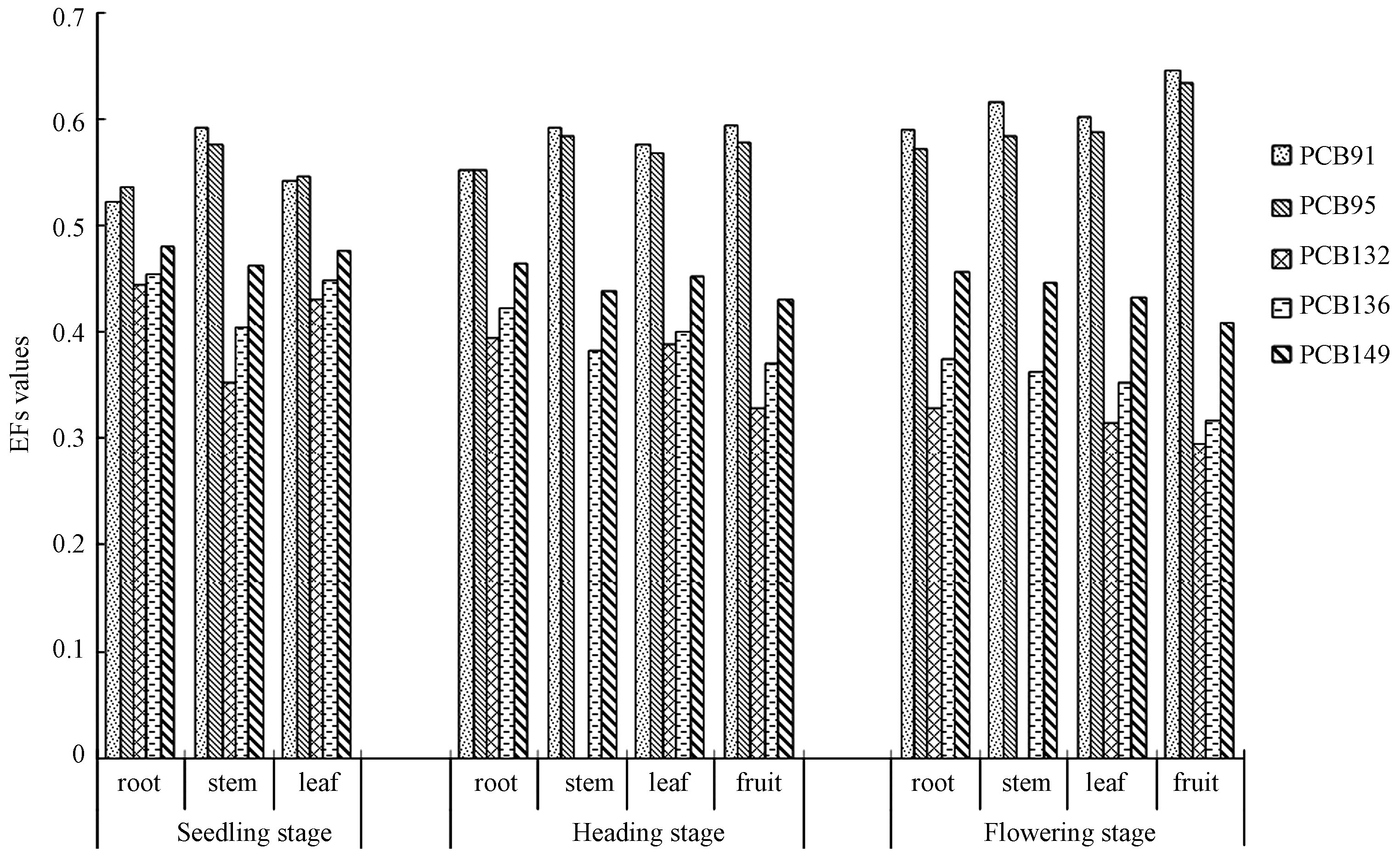
玉米不同生长期不同组织器官中PCB45、PCB91、PCB95、PCB132、PCB136、PCB149和PCB174的对映体EFs数据列于表2中。玉米中PCB91、PCB95、PCB132、PCB136和PCB149的EF均值分别为0.584±0.010、0.574±0.008、0.363±0.014、0.389±0.012和0.449±0.006,在全部可检出手性PCBs的玉米样品中全部的PCB95、PCB132、PCB136和90.9%的PCB91,81.8%的PCB149具有非外消旋特征。与该地区耕地土壤中PCB91、PCB95、PCB132、PCB136和PCB149的EF值分别为0.544±0.004、0.414±0.011、0.430±0.021、0.333±0.015和0.509±0.022 相比,玉米中手性PCBs的EF值的发生了较大的改变,证实了玉米中手性PCBs选择性累积作用,这可能是由于叶片中细胞因子P-450酶的代谢所致。随着生长期的增加,玉米中手性PCBs偏离外消旋的程度逐渐增加,即在玉米中的手性PCBs选择性累积作用随着玉米的生长而不断增强。
将玉米不同组织器官中手性PCBs的含量绘制成图2。从图2中可以看出,在不同生长周期和不同部位PCB91和PCB95 偏离外消旋的方向一致,即右旋,PCB132、PCB136和PCB149偏离外消旋的方向与PCB91和PCB95正好相反,向左偏离,这可能是因为玉米倾向于富集5氯取代PCBs,而代谢6氯取代PCBs。从整体来看苗期和穗期玉米中,目标PCBs的外消旋偏离度为茎>叶>根,并且随着生长周期的增长,手性PCBs在根茎叶外消旋偏离程度逐渐缩短。单因素方差分析数据表明,在0.05水平上,除了手性PCB149外,PCB91、PCB95、PCB132和PCB136的对映体组成在玉米不同组织器官中差异性不显著(分别为P=0.138,P=0.116,P=0.356和P=0.273),PCB149的对映体组成在玉米不同组织器官中差异性显著(P=0.050),这可能是因为PCB149的Kow(辛醇/水分配系数)较高的原因。
玉米茎杆外部坚硬,髓部充实而松软,富含水分和营养物质,以木质部和韧皮部为主,脂含量较小。玉米茎有输导、支持、贮等功能。茎外部角质层硅质化程度较高,无法从外界环境吸收有机污染物,茎中的检出的手性PCBs主要来自根或叶的传输,茎与根和叶中手性PCBs的EFs值的不同表明手性PCBs在玉米茎中具有对映体选择性。2-PCB91、(−)-PCB95、(+)-PCB132、(+)-PCB136和(+)-PCB149在转移过程中与细胞色素酶结合被代谢,而1-PCB91、(+)-PCB95、(−)-PCB132、(−)-PCB136和(−)-PCB149被选择性富集在茎中。玉米叶片中手性PCBs的富集来自于两个方面,一是根和茎中富集的手性PCBs传输到叶片中,二是叶片从大气中吸收手性PCBs[21]。该耕地空气(气相和颗粒相之和)中PCB91、PCB95、PCB132、PCB136和PCB149的EF值分别为0.514±0.007、0.498±0.009、0.487±0.013、0.493±0.015、0.498±0.022,以外消旋存在,与叶片中手性PCBs的EF值相差较大,表明手性PCBs在叶片中具有对映体选择性。玉米果实在植株上的生长时间短,但营养成分最高,手性PCBs伴随着大量营养物质被转运至玉米籽粒中,研究发现1-PCB91、(+)-PCB95、(−)-PCB132、(−)-PCB136和(−)-PCB149在玉米籽中被选择性累积,手性PCBs在籽粒中具有选择性累积作用。
2.1. 玉米中典型手性PCBs同系物的污染水平及分布特征
2.2. 植物中典型手性PCBs生物转化的对映体选择性
-
电子垃圾拆解区玉米不同器官中ΣPCBs的浓度在87.6—294.3 ng·g−1,证实当地玉米受到手性PCBs的污染。除了穗期和花粒期茎中手性PCBs,五种手性PCBs在玉米不同生长时期不同部位的浓度水平均为PCB95>PCB132>PCB136> PCB91>PCB149,与采样区耕地中手性PCBs的规律一致。土壤和空气中的手性PCBs进入玉米植株后,随着生长周期的增加逐渐降低最终趋于平稳,手性PCBs的浓度水平表现为苗期>穗期≈花粒期。进入玉米植株的手性PCBs具有明显非外消旋特征,与该地区耕地土壤中手性PCBs的EF值相比,玉米中手性PCBs的EF值的发生了较大的改变,并且随着生长期的增加,玉米中手性PCBs偏离外消旋的程度逐渐增加。手性PCBs的RCF值均大于1,玉米根部对土壤中的手性PCBs有明显的富集效应;TFr-s值<1,表明手性PCBs不易从玉米根部向茎中转移,TFs-l值>1,表明手性PCBs易从玉米茎部向叶中转移。



 下载:
下载: