-
漆酶广泛存在于自然界中,它是一种含铜氧化酶。于1883年Yoshida首次发现[1],1894年Bertrand将其命名为“漆酶”,在自然界中,按漆酶分为漆树漆酶(rhus laccase)和真菌漆酶(fungal laccase)两大类[2]。漆酶是二聚或者四聚糖蛋白,为了发挥其催化作用,漆酶依赖于分布在不同活性中心的4个铜离子[3]。漆酶的催化效率高、催化条件温和,漆酶的活性主要受环境的温度、pH值和其自身的等电点等影响,真菌漆酶的最适温度一般在25—50 ℃,最适pH值范围为4.0—6.0之间 [4-6]。漆酶催化机理是利用氧分子作为电子受体,催化氧分子还原为水用于降解不同的环境污染物[7],没有二次污染,已被广泛用于自然水体中多环芳烃、农药以及氯酚类污染物的降解[8]。
对乙酰氨基酚(acetaminophen,AAP),又称扑热息痛,最常用的非处方药之一,是一种快速有效的止痛和退烧药物[9-10]。人类及哺乳动物服用AAP后,药物大多以原形或初级代谢产物排泄到体外,最终通过多种途径进入环境。据报道,在地表水甚至地下水中,AAP普遍以μg·L−1的浓度存在水体中。数据显示,美国 139 条河流中,AAP 的最大浓度为 10 μg·L−1,英国泰恩河中 AAP 的浓度则达到了 65 μg·L−1[11-12]。在饮用水和废水的氯化消毒过程中大量的乙酰氨基酚很容易转化为1,4-苯醌和乙酰基对苯醌,两者都具有相当的毒性,AAP及其转换产物均容易导致肝脏和肾脏的损害[13]。当其在污水处理厂处理过程中会沉积在污泥里,污泥会作为肥料用到农田,进入土壤系统[14]。因此,对AAP去除技术的研究与开发已成为近期研究的热点。目前已经有研究发现在水生环境中胞外酶可以对AAP进行降解[15],但是对于土壤体系下AAP的降解转化研究却较少。关于真菌漆酶降解土壤中的多环芳烃已经有大量的研究[16],而对于实际土壤介质对漆酶降解AAP的影响却研究较少,所以有必要进行这方面的研究。
本文探究了不同地区土壤介质对漆酶降解AAP的影响,比较了不同土壤介质对AAP吸附性能的差异以及对漆酶酶活的影响,揭示了不同土壤介质对漆酶降解AAP效果差异的原因,为后续土壤介质体系胞外酶降解酚类污染物提供研究参考。

-
对乙酰氨基酚(Acetaminophen,纯度>99.5%)购自百灵威科技有限公司;2, 2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)和漆酶 (来自白腐菌),购自美国Sigma-Aldrich有限公司;HPLC级甲醇购自Tedia公司;其他实验室常用试剂为分析纯;所有用水均为超纯水。
-
漆酶酶活定义:每分钟氧化1 μmol·L−1的ABTS所需要的酶量即1个单位的酶活性(pH=5的条件下测定)[17]。1 cm比色皿中加入2.8 mL的pH=5、浓度为10 mmol·L−1的醋酸缓冲溶液,加入100 μL浓度为10 mmol·L−1的 ABTS溶液,最后加入100 μL漆酶溶液,启动反应。迅速将反应溶液放于紫外分光光度计中,检测其在420 nm处的吸光度在3 min内随时间的变化,重复3次,取其斜率k的平均值。酶活性计算公式如下[18]:
-
AAP储备液的浓度为200 mg·L−1,封存于棕色玻璃瓶中4 ℃保存,实际AAP反应浓度为10 mg·L−1,水土比为10∶1,溶液体积10 mL,土壤1.0 g。预先称取1.0 g土壤于玻璃瓶中,加入9.5 mL的超纯水混合均匀并超声30 min,超声完成后,加入500 μL的AAP储备液并立即放置在恒温振荡培养箱以180 r·min−1进行振荡,温度25 ℃,pH=7,每组反应都有两组平行样。总吸附反应时间为72 h,取样时间点是0 、2 、6 、12 、24 、36、48 、60、72 h。每次取样500 μL,过0.22 μm GHP Acrodisc滤头(Pall公司,美国)至液相色谱瓶中,分析溶液中AAP浓度。
-
吸取500 μL的AAP储备液于棕色玻璃瓶中,漆酶的酶活分别设置为0.01 、0.05 、0.10 U,用pH=7的10 mmol·L−1的磷酸缓冲溶液(PBS)定容,漆酶是最后加入,启动反应,并立即放置在恒温振荡培养箱以180 r·min−1进行25 ℃恒温振荡。总反应时长60 min,取样时间分别是0 、10 、20 、30 、40 、50 、60 min。每次取样500 μL,同时立即加入500 μL甲醇猝灭,转移到液相色谱瓶中进行液相分析。一级速率常数k1表达式如下[18]:
-
供试的土样分别来自江苏宜兴水稻土、陕西洛川黑垆土、江西鹰潭红土、广东德庆砖红土,土壤均磨细后过60目筛,受试污染物为AAP,分别称取4份3 mg的AAP溶于150 mL的甲醇水混合体系中(甲醇比例为3%),配置成20 mg·L−1的AAP溶液,与300 g土壤混合均匀,充分晾干,制备的受试污染物AAP的浓度为10 mg·kg−1干土。在土壤降解中,称取污染土壤2 g,加入10 mL超纯水,水土比5∶1,漆酶活性为0.10 U,取样时间点为0和60 min。到了取样时间加入10 mL甲醇,猝灭降解反应 [19]。
-
AAP浓度用Agilent 1200型高效液相色谱仪测定,色谱柱为Agilent XDB-C18型色谱柱(5 μm,4.6 mm × 250 mm),流动相甲醇∶水= 25∶75,流速0.8 mL·min−1,柱温25 ℃,进样量20 μL,检测波长为245 nm[20]。
-
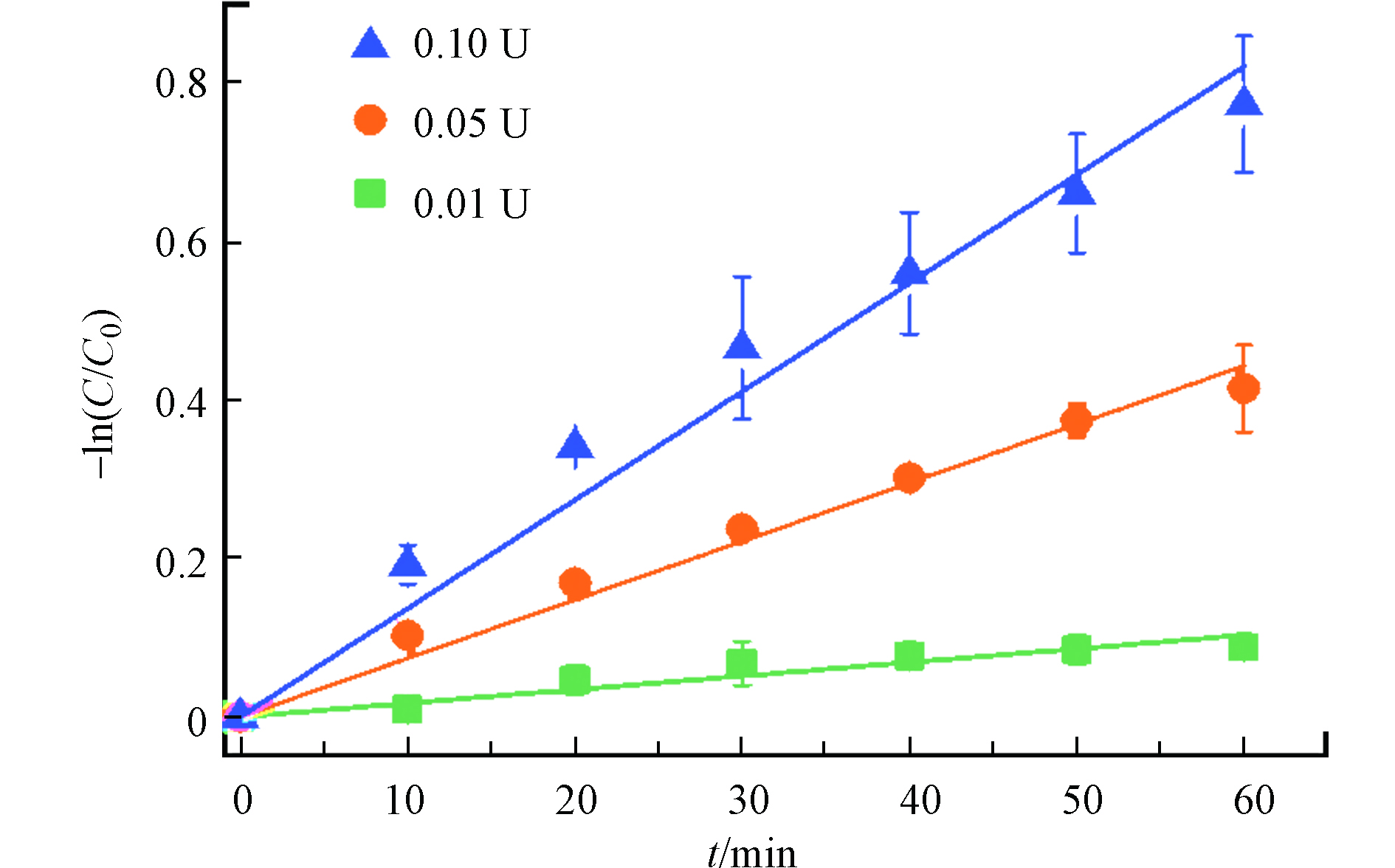
首先探究水相中的降解动力学,考虑了不同初始酶活条件下对AAP的降解速率差异。如图1所示,不同酶活条件下,漆酶降解AAP的均符合假一级动力学反应,由此可以说明在整个反应过程中酶活基本是不变的[20]。当酶活为0.01、 0.05、 0.10 U时,假一级速率常数分别为0.0016 min−1、0.0069 min−1、0.012 min−1。可以发现在水溶液条件下漆酶可以有效的降解AAP,即AAP是漆酶的一种良好底物,并且随着酶活的升高降解速率也进一步加大。
-
供试的土样分别来自江苏宜兴水稻土、陕西洛川黑垆土、江西鹰潭红土、广东德庆砖红土,所有样品土壤都已经经过高温灭菌处理。本实验分别测定了这4种土壤的pH值、土壤有机质(SOM)含量、比表面积以及内部结构中黏粒、淤泥和沙粒的含量占比。具体元素组成、理化性质见表1。
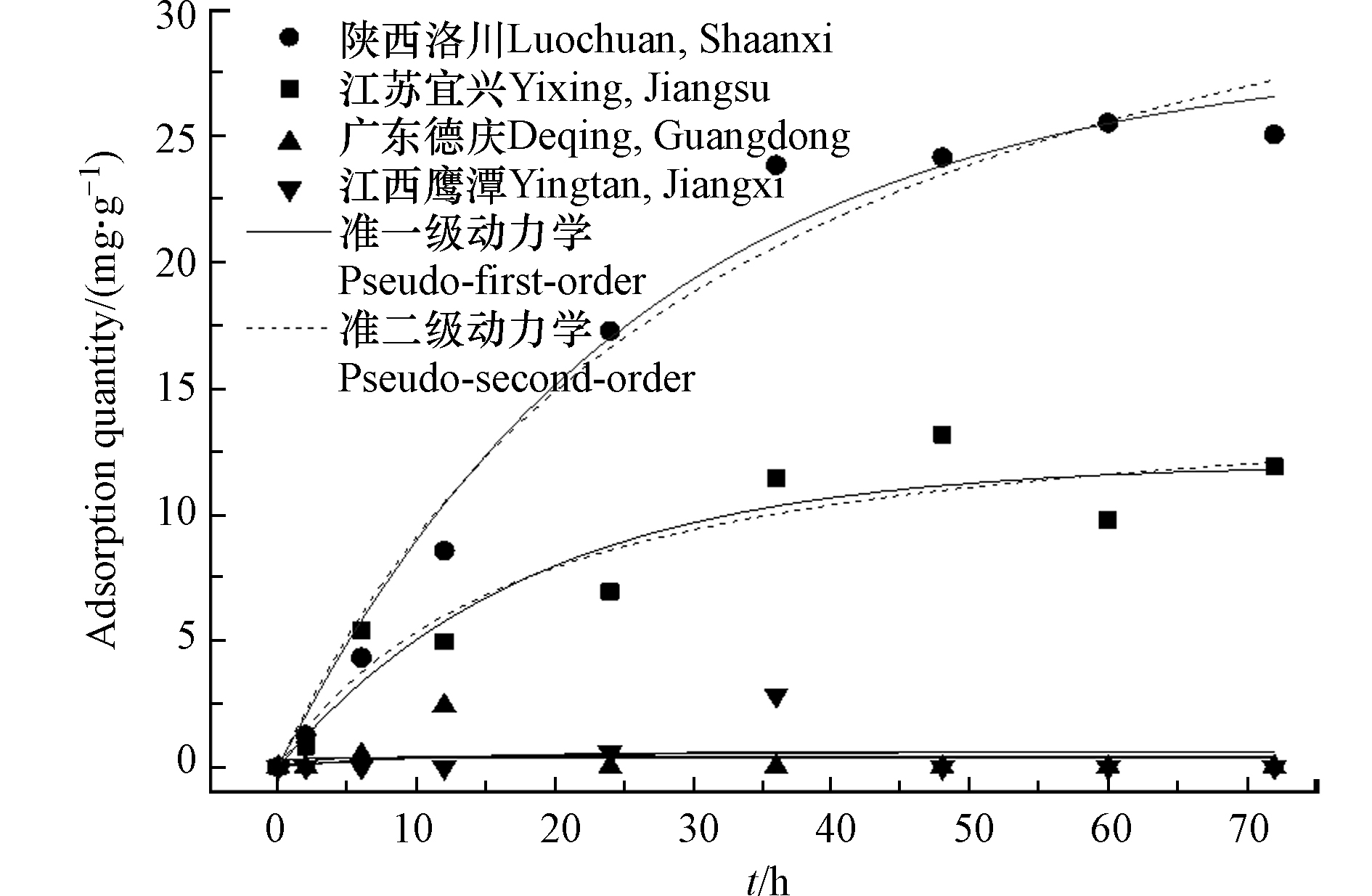
在进行土壤介质中漆酶降解AAP的实验前,首先探究试验土壤对AAP的吸附情况,温度设置为25 ℃,pH=7。图2中可以发现,陕西洛川黑垆土和江苏宜兴水稻土对AAP有比较明显的吸附作用,而广东德庆砖红土和江西鹰潭红壤土对AAP基本无吸附作用。
对有吸附作用的两种土壤对AAP的吸附分别用准一级动力学和准二级动力学方程拟合,其表达式如下(1)和(2)所示 [22-23] :
式中,qt为t时刻的吸附量(mg·g−1); qe为吸附达到平衡时的吸附量(mg·g−1); k1(h−1)和k2(g·(mg·h)−1)分别为准一级动力学和准二级动力学吸附速率常数。拟合结果如表2所示。
从表2可以发现,受试土壤对AAP的吸附更符合准一级动力学拟合,其中陕西洛川黑垆土和江苏宜兴水稻土的吸附方程R2分别为0.981和0.894,准一级动力学常数k1分别为0.038和0.054,表明江苏宜兴土壤对AAP的吸附速率较快[23]。而这两种土的平衡吸附量分别为28.37 mg·g−1和12.03 mg·g−1,表明陕西洛川土壤对AAP的平衡吸附量明显高于江苏宜兴的土壤。对比几种土壤的成分组成,发现吸附性能较大的土壤介质中其淤泥组成含量较大,砂质组成含量较少,且土壤SOM含量较大,已经有大量的研究表明淤泥质地和土壤SOM能吸附有机污染物[24-28]。这可能是影响其吸附性能差异的原因。
-
为了排除吸附作用的影响,需要选择适合的萃取剂。比较不同的萃取剂包括二氯甲烷∶甲醇=1∶1、丙酮、二氯甲烷、甲醇等,发现只加甲醇的萃取效果最好,并且甲醇作为萃取剂的同时也是猝灭剂。甲醇体积与反应中水的体积按照1∶1加入效果也较佳。如图3所示,无论是低浓度的AAP还是高浓度的AAP,甲醇的洗脱效果均高于90%,并且高浓度的AAP的萃取效果要优于低浓度的AAP。甲醇对不同土壤之间的洗脱效果并无明显差异,这也为之后在土壤中降解AAP的实验做铺垫,在土壤降解实验中取样前加入洗脱剂,可以排除土壤颗粒对AAP的吸附作用。
-
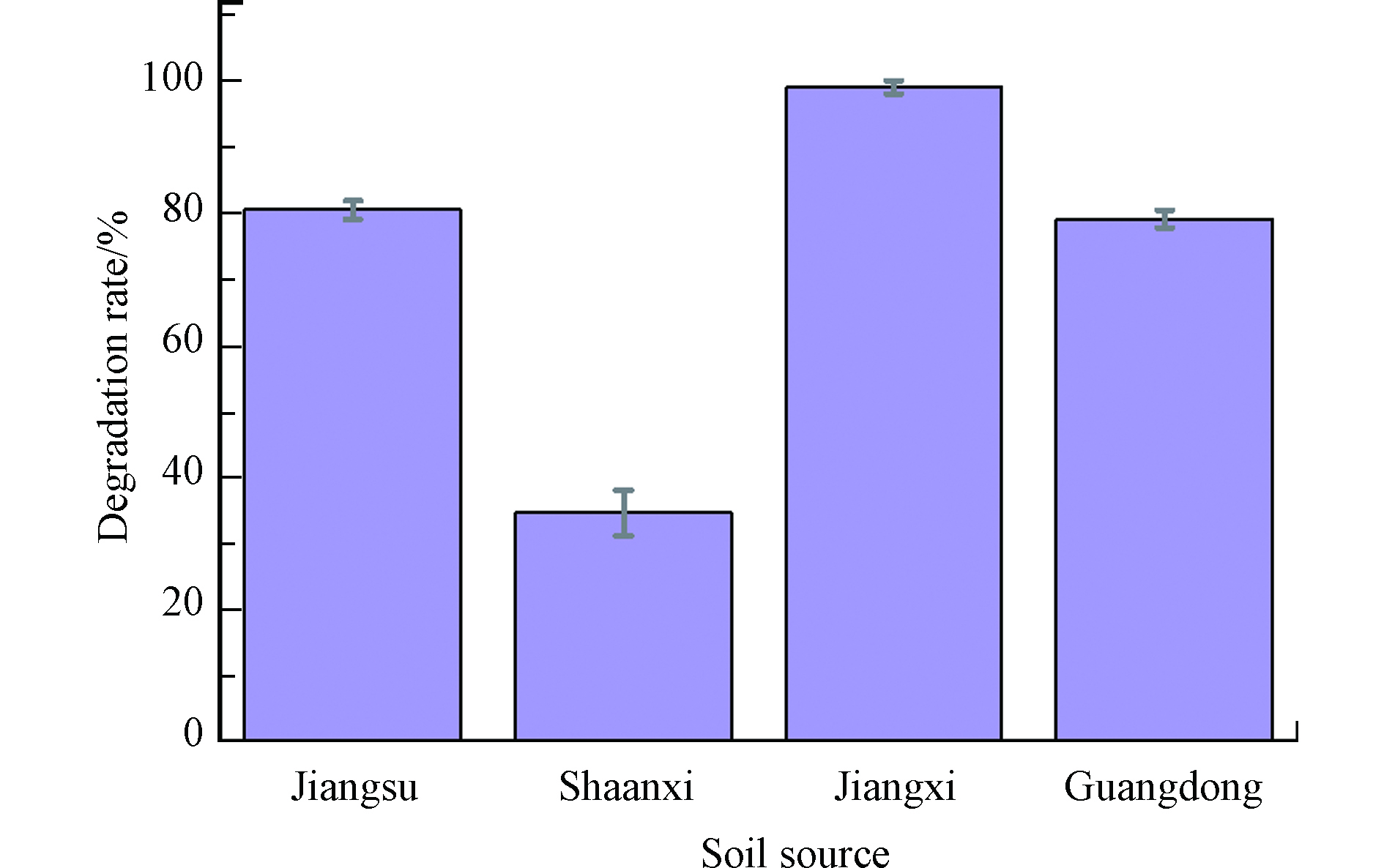
探究江苏宜兴水稻土、陕西洛川黑垆土、江西鹰潭红土、广东德庆砖红土这4种不同土壤介质中漆酶对AAP的降解效果,如图4所示。可以发现, 在4种土壤介质中,漆酶对AAP均有降解,但是降解程度各不相同。其中降解最快的是江西鹰潭的红壤土,反应60 min 后AAP的降解率接近100%;江苏宜兴水稻土和广东德庆红壤土降解率接近,反应60 min后降解率分别为80.58%和79.17%;降解最慢的为陕西洛川黑垆土,反应60 min降解率为34.74%。 可见在不同土壤体系下,漆酶降解AAP差异明显。
-
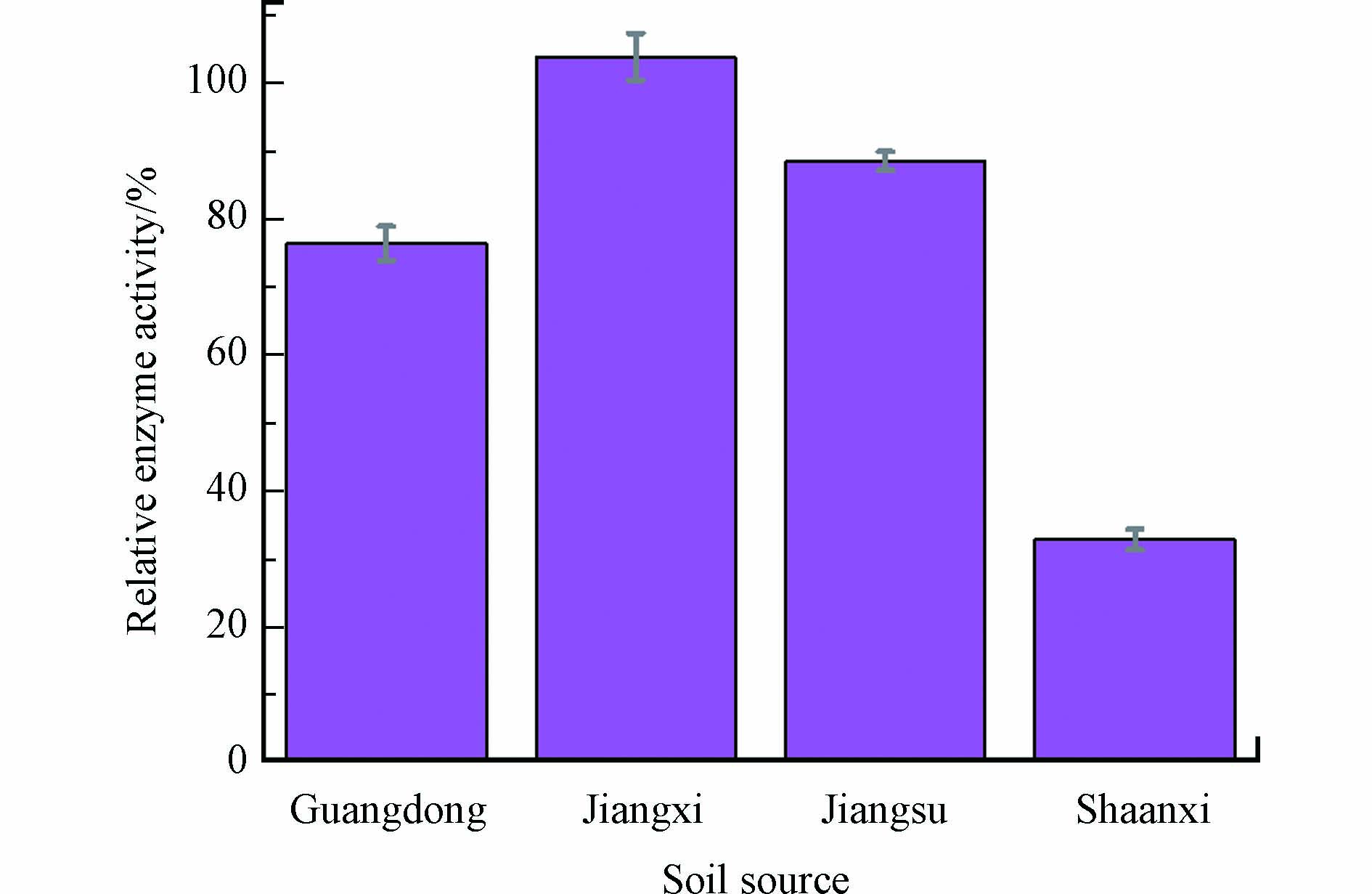
为了探究漆酶在4种土壤介质中对AAP的降解效果的差异。对土壤介质中漆酶的活性进行了监测。如图5所示,可以发现不同土壤介质中漆酶活性变化差异明显,其中陕西洛川红壤土的酶活衰减最大,60 min衰减了65.17%,酶活仅剩初始酶活的34.83%。所以在降解效果上该土壤介质的降解效果最不好。已经有大量的文献表明,pH值会显著影响漆酶的活性,这是因为环境pH的波动会影响漆酶蛋白质表面的静电性能,改变漆酶的活性中心状态,从而影响漆酶的活性和稳定性[29-31]。漆酶在pH值为4.5—5.5的酸性条件下活性较高,中碱性条件下活性较低[32]。而陕西洛川的红壤土pH值为7.71,呈弱碱性,因此漆酶在该土壤中活性较差对于AAP的降解效果也不显著。广东德庆砖红土和江苏宜兴水稻土这两种介质中的酶活差异不明显,酶活都有削减,但降低量有限,60 min后剩余酶活分别占初始酶活的76.39%和88.59%。漆酶在江苏宜兴水稻土介质中剩余活性是要高于广东德庆砖红土介质的,但是对AAP的降解效率却相差较小。这可能是因为江苏宜兴水稻土介质中土壤SOM含量较高的缘故。已经有研究表明土壤SOM是漆酶的良好底物[33-34],SOM的存在会和底物竞争,从而抑制底物AAP的酶降解。江西鹰潭砖红土中酶活变化与初始差异不明显,说明该土壤介质中的组分对酶活并没有产生较大影响。该土壤中pH值较低,适宜酶生存并产生活性从而对AAP产生优异的降解。
-
在江西鹰潭红壤土介质中,酶的活性是最稳定的,也是最大的,同时在该土壤介质中漆酶对AAP的降解效果优异,江苏宜兴水稻土和广东德庆砖红土两种土壤降解程度接近,但是原因却大不相同,江苏宜兴水稻土介质中的酶活相对较高,但是土壤介质中SOM的含量较高,因此在降解效果与广东德庆砖红土体系下接近。而陕西洛川由于土壤介质pH值呈弱碱性,在该pH条件下漆酶的活性较低,因此对于污染物AAP的降解效率也较低。总的来说,该研究揭示了在实际土壤介质中,不同的土壤体系对漆酶降解环境污染物AAP的差异和造成差异的原因,为后续研究提供理论依据。
在不同土壤体系下漆酶催化降解对乙酰氨基酚的差异研究
Effects of laccase degradation on acetaminophen in different soil systems
-
摘要: 漆酶广泛分布在天然环境中,可以有效催化降解水体和土壤中有机污染物。对乙酰氨基酚(Acetaminophen,AAP)是一种最常用的止痛和退烧药物,环境残留浓度较高,AAP及其转换产物均易导致肝脏和肾脏的损害。研究表明,在水体介质中漆酶可以有效降解AAP,但是对于土壤介质中漆酶降解AAP的研究却较少。本文系统地研究了不同地区土壤(江苏宜兴水稻土、陕西洛川黑垆土、江西鹰潭红土和广东德庆砖红土)体系下漆酶降解AAP的差异,包括其对AAP的吸附作用和对漆酶的酶活影响。结果表明,组成成分淤泥含量较高的江苏宜兴水稻土和陕西洛川黑垆土对AAP的吸附性能较大,平衡吸附量分别为12.03 mg·g−1和28.37 mg·g−1,而江西鹰潭红土和广东德庆砖红土对AAP无明显吸附。江西鹰潭红壤土介质中,酶的活性是最稳定的,同时在该土壤介质中漆酶对AAP的降解效果优异,而陕西洛川由于土壤介质pH值呈弱碱性,在该pH条件下漆酶的活性较低,因此对于污染物AAP的降解效率也较低。江苏宜兴水稻土介质中的酶活相对广东德庆砖红土较高,但是土壤介质中SOM的含量较多,综合在降解效果与广东德庆砖红土接近。本研究为评价实际土壤介质对漆酶降解环境污染物提供科学依据。Abstract: Laccase is widely distributed in the environment and can effectively degrade persistent pollutants in water. Acetaminophen (AAP) is one of the most commonly prescribed over-the-counter drugs to relieve pain and reduce fever, with high environmental residual concentrations. Both AAP and its conversion products are likely to affect human health. Previous studies have shown that laccase can effectively degrade AAP in aqueous media, but there are few studies on laccase degradation of AAP in soil media. This study systematically investigated the effects of soils from different site on the laccase-catalyzed removal of AAP, including the adsorption and enzyme activity. Four different soils were sampled from Yixing paddy soil in Jiangsu, Luochuan black soil in Shaanxi, Yingtan red soil in Jiangxi, and Deqing brick red soil in Guangdong. The results showed that Jiangsu Yixing paddy soil and Luochuan black soil in Shaanxi had higher adsorption capacity for AAP, with saturated adsorption capacities of 12.03 mg·g−1 and 28.37 mg·g−1, respectively. Yingtan red soil in Jiangxi and brick red soil in Deqing, Guangdong did not significantly adsorb AAP. The enzyme activity is the most stable in Yingtan red soil. At the same time, the degradation effect of laccase on AAP is excellent in this soil. In Luochuan black soil, the activity of laccase was low because the pH value was weakly alkaline, so the degradation efficiency of pollutant AAP was also low. However, the enzyme activity in the Yixing paddy soil in Jiangsu is relatively high, but the content of SOM in soil was high, so the degradation effect was similar to that in Deqing brick red soil. This study provides a scientific basis for evaluating soil for laccase degradation of environmental pollutants.
-
Key words:
- laccase /
- soil /
- acetaminophen /
- degradation /
- adsorption
-

-
表 1 实验土壤及理化性质
Table 1. Experimental soil and physical and chemical properties
土样来源
Soil source土壤种类
Soil typepH SOM/(g·kg−1) 比表面积/(m2·g−1)
Specific surface area结构/%
Component黏粒
Clay淤泥
Silt沙粒
Sand江西鹰潭 红壤 4.50 12.40 36.17 6.65 30.98 62.37 江苏宜兴 水稻土 5.68 20.20 6.04 5.75 90.96 3.29 陕西洛川 黑垆土 7.71 12.90 16.28 7.25 76.61 16.14 广东德庆 砖红壤 4.85 4.14 20.97 12.69 66.81 20.50 表 2 AAP在受试土壤上的吸附动力学参数
Table 2. Adsorption kinetic parameters of AAP on the tested soil
土样来源
Soil source反应温度/℃
Reaction temperature准一级动力学
Pseudo-first-order准二级动力学
Pseudo-second-orderqe/(mg·g−1) k1/h−1 r2 qe/(mg·g−1) k2/(g·(mg·h)−1) r2 陕西洛川 25 28.37 0.038 0.981 39.97 0.0007 0.972 江苏宜兴 25 12.03 0.054 0.894 15.13 0.0036 0.893 -
[1] THURSTON, C F. The structure and function of fungal laccases [J]. Microbiology-Sgm, 1994, 140: 19-26. doi: 10.1099/13500872-140-1-19 [2] MAYER A M, STAPLES R C. Laccase: new functions for an old enzyme [J]. Phytochemistry, 2002, 60(6): 551-565. doi: 10.1016/S0031-9422(02)00171-1 [3] MATERA I, GULLOTTO A, TILLI S, et al. Crystal structure of the blue multicopper oxidase from the white-rot fungus trametes trogii complexed with p-toluate [J]. Inorganica Chimica Acta, 2008, 361: 4129-4137. doi: 10.1016/j.ica.2008.03.091 [4] MOUGIN C, JOLIVALT C, BRIOZZO P, et al. Fungal laccases: From structure-activity studies to environmental applications [J]. Environmental Chemistry Letters, 2003, 1(2): 145-148. doi: 10.1007/s10311-003-0024-9 [5] YANG J, YANG X, LIN Y, et al. Laccase-catalyzed decolorization of malachite green: Performance optimization and degradation mechanism [J]. Plos One, 2015: 10. [6] DWIVEDI U N, SINGH P, PANDEY V P, et al. Structure-function relationship among bacterial, fungal and plant laccases [J]. Journal of Molecular Catalysis B-Enzymatic, 2011, 68: 117-128. doi: 10.1016/j.molcatb.2010.11.002 [7] POLYAKOV K M, GAVRYUSHOV S, IVANOVA S, et al. Structural study of the X-ray-induced enzymatic reduction of molecular oxygen to water by Steccherinum murashkinskyi laccase: Insights into the reaction mechanism [J]. Acta Crystallographica. Section D, Structural Biology, 2017, 73(5): 388-401. doi: 10.1107/S2059798317003667 [8] ZHAO Y C, YI X, LI M H, et al. Biodegradation kinetics of DDT in soil under different environmental conditions by laccase extract from White Rot Fungi [J]. Chinese Journal of Chemical Engineering, 2010, 18(3): 486-492. doi: 10.1016/S1004-9541(10)60247-9 [9] DE GUSSEME B, VANHAECKE L, VERSTRAETE W, et al. Degradation of acetaminophen by delftia tsuruhatensis and pseudomonas aeruginosa in a membrane bioreactor [J]. Water Research, 2011, 45: 1829-1837. doi: 10.1016/j.watres.2010.11.040 [10] SEBASTINE I M, WAKEMAN R J. Consumption and environmental hazards of pharmaceutical substances in the UK [J]. Process Safety and Environmental Protection:Transactions of the Institution of Chemical Engineers, Part B, 2003, 81(4): 229-235. doi: 10.1205/095758203322299743 [11] ROBERTS P H, THOMAS K V. The occurrence of selected pharmaceuticals in wastewater effluent and surface waters of the lower Tyne catchment [J]. The Science of the Total Environment, 2006, 356(1/2/3): 143-153. [12] SIM W J, LEE J W, OH J E. Occurrence and fate of pharmaceuticals in wastewater treatment plants and rivers in Korea [J]. Environmental Pollution, 2010, 158(5): 1938-1947. doi: 10.1016/j.envpol.2009.10.036 [13] BEDNER M, MACCREHAN W A. Transformation of acetaminophen by chlorination produces the toxicants 1, 4-benzoquinone and N-acetyl-p-benzoquinone imine [J]. Environmental Science & Technology, 2006, 40(2): 516-522. [14] LI J Y, YE Q F, GAN J. Degradation and transformation products of acetaminophen in soil [J]. Water Research, 2014, 49: 44-52. doi: 10.1016/j.watres.2013.11.008 [15] VEITCH N C. Horseradish peroxidase: A modern view of a classic enzyme [J]. Phytochemistry, 2004, 65(3): 249-259. doi: 10.1016/j.phytochem.2003.10.022 [16] WU Y C, TENG Y, LI Z G, et al. Potential role of polycyclic aromatic hydrocarbons (PAHs) oxidation by fungal laccase in the remediation of an aged contaminated soil [J]. Soil Biology and Biochemistry, 2008, 40: 789-796. doi: 10.1016/j.soilbio.2007.10.013 [17] Auriol M, Filali-Meknassi Y, Tyagi R D, et al. Laccase-catalyzed conversion of natural and synthetic hormones from a municipal wastewater [J]. Water Research, 2007, 41(15): 3281-3288. doi: 10.1016/j.watres.2007.05.008 [18] 石欢欢. 漆酶催化降解杀菌剂苄氯酚和双氯酚的机理研究[D]. 南京: 南京大学, 2016. SHI H H. Study on the mechanism of laccase-catalyzed removal of the antimicrobials chlorophene and dichlorophen [D]. Nanjing: Nanjing University, 2016(in Chinese).
[19] BOLEL P, HALDER M. Fluorescence quenching of carmoisine by viologens in neat methanol: Observation of inversion in quenching [J]. Chemical Physics Letters, 2011, 507: 234-239. doi: 10.1016/j.cplett.2011.03.054 [20] GONG Z, WANG G, SHI H, et al. Mn(Ⅱ)-Mn(Ⅲ)-Mn(Ⅳ) redox cycling inhibits the removal of methylparaben and acetaminophen mediated by horseradish peroxidase: New insights into the mechanism [J]. Science of the Total Environment, 2021, 788: 147788. doi: 10.1016/j.scitotenv.2021.147788 [21] 李建华. 模拟自然光照下胞外过氧化物酶去除水中典型内分泌干扰物机理研究[D]. 南京: 南京大学, 2017. LI J H. Removal mechansim of representative endocrine disruptors from water mediated by extracellular peroxidase under simulated solar light [D]. Nanjing: Nanjing University, 2017(in Chinese).
[22] HU J Q, YANG S Z, GUO L, et al. Microscopic investigation on the adsorption of lubrication oil on microplastics [J]. Journal of Molecular Liquids, 2017, 227: 351-355. doi: 10.1016/j.molliq.2016.12.043 [23] 刘鹏, 王焓钰, 吴小伟, 等. 粒径对聚苯乙烯微塑料吸附环丙沙星的影响 [J]. 环境化学, 2020, 39(11): 3153-3160. doi: 10.7524/j.issn.0254-6108.2019082802 LIU P, WANG H Y, WU X W, et al. Effects of particle size on the adsorption of ciprofloxacin on polystyrene microplastics [J]. Environmental Chemistry, 2020, 39(11): 3153-3160(in Chinese). doi: 10.7524/j.issn.0254-6108.2019082802
[24] LIU P, QIAN L, WANG H Y, et al. New insights into the aging behavior of microplastics accelerated by advanced oxidation processes [J]. Environmental Science & Technology, 2019, 53(7): 3579-3588. [25] 田世烜, 张萌, 陈亮, 等. 3种污泥对磺胺二甲基嘧啶的吸附性能 [J]. 环境工程学报, 2012, 6(3): 1020-1024. TIAN S (H /X), ZHANG M, CHEN L, et al. Adsorption characteristics of sulfamethazine by three kinds of sludge [J]. Chinese Journal of Environmental Engineering, 2012, 6(3): 1020-1024(in Chinese).
[26] 仉春华, 孙红杰, 冯福绿等. 活性污泥对2种喹诺酮类抗生素的吸附特征 [J]. 辽宁工程技术大学学报(自然科学版), 2021, 40(4): 360-366. ZHANG C H, SUN H J, CHEN F L, et al. Adsorption characters of two Quinolone antibiotics inactivated sludge [J]. Journal of Liaoning Technical University, 2021, 40(4): 360-366(in Chinese).
[27] 仇付国, 王肖倩, 童诗雨, 等. 给水厂污泥改性活性炭对硝酸根的吸附性能[J]. 应用化工, 2022, 51(2): 354-359. QIU F G, WANG X Q, TONG S Y, et al. The adsorption characteristics of nitrate on activated carbon modified by metals extracted from water treatment residual [J]. Applied Chemical Industry, 2022,51(2): 354-359 (in Chinese) .
[28] 张凌霄, 于洁, 吕阳, 等. 污泥基吸附剂对亚甲基蓝和环丙沙星的吸附性能研究 [J]. 宁波大学学报(理工版), 2021, 34(3): 47-53. ZHANG L X, YU J, LÜ Y, et al. Adsorption of methylene blue and ciprofloxacin by activated sludge-derived adsorbent [J]. Journal of Ningbo University (Natural Science & Engineering Edition), 2021, 34(3): 47-53(in Chinese).
[29] 郑红婷, 张秀霞, 钟哲森, 等. 石油污染土壤中漆酶活性的影响因素 [J]. 环境工程学报, 2017, 11(10): 5703-5707. doi: 10.12030/j.cjee.201611066 ZHENG H T, ZHANG X X, ZHONG Z S, et al. Influence factors of laccase activity in oil-contaminated soil [J]. Chinese Journal of Environmental Engineering, 2017, 11(10): 5703-5707(in Chinese). doi: 10.12030/j.cjee.201611066
[30] KEUM Y S, LI Q X. Fungal laccase-catalyzed degradation of hydroxy polychlorinated biphenyls [J]. Chemosphere, 2004, 56(1): 23-30. doi: 10.1016/j.chemosphere.2004.02.028 [31] 张阳. pH值及温度对杂色云芝漆酶活性的影响 [J]. 资源节约与环保, 2015(3): 86. doi: 10.3969/j.issn.1673-2251.2015.03.067 ZHANG Y. Effects of pH and temperature on laccase activity of Yunzhi versicolor [J]. Resources Economization & Environment Protection, 2015(3): 86(in Chinese). doi: 10.3969/j.issn.1673-2251.2015.03.067
[32] EICHLEROVÁ I, ŠNAJDR J, BALDRIAN P. Laccase activity in soils: Considerations for the measurement of enzyme activity [J]. Chemosphere, 2012, 88(10): 1154-1160. doi: 10.1016/j.chemosphere.2012.03.019 [33] MATHUR S P, 唐咏. 热带、亚热带和温带地区土壤酶在有机质降解中的作用 [J]. 土壤学进展, 1985(5): 20-23. MATHUR S P, TANG Y. The role of soil enzymes in the degradation of organic matter in tropical, subtropical and temperate regions [J]. Advances in Soil Science, 1985(5): 20-23(in Chinese).
[34] 梁小兵, 朱建明, 刘丛强, 等. 贵州红枫湖沉积物有机质的酶及微生物降解 [J]. 第四纪研究, 2003, 23(5): 565-572. doi: 10.3321/j.issn:1001-7410.2003.05.012 LIANG X B, ZHU J M, LIU C Q, et al. Enzymatic and microbial degradation of organic matter in Lake Hongfeng of Guizhou Province [J]. Quaternary Sciences, 2003, 23(5): 565-572(in Chinese). doi: 10.3321/j.issn:1001-7410.2003.05.012
-



 下载:
下载: